Sērūdeņraža siltumietilpība dažādās temperatūrās. Dabasgāzes īpatnējā siltumietilpība
Ne specifiska, bet kopējā siltuma jauda vispārpieņemtajā fizikālā nozīmē ir vielas spēja uzkarst. Vismaz tā mums saka jebkura termiskās fizikas mācību grāmata - tas ir klasiskā definīcija siltuma jauda(pareizs formulējums). Patiesībā šī ir interesanta fiziska iezīme. Ikdienā mums maz zināmā "monētas puse". Izrādās, ka tad, kad siltums tiek piegādāts no ārpuses (sildīšana, sasilšana), ne visas vielas vienādi reaģē uz siltumu ( siltumenerģija) un uzkarsē savādāk. Spēja Dabas izcelsmes GĀZE, ko izmanto kā degvielu saņemt, saņemt, saglabāt un uzkrāt (uzkrāt) siltumenerģiju sauc par DABAS degošās gāzes siltumietilpību. Un viņa pati metāna siltumietilpība, ir fizikāls raksturlielums, kas raksturo gāzdegvielas termofizikālās īpašības. Tajā pašā laikā dažādos lietišķajos aspektos, atkarībā no konkrēta praktiska gadījuma, mums viena lieta var izrādīties svarīga. Piemēram: vielas spēja uzņemties silts vai spēja uzkrāties siltumenerģija vai "talantu", lai to saglabātu. Tomēr, neskatoties uz dažām atšķirībām, fiziskā nozīmē mums vajadzīgās īpašības tiks aprakstītas metāna siltumietilpība.
Neliela, bet ļoti "nejauka" fundamentāla rakstura aizķeršanās ir tāda, ka spēja uzkarst - metāna siltuma jauda, ir tieši saistīta ne tikai ar ķīmiskais sastāvs, vielas molekulārā struktūra, bet arī tās daudzums (svars, masa, tilpums). Šāda "nepatīkamā" savienojuma dēļ ģenerālis metāna siltumietilpība kļūst pārāk neērta vielas fizikālā īpašība. Tā kā viens izmērītais parametrs vienlaikus apraksta "divas dažādas lietas". Proti: tiešām raksturo DABAS GĀZES termofizikālās īpašības, tomēr "garāmejot" ņem vērā arī tā daudzumu. Veidojot sava veida neatņemamu raksturlielumu, kurā automātiski tiek savienota "augsta" siltuma fizika un "banāls" vielas daudzums (mūsu gadījumā: gāzes kurināmais).
Nu, kāpēc mums ir vajadzīgas tādas termofizikālās īpašības, kurās ir skaidri izsekota "neadekvāta psihe"? No fizikas viedokļa kopsumma metāna siltumietilpība(visneveiklākajā veidā) mēģina ne tikai aprakstīt siltumenerģijas daudzumu, kas spēj uzkrāties gāzes kurināmajā, bet arī "pagaidām informēt mūs" par daudzumu DABAS DEGOŠĀ GĀZE. Izrādās absurds, nevis skaidrs, saprotams, stabils, pareizs Metāna termofizikālās īpašības. Noderīgas konstantes vietā, kas piemērota praktiskajam termofizikālie aprēķini, mums tiek dots peldošs parametrs, kas ir saņemtā siltuma daudzuma summa (integrālis). DABASGĀZE un tā metāna masu vai tilpumu.
Paldies, protams, par tādu "sajūsmu", bet daudzums DABAS DEGVIELAS GĀZE Es varu izmērīt sevi. Saņemot rezultātus daudz ērtākā, "cilvēciskā" formā. Daudzums DABAS DEGOŠĀ GĀZE Es nevēlos "izvilkt" ar matemātiskām metodēm un aprēķiniem, izmantojot sarežģītu formulu no vispārējā metāna siltumietilpība, dažādās temperatūrās, un uzzināt svaru (masu) gramos (g, g), kilogramos (kg), tonnās (tonnās), kubos (kubikmetri, kubikmetri, m3), litros (l) vai mililitros (ml ). It īpaši kopš gudri cilvēki sen nāca klajā ar šiem mērķiem diezgan piemērotus mērinstrumentus. Piemēram: svari vai citas ierīces.
Īpaši parametra "kaitinošais peldošais raksturs": vispārīgs dabā sastopamās GĀZES siltumietilpība. Viņa nestabilais, mainīgais "garastāvoklis". Mainot "porcijas lielumu vai devu", DABASGĀZES siltumietilpība dažādās temperatūrās nekavējoties mainās. Degošāks gāzu maisījums, fiziskais daudzums, absolūtā vērtība metāna siltumietilpība- palielinās. Mazāks degošu gāzu maisījuma daudzums, vērtība metāna siltuma jauda samazinās. "Apkaunojums" daži izrādās! Citiem vārdiem sakot, to, kas mums "ir", nekādā veidā nevar uzskatīt par pastāvīgu aprakstīšanu DABAS GĀZES termofizikālās īpašības dažādās temperatūrās. Un vēlams, lai mums "būtu" saprotams, nemainīgs koeficients, atskaites parametrs, kas raksturo termiskās īpašības gāzes degviela, bez "atsaucēm" uz metāna daudzumu (masu, masu, tilpumu). Ko darīt?
Šeit mums palīdz ļoti vienkārša, bet "ļoti zinātniska" metode. Tas attiecas ne tikai uz tiesu izpildītāju "ud. — specifisks", pirms tam fiziskais daudzums, bet gan uz elegantu risinājumu, kas ietver vielas daudzuma izslēgšanu no izskatīšanas. Protams, "neērti, lieki" parametri: masa vai tilpums DABAS DEGOŠĀ GĀZE pilnīgi neiespējami izslēgt. Vismaz tā iemesla dēļ, ka, ja nebūs metāna daudzuma, tad nebūs arī paša "diskusijas priekšmeta". Bet būtībai ir jābūt. Tāpēc mēs izvēlamies kādu nosacītu masas vai tilpuma etalonu, ko var uzskatīt par vienību, kas piemērota mums vajadzīgā koeficienta "C" vērtības noteikšanai. Priekš DABASGĀZES degvielas svars, šāda praktiskā lietošanā ērta metāna masas vienība izrādījās 1 kilograms (kg).
Tagad mēs vienu kilogramu DABASGĀZES uzsildām par 1 grādu, un siltuma daudzumu (siltuma enerģiju) mums vajag sildīt gāzes maisījums viens grāds - tas ir mūsu pareizais fiziskais parametrs, koeficients "C", labi, diezgan pilnībā un skaidri aprakstot vienu no DABAS GĀZES termofizikālās īpašības dažādās temperatūrās. Lūdzu, ņemiet vērā, ka tagad mums ir darīšana ar raksturlielumu aprakstu fiziskais īpašums vielu, bet necenšoties "papildus informēt mūs" par tās daudzumu. Ērti? Nav vārdu. Tā ir pavisam cita lieta. Starp citu, tagad mēs nerunājam par ģenerāli metāna siltuma jauda. Viss ir mainījies. TAS IR ĪPAŠAIS DABASGĀZES SILTUMS, ko dažreiz sauc citā vārdā. Kā? Vienkārši MASĪVI DABAS DEGOŠĀS GĀZES SILTUMKApacitāte. Specifisks (ud.) Un masa (m.) - šajā gadījumā: sinonīmi, tie šeit nozīmē to, kas mums ir vajadzīgs koeficients "C".
1. tabula. Koeficients: DABASGĀZES īpatnējā siltumietilpība (sp.). DABAS deggāzes masas siltuma jauda. Atsauces dati.
Vienkārši sakot, siltuma jauda NOķermeni sauc par siltuma daudzumu, kas jāiztērē šo procesu lai sasildītu ķermeni par vienu grādu: .
Parasti siltumietilpība tiek apzīmēta ar vielas daudzuma vienību un atkarībā no izvēlētās vienības izšķir:
īpatnējās masas siltuma jauda Ar, attiecas uz 1 kg gāzes, J/(kgK);
īpatnējā tilpuma siltuma jauda Ar´, attiecas uz gāzes daudzumu, kas ir 1 m 3 tilpuma normālos fizikālos apstākļos, J / (m 3 K);
īpatnējā molārā siltumietilpība μ Ar, attiecas uz vienu kilomolu, J / (kmolK).
Sakarību starp īpatnējām siltuma jaudām nosaka acīmredzamas attiecības:
Ar= μ Ar/μ; Ar´= Arρ n. (2.13)
Šeit ρ n ir gāzes blīvums normālos apstākļos.
Ķermeņa temperatūras izmaiņas ar tādu pašu piegādātā siltuma daudzumu ir atkarīgas no notiekošā procesa rakstura, tāpēc siltuma jauda ir procesa funkcija. Tas nozīmē, ka vienam un tam pašam darba šķidrumam atkarībā no procesa ir nepieciešams atšķirīgs siltuma daudzums, lai to uzsildītu par 1 K. Skaitliski lielums Ar mainās no + ∞ līdz – ∞.
Termodinamiskajos aprēķinos liela nozīme ir:
siltuma jauda pastāvīgā spiedienā
Ar p = δ q p/ dT, (2.14)
q p , kas tiek ievests organismā procesā ar pastāvīgu spiedienu, līdz ķermeņa temperatūras izmaiņām dT;
siltuma jauda nemainīgā tilpumā
Ar v = δ q v /dT, (2.15)
vienāds ar siltuma daudzuma attiecību δ q v, kas tiek nogādāts organismā procesā nemainīgā tilpumā, līdz ķermeņa temperatūras izmaiņām dT.
Saskaņā ar pirmo termodinamikas likumu slēgtām sistēmām δ q = du + pdv.
Ņemot vērā faktu, ka 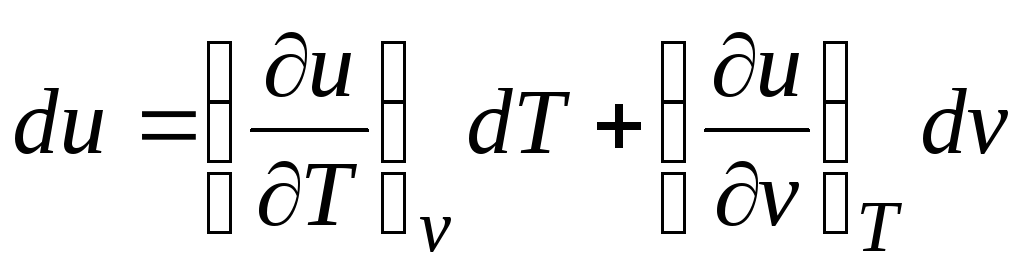 (attiecības (2.1))
(attiecības (2.1))
Δ q = (∂u/∂T) v dT + [(∂u/∂v) T + lpp]dv. (2.16)
Izohoriskam procesam ( v=const) šis vienādojums iegūst formu 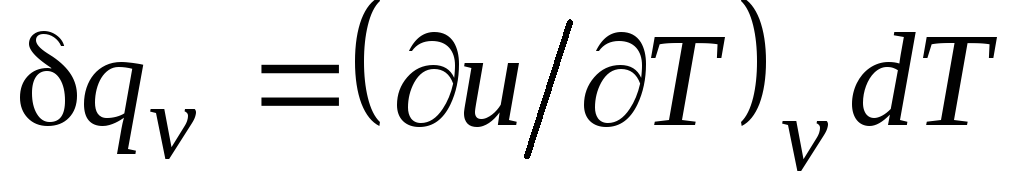 , un, ņemot vērā (2.15), iegūstam, ka
, un, ņemot vērā (2.15), iegūstam, ka
c v = (∂u/∂T) v . (2.17)
Ideālai gāzei
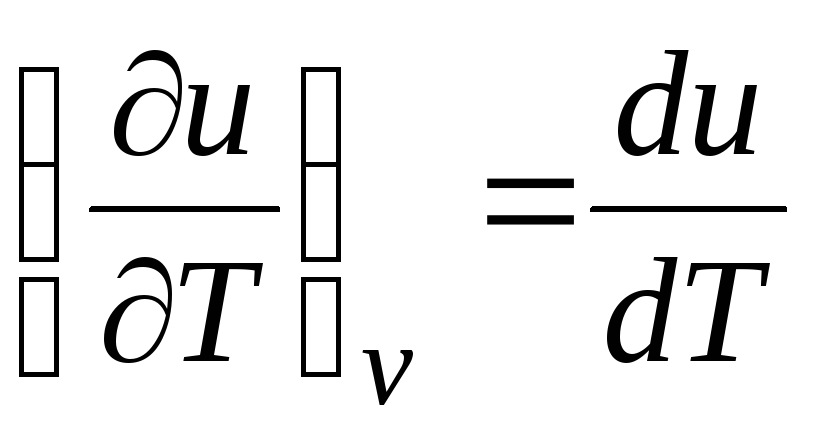 (2.2. vienādojums), tātad
(2.2. vienādojums), tātad
c v = du/dT. (2.18)
Izobāriskam procesam ( R=const) no vienādojumiem (2.16) un (2.14) iegūstam
c p = (∂ u/∂T) v + [(∂u/∂v) T + lpp](dv/dT) lpp
Tā kā iekšējā enerģija ideāla gāze nosaka tikai tā temperatūra un nav atkarīgs no konkrētā tilpuma, tad
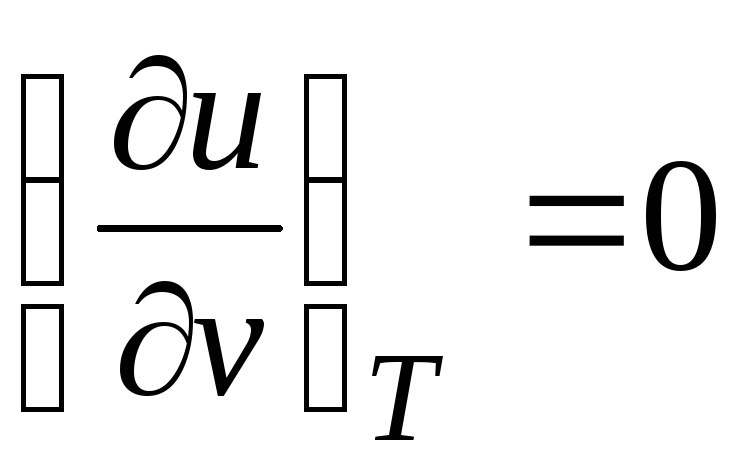 .
(2.19)
.
(2.19)
No Klepeirona vienādojuma (1.4.) pv
= RT(1.3) seko 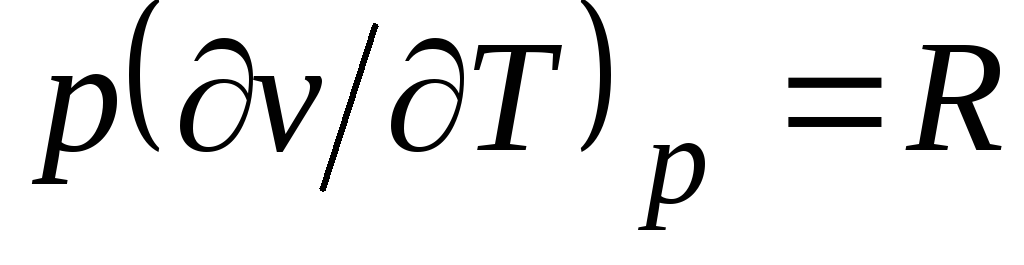 , kur
, kur
c p= Ar v + R. (2.20)
Sakarību (2.20) sauc par Mejera vienādojumu un ir viena no galvenajām ideālo gāzu tehniskajā termodinamikā.
Procesā v\u003d const, gāzei nodotais siltums aiziet tikai, lai mainītu tās iekšējo enerģiju, savukārt procesā p \u003d const siltums tiek tērēts gan iekšējās enerģijas palielināšanai, gan izplešanās darba veikšanai. Tāpēc c p vairāk Ar v pēc šī darba apjoma.
Formula ![]() nosaka tā saukto patieso siltumietilpību, t.i., siltumietilpības vērtību noteiktā temperatūrā. Praksē siltumietilpība tiek plaši izmantota, lai aprēķinātu siltuma daudzumu q 12 , kas jāiztērē ķermeņa uzsildīšanai no vienas temperatūras ( t 1) citam ( t 2) (vai kas izdalīsies pēc atdzesēšanas no t 2 līdz t 1).
nosaka tā saukto patieso siltumietilpību, t.i., siltumietilpības vērtību noteiktā temperatūrā. Praksē siltumietilpība tiek plaši izmantota, lai aprēķinātu siltuma daudzumu q 12 , kas jāiztērē ķermeņa uzsildīšanai no vienas temperatūras ( t 1) citam ( t 2) (vai kas izdalīsies pēc atdzesēšanas no t 2 līdz t 1).
Ja norādītajā temperatūras diapazonā siltumietilpība nemainās, tad
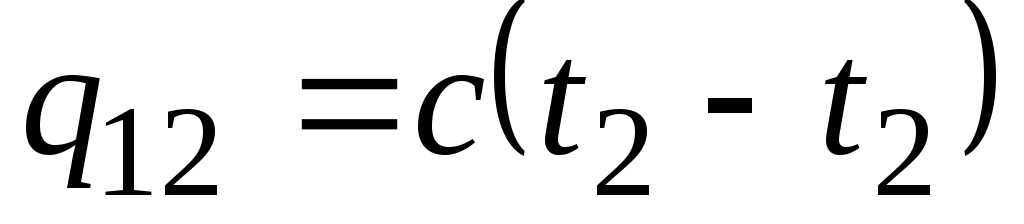 , kJ/kg un
, kJ/kg un 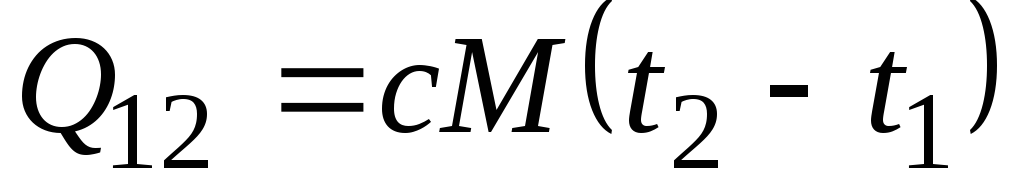 , kJ. (2.21)
, kJ. (2.21)
Šo formulu var izmantot arī aptuveniem (ne pārāk precīziem) aprēķiniem. Piemēram, ūdens īpatnējā siltumietilpība istabas temperatūrā ir 4,187 kJ/(kgC), bet gaisa 1 kJ/(kgC). Tā kā gandrīz visu vielu siltumietilpība mainās (visbiežāk palielinās), palielinoties temperatūrai, stingri runājot, ir jāizmanto formula
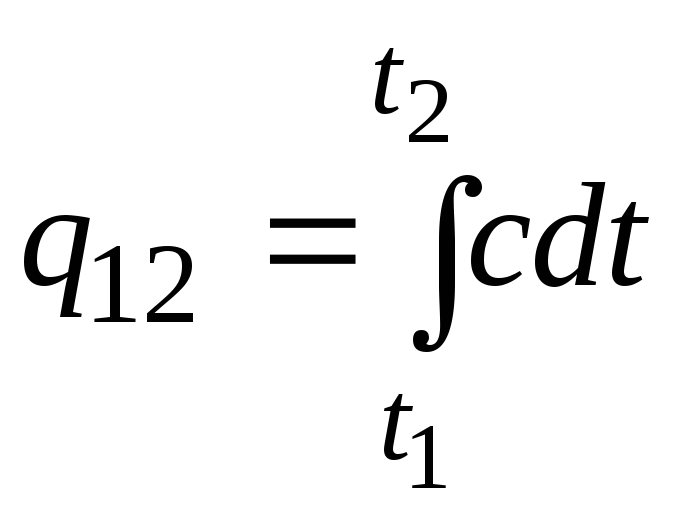 .
(2.21a)
.
(2.21a)
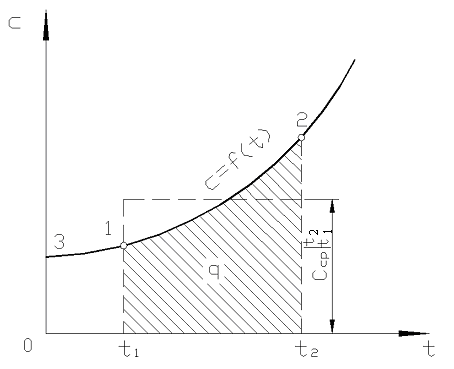
Uz att. 2,2 magnitūdas q 12 ir parādīts kā ēnots laukums. Šķiet, ka vienkāršākais veids, pielietojot vidējās vērtības teorēmu, ir rakstīt
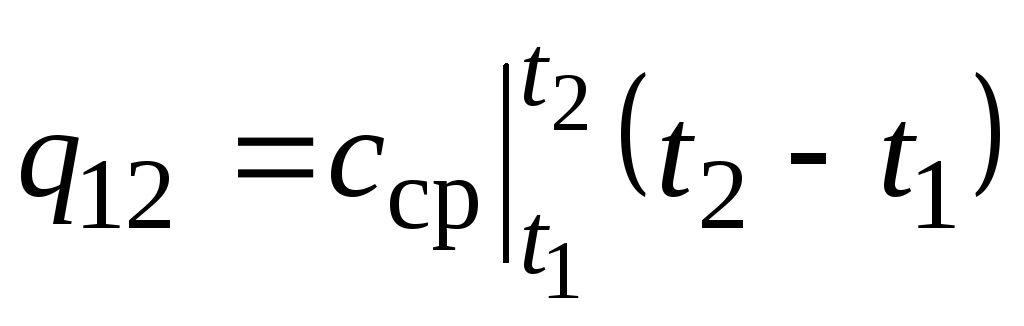 ,
(2.22)
,
(2.22)
kur 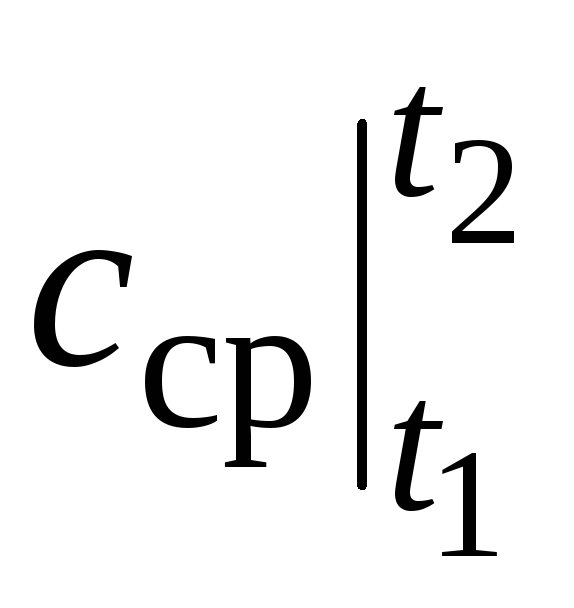 ir vidējā siltuma jauda temperatūras diapazonā t 1 …t 2 .
ir vidējā siltuma jauda temperatūras diapazonā t 1 …t 2 .
Rīsi. 2.2. Patiesās siltumietilpības atkarība no temperatūras
Tomēr reāliem aprēķiniem šāds apzīmējums ir ļoti neērts, jo siltuma jauda tiek izvēlēta no tabulām un 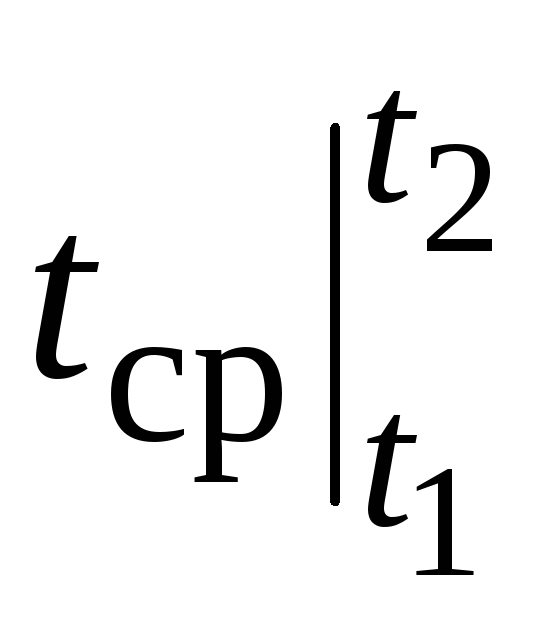 atkarīgs no tā, kā t 1 un no t 2. Divu argumentu funkciju tabula būtu ļoti apgrūtinoša.
atkarīgs no tā, kā t 1 un no t 2. Divu argumentu funkciju tabula būtu ļoti apgrūtinoša.
Praksē rīkojieties šādi. Vēlamais siltuma daudzums tiek parādīts kā starpība starp tā daudzumiem, kas nepieciešami ķermeņa uzsildīšanai no 0 С līdz temperatūrai t 2 un t 1 attiecīgi (2.2. att.)
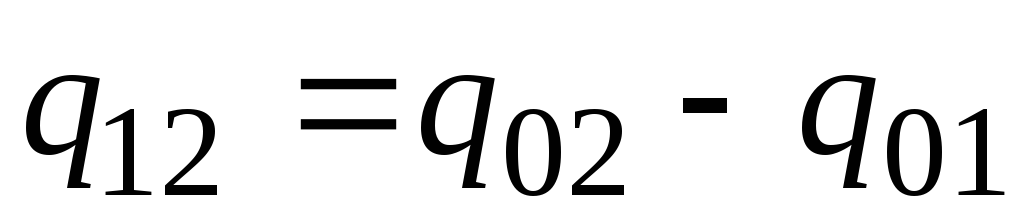 . (2.23)
. (2.23)
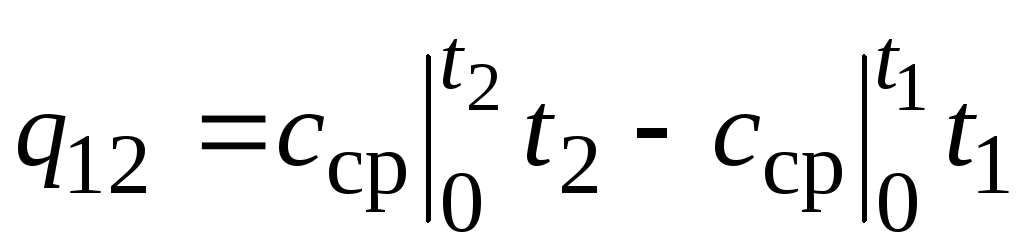 ,
(2.24)
,
(2.24)
kur  - vidējā siltumietilpība temperatūras diapazonā 0… tC.
- vidējā siltumietilpība temperatūras diapazonā 0… tC.
Vidējās siltumietilpības vērtība  konkrētai vielai (un noteiktam procesam, t.i. Ar R vai c v) ir atkarīgs tikai no vienas temperatūras t. Tieši šīs siltuma jaudas ir norādītas visās tabulās ar nosaukumu "vidējais". Tas, kas tika teikts, ir taisnība Ar
(Ar R un c v), kā arī par Ar un Ar. Piemēram, zemāk esošajā tabulā ir parādīta dažu visbiežāk sastopamo gāzu siltuma jauda pret temperatūru. Jāuzsver, ka formulā (2.24) temperatūra tiek aizstāta ar Celsija grādiem.
konkrētai vielai (un noteiktam procesam, t.i. Ar R vai c v) ir atkarīgs tikai no vienas temperatūras t. Tieši šīs siltuma jaudas ir norādītas visās tabulās ar nosaukumu "vidējais". Tas, kas tika teikts, ir taisnība Ar
(Ar R un c v), kā arī par Ar un Ar. Piemēram, zemāk esošajā tabulā ir parādīta dažu visbiežāk sastopamo gāzu siltuma jauda pret temperatūru. Jāuzsver, ka formulā (2.24) temperatūra tiek aizstāta ar Celsija grādiem.
Dažādu gāzu vidējā molārā siltumietilpība plkst R= konst
(pēc M. P. Vukaloviča, V. A. Kiriļina, V. N. Timofejeva vārdiem)
|
t, C |
Ar R, kJ/(kmolK) |
|||||||
|
N 2 atmosfēras | ||||||||
Šajā tabulā vērtības Ar p ir dotas līdz 100 С. Tā kā tie daudz nemainās ar temperatūru, starpvērtības var atrast ar lineāru ekstrapolāciju. Atcerieties, kā tas tiek darīts. Ir tabulas funkciju vērtības y
= f(x) plkst 1 (kad X= X 1) un plkst 2 (kad X= X 2). Funkcijas vērtība plkst(X) plkst X 1 <X<X 2 vienāds 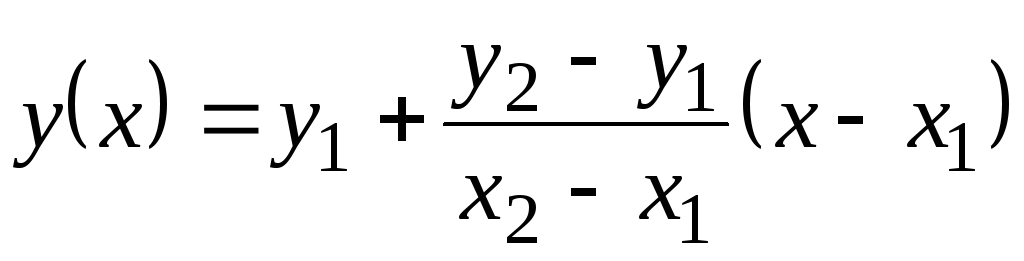 . Šī formula ir patiesa gan monotoni pieaugošai funkcijai (kad plkst 2 >plkst 1) un monotoniski dilstošam ( plkst 2 <plkst viens); Šajā gadījumā daļa būs negatīva, jo X 2 > X 1 vienmēr.
. Šī formula ir patiesa gan monotoni pieaugošai funkcijai (kad plkst 2 >plkst 1) un monotoniski dilstošam ( plkst 2 <plkst viens); Šajā gadījumā daļa būs negatīva, jo X 2 > X 1 vienmēr.
Tabulā parādītas gāzu siltumvadītspējas vērtības atkarībā no temperatūras un spiediena.
Siltumvadītspējas vērtības ir norādītas temperatūrām no 20 K (-253 °C) līdz 1500 K (1227 °C) un spiedienam no 1 līdz 1000 atmosfērām.
Tabula ņemot vērā šādu gāzu siltumvadītspēju: , , freons-14 CF 4, etilēns C 2 H 4 . Siltumvadītspējas mērvienība ir W/(m deg).
Jāpiebilst, ka gāzu siltumvadītspēja palielinās, palielinoties temperatūrai un spiedienam. Piemēram, amonjaka gāzes siltumvadītspēja istabas temperatūrā un normālā atmosfēras spiedienā ir 0,024 W / (m deg), un, to uzkarsējot par 300 grādiem, siltumvadītspēja palielinās līdz vērtībai 0,067 W / (m deg). Ja šīs gāzes spiedienu palielina līdz 300 atmosfērām, siltumvadītspējas vērtība kļūs vēl augstāka un tās vērtība būs 0,108 W / (m deg).
Piezīme: esiet uzmanīgi! Siltumvadītspēja tabulā norādīta ar koeficientu 10 3 . Neaizmirstiet dalīt ar 1000!
Neorganisko gāzu siltumvadītspēja atkarībā no temperatūras
Tabulā ir norādītas neorganisko gāzu siltumvadītspējas vērtības atkarībā no temperatūras normālā atmosfēras spiedienā. Gāzu siltumvadītspējas vērtības ir norādītas temperatūrā no 80 līdz 1500 K (-193 ... 1227 ° C).
Tabulā ir parādīta šādu gāzu siltumvadītspēja: slāpekļa oksīds N 2 O, sēra heksafluorīds SF 6, slāpekļa oksīds NO, sērūdeņradis H 2 S, amonjaks NH 3, sēra dioksīds SO 2, tvaiks H 2 O, oglekļa dioksīds CO 2 , smagais ūdens tvaiks D 2 O, gaiss.
Jāpiebilst, ka neorganisko gāzu siltumvadītspēja palielinās, palielinoties gāzes temperatūrai.
Piezīme: Gāzu siltumvadītspēja tabulā ir norādīta ar koeficientu 10 3 . Neaizmirstiet dalīt ar 1000!
Organisko gāzu siltumvadītspēja kā temperatūras funkcija
Tabulā parādītas dažu šķidrumu organisko gāzu un tvaiku siltumvadītspējas vērtības atkarībā no temperatūras normālā atmosfēras spiedienā. Gāzu siltumvadītspējas vērtības ir norādītas tabulā temperatūras diapazonā no 120 līdz 800 K.
Tiek dota šādu organisko gāzu un šķidrumu siltumvadītspēja: acetons CH 3 COCH 3, oktāns C 8 H 18, pentāns C 5 H 12, butāns C 4 H 10, heksāns C 6 H 14, propilēns C 3 H 6, heptāns C 7 H 16, amilspirts C 5 H 11 OH, ksilols C 8 H 10, izopropilspirts C 2 H 7 OH, metāns CH 4, metilspirts CH 3 OH, oglekļa tetrahlorīds CCl 4, cikloheksāns C 6 H 12, etāns C 2 H 6, oglekļa tetrafluorīds CF 4, freons-11 CFCl 3, etilhlorīds C 2 H 5 Cl, freons-12 CF 2 Cl 2, etilēns C 2 H 4, freons-13 CF 3 Cl, etilformiāts HCOOC 2 H 5, freons-21 CHFCl 2, dietilēteris (C 2 H 5) 2O.
Kā redzams no tabulas, pieaugot gāzes temperatūrai, palielinās arī organisko gāzu siltumvadītspējas vērtība.
Esi uzmanīgs! Siltumvadītspēja tabulā norādīta ar koeficientu 10 3 . Neaizmirstiet dalīt ar 1000! Piemēram, acetona tvaiku siltumvadītspēja 400 K (127°C) temperatūrā ir 0,0204 W/(m deg).
