Պինդ մարմնի ջերմունակության որոշման մեթոդ
Ինչ է ջերմային հզորությունը
Ջերմության մատակարարման դեպքում համակարգի ջերմաստիճանը բարձրանում է: Ջերմաստիճանի անսահման փոքր փոփոխության դեպքում համաչափությունը վավեր է
dT=δQ, կամ dT=constδQ
Ավելի հարմար է այս կապը գրել դQ=СdT կամ
C արժեքը կոչվում է համակարգի իրական ջերմային հզորություն:
Ջերմային հզորությունը համակարգին մատակարարվող ջերմության քանակի և տեղի ունեցող ջերմաստիճանի փոփոխության հարաբերակցությունն է:
Բացի իրականից, կա նաև միջին ջերմային հզորություն.
Ջերմային հզորություն
Եթե ջերմային հզորությունը վերագրվում է նյութի միավոր զանգվածին (մոլին), ապա այն դառնում է անկախ ամբողջ համակարգի զանգվածից և ձեռք է բերում ինտենսիվ պարամետրի հատկություններ։ Եթե ջերմային հզորությունը վերաբերում է նյութի միավորի զանգվածին, այն կոչվում է հատուկ, իսկ 1 մոլին՝ Ջ / (մոլ * կ) չափսով ջերմային հզորություն:
Մենք կդիտարկենք միայն մոլային ջերմային հզորությունները, քանի որ նրանց համար բոլոր օրինաչափությունները շատ ավելի պարզ են, քան հատուկ ջերմային հզորությունների համար:
Ջերմային հզորությունը կախված է այն պայմաններից, որոնցում տեղի է ունենում ջերմության փոխանցումը համակարգին: Եթե համակարգը պարփակված է հաստատուն ծավալի մեջ, ապա ջերմաստիճանի բարձրացում dT-ով տեղի կունենա CvdT-ին հավասար ջերմության ազդեցության ներքո, որտեղ Cv-ն հաստատուն ծավալի ջերմային հզորությունն է: Համակարգի ընդլայնման ժամանակ մշտական ճնշման դեպքում ջերմաստիճանը dT-ով բարձրացնելու համար կպահանջվի ջերմային CpdT, որտեղ Cp-ն մշտական ճնշման տակ ջերմային հզորությունն է։
Հաշվի առնելով ջերմության փոխանցման պայմանները, երբ մեկ կամ մի քանի փոփոխականներ պահպանվում են հաստատուն, մինչդեռ մյուսները փոխվում են, ջերմային հզորությունը կարող է արտահայտվել մասնակի ածանցյալների միջոցով. ![]() . Քանի որ δQ v = dU,
. Քանի որ δQ v = dU,
δQ p =dH, մենք կարող ենք գրել.
![]() (1)
(1)
Cv-ն գազերի իզոխորային ջերմունակությունն է, Cp-ը՝ գազերի իզոբարային ջերմունակությունը։
Իզոխորային և իզոբարային ջերմային հզորությունների տարբերությունները պայմանավորված են ներքին էներգիայի և էթալպիայի տարբերությամբ: Էնթալպիայի և ներքին էներգիայի փոփոխությունները տարբերվում են համակարգի կատարած աշխատանքի քանակից:
δW=∆nRT, ∆H-∆U=∆nRT
Հետևաբար, ջերմային հզորությունները հաստատուն Cv ծավալի և մշտական ճնշման Cp-ի դեպքում նույնպես տարբերվում են աշխատանքի քանակով. Cp - Cv = δW
Հիմնվելով (1) արտահայտությունների վրա՝ կարող ենք գրել.
Այս հավասարությունները փոխարինելով ∆H- ∆U=∆nRT հավասարման մեջ
և հաշվի առնելով, որ ∆n= 1, մենք կգտնենք կապը գազերի մոլային ջերմային հզորությունների միջև.
Cp– Cv= R կամ Cp= Cv+ R
Ինչպես երևում է, դրանք տարբերվում են գազի հաստատունի արժեքով։
Cp= Cv+ R պայմանից հետևում է, որ Cp˃Cv, այսինքն՝ իզոբար գործընթացում, երբ P=const, համակարգի ջերմաստիճանը բարձրացնելու համար պահանջվում է. մեծ քանակությամբջերմություն, քան իզոխորիկ գործընթացում:
Գազերի մոլային ջերմային հզորությունը R-ի կարգի արժեքներ ունի, ուստի Cp-ի և Cv-ի միջև տարբերությունը շատ նշանակալի է: Այսպիսով, ածխածնի երկօքսիդի համար CO 2-ի համար 25 0 C Cp = 37, 14; և Cv = 28,83 J / (մոլ * K)
Cp - Cv տարբերությունը մեկ մոլի իզոբարային ընդարձակման աշխատանքն է իդեալական գազերբ ջերմաստիճանը բարձրանում է մեկ աստիճանով. Մարմնի հեղուկները և պինդ մարմինները տաքացման ժամանակ բնութագրվում են ծավալի մի փոքր աճով: Ուստի խտացված մարմինների համար կարելի է ենթադրել, որ Ср ≈ Сv.
ԿԻՐԽՀՈՖԻ ՀԱՎԱՍԱՐՈՒՄԸ. ՋԵՐՄԱԿԱՆ ԱԶԴԵՑՈՒԹՅՈՒՆՆԵՐԻ ԿԱԽՎՈՒԹՅՈՒՆԸ ՋԵՐՄԱՍՏԱՆԻՑ.
Նախկինում դիտարկված ջերմային ազդեցությունների հաշվարկները, որոնք հիմնված են Հեսսի օրենքի վրա, առաջացման և այրման ջերմության համար սահմանափակված են ստանդարտ պայմաններով: Գործնական նպատակների համար անհրաժեշտ է հաշվարկել ջերմային ազդեցությունները հատուկ պայմանների համար, բացի ստանդարտ պայմաններից:
Ստանդարտ պայմաններում անցնել հայտնի ջերմային ազդեցություններից, այսինքն. 25 0 C (298,15 Կ) ջերմաստիճանի և 1 ատմ ճնշման դեպքում։ (1,013 * 10 5 Պա), հնարավոր է հաշվարկել ջերմային ազդեցությունները մեզ հետաքրքրող ցանկացած ջերմաստիճանում՝ օգտագործելով Կիրխհոֆի օրենքը. Արդյունաբերական պայմաններում գործընթացները բնութագրվում են ջերմաստիճանի զգալի տատանումներով, որոնց տիրույթը որոշվում է ոչ միայն տեխնոլոգիայի պայմաններով, այլև սեզոնով: Այս միջակայքը կարող է հասնել հարյուրավոր աստիճանների, բնական է, որ ջերմային ազդեցությունները կլինեն. զգալիորեն տարբերվում են և կախված են ջերմաստիճանից:
Դիտարկենք Կիրխհոֆի օրենքը դիֆերենցիալ ձևով: Դա անելու համար մենք գրում ենք էթալպիայի փոփոխությունները իզոբարային և ներքին էներգիայի իզոխորիկ գործընթացներում:
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
Տարբերեք այս հավասարումները ջերմաստիճանի նկատմամբ և ստացեք.
Կիրխհոֆի հավասարումներ.

Եվ - համապատասխանաբար իզոբար և իզոխորիկ պրոցեսների ջերմային ազդեցության ջերմաստիճանի գործակիցները. և - համակարգի ջերմային հզորության փոփոխությունը համապատասխանաբար իզոբար և իզոխորիկ գործընթացների արդյունքում:
Կիրխհոֆի հավասարման հիման վրա Կիրխհոֆի օրենքը ձևակերպվում է դիֆերենցիալ ձևով. գործընթացի ջերմային ազդեցության ջերմաստիճանի գործակիցը հավասար է համակարգի ջերմային հզորության փոփոխությանը, որը տեղի է ունենում այս գործընթացի արդյունքում:
Այսպիսով, Կիրխհոֆի օրենքը դիֆերենցիալ ձևով հնարավորություն է տալիս որոշել միայն ջերմային էֆեկտի փոփոխությունը ջերմաստիճանի հետ, և ոչ թե բուն ջերմային էֆեկտի մեծությունը։
Եկեք վերլուծենք Կիրխհոֆի հավասարումը
Ռեակցիայի համար՝ aA + bB = dD + rR իզոբար պրոցեսում (р=const), ըստ Կիրխհոֆի օրենքի, ջերմային հզորության փոփոխությունը համակարգում կունենա ձև.
Նմանատիպ արտահայտություն կարելի է ձեռք բերել իզոխորիկ գործընթացի համար.
Քանի որ Կիրխհոֆի օրենքը թույլ է տալիս որոշել գործընթացի ջերմային ազդեցության փոփոխությունները ջերմաստիճանի փոփոխությամբ, մենք կառուցում ենք գրաֆիկ.
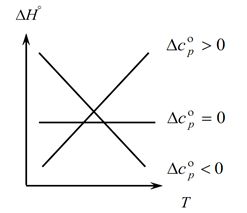
1. Դիտարկենք առաջին դեպքը, երբ ∆Ср(∆Сv)˃0, քանի որ ∆Ср=∑С կոն. -∑С սկզբնական, հետևաբար հետևում է, որ ռեակցիայի արգասիքների ջերմային հզորությունների գումարն ավելի մեծ է, քան մեկնարկային նյութերի ջերմային հզորությունների գումարը՝ ∑С կոն. ˃∑Սկզբից Այս դեպքում գրաֆիկի վրա մենք ստանում ենք կոր 1, ինչը նշանակում է, որ ջերմաստիճանի բարձրացմանը զուգահեռ մեծանում է նաև գործընթացի ջերմային ազդեցության փոփոխությունը (T և ∆H);
2. Երկրորդ դեպքը, երբ ∆Ср(∆Сv)˂0. Առաջին օրենքի նման մենք ունենք ∑С con. ˂∑Վաղուց (վերջնական արտադրանքի ջերմային հզորությունների գումարը փոքր է սկզբնական նյութերի ջերմային հզորությունների գումարից): Այնուհետև գրաֆիկի վրա ստանում ենք կոր, ինչը նշանակում է, որ ջերմաստիճանի բարձրացմամբ գործընթացի ջերմային ազդեցության փոփոխությունը նվազում է (Т→∆H↓)
3. Եվ երրորդ դեպքը, երբ համակարգի ջերմային հզորությունների փոփոխությունը հավասար է զրոյի ∆Ср(∆Сv)=0։ Այնուհետեւ ռեակցիաների վերջնական արտադրանքների ջերմային հզորությունների գումարը հավասար է ելանյութերի ջերմային հզորությունների գումարին ∑С con. \u003d ∑ Սկզբից: Այս դեպքում ռեակցիայի ջերմային ազդեցությունը ջերմաստիճանի ֆունկցիա չէ (∆H ≠ f(T)) և գրաֆիկի վրա ստանում ենք ուղիղ գիծ։
ՋԵՐՄԱԿԱՆ ԱԶԴԵՑՈՒԹՅԱՆ ՀԱՇՎԱՐԿ ՏՐՎԱԾ ՀԱՄԱՐ
ՋԵՐՄԱՑՈՒՅՑ. ԿԻՐԽՀՈՖԻ ՀԱՎԱՍԱՐՄԱՆԻ ԻՆՏԵԳՐԱՑՈՒՄ
Ջերմային էֆեկտի արժեքը ջերմաստիճանից կախված գտնելու համար անհրաժեշտ է ինտեգրել հավասարումները

T-ից մինչև T 0 (որտեղ T-ը պահանջվող ջերմաստիճանն է, T 0-ը ստանդարտ ջերմաստիճանն է), ∆H-ից մինչև ∆H 0 կամ ∆U-ից մինչև ∆U 0 (որտեղ ∆H-ը և ∆U-ն ենթալպիան և ներքին էներգիան են՝ պայմաններ, որոնք տարբերվում են ստանդարտից): Ինտեգրումն իրականացվում է երկու դեպքում.
Համար ոչ օրգանական նյութերՕրգանական նյութերի համար.
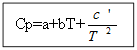
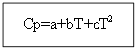
Օրինակ՝ H 2 (g)-ի համար՝ անօրգանական նյութ
| Ср=f(T) | Տ | |||
| ա | բ*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27.28 + 3.26 * 10 -3 T +:
ա) Մոտավոր ինտեգրում:
isobaric գործընթացի համար
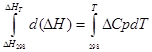
∆H T - ∆H 298 =∆Cp*(T-298)
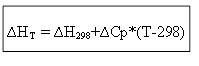
isochoric գործընթացի համար.
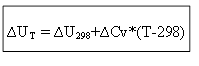
Այսպիսով, ջերմային էֆեկտը ∆H կամ ∆U ներքին էներգիան որոշելու համար ցանկացած T ջերմաստիճանում, անհրաժեշտ է իմանալ պրոցեսի ջերմությունը ∆H 0 (∆U 0) ստանդարտ պայմաններում և ջերմային հզորությունների ∆Ср, ∆. CV.
Օրինակ. Հաշվե՛ք ացետիլենից բենզոլի ստացման գործընթացի ∆H ջերմային ազդեցությունը.
3C 2 H 2 (g) → C 6 H 6 (g) 75 0 C (348K):
1. Աղյուսակներից գտնում ենք բենզոլի և ացետիլենի միջին մոլային իզոբար ջերմային հզորությունները.
Ср С6Н6 (g) \u003d 81,67 J / (մոլ * Կ);
Cp C2H2 (g) \u003d 43,93 J / (մոլ * Կ):
2. Գործընթացի ջերմային հզորության փոփոխությունը մենք գտնում ենք.
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) սկզբնական \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 K) J /m.
3. Ըստ աղյուսակային տվյալների ջերմային էֆեկտը գտնում ենք ստանդարտ պայմաններում.
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 կՋ / մոլ
4. Գտեք ջերմային ազդեցությունը տվյալ ջերմաստիճանում.
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 Ջ / մոլ
բ) Ճշգրիտ ինտեգրում:
Դիտարկենք երկրորդ, ավելի բարդ դեպքը, երբ ջերմային հզորության փոփոխությունը կախված է ջերմաստիճանից, այսինքն. Ср=f(T), Cv=f(T):
Անդրադառնանք ռեակցիայի հավասարմանը ընդհանուր ձևով
dD + rR = qQ + pP
| ա | բ*10 3 | c’*10 -5 | C*10 6 | |
| Դ | + | + | - | + |
| Ռ | + | + | + | - |
| Ք | + | + | + | - |
| Պ | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
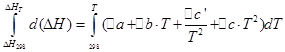
Մենք կիրականացնենք նույն գործողությունները իզոխորիկ գործընթացի համար.
Տարրալուծման ջերմություն
Պինդ, հեղուկ կամ գազային նյութը լուծույթի անցնելու ժամանակ էթալպիայի փոփոխությունը կոչվում է տարրալուծման ջերմային կամ էնթալպիա.
Տարրալուծման ջերմությունը սովորաբար ներառում է բյուրեղային ցանցի քայքայման ջերմությունը (համար պինդ նյութեր), իոնացում և լուծույթ։
Բյուրեղային աղի իոնների միջև կապը խզելու համար անհրաժեշտ է էներգիա, այսինքն. մինչդեռ ջերմությունը կլանում է: Միևնույն ժամանակ, ջրային լուծույթում տեղի է ունենում իոնային խոնավացում. H 2 O-ի իոնների և մոլեկուլների միջև կապ է ձևավորվում: Տարրալուծման ջերմության նշանը որոշվում է այն գործընթացով, որն էներգետիկորեն ավելի ցայտուն է:
LiBr: ∆H dist = - 49,02 կՋ / մոլ - ջերմություն է արտանետվում
KCl: ∆H dist = 7,23 կՋ/մոլ - ջերմությունը ներծծվում է
Տարբերակել. տարրալուծման ամբողջական ջերմությունն այն ջերմությունն է, որն ազատվում կամ ներծծվում է, երբ 1 մոլ տվյալ նյութը լուծարվում է և առաջանում է տվյալ կոնցենտրացիայի լուծույթ: Լուծման ամբողջական ջերմությունը տատանվում է՝ կախված լուծված նյութի քանակից։
Տարբերակել. տարրալուծման դիֆերենցիալ ջերմություն - սա այն ջերմությունն է, որն ուղեկցում է տվյալ նյութի 1 մոլի անսահման լուծարմանը։ մեծ ծավալայս նյութի լուծում. Ինտեգրալ ջերմությունները լայնորեն օգտագործվում են Հեսսի օրենքի համաձայն առաջացման և այլ ռեակցիաների ջերմությունները հաշվարկելիս։ Տարրալուծման դիֆերենցիալ ջերմությունները բնութագրում են լուծույթների թերմոդինամիկական հատկությունները և դրանց առաջացման գործընթացը։
ԼԱԲ #8
ՊԻՐԴ ՄԱՐՄԻՆՆԵՐԻ ՋԵՐՄԱԿԱՆ ԿԱՐՈՂՈՒԹՅԱՆ ՈՐՈՇՈՒՄԸ
Գործիքներ և պարագաներ.փորձարարական կարգավորում FPT1-8:
Նպատակը:մետաղական նմուշների ջերմային հզորության որոշում կալորիմետրիկ մեթոդով` օգտագործելով էլեկտրական ջեռուցում:
Համառոտ տեսություն
Նյութի հատուկ ջերմային հզորություն - արժեք, որը հավասար է ջերմության քանակին, որն անհրաժեշտ է 1 կգ նյութը 1 Կ-ով տաքացնելու համար.
Մոլային ջերմային հզորություն - արժեք, որը հավասար է ջերմության քանակին, որն անհրաժեշտ է 1 մոլ նյութը 1 Կ-ում տաքացնելու համար.
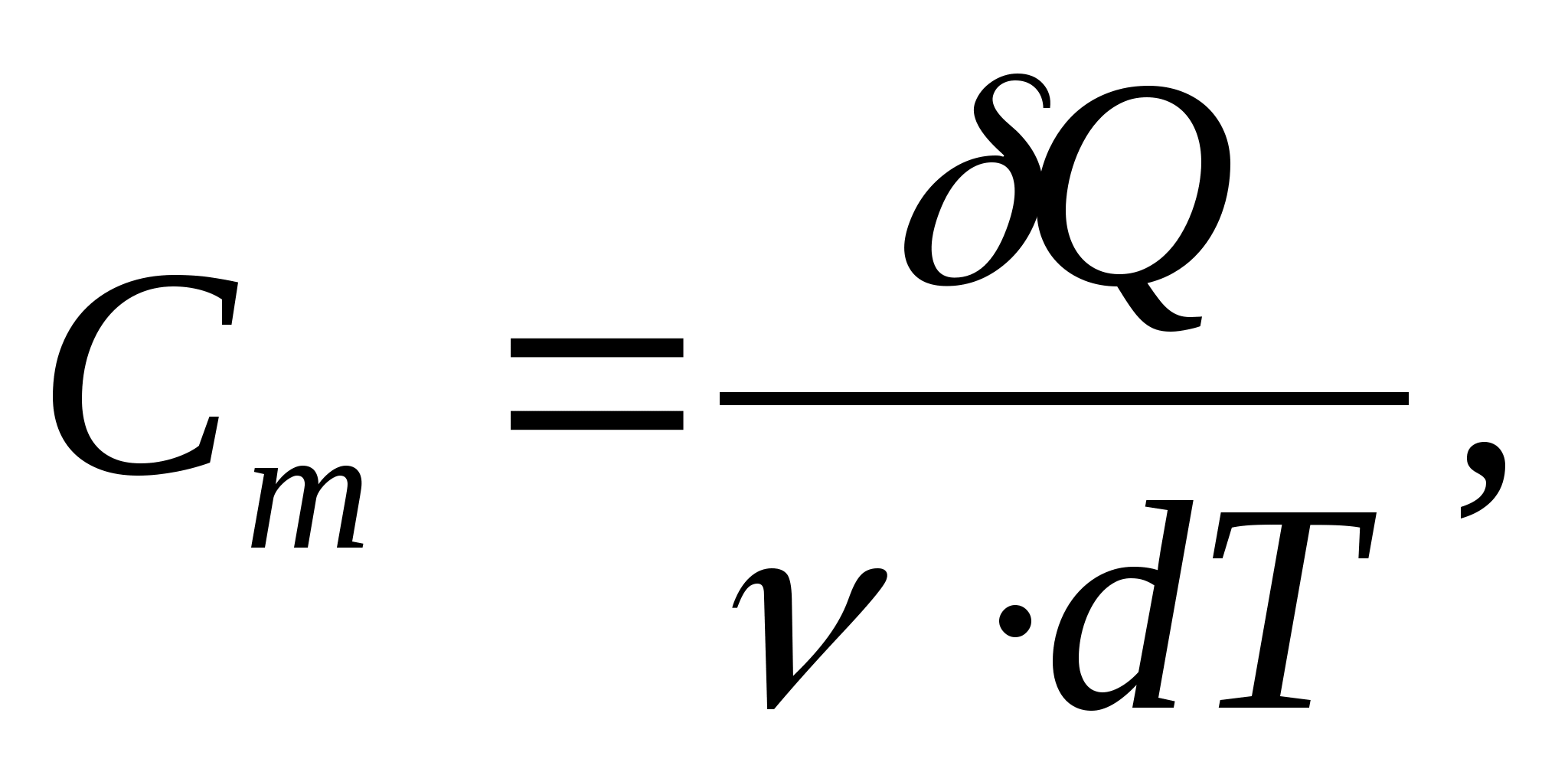
որտեղ 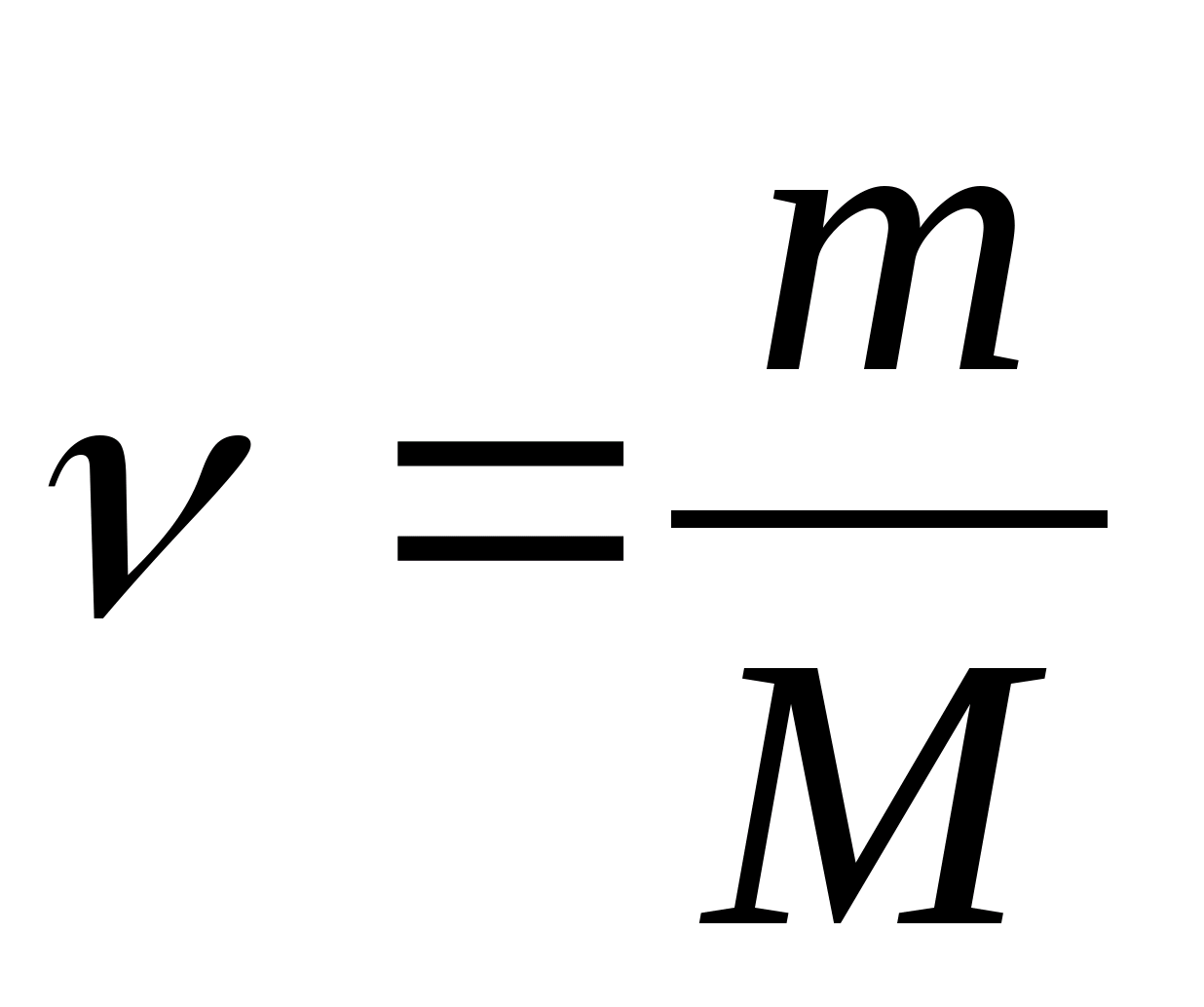 - նյութի քանակությունը.
- նյութի քանակությունը.
Հատուկ ջերմություն գկապված մոլարի հետ Գ մհարաբերակցությունը

որտեղ Մնյութի մոլային զանգվածն է։
Տարբերել ջերմային հզորություն մշտական ծավալովև մշտական ճնշում, եթե նյութը տաքացնելու գործընթացում նրա ծավալը կամ ճնշումը պահպանվում է հաստատուն։
Անկախ փոփոխականների (կոորդինատների) ամենափոքր թիվը, որոնք ամբողջությամբ որոշում են համակարգի դիրքը տարածության մեջ, կոչվում է ազատության աստիճանների քանակը .
Համաձայն Բոլցմանի օրենքի՝ մոլեկուլների ազատության աստիճանների վրա էներգիայի միասնական բաշխման մասին, ազատության յուրաքանչյուր թարգմանական և պտտվող աստիճան ունի միջին կինետիկ էներգիա, որը հավասար է.
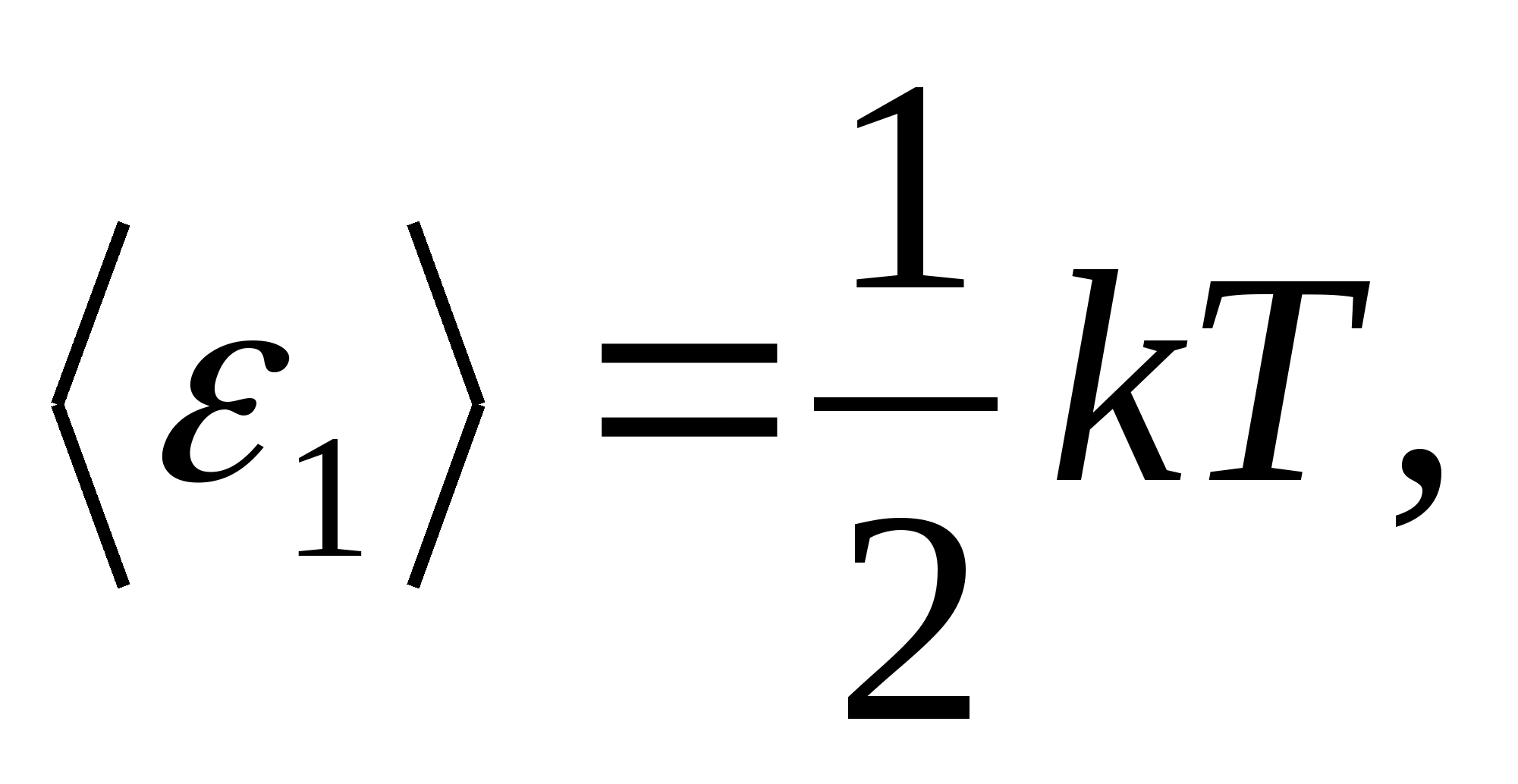
(որտեղ կԲոլցմանի հաստատունն է), և ազատության յուրաքանչյուր թրթիռային աստիճանի համար միջինում էներգիան հավասար է
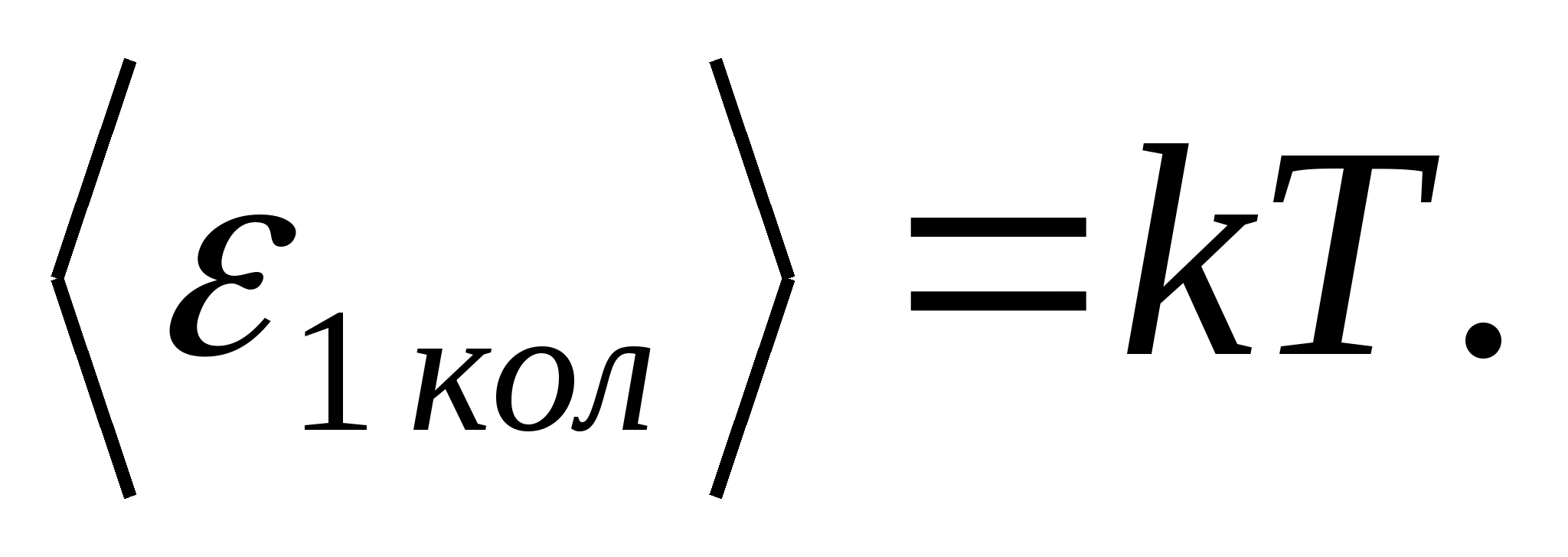
Այսպիսով, մոլեկուլի միջին էներգիան
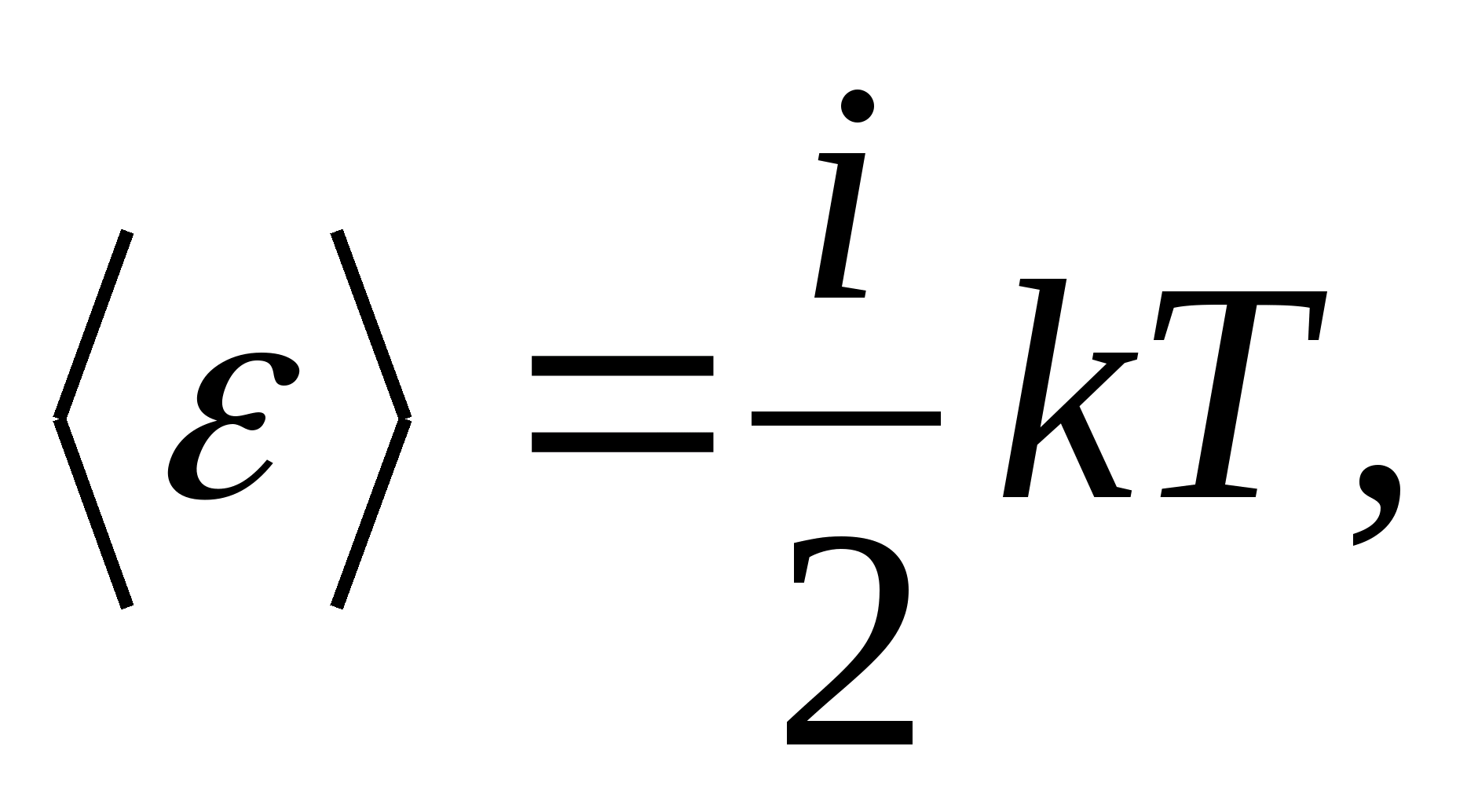
որտեղ եսմոլեկուլի ազատության թրթռման աստիճանների քանակի գումարն է, պտտվող և կրկնակի թվի թրթռումային աստիճաններ.
![]()
Օրինակ, միատոմային իդեալական գազի մոլեկուլների միջին կինետիկ էներգիան ( 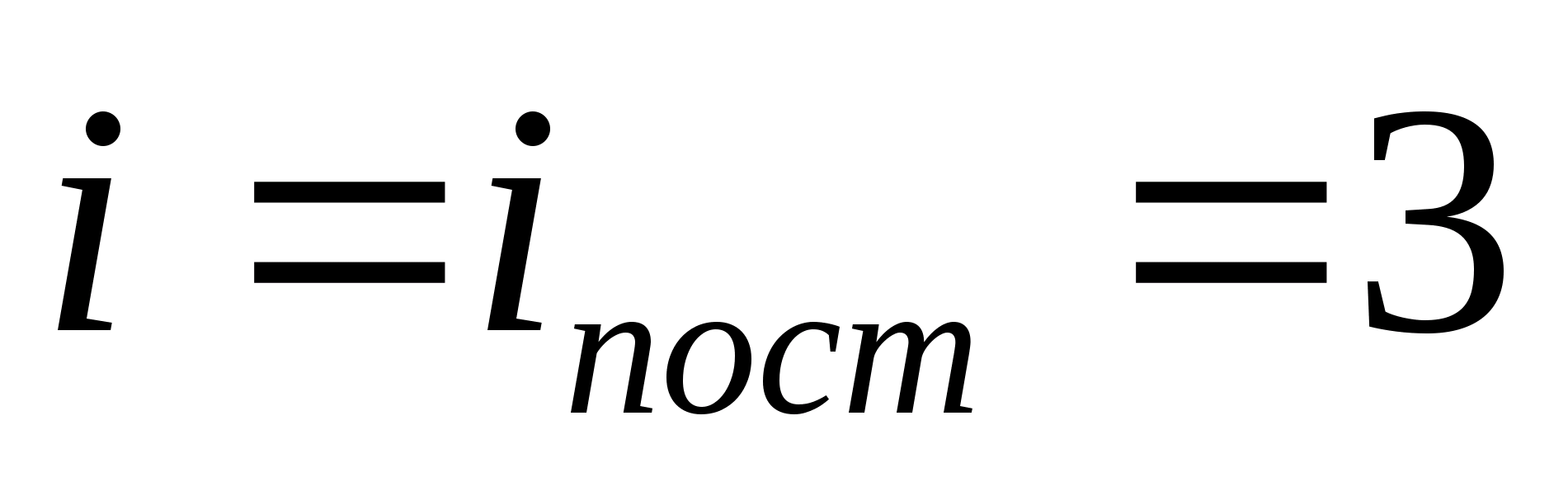 ) հավասար է
) հավասար է
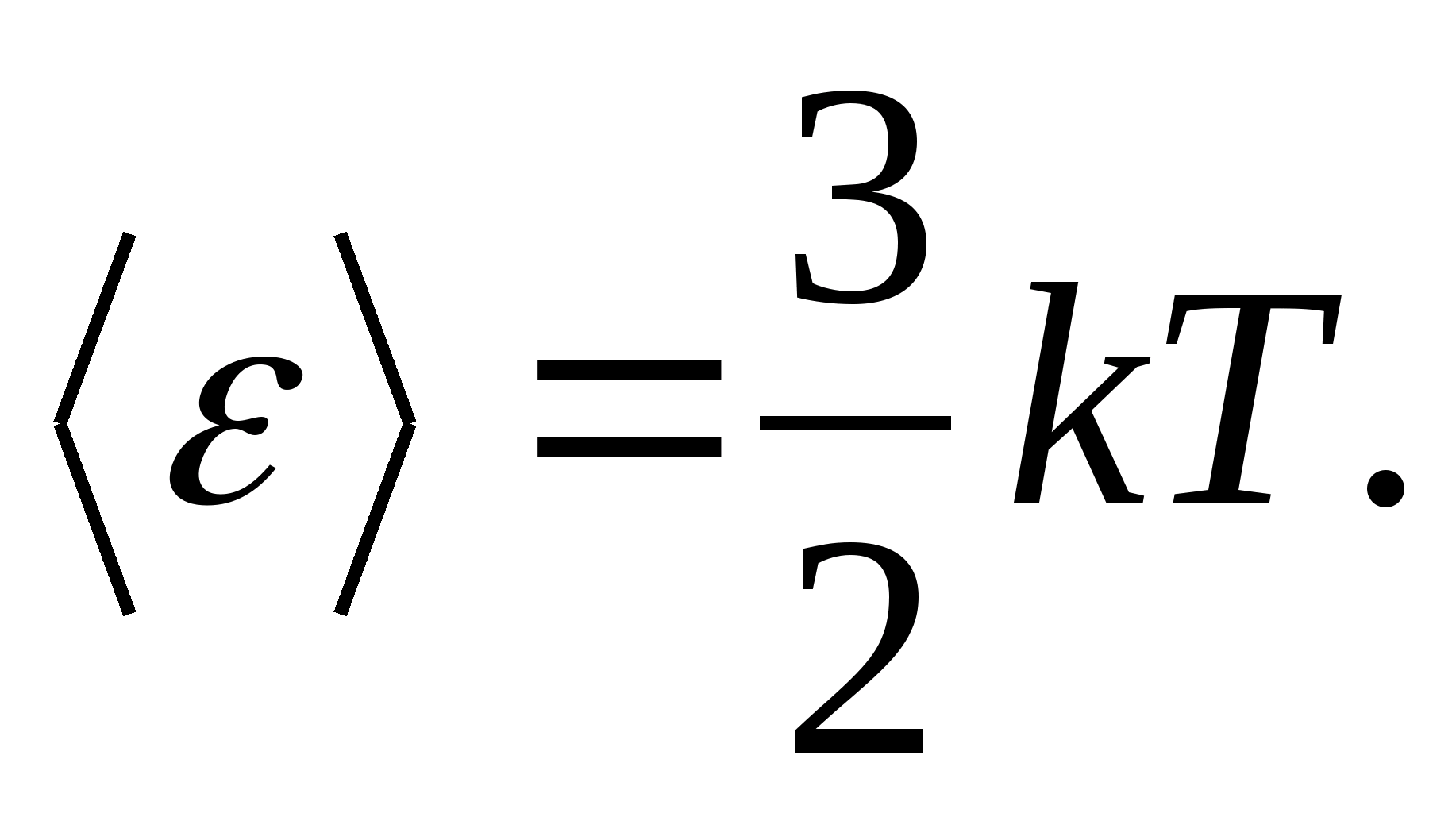
Ինչպես մոդելներպինդ մարմնի համար դիտարկենք ճիշտ կառուցված բյուրեղյա ցանց, որի հանգույցներում մասնիկները (ատոմներ, իոններ, մոլեկուլներ) վերցված են որպես. նյութական կետեր, տատանվում են իրենց հավասարակշռության դիրքերի շուրջ - վանդակավոր հանգույցներ -երեք միմյանց ուղղահայաց ուղղություններով. Այսպիսով, բյուրեղային ցանցը կազմող յուրաքանչյուր մասնիկի հատկացվում է ազատության երեք թրթռումային աստիճան, որոնցից յուրաքանչյուրը, ըստ ազատության աստիճանների վրա էներգիայի միասնական բաշխման օրենքի, ունի էներգիա. կՏ.
Այնուհետև բյուրեղային ցանցում տատանողական շարժման ժամանակ մասնիկի ընդհանուր էներգիայի միջին արժեքը
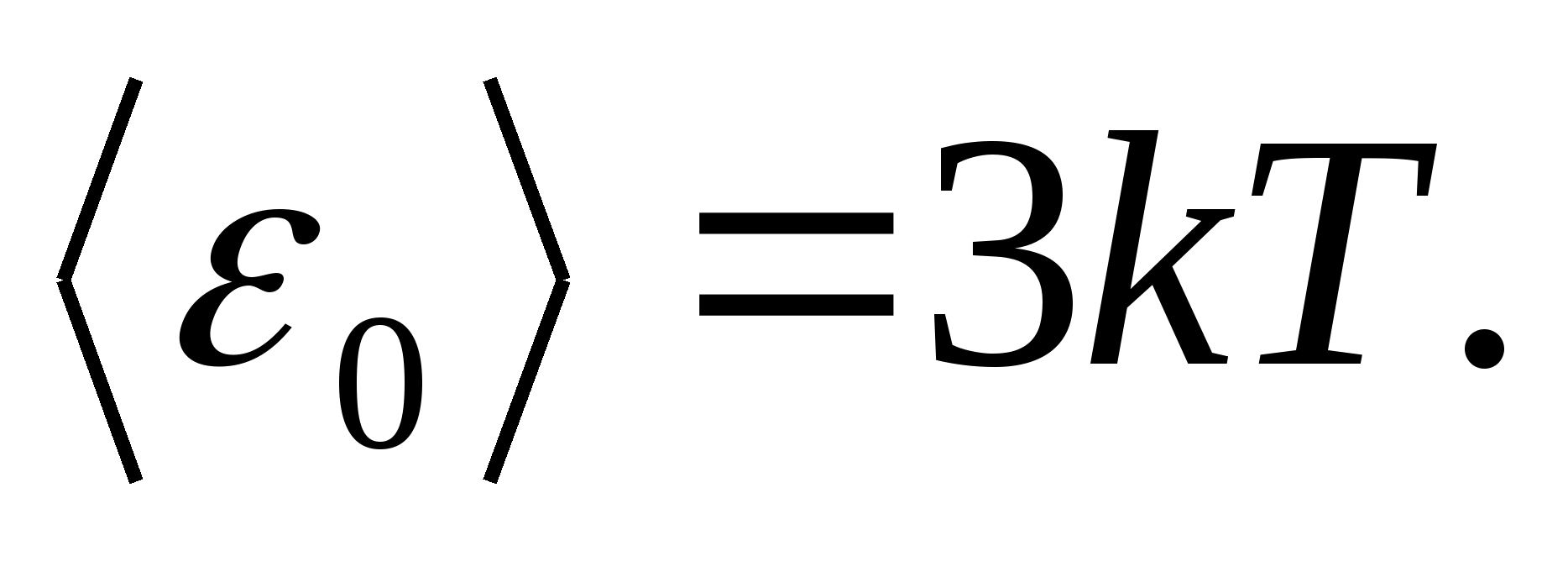
Պինդ մարմնի մեկ մոլի ընդհանուր ներքին էներգիան ստացվում է մեկ մասնիկի միջին էներգիան բազմապատկելով մեկ մոլում պարունակվող ինքնուրույն թրթռացող մասնիկների թվով, այսինքն. Ավոգադրոյի հաստատունին Ն Ա :
որտեղ R=N Ա կհամընդհանուր (մոլային) գազի հաստատուն է, R= 8,31 Ջ/(մոլԿ):
Պինդ մարմինների համար, ջերմային ընդարձակման փոքր գործակցի պատճառով, ջերմային հզորությունները մշտական ճնշման և հաստատուն ծավալի դեպքում գործնականում չեն տարբերվում: Հետևաբար, հաշվի առնելով (8.1) պինդ մարմնի մոլային ջերմունակությունը
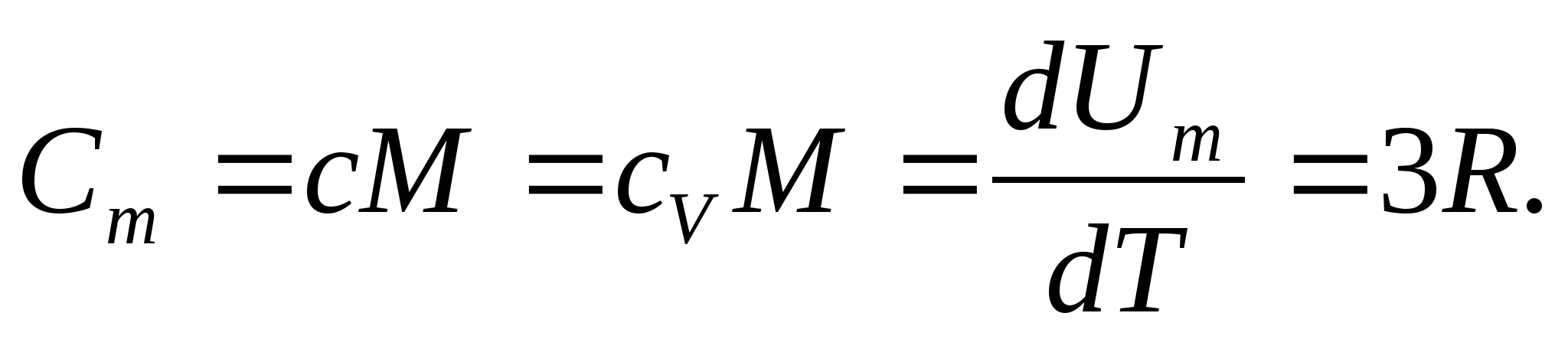 (8.2)
(8.2)
Փոխարինելով մոլային գազի հաստատունի թվային արժեքը՝ ստանում ենք.
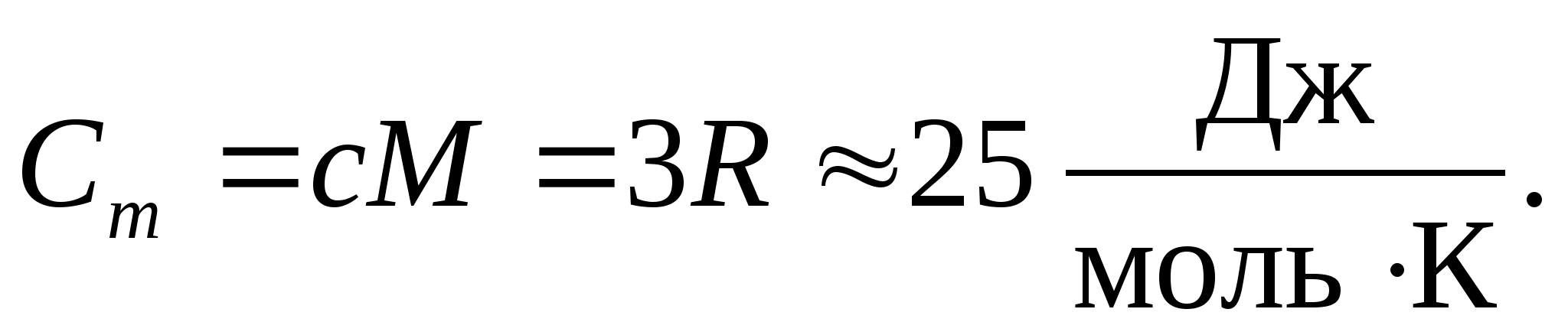
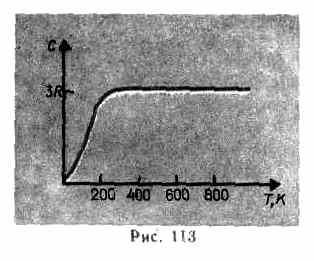
Այս հավասարությունը պահպանում է բավականին լավ մոտարկում սենյակային ջերմաստիճանում գտնվող շատ նյութերի համար և կոչվում է Դուլոնգի և Փիթի օրենքը : Բոլոր քիմիապես պարզ բյուրեղների մոլային ջերմային հզորությունը պինդ նյութերմոտավորապես հավասար է 25 Ջ/(մոլ TO). Երբ ջերմաստիճանը նվազում է, բոլոր պինդ մարմինների ջերմային հզորությունները նվազում են՝ մոտենալով զրոյին Տ0. Բացարձակ զրոյի մոտ, բոլոր մարմինների մոլային ջերմային հզորությունը համաչափ է T 3-ին, և միայն յուրաքանչյուր նյութին բնորոշ բավական բարձր ջերմաստիճանի դեպքում է հավասարությունը (8.2) սկսում պահպանվել: Ցածր ջերմաստիճաններում պինդ մարմինների ջերմային հզորությունների այս առանձնահատկությունները կարելի է բացատրել Էյնշտեյնի և Դեբիի կողմից ստեղծված ջերմային հզորության քվանտային տեսության միջոցով։
Ջերմային հզորությունը փորձնականորեն որոշելու համար ուսումնասիրվող մարմինը տեղադրում են կալորիմետրի մեջ, որը տաքացվում է էլեկտրական հոսանքով։ Եթե փորձանմուշով կալորիմետրի ջերմաստիճանը նախնականից շատ դանդաղ է բարձրանում Տ 0-ից Տ, ապա էլեկտրական հոսանքի էներգիան կօգտագործվի նմուշը և կալորիմետրը տաքացնելու համար.
որտեղ Իև U- ջեռուցիչի հոսանքը և լարումը; - ջեռուցման ժամանակը; մ 0 և մկալորիմետրի և փորձանմուշի զանգվածներն են, Հետ 0 և Հետ− կալորիմետրի և փորձանմուշի հատուկ ջերմային հզորությունները, Ք- ջերմության կորուստ կալորիմետրի ջերմամեկուսացման և շրջակա տարածքի նկատմամբ:
(8.3) հավասարումից բացառելու համար կալորիմետրի տաքացման վրա ծախսվող ջերմության քանակությունը և շրջակա տարածքի ջերմության կորուստը, անհրաժեշտ է, որ նույն ջեռուցիչի հզորությամբ, դատարկ կալորիմետրը (առանց նմուշի) տաքացվի սկզբնական ջերմաստիճանից։ Տ 0 նույն ջերմաստիճանի տարբերության համար Տ. Ջերմության կորուստը երկու դեպքում էլ կլինի գրեթե նույնը և շատ փոքր, եթե կալորիմետրի պաշտպանիչ պատյանների ջերմաստիճանը երկու դեպքում էլ հաստատուն է և հավասար է սենյակային ջերմաստիճանին.
(8.3) և (8.4) հավասարումները ենթադրում են
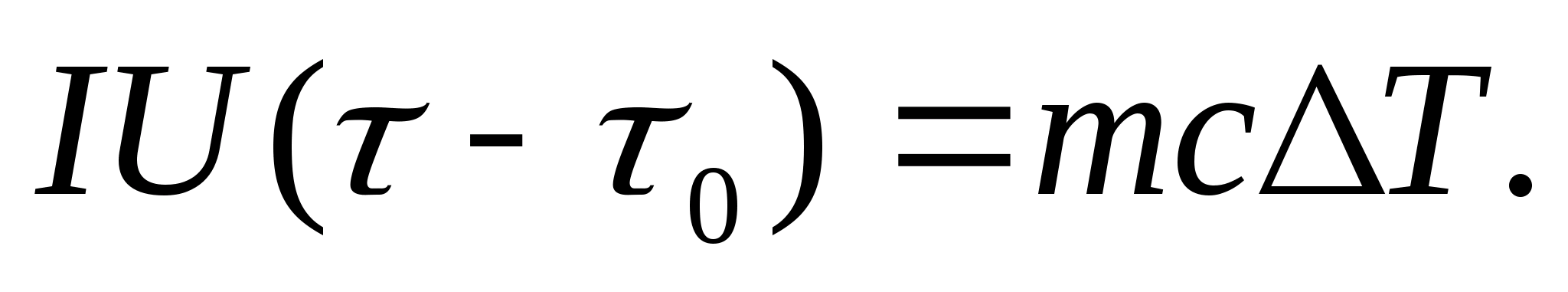 (8.5)
(8.5)
Հավասարումը (8.5) կարող է օգտագործվել փորձնականորեն որոշելու փորձանմուշի նյութի հատուկ ջերմային հզորությունը: Կալորիմետրի ջերմաստիճանը փոխելով` անհրաժեշտ է գծագրել տաքացման ժամանակի տարբերության կախվածությունը փորձանմուշի ջերմաստիճանի փոփոխությունից.
−
0)=զ(Տ), ըստ որի անկյունային գործակցի 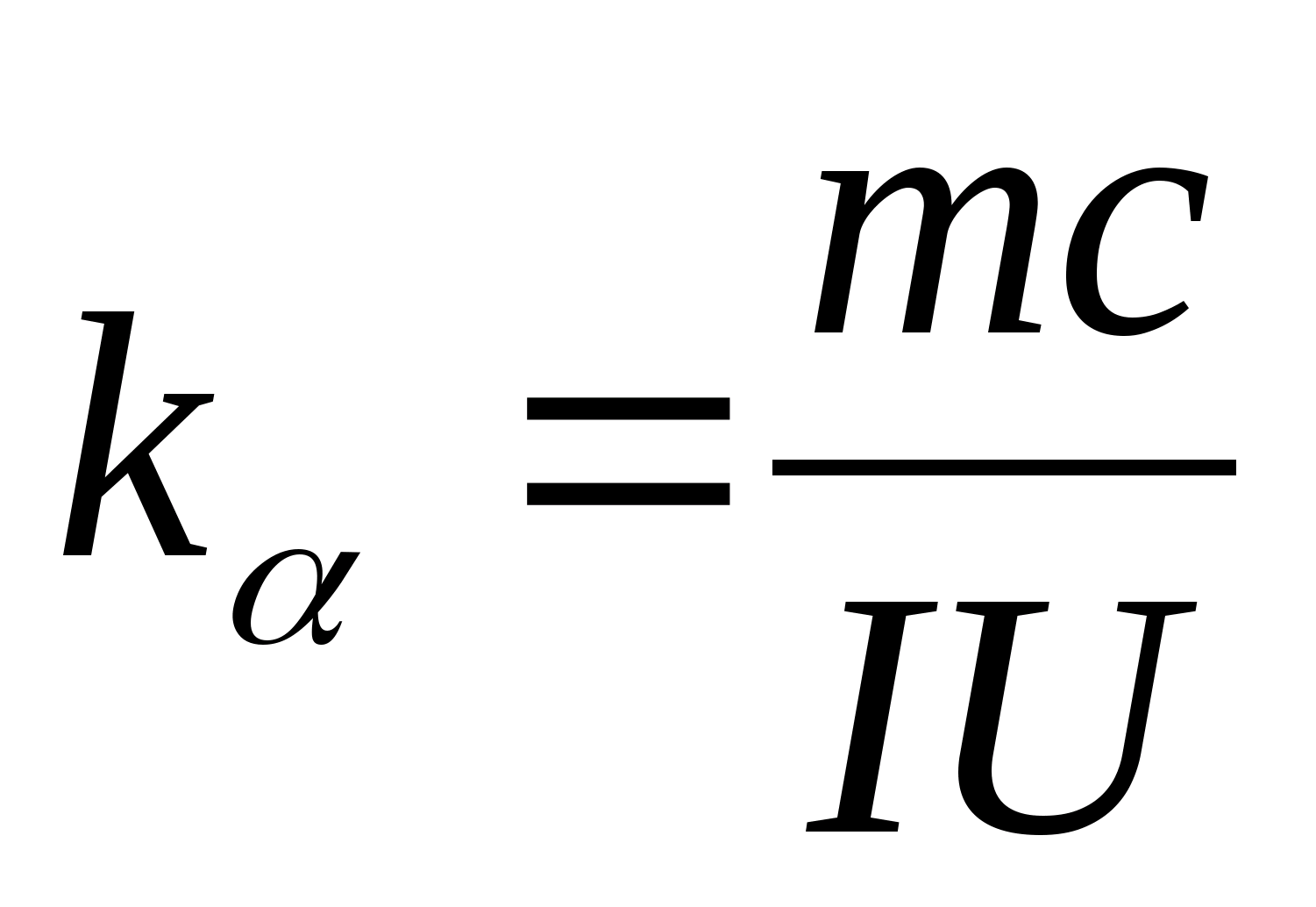 կարող է որոշվել նմուշի հատուկ ջերմային հզորությունը:
կարող է որոշվել նմուշի հատուկ ջերմային հզորությունը:
Լաբորատոր կազմավորման նկարագրությունը
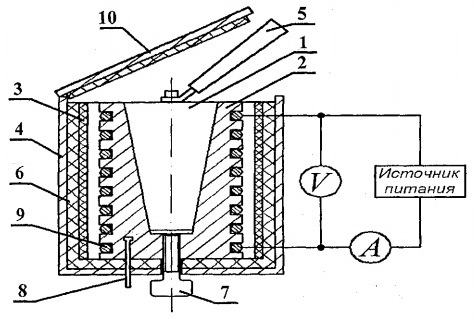
Պինդ մարմինների ջերմային հզորությունը որոշելու համար նախագծված է FPT1-8 փորձարարական կարգավորումը, որի ընդհանուր տեսքը ներկայացված է Նկ. 8.1. Տեղադրումը բաղկացած է երեք հիմնական մասից՝ գործիքային միավոր 1, գործառնական տարրի միավոր 2 և դարակ 3։
Կառավարման միավոր 1-ի առջևի վահանակի վրա կան՝ «ՑԱՆՑ» անջատիչ, որը միավորը միացնում է սնուցման լարման ցանցին. անջատիչ «HEATING», որը միացնում է ջեռուցիչը; «ՋԵՌՈՒՑՄԱՆ» կարգավորիչը, որի օգնությամբ կարգավորվում է ջեռուցիչի հզորությունը. վոլտմետր և ամպաչափ, որոնք չափում են լարումը և հոսանքը ջեռուցիչի միացումում; վայրկյանաչափ, որը չափում է կալորիմետրի տաքացման ժամանակը: Վայրկյանաչափն ակտիվանում է, երբ գործիքային միավորը միացված է:
Աշխատանքային տարրի 2-ի բլոկը առջևից փակված է օրգ-ից շարժական էկրանով։ ապակի. Աշխատանք կատարելիս էկրանը կախված է աշխատանքային տարրի բլոկի հետևի պատին։ Աշխատանքային տարրի վահանակի բլոկի վրա տեղադրված է թվային ջերմաչափ 6 ջերմաստիճանը չափելու համար: Ներքևում՝ բների մեջ, տեղադրված են տարբեր նյութերից պատրաստված 5 փորձանմուշներ և նմուշները տաքացուցիչի մեջ տեղադրելու բռնակ։
Ջեռուցիչը 4 բաղկացած է մետաղյա պատյանից, ջերմամեկուսիչ նյութից և կալորիմետրից:

Նմուշները տաքացվում են կալորիմետրով, որի սխեման ներկայացված է Նկ. 8.2.
Կալորիմետրը փողային պատյան է 2 կոնաձև անցքով, որտեղ տեղադրվում է փորձանմուշ 1։ Գործարանի արտաքին մակերեսին հատուկ ակոսներում տեղադրվում է ջեռուցման կծիկ 9։ Դրսում կալորիմետրի պատյանը ջերմամեկուսացված է ասբեստի շերտերով։ 3 և ապակե մանրաթել 6 և փակվում ալյումինե պատյանով 4. Կալորաչափը փակվում է ջերմամեկուսիչ ծածկով 10. Փորձի ավարտից հետո նմուշը կարելի է դուրս մղել կալորիմետրի մարմնի կոնաձև անցքից. պտուտակ 7. Ջեռուցված նմուշը կալորիմետրից հեռացնելու և նմուշը ջեռուցիչի մեջ տեղադրելու համար օգտագործվում է բռնակ 5, որը գտնվում է ուսումնասիրվող նմուշների կողքին գտնվող հատուկ վարդակից:
Կալորիմետրի ջերմաստիճանը չափվում է թվային ջերմաչափով, որի ջերմաստիճանի ցուցիչը 8-ը գտնվում է կալորիմետրի 2-րդ պատյանում:
Անվտանգություն
Աշխատանքներ կատարելիս պահպանվում են մեխանիկայի լաբորատորիայում անվտանգության ընդհանուր պահանջները։
Աշխատանքային կարգը
ՈՒՇԱԴՐՈՒԹՅՈՒՆ.Կալորիմետրը սառչելու համար երկար ժամանակ է պահանջում, ուստի բոլոր ժամանակային արժեքները չափելուց հետո 0 դատարկ կալորիմետրի տաքացում, անմիջապես անջատեք ջեռուցումը (տե՛ս ստորև 4-րդ կետը): Այս միավորի ջեռուցման առավելագույն ջերմաստիճանը +44С է:
1. Հեռացրեք տեղադրման աշխատանքային տարրի միավորի թափանցիկ կափարիչը և կախեք այն հետևի վահանակի պտուտակներից: Սահմանեք HEAT կառավարման կոճակը նվազագույնի: Միացրեք տեղադրումը «NETWORK» անջատիչով:
2. Կափարիչը ամուր փակեք դատարկ կալորիմետրի վրա: Միացրեք «HEAT» անջատիչը: Օգտագործելով HEAT կարգավորիչը, լարումը սահմանեք 10-20 Վ (որքան բարձր է լարումը, այնքան ավելի արագ է ջեռուցվում): Գրեք աղյուսակում. 8.1 ընտրված լարման արժեքներ Uև ընթացիկ Ի.
3. Սկսած կալորիմետրի ջերմաստիճանից տՈւսուցչի կողմից նշված 0, 1С ընդմիջումից հետո մուտքագրեք աղյուսակում: 8.1 ժամանակային արժեքներ 0, որը համապատասխանում է յուրաքանչյուր հասած ջերմաստիճանին տ.
4. Անջատեք «HEAT» անջատիչի անջատիչը, բացեք կափարիչը և սառեցրեք կալորիմետրը մինչև նախնական ջերմաստիճանը։ տ 0 . Կալորիմետրը արագ սառեցնելու համար դուք կարող եք նմուշներից մեկը իջեցնել կալորիմետրի մեջ, բացառությամբ ուսուցչի կողմից նշվածի (նմուշը կալորիմետրի մեջ տեղադրելիս, պտուտակը պտտեք կալորիմետրի ներքևի մասում դեպի ձախ): Ջերմաստիճանը կսկսի նվազել. Երբ սառեցման արագությունը նվազում է, հանեք տաքացված նմուշը և տեղադրեք հաջորդը (սառը), բացառությամբ ուսուցչի կողմից նշվածի: Նմուշը հանելու համար պտուտակը պտտեք կալորիմետրի ներքևի մասում դեպի աջ (ժամացույցի սլաքի ուղղությամբ), այնուհետև բռնակով դուրս քաշեք նմուշը:
Աղյուսակ 8.1
|
Տ= տ− տ 0 , |
= − 0 , |
J/(kgK) |
Գ մ =ՀետՄ, J/(մոլK) |
||||||||
5. Պտուտակը պտտելով դեպի ձախ, կալորիմետրի մեջ տեղադրեք ուսուցչի հրահանգով վերցված փորձանմուշներից մեկը: Սերտորեն փակեք կալորիմետրի կափարիչը և սպասեք 2-3 րոպե, մինչև կալորիմետրի և նմուշի ջերմաստիճանը հավասարվի:
6. Միացրեք «HEAT» անջատիչը և շղթայում սահմանեք նույն լարումը, ինչ դատարկ կալորիմետրը տաքացնելիս:
7. Սկսած նույն նախնական կալորիմետրի ջերմաստիճանից տ 0, 1С ընդմիջումից հետո մուտքագրեք աղյուսակում: 8.1 ժամանակային արժեքներ յուրաքանչյուր ձեռք բերված ջերմաստիճանին համապատասխան տ.
8. «HEATING» կարգավորիչը դրեք ծայրահեղ ձախ դիրքում (մինչև նվազագույնը), անջատեք «HEATING» անջատիչը, բացեք կալորիմետրի կափարիչը: Նմուշը կալորիմետրից հանելու համար պտուտակն աջ կողմ դարձրեք, ապա բռնակի միջոցով հանեք տաքացված նմուշը:
9. Անջատեք միավորը «NETWORK» անջատիչով:
10. Թարգմանեք մեծությունների բոլոր արժեքները 0 և արժեքների մեջ վայրկյաններով (առանց րոպեների) և մուտքագրեք դրանք աղյուսակում: 8.1. Աղյուսակի յուրաքանչյուր տողի համար: 8.1 հաշվարկել -ի արժեքները = − 0 և Տ= տ− տ 0 .
11. Կատարեք նմուշի տեսակարար ջերմային հզորության գնահատված հաշվարկ՝ օգտագործելով բանաձեւը 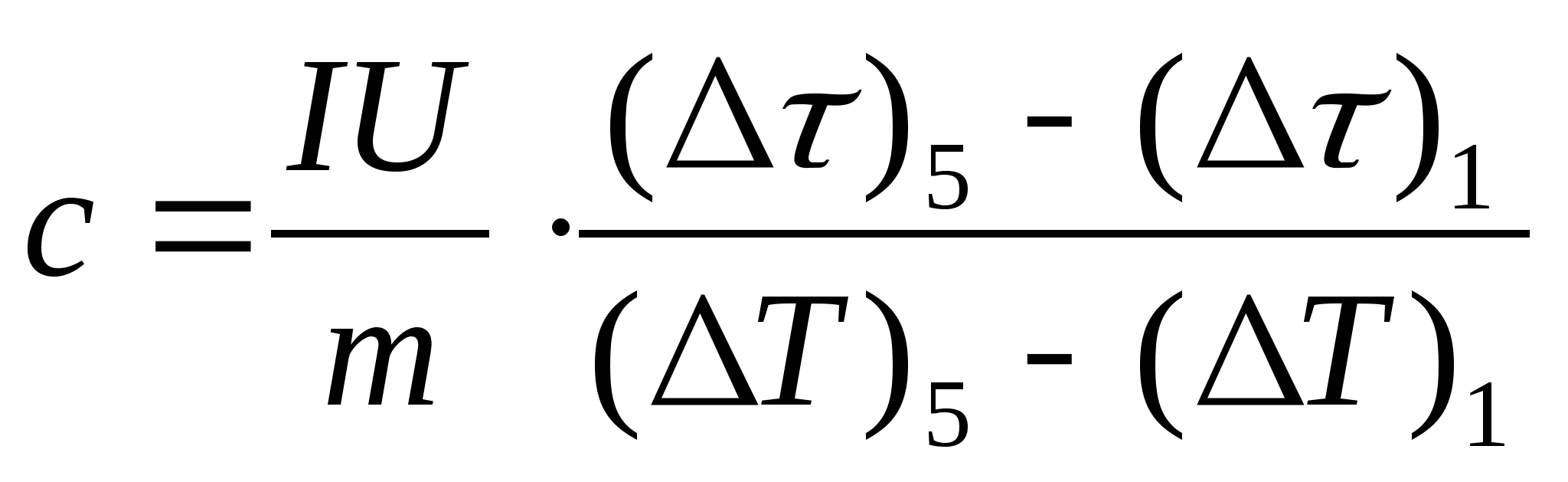 , որտեղ նմուշի զանգվածը մ=139,5 գ (արույր) կամ մ=129,7 գ (պողպատ) կամ
մ=46,05 գ (duralumin): Եկեք ուսուցչի մոտ ստուգման համար:
, որտեղ նմուշի զանգվածը մ=139,5 գ (արույր) կամ մ=129,7 գ (պողպատ) կամ
մ=46,05 գ (duralumin): Եկեք ուսուցչի մոտ ստուգման համար:
Չափումների արդյունքների մշակում
1. Հողամաս
= զ(Տ) նմուշի և դատարկ կալորիմետրի կալորիմետրի տաքացման ժամանակի տարբերության կախվածությունը կալորիմետրի ջերմաստիճանի փոփոխությունից, ընտրեք գրաֆիկի ցանկացած երկու կետ և որոշեք ուղիղ գծի թեքությունը՝ օգտագործելով բանաձևը. 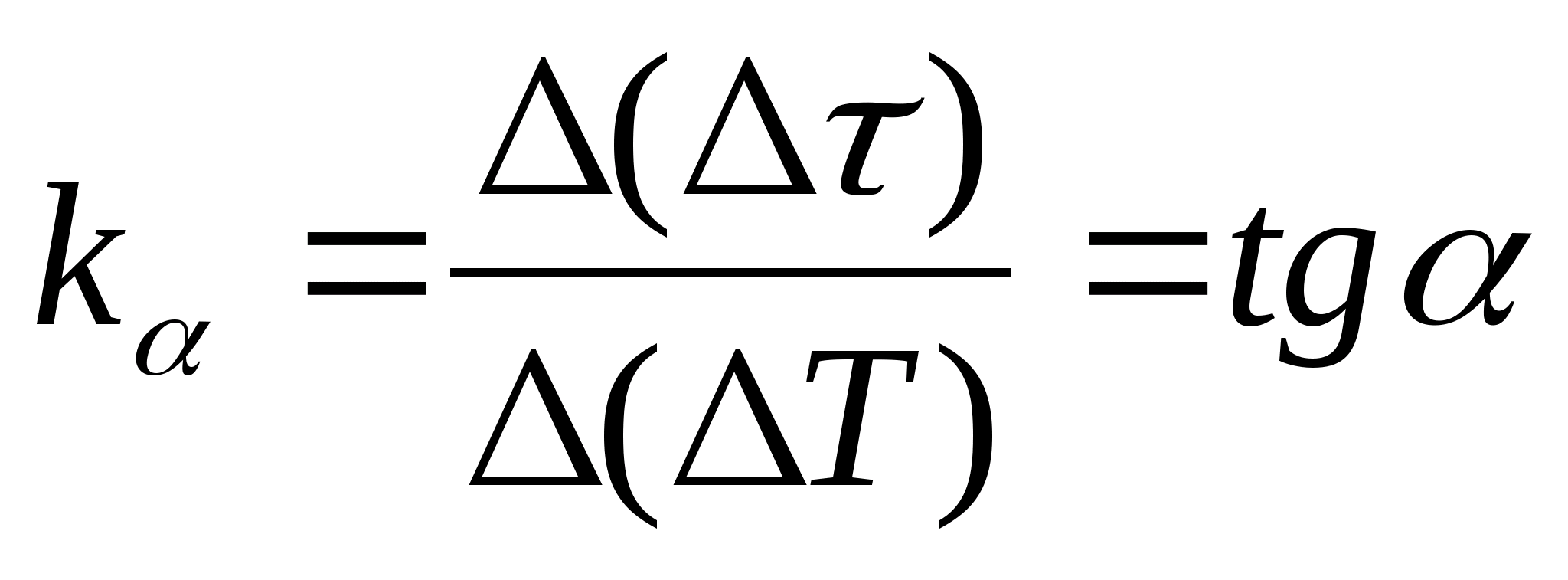 , որտեղ
− գրաֆիկի թեքության անկյունը առանցքի նկատմամբ Տ
(եթե -ի միավորները
և Տցուցադրվում են երկու առանցքների վրա որպես նույն երկարության հատվածներ):
, որտեղ
− գրաֆիկի թեքության անկյունը առանցքի նկատմամբ Տ
(եթե -ի միավորները
և Տցուցադրվում են երկու առանցքների վրա որպես նույն երկարության հատվածներ):
2. Օգտագործելով լանջի արժեքը կ
, որոշեք նմուշի հատուկ ջերմային հզորությունը՝ օգտագործելով բանաձեւը 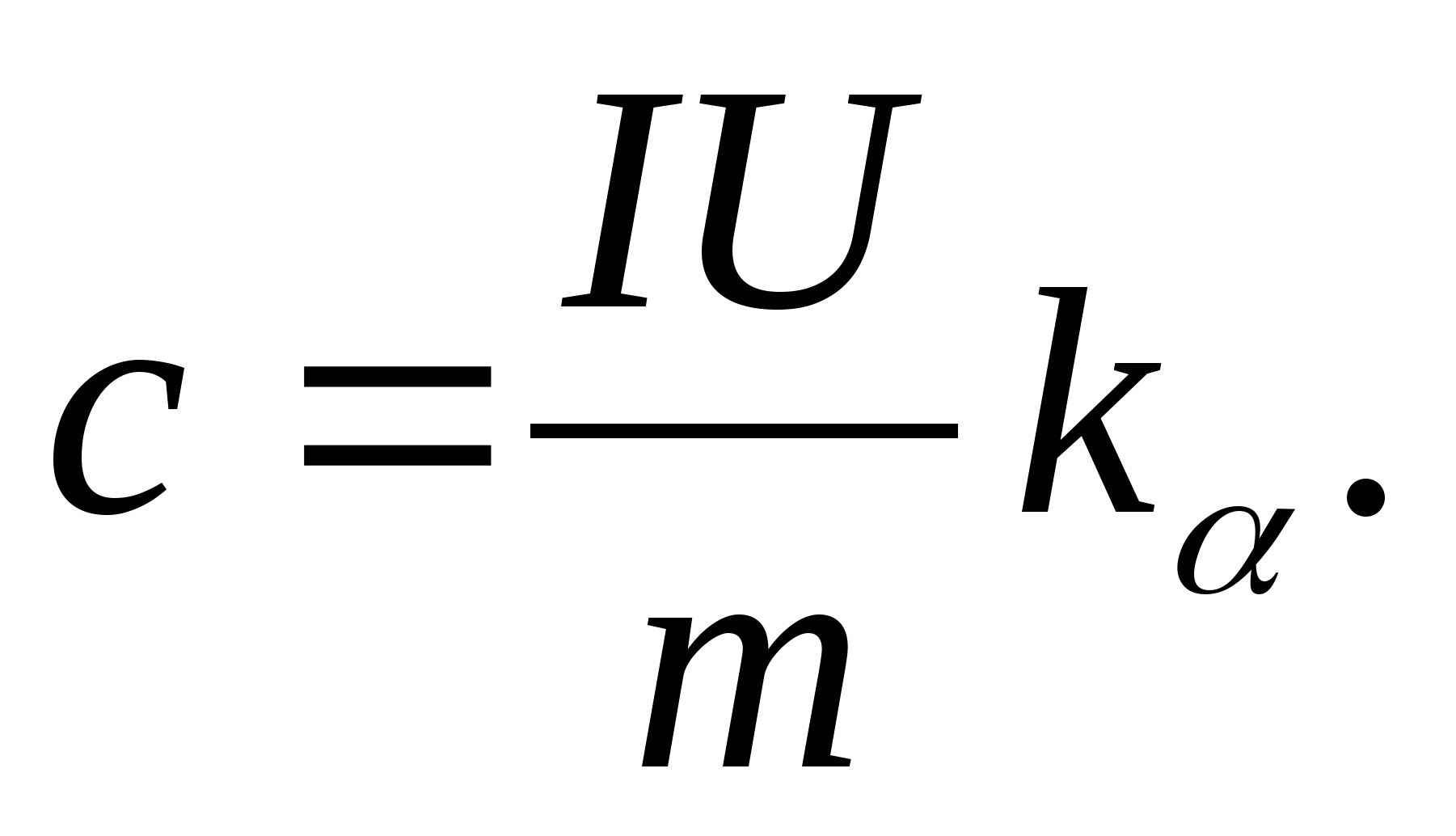
3. Օգտագործելով աղյուսակ 8.2-ի (կամ պարբերական աղյուսակի) տվյալները, որոշեք նմուշի մոլային ջերմային հզորությունը բանաձևով. Գ մ =ՀետՄ.
Աղյուսակ 8.2
|
Նմուշի նյութ |
Ատոմային զանգված, կգ/մոլ |
|
Որպես պինդ մարմնի մոդել՝ դիտարկենք ճիշտ կառուցված բյուրեղյա ցանցը, որի հանգույցներում որպես նյութական կետեր վերցված մասնիկները (ատոմներ, իոններ, մոլեկուլներ) տատանվում են իրենց հավասարակշռության դիրքերի շուրջ՝ վանդակավոր հանգույցներ՝ երեք փոխադարձ ուղղահայաց ուղղություններով։ . Այսպիսով, բյուրեղային ցանցը կազմող յուրաքանչյուր մասնիկի տրված է ազատության երեք թրթռումային աստիճան, որոնցից յուրաքանչյուրը, ըստ ազատության աստիճանների վրա էներգիայի հավասարաչափ բաժանման օրենքի (տես § 50), ունի էներգիա. կՏ.
Պինդ մարմնի խլուրդի ներքին էներգիան
U m \u003d 3N A kT \u003d 3RT,
որտեղ N A-ն Ավոգադրոյի հաստատունն է. ՆԱ կ= Ռ (Ռ մոլային գազի հաստատունն է):
Պինդ մարմնի մոլային ջերմունակությունը
այսինքն մոլային (ատոմային) ջերմային հզորություն քիմիապես պարզ մարմիններբյուրեղային վիճակում նույնն է (հավասար է 3 Ռ) և կախված չէ ջերմաստիճանից: Այս օրենքը էմպիրիկորեն ստացել են ֆրանսիացի գիտնականներ Պ. Դուլոնգը (1785-1838) և Լ. Պետիտը (1791-1820 թթ.) և կոչումԴուլոնգի և Փիթի օրենքը.
Եթե պինդ նյութը քիմիական միացություն է (օրինակ՝ NaCl), ապա մոլի մասնիկների թիվը հավասար չէ Ավոգադրոյի հաստատունին, այլ հավասար է. nNԱ , որտեղ n - մոլեկուլում ատոմների թիվը (NaCl-ի համար մոլում մասնիկների թիվը 2 է Նև, հետևաբար, NaCl-ի մեկ մոլը պարունակում է N A Na ատոմներ և N A Cl ատոմներ): Այսպիսով, մոլային ջերմային հզորությունը պինդ քիմիական միացություններ
C V \u003d 3R25n J / (մոլ K),
այսինքն՝ հավասար է այս միացությունը կազմող տարրերի ատոմային ջերմային հզորությունների գումարին։
Ինչպես ցույց են տալիս փորձարարական տվյալները (Աղյուսակ 4), շատ նյութերի համար Դուլոնգի և Պիտի օրենքը բավարարվում է բավականին լավ մոտավորությամբ, չնայած որոշ նյութեր (C, Be, B) ունեն զգալի շեղումներ հաշվարկված ջերմային հզորություններից: Բացի այդ, ինչպես գազերի դեպքում (տես § 53), ցածր ջերմաստիճաններում պինդ մարմինների ջերմային հզորությունը չափելու փորձերը ցույց են տվել, որ այն կախված է ջերմաստիճանից (նկ. 113): Մոտ զրոյական Կելվինի, մարմինների ջերմունակությունը համաչափ է T 3-ին, և միայն բավարար բարձր ջերմաստիճանի դեպքում, որը բնորոշ է յուրաքանչյուր նյութին, պայմանը (73.1) բավարարված է։ Ադամանդը, օրինակ, ունի 3 ջերմային հզորություն Ռ ժամը 1800 K! Այնուամենայնիվ, պինդ նյութերի մեծ մասի համար սենյակային ջերմաստիճանն արդեն բավական բարձր է:
Հաշվարկված ջերմային հզորությունների փորձարարական և տեսական արժեքների միջև անհամապատասխանությունը
Դասական տեսության հիմքը, բացատրվել է ջերմային հզորությունների քվանտային տեսության հիման վրա, Ա. Էյնշտեյնը և Պ. Դեբին (1884-1966):
§ 74. Գոլորշիացում, սուբլիմացիա, հալում և բյուրեղացում. Ամորֆ մարմիններ
Ե՛վ հեղուկներում, և՛ պինդ մարմիններում միշտ կա որոշակի քանակությամբ մոլեկուլներ, որոնց էներգիան բավարար է այլ մոլեկուլների նկատմամբ գրավչությունը հաղթահարելու համար և որոնք ի վիճակի են պոկվել հեղուկի կամ պինդի մակերեսից և անցնել նրանց շրջապատող տարածություն: Հեղուկի այս գործընթացը կոչվում է գոլորշիացում(կամ գոլորշիացում),պինդ մարմինների համար - սուբլիմացիա(կամ սուբլիմացիա):
Հեղուկների գոլորշիացումը տեղի է ունենում ցանկացած ջերմաստիճանում, սակայն դրա ինտենսիվությունը մեծանում է ջերմաստիճանի բարձրացման հետ: Գոլորշիացման գործընթացին զուգահեռ տեղի է ունենում փոխհատուցման գործընթաց խտացումգոլորշի հեղուկ. Եթե մոլեկուլների թիվը մեկ միավորի ընթացքում հեղուկը թողնում է միավոր մակերեսի միջով հավասար է գոլորշիից հեղուկ անցնող մոլեկուլների թվին, ապա. դինամիկ հավասարակշռությունգոլորշիացման և խտացման գործընթացների միջև: Իր հեղուկի հետ հավասարակշռության մեջ գտնվող գոլորշին կոչվում է հարուստ(տե՛ս նաև § 62):
Պինդ մարմինների մեծ մասի համար սովորական ջերմաստիճանում սուբլիմացիայի գործընթացը աննշան է, իսկ գոլորշիների ճնշումը պինդ նյութի մակերեսի վրա ցածր է. այն մեծանում է ջերմաստիճանի բարձրացման հետ: Ինտենսիվորեն սուբլիմացնում է այնպիսի նյութեր, ինչպիսիք են նաֆթալինը, կամֆորան, որը հայտնաբերվում է սուր, բնորոշ հոտով: Սուբլիմացիան հատկապես ինտենսիվ է տեղի ունենում վակուումում. սա օգտագործվում է հայելիներ պատրաստելու համար: Սուբլիմացիայի հայտնի օրինակ է սառույցի վերածումը գոլորշու՝ թաց լվացքը չորանում է ցրտին:
Եթե պինդ մարմինը տաքացվում է, ապա այն ներքին էներգիա(վանդակավոր տեղամասերում մասնիկների թրթռումների էներգիայի և այդ մասնիկների փոխազդեցության էներգիայի գումարը) մեծանում է։ Երբ ջերմաստիճանը բարձրանում է, մասնիկների տատանումների ամպլիտուդը
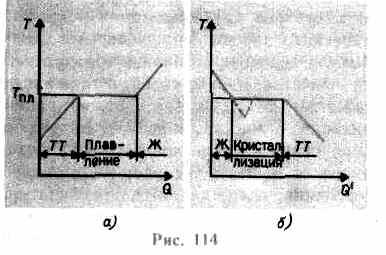
ավելանում է այնքան ժամանակ, մինչև բյուրեղյա վանդակը փլուզվի - պինդը հալվում է: Նկ. 114 ացուցադրվում է մոտավոր կախվածություն Տ(Ք), որտեղ Ք- հալման ընթացքում մարմնի կողմից ստացված ջերմության քանակը. Որպես հաղորդագրություն պինդին ջերմ մարմիննրա ջերմաստիճանը բարձրանում է, իսկ հալման կետում Տ pl սկսում է մարմնի անցումը պինդ վիճակից հեղուկ վիճակի: Ջերմաստիճանը Տ pl մնում է անփոփոխ, մինչև ամբողջ բյուրեղը հալվի, և միայն դրանից հետո հեղուկի ջերմաստիճանը նորից սկսում է բարձրանալ:
Տաքացնելով պինդ մինչև Տ pl այն դեռ չի փոխակերպում հեղուկ վիճակի, քանի որ նյութի մասնիկների էներգիան պետք է բավարար լինի բյուրեղային ցանցը ոչնչացնելու համար։ Հալման գործընթացում նյութին հաղորդվող ջերմությունն օգտագործվում է բյուրեղային ցանցի քայքայման աշխատանքներ կատարելու համար, և, հետևաբար, T pl =const մինչև ամբողջ բյուրեղը հալվի: Այնուհետև մատակարարվող ջերմությունը նորից կբարձրանա հեղուկի մասնիկների էներգիան, և դրա ջերմաստիճանը կսկսի բարձրանալ: 1 կգ նյութը հալեցնելու համար պահանջվող ջերմության քանակը կոչվում է միաձուլման հատուկ ջերմություն.
Եթե հեղուկը սառչում է, ապա գործընթացը ընթանում է հակառակ ուղղությամբ (նկ. 114, բ; Ք" - բյուրեղացման ընթացքում մարմնի կողմից արտանետվող ջերմության քանակը. նախ հեղուկի ջերմաստիճանը նվազում է, այնուհետև սկսվում է T pl-ին հավասար հաստատուն ջերմաստիճանում. բյուրեղացում,դրա ավարտից հետո բյուրեղի ջերմաստիճանը սկսում է նվազել: Նյութի բյուրեղացման համար առկա է այսպես կոչված բյուրեղացման կենտրոններ -բյուրեղային միջուկներ, որոնք կարող են լինել ոչ միայն գոյացած նյութի բյուրեղները, այլև կեղտերը, ինչպես նաև փոշին, մուրը և այլն: Մաքուր հեղուկում բյուրեղացման կենտրոնների բացակայությունը դժվարացնում է մանրադիտակային բյուրեղների ձևավորումը, իսկ նյութը, մնալով հեղուկ վիճակում՝ սառչում է մինչև բյուրեղացման ջերմաստիճանից ցածր ջերմաստիճան՝ այդպիսով առաջանալով գերսառեցված հեղուկ(114-ի վրա բ համապատասխանում է գծավոր կորին)։ Ուժեղ գերսառեցմամբ սկսվում է բյուրեղացման կենտրոնների ինքնաբուխ ձևավորումը, և նյութը բավականին արագ բյուրեղանում է:
Սովորաբար հալվածքի գերսառեցումը տեղի է ունենում ֆրակցիաներից մինչև տասնյակ աստիճաններ, սակայն մի շարք նյութերի դեպքում այն կարող է հասնել հարյուրավոր աստիճանների։ Բարձր մածուցիկության պատճառով բարձր գերսառեցված հեղուկները կորցնում են իրենց հեղուկությունը՝ պահպանելով իրենց ձևը, ինչպես պինդ մարմինները։ Այս մարմինները կոչվում են ամորֆ պինդ նյութեր;դրանք ներառում են խեժեր, մոմ, կնքման մոմ, ապակի: Ամորֆ մարմինները՝ լինելով գերսառեցված հեղուկներ, իզոտրոպ,այսինքն, նրանց հատկությունները նույնն են բոլոր ուղղություններով. նրանց, ինչպես նաև հեղուկների համար հատկանշական է կարճ միջակայքի պատվերմասնիկների դասավորության մեջ; դրանցում, ի տարբերություն հեղուկների, մասնիկների շարժունակությունը բավականին փոքր է։ Ամորֆ մարմինների առանձնահատկությունն այն է, որ նրանք չունեն հատուկ հալման կետ, այսինքն՝ անհնար է նշել կոնկրետ ջերմաստիճան, որից բարձր հեղուկ վիճակ կարելի է պարզել, իսկ պինդ վիճակից ցածր։ Փորձից հայտնի է, որ ամորֆ մարմիններում բյուրեղացման պրոցեսը կարելի է դիտարկել ժամանակի ընթացքում, օրինակ՝ բյուրեղները հայտնվում են ապակու մեջ; այն, կորցնելով թափանցիկությունը, սկսում է պղտորվել և վերածվել բազմաբյուրեղ մարմնի։
Վերջերս լայն տարածում գտավ ազգային տնտեսությունստացել է պոլիմերներ- օրգանական ամորֆ մարմիններ, որոնց մոլեկուլները բաղկացած են մեծ թվով միանման երկար մոլեկուլային շղթաներից՝ կապված քիմիական (վալենտային) կապերով։ Պոլիմերները ներառում են ինչպես բնական (օսլա, սպիտակուց, կաուչուկ, մանրաթել և այլն), այնպես էլ արհեստական (պլաստմասսա, ռետինե, պոլիստիրոլ, լավսան, նեյլոն և այլն) օրգանական նյութեր։ Պոլիմերները բնորոշ ուժ և առաձգականություն են. որոշ պոլիմերներ դիմանում են իրենց սկզբնական երկարության 5-10 անգամ ձգվելուն: Սա բացատրվում է նրանով, որ երկար մոլեկուլային շղթաները կարող են դեֆորմացիայի դեպքում կամ ծալվել խիտ գնդիկների կամ ձգվել ուղիղ գծերի: Պոլիմերների առաձգականությունը դրսևորվում է միայն որոշակի ջերմաստիճանի տիրույթում, որից ցածր դրանք դառնում են կոշտ և փխրուն, իսկ վերևում՝ պլաստիկ։ Թեև ստեղծվել են բազմաթիվ սինթետիկ պոլիմերային նյութեր (արհեստական մանրաթելեր, կաշվի փոխարինիչներ, շինանյութեր, մետաղների փոխարինիչներ և այլն), պոլիմերների տեսությունը դեռևս լիովին զարգացած չէ։ Դրա զարգացումը պայմանավորված է ժամանակակից տեխնոլոգիայի պահանջներով, որը պահանջում է նախապես որոշված հատկություններով պոլիմերների սինթեզ։
Նյութի հատուկ ջերմային հզորությունը հասկացվում է որպես արժեք
, (1)
որտեղ է մարմնին փոխանցվող ջերմության քանակը:
ջերմաստիճանի փոփոխությունն է, որը տեղի է ունենում
մարմնին ջերմության փոխանցման արդյունքում,
m-ը տաքացած մարմնի զանգվածն է։
Փորձը սովորաբար որոշում է միջինը հատուկ ջերմություն c նյութը, թվայինորեն հավասար է ջերմության քանակին, որը պետք է հաղորդվի այս նյութի միավոր զանգվածին՝ նրա ջերմաստիճանը բարձրացնելու համար՝
(2),
որտեղ է տարբերությունը ուսումնասիրվող մարմնի վերջնական և սկզբնական ջերմաստիճանների միջև:
Ջերմային հզորությունը փորձնականորեն որոշելու համար օգտագործվում են տարբեր կալորիմետրիկ մեթոդներ: Այս մեթոդների բազմազանությունը պայմանավորված է նրանով, որ մարմնին փոխանցվող ջերմության քանակի ճշգրիտ չափումը պահանջում է ջերմության կորուստների վերացում, որոնք հաշվի չեն առնվում ուսումնասիրվող մարմինը տաքացնելիս:
Սովորաբար, այսպես կոչված, իզոթերմային թաղանթով կալորիմետրերում ներդրվում է ճառագայթման հաշվարկված կամ փորձարարականորեն որոշված ուղղում, այսինքն՝ այն ջերմության քանակությունը, որը կալորիմետրը ստանում կամ տալիս է արտաքին միջավայրին ճառագայթման միջոցով փորձի ընթացքում:
Այնուամենայնիվ, հնարավոր է զգալիորեն նվազեցնել ջերմային կորուստները՝ ներմուծելով լավ ջերմամեկուսացում կամ նվազեցնելով փորձի տևողությունը, ինչը ձեռք է բերվում նմուշի տաքացման բարձր արագությամբ ~ (ջերմային հզորության չափման իմպուլսային մեթոդ), որի դեպքում ջերմային կորուստները կլինեն. լինի փոքր՝ մատակարարվող ջերմության ընդհանուր քանակի համեմատ:
Ջերմային հզորության որոշման առավել ճշգրիտ մեթոդներից մեկը ադիաբատիկ կալորիմետրի մեթոդն է: Այս տեսակի կալորիմետրերում ջերմային կորուստները հաշվի առնելու անհրաժեշտության հետ կապված դժվարությունները վերացվում են նրանով, որ չափումները կատարվում են ջերմային հավասարակշռության պայմաններում, այսինքն՝ ուսումնասիրվող նմուշի և նմուշը շրջապատող բլոկի հավասար ջերմաստիճանների պայմաններում։ . Այս մեթոդի առավելությունները, բարձր ճշգրտության հետ մեկտեղ, ներառում են նաև պինդ մարմինների ջերմային հզորությունը ջերմաստիճանի լայն տիրույթում որոշելու հնարավորությունը, ինչը հատկապես կարևոր է, եթե նյութերը ենթարկվում են փուլային փոխակերպումների:
Ադիաբատիկ կալորիմետրի տեսակներից մեկի սարքը սխեմատիկորեն ներկայացված է նկարում: Փորձանմուշ 1-ը տեղադրվում է պղնձե բլոկում 3 և դրա հետ միասին տաքացվում է վառարանում 4: Տաքացուցիչ 2-ը ներմուծվում է նմուշի ներսում, որը թույլ է տալիս լրացուցիչ տաքացնել նմուշը:
Վառարան 4-ը միացնելուց հետո, որի մեջ տեղադրվում է նմուշով բլոկը, նմուշի ջերմաստիճանը սկսում է բարձրանալ՝ մնալով բլոկի ջերմաստիճանից ցածր։ Նմուշի և բլոկի ջերմաստիճանների միջև հավասարություն հաստատելու համար միացրեք նմուշի ներսում տեղադրված ջեռուցիչը: Երբ նմուշի ջերմաստիճանը փոքր-ինչ բարձր է բլոկի ջերմաստիճանից, ներքին ջեռուցիչը անջատված է:
Հետագայում այս ջեռուցիչը պարբերաբար միացվում և անջատվում է, որպեսզի նմուշի և բլոկի միջև ջերմաստիճանի տարբերությունը անընդհատ փոխի նշանը:
Այն պահին, երբ այն հավասար է զրոյի (երբ ներքին ջեռուցիչը միացված է), նմուշի և բլոկի միջև ջերմափոխանակություն չկա, և ներքին ջեռուցիչի կողմից թողարկված ջերմության ամբողջ քանակությունը ծախսվում է միայն նմուշը տաքացնելու վրա. հատուկ ջերմություն այս դեպքում կարող է որոշվել բանաձևով (2):
Ներքին ջեռուցիչի կողմից թողարկվող ջերմության քանակը որոշվում է բանաձևով.
որտեղ ես ներքին ջեռուցիչի հոսանքն է.
V-ը դրա վրայով լարման անկումն է.
- ժամանակային միջակայքը, որի ընթացքում ջերմաստիճանը բարձրացել է .
Հետո
(4)
որտեղ է այն ժամանակը, որի ընթացքում նմուշի ջերմաստիճանը փոխվել է .
Դիֆերենցիալ ձևով բանաձևը (4) ունի ձև
(5)
Նմուշի ջերմաստիճանը չափվում է T ջերմազույգով: Բլոկի և նմուշի ջերմաստիճանի տարբերությունը չափվում է դիֆերենցիալ ջերմազույգով: Նմուշի ջերմաստիճանը որոշելու համար օգտագործվում է ջերմազույգի տրամաչափման կորը T: Բլոկի և նմուշի ջերմաստիճանի տարբերությունը որոշվում է գալվանոմետրի սանդղակի բաժանումներով (քանի որ անհրաժեշտ է ամրագրել միայն այն պահը, երբ բլոկի և բլոկի միջև ջերմաստիճանի տարբերությունը նմուշի փոփոխության նշան):
Աշխատանքի ավարտը.
Նմուշը դրվում է պղնձե բլոկի ներսում տեղադրված ջեռուցիչի վրա։ Ջերմազույգը միացնում է T և միացված է նմուշին և բլոկին: Ջեռոցը փակվում է կափարիչով։ Վառարանի էլեկտրական ոլորուն, որի մեջ տեղադրված է բլոկը, միացված է: Նմուշի ներսում տեղադրված ջեռուցիչը պարբերաբար միացվում և անջատվում է, իսկ I և V-ի արժեքները գրանցվում են ներքին տաքացուցիչի շղթայում:
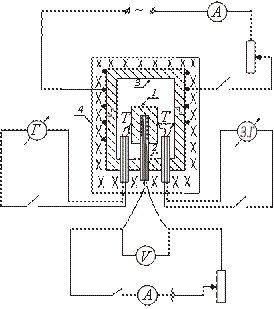
Նախքան չափումները սկսելը, անհրաժեշտ է ստուգել հայելային գալվանոմետրի զրոյական դիրքը: Դա անելու համար, անջատելով ջերմազույգը գալվանոմետրից, նրանք ակնկալում են, որ նապաստակը կդադարի տատանվել սանդղակի երկայնքով: Եթե սրանից հետո թելի պատկերը չի համընկնում զրոյի հետ, ապա սանդղակը տեղափոխելով այս համընկնումն է ստացվում։
Գծագրված են T-ի և ժամանակի կախվածության կորերը:
T(t) կորի թեքությունից այն կետում, որտեղ այն փոխում է նշանը (այսինքն, երբ հաստատվում է ջերմային հավասարակշռություն), հատուկ ջերմությունը հաշվարկվում է բանաձևով (5): Այս ջերմային հզորությունը վերաբերում է T(t) կորից ընթերցվող ջերմաստիճանին այն պահին, երբ բլոկի և նմուշի միջև ջերմաստիճանի տարբերությունը փոխում է նշանը:
