Իդեալական գազ։ Իդեալական գազերի մոլեկուլային-կինետիկ տեսություն
Մոլեկուլային կինետիկ տեսությունը նկարագրում է հատուկ իդեալական օբյեկտի վարքը և հատկությունները, որը կոչվում է իդեալական գազ. Այս ֆիզիկական մոդելը հիմնված է նյութի մոլեկուլային կառուցվածքի վրա։ Մոլեկուլային տեսության ստեղծումը կապված է Ռ.Կլաուզիուսի, Ջ.Մաքսվելի, Դ.Ջուլի և Լ.Բոլցմանի աշխատությունների հետ։
Իդեալական գազ. Իդեալական գազի մոլեկուլային-կինետիկ տեսություն կառուցված է հետևյալ ենթադրությունների վրա.
ատոմները և մոլեկուլները կարող են դիտվել որպես նյութական կետեր, որոնք գտնվում են շարունակական շարժման մեջ;
գազի մոլեկուլների ներքին ծավալը աննշան է նավի ծավալի համեմատ.
բոլոր ատոմներն ու մոլեկուլները տարբերվում են, այսինքն՝ սկզբունքորեն հնարավոր է հետևել յուրաքանչյուր մասնիկի շարժմանը.
Մինչև դրանց միջև գազի մոլեկուլների բախումը, փոխազդեցության ուժեր չկան, և մոլեկուլների բախումները իրենց միջև և նավի պատերի հետ ենթադրվում են բացարձակ առաձգական.
Գազի յուրաքանչյուր ատոմի կամ մոլեկուլի շարժումը նկարագրվում է դասական մեխանիկայի օրենքներով։
Իդեալական գազի համար ստացված օրենքները կարող են օգտագործվել իրական գազերի ուսումնասիրության ժամանակ։ Դրա համար ստեղծվում են իդեալական գազի փորձարարական մոդելներ, որոնցում իրական գազի հատկությունները մոտ են իդեալական գազի հատկություններին (օրինակ՝ ցածր ճնշման և բարձր ջերմաստիճանի դեպքում)։
Իդեալական գազի օրենքները
Բոյլ-Մարիոտի օրենքը:
հաստատուն ջերմաստիճանում գազի տվյալ զանգվածի համար գազի ճնշման և դրա ծավալի արտադրյալը հաստատուն արժեք է. pV = կոնստ , (1.1)
ժամը Տ = հաստատ , m = կոնստ .
Քոր, որը ցույց է տալիս մեծությունների միջև կապը Ռև Վ, բնութագրում է նյութի հատկությունները հաստատուն ջերմաստիճանում և կոչվում է իզոթերմ սա հիպերբոլա է (նկ. 1.1.), և հաստատուն ջերմաստիճանում ընթացող պրոցեսը կոչվում է իզոթերմ։
Գեյ-Լյուսակի օրենքները:
Գազի տվյալ զանգվածի ծավալը մշտական ճնշման տակ տատանվում է գծային՝ կախված ջերմաստիճանից
V = V 0 (1 + տ ) ժամը P = կոնստ , m = կոնստ . (1.2)

էջ = էջ 0 (1 + տ ) ժամը V = կոնստ , m = կոնստ . (1.3)
(1.2) և (1.3) հավասարումներում ջերմաստիճանն արտահայտվում է Ցելսիուսի սանդղակով, ճնշումը և ծավալը՝ ժամը
0 С, մինչդեռ
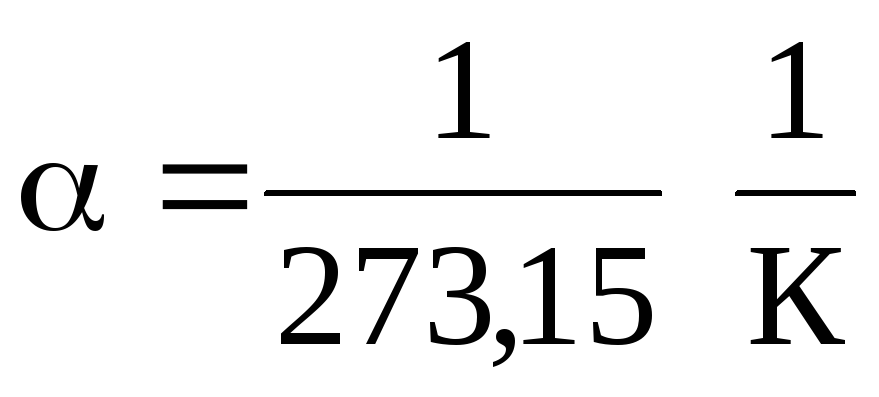 .
.
Գործընթացը, որը տեղի է ունենում մշտական ճնշման տակ, կոչվում է իզոբարիկ, այն կարող է ներկայացվել որպես գծային ֆունկցիա (նկ. 1.2.):
Գործընթացը, որը տեղի է ունենում մշտական ծավալով, կոչվում է իզոխորիկ(նկ. 1.3.):
(1.2) և (1.3) հավասարումներից հետևում է, որ իզոբարներն ու իզոխորները հատում են ջերմաստիճանի առանցքը կետում։ t =1/ \u003d - 273,15 С . Եթե սկզբնաղբյուրը տեղափոխենք այս կետ, ապա կանցնենք Քելվինի սանդղակի:
Ներկայացնելով (1.2) և (1.3) բանաձևերը. թերմոդինամիկ ջերմաստիճանը, Gay-Lussac-ի օրենքներին կարելի է ավելի հարմար ձև տալ.
Վ = Վ 0 (1+տ) = = Վ 0 = =Վ 0 Տ;
էջ = էջ 0 (1+տ) = էջ 0 = էջ 0 Տ;
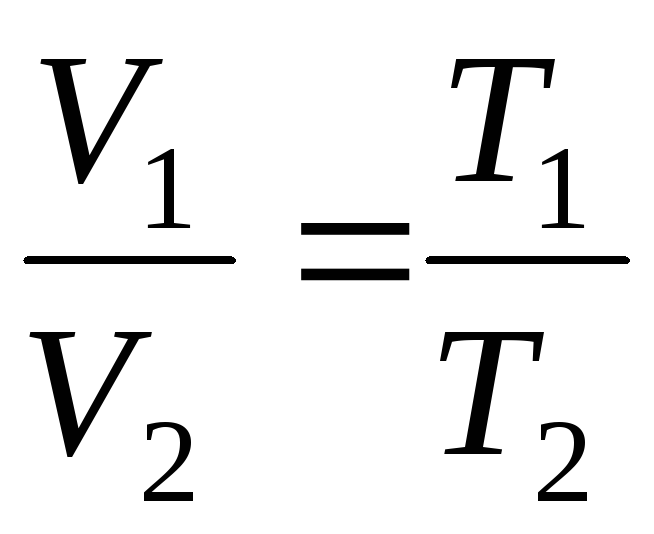 ժամը
p=const, m=const
;
(1.4)
ժամը
p=const, m=const
;
(1.4)
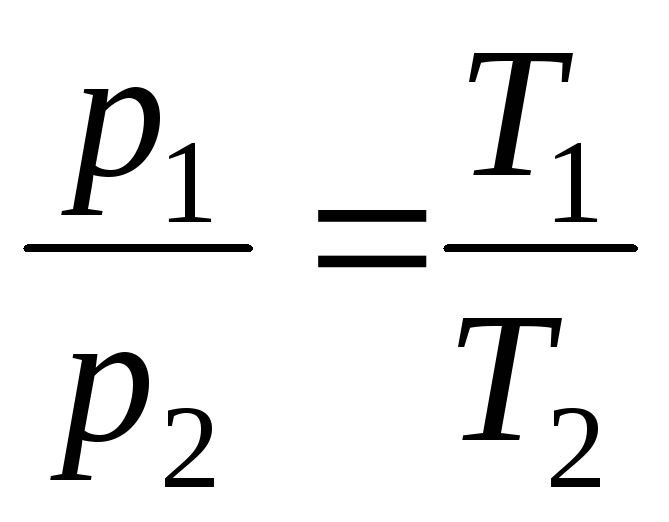 ժամը V = const, m = const
,
(1.5)
ժամը V = const, m = const
,
(1.5)
որտեղ 1 և 2 ինդեքսները վերաբերում են կամայական վիճակներին, որոնք գտնվում են նույն իզոբարի կամ իզոխորի վրա .
Ավոգադրոյի օրենքը:
Ցանկացած գազերի մոլերը նույն ջերմաստիճաններում և ճնշումներում զբաղեցնում են նույն ծավալները:
Նորմալ պայմաններում այս ծավալը հավասար է Վ,0 \u003d 22,4110 -3 մ 3 / մոլ . Ըստ սահմանման՝ մեկ խլուրդում տարբեր նյութերպարունակում է նույն թվով մոլեկուլներ՝ հավասար մշտական Ավոգադրո:Ն Ա = 6,02210 23 մոլ -1 .
Դալթոնի օրենքը:
խառնուրդի ճնշում իդեալական գազերհավասար է մասնակի ճնշումների գումարին Ռ 1 , Ռ 2 , Ռ 3 … Ռ n, դրանում ընդգրկված գազերը.
p = p 1 + էջ 2 + Ռ 3 + …+ էջ n .
Մասնակի ճնշում – սա ճնշումը, որը կստեղծեր բաղադրության մեջ գտնվող գազը գազի խառնուրդեթե նա միայնակ զբաղեցրեց միևնույն ջերմաստիճանում խառնուրդի ծավալին հավասար ծավալ։
Իդեալական գազի վիճակի հավասարումը
(Կլապեյրոն-Մենդելեևի հավասարում)
Ջերմաստիճանի, ծավալի և ճնշման միջև որոշակի կապ կա: Այս հարաբերությունը կարող է ներկայացվել ֆունկցիոնալ կախվածությամբ.
f(p, V, T)= 0.
Իր հերթին, փոփոխականներից յուրաքանչյուրը ( p, v, t) երկու այլ փոփոխականների ֆունկցիա է։ Նյութի յուրաքանչյուր փուլային վիճակի (պինդ, հեղուկ, գազային) ֆունկցիոնալ կախվածության տեսակը հայտնաբերվում է փորձարարական եղանակով։ Սա շատ աշխատատար գործընթաց է, և վիճակի հավասարումը հաստատվել է միայն հազվագյուտ վիճակում գտնվող գազերի համար, իսկ որոշ սեղմված գազերի մոտավոր ձևով: Այն նյութերի համար, որոնք գազային վիճակում չեն, այս խնդիրը դեռ չի լուծվել։
Ֆրանսիացի ֆիզիկոս Բ.Կլապեյրոնը բերեց վիճակի իդեալական գազի հավասարումը, համատեղելով Բոյլ-Մարիոտտի, Գեյ-Լյուսակի, Չարլզի օրենքները.
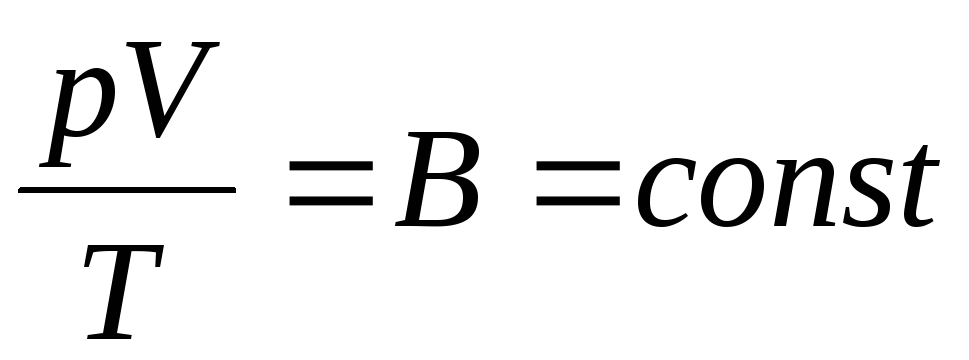 . (1.6)
. (1.6)
Արտահայտությունը (1.6) Կլապեյրոնի հավասարումն է, որտեղ ATգազի հաստատունն է։ Տարբեր գազերի համար տարբեր է։
Դ.Ի. Մենդելեևը միավորեց Կլապեյրոնի հավասարումը Ավոգադրոյի օրենքի հետ՝ հղում անելով (1.6) հավասարմանը մեկ մոլի և օգտագործելով մոլային ծավալը։ Վ . Ավոգադրոյի օրենքի համաձայն՝ նույնի համար Ռև Տբոլոր գազերի մոլերը զբաղեցնում են նույն մոլային ծավալը Վ .
.
Հետեւաբար, մշտական ATնույնը կլինի բոլոր իդեալական գազերի համար: Այս հաստատունը սովորաբար նշվում է Ռև հավասար է Ռ=
8,31
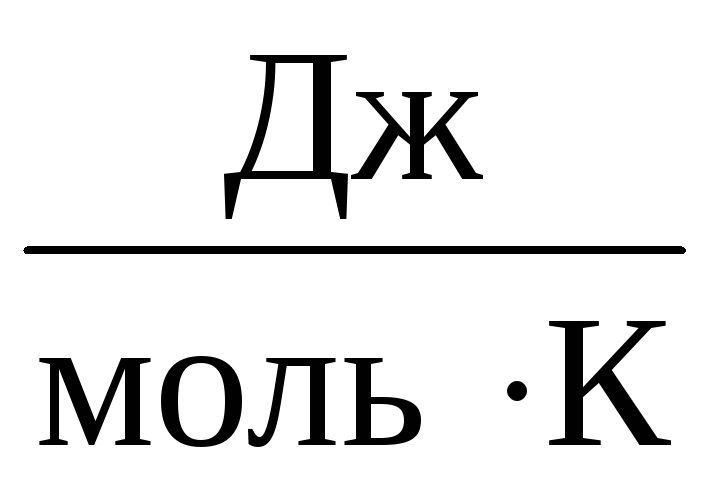 .
.
Կլապեյրոն-Մենդելեև հավասարումը ունի հետևյալ ձևը.
էջ Վ . = Ռ Տ.
Մեկ մոլ գազի համար (1.7) հավասարումից կարելի է գնալ Կլապեյրոն-Մենդելեևի հավասարմանը գազի կամայական զանգվածի համար:
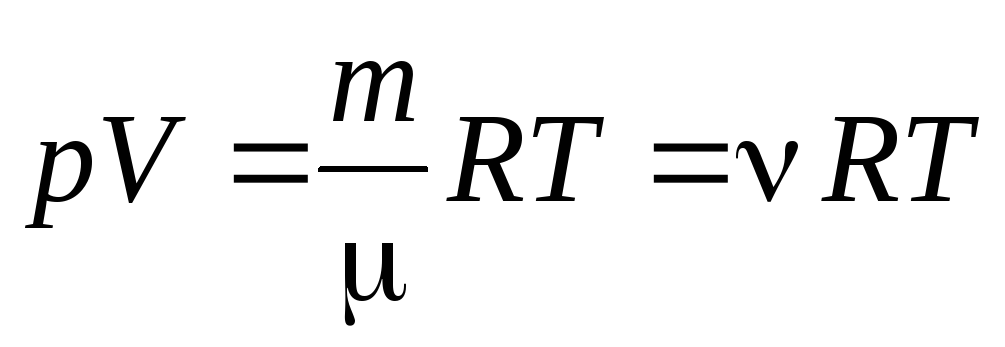 , (1.7)
, (1.7)
որտեղ
–
մոլային զանգված
(նյութի մեկ մոլի զանգված, կգ/մոլ); մ
գազի զանգված;
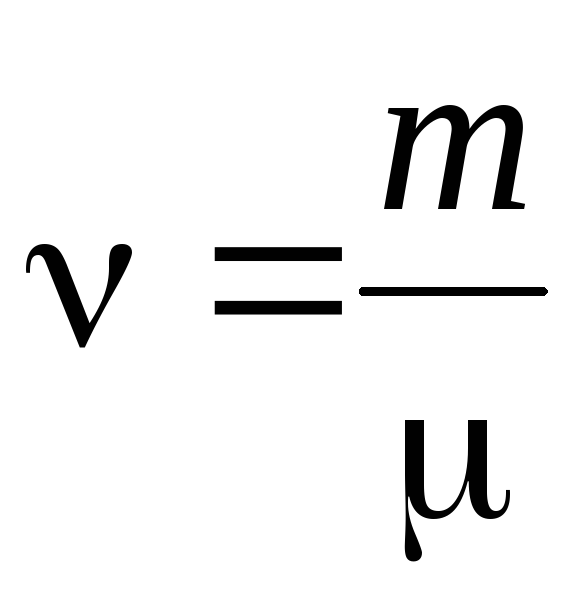 - նյութի քանակությունը .
- նյութի քանակությունը .
Ավելի հաճախ օգտագործվում է վիճակի իդեալական գազի հավասարման մեկ այլ ձև՝ ներկայացնելով Բոլցմանի հաստատունը: 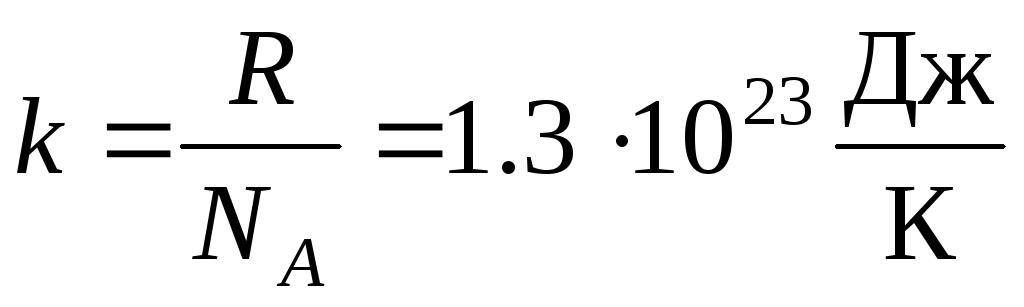 .
.
Այնուհետև հավասարումը (1.7) ունի հետևյալ տեսքը.
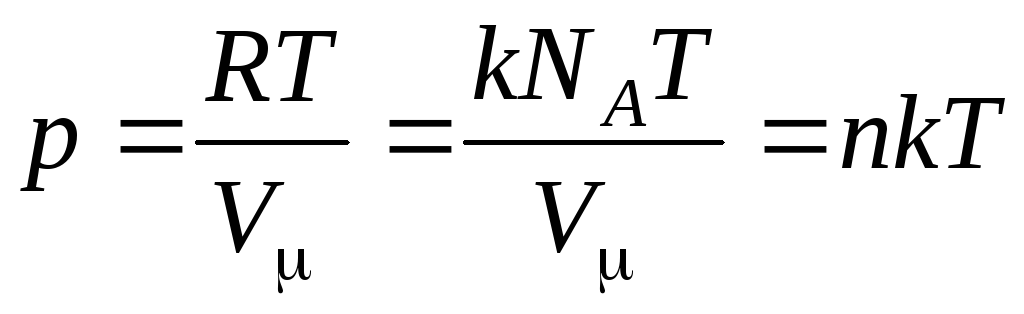 ,
(1.8)
,
(1.8)
որտեղ
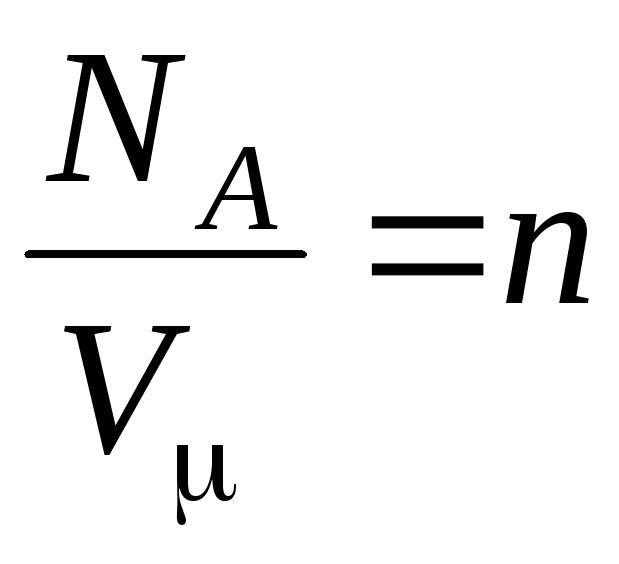 –
մոլեկուլների կոնցենտրացիան (մոլեկուլների քանակը մեկ միավորի ծավալով): Այս արտահայտությունից հետևում է, որ իդեալական գազի ճնշումն ուղիղ համեմատական է նրա մոլեկուլների կոնցենտրացիային կամ գազի խտությանը։ Միևնույն ջերմաստիճանի և ճնշման դեպքում բոլոր գազերը պարունակում են նույն թվով մոլեկուլներ մեկ միավորի ծավալով: Նորմալ պայմաններում 1 մ 3-ում պարունակվող մոլեկուլների թիվը կոչվում է
Լոշմիդտի համարը:
–
մոլեկուլների կոնցենտրացիան (մոլեկուլների քանակը մեկ միավորի ծավալով): Այս արտահայտությունից հետևում է, որ իդեալական գազի ճնշումն ուղիղ համեմատական է նրա մոլեկուլների կոնցենտրացիային կամ գազի խտությանը։ Միևնույն ջերմաստիճանի և ճնշման դեպքում բոլոր գազերը պարունակում են նույն թվով մոլեկուլներ մեկ միավորի ծավալով: Նորմալ պայմաններում 1 մ 3-ում պարունակվող մոլեկուլների թիվը կոչվում է
Լոշմիդտի համարը:
Ն Լ = 2,68 10 25 մ -3.
Մոլեկուլային կինետիկայի հիմնական հավասարումը
իդեալական գազերի տեսություն
Ամենակարևոր խնդիրը Գազերի կինետիկ տեսությունը իդեալական գազի ճնշման տեսական հաշվարկն է հիմնված մոլեկուլային կինետիկ հասկացությունների վրա: Իդեալական գազերի մոլեկուլային կինետիկ տեսության հիմնական հավասարումը ստացվում է օգտագործելով վիճակագրական մեթոդներ.
Ենթադրվում է, որ գազի մոլեկուլները շարժվում են պատահականորեն, գազի մոլեկուլների միջև փոխադարձ բախումների թիվը աննշան է նավի պատերին հարվածների քանակի համեմատ, և այդ բախումները բացարձակ առաձգական են: Անոթի պատին որոշ տարրական տարածք Սև հաշվարկել այն ճնշումը, որը գազի մոլեկուլները կգործադրեն այս տարածքի վրա:
Պետք է հաշվի առնել այն փաստը, որ իրականում մոլեկուլները կարող են տեղաշարժվել տարբեր անկյուններով և կարող են ունենալ. տարբեր արագություններ, որը, ընդ որում, կարող է փոխվել յուրաքանչյուր բախման հետ։ Տեսական հաշվարկներում մոլեկուլների քաոսային շարժումը իդեալականացվում է, դրանք փոխարինվում են երեք փոխադարձ ուղղահայաց ուղղություններով։
Եթե դիտարկենք խորանարդի տեսքով անոթ, որի մեջ Նգազի մոլեկուլները վեց ուղղություններով, հեշտ է տեսնել, որ ցանկացած պահի բոլոր մոլեկուլների թվի 1/3-ը շարժվում է դրանցից յուրաքանչյուրի երկայնքով, և դրանց կեսը (այսինքն՝ բոլոր մոլեկուլների թվի 1/6-ը) շարժվում է ներսում։ մեկ ուղղությամբ, իսկ երկրորդ կեսը (նաև 1/6) - հակառակ ուղղությամբ: Յուրաքանչյուր բախման ժամանակ տեղամասին ուղղահայաց շարժվող առանձին մոլեկուլ, արտացոլելով, իմպուլս է փոխանցում դրան, մինչդեռ դրա իմպուլսը (իմպուլսը) փոխվում է քանակով։
Ռ 1 =մ 0 v – (– մ 0 v) = 2 մ 0 v.
Տեղանքի վրա տվյալ ուղղությամբ շարժվող մոլեկուլների ազդեցությունների թիվը հավասար կլինի. Ն = 1/6 n Սvտ. Հարթակի հետ բախվելիս այս մոլեկուլները թափ կփոխանցեն դրան։
Պ= Ն Պ 1 =2 մ 0 vnՍvt=m 0 v 2 nՍտ,
որտեղ nմոլեկուլների կոնցենտրացիան է։ Այնուհետև ճնշումը, որը գազը գործադրում է նավի պատի վրա, հավասար կլինի.
p = 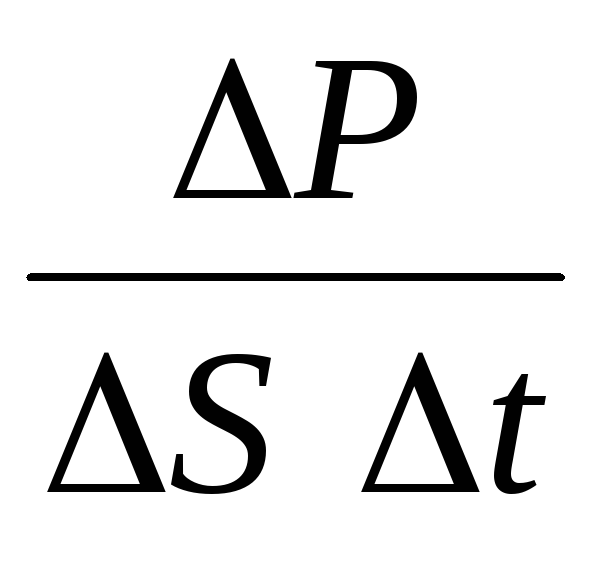 =
n մ 0
v 2
.
(1.9)
=
n մ 0
v 2
.
(1.9)
Այնուամենայնիվ, գազի մոլեկուլները շարժվում են տարբեր արագություններով. v 1 , v 2 , …,v n, ուստի արագությունները պետք է միջինացված լինեն։ Գազի մոլեկուլների արագությունների քառակուսիների գումարը, բաժանված նրանց թվի վրա, որոշում է միջին քառակուսի արագության արմատը.
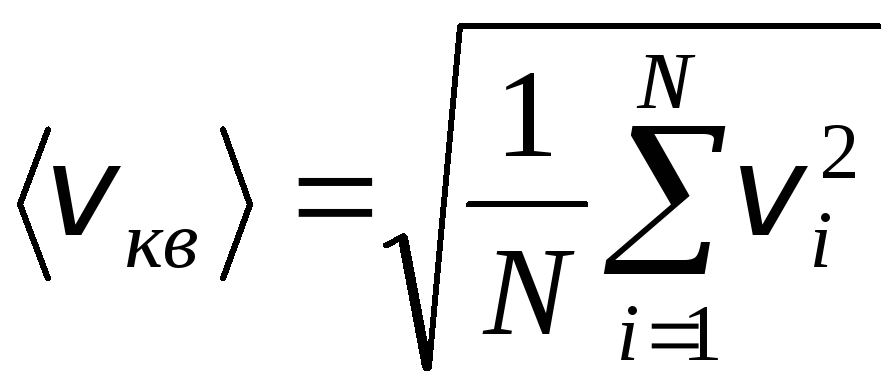 .
.
Հավասարում (1.9) կընդունի ձևը՝
![]() (1.10)
(1.10)
(1.10) արտահայտությունը կոչվում է մոլեկուլային կինետիկ տեսության հիմնական հավասարումըիդեալական գազեր.
Հաշվի առնելով, որ 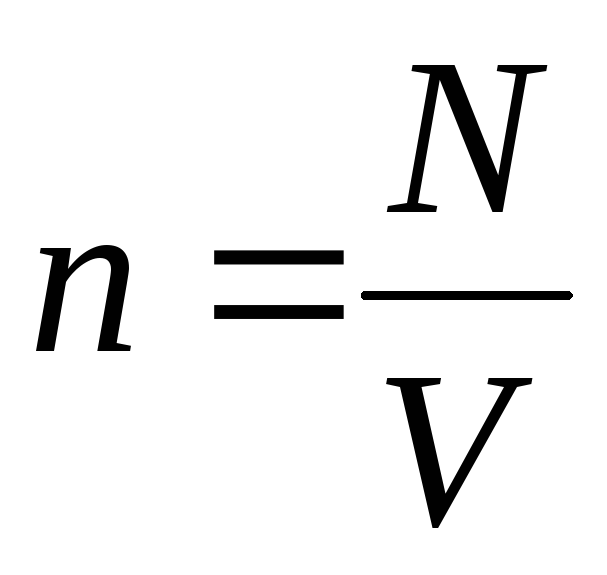 , ստանում ենք.
, ստանում ենք.
p V = N 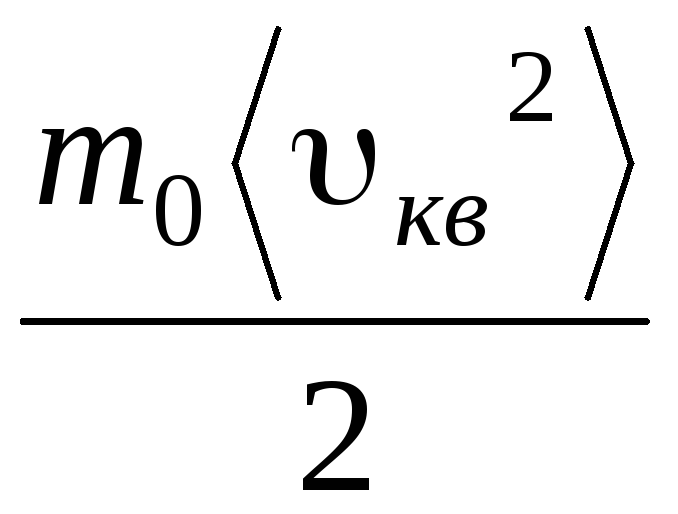 =Է,
(1.11)
=Է,
(1.11)
որտեղ Եգազի բոլոր մոլեկուլների փոխադրական շարժման ընդհանուր կինետիկ էներգիան է։ Հետևաբար, գազի ճնշումը ուղիղ համեմատական է գազի մոլեկուլների փոխադրական շարժման կինետիկ էներգիային։
Մեկ մոլ գազի համար մ =, իսկ Կլապեյրոն-Մենդելեև հավասարումն ունի հետևյալ ձևը.
p V . = Ռ Տ,
և քանի որ (1.11)-ից հետևում է, որ p V . = v քառ. 2, մենք ստանում ենք.
R.T.= v քառ. 2 .
Այսպիսով, գազի մոլեկուլների արմատ-միջին քառակուսի արագությունը հավասար է
v
քառ.
=
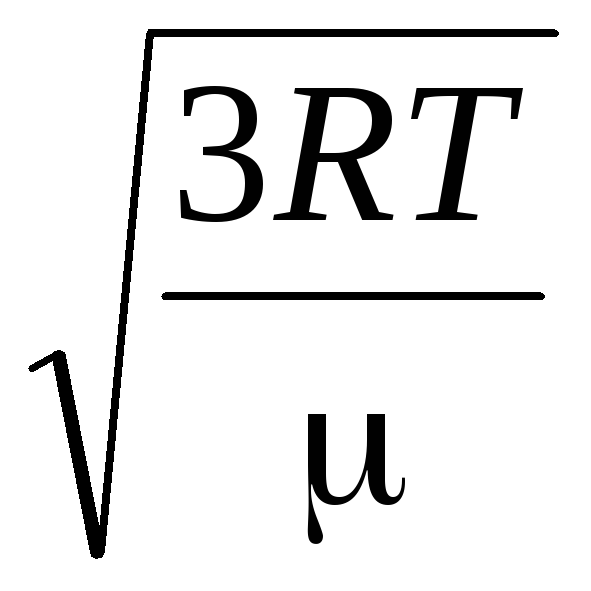 =
=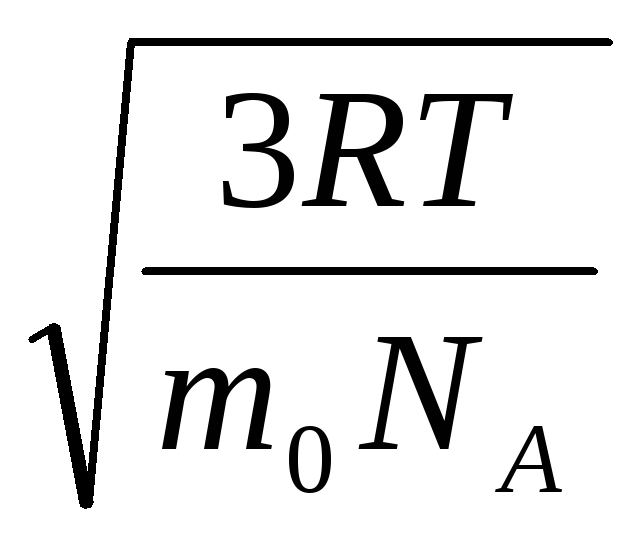 =
= ,
,
որտեղ կ = Ռ/Ն Ա = 1,3810 -23 J/K – Բոլցմանի հաստատունը. Այստեղից կարելի է գտնել թթվածնի մոլեկուլների միջին քառակուսի արագությունը սենյակային ջերմաստիճանում՝ 480 մ/վ, ջրածնի՝ 1900 մ/վրկ։
Ջերմաստիճանի մոլեկուլային-կինետիկ նշանակությունը
Ջերմաստիճանը մարմնի տաքության քանակական միջոց է: Բացարձակ թերմոդինամիկական ջերմաստիճանի ֆիզիկական նշանակությունը պարզելու համար ՏՀամեմատենք գազերի մոլեկուլային-կինետիկ տեսության հիմնական հավասարումը (1.14) Կլապեյրոն-Մենդելեև հավասարման հետ. էջՎ = Ռ.Տ.
Հավասարեցնելով այս հավասարումների ճիշտ մասերը՝ մենք գտնում ենք մեկ մոլեկուլի կինետիկ էներգիայի 0 միջին արժեքը ( = Ն/Ն Ա , կ=Ռ/Ն Ա):
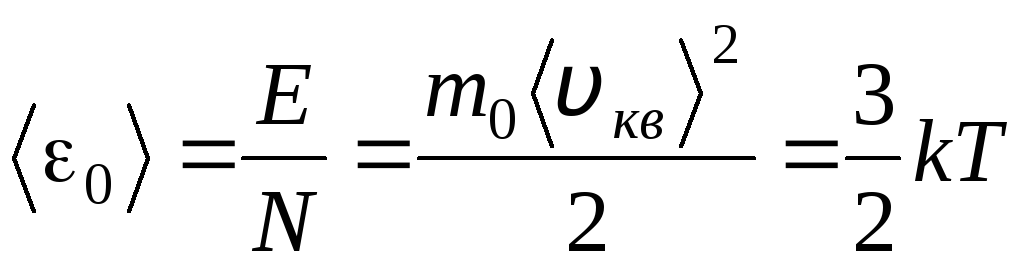 .
.
Այս հավասարումից բխում է մոլեկուլային կինետիկ տեսության ամենակարևոր եզրակացությունը. Իդեալական գազի մեկ մոլեկուլի թարգմանական շարժման միջին կինետիկ էներգիան կախված է միայն ջերմաստիճանից, մինչդեռ այն ուղիղ համեմատական է թերմոդինամիկական ջերմաստիճանին։ Այսպիսով, թերմոդինամիկական ջերմաստիճանի սանդղակը ձեռք է բերում ուղղակի ֆիզիկական նշանակություն՝ ժամը Տ= 0 իդեալական գազի մոլեկուլների կինետիկ էներգիան զրո է: Հետևաբար, այս տեսության հիման վրա գազի մոլեկուլների թարգմանական շարժումը կդադարի, և նրա ճնշումը կհավասարվի զրոյի։
Իդեալական գազի հավասարակշռության հատկությունների տեսություն
Մոլեկուլների ազատության աստիճանների թիվը. Իդեալական գազերի մոլեկուլային-կինետիկ տեսությունը հանգեցնում է մի շատ կարևոր հետևանքի՝ գազի մոլեկուլները շարժվում են պատահականորեն, և մոլեկուլի փոխադրական շարժման միջին կինետիկ էներգիան որոշվում է բացառապես ջերմաստիճանով։
Մոլեկուլային շարժման կինետիկ էներգիան կինետիկով չի սպառվում առաջ շարժման էներգիաայն բաղկացած է նաև կինետիկից էներգիաներ ռոտացիանև տատանումներմոլեկուլները. Մոլեկուլային բոլոր տեսակի շարժման մեջ մտնող էներգիան հաշվարկելու համար անհրաժեշտ է սահմանել ազատության աստիճանների քանակը.
Տակ ազատության աստիճանների քանակը (ես) մարմնի ենթադրվում է անկախ կոորդինատների թիվը, որոնք պետք է մուտքագրվեն տիեզերքում մարմնի դիրքը որոշելու համար:
Հ  Օրինակ, նյութական կետն ունի ազատության երեք աստիճան, քանի որ տարածության մեջ նրա դիրքը որոշվում է երեք կոորդինատներով. x, yև զ. Հետևաբար, միատոմային մոլեկուլն ունի երեք աստիճանի թարգմանական շարժման ազատություն։
Օրինակ, նյութական կետն ունի ազատության երեք աստիճան, քանի որ տարածության մեջ նրա դիրքը որոշվում է երեք կոորդինատներով. x, yև զ. Հետևաբար, միատոմային մոլեկուլն ունի երեք աստիճանի թարգմանական շարժման ազատություն։
Դ  Բուկատոմիական մոլեկուլն ունի 5 աստիճան ազատություն (նկ. 1.4).
Բուկատոմիական մոլեկուլն ունի 5 աստիճան ազատություն (նկ. 1.4).
Երեք և ավելի ատոմների մոլեկուլներն ունեն 6 աստիճան ազատություն՝ 3 աստիճան թարգմանական շարժման ազատություն և 3 աստիճան պտտվող շարժման ազատություն (նկ. 1.5):
Գազի յուրաքանչյուր մոլեկուլ ունի որոշակի թվով ազատության աստիճաններ, որոնցից երեքը համապատասխանում են նրա թարգմանական շարժմանը։
Էներգիայի հավասար բաշխման կանոնակարգ
ազատության աստիճաններով
Գազերի մոլեկուլային-կինետիկ տեսության հիմնական նախադրյալը մոլեկուլների շարժման մեջ լրիվ պատահականության ենթադրությունն է։ Սա վերաբերում է և՛ տատանողական, և՛ պտտվող շարժումներին, և ոչ միայն թարգմանական: Ենթադրվում է, որ գազի մեջ մոլեկուլների շարժման բոլոր ուղղությունները հավասարապես հավանական են։ Հետևաբար, մենք կարող ենք ենթադրել, որ մոլեկուլի ազատության յուրաքանչյուր աստիճանի համար միջինում կա էներգիայի նույն քանակությունը. սա է դիրքը էներգիայի հավասարաչափ բաժանման վերաբերյալ ազատության աստիճանների նկատմամբ: Մոլեկուլի մեկ աստիճանի ազատության էներգիան հետևյալն է.
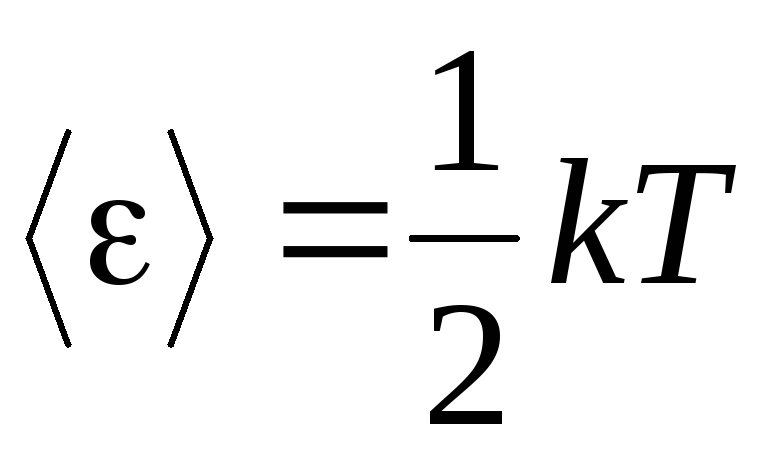 . (1.12)
. (1.12)
Եթե մոլեկուլն ունի եսազատության աստիճաններ, ապա ազատության յուրաքանչյուր աստիճանի համար միջինում կա.
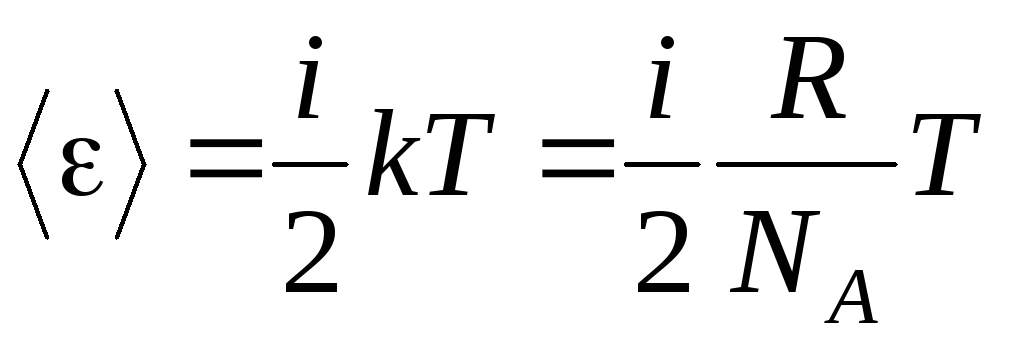 .
(1.13)
.
(1.13)
Իդեալական գազի ներքին էներգիան
Եթե գազի ներքին էներգիայի ընդհանուր մատակարարումը վերագրենք մեկ մոլի, ապա դրա արժեքը կստանանք՝ բազմապատկելով Ավոգադրոյի թվով.
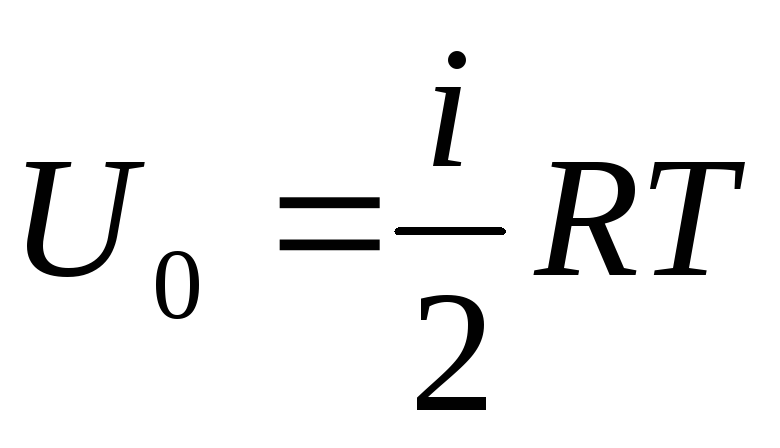 .
(1.14)
.
(1.14)
Հետևում է, որ իդեալական գազի մեկ մոլի ներքին էներգիան կախված է միայն ջերմաստիճանից և գազի մոլեկուլների ազատության աստիճաններից։
Մաքսվելի և Բոլցմանի բաշխումները
Իդեալական գազի մոլեկուլների բաշխումը ջերմային շարժման արագությունների և էներգիաների առումով (Մաքսվելի բաշխում)։ Գազի մշտական ջերմաստիճանի դեպքում մոլեկուլային շարժման բոլոր ուղղությունները ենթադրվում են հավասարապես հավանական: Այս դեպքում յուրաքանչյուր մոլեկուլի արմատ-միջին քառակուսի արագությունը մնում է հաստատուն և հավասար է
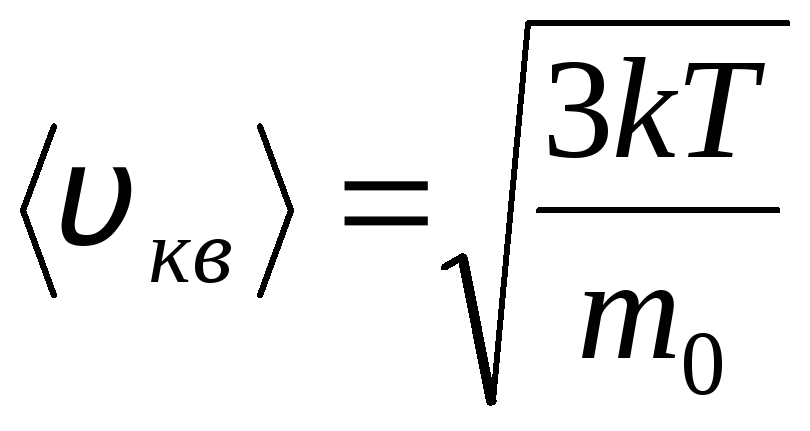 .
.
Դա բացատրվում է նրանով, որ իդեալական գազում, որը գտնվում է հավասարակշռության վիճակում, հաստատվում է մոլեկուլների որոշակի անշարժ արագության բաշխում, որը ժամանակի հետ չի փոխվում։ այս բաշխումը ենթակա է որոշակի վիճակագրական օրենքի, որը տեսականորեն բխում է Ջ. Մաքսվելը: Մաքսվելի օրենքը նկարագրվում է ֆունկցիայով
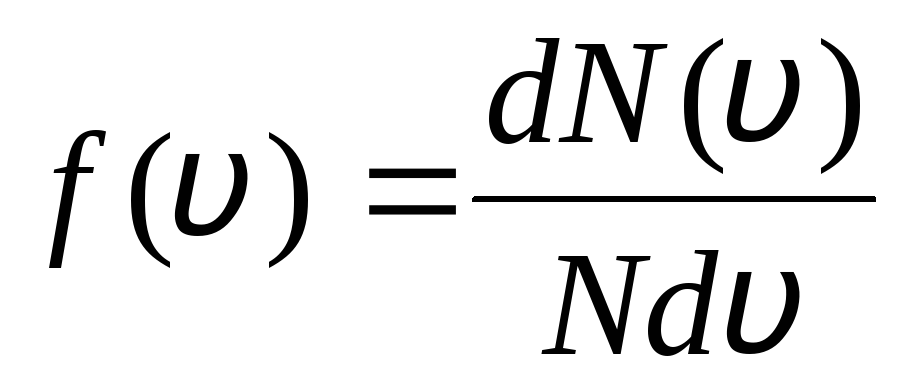 ,
,
դա գործառույթն է զ(v) որոշում է մոլեկուլների հարաբերական թիվը  , որի արագությունները գտնվում են սկսած միջակայքում v
նախքան v+dv. Կիրառելով հավանականությունների տեսության մեթոդները՝ Մաքսվելը գտավ Իդեալական գազի մոլեկուլների արագությունների բաշխման օրենքը.
, որի արագությունները գտնվում են սկսած միջակայքում v
նախքան v+dv. Կիրառելով հավանականությունների տեսության մեթոդները՝ Մաքսվելը գտավ Իդեալական գազի մոլեկուլների արագությունների բաշխման օրենքը.
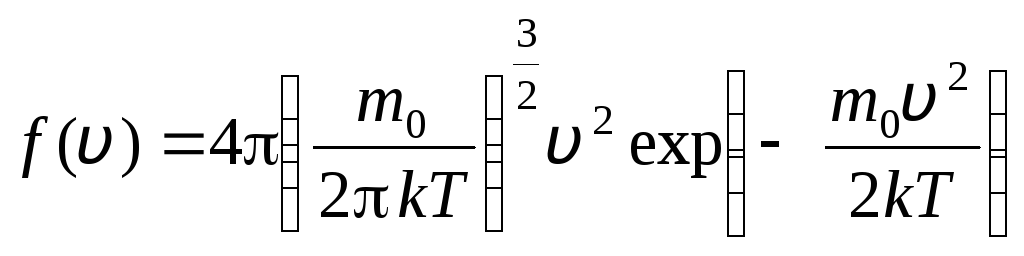 . (1.15)
. (1.15)
Բաշխման ֆունկցիան գրաֆիկորեն ներկայացված է նկ. 1.6. Բաշխման կորով և x առանցքով սահմանափակված տարածքը հավասար է մեկի: Սա նշանակում է, որ ֆունկցիան զ(v) բավարարում է նորմալացման պայմանը.
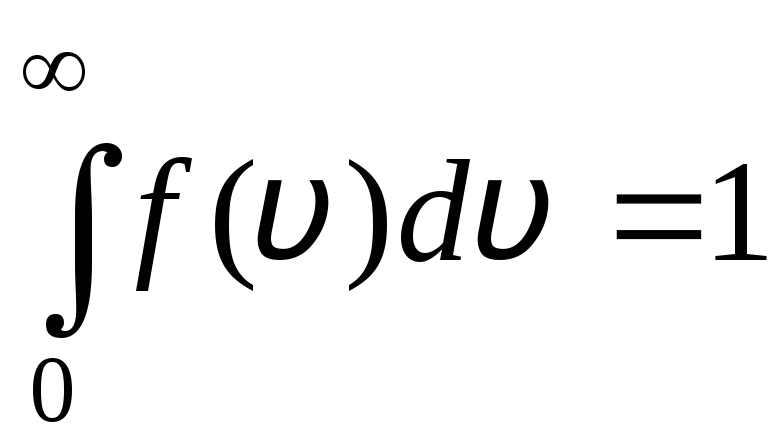 .
.
ԻՑ  արագություն, որով իդեալական գազի մոլեկուլների բաշխման ֆունկցիան արագությունների առումով զ(v) առավելագույնն է, կոչվում է Ամենայն հավանականությամբ
արագություն
v Բ .
արագություն, որով իդեալական գազի մոլեկուլների բաշխման ֆունկցիան արագությունների առումով զ(v) առավելագույնն է, կոչվում է Ամենայն հավանականությամբ
արագություն
v Բ .
Արժեքներ v = 0 և v = համապատասխանում են արտահայտման նվազագույնին (1.15): Ամենահավանական արագությունը կարելի է գտնել՝ տարբերակելով արտահայտությունը (1.23) և այն հավասարեցնելով զրոյի.
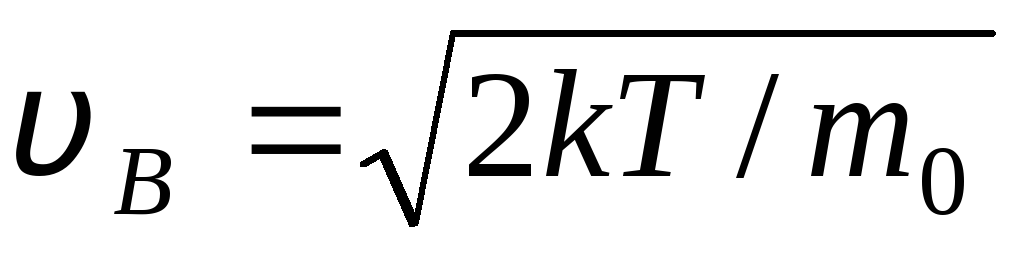 =
=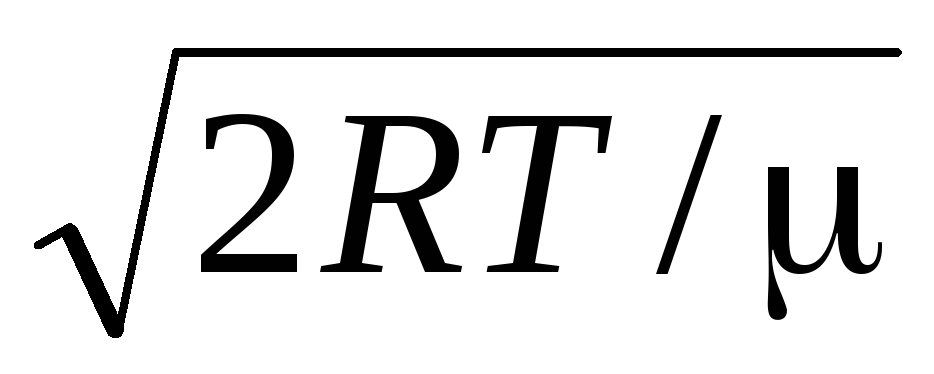 =
1,41
=
1,41
Ջերմաստիճանի բարձրացման դեպքում ֆունկցիայի առավելագույնը կտեղափոխվի աջ (նկ. 1.6), այսինքն՝ ջերմաստիճանի բարձրացման դեպքում մեծանում է նաև ամենահավանական արագությունը, սակայն կորով սահմանափակված տարածքը մնում է անփոփոխ։ Հարկ է նշել, որ գազերում և ցածր ջերմաստիճաններում միշտ փոքր քանակությամբ մոլեկուլներ կան, որոնք շարժվում են մեծ արագությամբ։ Նման «տաք» մոլեկուլների առկայությունը ունի մեծ նշանակությունբազմաթիվ գործընթացների ընթացքում։
Միջին թվաբանական արագությունմոլեկուլները որոշվում են բանաձևով
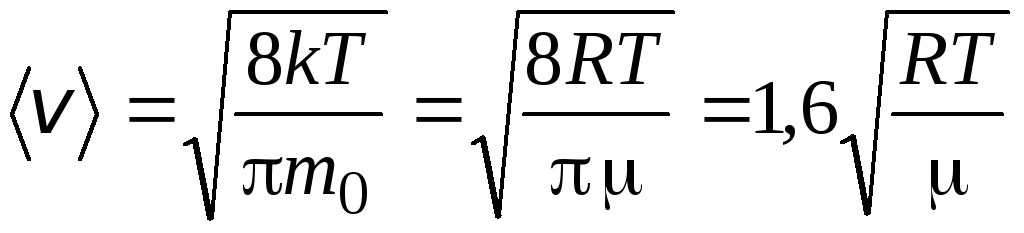 .
.
Արմատի միջին քառակուսի արագություն
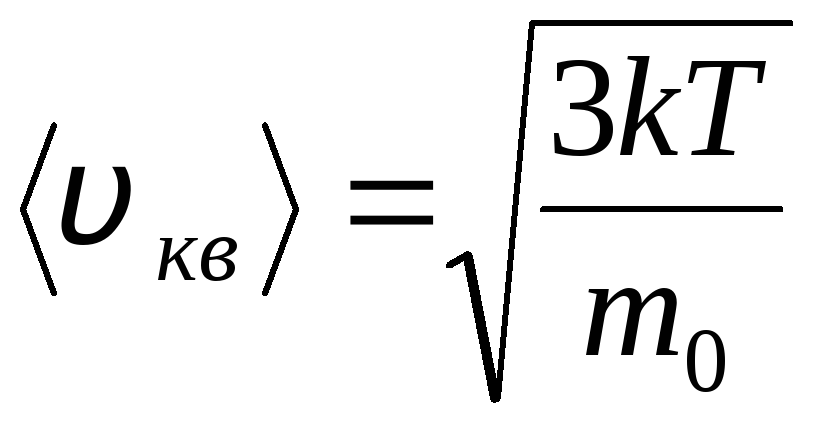 =
1,73
=
1,73 .
.
Այս արագությունների հարաբերակցությունը կախված չէ ջերմաստիճանից կամ գազի տեսակից։
Ջերմային շարժման էներգիաներով մոլեկուլների բաշխման ֆունկցիան. Այս ֆունկցիան կարելի է ստանալ՝ արագության փոխարեն կինետիկ էներգիայի արժեքը փոխարինելով մոլեկուլների բաշխման հավասարման մեջ (1.15).
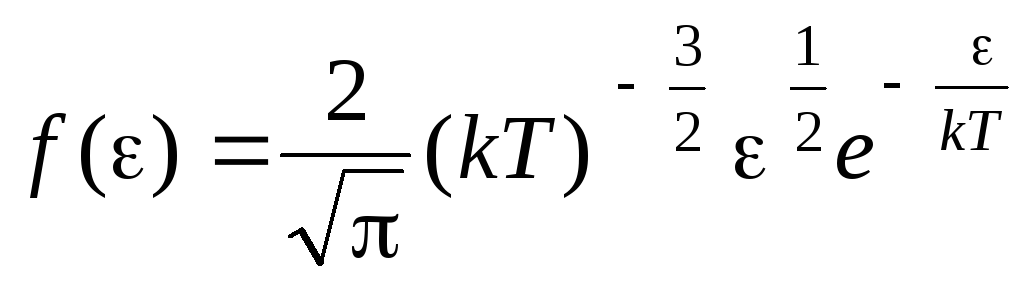 .
.
Ունենալով ինտեգրված արտահայտությունը էներգիայի արժեքների նկատմամբ  նախքան
նախքան 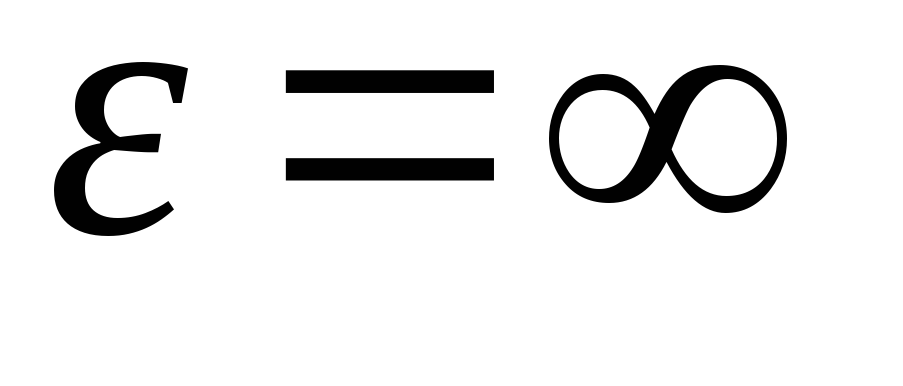
 , ստանում ենք միջին կինետիկ էներգիաիդեալական գազի մոլեկուլներ.
, ստանում ենք միջին կինետիկ էներգիաիդեալական գազի մոլեկուլներ.
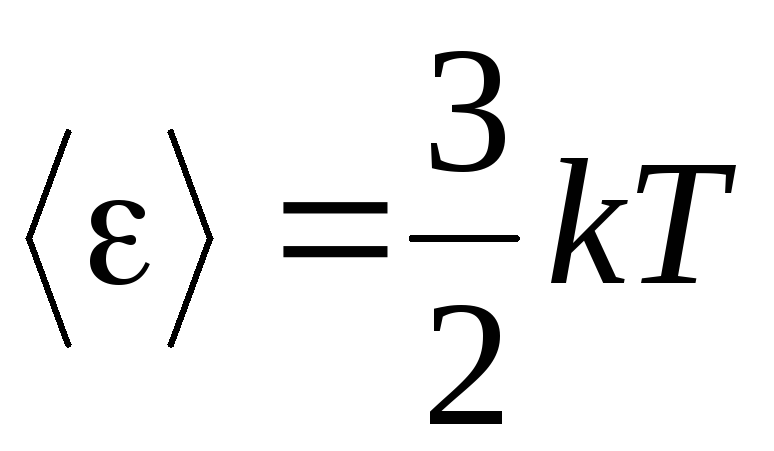 .
.
բարոմետրիկ բանաձև. Բոլցմանի բաշխում. Գազերի մոլեկուլային-կինետիկ տեսության հիմնական հավասարումը և մոլեկուլների Մաքսվելի բաշխումն ըստ արագության, ենթադրվում էր, որ իդեալական գազի մոլեկուլների վրա արտաքին ուժերը չեն ազդում, հետևաբար մոլեկուլները հավասարաչափ բաշխված են ամբողջ ծավալով: Այնուամենայնիվ, ցանկացած գազի մոլեկուլները գտնվում են Երկրի գրավիտացիոն դաշտում: Բարձրությունից ճնշման կախվածության օրենքը հանելիս ենթադրվում է, որ գրավիտացիոն դաշտը միատեսակ է, ջերմաստիճանը՝ հաստատուն, և բոլոր մոլեկուլների զանգվածը՝ նույնը.
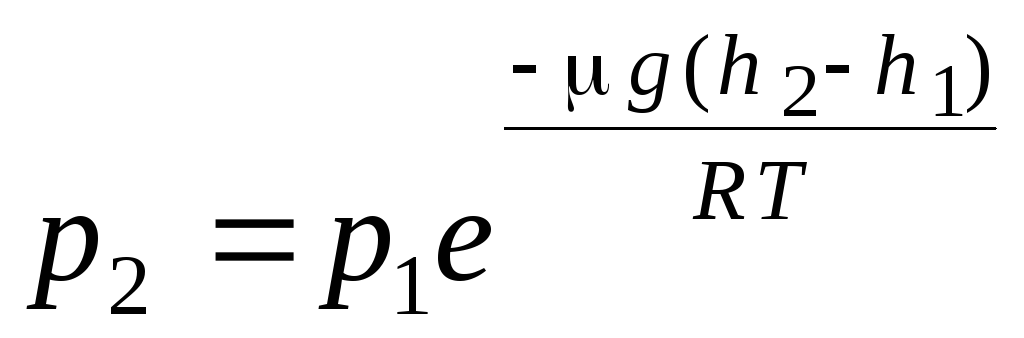 . (1.16)
. (1.16)
(1.16) արտահայտությունը կոչվում է բարոմետրիկ բանաձև. Այն թույլ է տալիս գտնել մթնոլորտային ճնշումը՝ կախված բարձրությունից, կամ ճնշումը չափելով՝ կարող եք գտնել բարձրությունը։ Որովհետեւ հ 1 ծովի մակարդակից բարձրությունն է, որտեղ ճնշումը համարվում է նորմալ, ապա արտահայտությունը կարող է փոփոխվել.
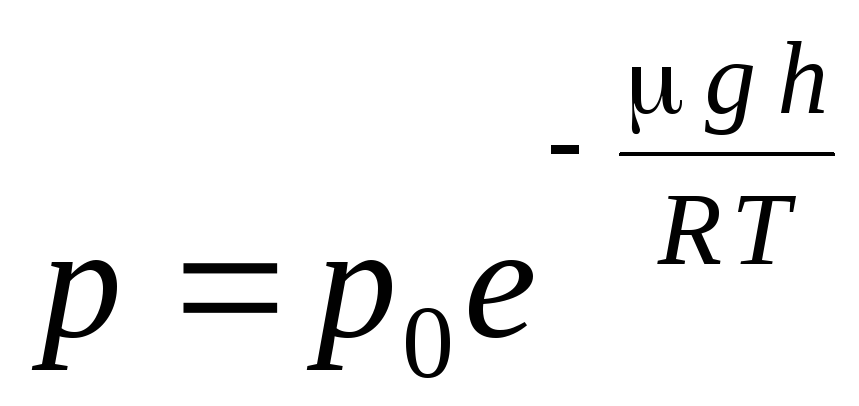 .
.
Բարոմետրիկ բանաձևը կարող է փոխակերպվել արտահայտության միջոցով p = nkT:
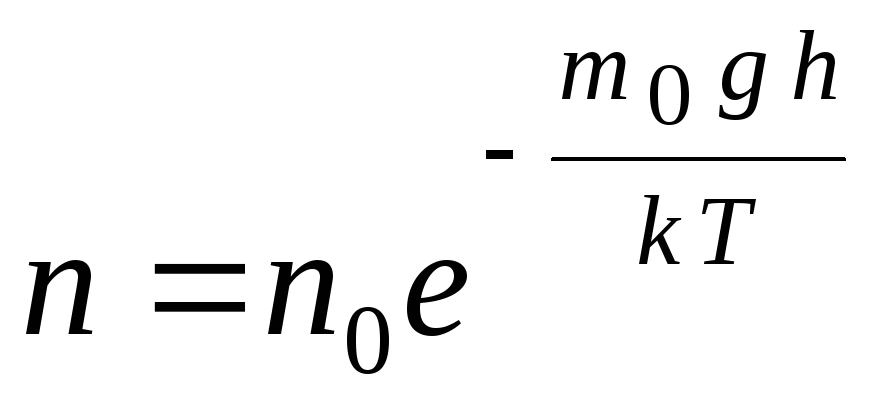 ,
,
Գ  դե n
–
մոլեկուլների կոնցենտրացիան բարձրության վրա հ,
մ 0
ղ=Պ–
մոլեկուլի պոտենցիալ էներգիան գրավիտացիոն դաշտում: Մշտական ջերմաստիճանում գազի խտությունն ավելի մեծ է այնտեղ, որտեղ մոլեկուլի պոտենցիալ էներգիան ավելի ցածր է: Գրաֆիկորեն, բարձրության հետ մեկ միավորի ծավալով մասնիկների քանակի նվազման օրենքը կարծես թե ինչպես ցույց է տրված Նկ. 1.7.
դե n
–
մոլեկուլների կոնցենտրացիան բարձրության վրա հ,
մ 0
ղ=Պ–
մոլեկուլի պոտենցիալ էներգիան գրավիտացիոն դաշտում: Մշտական ջերմաստիճանում գազի խտությունն ավելի մեծ է այնտեղ, որտեղ մոլեկուլի պոտենցիալ էներգիան ավելի ցածր է: Գրաֆիկորեն, բարձրության հետ մեկ միավորի ծավալով մասնիկների քանակի նվազման օրենքը կարծես թե ինչպես ցույց է տրված Նկ. 1.7.
Արտաքին պոտենցիալ կամայական դաշտի համար մենք գրում ենք հետևյալ ընդհանուր արտահայտությունը
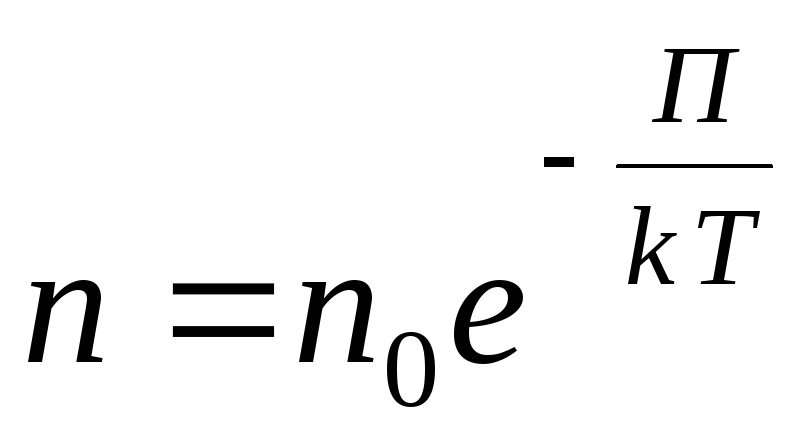 ,
,
Հազվագյուտ գազում մոլեկուլների միջև հեռավորությունը շատ անգամ ավելի մեծ է, քան դրանց չափը: Այս դեպքում մոլեկուլների փոխազդեցությունը աննշան է, և մոլեկուլների կինետիկ էներգիան շատ ավելի մեծ է, քան նրանց փոխազդեցության պոտենցիալ էներգիան։
Գազային վիճակում գտնվող նյութի հատկությունները բացատրելու համար իրական գազի փոխարեն օգտագործվում է նրա ֆիզիկական մոդելը՝ իդեալական գազ։ Մոդելը ենթադրում է.
մոլեկուլների միջև հեռավորությունը մի փոքր ավելի մեծ է, քան դրանց տրամագիծը.
մոլեկուլները առաձգական գնդիկներ են;
մոլեկուլների միջև չկան գրավիչ ուժեր.
երբ մոլեկուլները բախվում են միմյանց և նավի պատերին, գործում են վանող ուժեր.
Մոլեկուլային շարժումը ենթարկվում է մեխանիկայի օրենքներին:
Իդեալական գազի հիմնական հավասարումը mkt.
MKT-ի հիմնական հավասարումը հնարավորություն է տալիս հաշվարկել գազի ճնշումը, եթե հայտնի են մոլեկուլի զանգվածը, արագության քառակուսու միջին արժեքը և մոլեկուլների կոնցենտրացիան։
Գազի իդեալական ճնշումկայանում է նրանում, որ նավի պատերի հետ բախվելիս մոլեկուլները փոխազդում են նրանց հետ մեխանիկայի օրենքների համաձայն՝ որպես առաձգական մարմիններ։ Երբ մոլեկուլը բախվում է նավի պատին, արագության վեկտորի vx արագության պրոյեկցիան պատին ուղղահայաց OX առանցքի վրա փոխում է իր նշանը հակառակի վրա, բայց բացարձակ արժեքով մնում է հաստատուն։ Հետևաբար, մոլեկուլի պատի հետ բախումների արդյունքում նրա իմպուլսի պրոյեկցիան OX առանցքի վրա փոխվում է mv 1x = -mv x-ից մինչև mv 2x =mv x: Մոլեկուլի իմպուլսի փոփոխությունը պատին բախվելիս առաջացնում է F 1 ուժ, որը գործում է նրա վրա պատի կողմից: Մոլեկուլի իմպուլսի փոփոխությունը հավասար է այս ուժի իմպուլսին.
Բախման ժամանակ, ըստ Նյուտոնի երրորդ օրենքի, մոլեկուլը պատի վրա գործում է F 2 ուժով, որը բացարձակ արժեքով հավասար է F 1 ուժին և ուղղված է հակառակ:
Կան բազմաթիվ մոլեկուլներ, և յուրաքանչյուրը բախվելիս պատին հաղորդում է նույն թափը: Մի վայրկյանում իմպուլս են փոխանցում 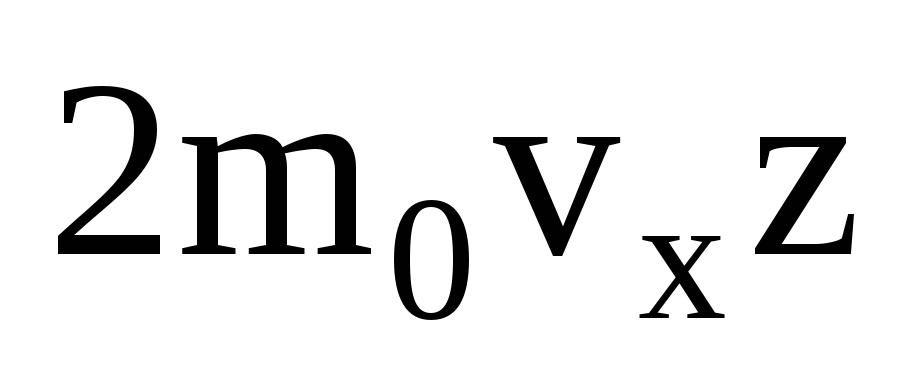 , որտեղ z-ը պատի հետ բոլոր մոլեկուլների բախումների թիվն է, որը համաչափ է գազում մոլեկուլների կոնցենտրացիային, մոլեկուլների արագությանը և պատի մակերեսին.
, որտեղ z-ը պատի հետ բոլոր մոլեկուլների բախումների թիվն է, որը համաչափ է գազում մոլեկուլների կոնցենտրացիային, մոլեկուլների արագությանը և պատի մակերեսին. 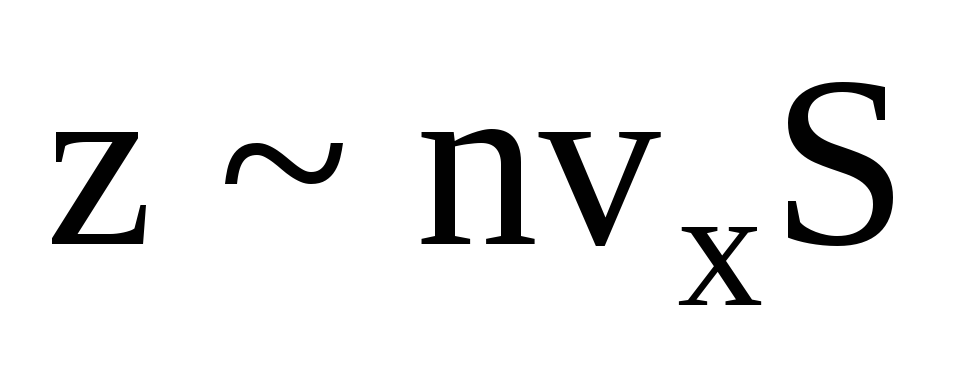 . Մոլեկուլների միայն կեսն է շարժվում դեպի պատը, մնացածը շարժվում են հակառակ ուղղությամբ.
. Մոլեկուլների միայն կեսն է շարժվում դեպի պատը, մնացածը շարժվում են հակառակ ուղղությամբ. 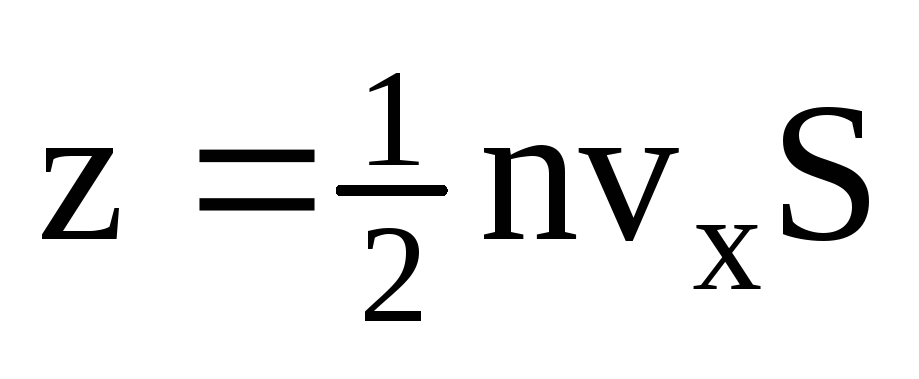 . Այնուհետև 1 վայրկյանում պատին փոխանցված ընդհանուր թափը.
. Այնուհետև 1 վայրկյանում պատին փոխանցված ընդհանուր թափը. 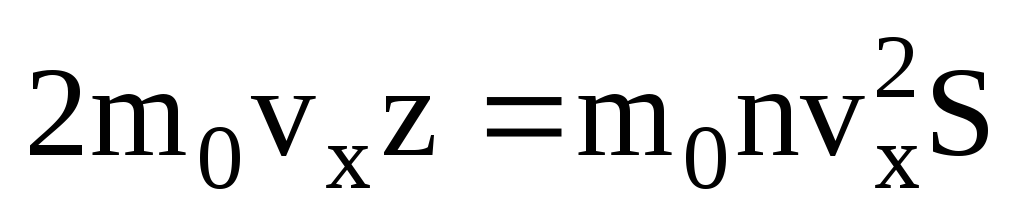 . Նյուտոնի երկրորդ օրենքի համաձայն՝ մարմնի իմպուլսի փոփոխությունը միավոր ժամանակում հավասար է նրա վրա ազդող ուժին.
. Նյուտոնի երկրորդ օրենքի համաձայն՝ մարմնի իմպուլսի փոփոխությունը միավոր ժամանակում հավասար է նրա վրա ազդող ուժին.
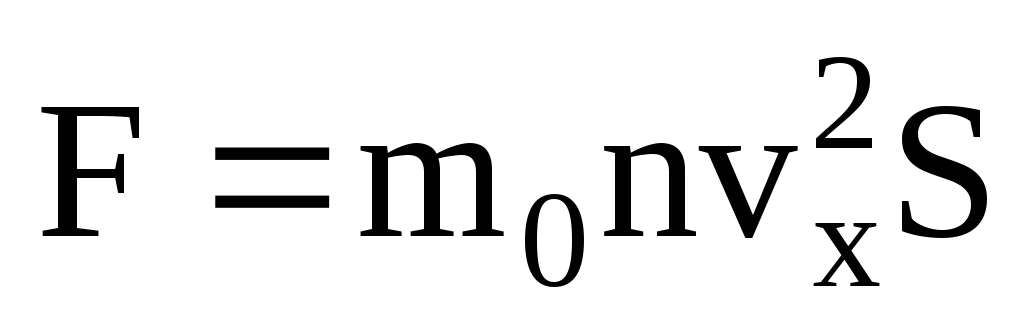
Հաշվի առնելով, որ ոչ բոլոր մոլեկուլներն ունեն նույն արագությունը, պատի վրա ազդող ուժը համաչափ կլինի արագության միջին քառակուսու հետ։ Քանի որ մոլեկուլները շարժվում են բոլոր ուղղություններով, արագության կանխատեսումների քառակուսիների միջին արժեքները հավասար են: Հետևաբար, արագության պրոյեկցիայի միջին քառակուսին հետևյալն է. 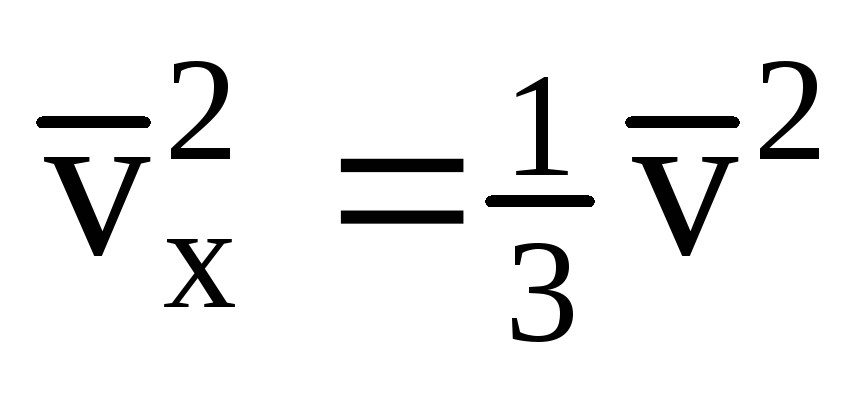 ;
;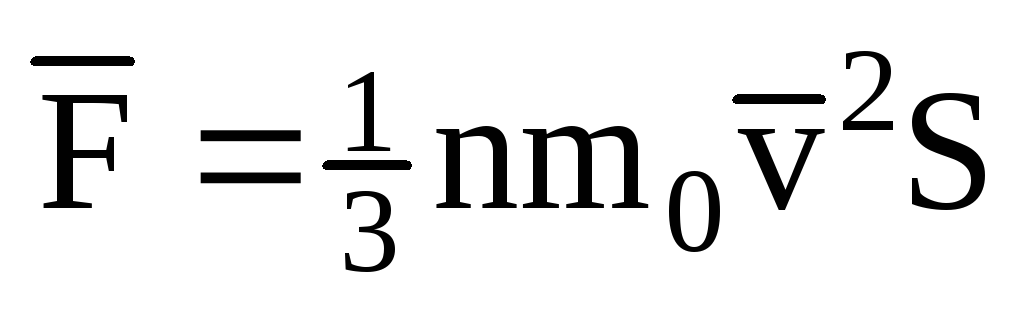 . Այնուհետև գազի ճնշումը նավի պատի վրա կազմում է.
. Այնուհետև գազի ճնշումը նավի պատի վրա կազմում է.
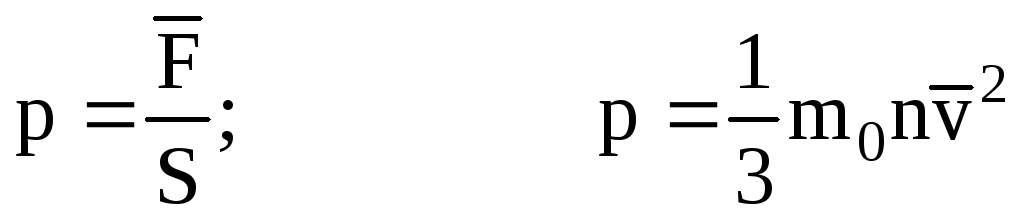 - MKT-ի հիմնական հավասարումը.
- MKT-ի հիմնական հավասարումը.
Նշանակելով իդեալական գազի մոլեկուլների փոխադրական շարժման կինետիկ էներգիայի միջին արժեքը.
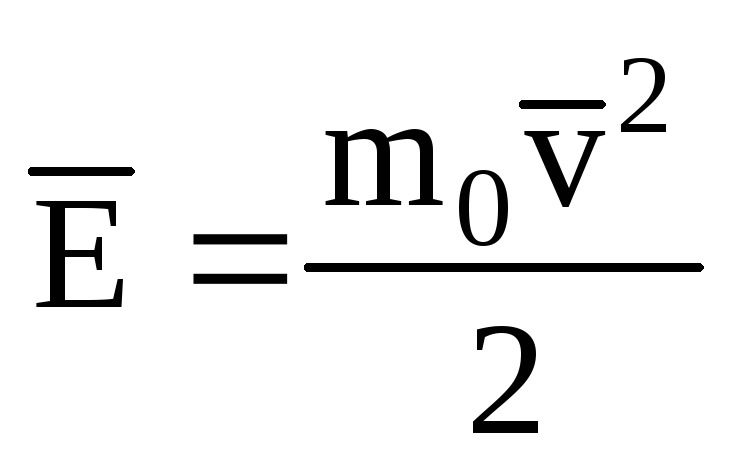 , ստանում ենք
, ստանում ենք
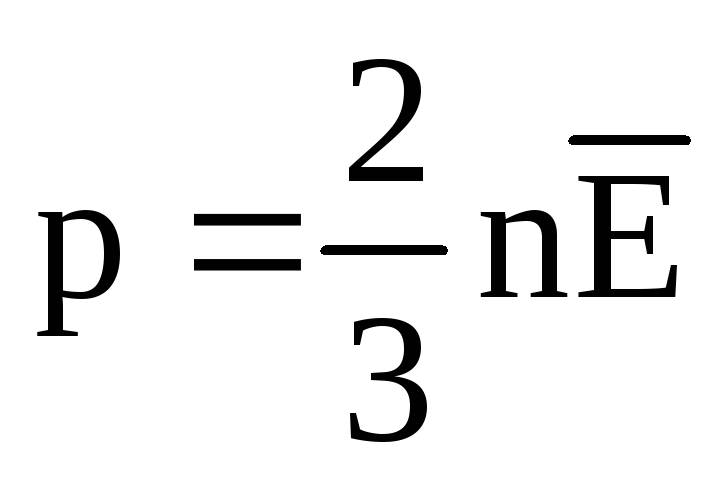
Ջերմաստիճանը և դրա չափումը.
Իդեալական գազի հիմնական MKT հավասարումը կապում է հեշտությամբ չափելի մակրոսկոպիկ պարամետրը՝ ճնշումը, գազի այնպիսի միկրոսկոպիկ պարամետրերի հետ, ինչպիսիք են միջին կինետիկ էներգիան և մոլեկուլների կոնցենտրացիան: Բայց, չափելով միայն ճնշումը, մենք չենք կարող պարզել ոչ առանձին մոլեկուլների կինետիկ էներգիայի միջին արժեքը, ոչ էլ դրանց կոնցենտրացիան։ Հետևաբար, գազի մանրադիտակային պարամետրերը գտնելու համար անհրաժեշտ են մոլեկուլների միջին կինետիկ էներգիայի հետ կապված որևէ այլ ֆիզիկական մեծության չափումներ։ Այս արժեքն է ջերմաստիճանը.
Ցանկացած մակրոսկոպիկ մարմին կամ մակրոսկոպիկ մարմինների խումբ, մշտական արտաքին պայմաններում, ինքնաբերաբար անցնում է ջերմային հավասարակշռության վիճակի։ Ջերմային հավասարակշռություն -սա մի վիճակ է, երբ բոլոր մակրոսկոպիկ պարամետրերը կամայականորեն երկար ժամանակ մնում են անփոփոխ:
Ջերմաստիճանը բնութագրում է մարմինների համակարգի ջերմային հավասարակշռության վիճակը. համակարգի բոլոր մարմինները, որոնք միմյանց հետ ջերմային հավասարակշռության մեջ են, ունեն նույն ջերմաստիճանը:.
Ջերմաստիճանը չափելու համար կարող եք օգտագործել ցանկացած մակրոսկոպիկ մեծության փոփոխություն՝ կախված ջերմաստիճանից՝ ծավալ, ճնշում, էլեկտրական դիմադրություն և այլն։
Ամենից հաճախ գործնականում օգտագործվում է հեղուկի (սնդիկի կամ ալկոհոլի) ծավալի կախվածությունը ջերմաստիճանից։ Ջերմաչափը չափաբերելիս սառույցի հալվող ջերմաստիճանը սովորաբար ընդունվում է որպես հղման կետ (0); երկրորդ հաստատուն կետը (100) ջրի եռման կետն է նորմալ մթնոլորտային ճնշման դեպքում (Ցելսիուսի սանդղակ): Քանի որ տարբեր հեղուկներ տաքացնելիս տարբեր կերպ են ընդլայնվում, այդպիսով հաստատված մասշտաբը որոշ չափով կախված կլինի տվյալ հեղուկի հատկություններից: Իհարկե, 0-ը և 100°C-ը կհամապատասխանեն բոլոր ջերմաչափերին, բայց 50°C-ը չի համընկնի:
Ի տարբերություն հեղուկների, բոլոր հազվագյուտ գազերը տաքանալիս միևնույն ձևով ընդարձակվում են և ջերմաստիճանի փոփոխությամբ նույն կերպ փոխում են իրենց ճնշումը։ Հետևաբար, ֆիզիկայում ջերմաստիճանի ռացիոնալ սանդղակ սահմանելու համար օգտագործվում է որոշակի քանակությամբ հազվագյուտ գազի ճնշման փոփոխություն հաստատուն ծավալով կամ գազի ծավալի փոփոխություն մշտական ճնշման դեպքում։ Այս սանդղակը երբեմն կոչվում է իդեալական գազի ջերմաստիճանի սանդղակ.
Ջերմային հավասարակշռության դեպքում բոլոր գազերի մոլեկուլների փոխադրական շարժման միջին կինետիկ էներգիան նույնն է։ Ճնշումն ուղիղ համեմատական է մոլեկուլների փոխադրական շարժման միջին կինետիկ էներգիային. 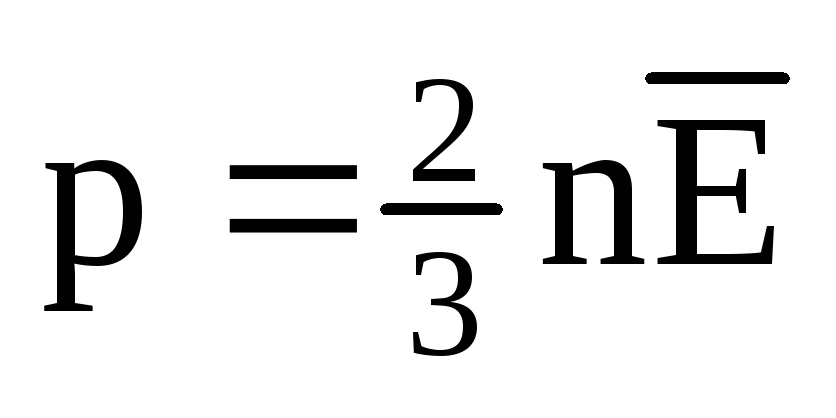 . Ջերմային հավասարակշռության դեպքում, եթե տվյալ զանգվածի գազի ճնշումը և դրա ծավալը ֆիքսված են, գազի մոլեկուլների միջին կինետիկ էներգիան պետք է ունենա խիստ սահմանված արժեք, ինչպես ջերմաստիճանը։ Որովհետեւ
. Ջերմային հավասարակշռության դեպքում, եթե տվյալ զանգվածի գազի ճնշումը և դրա ծավալը ֆիքսված են, գազի մոլեկուլների միջին կինետիկ էներգիան պետք է ունենա խիստ սահմանված արժեք, ինչպես ջերմաստիճանը։ Որովհետեւ 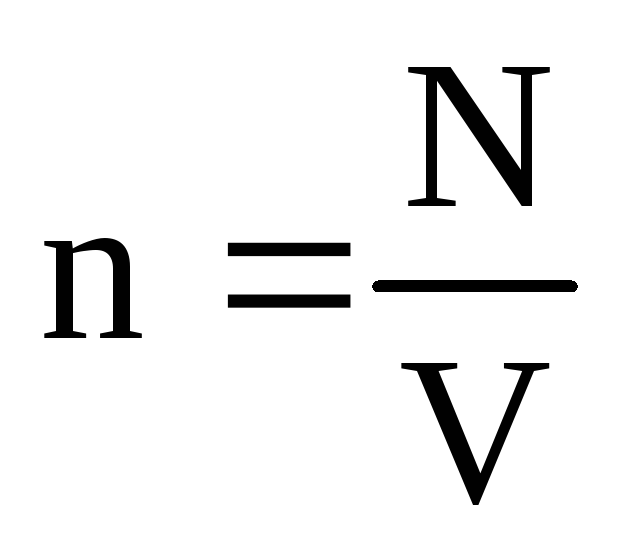 , ապա
, ապա 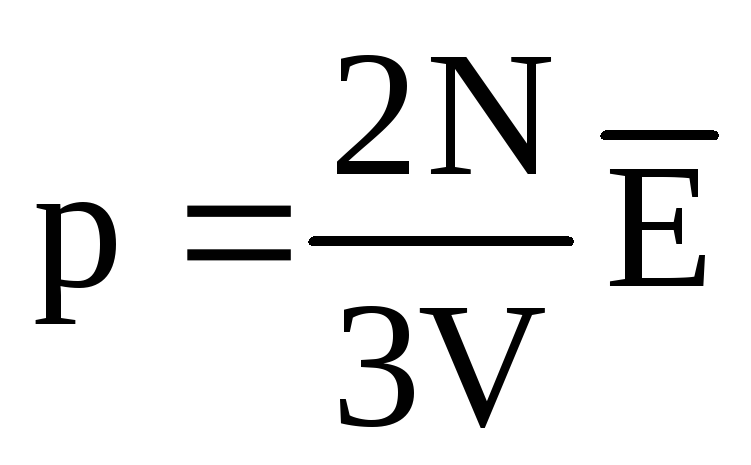 , կամ
, կամ 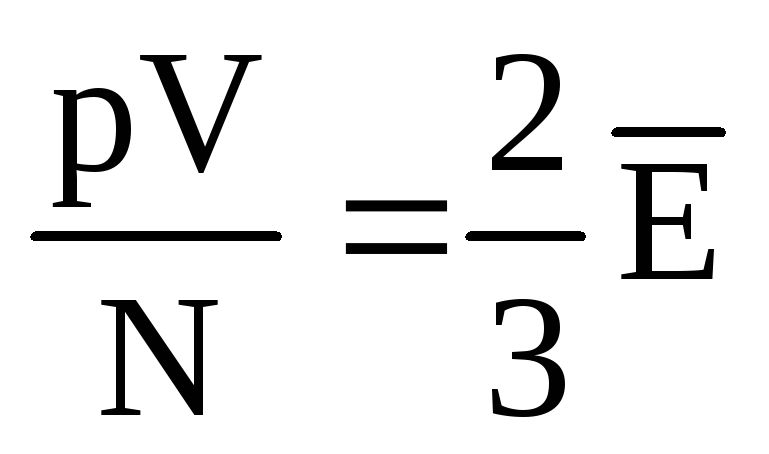 .
.
Նշանակել 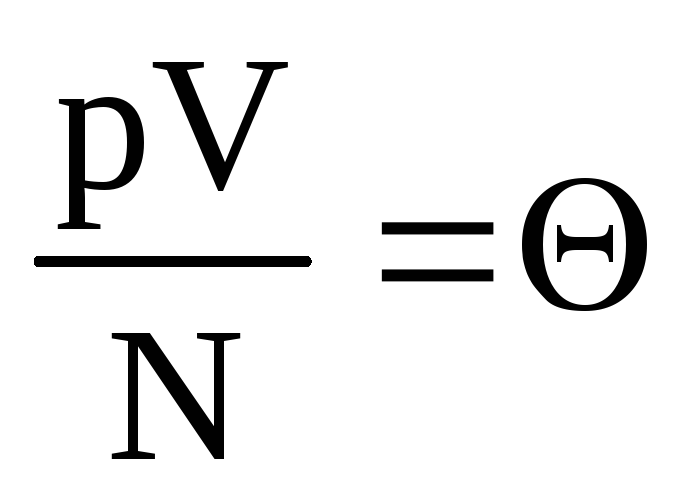 . Արժեք
. Արժեք  բարձրանում է ջերմաստիճանի հետ և կախված չէ որևէ այլ բանից, քան ջերմաստիճանը: Հետեւաբար, այն կարելի է համարել ջերմաստիճանի բնական չափիչ։
բարձրանում է ջերմաստիճանի հետ և կախված չէ որևէ այլ բանից, քան ջերմաստիճանը: Հետեւաբար, այն կարելի է համարել ջերմաստիճանի բնական չափիչ։
Դուք գիտեի՞ք,
ինչ է մտքի փորձը, գեդանկեն փորձը.
Դա գոյություն չունեցող պրակտիկա է, այլաշխարհիկ փորձ, երեւակայություն այն բանի, ինչ իրականում չկա։ Մտքի փորձերը նման են երազների: Նրանք հրեշներ են ծնում։ Ի տարբերություն ֆիզիկական փորձի, որը հիպոթեզների փորձարարական թեստ է, «մտքի փորձը» կախարդական կերպով փոխարինում է փորձարարական թեստը ցանկալի, չստուգված եզրակացություններով՝ շահարկելով տրամաբանական կառուցվածքները, որոնք իրականում խախտում են տրամաբանությունը՝ օգտագործելով չապացուցված նախադրյալները որպես ապացուցվածներ, այսինքն՝ փոխարինում. Այսպիսով, «մտքի փորձեր» դիմողների հիմնական խնդիրը ունկնդրին կամ ընթերցողին խաբելն է՝ փոխարինելով իրական ֆիզիկական փորձը նրա «տիկնիկով»՝ պայմանական վաղաժամկետ ազատման ֆիկտիվ պատճառաբանություն՝ առանց ինքնին ֆիզիկական ստուգման։
Ֆիզիկան երևակայական, «մտքի փորձերով» լցնելը հանգեցրել է աշխարհի անհեթեթ, սյուրռեալիստական, շփոթեցնող պատկերի: Իսկական հետազոտողը պետք է տարբերի նման «փաթաթանները» իրական արժեքներից։
Հարաբերականներն ու պոզիտիվիստները պնդում են, որ «մտքի փորձը» շատ օգտակար գործիք է տեսությունները (նաև մեր մտքում առաջացող) ստուգելու հետևողականության համար: Դրանով նրանք խաբում են մարդկանց, քանի որ ցանկացած ստուգում կարող է իրականացվել միայն ստուգման օբյեկտից անկախ աղբյուրի կողմից: Հիպոթեզի դիմողն ինքը չի կարող լինել սեփական հայտարարության թեստ, քանի որ այս հայտարարության պատճառն ինքնին հայտարարության մեջ դիմողի համար տեսանելի հակասությունների բացակայությունն է:
Սա տեսնում ենք SRT-ի և GTR-ի օրինակով, որոնք վերածվել են մի տեսակ կրոնի, որը ղեկավարում է գիտությունը և հանրային կարծիք. Դրանց հակասող ոչ մի փաստ չի կարող հաղթահարել Էյնշտեյնի բանաձևը. «Եթե փաստը չի համապատասխանում տեսությանը, փոխիր փաստը» (մեկ այլ տարբերակում, «Արդյո՞ք փաստը չի համապատասխանում տեսությանը. - այնքան ավելի վատ փաստի համար. »):
Առավելագույնը, որ կարող է պնդել «մտքի փորձը», միայն վարկածի ներքին հետևողականությունն է դիմողի սեփական, հաճախ ոչ մի կերպ ճիշտ տրամաբանության շրջանակներում։ Պրակտիկայի համապատասխանությունը դա չի ստուգում: Իրական փորձարկումը կարող է տեղի ունենալ միայն իրական ֆիզիկական փորձի ժամանակ:
Փորձը փորձ է, քանի որ դա ոչ թե մտքի ճշգրտում է, այլ մտքի փորձություն: Միտքը, որն ինքնին հետևողական է, չի կարող իրեն ստուգել: Դա ապացուցել է Կուրտ Գյոդելը։
