La quantité de chaleur dans le système SI est mesurée. Méthodes et moyens de mesurer la quantité de chaleur
Chaleur- l'énergie transférée d'un corps plus chaud à un moins chauffé par contact direct ou par rayonnement.
La température est une mesure de l'intensité du mouvement moléculaire.
La quantité de chaleur que possède un corps à une température donnée dépend de sa masse ; Par exemple, à la même température, plus de chaleur est stockée dans une grande tasse d'eau que dans une petite, et dans un seau d'eau froide, cela peut être plus que dans une tasse d'eau. eau chaude(bien que la température de l'eau dans le seau soit plus basse).
La chaleur joue un rôle important dans la vie humaine, notamment dans le fonctionnement de son corps. Une partie de l'énergie chimique contenue dans les aliments est convertie en chaleur, grâce à laquelle la température corporelle est maintenue à près de 37 ° C. Le bilan thermique du corps humain dépend également de la température. environnement, et les gens sont obligés de dépenser beaucoup d'énergie pour chauffer les locaux résidentiels et industriels en hiver et les refroidir en été. La majeure partie de cette énergie est fournie par des moteurs thermiques, tels que les chaudières et les turbines à vapeur des centrales électriques qui fonctionnent aux combustibles fossiles (charbon, pétrole) et produisent de l'électricité.
Jusqu'à la fin du XVIIIe siècle. la chaleur était considérée comme une substance matérielle, croyant que la température d'un corps est déterminée par la quantité de<калорической жидкости>, ou<теплорода>. Plus tard, B. Rumford, J. Joule et d'autres physiciens de l'époque, par des expériences et des raisonnements pleins d'esprit, ont réfuté<калорическую>théorie, prouvant que la chaleur est sans poids et peut être obtenue en n'importe quelle quantité simplement en raison du mouvement mécanique. La chaleur en soi n'est pas une substance - c'est juste l'énergie du mouvement de ses atomes ou molécules. C'est à cette compréhension de la chaleur que la physique moderne adhère.
Dans cet article, nous verrons comment la chaleur et la température sont liées et comment ces quantités sont mesurées. Le sujet de notre discussion sera également les questions suivantes : le transfert de chaleur d'une partie du corps à une autre ; transfert de chaleur dans le vide (un espace qui ne contient pas de matière); le rôle de la chaleur dans le monde moderne.
Chaleur et température
La quantité d'énergie thermique dans une substance ne peut pas être déterminée en observant séparément le mouvement de chacune de ses molécules. Au contraire, ce n'est qu'en étudiant les propriétés macroscopiques de la matière que l'on peut trouver les caractéristiques du mouvement microscopique de nombreuses molécules moyennées sur une certaine période de temps. La température d'une substance est l'indicateur moyen de l'intensité du mouvement des molécules dont l'énergie est l'énérgie thermique substances.
L'un des moyens les plus familiers, mais aussi les moins précis, d'estimer la température est le toucher. En touchant un objet, nous jugeons s'il fait chaud ou froid, en nous concentrant sur nos sensations. Bien sûr, ces sensations dépendent de la température de notre corps, ce qui nous amène au concept d'équilibre thermique - l'un des plus importants dans la mesure de la température.
Équilibre thermique
Équilibre thermique entre les corps A et B
Évidemment, si deux corps A et B sont serrés l'un contre l'autre, alors, après les avoir touchés après un temps suffisamment long, on s'apercevra que leur température est la même. Dans ce cas, les corps A et B sont dits en équilibre thermique l'un avec l'autre. Cependant, les corps, en général, n'ont pas besoin d'être en contact pour qu'un équilibre thermique existe entre eux - il suffit que leurs températures soient les mêmes. Ceci peut être vérifié à l'aide du troisième corps C, en le mettant d'abord en équilibre thermique avec le corps A, puis en comparant les températures des corps C et B. Le corps C joue ici le rôle d'un thermomètre. Dans une formulation stricte, ce principe est appelé la loi zéro de la thermodynamique : si les corps A et B sont en équilibre thermique avec un troisième corps C, alors ces corps sont également en équilibre thermique entre eux. Cette loi sous-tend toutes les méthodes de mesure de la température.
Mesure de température

Échelles de température

thermomètres
Thermomètres basés sur les effets électriques
Si nous voulons effectuer des expériences et des calculs précis, des cotes de température telles que chaud, chaud, frais, froid ne suffisent pas - nous avons besoin d'une échelle de température graduée. Il existe plusieurs échelles de ce type, et les points de congélation et d'ébullition de l'eau sont généralement pris comme points de référence. Les quatre échelles les plus courantes sont présentées dans la figure. L'échelle centigrade, selon laquelle le point de congélation de l'eau correspond à 0°, et le point d'ébullition à 100°, s'appelle l'échelle Celsius du nom de A. Celsius, un astronome suédois qui l'a décrite en 1742. On pense que le Le naturaliste suédois K. Linnaeus a appliqué cette échelle pour la première fois. Aujourd'hui, l'échelle Celsius est la plus répandue au monde. L'échelle de température Fahrenheit, dans laquelle les points de congélation et d'ébullition de l'eau correspondent à des nombres extrêmement inconfortables de 32 et 212 °, a été proposée en 1724 par G. Fahrenheit. L'échelle Fahrenheit est largement utilisée dans les pays anglophones, mais elle est peu utilisée dans la littérature scientifique. Pour convertir la température Celsius (°C) en température Fahrenheit (°F), il existe une formule °F = (9/5)°C + 32, et pour la traduction inverse - la formule °C = (5/9) ( °F-32).
Les deux échelles - Fahrenheit et Celsius - sont très gênantes lors de la réalisation d'expériences dans des conditions où la température descend en dessous du point de congélation de l'eau et est exprimée sous la forme d'un nombre négatif. Pour de tels cas, des échelles de température absolues ont été introduites, qui sont basées sur l'extrapolation au soi-disant zéro absolu - le point auquel le mouvement moléculaire doit s'arrêter. L'une d'elles s'appelle l'échelle de Rankin, et l'autre s'appelle l'échelle thermodynamique absolue ; les températures sont mesurées en degrés Rankine (°R) et kelvins (K). Les deux échelles commencent au zéro absolu et le point de congélation de l'eau correspond à 491,7 ° R et 273,16 K. Le nombre de degrés et de kelvins entre les points de congélation et d'ébullition de l'eau sur l'échelle Celsius et l'échelle thermodynamique absolue est le même et égal à 100 ; pour les échelles Fahrenheit et Rankine, c'est également la même chose, mais égale à 180. Les degrés Celsius sont convertis en kelvins en utilisant la formule K \u003d ° C + 273,16, et les degrés Fahrenheit sont convertis en degrés Rankine en utilisant la formule ° R \u003d ° F + 459,7.
Le fonctionnement des appareils conçus pour mesurer la température repose sur divers phénomènes physiques associés à une modification de l'énergie thermique d'une substance - modifications de la résistance électrique, du volume, de la pression, des caractéristiques radiatives, des propriétés thermoélectriques. L'un des instruments de mesure de température les plus simples et les plus connus est le thermomètre en verre illustré sur la figure. La bille c dans la partie inférieure du thermomètre est placée dans le milieu ou plaquée contre l'objet dont la température doit être mesurée, et selon que la bille reçoit de la chaleur ou dégage, se dilate ou se contracte et que sa colonne monte ou descend dans le capillaire. Si le thermomètre est pré-calibré et équipé d'une échelle, vous pouvez alors connaître directement la température corporelle.
Un autre dispositif dont l'action est basée sur la dilatation thermique est le thermomètre bimétallique représenté sur la figure. Son élément principal est une plaque en spirale de deux métaux soudés avec différents coefficients de dilatation thermique. Lorsqu'il est chauffé, l'un des métaux se dilate plus que l'autre, la spirale se tord et fait tourner la flèche par rapport à l'échelle. De tels appareils sont souvent utilisés pour mesurer la température de l'air intérieur et extérieur, mais ils ne conviennent pas pour déterminer la température locale.
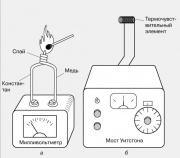
La température locale est généralement mesurée à l'aide d'un thermocouple, qui est constitué de deux fils de métaux différents soudés à une extrémité. Lorsqu'une telle jonction est chauffée, une FEM apparaît aux extrémités libres des fils, généralement de quelques millivolts. Les thermocouples sont fabriqués à partir de différentes paires de métaux : fer et constantan, cuivre et constantan, chromel et alumel. Leur thermo-EMF change presque linéairement avec la température sur une large plage de températures.
Un autre effet thermoélectrique est également connu - la dépendance de la résistance d'un matériau conducteur à la température. Il sous-tend le fonctionnement des thermomètres à résistance électrique, dont l'un est représenté sur la figure. La résistance d'un petit élément de détection de température (thermocouple) - généralement des bobines de fil fin - est comparée à la résistance d'une résistance variable calibrée utilisant un pont de Wheatstone. L'instrument de sortie peut être gradué directement en degrés.
Les pyromètres optiques sont utilisés pour mesurer la température des corps chauds qui émettent de la lumière visible. Dans une version de ce dispositif, la lumière émise par le corps est comparée au rayonnement d'un filament de lampe à incandescence placé dans le plan focal des jumelles à travers lesquelles on regarde le corps émetteur. Le courant électrique, chauffant le filament de la lampe, est modifié jusqu'à ce que, en comparant visuellement la lueur du filament et du corps, on constate qu'un équilibre thermique s'est établi entre eux. L'échelle de l'appareil peut être graduée directement en unités de température.
Avancées techniques ces dernières années permis de créer de nouveaux capteurs de température. Par exemple, dans les cas où une sensibilité particulièrement élevée est nécessaire, au lieu d'un thermocouple ou d'un thermomètre à résistance conventionnel, un dispositif à semi-conducteur est utilisé - thermistance. Les colorants et les cristaux liquides qui changent d'état de phase sont également utilisés comme convertisseurs thermiques, en particulier dans les cas où la température de surface du corps varie sur une large plage. Enfin, la thermographie infrarouge est utilisée, dans laquelle une image infrarouge d'un objet est obtenue en couleurs conditionnelles, où chaque couleur correspond à une certaine température. Cette méthode de mesure de la température trouve l'application la plus large - de diagnostic médical avant de vérifier l'isolation thermique des locaux.
Mesurer la quantité de chaleur
calorimètre à eau
L'énergie thermique (quantité de chaleur) d'un corps peut être mesurée directement avec un soi-disant calorimètre ; Une version simple d'un tel dispositif est représentée sur la figure. Il s'agit d'un récipient fermé soigneusement isolé, équipé de dispositifs de mesure de la température à l'intérieur et parfois rempli d'un fluide de travail aux propriétés connues, comme l'eau. Pour mesurer la quantité de chaleur dans un petit corps chauffé, il est placé dans un calorimètre et attend que le système entre en équilibre thermique. La quantité de chaleur transférée au calorimètre (plus précisément à l'eau qui le remplit) est déterminée par l'augmentation de la température de l'eau.
La quantité de chaleur dégagée lors d'une réaction chimique, comme la combustion, peut être mesurée en plaçant une petite<бомбу>. À<бомбе>un échantillon est localisé, auquel des fils électriques pour l'allumage sont connectés, et la quantité d'oxygène correspondante. Une fois que l'échantillon a complètement brûlé et que l'équilibre thermique est établi, il est déterminé de combien la température de l'eau dans le calorimètre a augmenté, et donc la quantité de chaleur dégagée.
Unités de chauffage
La chaleur est une forme d'énergie et doit donc être mesurée en unités d'énergie. Dans le système SI international, l'unité d'énergie est le joule (J). Il est également permis d'utiliser des unités hors système de la quantité de chaleur - calories: une calorie internationale est de 4,1868 J, une calorie thermochimique est de 4,1840 J. Dans les laboratoires étrangers, les résultats de la recherche sont souvent exprimés à l'aide de ce qu'on appelle. Une calorie de 15 degrés égale à 4,1855 J. Le British Thermal Unit (BTU) hors système tombe en désuétude : BTU moy = 1,055 J.
Sources de chaleur
Les principales sources de chaleur sont les réactions chimiques et nucléaires, ainsi que divers processus de conversion d'énergie. Des exemples de réactions chimiques avec dégagement de chaleur sont la combustion et la dégradation des composants alimentaires. La quasi-totalité de la chaleur reçue par la Terre est fournie par des réactions nucléaires se produisant dans les profondeurs du Soleil. L'humanité a appris à obtenir de la chaleur à l'aide de processus contrôlés de fission nucléaire, et maintenant elle essaie d'utiliser des réactions de fusion thermonucléaire dans le même but. D'autres types d'énergie peuvent également être convertis en chaleur, comme le travail mécanique et l'énergie électrique. Il est important de se rappeler que l'énergie thermique (comme toute autre) ne peut être convertie que sous une autre forme, mais ne peut pas être obtenue.<из ничего>, ni détruire. C'est l'un des principes de base de la science appelée thermodynamique.
Thermodynamique
Thermodynamique est la science des relations entre la chaleur, le travail et la matière. Les idées modernes sur ces relations se sont formées sur la base des travaux de grands scientifiques du passé tels que Carnot, Clausius, Gibbs, Joule, Kelvin et d'autres.La thermodynamique explique la signification de la capacité calorifique et de la conductivité thermique d'une substance, la la dilatation thermique des corps et la chaleur des transitions de phase. Cette science est basée sur plusieurs lois - principes établis expérimentalement.
Chaleur et propriétés des substances
Substances diverses avoir une capacité différente à accumuler de l'énergie thermique; cela dépend de leur structure moléculaire et de leur densité. La quantité de chaleur nécessaire pour élever d'un degré la température d'une unité de masse d'une substance s'appelle sa capacité thermique spécifique. La capacité calorifique dépend des conditions dans lesquelles se trouve la substance. Par exemple, pour chauffer un gramme d'air dans un ballon de 1 K, il faut plus de chaleur que pour le chauffer de la même manière dans un récipient étanche à parois rigides, car une partie de l'énergie transmise au ballon est dépensée pour dilater le l'air, et non en le chauffant. Ainsi, en particulier, la capacité calorifique des gaz est mesurée séparément à pression constante et à volume constant.
Avec une augmentation de la température, l'intensité du mouvement chaotique des molécules augmente - la plupart des substances se dilatent lorsqu'elles sont chauffées. Le degré d'expansion d'une substance avec une augmentation de température de 1 K est appelé coefficient de dilatation thermique.
Pour qu'une substance passe d'un état de phase à un autre, par exemple de solide à liquide (et parfois immédiatement à gazeux), elle doit recevoir une certaine quantité de chaleur. Si chauffé solide, alors sa température augmentera jusqu'à ce qu'il commence à fondre; jusqu'à ce que la fusion soit terminée, la température du corps restera constante malgré l'apport de chaleur. La quantité de chaleur nécessaire pour faire fondre une unité de masse d'une substance s'appelle la chaleur de fusion. Si vous continuez à fournir de la chaleur, la substance fondue chauffera jusqu'à ébullition. La quantité de chaleur nécessaire pour vaporiser une unité de masse d'un liquide à une température donnée est appelée la chaleur de vaporisation.
Le rôle de la chaleur et son utilisation
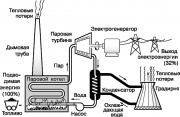
Schéma de fonctionnement d'une centrale électrique à turbine à vapeur
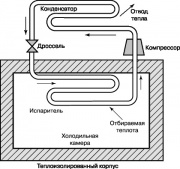
Diagramme du cycle de réfrigération
Les processus globaux de transfert de chaleur ne se réduisent pas au réchauffement de la Terre par le rayonnement solaire. Les courants de convection massifs dans l'atmosphère déterminent les changements quotidiens des conditions météorologiques dans le monde entier. Les différences de température dans l'atmosphère entre les régions équatoriales et polaires, ainsi que les forces de Coriolis dues à la rotation de la Terre, conduisent à l'apparition de courants de convection en constante évolution, tels que les alizés, les courants-jets et les fronts chauds et froids.
Le transfert de chaleur (dû à la conductivité thermique) du noyau en fusion de la Terre vers sa surface entraîne des éruptions volcaniques et l'apparition de geysers. Dans certaines régions, l'énergie géothermique est utilisée pour le chauffage des locaux et la production d'électricité.
La chaleur est un participant indispensable dans presque tous procédés de fabrication. Nous mentionnerons les plus importants d'entre eux, tels que la fonte et le traitement des métaux, le fonctionnement des moteurs, la production alimentaire, la synthèse chimique, le raffinage du pétrole, la fabrication d'une grande variété d'articles - des briques et de la vaisselle aux voitures et aux appareils électroniques. .
De nombreuses productions et transports industriels, ainsi que des centrales thermiques, ne pourraient pas fonctionner sans moteurs thermiques - des appareils qui convertissent la chaleur en travail utile. Des exemples de telles machines sont les compresseurs, les turbines, les moteurs à vapeur, à essence et à réaction.
L'un des moteurs thermiques les plus connus est la turbine à vapeur, qui met en œuvre une partie du cycle de Rankine utilisé dans les centrales électriques modernes. Un schéma simplifié de ce cycle est représenté sur la figure. Le fluide de travail - l'eau - est converti en vapeur surchauffée dans une chaudière à vapeur chauffée par la combustion de combustibles fossiles (charbon, pétrole ou gaz naturel). Vapeur élevée
Gasovik - équipements à gaz industriels Répertoire de GOST, SNiP, PB Unités de grandeurs physiques, concepts physico-chimiques, rapports, composition et caractéristiques des gaz
Unités de mesure de la température et de la quantité de chaleur
L'unité de base de mesure de la température était le degré de l'échelle internationale de température, qui correspond pratiquement au degré Celsius. Cette valeur est égale à 1/100 de l'intervalle de température entre 0 et 100°C, c'est-à-dire entre les points de fusion de la glace et de l'eau bouillante à une pression de 760 mm Hg. Art.
La température absolue est la température mesurée à partir du zéro absolu, c'est-à-dire à partir de -273,16 °C, et mesurée en degrés Kelvin (°K). Le degré Kelvin est le même que le degré Celsius. Par conséquent, la température absolue est exprimée en degrés centigrades comme suit :
T, °K = t, °C + 273,16
Dans le système SI, l'unité de température est le Kelvin. Il est permis d'exprimer les résultats pratiques des mesures de température en utilisant le degré Celsius avec le degré Kelvin, en fonction de l'origine (position du zéro) sur l'échelle.
Exemple: 250 ±5 °С = 523,16 ±5 °K.
Dans le système SI, le travail, l'énergie et la chaleur sont mesurés en joules (J). Parfois, une unité plus grande et plus pratique à des fins pratiques est utilisée - un kilojoule (kJ), égal à 1000 J. Une unité de travail en SI est le travail effectué par une force de 1 N à un déplacement de 1 m. quantité physique montrant combien de travail le corps peut faire.
Les calories et les kilocalories peuvent être utilisées comme unités de chaleur hors système. Une calorie est la quantité de chaleur nécessaire pour élever la température de 1 gramme d'eau de 1°C (19,5 à 20,5°C).
1 cal (calorie) = 4,1868 J ;
1 kcal (kilocalorie) \u003d 1000 cal \u003d 4186,8 J \u003d 4,187 kJ;
1 Mcal (mégacalorie) \u003d 10 6 cal \u003d 4,1868 MJ;
1 Gcal (gigacalorie) \u003d 10 9 cal \u003d 4186,8 MJ.
À titre de comparaison, lors de l'évaluation du carburant, on utilise la chaleur dite conditionnelle, dont le pouvoir calorifique pour le calcul est supposé être conditionnellement égal à 7 Mcal/kg ou 7 Gcal/t. Dans de tels cas, on parle respectivement de 1 kg ou 1 tonne de carburant standard (t.c.f.).
La chaleur joue un rôle important dans la vie humaine, notamment dans le fonctionnement de son corps. Une partie de l'énergie chimique contenue dans les aliments est convertie en chaleur, grâce à laquelle la température corporelle est maintenue près de 37
° C. Le bilan thermique du corps humain dépend également de la température ambiante, et les gens sont obligés de dépenser beaucoup d'énergie pour chauffer les locaux résidentiels et industriels en hiver et les refroidir en été. La majeure partie de cette énergie est fournie par des moteurs thermiques, tels que les chaudières et les turbines à vapeur des centrales électriques qui fonctionnent aux combustibles fossiles (charbon, pétrole) et produisent de l'électricité.Jusqu'à la fin du XVIIIe siècle. la chaleur était considérée comme une substance matérielle, estimant que la température d'un corps est déterminée par la quantité de "liquide calorique" ou "calorique" qu'il contient. Plus tard, B. Rumford, J. Joule et d'autres physiciens de l'époque, par des expériences et des raisonnements ingénieux, ont réfuté la théorie "calorique", prouvant que la chaleur est sans poids et qu'elle peut être obtenue en n'importe quelle quantité simplement grâce au mouvement mécanique. La chaleur elle-même n'est pas une substance, c'est juste l'énergie du mouvement de ses atomes ou molécules. C'est à cette compréhension de la chaleur que la physique moderne adhère. voir également LA PHYSIQUE.
Dans cet article, nous verrons comment la chaleur et la température sont liées et comment ces quantités sont mesurées. Le sujet de notre discussion sera également les questions suivantes : le transfert de chaleur d'une partie du corps à une autre ; transfert de chaleur dans le vide (un espace qui ne contient pas de matière); le rôle de la chaleur dans le monde moderne.
CHALEUR ET TEMPÉRATURE La quantité d'énergie thermique dans une substance ne peut pas être déterminée en observant séparément le mouvement de chacune de ses molécules. Au contraire, ce n'est qu'en étudiant les propriétés macroscopiques de la matière que l'on peut trouver les caractéristiques du mouvement microscopique de nombreuses molécules moyennées sur une certaine période de temps. La température d'une substance est un indicateur moyen de l'intensité du mouvement des molécules, dont l'énergie est l'énergie thermique d'une substance.L'un des moyens les plus familiers, mais aussi les moins précis, d'évaluer la température au toucher. En touchant un objet, nous jugeons s'il fait chaud ou froid, en nous concentrant sur nos sensations. Bien entendu, ces sensations dépendent de la température de notre corps, ce qui nous amène au concept d'équilibre thermique, l'un des plus importants dans la mesure de la température.
Bilan thermique. Évidemment, si deux corps Un et B (Fig. 1) étroitement serrés les uns contre les autres, puis, les ayant touchés après un temps suffisamment long, nous remarquerons que leur température est la même. Dans ce cas, les corps sont dits Un et B sont en équilibre thermique entre eux. Or, les corps, d'une manière générale, n'ont pas besoin d'être en contact pour qu'un équilibre thermique existe entre eux, il suffit que leurs températures soient les mêmes. Ceci peut être vérifié en utilisant le troisième corps C , le mettant d'abord en équilibre thermique avec le corps UN , puis en comparant les températures des corps C et b. Corps C joue ici le rôle d'un thermomètre. Dans une formulation stricte, ce principe est appelé la loi zéro de la thermodynamique : si les corps A et B sont en équilibre thermique avec un troisième corps C, alors ces corps sont également en équilibre thermique entre eux. Cette loi sous-tend toutes les méthodes de mesure de la température.Mesure de température. Si nous voulons mener des expériences et des calculs précis, alors des cotes de température telles que chaud, chaud, frais, froid ne suffisent pas, nous avons besoin d'une échelle de température graduée. Il existe plusieurs échelles de ce type, et les points de congélation et d'ébullition de l'eau sont généralement pris comme points de référence. Les quatre échelles les plus courantes sont illustrées à la fig. 2. Échelle centigrade, selon laquelle le point de congélation de l'eau correspond à 0° , et le point d'ébullition est de 100° , est appelée l'échelle Celsius du nom de A. Celsius, un astronome suédois qui l'a décrite en 1742. On pense que le naturaliste suédois K. Linney a été le premier à utiliser cette échelle. Aujourd'hui, l'échelle Celsius est la plus répandue au monde. L'échelle de température Fahrenheit, dans laquelle les points de congélation et d'ébullition de l'eau correspondent aux nombres extrêmement inconfortables 32 et 212° , a été proposé en 1724 par G. Fahrenheit. L'échelle Fahrenheit est largement utilisée dans les pays anglophones, mais elle est peu utilisée dans la littérature scientifique. Pour convertir la température en degrés Celsius (° C) à la température Fahrenheit (° F) il existe une formule° F = (9/5) ° C + 32, et pour la formule de traduction inverse°C = (5/9)(°F - 32). Les deux échelles, Fahrenheit et Celsius, sont très gênantes lors de la réalisation d'expériences dans des conditions où la température descend en dessous du point de congélation de l'eau et est exprimée sous la forme d'un nombre négatif. Pour de tels cas, des échelles de température absolues ont été introduites, qui sont basées sur l'extrapolation au soi-disant zéro absolu, le point auquel le mouvement moléculaire doit s'arrêter. L'une d'elles s'appelle l'échelle de Rankin, et l'autre s'appelle l'échelle thermodynamique absolue ; les températures sont mesurées en degrés Rankine (° R) et kelvins (K). Les deux échelles commencent au zéro absolu et le point de congélation de l'eau est de 491,7° R et 273,16 K. Le nombre de degrés et de kelvins entre les points de congélation et d'ébullition de l'eau sur l'échelle Celsius et l'échelle thermodynamique absolue est le même et égal à 100 ; pour les échelles Fahrenheit et Rankine, c'est également la même chose, mais égale à 180. Les degrés Celsius sont convertis en kelvins à l'aide de la formule K \u003d° C + 273,16, et degrés Fahrenheit en degrés Rankine en utilisant la formule°R = °F + 459,7. Le fonctionnement des appareils destinés à mesurer la température repose sur divers phénomènes physiques associés à une modification de l'énergie thermique d'une substance, des modifications de la résistance électrique, du volume, de la pression, des caractéristiques radiatives et des propriétés thermoélectriques. L'un des instruments les plus simples et les plus connus pour mesurer la température est le thermomètre à mercure dans le verre illustré à la fig. 3, un. La boule de mercure dans la partie inférieure du thermomètre est placée dans le milieu ou pressée contre l'objet dont la température doit être mesurée, et selon que la boule reçoit de la chaleur ou en dégage, le mercure se dilate ou se contracte et sa colonne monte ou tombe dans le capillaire. Si le thermomètre est pré-calibré et équipé d'une échelle, vous pouvez alors connaître directement la température corporelle.Un autre dispositif dont le fonctionnement est basé sur la dilatation thermique est le thermomètre bimétallique illustré à la fig.
3, b. Son élément principal plaque en spirale de deux métaux soudés avec différents coefficients de dilatation thermique. Lorsqu'il est chauffé, l'un des métaux se dilate plus que l'autre, la spirale se tord et fait tourner la flèche par rapport à l'échelle. De tels appareils sont souvent utilisés pour mesurer la température de l'air intérieur et extérieur, mais ils ne conviennent pas pour déterminer la température locale.La température locale est généralement mesurée à l'aide d'un thermocouple, qui est constitué de deux fils de métaux différents soudés à une extrémité (Fig.
4, un). Lorsqu'une telle jonction est chauffée, une force électromotrice apparaît aux extrémités libres des fils, généralement de quelques millivolts. Les thermocouples sont fabriqués à partir de différentes paires de métaux : fer et constantan, cuivre et constantan, chromel et alumel. Leur thermo-EMF change presque linéairement avec la température sur une large plage de températures.Un autre effet thermoélectrique est également connu - la dépendance de la résistance d'un matériau conducteur à la température. Il sous-tend le fonctionnement des thermomètres à résistance électrique, dont l'un est illustré à la Fig.
4, b. La résistance d'un petit élément sensible à la température (capteur thermique), généralement des bobines de fil fin, est comparée à la résistance d'une résistance variable calibrée à l'aide d'un pont de Wheatstone. L'instrument de sortie peut être gradué directement en degrés.Les pyromètres optiques sont utilisés pour mesurer la température des corps incandescents qui émettent de la lumière visible. Dans une version de ce dispositif, la lumière émise par le corps est comparée au rayonnement d'un filament de lampe à incandescence placé dans le plan focal des jumelles à travers lesquelles on regarde le corps émetteur. Le courant électrique qui chauffe le filament de la lampe est modifié jusqu'à ce qu'une comparaison visuelle de la lueur du filament et du corps révèle qu'un équilibre thermique a été établi entre eux. L'échelle de l'appareil peut être graduée directement en unités de température.
Les progrès techniques de ces dernières années ont permis de créer de nouveaux capteurs de température. Par exemple, dans les cas où une sensibilité particulièrement élevée est nécessaire, un dispositif semi-conducteur, la thermistance, est utilisé à la place d'un thermocouple ou d'un thermomètre à résistance conventionnel. Les colorants et les cristaux liquides qui changent d'état de phase sont également utilisés comme convertisseurs thermiques, en particulier dans les cas où la température de surface du corps varie sur une large plage. Enfin, la thermographie infrarouge est utilisée, dans laquelle une image infrarouge d'un objet est obtenue en couleurs conditionnelles, où chaque couleur correspond à une certaine température. Cette méthode de mesure de la température trouve l'application la plus large, du diagnostic médical à la vérification de l'isolation thermique des pièces. voir également PHYSIQUE DE L'ÉTAT SOLIDE ; LIQUIDE CRYSTAL.
Mesure de la quantité de chaleur. L'énergie thermique (quantité de chaleur) d'un corps peut être mesurée directement avec un soi-disant calorimètre ; Une version simple d'un tel dispositif est illustrée à la Fig. 5. Il s'agit d'un récipient fermé soigneusement isolé, équipé de dispositifs de mesure de la température à l'intérieur et parfois rempli d'un fluide de travail aux propriétés connues, comme l'eau. Pour mesurer la quantité de chaleur dans un petit corps chauffé, il est placé dans un calorimètre et attend que le système entre en équilibre thermique. La quantité de chaleur transférée au calorimètre (plus précisément à l'eau qui le remplit) est déterminée par l'augmentation de la température de l'eau.La quantité de chaleur dégagée lors d'une réaction chimique, comme la combustion, peut être mesurée en plaçant une petite "bombe" dans le calorimètre. La "bombe" contient un échantillon, auquel des fils électriques sont connectés pour l'allumage, et la quantité correspondante d'oxygène. Une fois que l'échantillon a complètement brûlé et que l'équilibre thermique est établi, il est déterminé de combien la température de l'eau dans le calorimètre a augmenté, et donc la quantité de chaleur dégagée. voir également CALORIMÉTRIE.
Unités de chauffage. La chaleur est une forme d'énergie et doit donc être mesurée en unités d'énergie. Dans le système SI international, l'unité d'énergie est le joule (J). Il est également permis d'utiliser des unités non systémiques de la quantité de calories calorifiques: une calorie internationale est de 4,1868 J, une calorie thermochimique est de 4,1840 J. Dans les laboratoires étrangers, les résultats de la recherche sont souvent exprimés à l'aide de ce qu'on appelle. Une calorie de 15 degrés égale à 4,1855 J. Le British Thermal Unit (BTU) hors système tombe en désuétude : BTU moy = 1,055 J. Les principales sources de chaleur sont les réactions chimiques et nucléaires, ainsi que divers processus de conversion d'énergie. Des exemples de réactions chimiques avec dégagement de chaleur sont la combustion et la dégradation des composants alimentaires. La quasi-totalité de la chaleur reçue par la Terre est fournie par des réactions nucléaires se produisant dans les profondeurs du Soleil. L'humanité a appris à obtenir de la chaleur à l'aide de processus contrôlés de fission nucléaire, et maintenant elle essaie d'utiliser des réactions de fusion thermonucléaire dans le même but. D'autres types d'énergie peuvent également être convertis en chaleur, comme le travail mécanique et l'énergie électrique. Il est important de rappeler que l'énergie thermique (comme toute autre) ne peut être transformée que sous une autre forme, mais elle ne peut être ni obtenue « à partir de rien » ni détruite. C'est l'un des principes de base de la science appelée thermodynamique. THERMODYNAMIQUE La thermodynamique est la science des relations entre la chaleur, le travail et la matière. Les idées modernes sur ces relations se sont formées sur la base des travaux de grands scientifiques du passé tels que Carnot, Clausius, Gibbs, Joule, Kelvin et d'autres.La thermodynamique explique la signification de la capacité calorifique et de la conductivité thermique d'une substance, la la dilatation thermique des corps et la chaleur des transitions de phase. Cette science est basée sur plusieurs principes de lois établis expérimentalement.Débuts de la thermodynamique. La loi zéro de la thermodynamique formulée ci-dessus introduit les notions d'équilibre thermique, de température et de thermométrie. La première loi de la thermodynamique est une affirmation d'une importance capitale pour toute la science dans son ensemble : l'énergie ne peut être ni détruite ni obtenue "à partir de rien", de sorte que l'énergie totale de l'Univers est une valeur constante. Dans sa forme la plus simple, la première loi de la thermodynamique peut s'énoncer comme suit : l'énergie que le système reçoit, moins l'énergie qu'il cède, est égale à l'énergie restant dans le système. À première vue, cette affirmation semble évidente, mais pas dans un tel cas, par exemple, des situations comme la combustion de l'essence dans les cylindres d'un moteur automobile : ici l'énergie reçue est chimique, l'énergie dégagée est mécanique (travail) et l'énergie restant dans le système est thermique.Ainsi, il est clair que l'énergie peut changer d'une forme à une autre et que de telles transformations se produisent constamment dans la nature et la technologie. Il y a plus de cent ans, J. Joule l'a prouvé pour le cas de la conversion d'énergie mécanique en énergie thermique à l'aide du dispositif de la fig. 6, un. Dans cet appareil, des poids descendants et ascendants faisaient tourner un arbre avec des pales dans un calorimètre rempli d'eau, à la suite de quoi l'eau était chauffée. Des mesures précises ont permis à Joule de déterminer qu'une calorie de chaleur équivaut à 4,186 J de travail mécanique. Le dispositif représenté sur la fig.
6, b, a été utilisé pour déterminer l'équivalent thermique de l'énergie électrique.La première loi de la thermodynamique explique de nombreux phénomènes courants. Par exemple, il devient clair pourquoi il est impossible de refroidir la cuisine avec un réfrigérateur ouvert. Supposons que nous ayons isolé thermiquement la cuisine de l'environnement. L'énergie est continuellement fournie au système par le câble d'alimentation du réfrigérateur, mais le système ne dégage aucune énergie. Ainsi, son énergie totale augmente, et la cuisine devient plus chaude : il suffit de toucher les tubes de l'échangeur de chaleur (condenseur) à l'arrière du réfrigérateur, et vous comprendrez son inutilité en tant qu'appareil de « refroidissement ». Mais si ces tuyaux étaient sortis du système (par exemple, par la fenêtre), la cuisine donnerait plus d'énergie qu'elle n'en recevrait, c'est-à-dire serait refroidi et le réfrigérateur fonctionnait comme un climatiseur de fenêtre.
La première loi de la thermodynamique est une loi de la nature qui empêche la création ou la destruction d'énergie. Cependant, cela ne dit rien sur la façon dont les processus de transfert d'énergie se déroulent dans la nature. Ainsi, nous savons qu'un corps chaud réchauffera un corps froid si ces corps sont mis en contact. Mais un corps froid peut-il à lui seul transférer sa réserve de chaleur à un corps chaud ? Dernière opportunité catégoriquement rejetée par la seconde loi de la thermodynamique.
La première loi exclut également la possibilité de créer un moteur avec un coefficient action utile(rendement) supérieur à 100 % (similaire
" éternel " le moteur pourrait dégager plus d'énergie pendant un temps arbitrairement long qu'il n'en consomme). Il est impossible de construire un moteur même avec un rendement égal à 100%, car une partie de l'énergie qui lui est fournie doit nécessairement être perdue par lui sous forme d'énergie thermique moins utile. Ainsi, la roue ne tournera pas indéfiniment sans apport d'énergie, car en raison du frottement dans les roulements, l'énergie du mouvement mécanique se transformera progressivement en chaleur jusqu'à ce que la roue s'arrête.La tendance à transformer un travail "utile" en chaleur énergétique moins utile peut être comparée à un autre processus qui se produit lorsque deux récipients contenant des gaz différents sont connectés. Après une attente assez longue, on trouve dans les deux vases un mélange homogène de gaz que la nature agit de telle sorte que l'ordre du système diminue. La mesure thermodynamique de ce désordre s'appelle l'entropie, et la deuxième loi de la thermodynamique peut être formulée différemment : les processus dans la nature se déroulent toujours de telle manière que l'entropie du système et de son environnement augmente. Ainsi, l'énergie de l'Univers reste constante, tandis que son entropie ne cesse de croître.
Chaleur et propriétés des substances. Différentes substances ont une capacité différente à stocker l'énergie thermique; cela dépend de leur structure moléculaire et de leur densité. La quantité de chaleur nécessaire pour élever d'un degré la température d'une unité de masse d'une substance est appelée son chaleur spécifique. La capacité calorifique dépend des conditions dans lesquelles se trouve la substance. Par exemple, pour chauffer un gramme d'air dans un ballon de 1 K, il faut plus de chaleur que pour le chauffer de la même manière dans un récipient étanche à parois rigides, car une partie de l'énergie transmise au ballon est dépensée pour dilater le l'air, et non en le chauffant. Ainsi, en particulier, la capacité calorifique des gaz est mesurée séparément à pression constante et à volume constant.Avec une augmentation de la température, l'intensité du mouvement chaotique des molécules augmente, la plupart des substances se dilatent lorsqu'elles sont chauffées. Le degré de dilatation d'une substance avec une augmentation de température de 1 K est appelé coefficient de dilatation thermique.
Pour qu'une substance passe d'un état de phase à un autre, par exemple de solide à liquide (et parfois immédiatement à gazeux), elle doit recevoir une certaine quantité de chaleur. Si un corps solide est chauffé, sa température augmentera jusqu'à ce qu'il commence à fondre ; jusqu'à ce que la fusion soit terminée, la température du corps restera constante, malgré l'apport de chaleur. La quantité de chaleur nécessaire pour faire fondre une unité de masse d'une substance s'appelle la chaleur de fusion. Si vous continuez à fournir de la chaleur, la substance fondue chauffera jusqu'à ébullition. La quantité de chaleur nécessaire pour vaporiser une unité de masse d'un liquide à une température donnée est appelée la chaleur de vaporisation.
Théorie moléculaire-cinétique. La théorie de la cinétique moléculaire explique les propriétés macroscopiques d'une substance en considérant au niveau microscopique le comportement des atomes et des molécules qui composent cette substance. Dans ce cas, une approche statistique est utilisée et certaines hypothèses sont faites sur les particules elles-mêmes et la nature de leur mouvement. Ainsi, les molécules sont considérées comme des boules solides qui, dans les milieux gazeux, sont en mouvement chaotique continu et parcourent des distances considérables d'une collision à l'autre. Les collisions sont considérées comme élastiques et se produisent entre des particules dont la taille est petite et le nombre est très grand. Aucun des gaz réels ne correspond exactement à ce modèle, mais la plupart des gaz en sont assez proches, ce qui explique la valeur pratique de la théorie de la cinétique moléculaire.Sur la base de ces idées et en utilisant une approche statistique, Maxwell a dérivé la distribution des vitesses des molécules de gaz dans un volume limité, qui a ensuite été nommé en son honneur. Cette distribution est présentée graphiquement dans la fig. 7 pour une masse donnée d'hydrogène à des températures de 100 et 1000
° C. L'ordonnée représente le nombre de molécules se déplaçant à la vitesse indiquée en abscisse. Le nombre total de particules est égal à l'aire sous chaque courbe et est le même dans les deux cas. On peut voir sur le graphique que la plupart des particules ont des vitesses proches d'une certaine valeur moyenne, et seul un petit nombre d'entre elles ont des vitesses très élevées ou faibles. Les vitesses moyennes à ces températures se situent entre 2000 et 3000 m/s, c'est-à-dire très grand.Un grand nombre de ces molécules de gaz en mouvement rapide agissent avec une force complètement mesurable sur les corps environnants. Les forces microscopiques avec lesquelles de nombreuses molécules de gaz frappent les parois du récipient s'ajoutent à une quantité macroscopique appelée pression. Lorsque de l'énergie est fournie à un gaz (la température augmente), l'énergie cinétique moyenne de ses molécules augmente, les particules de gaz frappent les parois plus souvent et plus fort, la pression augmente et si les parois ne sont pas complètement rigides, elles s'étirent et le le volume de gaz augmente. Ainsi, l'approche statistique microscopique sous-jacente à la théorie de la cinétique moléculaire permet d'expliquer le phénomène de dilatation thermique dont nous avons parlé.
Un autre résultat de la théorie de la cinétique moléculaire est une loi qui décrit les propriétés d'un gaz qui satisfait aux exigences énumérées ci-dessus. C'est ce qu'on appelle l'équation d'état gaz parfait relie la pression, le volume et la température d'une mole de gaz et a la forme d'égalité
PV = RT où P pression, Volume V, J température, et R constante de gaz universelle égale à (8,31441± 0,00026) J/(mol H À). voir également THÉORIE MOLÉCULAIRE-CINÉTIQUE ; THERMODYNAMIQUE. TRANSFERT DE CHALEUR Le transfert de chaleur est le processus de transfert de chaleur à l'intérieur d'un corps ou d'un corps à un autre, en raison d'une différence de température. L'intensité du transfert de chaleur dépend des propriétés de la substance, de la différence de température et obéit aux lois de la nature établies expérimentalement. Pour créer des systèmes de chauffage ou de refroidissement efficaces, divers moteurs, centrales électriques, systèmes d'isolation thermique, vous devez connaître les principes du transfert de chaleur. Dans certains cas, l'échange de chaleur n'est pas souhaitable (isolation thermique des fours de fusion, des vaisseaux spatiaux, etc.), tandis que dans d'autres, il doit être le plus important possible (chaudières à vapeur, échangeurs de chaleur, ustensiles de cuisine).Il existe trois principaux types de transfert de chaleur : la conduction, la convection et le transfert de chaleur rayonnante.
Conductivité thermique. S'il y a une différence de température à l'intérieur du corps, l'énergie thermique passe de sa partie la plus chaude à la plus froide. Ce type de transfert de chaleur, dû aux mouvements thermiques et aux collisions de molécules, est appelé conductivité thermique ; assez hautes températures dans les solides, il peut être observé visuellement. Ainsi, lorsqu'une tige d'acier est chauffée à partir d'une extrémité dans la flamme d'un brûleur à gaz, l'énergie thermique est transférée à travers la tige et une lueur se propage à une certaine distance de l'extrémité chauffée (de moins en moins intense avec la distance du lieu de chauffage).L'intensité du transfert de chaleur dû à la conductivité thermique dépend du gradient de température, c'est-à-dire rapports
ré T/D X différence de température aux extrémités de la tige à la distance qui les sépare. Cela dépend également de la section transversale de la tige (en m 2 ) et la conductivité thermique du matériau[ dans les unités correspondantes W/(m Ch K) ] . La relation entre ces quantités a été dérivée par le mathématicien français J. Fourier et a la forme suivante : où q flux de chaleur, k coefficient de conductivité thermique, et UN zone transversale. Cette relation est appelée loi de Fourier sur la conduction thermique ; le signe moins indique que la chaleur est transférée dans la direction opposée au gradient de température.Il découle de la loi de Fourier que le flux de chaleur peut être réduit en réduisant l'une des grandeurs que sont le coefficient de conductivité thermique, la surface ou le gradient de température. Pour un bâtiment en conditions hivernales, ces dernières valeurs sont pratiquement constantes, et donc, pour maintenir la température souhaitée dans la pièce, il reste à réduire la conductivité thermique des murs, c'est-à-dire améliorer leur isolation thermique.
Le tableau montre les coefficients de conductivité thermique de certaines substances et matériaux. Le tableau montre que certains métaux conduisent bien mieux la chaleur que d'autres, mais tous sont de bien meilleurs conducteurs de chaleur que l'air et les matériaux poreux.
|
CONDUCTIVITÉ THERMIQUE DE CERTAINES SUBSTANCES ET MATÉRIAUX |
|
|
Substances et matériaux |
Conductivité thermique, W / (m × K) |
| Aluminium | |
| Bronze | |
| Bismuth | |
| Tungstène | |
| Le fer | |
| Or | |
| Cadmium | |
| Magnésium | |
| Cuivre | |
| Arsenic | |
| Nickel | |
| Platine | |
| Mercure | |
| Conduire | |
| Zinc | |
|
Autres matériaux |
|
| Amiante | |
| Béton | |
| Air | |
| Duvet d'eider (lâche) | |
| Noisetier) | |
| Magnésie (MgO) | |
| Sciure | |
| Caoutchouc (éponge) | |
| Mica | |
| Verre | |
| Carbone (graphite) | |
La résistance thermique et électrique de nombreuses substances diminue fortement lorsque la température descend en dessous de la température de l'hélium liquide (1,8 K). Ce phénomène, appelé supraconductivité, est utilisé pour améliorer l'efficacité de nombreux dispositifs, des dispositifs microélectroniques aux lignes électriques et aux gros électroaimants. voir également SUPRACONDUCTIVITÉ.
Convection. Comme nous l'avons déjà dit, lorsque de la chaleur est appliquée à un liquide ou à un gaz, l'intensité du mouvement des molécules augmente et, par conséquent, la pression augmente. Si un liquide ou un gaz n'est pas limité en volume, alors ils se dilatent; la densité locale du liquide (gaz) diminue et, en raison des forces de flottabilité (Archimède), la partie chauffée du fluide monte (c'est pourquoi l'air chaud de la pièce monte des batteries au plafond). Ce phénomène est appelé convection. Afin de ne pas gaspiller la chaleur du système de chauffage pour rien, vous devez utiliser des appareils de chauffage modernes qui assurent une circulation d'air forcée.Le flux de chaleur convectif du réchauffeur vers le milieu chauffé dépend de la vitesse initiale des molécules, de la densité, de la viscosité, de la conductivité thermique et de la capacité thermique, et du milieu; la taille et la forme de l'appareil de chauffage sont également très importantes. Le rapport entre les grandeurs correspondantes obéit à la loi de Newton
q = hA( T W- TҐ ), où q flux de chaleur (mesuré en watts), UN surface de la source de chaleur (en m 2), T W et J température de la source et de son environnement (en kelvins). Coefficient de transfert de chaleur par convection h dépend des propriétés du milieu, de la vitesse initiale de ses molécules, ainsi que de la forme de la source de chaleur, et se mesure en unités de W/(m 2h À).Évaluer
h n'est pas la même pour les cas où l'air autour du radiateur est stationnaire (convection libre) et lorsque le même radiateur est dans le flux d'air (convection forcée). Dans les cas simples d'écoulement de fluide à travers un tuyau ou autour d'une surface plane, le coefficient h peut être calculé théoriquement. Cependant, il n'a pas encore été possible de trouver une solution analytique au problème de la convection pour un écoulement turbulent d'un milieu. La turbulence est un mouvement complexe d'un liquide (gaz), chaotique à une échelle qui dépasse largement les moléculaires.Si un corps chauffé (ou, au contraire, froid) est placé dans un milieu stationnaire ou dans un écoulement, alors des courants convectifs et une couche limite se forment autour de lui. La température, la pression et la vitesse des molécules dans cette couche jouent un rôle important dans la détermination du coefficient de transfert de chaleur par convection.
La convection doit être prise en compte dans la conception des échangeurs de chaleur, des systèmes de climatisation, des avions à grande vitesse et de nombreuses autres applications. Dans tous ces systèmes, la conduction thermique a lieu simultanément avec la convection, à la fois entre les solides et dans leur environnement. À températures élevées Le transfert de chaleur par rayonnement peut également jouer un rôle important.
Transfert de chaleur par rayonnement. Le troisième type de transfert de chaleur par transfert de chaleur par rayonnement diffère de la conduction thermique et de la convection en ce que la chaleur peut dans ce cas être transférée par le vide. Sa similitude avec d'autres méthodes de transfert de chaleur est qu'elle est également due à la différence de température. Le rayonnement thermique est l'un des types un rayonnement électromagnétique. D'autres types de rayonnement radio, ultraviolet et gamma se produisent en l'absence de différence de température.Sur la fig. 8 montre la dépendance de l'énergie du rayonnement thermique (infrarouge) sur la longueur d'onde. Le rayonnement thermique peut s'accompagner de l'émission de lumière visible, mais son énergie est faible par rapport à l'énergie de rayonnement de la partie invisible du spectre.
L'intensité du transfert de chaleur par conduction thermique et convection est proportionnelle à la température, et le flux de chaleur rayonnante est proportionnel à la quatrième puissance de température et obéit à la loi de Stefan Boltzmann
Les espaces résidentiels et de bureaux sont souvent chauffés avec de petits émetteurs de chaleur électriques ; la lueur rougeâtre de leurs spirales est un rayonnement thermique visible proche du bord de la partie infrarouge du spectre. La pièce est chauffée par la chaleur, qui est principalement transportée par la partie infrarouge invisible du rayonnement. Dans les appareils de vision nocturne
^ La caméra utilise une source de rayonnement thermique et un récepteur sensible aux infrarouges qui vous permet de voir dans l'obscurité.Le Soleil est un puissant émetteur d'énergie thermique ; il chauffe la Terre même à une distance de 150 millions de km. L'intensité du rayonnement solaire, enregistrée année après année par des stations situées dans de nombreuses régions du globe, est d'environ 1,37 W
/ m 2 . L'énergie solaire est la source de la vie sur Terre. Des recherches sont en cours pour trouver les moyens de l'utiliser le plus efficacement possible. Des panneaux solaires ont été créés pour chauffer les maisons et produire de l'électricité pour les besoins domestiques. LE RÔLE DE LA CHALEUR ET SON UTILISATION Les processus globaux de transfert de chaleur ne se réduisent pas au réchauffement de la Terre par le rayonnement solaire. Les courants de convection massifs dans l'atmosphère déterminent les changements quotidiens des conditions météorologiques dans le monde entier. Les différences de température dans l'atmosphère entre les régions équatoriales et polaires, ainsi que les forces de Coriolis dues à la rotation de la Terre, conduisent à l'apparition de courants de convection en constante évolution, tels que les alizés, les courants-jets et les fronts chauds et froids. voir également CLIMAT; MÉTÉOROLOGIE ET CLIMATOLOGIE.Le transfert de chaleur (dû à la conductivité thermique) du noyau en fusion de la Terre vers sa surface entraîne des éruptions volcaniques et l'apparition de geysers. Dans certaines régions, l'énergie géothermique est utilisée pour le chauffage des locaux et la production d'électricité.
La chaleur est un participant indispensable dans presque tous les processus de production. Citons les plus importants d'entre eux, tels que la fonte et le traitement des métaux, le fonctionnement des moteurs, la production alimentaire, la synthèse chimique, le raffinage du pétrole, la fabrication d'une grande variété d'objets allant des briques et de la vaisselle aux voitures et aux appareils électroniques.
De nombreuses productions et transports industriels, ainsi que des centrales thermiques, ne pourraient pas fonctionner sans moteurs thermiques - des appareils qui convertissent la chaleur en travail utile. Des exemples de telles machines sont les compresseurs, les turbines, les moteurs à vapeur, à essence et à réaction.
L'un des moteurs thermiques les plus célèbres est la turbine à vapeur, qui met en œuvre une partie du cycle de Rankine utilisé dans les centrales électriques modernes. Un schéma simplifié de ce cycle est représenté sur la fig. 9. L'eau du fluide de travail est convertie en vapeur surchauffée dans une chaudière à vapeur chauffée par la combustion de combustibles fossiles (charbon, pétrole ou gaz naturel). Vapeur haute pression fait tourner l'arbre d'une turbine à vapeur, qui entraîne un générateur qui génère de l'électricité. La vapeur d'échappement se condense lorsqu'elle est refroidie par l'eau courante, qui absorbe une partie de la chaleur non utilisée dans le cycle de Rankine. Ensuite, l'eau est introduite dans la tour de refroidissement (tour de refroidissement), d'où une partie de la chaleur est rejetée dans l'atmosphère. Le condensat est pompé vers la chaudière à vapeur et tout le cycle est répété.
Tous les processus du cycle de Rankine illustrent les principes de la thermodynamique décrits ci-dessus. En particulier, selon la deuxième loi, une partie de l'énergie consommée par la centrale électrique doit être dissipée dans l'environnement sous forme de chaleur. Il s'avère qu'environ 68 % de l'énergie contenue à l'origine dans les combustibles fossiles est ainsi perdue. Une augmentation notable de l'efficacité de la centrale électrique ne pourrait être obtenue qu'en augmentant la température de la chaudière à vapeur (qui est limitée par la résistance à la chaleur des matériaux) ou en abaissant la température du milieu où va la chaleur, c'est-à-dire atmosphère.
Un autre cycle thermodynamique ayant grande importance dans notre Vie courante, est le cycle de réfrigération du compresseur de vapeur de Rankin, dont le schéma est illustré à la fig. 10. Dans les réfrigérateurs et les climatiseurs domestiques, l'énergie est fournie de l'extérieur pour la fournir. Le compresseur augmente la température et la pression de la substance de travail du fréon, de l'ammoniac ou du dioxyde de carbone du réfrigérateur. Le gaz surchauffé est introduit dans le condenseur, où il est refroidi et condensé, dégageant de la chaleur dans l'environnement. Le liquide sortant des buses du condenseur passe à travers la vanne d'étranglement dans l'évaporateur et une partie de celui-ci s'évapore, ce qui s'accompagne d'une forte baisse de température. L'évaporateur prélève la chaleur de la chambre du réfrigérateur, qui chauffe le fluide de travail dans les buses; ce liquide est fourni par le compresseur au condenseur, et le cycle se répète à nouveau.
Le cycle de réfrigération illustré à la fig. 10 peut également être utilisé dans une pompe à chaleur. De telles pompes à chaleur en été dégagent de la chaleur dans l'air atmosphérique chaud et conditionnent la pièce, et en hiver, au contraire, elles prélèvent la chaleur de l'air froid et chauffent la pièce.
Les réactions nucléaires sont une importante source de chaleur à des fins telles que la production d'électricité et le transport. En 1905, A. Einstein a montré que la masse et l'énergie sont liées par la relation
E=mc2 , c'est à dire. peuvent passer l'un dans l'autre. vitesse de la lumière c très grand : 300 000 km/ Avec. Cela signifie que même une petite quantité de matière peut fournir une énorme quantité d'énergie. Ainsi, à partir de 1 kg de matière fissile (par exemple, l'uranium), il est théoriquement possible d'obtenir de l'énergie qui, pendant 1000 jours de fonctionnement continu, est fournie par une centrale électrique d'une capacité de 1 MW. voir également STRUCTURE ATOMIQUE ; FOURS ET TECHNOLOGIE DES FOURS ; UN RAYONNEMENT ÉLECTROMAGNÉTIQUE;ÉCHANGEUR DE CHALEUR; TURBINE; UNITÉS DE MESURE DES GRANDEURS PHYSIQUES.LITTÉRATURE Zemanski M. Températures très élevées et très basses. M., 1968Paul R . Mécanique, acoustique et doctrine de la chaleur. M., 1971
Smorodinsky Ya.A. Température. M., 1981
FanJ. Machines, énergie et entropie. M., 1986
Atkins PV Ordre et désordre dans la nature. M., 1987
Calorimètres liquides
Ce type de calorimètre, le plus utilisé en technologie, est de conception simple et facile à entretenir. La quantité de chaleur produite par une réaction induite de l'extérieur est d'abord transférée au récipient de réaction (dans lequel la réaction a eu lieu) puis au bain liquide. Le liquide dans le bain est continuellement agité au moyen d'une turbine, d'une vis élévatrice ou de pompes, ce qui accélère l'égalisation des températures. Le bain est isolé thermiquement (blindé) de l'environnement autant que possible. Le changement de température du bain liquide est une mesure de la quantité de chaleur détectée. La capacité calorifique des masses à chauffer ne doit pas être trop élevée afin d'assurer un changement de température suffisant et pour que le processus de mesure ne dure pas trop longtemps (ce qui augmente les pertes de chaleur).
Figure Dispositif d'un calorimètre liquide.
Avec des exigences élevées en matière de constance des conditions ambiantes, il est possible de placer l'ensemble du calorimètre dans un autre bain et d'y stabiliser la température avec une grande précision à l'aide d'une boucle de régulation. Cela est nécessaire en premier lieu dans les cas où il est nécessaire de mener une expérience à des températures qui diffèrent sensiblement de la température ambiante.
Pour l'analyse à basse température (jusqu'à environ -150°C), l'azote liquide est utilisé comme fluide de refroidissement. Dans ce cas, il faut faire attention au fait que lors de leur changement, le givre de l'air humide environnant ne se précipite pas sur les échantillons ou les récipients d'échantillons, car sa couche peut affecter le processus de mesure. Pour éviter cela, lorsque le calorimètre est ouvert, l'échantillon et le récipient d'échantillon sont purgés avec de l'azote gazeux froid.
Calorimètres à corps métallique
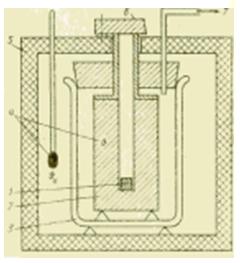
Figure Schéma de l'appareil d'un calorimètre métallique.
S'il est nécessaire de réaliser des études calorimétriques dans une plage de température plus large, alors les calorimètres liquides ne sont plus adaptés. Dans les calorimètres à corps métallique adaptés à cet usage, la quantité de chaleur transférée est absorbée par un bloc métallique (argent, cuivre, aluminium) qui est généralement à température ambiante. Un tel calorimètre est principalement destiné à déterminer la capacité thermique spécifique c, J / (kg * K), les substances liquides et solides.
L'échantillon est d'abord refroidi à l'extérieur du calorimètre dans installation de réfrigération ou chauffé dans un four et, après avoir atteint un état stable, abaissé (tombé) dans un trou dans un bloc de métal. Selon le mode de fonctionnement, un tel dispositif est appelé calorimètre à chute libre et, selon la nature des processus thermodynamiques qu'il contient, il est parfois appelé calorimètre à déplacement.
La quantité de chaleur transférée lors de ce mélange de l'échantillon (avec les paramètres m1, c1, ) au bloc métallique (m2, c2, ) provoque un changement mesurable de la température du bloc. Cela permet de déterminer la valeur généralement inconnue de la capacité calorifique spécifique de l'échantillon pour conditions idéales(en l'absence d'échange de chaleur avec le milieu) de l'expression :
Le bloc métallique lui-même est situé dans un vase Dewar sous vide, et parfois dans un bain liquide. Dans ce dernier cas, pour obtenir la capacité calorifique du calorimètre Ck, il faut ajouter la capacité calorifique du bain Cw à la capacité calorifique du bloc métallique C2 :
CK=C2+CW=c2m2+cWmW .
MÉTHODES CALORIMÉTRIQUES DE MESURE
Le plus souvent, les calorimètres sont utilisés dans le mode de conditions environnementales constantes. Cela s'applique en premier lieu à la plupart des calorimètres à combustion, dans lesquels le temps de réaction est très court. Alors que la température des parties internes du calorimètre change en raison de la réaction, la température ambiante reste constante. Dans de nombreux cas, un thermostat le bain est utilisé comme environnement afin d'éviter toute influence sur la valeur mesurée des interférences externes - fluctuations de température dans la pièce, rayonnement, courants d'air, etc.
L'avantage de ce schéma de mesure est le coût relativement faible du matériel, qui peut être utilisé pour effectuer la majeure partie des mesures calorimétriques. Le principal inconvénient doit être considéré comme l'échange de chaleur du calorimètre avec l'environnement, ce qui complique l'interprétation des résultats. Cette méthode de mesure est toujours appelée isopéribol (diathermique). En aucun cas, il ne peut être qualifié d'isotherme, dont l'essence réside dans le fait que la température du calorimètre reste constante au cours de la réaction, comme par exemple les calorimètres destinés à mesurer les transformations de phase.
méthode adiabatique
S'il est possible d'exclure l'échange de chaleur avec l'environnement, c'est-à-dire d'assurer le déroulement adiabatique du processus, l'expérience et l'interprétation des résultats sont simplifiées et le résultat de la mesure est plus précis, car il n'est pas nécessaire d'enregistrer en continu changements de température et calculer les corrections. De plus, dans ce cas, une élévation de température un peu plus importante dans la cuve du calorimètre peut être tolérée ; pour les appareils non adiabatiques, cela est inacceptable en raison d'une augmentation des pertes de chaleur.
Afin d'éviter un transfert de chaleur entre la cuve du calorimètre et son environnement immédiat (généralement le bain liquide), la température du bain doit être constamment ajustée en fonction des variations de température à l'intérieur de la cuve. A l'aide d'un contrôleur électronique (circuit de suivi), il est possible de maintenir constamment la différence de ces températures pratiquement égale à zéro. Cela augmente le coût des équipements de mesure en fonction de la précision de mesure requise.
Les éléments matériels doivent être rapides et stables pendant longtemps (avoir une dérive minimale). La zone morte de la boucle de contrôle de suivi doit être comprise entre ± 10-3 et ± 10-5 K. En tant qu'appareils de mesure, vous pouvez utiliser n'importe quel thermomètre à contact électrique à réponse rapide qui, lorsqu'il est inclus dans le circuit en pont, donne une impulsion au régulateur pour modifier la puissance de chauffage. Le chauffage est réalisé soit au moyen d'une bobine de résistance électrique, soit directement dans un bain liquide, qui agit comme une résistance chauffante en raison d'une faible dissociation (chauffage dit électrolytique). Cette deuxième méthode est pratiquement sans inertie. Le résultat peut être obtenu en utilisant des moyens déjà existants pour la mesure électrique de la température ou en utilisant un thermomètre à liquide installé en plus (Beckmann).
La méthode de mesure adiabatique convient pour étudier principalement les processus lents et les effets thermiques. Avec des changements rapides de la quantité de chaleur (dans les calorimètres à combustion), l'inertie de l'égalisation de la température a un effet si défavorable que même la précision des méthodes non adiabatiques conventionnelles n'est pas atteinte. Cependant, en fournissant une faible capacité calorifique des éléments chauffants et des capteurs de température et en effectuant un mélange intensif du liquide du bain, il est possible d'obtenir de petites valeurs de différentes constantes de temps (pour réduire l'inertie).
Méthode de rémunération
En utilisant des calorimètres différentiels ou doubles basés sur le principe de compensation, il est possible d'éliminer en grande partie les influences externes sur le processus de mesure. Deux récipients calorimétriques identiques avec des accessoires identiques sont placés dans un environnement dans les mêmes conditions. Dans un récipient, le processus étudié avec un effet thermique se produit et l'autre récipient est chauffé à l'aide d'un système de servocommande de telle sorte que la perte de chaleur dans l'environnement pour les deux récipients soit la même. Par conséquent, la puissance de chauffage d'entrée peut être mise en proportion directe avec la quantité de chaleur dégagée au cours du processus à l'étude. Dans ce cas, la tâche expérimentale de mesure entre dans un autre domaine et se réduit à une détermination très précise de la puissance de chauffage électrique fournie (W * s, J):
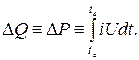
Le calorimètre différentiel est utilisé, en particulier, dans des conditions ambiantes adiabatiques, en particulier lorsqu'il faut s'attendre à des variations très faibles ou très lentes de la quantité de chaleur. Dans les procédés endothermiques, il suffit d'avoir une cuve calorimétrique. L'apport de chaleur est contrôlé de manière à ce que la température dans la cuve reste la même tout le temps (méthode isotherme). L'inconvénient des calorimètres différentiels est le coût élevé des équipements et des instruments de mesure.
CALORIMÈTRES À COMBUSTION
Le combustible utilisé dans les installations de production de chaleur et d'électricité est examiné afin de déterminer son pouvoir calorifique H (J/kg). Cet indicateur est nécessaire pour déterminer les facteurs d'efficacité, étudier l'efficacité et les calculs de l'énergie consommée dans diverses installations, ainsi que pour un contrôle optimal du processus de combustion. Des fluctuations importantes dans la composition des composants combustibles nécessitent souvent une détermination continue du pouvoir calorifique.
Lorsqu'une substance est complètement brûlée, une certaine quantité de chaleur Q (chaleur de combustion) est libérée. Si on la divise par la masse m (ou par le volume dans les conditions normales Vn), on obtient la chaleur (spécifique) de combustion :
Selon l'état des produits de combustion, on distingue deux types de pouvoir calorifique : H0 supérieur et H inférieur, également appelés chaleur de combustion et pouvoir calorifique. Lors de la détermination du pouvoir calorifique inférieur du Ni, l'eau formée pendant réactions chimiques doit être à l'état de vapeur. La différence entre les deux chaleurs H0 - Ni correspond à la chaleur de vaporisation de l'eau condensée (indice KO - condensat) r, qui est égale à 2,441 MJ/kg.
Pour les combustibles solides et liquides, la quantité d'eau résultante peut être déterminée sur la base d'une analyse élémentaire et, lors de la combustion de combustibles gazeux, en mesurant la quantité de condensat.
Dans les fours industriels, la température des produits de combustion dépasse toujours le point d'ébullition de l'eau. Par conséquent, seul le pouvoir calorifique inférieur Ni est généralement intéressant, car la chaleur de condensation de l'eau ne peut pas être utilisée.
Calorimètres à combustion pour solides et liquides
Pour les processus de combustion rapide, une forme spéciale de calorimètre liquide a été développée - la soi-disant bombe calorimétrique Berthelot (Fig. 3).
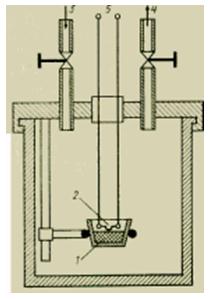
Figure Le dispositif d'une bombe calorimétrique.
La combustion d'une petite quantité mesurée avec précision d'une substance se produit à un volume constant dans une bombe scellée dans une atmosphère d'oxygène le plus pur possible à une pression d'environ 30 atm (3 MPa). La bombe remplie est placée dans le bain liquide du calorimètre, qui absorbe la chaleur de combustion dégagée.
Solides généralement pressé en petites briquettes (comprimés) et pesé très précisément. Il est conseillé de mélanger des substances peu brûlantes avec des liquides bien brûlants avec une chaleur de combustion connue (par exemple, l'acide benzoïque). Les substances liquides sont placées dans des coupelles (bateaux) en platine ou en quartz ou dans de petites capsules en plastique. Sur le couvercle, boulonné au corps de la bombe, se trouvent tous les dispositifs nécessaires à la recherche : des vannes d'alimentation en oxygène et d'évacuation des produits de combustion, des porte-échantillons et un allumeur électrique. L'allumage est effectué en fournissant de l'électricité à un fin fil de platine. La chaleur fournie pour l'allumage doit être mesurée avec précision afin qu'elle puisse être prise en compte lors du déchiffrement des résultats de l'expérience. Dans une bombe calorimétrique, le pouvoir calorifique le plus élevé H0 est déterminé. Lors de la vérification, l'équivalent thermique du calorimètre Ck est déterminé en brûlant une substance de référence (par exemple, l'acide benzoïque) ou en utilisant un appareil de chauffage électrique.
Calorimètre à combustion pour substances gazeuses
Pour déterminer la chaleur de combustion des milieux gazeux, il existe différentes méthodes. Tous, contrairement à la bombe calorimétrique pour les substances solides et liquides, sont basés sur une mesure continue. Le principe de mesure utilisé est assez simple. Le gaz d'essai est brûlé en continu dans un brûleur à une pression constante. Toute la chaleur dégagée lors de la combustion est absorbée soit par le flux du fluide caloporteur dans l'échangeur de chaleur (calorimètre humide ou échangeur), soit en mélangeant les produits de combustion avec le flux d'air à un débit connu (calorimètre sec ou mélangeur). Déterminez généralement le pouvoir calorifique inférieur Hu. Pour déterminer le pouvoir calorifique supérieur H0, il est nécessaire de condenser la vapeur d'eau (indice KO) contenue dans les fumées. Connaissant les débits massiques et la différence de température à l'entrée (indice e) et à la sortie (indice a) du calorimètre, il est possible de calculer le pouvoir calorifique correspondant à l'aide de l'équation du bilan thermique.
La préparation de gaz requise est fondamentalement la même dans tous les calorimètres à gaz. Avant la combustion, le gaz (indice G) est d'abord nettoyé des impuretés mécaniques solides (dans le filtre) et humidifié (jusqu'à saturation en humidité, 100%), puis amené aux valeurs spécifiées de pression préliminaire (à l'aide d'un réducteur de pression vanne) et température du fluide de refroidissement (indice K) . L'air nécessaire à la combustion (indice L) est également humidifié et porté à la température du fluide caloporteur.
Selon la précision requise et les coûts d'instrumentation admissibles, certaines de ces conditions peuvent ne pas être remplies. Les calorimètres doivent être vérifiés avec un gaz de référence (par exemple l'hydrogène) pour déterminer l'écart par rapport à l'équation de l'état idéal du calorimètre. Pour un calorimètre à échange de chaleur (humide), l'équation ci-dessus a la forme
où et sont les débits massiques du fluide de refroidissement et du combustible, en kg/s ; sk - capacité thermique spécifique du fluide de refroidissement, J / (kg * K); - augmentation de la température du fluide de refroidissement, K.
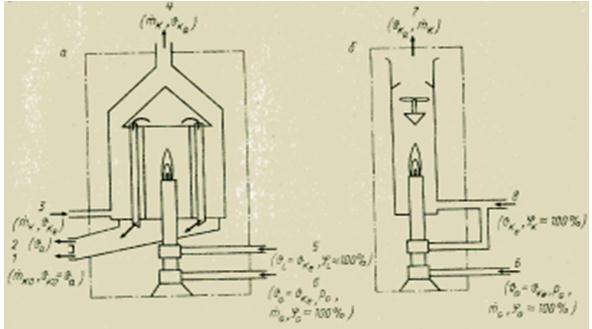
Figure Dispositif de calorimètres humides (a) et secs (b) pour combustible gazeux.
L'élévation de température est généralement de 5 à 15 K. En raison de la grande masse thermique, les calorimètres à transfert de chaleur ont une constante de temps très longue, pouvant aller jusqu'à plusieurs minutes. Ils sont donc moins adaptés à une utilisation en boucle de régulation fermée comme capteur que les calorimètres secs (à mélange) dont la constante de temps n'est que de quelques secondes. D'autre part, la précision réalisable des calorimètres à échange de chaleur est relativement élevée. Leur erreur ne dépasse pas ±0,25-1%, ils peuvent donc également être utilisés pour les travaux de laboratoire et pour la vérification. Les calorimètres secs (à mélange) ont une erreur de ±1 à ±2 % de la limite supérieure de la plage de mesure.
Les versions de conception des calorimètres de divers fabricants diffèrent principalement par les dispositifs auxiliaires et de sécurité, les éléments de détection et les circuits de calcul qui fournissent une compensation d'erreur. Ainsi, dans les calorimètres échangeurs de chaleur, le rapport des débits de gaz et de fluide de refroidissement est maintenu de différentes manières (voir l'équation du calorimètre ci-dessus), grâce à quoi la valeur calorifique supérieure H0 ne dépend directement que de l'augmentation de la température.
Dans les calorimètres secs, l'élévation de température est mesurée soit directement à l'aide de thermomètres à contact électrique, soit indirectement à l'aide d'un capteur dilatométrique - un tube en expansion situé dans le flux de gaz d'échappement. Dans le calorimètre ADOS, l'allongement thermique du tube du dilatomètre correspond directement à la chaleur de combustion et peut être converti en n'importe quel signal à l'aide d'une liaison et d'une jauge de longueur. Dans le calorimètre de Reinecke, le prolongement de la tige sert de signal de mesure dans un circuit de régulation qui régule le débit d'air de refroidissement de manière à ce que l'augmentation de sa température reste quasi constante. Dans ce cas, la boucle de contrôle s'avère être purement proportionnelle, mais un certain écart résiduel y est inévitable. Dans ce cas, la consommation d'air de refroidissement ou l'allongement du tube dilatométrique (tige) sont une mesure du pouvoir calorifique déterminé. Une condition préalable à l'obtention d'une précision suffisante dans tous les calorimètres secs est un bon mélange de l'air de refroidissement et des produits de combustion.
MESURES DE FLUX THERMIQUES
La chaleur en tant que forme d'énergie est transférée de trois manières : à travers un corps solide (conduction thermique), un milieu liquide ou gazeux (convection) et sans la participation de la matière (rayonnement). En technologie, les trois composants sont presque toujours impliqués dans le transfert de chaleur ; cependant, dans de nombreux cas, il est possible d'obtenir des résultats d'une précision acceptable en mesurant un seul composant.
La mesure flux de chaleur avec conductivité thermique
Le transfert de chaleur à travers des parois conductrices de chaleur est d'une grande importance dans de nombreux domaines technologiques (échangeurs de chaleur de toutes sortes, isolation thermique, etc.). Dans le même temps, ce n'est pas tant le contrôle actuel des quantités de production qui est intéressant, mais les résultats de mesures uniques utilisées pour évaluer la charge, vérifier le respect des indicateurs garantis et l'efficacité.
Selon les lois de la conduction thermique stationnaire, le flux de chaleur est déterminé par les formules suivantes (J/s) :
La conductivité thermique de la paroi [J/(m*s*K)] et ses dimensions géométriques étant connues, la mesure du flux thermique se réduit à la mesure de la différence de température. Cependant, cette technique nécessite une détermination très précise des températures de surface. Les erreurs associées aux modifications des conditions de transfert de chaleur lors de l'installation d'éléments sensibles à la température sur des surfaces peuvent être assez importantes. Par conséquent, pour des mesures plus précises, les méthodes ci-dessous sont recommandées, dans lesquelles la conductivité thermique et le transfert de chaleur sont utilisés simultanément.
Mesure des flux de chaleur dans le transfert de chaleur (transfert de chaleur combiné à la conduction thermique)
Pour la paroi plane mentionnée dans la section précédente, la loi de transfert de chaleur (J/s) suivante est valable :
![]() ,
,
où dans le coefficient de transfert de chaleur k 1J/(m2*s*K)], ainsi que le coefficient de transfert de chaleur [J/Dm*s*K)], les coefficients de transfert de chaleur et [J/(m2*s*K) ] des deux côtés du mur sont également pris en compte.
Sur une paroi plane à travers laquelle passe le flux de chaleur mesuré, une petite plaque mince est placée, dont la température de surface est déterminée par des thermocouples à couche mince intégrés. L'avantage de mesurer de cette manière est qu'il n'est pas nécessaire de connaître les propriétés thermiques de la paroi, et les propriétés correspondantes de la plaque peuvent être réduites à une seule valeur constante lors de l'étalonnage. De tels éléments sensibles ont une taille d'environ 30x30x0,5 mm ; la gamme de mesure couvre les flux thermiques de 10 à 100 000 W/m2 ; l'erreur est de 2-5%.
Figure Le principe de fonctionnement du compteur de flux thermique.
Avec l'amélioration de cette méthode de mesure, des tapis en caoutchouc sont utilisés à la place d'une plaque superposée. En les collant sur des surfaces non planes ou en les enroulant autour d'une surface incurvée, il est possible de déterminer le transfert de chaleur à partir d'une surface d'une surface relativement grande, par exemple, à partir d'un tuyau, d'un récipient, etc. Les thermocouples sont intégrés aux deux surfaces de le tapis de manière à ce que leurs jonctions chaudes et froides soient situées exactement l'une contre l'autre (Fig. 6). Et dans ce cas, la densité de flux thermique conformément à l'étalonnage est proportionnelle à la différence de température. Cependant, les tapis appliqués perturbent quelque peu le transfert de chaleur initial, ce qui devient perceptible avec des mesures précises. Par conséquent, cette méthode de mesure est principalement utilisée pour déterminer les constantes thermodynamiques d'une substance, lorsque la violation du flux de chaleur n'affecte pas le résultat de la mesure.
Mesure des flux de chaleur dans les environnements actuels.
Une partie importante de l'énergie thermique est transférée par des fluides liquides ou gazeux (eau, vapeur, etc.) circulant dans un réseau fermé de canalisations. Cependant, par rapport à la transmission d'énergie électrique par fil, la distance sur laquelle l'énergie thermique peut être transmise est limitée. Pour les études thermotechniques de tous types de systèmes de chauffage et de réfrigération, il est nécessaire de mesurer le dégagement et la consommation de chaleur.
Le flux de chaleur F (J/s), transmis par le flux du fluide - caloporteur (kg/s) à travers la section de contrôle avec une surface A (m2) dans une certaine zone, pour laquelle le bilan thermique est compilé (dans le zone de traitement, Fig. 7), est égal à
La quantité de chaleur dégagée pendant l'intervalle de temps t2 - t1 est déterminée comme une intégrale (J) :
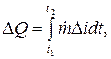
où est la différence d'enthalpie (enthalpies, J/kg) du fluide caloporteur à l'entrée (indice e) et à la sortie (indice a) de la zone de bilan thermique.
Comme, dans le cas général, la valeur de l'enthalpie n'a d'intérêt que par rapport à un certain niveau, par exemple avec l'enthalpie à température ambiante, toutes les mesures de flux de chaleur sont essentiellement des mesures de différence.
Les enthalpies individuelles incluses dans l'équation générale peuvent être exprimées en termes de températures correspondantes et de capacités thermiques spécifiques;
Ainsi, la mesure de flux de chaleur est directement réduite à la mesure de températures et de débits massiques. Dans de nombreux cas, ce n'est pas la masse, mais le débit volumique du liquide de refroidissement qui est mesuré ; dans ce cas, le résultat obtenu ne différera que de la valeur de la densité de liquide de refroidissement p. Les capacités calorifiques spécifiques, ci, sont elles-mêmes des fonctions de la température. Cependant, en raison de la plage de mesure étroite de nombreux instruments, ils peuvent généralement être considérés comme des valeurs constantes sans grande perte de précision. La capacité calorifique spécifique doit être connue. Pour les liquides, l'équation du flux de chaleur est encore plus simplifiée, puisque leur capacités thermiques spécifiques ne dépend pas de la pression :
![]() , J/s.
, J/s.
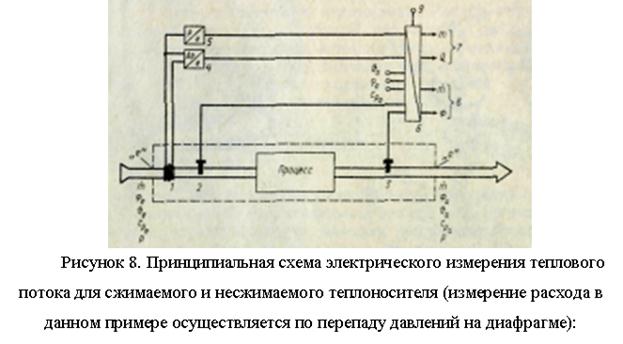
Dans toutes les équations de ce type, il faut tenir compte des signes des grandeurs selon qu'il y a apport ou évacuation de chaleur, que le processus est endothermique ou exothermique, qu'il se produit un refroidissement ou un échauffement.
