W jakich jednostkach mierzy się pojemność cieplną? Pojemność cieplna gazów. Rodzaje pojemności cieplnych
Pojemność cieplna ciała to ilość ciepła, która musi zostać przekazana danemu ciału, aby podnieść jego temperaturę o jeden stopień. Po schłodzeniu o jeden stopień ciało wydziela taką samą ilość ciepła. Pojemność cieplna jest proporcjonalna do masy ciała. Pojemność cieplna jednostki masy ciała nazywana jest specyficzną, a iloczyn ciepła właściwego przez masę atomową lub cząsteczkową nazywa się odpowiednio atomowym lub molowym.
Pojemności cieplne różne substancje znacznie się od siebie różnią. Więc, ciepło właściwe woda w temperaturze 20 ° C wynosi 4200 J / kg K, drewno sosnowe - 1700, powietrze - 1010. W przypadku metali jest to mniej: aluminium - 880 J / kg K, żelazo - 460, miedź - 385, ołów - 130. Ciepło właściwe nieznacznie wzrasta wraz z temperaturą (przy 90°C pojemność cieplna wody wynosi 4220 J/kg K) i zmienia się znacznie podczas przemian fazowych: pojemność cieplna lodu przy 0°C jest 2 razy mniejsza niż wody; pojemność cieplna pary wodnej w 100°C wynosi około 1500 J/kg K.
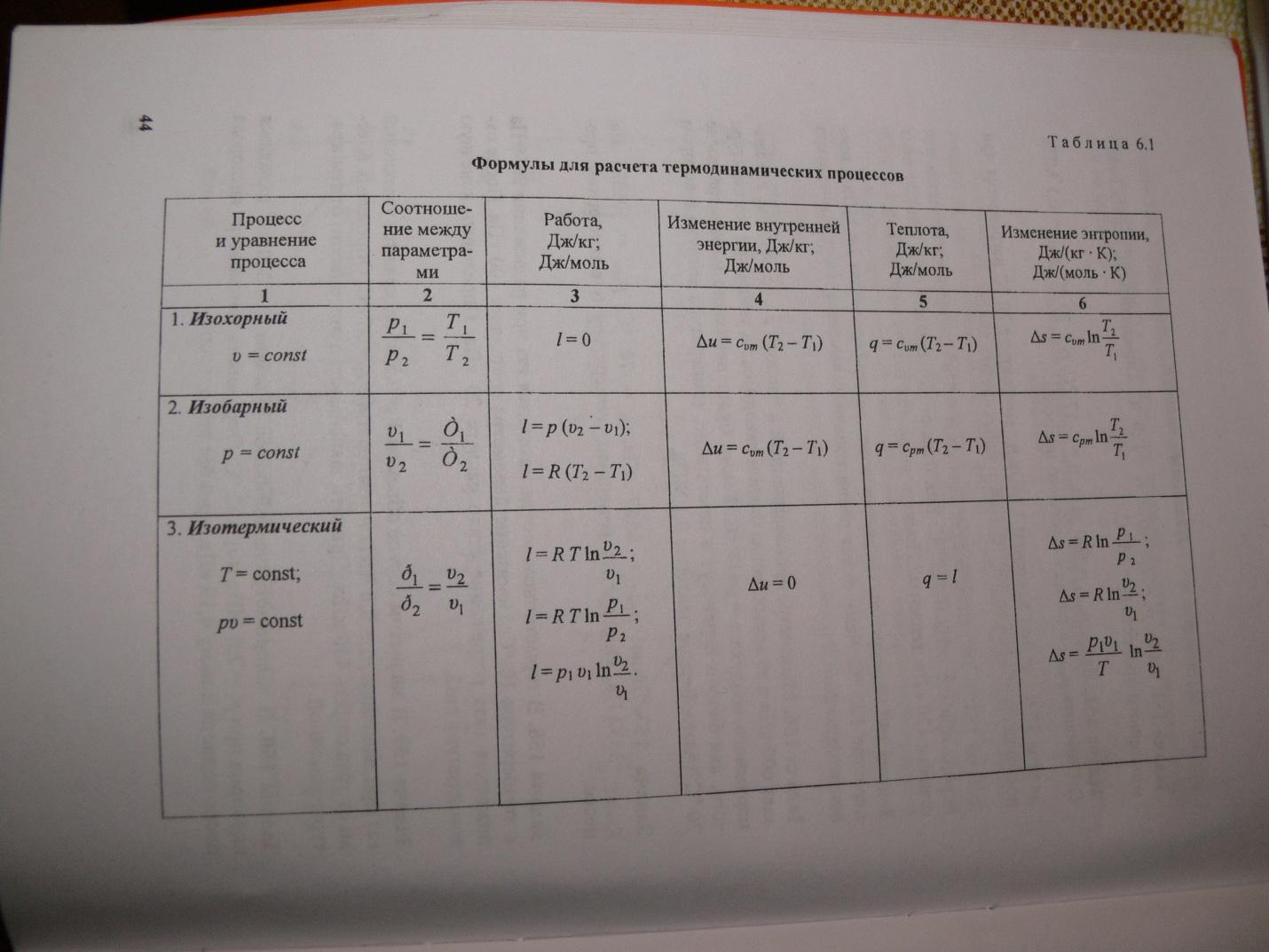
Pojemność cieplna zależy od warunków, w jakich zmienia się temperatura ciała. Jeśli wymiary ciała się nie zmieniają, całe ciepło idzie na zmianę energii wewnętrznej. Tutaj mówimy o pojemności cieplnej przy stałej objętości. Przy stałym ciśnieniu zewnętrznym, ze względu na rozszerzalność cieplną, praca mechaniczna jest wykonywana przeciw siłom zewnętrznym, a podgrzanie do określonej temperatury wymaga więcej ciepła. Dlatego pojemność cieplna przy stałym ciśnieniu jest zawsze większa niż . Do gazy idealne(patrz rysunek), gdzie R jest stałą gazową równą 8,32 J / mol K.
Zwykle mierzone. Klasyczny sposób pomiary pojemności cieplnej są następujące: korpus, którego pojemność cieplna ma być mierzona, jest podgrzewany do określonej temperatury i umieszczany w kalorymetrze o temperaturze początkowej , wypełniony wodą lub inną cieczą o znanej pojemności cieplnej oraz - pojemność cieplna kalorymetr i ciecz).
Mierząc temperaturę w kalorymetrze po ustaleniu równowagi termicznej, pojemność cieplną ciała można obliczyć za pomocą wzoru:
![]()
gdzie i są masami ciała, cieczy i kalorymetru.
Najbardziej rozwiniętą teorią jest pojemność cieplna gazów. W zwykłych temperaturach ogrzewanie prowadzi głównie do zmiany energii ruchu translacyjnego i obrotowego cząsteczek gazu. Dla molowej pojemności cieplnej gazów jednoatomowych teoria podaje , dwuatomowe i wieloatomowe - i . W bardzo niskich temperaturach pojemność cieplna jest nieco mniejsza z powodu efektów kwantowych (patrz rys. Mechanika kwantowa). Na wysokie temperatury dodaje się energię wibracyjną, a pojemność cieplna gazów wieloatomowych wzrasta wraz ze wzrostem temperatury.
Atomowa pojemność cieplna kryształów, zgodnie z teorią klasyczną, jest równa , co jest zgodne z empirycznym prawem Dulonga i Petita (ustanowionym w 1819 r. Przez francuskich naukowców P. Dulonga i A. Petita). Teoria kwantowa pojemność cieplna prowadzi do tego samego wniosku w wysokich temperaturach, ale przewiduje spadek pojemności cieplnej wraz ze spadkiem temperatury. W pobliżu zera absolutnego pojemność cieplna wszystkich ciał dąży do zera (trzecia zasada termodynamiki).
Pojemność cieplna ciała- to jest wielkość fizyczna, określony przez stosunek ilości ciepła pochłoniętego przez ciało po podgrzaniu do zmiany jego temperatury:
Fizyczne znaczenie pojemności cieplnej ciała: pojemność cieplna ciała jest równa ilości ciepła pochłoniętego przez ciało podczas ogrzewania lub uwalnianego po ochłodzeniu o 1K.
Ponieważ pojemności cieplne są zmienne, rozróżnia się pomiędzy średnią a rzeczywistą pojemnością cieplną. Pod średnią pojemnością cieplną zrozum stosunek ilości ciepła q , zsumowany do jednostki ilości substancji (gazu), do zmiany jej temperatury od t 1 zanim t 2 pod warunkiem, że różnica temperatur t 2 - t 1 jest wartością skończoną. Średnią masę, objętość i molową pojemność cieplną oznaczono odpowiednio przez c m , c m ' oraz m . Z definicji średniej pojemności cieplnej wynika, że jeżeli temperatura gazu wzrośnie z t 1 zanim t 2 wtedy jego średnia pojemność cieplna [kJ/(kg*K)]
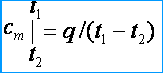
Pod rzeczywistą pojemnością cieplną zrozum pojemność cieplną gazu, odpowiadającą nieskończenie małej zmianie temperatury gazu, odpowiadającej nieskończenie małej zmianie temperatury dt , tj.
c = dq/dt,
gdzie dq=cdt.
Ciepło właściwe to zdolność różnych substancji do pochłaniania ciepła podczas ich podgrzewania. Specyficzna pojemność cieplna substancji jest określona przez stosunek ilości ciepła otrzymanego przez nią po podgrzaniu do masy substancji i zmiany jej temperatury, jeżeli: ![]()
zależność wyrażająca zależność między molowymi pojemnościami cieplnymi Cp i CV ma postać (wzór Mayera): Cp = CV + R. LUB WIĘCEJ ROZSZERZONA Pojemność cieplna gaz doskonały Jeżeli w wyniku wymiany ciepła do ciała zostaje przekazana pewna ilość ciepła, to zmienia się energia wewnętrzna ciała i jego temperatura. Ilość ciepła Q potrzebna do podgrzania 1 kg substancji o 1 K nazywana jest ciepłem właściwym substancji c. c = Q / (mΔT). W wielu przypadkach wygodnie jest stosować molową pojemność cieplną C: C = M c, gdzie M jest masą molową substancji. Określona w ten sposób pojemność cieplna nie jest jednoznaczną cechą substancji. Zgodnie z pierwszą zasadą termodynamiki zmiana energii wewnętrznej ciała zależy nie tylko od ilości otrzymanego ciepła, ale także od pracy wykonanej przez ciało. W zależności od warunków, w jakich przebiegał proces wymiany ciepła, korpus mógł wykonywać różne prace. W związku z tym ta sama ilość ciepła przekazanego ciału może powodować różne zmiany jego energii wewnętrznej, a co za tym idzie temperatury. Taka niejednoznaczność w określaniu pojemności cieplnej jest typowa tylko dla substancji gazowej. Gdy ciała płynne i stałe są podgrzewane, ich objętość praktycznie się nie zmienia, a praca rozszerzania okazuje się równa zeru. Dlatego cała ilość ciepła otrzymanego przez ciało idzie na zmianę jego energii wewnętrznej. W przeciwieństwie do płynów i ciała stałe, gaz w procesie wymiany ciepła może znacznie zmienić swoją objętość i działać. Dlatego pojemność cieplna substancji gazowej zależy od charakteru procesu termodynamicznego. Zwykle rozważane są dwie wartości pojemności cieplnej gazów: CV to molowa pojemność cieplna w procesie izochorycznym (V = const), a Cp to molowa pojemność cieplna w procesie izobarycznym (p = const). W procesie przy stałej objętości gaz nie działa: A = 0. Z pierwszej zasady termodynamiki dla 1 mola gazu wynika QV = CVΔT = ΔU. Zmiana ΔU energii wewnętrznej gazu jest wprost proporcjonalna do zmiany ΔT jego temperatury. Dla procesu przy stałym ciśnieniu pierwsza zasada termodynamiki daje: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, gdzie ΔV jest zmianą objętości 1 mola gazu doskonałego przy zmianie jego temperatury o ΔT. Wynika z tego: Stosunek ΔV / ΔT można znaleźć z równania stanu gazu doskonałego zapisanego dla 1 mola: pV = RT, gdzie R jest uniwersalną stałą gazową. W p = const Zatem relacja wyrażająca zależność między molowymi pojemnościami cieplnymi Cp i CV ma postać (wzór Mayera): Cp = CV + R.
Stała gazowa jest liczbowo równa pracy rozprężania 1 mola gazu doskonałego pod stałym ciśnieniem po podgrzaniu o 1 K. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K = 8,31(44) Dż/ (mol K)
Uniwersalna stała gazowa jest uniwersalną, fundamentalną stałą fizyczną R, równą iloczynowi stałej Boltzmanna k i stałej Avogadro
Znaczenie fizyczne: Stała gazowa i jest liczbowo równa pracy ekspansji jednego mola gazu doskonałego w procesie izobarycznym ze wzrostem temperatury o 1 K
W systemie CGS stała gazowa wynosi:
Określona stała gazu to:
Wykładnik adiabatyczny(Czasem nazywany współczynnikPoissona) - stosunek pojemności cieplnej przy stałym ciśnieniu () do pojemności cieplnej przy stałej objętości (). Czasami nazywa się to również czynnik izentropowy rozszerzenia. Oznaczone grecką literą (gamma) lub (kappa). Symbol litery jest używany głównie w dyscyplinach inżynierii chemicznej. W ciepłownictwie używa się litery łacińskiej.
Mieszanina gazów to zbiór kilku różnych gazów, które w rozważanych warunkach nie wchodzą ze sobą w reakcje chemiczne.
Mieszanina gazów to jednorodny układ termodynamiczny (w którym nie ma interfejsów oddzielających od siebie makroskopowe części układu, różniące się właściwościami i składem).
Ciśnienie cząstkowe Pi i-tego gazu w mieszaninie to ciśnienie, pod jakim byłby ten gaz, gdyby wszystkie inne gazy zostały usunięte z mieszaniny, a V i T pozostałyby takie same.
Prawo Daltona - Ciśnienie mieszaniny gazów, które nie oddziałują ze sobą chemicznie, jest równe sumie ciśnień cząstkowych tych gazów.
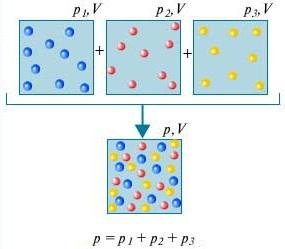
Aby zrozumieć, co to jest prawo Daltona, weź pod uwagę powietrze w pomieszczeniu. Jest to mieszanina kilku gazów: azotu (80%), tlenu (20%). Ciśnienie cząstkowe każdego z tych gazów to ciśnienie, jakie miałby gaz, gdyby sam zajmował całą objętość. Na przykład, jeśli wszystkie gazy z wyjątkiem azotu zostałyby usunięte z pomieszczenia, wówczas ciśnienie pozostałe byłoby ciśnieniem cząstkowym azotu. Prawo Daltona stwierdza, że całkowite ciśnienie wszystkich gazów wziętych razem jest równe sumie ciśnień cząstkowych każdego gazu z osobna. (Ściśle mówiąc, prawo dotyczy tylko gazów doskonałych, ale w wystarczająco dobrym przybliżeniu opisuje również gazy rzeczywiste.)
Pierwsza zasada termodynamiki jest uogólnieniem prawa zachowania i transformacji energii dla układu termodynamicznego. Formułuje się następująco:
Zmień ΔU energia wewnętrzna nieizolowanego układu termodynamicznego jest równa różnicy między ilością ciepłaQ przeniesiony do systemu i działaA , doskonały system nad ciałami zewnętrznymi.
|
Relacja wyrażająca pierwszą zasadę termodynamiki jest często zapisywana w innej formie:
|
Ilość ciepła odbieranego przez system jest wykorzystywana do zmiany jego energii wewnętrznej i wykonywania pracy na ciałach zewnętrznych.
Pierwsza zasada termodynamiki jest uogólnieniem faktów doświadczalnych. Zgodnie z tym prawem energia nie może zostać stworzona ani zniszczona; jest przenoszona z jednego systemu do drugiego i przekształcana z jednej formy w drugą. Ważną konsekwencją pierwszej zasady termodynamiki jest twierdzenie, że nie da się stworzyć maszyny zdolnej do wykonywania użytecznej pracy bez zużywania energii z zewnątrz i bez zmian wewnątrz samej maszyny. Taka hipotetyczna maszyna nazywa się perpetuum mobile (perpetuum mobile) pierwszego rodzaju . Liczne próby stworzenia takiej maszyny niezmiennie kończyły się niepowodzeniem. Każda maszyna może wykonać pozytywną pracę A nad ciałami zewnętrznymi tylko poprzez uzyskanie określonej ilości ciepła Q z otaczających ciał lub zmniejszenie Δ U jego energia wewnętrzna.
Zastosujmy pierwszą zasadę termodynamiki do izoprocesów w gazach.
Z ekspansją izobaryczną Q> 0 - ciepło jest pochłaniane przez gaz, a gaz wykonuje pozytywną pracę. Z kompresją izobaryczną Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T jeden ; energia wewnętrzna maleje, Δ U < 0.
W proces izotermiczny temperatura gazu nie zmienia się, dlatego energia wewnętrzna gazu, Δ U = 0.
W proces izochoryczny (V= const) gaz nie działa, A= 0. Dlatego
Pierwsza zasada termodynamiki dla procesu izobarycznego podaje:
|
Pierwsza zasada termodynamiki dla procesu izotermicznego wyraża się zależnością
|
Ilość ciepła Q, otrzymywany przez gaz w procesie ekspansji izotermicznej, zamienia się w pracę na ciałach zewnętrznych. Pod wpływem kompresji izotermicznej praca sił zewnętrznych wytworzonych na gazie zamieniana jest na ciepło, które jest przekazywane do otaczających ciał.
Wraz z procesami izochorycznymi, izobarycznymi i izotermicznymi termodynamika często uwzględnia procesy zachodzące przy braku wymiany ciepła z otaczającymi ciałami. Nazywane są naczynia z izolacyjnymi ścianami muszle adiabatyczne, a procesy rozprężania lub sprężania gazu w takich naczyniach są nazywane adiabatyczny.
W proces adiabatycznyQ= 0; więc pierwsza zasada termodynamiki przybiera postać
|
|
|
W sensie fizycznym pierwszą zasadą termodynamiki jest zasada zachowania (zmiany) energii w termodynamice. Jeżeli zgodnie z prawem zmiany energii w mechanice praca sił niezachowawczych jest równa przyrostowi energii mechanicznej układu (w szczególności praca sił tarcia o znaku ujemnym jest równa zmniejszeniu energii mechanicznej układu), to zgodnie z pierwszą zasadą termodynamiki przyrost energii wewnętrznej układu termodynamicznego jest równy sumie pracy sił zewnętrznych doskonałych nad układem oraz energii przekazanej do układu termodynamicznego. system przez wymianę ciepła. Entalpia(z greckiego. entalpo- nagrzewanie) jest własność materii, wskazując ilość energii, którą można przekształcić w ciepło. Entalpia to termodynamiczna właściwość substancji, która wskazuje na poziom energii zmagazynowanej w jej strukturze molekularnej. Oznacza to, że chociaż materia może mieć energię opartą na temperaturze i ciśnieniu, nie wszystko może zostać przekształcone w ciepło. Część energii wewnętrznej zawsze pozostaje w substancji i zachowuje jej strukturę molekularną. Część energii kinetycznej substancji nie jest dostępna, gdy jej temperatura zbliża się do temperatury otoczenia. W konsekwencji, entalpia to ilość energii, która jest dostępna do przekształcenia w ciepło w danej temperaturze i ciśnieniu. Jednostki entalpii to BTU lub dżul dla energii i Btu/lbm lub J/kg dla energii właściwej. 11 pytań |

Cel: Eksperymentalne wyznaczanie pojemności cieplnej materiałów.
Ekwipunek: Waga, waga, kalorymetr, metalowy cylinder o znanej pojemności cieplnej, zlewka, grzałka, hak.
Krótka teoria:
Wszystkie makroskopowe ciała i układy ciał, oprócz energii mechanicznej wynikającej z ich ruchu i interakcji, posiadają energię zależną od ich stanu wewnętrznego. Ta energia, która jest energią ruchu i interakcji pomiędzy wszystkimi cząsteczkami tworzącymi ciało, nazywana jest wewnętrzną.
Energia wewnętrzna obejmuje energię kinetyczną ruchu termicznego cząsteczek i atomów tworzących dane ciało, energię kinetyczną elektronów poruszających się w atomach wokół jądra, energię potencjalną oddziaływań między cząsteczkami, atomami, elektronami i jądrami, nukleony w jądrze itp. Pojęcie energii wewnętrznej nie obejmuje energii kinetycznej i potencjalnej danego ciała jako całości.
Energia wewnętrzna jest jednoznacznie określona przez zestaw parametrów charakteryzujących stan danego układu, tj. jest jednowartościową funkcją stanu tego układu.
Energia wewnętrzna jest zwykle oznaczana literą U.
W zjawiskach termicznych zachodzących w temperaturach dalekich od temperatur przemian fazowych zmiana energii wewnętrznej DU wiąże się ze zmianą energii kinetycznej i potencjalnej cząsteczek, podczas gdy pozostałe składniki energii wewnętrznej nie ulegają zmianie. Dlatego w takich procesach możemy założyć, że energia wewnętrzna ciała jest równa sumie energii kinetycznych chaotycznego ruchu termicznego wszystkich cząsteczek względem środka masy tego ciała i energii potencjalnych oddziaływań wszystkich cząsteczki ze sobą.
Kiedy zmienia się stan ciała, zmienia się jego wewnętrzna energia. Na przykład, gdy temperatura ciała wzrasta, wzrasta jego energia wewnętrzna, ponieważ wzrasta średnia energia kinetyczna ruchu cząsteczek tego ciała. Wraz ze spadkiem temperatury zmniejsza się energia wewnętrzna ciała.
Energia wewnętrzna ciał może się zmienić różne sposoby. Na przykład, energia wewnętrzna zmienia się, gdy na dane ciało w trakcie jego deformacji wykonują pracę mechaniczną siły zewnętrzne, a także bez pracy, gdy ciało styka się z innym ciałem (lub medium), które ma wyższą lub niższą temperaturę niż dane ciało.
Proces zmiany energii wewnętrznej ciała bez wykonywania pracy mechanicznej nazywa się przenoszeniem ciepła lub przenoszeniem ciepła. Istnieją trzy rodzaje wymiany ciepła: konwekcja, przewodzenie i promieniowanie.
Podczas wymiany ciepła nie dochodzi do konwersji energii z jednego rodzaju na inny. Proces wymiany ciepła polega na tym, że część energii wewnętrznej z cieplejszego ciała jest przekazywana do mniej gorącego ciała (lub medium).
Aby scharakteryzować procesy wymiany ciepła, wprowadza się pojęcie ilości ciepła, które nazywa się ilością, która jest ilościową miarą zmiany energii wewnętrznej ciała w procesie wymiany ciepła.
Należy pamiętać, że ciało może tylko dawać lub odbierać energię, a ilość ciepła Q jest tylko liczbowym odpowiednikiem energii oddanej lub otrzymanej przez ciało w procesie wymiany ciepła.
Ilość ciepła zależy od rodzaju procesu i nie jest funkcją stanu systemu.
Ilość ciepła potrzebna do ogrzania ciała, która zachodzi bez przemian fazowych (bez zmiany stanu skupienia substancji):
gdzie c jest specyficzną pojemnością cieplną ciała, określoną przez stosunek ilości ciepła przekazanego do masy m ciała i wynikającą z tego zmianę temperatury DT, m jest masą ciała, DT jest różnicą między końcową i początkowe temperatury danego ciała.
Ilość ciepła, która musi zostać przekazana ciału, aby podnieść jego temperaturę o jeden kelwin, nazywana jest pojemnością cieplną tej substancji. Po schłodzeniu o jeden kelwin ciało wydziela taką samą ilość ciepła. Pojemność cieplna ciała jest proporcjonalna do masy ciała i zależy od substancji, z której się składa. W układzie jednostek SI pojemność cieplna jest mierzona w J/K.
Aby scharakteryzować właściwości termiczne substancji, przyjmuje się pojemność cieplną masy jednostkowej tej substancji. Ta cecha nazywa się właściwą pojemnością cieplną. Jest równy stosunkowi pojemności cieplnej danego ciała do jego masy. Ciepło właściwe w układzie SI jest mierzone w J / (kg × K).
Eksperymentalnie ciepło właściwe metalowego korpusu określa się za pomocą kalorymetru i termometru. Najprostszy kalorymetr składa się z polerowanego szkła metalowego umieszczonego wewnątrz innego szkła na korkach (w celu izolacji termicznej). Szyba wewnętrzna jest wypełniona wodą lub inną cieczą o znanej pojemności cieplnej. Ciało rozgrzane do określonej temperatury t jest obniżane do kalorymetru. Niech temperatura cieczy w kalorymetrze wyniesie t 1 przed opuszczeniem ciała, a po ustaleniu równowagi termicznej cieczy i opuszczonego do niej ciała ich całkowita temperatura będzie równa q.
Z prawa zachowania energii wynika, że:
Q \u003d Q 1 + Q 2,(2)
gdzie jest ilość ciepła? Q, podana przez ogrzane ciało, jest równa sumie ilości ciepła Q1, uzyskane przez wodę, oraz Q2, otrzymane przez kalorymetr.
Biorąc pod uwagę (1), przepisujemy (2) jako:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
gdzie c 1 oraz m 1- ciepło właściwe i masa wody w kalorymetrze, c 2 oraz m2- ciepło właściwe i masa kalorymetru. To równanie nazywa się równaniem bilansu cieplnego. Z niego znajdujemy właściwą pojemność cieplną ciała:
Można inaczej podejść do rozwiązania tego problemu, zakładając, że straty energii w ramach jednego eksperymentu będą takie same. Ciało Z znana pojemność cieplna właściwa, podgrzana do określonej temperatury t, obniżony do kalorymetru, którego temperatura się zmienia. Wtedy równanie bilansu cieplnego przyjmie postać:
cm(t-q) = c 1 m 1 (q-t 1) + strata Q,(5)
gdzie Utrata Q to ilość ciepła odbieranego przez kalorymetr i środowisko, W konsekwencji:
Strata Q, = cm(t-q) - c 1 m 1 (q-t 1). (6)
Jeśli ciało o nieznanej pojemności cieplnej, ogrzane do tej samej temperatury, zostanie obniżone do kalorymetru, równanie bilansu cieplnego przyjmie postać:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + straty Q,(7)
gdzie m 1 to masa wody w kalorymetrze, oraz t¢ 1- temperatura wody w tym doświadczeniu. Następnie:
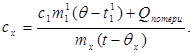 (8)
(8)
Podstawiając wartość (6) do (8) otrzymujemy:
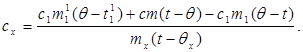 (9)
(9)
gdzie jest elementarna ilość ciepła; - elementarna zmiana temperatury.
Pojemność cieplna jest liczbowo równa ilości ciepła, które musi zostać dostarczone do układu, aby w danych warunkach podnieść jego temperaturę o 1 stopień. Ponieważ jednostką ciepła w SI jest dżul, a temperatura to stopień K, jednostką pojemności cieplnej jest J/K.
W zależności od jednostki ilościowej ciała, do której ciepło jest dostarczane w termodynamice, rozróżnia się masę, objętość i molowe pojemności cieplne.
Masowa pojemność cieplna to pojemność cieplna na jednostkę masy płynu roboczego,
gdzie i są objętością i gęstością ciała w normalnych warunkach fizycznych.
Objętościowa pojemność cieplna mierzona jest w J/(m3 K).
Molowa pojemność cieplna- pojemność cieplna, odniesiona do ilości płynu roboczego (gazu) w molach,
| , |
gdzie m3/mol to molowa objętość gazu w normalnych warunkach.
Biorąc pod uwagę, że pojemność cieplna nie jest stała, ale zależy od temperatury i innych parametrów cieplnych, rozróżnia się pojemność cieplną rzeczywistą i średnią. Zwykle rzeczywista pojemność cieplna jest rozumiana jako stosunek elementarnej ilości ciepła, która jest przekazywana do układu termodynamicznego w dowolnym procesie, do nieskończenie małego wzrostu temperatury tego układu spowodowanego przez przekazane ciepło. Rozważymy rzeczywistą pojemność cieplną układu termodynamicznego w temperaturze układu równej , oraz - true specyficzna pojemność cieplna płyn roboczy o temperaturze równej . Wówczas średnią właściwą pojemność cieplną płynu roboczego przy zmianie jego temperatury od do można wyznaczyć jako
Wyznaczanie energii wewnętrznej ciała.
Energia wewnętrzna ciało (określane jako mi lub U) jest sumą energii oddziaływań molekularnych i ruchów termicznych cząsteczki. W szczególności energia wewnętrzna gazu doskonałego jest równa sumie energii kinetycznych wszystkich cząstek gazu w ciągłym i losowym ruchu termicznym. Z tego wynika prawo Joule'a, potwierdzone licznymi eksperymentami.
Teoria kinetyki molekularnej prowadzi do następującego wyrażenia na energię wewnętrzną jednego mola idealnego gazu jednoatomowego (hel, neon itp.), którego cząsteczki wykonują tylko ruch translacyjny:
W ten sposób, energia wewnętrzna U ciało jest jednoznacznie zdeterminowane przez parametry makroskopowe charakteryzujące stan ciała. Nie zależy to od tego, w jaki sposób zrealizowano dany stan. Zwyczajowo mówi się, że energia wewnętrzna jest funkcją stanu.
W TD wykorzystywana jest zmiana energii wewnętrznej, a nie jej wartość bezwzględna.
Czym jest praca nad rozbudową. Pierwsze prawo TD.
Prace rozprężne - praca mechaniczna wykonywana przez pojazd przeciw siłom ciśnienia zewnętrznego w procesie jego rozprężania. Gdy zmienia się objętość, gaz działa, znak zmiany V pokrywa się ze znakiem pracy
Pierwsza zasada TD: ciepło przekazywane do systemu jest wykorzystywane do konwersji energii wewnętrznej i wykonania pracy.
Z punktu widzenia jego zdolności do odbierania (lub oddawania) energii w postaci ciepła, zwykle układ termodynamiczny charakteryzuje się jego pojemnością cieplną.
Pojemność cieplna ciała (układu) jest wielkością fizyczną, która jest liczbowo równa ilości ciepła, które musi zostać przekazane ciału (układowi), aby zmienić jego temperaturę o jeden kelwin.
Jeśli ciało otrzyma nieskończenie małą ilość ciepła Q, co spowodowało nieskończenie mały wzrost temperatury dT, następnie jego pojemność cieplna Z jest z definicji równy
Jednostką pojemności cieplnej w układzie SI jest dżul podzielony przez kelwin ( J/Do).
Eksperymenty i obliczenia teoretyczne pokazują, że pojemność cieplna ciała zależy od jego składu chemicznego, masy i stanu termodynamicznego(na przykład na temperaturę), a także na rodzaj procesu zmiany stanu ciała po przekazaniu mu ciepła.
Ciepło właściwe to pojemność cieplna na jednostkę masy substancji, czyli dla jednorodnej substancji
![]() , (25.2)
, (25.2)
gdzie Z- specyficzna pojemność cieplna, M to masa substancji.
Jednostką ciepła właściwego w układzie SI jest dżul podzielony przez kelwin-kilogram [( J/(Do . kg)].
Molowa pojemność cieplna to pojemność cieplna jednego mola substancji, to znaczy
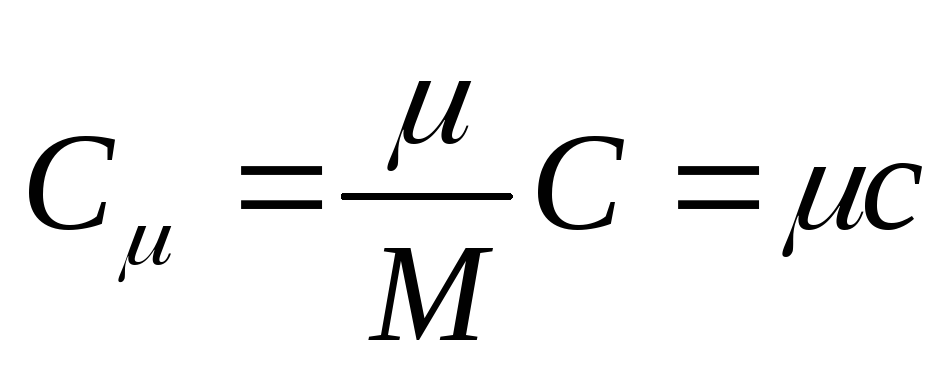 , (25.3)
, (25.3)
gdzie Z - molowa pojemność cieplna; to masa molowa substancji.
Jednostką molowej pojemności cieplnej w SI jest dżul podzielony przez kelwin-mol [ J/(Do . kret)].
Elementarna ilość ciepła Q, potrzebna do zmiany temperatury ciała dT, jest zdefiniowany jako
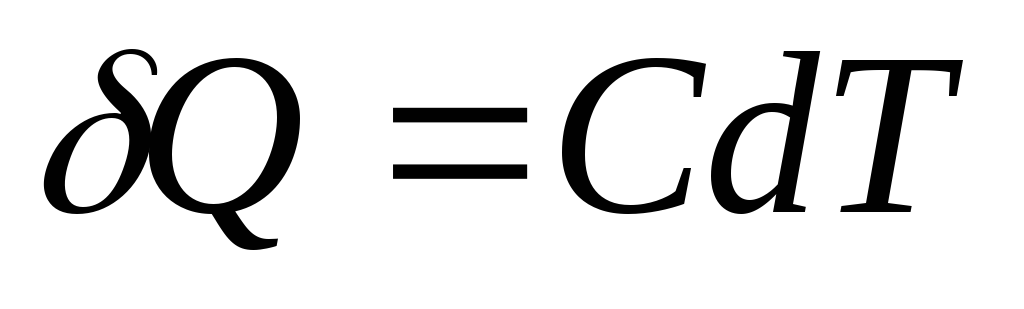 ,
,
i dla jednorodnego ciała
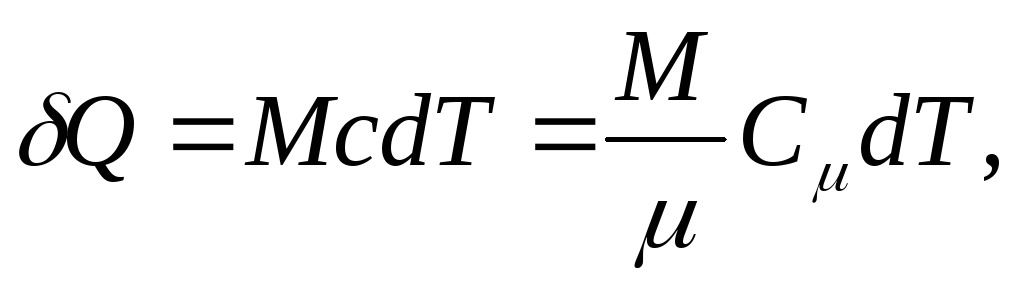 (25.4)
(25.4)
gdzie M/ - ilość substancji (liczba moli).
§26. Pierwsza zasada termodynamiki
Pierwsza zasada (pierwsza zasada) termodynamiki jest matematycznym wyrażeniem zasady zachowania i transformacji energii w zastosowaniu do układów termodynamicznych. Powstała w wyniku badań doświadczalnych i teoretycznych w dziedzinie fizyki i chemii, których końcowym etapem było odkrycie równoważności ciepła i pracy, czyli odkrycie, że przemiana ciepła w pracę i praca w ciepło jest zawsze prowadzone w tym samym ściśle stałym stosunku ilościowym.
W §24 zauważono, że energię wewnętrzną układu można zmieniać na dwa sposoby: wykonując pracę i przekazując ciepło. Dlatego możemy napisać:
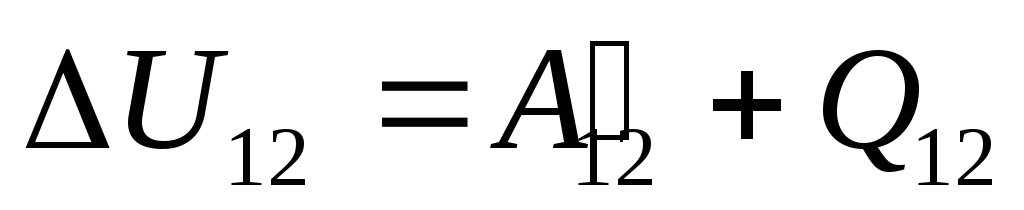 ,
(26.1)
,
(26.1)
gdzie
U 12
-
zmiana energii wewnętrznej układu podczas jego przejścia ze stanu 1
w stan 2
w wyniku prac nad nim 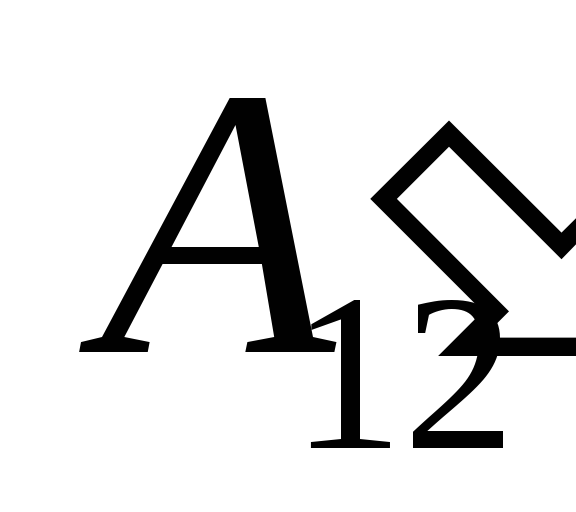 z ciał zewnętrznych i przenosząc do niego z zewnątrz pewną ilość ciepła
z ciał zewnętrznych i przenosząc do niego z zewnątrz pewną ilość ciepła  .
.
Wiemy, że działa 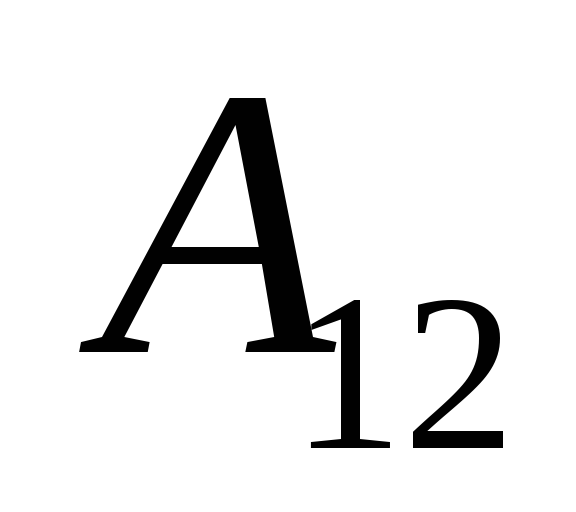 wykonywana przez sam system na ciałach zewnętrznych jest liczbowo równa i przeciwna w znaku pracy
wykonywana przez sam system na ciałach zewnętrznych jest liczbowo równa i przeciwna w znaku pracy  ciała zewnętrzne nad systemem, czyli
ciała zewnętrzne nad systemem, czyli
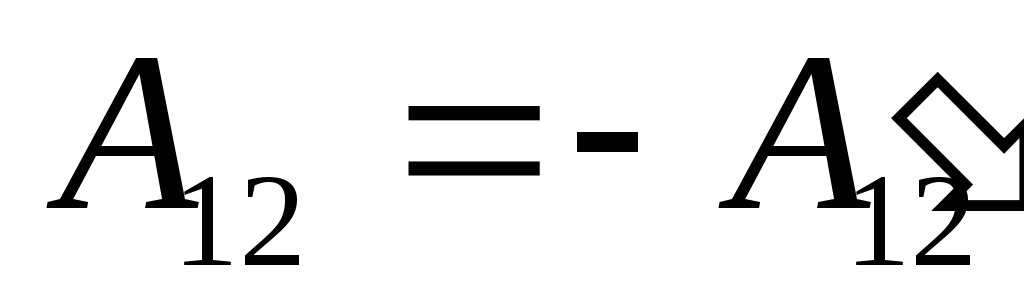 ,
(26.2)
,
(26.2)
dlatego wyrażenie (26.1) można przepisać jako
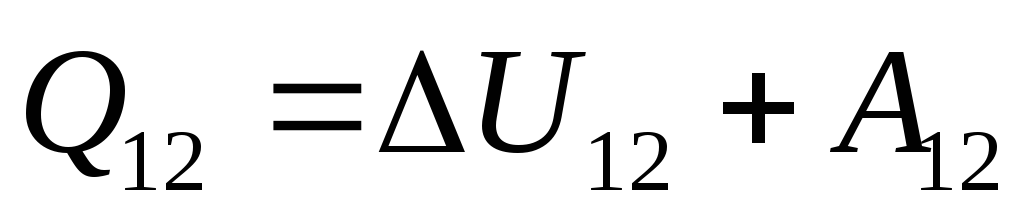 . (26.3)
. (26.3)
Równanie to jest matematycznym zapisem pierwszej zasady termodynamiki: ilość ciepła przekazanego do układu jest zużywana na zmianę jego energii wewnętrznej i wykonywanie przez układ pracy na ciałach zewnętrznych.
Przy nieskończenie małej zmianie stanu układu równanie (26.3) przyjmuje postać
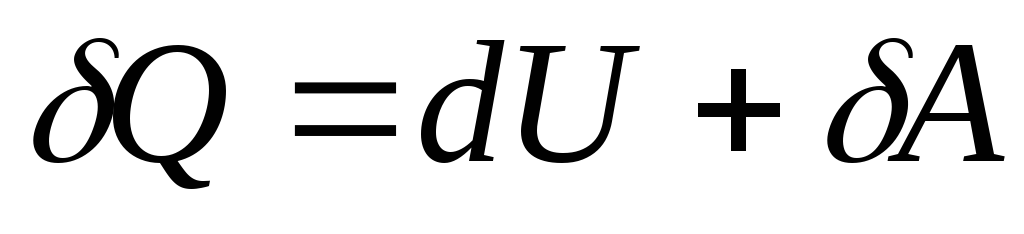 , (26.4)
, (26.4)
gdzie 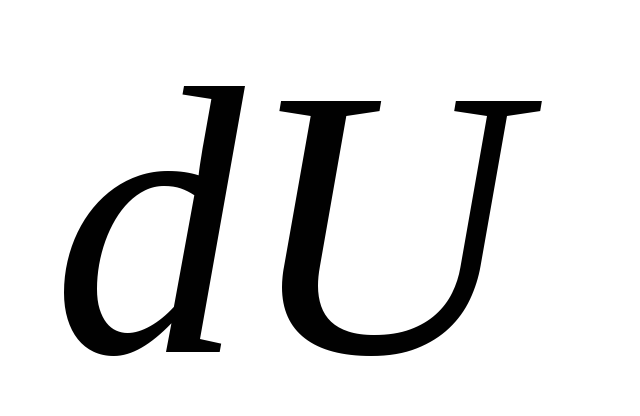 - nieskończenie mała zmiana energii wewnętrznej układu po przekazaniu mu elementarnej ilości ciepła
Q i wykonywanie podstawowych prac przez system
ALE nad ciałami zewnętrznymi.
- nieskończenie mała zmiana energii wewnętrznej układu po przekazaniu mu elementarnej ilości ciepła
Q i wykonywanie podstawowych prac przez system
ALE nad ciałami zewnętrznymi.
