Cieta ķermeņa siltumietilpības noteikšanas metode
Kas ir SILTUMA KApacitāte
Kad siltums tiek piegādāts, sistēmas temperatūra paaugstinās. Bezgalīgi mazu temperatūras izmaiņu gadījumā ir spēkā proporcionalitāte
dT=δQ vai dT=constδQ
Šo attiecību ērtāk ir rakstīt formā: δQ=СdT vai
Vērtību C sauc par sistēmas patieso siltuma jaudu.
Siltuma jauda ir sistēmai piegādātā siltuma daudzuma attiecība pret temperatūras izmaiņām, kas rodas šajā gadījumā.
Papildus patiesajai ir arī vidējā siltuma jauda:
Siltuma jauda
Ja siltumietilpību attiecina uz vielas masas vienību (molu), tad tā kļūst neatkarīga no visas sistēmas masas un iegūst intensīva parametra īpašības. Ja siltumietilpība attiecas uz vielas masas vienību, to sauc par specifisku, bet uz 1 molu - par siltumietilpību ar izmēru J / (mol * k)
Mēs ņemsim vērā tikai molārās siltuma jaudas, kopš viņiem visas likumsakarības ir daudz vienkāršākas nekā konkrētai siltumietilpībai.
Siltuma jauda ir atkarīga no apstākļiem, kādos notiek siltuma pārnese uz sistēmu. Ja sistēma ir ietverta nemainīgā tilpumā, tad temperatūras paaugstināšanās par dT notiks siltuma iedarbībā, kas vienāda ar CvdT, kur Cv ir siltuma jauda nemainīgā tilpumā. Pastāvīga spiediena gadījumā sistēmas paplašināšanas laikā, lai paaugstinātu temperatūru par dT, ir nepieciešams siltums CpdT, kur Cp ir siltuma jauda pie nemainīga spiediena.
Ņemot vērā siltuma pārneses nosacījumus, kad viens vai vairāki mainīgie paliek nemainīgi, bet citi mainās, siltumietilpību var izteikt, izmantojot daļējus atvasinājumus: ![]() . Tā kā δQ v = dU,
. Tā kā δQ v = dU,
δQ p =dH, mēs varam rakstīt:
![]() (1)
(1)
Cv ir gāzu izohoriskā siltumietilpība, Cp ir gāzu izobariskā siltumietilpība.
Atšķirības starp izohorisko un izobarisko siltuma jaudu ir saistītas ar iekšējās enerģijas un entalpijas atšķirībām. Entalpijas un iekšējās enerģijas izmaiņas atšķiras atkarībā no sistēmas veiktā darba apjoma.
δW=∆nRT, ∆H-∆U=∆nRT
Tāpēc siltuma jaudas pie nemainīga tilpuma Cv un nemainīga spiediena Cp atšķiras arī pēc darba apjoma: Cp - Cv = δW
Pamatojoties uz izteiksmēm (1), mēs varam rakstīt:
Aizvietojot šīs vienādības vienādojumā ∆H- ∆U=∆nRT
un ņemot vērā, ka ∆n= 1, mēs atradīsim sakarību starp gāzu molārajām siltumietilpībām:
Cp– Cv= R vai Cp= Cv+ R
Kā redzams, tie atšķiras pēc gāzes konstantes vērtības.
No nosacījuma Cp= Cv+ R izriet, ka Cp˃Cv, t.i., izobāriskā procesā, kad P=const, sistēmas temperatūras paaugstināšanai ir nepieciešams liels daudzums siltums nekā izohoriskā procesā.
Gāzu molārās siltumietilpības vērtības ir R, tāpēc atšķirība starp Cp un Cv ir ļoti nozīmīga. Tātad oglekļa dioksīdam CO 2 pie 25 0 C Cp = 37, 14 un Cv = 28,83 J / (mol * K)
Atšķirība Cp - Cv ir viena mola izobāriskās izplešanās darbs ideāla gāze kad temperatūra paaugstinās par vienu grādu. Ķermeņa šķidrumiem un cietām vielām raksturīgs neliels tilpuma pieaugums, kad tie tiek uzkarsēti. Tāpēc kondensētiem ķermeņiem varam pieņemt, ka Ср ≈ Сv.
KIRCHHOFA VIENĀDOJUMS. TERMĀLĀS IETEKMES ATKARĪBA NO TEMPERATŪRAS.
Iepriekš aplūkotos termisko efektu aprēķinus, pamatojoties uz Hesa likumu veidošanās un degšanas siltumam, ierobežo standarta apstākļi. Praktiskiem nolūkiem ir jāaprēķina termiskie efekti īpašiem apstākļiem, kas nav standarta apstākļi.
Pārejiet no zināmiem termiskajiem efektiem standarta apstākļos, t.i. 25 0 C (298,15 K) temperatūrā un 1 atm spiedienā. (1,013 * 10 5 Pa), ir iespējams aprēķināt termiskos efektus jebkurā mūs interesējošā temperatūrā, izmantojot Kirhhofa likums. Procesiem industriālajos apstākļos ir raksturīga ievērojama temperatūras variācija, kuras diapazonu nosaka ne tikai tehnoloģijas apstākļi, bet arī gadalaiks.Šis diapazons var sasniegt simtiem grādu - dabiski, ka termiskie efekti būs būtiski atšķirīgi un ir atkarīgs no temperatūras.
Apsveriet Kirhhofa likumu diferenciālā formā. Lai to izdarītu, mēs pierakstām entalpijas izmaiņas izobāriskajā un iekšējā enerģijā izohoriskos procesos.
∆H \u003d H2-H1; ∆U \u003d U 2 -U 1.
Atšķiriet šos vienādojumus attiecībā uz temperatūru un iegūstiet:
Kirhhofa vienādojumi:

Un - attiecīgi izobārisko un izohorisko procesu termiskā efekta temperatūras koeficienti; un - sistēmas siltumietilpības izmaiņas attiecīgi izobārisku un izohorisku procesu rezultātā.
Pamatojoties uz Kirhofa vienādojumu, Kirhofa likums formulēts diferenciālā formā: procesa termiskā efekta temperatūras koeficients ir vienāds ar sistēmas siltumietilpības izmaiņām, kas rodas šī procesa rezultātā.
Tādējādi Kirhhofa likums diferenciālā formā ļauj noteikt tikai termiskā efekta izmaiņas ar temperatūru, nevis paša termiskā efekta lielumu.
Analizēsim Kirhhofa vienādojumu
Reakcijai: aA + bB = dD + rR izobāriskā procesā (р=const) saskaņā ar Kirhhofa likumu siltumietilpības izmaiņām sistēmā būs šāda forma:
Līdzīgu izteiksmi var iegūt izohoriskam procesam:
Tā kā Kirhhofa likums ļauj noteikt procesa termiskā efekta izmaiņas, mainoties temperatūrai, mēs veidojam grafiku:
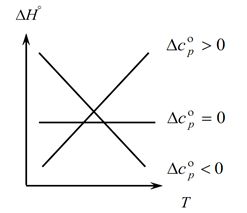
1. Aplūkosim pirmo gadījumu, kad ∆Ср(∆Сv)˃0, jo ∆Ср=∑С kon. -∑С sākotnējais, no tā izriet, ka reakcijas produktu siltumietilpību summa ir lielāka par izejvielu siltumietilpību summu: ∑С con. ˃∑No sākuma Šajā gadījumā grafikā iegūstam 1. līkni, kas nozīmē, ka, paaugstinoties temperatūrai, palielinās arī procesa termiskā efekta izmaiņas (T un ∆H);
2. Otrais gadījums, kad ∆Ср(∆Сv)˂0. Līdzīgi kā pirmajā likumā, mums ir ∑С kon. ˂∑No agra (galaproduktu siltumjaudu summa ir mazāka par sākotnējo vielu siltumietilpību summu). Tad grafikā iegūstam līkni, kas nozīmē, ka, paaugstinoties temperatūrai, procesa termiskā efekta izmaiņas samazinās (Т→∆H↓)
3. Un trešais gadījums, kad sistēmas siltuma jaudu izmaiņas ir vienādas ar nulli ∆Ср(∆Сv)=0. Tad reakciju galaproduktu siltumietilpību summa ir vienāda ar izejmateriālu siltumietilpību summu ∑С con. \u003d ∑ No sākuma. Šajā gadījumā reakcijas termiskais efekts nav temperatūras funkcija (∆H ≠ f(T)) un grafikā iegūstam taisnu līniju.
SILTUMU IETEKMJU APRĒĶINS DOTĀM
TEMPERATŪRA. KIRCHHOFA VIENĀDOJUMA INTEGRĀCIJA
Lai atrastu termiskā efekta vērtību kā temperatūras funkciju, ir jāintegrē vienādojumi

No T līdz T 0 (kur T ir nepieciešamā temperatūra, T 0 ir standarta temperatūra), no ∆H līdz ∆H 0 vai no ∆U līdz ∆U 0 (kur ∆H un ∆U ir entalpija un iekšējā enerģija zem apstākļi, kas atšķiras no standarta). Integrācija tiek veikta divos gadījumos:
Par nē organisko vielu: Organiskajām vielām:
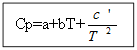
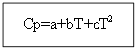
Piemērs: H 2 (g) - neorganiska viela
| Ср=f(T) | T | |||
| a | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27,28 + 3,26 * 10 -3 T +.
a) Aptuvenā integrācija:
izobāriskajam procesam
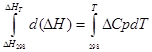
∆H T — ∆H 298 =∆Cp*(T-298)
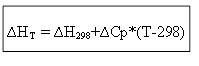
izohoriskajam procesam:
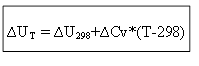
Tātad, lai noteiktu termisko efektu ∆H jeb iekšējo enerģiju ∆U pie jebkuras temperatūras T, ir jāzina procesa siltums standarta apstākļos ∆H 0 (∆U 0) un siltuma jaudu izmaiņas ∆Ср, ∆ Cv.
Piemērs. Aprēķiniet benzola iegūšanas procesa termisko efektu ∆H no acetilēna:
3C2H2 (g) → C6H6 (g) 75 0 C (348 K).
1. No tabulām atrodam benzola un acetilēna vidējās molārās izobāriskās siltumietilpības:
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. Mēs atrodam procesa siltumietilpības izmaiņas:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) sākotnējais \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81,67 - 3 * 43,93 \u003d K - 5.0.
3. Saskaņā ar tabulas datiem mēs atrodam termisko efektu standarta apstākļos:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Atrodiet termisko efektu noteiktā temperatūrā:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = -597,26 * 10 3 + (-50,12) * (348-298) = -599766 J / mol
b) Precīza integrācija:
Apskatīsim otro, sarežģītāku gadījumu, kad siltumietilpības izmaiņas ir atkarīgas no temperatūras, t.i. Ср=f(T), Cv=f(T).
Pievērsīsimies reakcijas vienādojumam vispārīgā formā
dD + rR = qQ + pP
| a | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| J | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
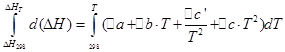
Izohoriskajam procesam mēs veiksim tādas pašas darbības:
IZŠĶĪDĪŠANAS SILTUMS
Tiek sauktas entalpijas izmaiņas cietas, šķidras vai gāzveida vielas pārejas laikā šķīdumā termiskā vai šķīšanas entalpija.
Izšķīšanas siltums parasti ietver kristāla režģa iznīcināšanas siltumu (par cietvielas), jonizācija un solvatācija.
Lai pārrautu saikni starp kristāliskā sāls joniem, nepieciešama enerģija, t.i. kamēr siltums tiek absorbēts. Tajā pašā laikā ūdens šķīdumā notiek jonu hidratācija; starp H 2 O joniem un molekulām veidojas saite. Šķīdīšanas siltuma zīmi nosaka process, kas enerģētiski ir izteiktāks.
LiBr: ∆H dist = - 49,02 kJ / mol - izdalās siltums
KCl: ∆H dist = 7,23 kJ/mol - tiek absorbēts siltums
Atšķirt: integrālais šķīdināšanas siltums ir siltums, kas izdalās vai absorbējas, izšķīdinot 1 molu noteiktas vielas, veidojot noteiktas koncentrācijas šķīdumu. Integrētais šķīdināšanas siltums mainās atkarībā no izšķīdušās vielas daudzuma.
Atšķirt: diferenciālais šķīšanas siltums - tas ir siltums, kas pavada 1 mola dotas vielas izšķīšanu bezgalīgi. liels apjomsšīs vielas šķīdums. Integrālo siltumu plaši izmanto, lai aprēķinātu veidošanās siltumu un citu reakciju siltumu saskaņā ar Hesa likumu. Diferenciālie šķīšanas siltumi raksturo šķīdumu termodinamiskās īpašības un to veidošanās procesu.
LAB Nr.8
CIETU ķermeņu SILTUMKApacitātes NOTEIKŠANA
Instrumenti un piederumi: eksperimentālā iestatīšana FPT1-8.
Mērķis: metāla paraugu siltumietilpības noteikšana ar kalorimetrisko metodi, izmantojot elektrisko apkuri.
Īsa teorija
Vielas īpatnējā siltumietilpība - vērtība, kas vienāda ar siltuma daudzumu, kas nepieciešams, lai uzsildītu 1 kg vielas par 1 K:
Molārā siltuma jauda - vērtība, kas vienāda ar siltuma daudzumu, kas nepieciešams, lai uzsildītu 1 molu vielas uz 1 K:
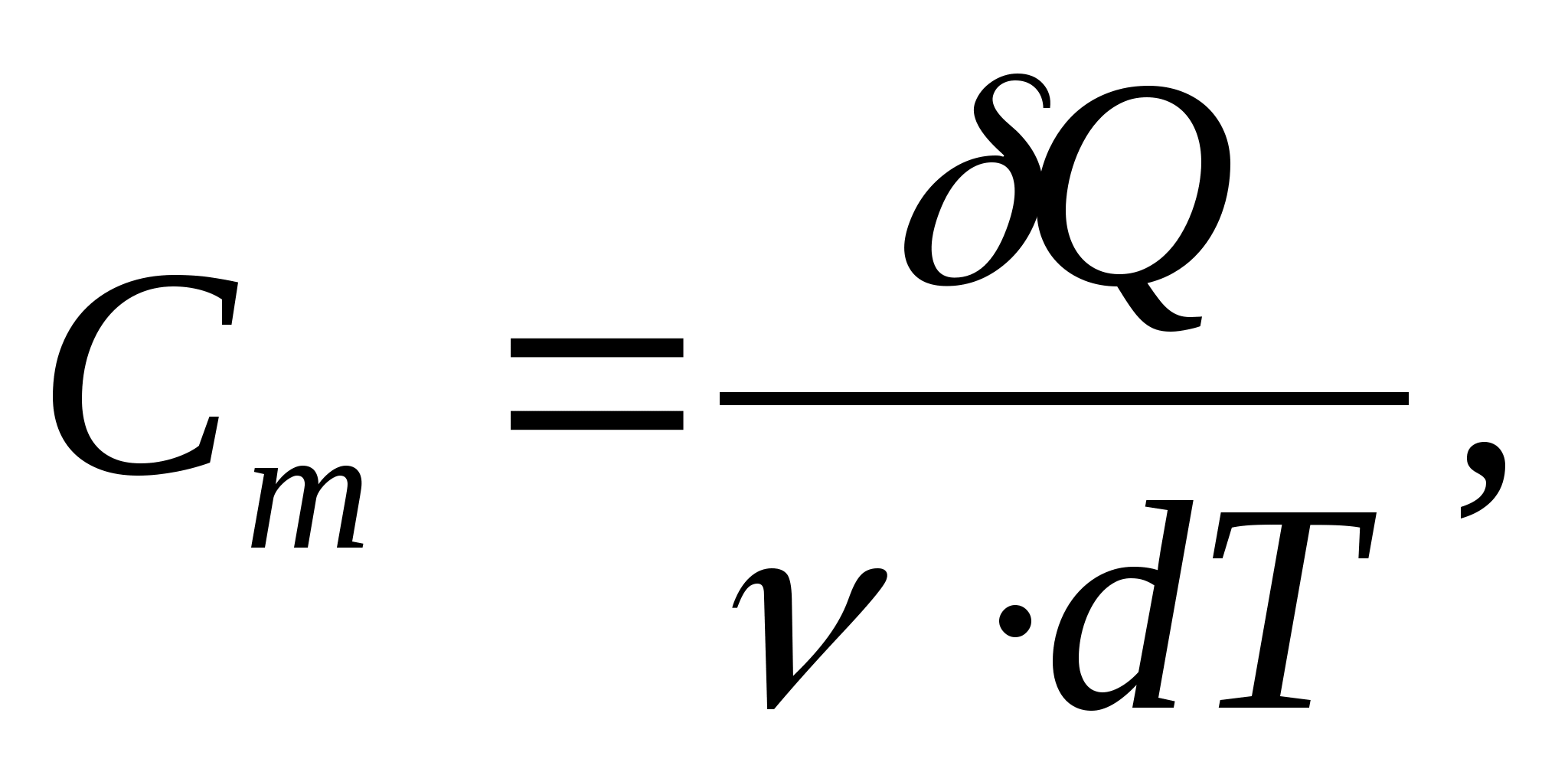
kur 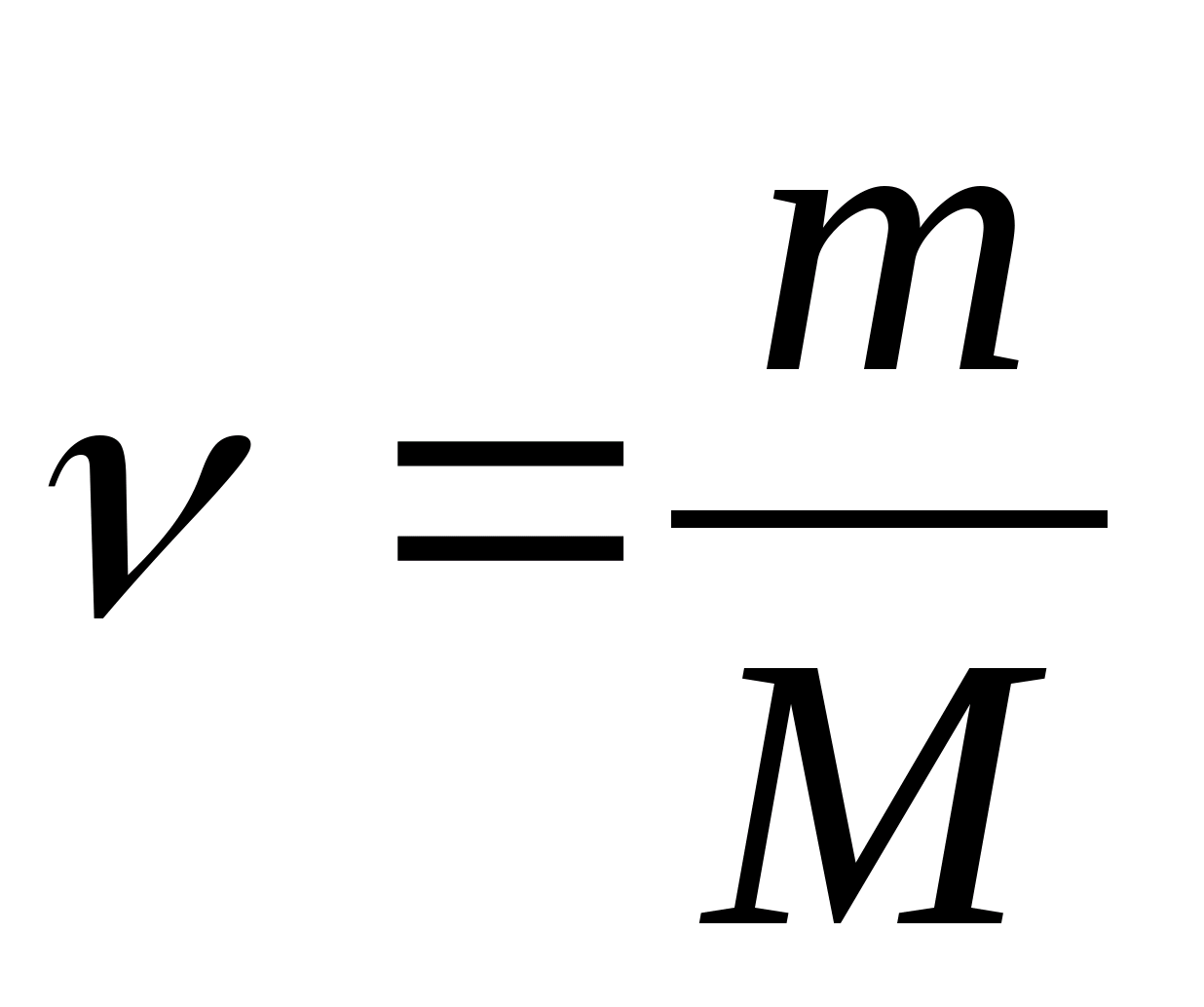 − vielas daudzums.
− vielas daudzums.
Īpašs karstums c saistīts ar molāru C m attiecība

kur M ir vielas molārā masa.
Atšķirt siltuma jauda nemainīgā tilpumā un pastāvīgs spiediens, ja vielas karsēšanas procesā tās tilpums vai spiediens tiek uzturēts nemainīgs.
Tiek saukts mazākais neatkarīgo mainīgo (koordinātu) skaits, kas pilnībā nosaka sistēmas stāvokli telpā brīvības pakāpju skaits .
Saskaņā ar Bolcmaņa likumu par vienmērīgu enerģijas sadalījumu pa molekulu brīvības pakāpēm katra translācijas un rotācijas brīvības pakāpe veido vidējo kinētisko enerģiju, kas vienāda ar
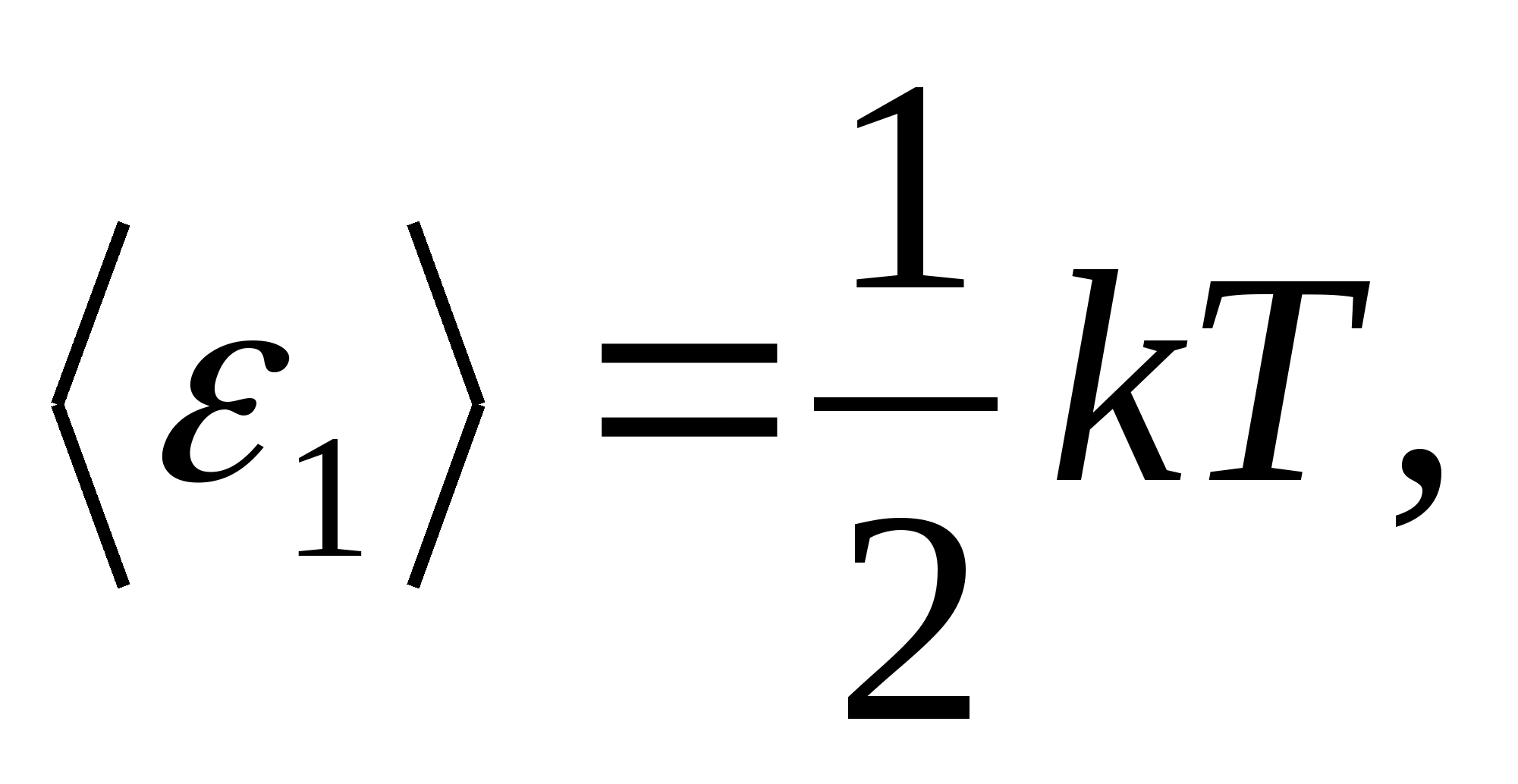
(kur k ir Bolcmaņa konstante), un katrai vibrācijas brīvības pakāpei vidēji enerģija ir vienāda ar
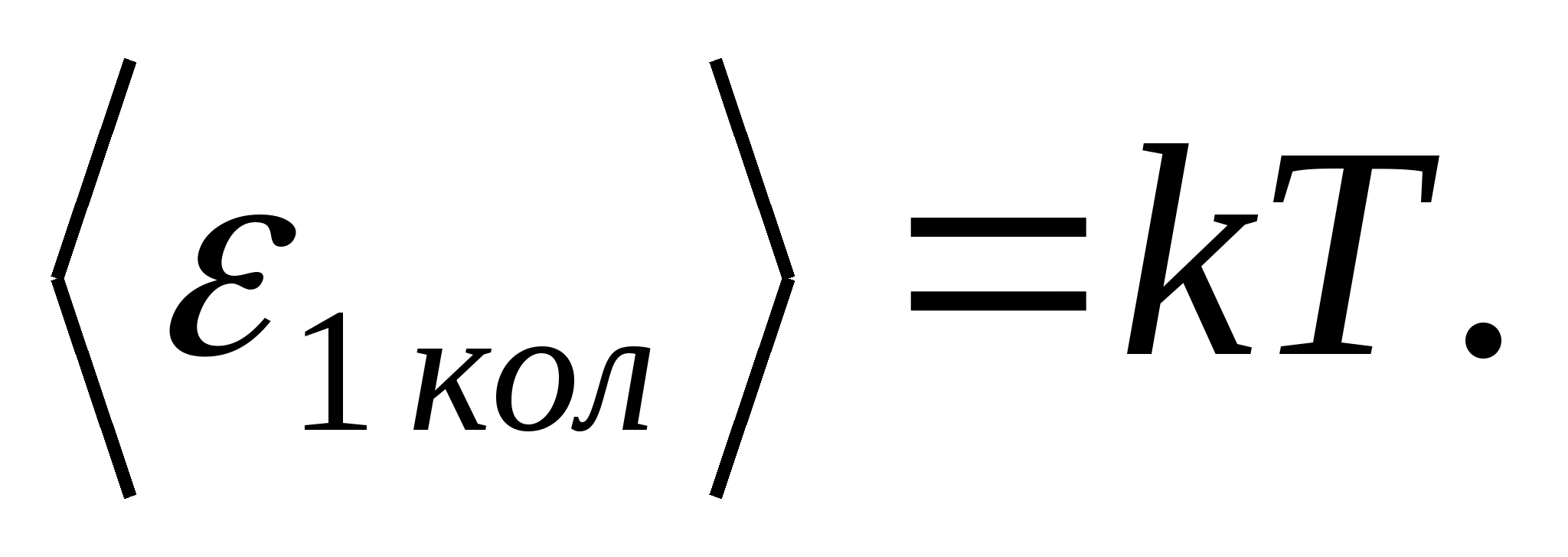
Tādējādi molekulas vidējā enerģija
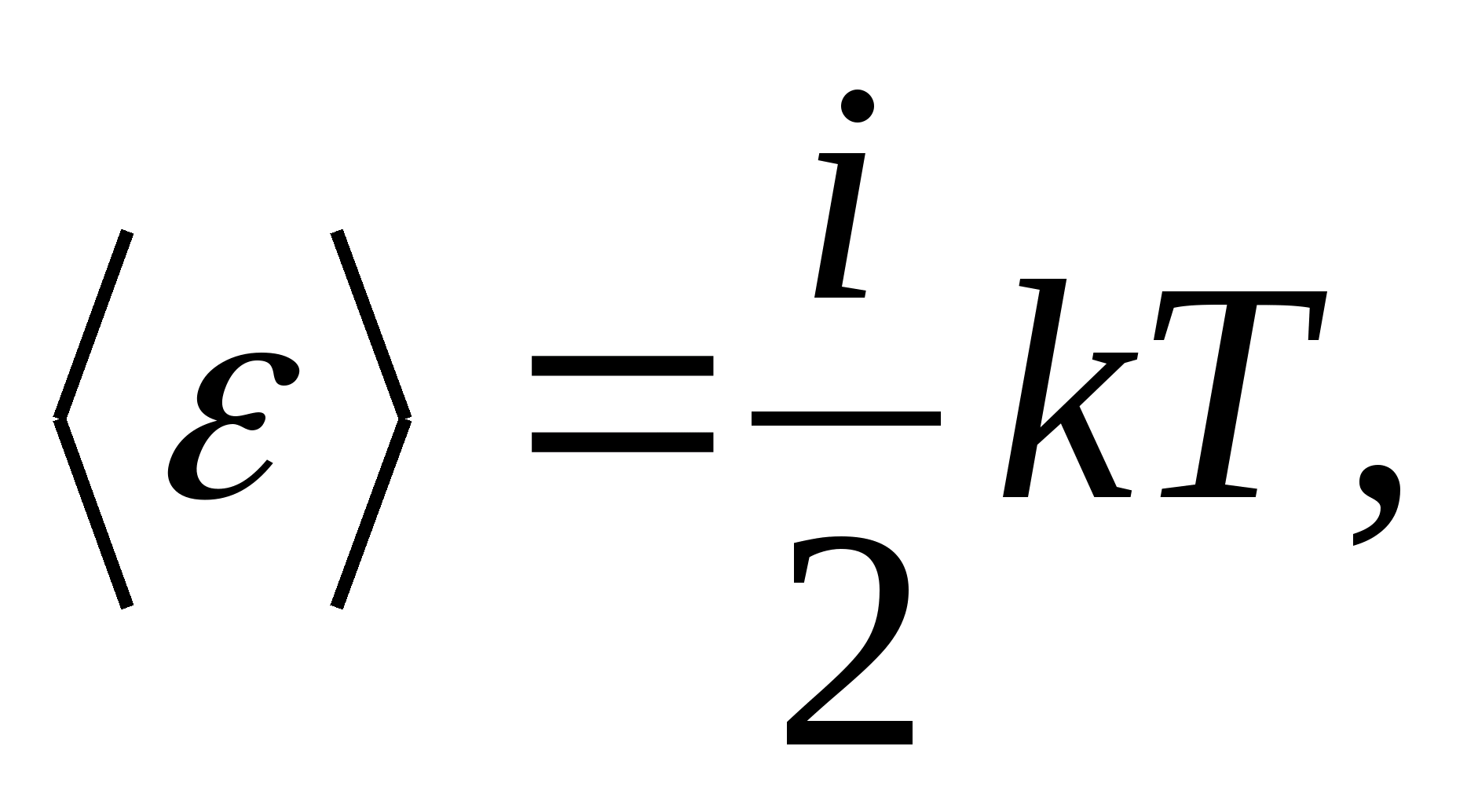
kur i ir molekulas translācijas, rotācijas skaita un divkāršā vibrācijas brīvības pakāpju skaita summa:
![]()
Piemēram, monatomiskās ideālās gāzes molekulu vidējā kinētiskā enerģija ( 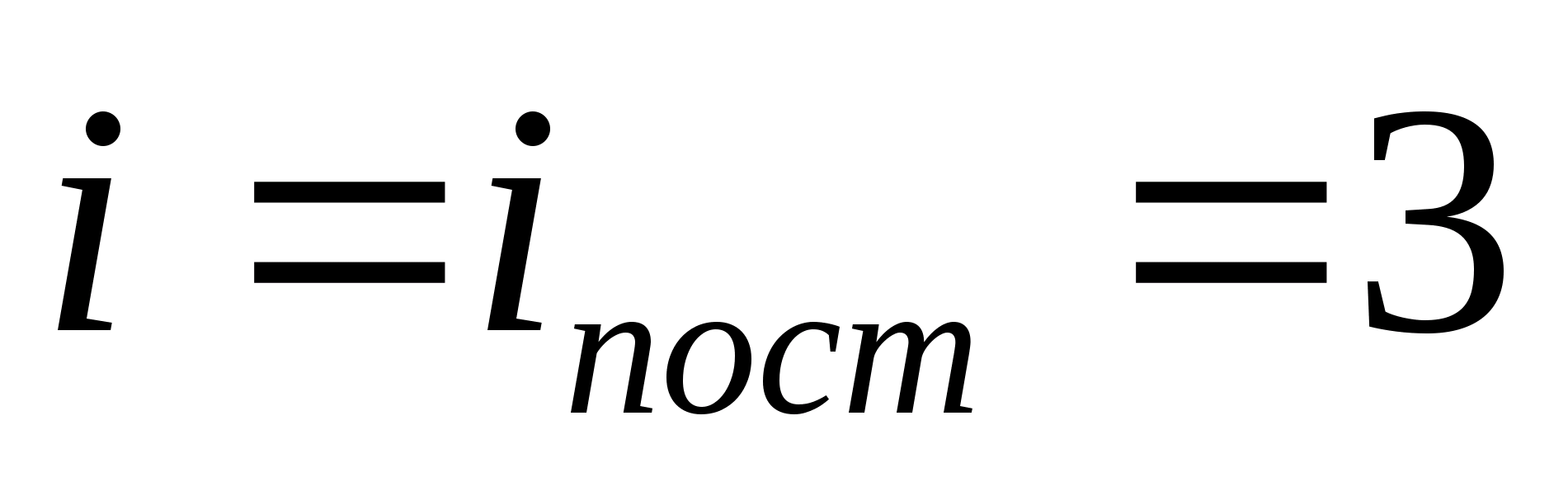 ) ir vienāds ar
) ir vienāds ar
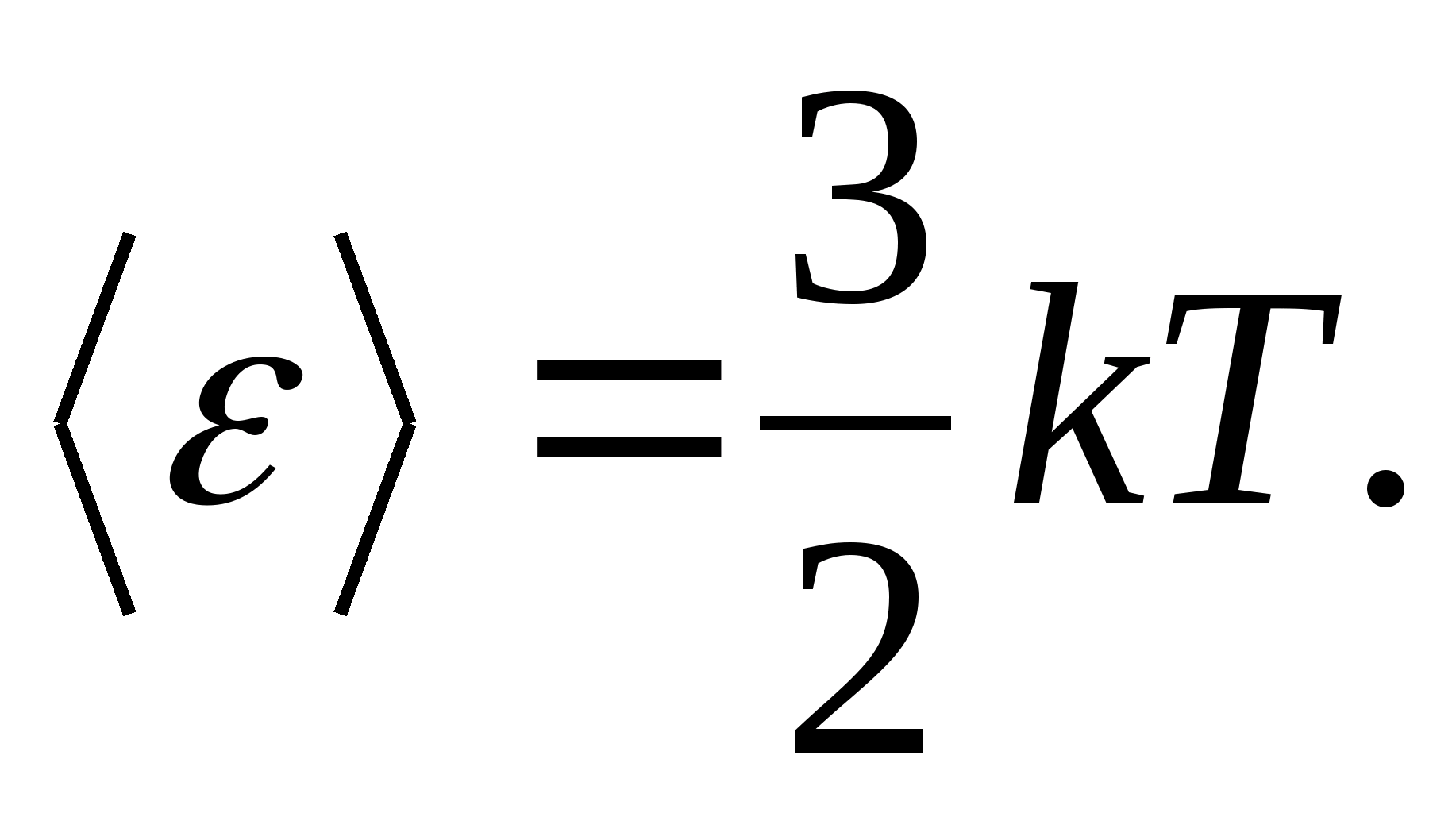
Kā modeļiem cieta ķermeņa, uzskata par pareizi uzbūvētu kristāla režģi, kura mezglos daļiņas (atomi, joni, molekulas) tiek uztvertas kā materiālie punkti, svārstās ap to līdzsvara pozīcijām - režģa mezgli - trīs savstarpēji perpendikulāros virzienos. Tādējādi katrai daļiņai, kas veido kristāla režģi, tiek piešķirtas trīs vibrācijas brīvības pakāpes, no kurām katrai saskaņā ar likumu par vienmērīgu enerģijas sadalījumu pa brīvības pakāpēm ir enerģija. kT.
Tad daļiņas kopējās enerģijas vidējā vērtība oscilācijas kustības laikā kristāla režģī
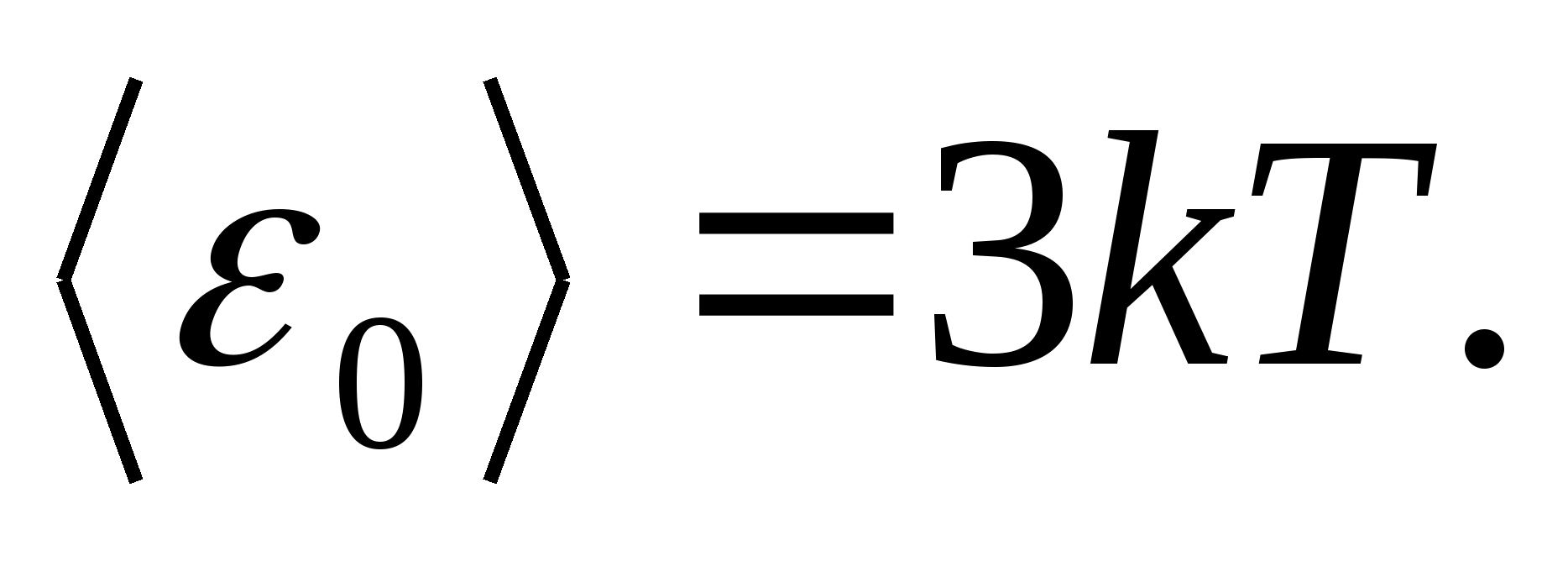
Cieta ķermeņa viena mola kopējo iekšējo enerģiju iegūst, reizinot vienas daļiņas vidējo enerģiju ar neatkarīgi vibrējošo daļiņu skaitu, ko satur viens mols, t.i. uz Avogadro konstanti N A :
kur R=N A k ir universālā (molārā) gāzes konstante, R= 8,31 J/(molK).
Cietām vielām mazā termiskās izplešanās koeficienta dēļ siltuma jaudas pie nemainīga spiediena un nemainīga tilpuma praktiski neatšķiras. Tāpēc, ņemot vērā (8.1), cietas vielas molāro siltumietilpību
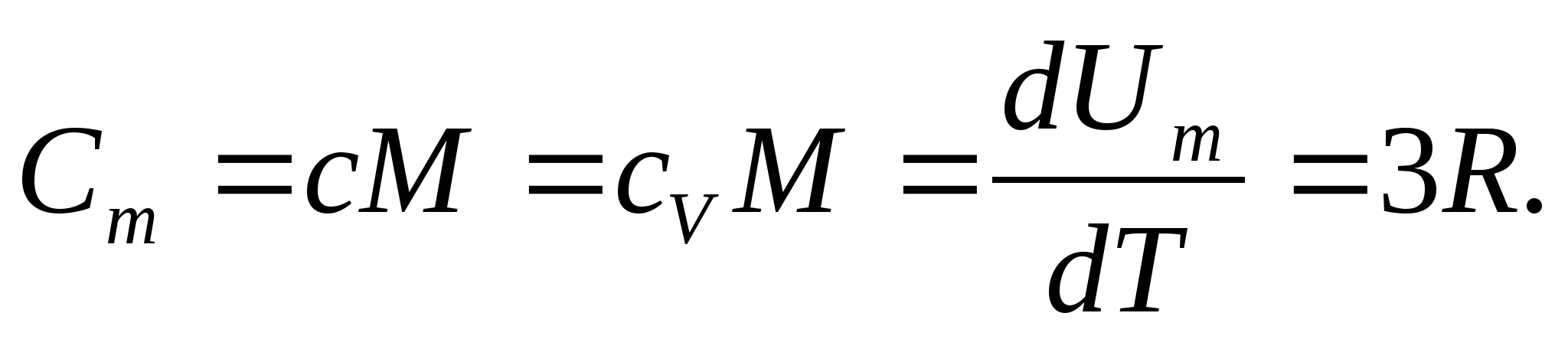 (8.2)
(8.2)
Aizvietojot gāzes molārās konstantes skaitlisko vērtību, mēs iegūstam:
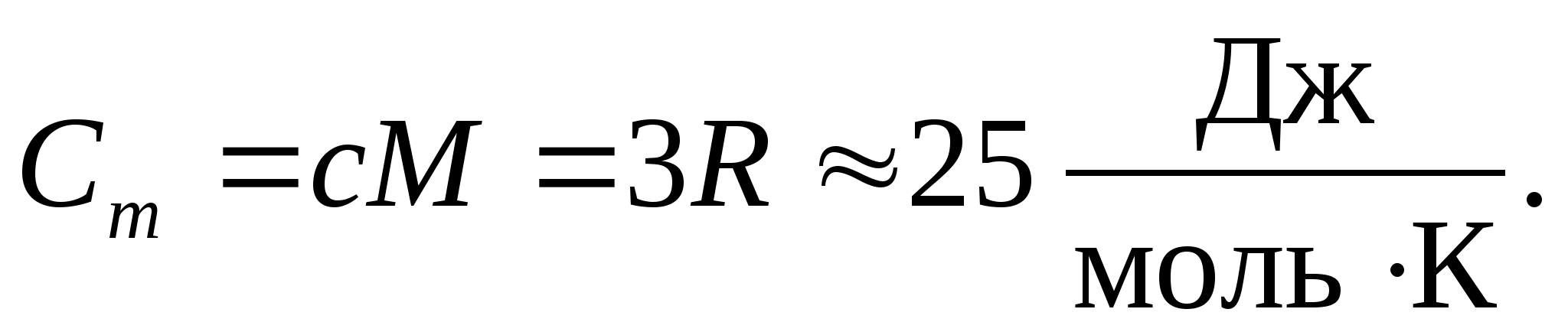
Šī vienlīdzība ir diezgan laba daudzām vielām istabas temperatūrā, un to sauc Dulongas un Petita likums : visu ķīmiski vienkāršā kristāliskā molārā siltumietilpība cietvielas aptuveni vienāds ar 25 J/(mol UZ). Temperatūrai pazeminoties, visu cieto vielu siltuma jaudas samazinās, tuvojoties nullei plkst T0. Tuvu absolūtajai nullei visu ķermeņu molārā siltumietilpība ir proporcionāla T 3, un tikai pie pietiekami augstas temperatūras, kas raksturīga katrai vielai, sāk pastāvēt vienādība (8.2). Šīs cieto vielu siltumietilpības pazīmes zemās temperatūrās var izskaidrot, izmantojot Einšteina un Debija izveidoto siltumietilpības kvantu teoriju.
Lai eksperimentāli noteiktu siltumietilpību, pētāmo ķermeni ievieto kalorimetrā, ko silda ar elektrisko strāvu. Ja kalorimetra temperatūru ar testa paraugu ļoti lēni palielina no sākotnējās T 0 līdz T, tad parauga un kalorimetra sildīšanai tiks izmantota elektriskās strāvas enerģija:
kur es un U− sildītāja strāva un spriegums; − sildīšanas laiks; m 0 un m ir kalorimetra un testa parauga masas, Ar 0 un Ar− kalorimetra un testa parauga īpatnējās siltumietilpības, J− siltuma zudumi kalorimetra siltumizolācijai un apkārtējai telpai.
Lai no (8.3.) vienādojuma izslēgtu kalorimetra sildīšanai patērēto siltuma daudzumu un siltuma zudumus apkārtējai telpai, ar tādu pašu sildītāja jaudu ir jāuzsilda tukšais kalorimetrs (bez parauga) no sākotnējās temperatūras. T 0 tai pašai temperatūras starpībai T. Siltuma zudumi abos gadījumos būs gandrīz vienādi un ļoti mazi, ja kalorimetra aizsargapvalka temperatūra abos gadījumos ir nemainīga un vienāda ar istabas temperatūru:
Vienādojumi (8.3) un (8.4) nozīmē
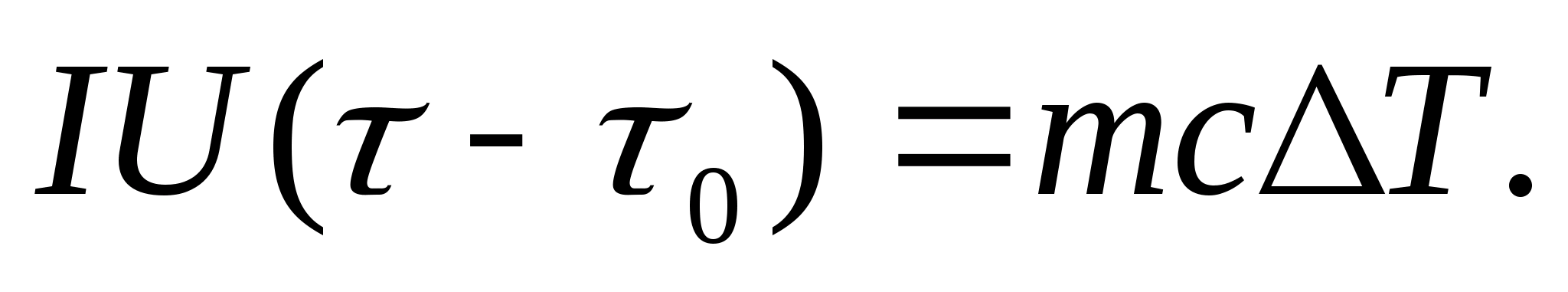 (8.5)
(8.5)
Vienādojumu (8.5.) var izmantot, lai eksperimentāli noteiktu testa parauga materiāla īpatnējo siltumietilpību. Mainot kalorimetra temperatūru, ir jāatzīmē karsēšanas laika starpības atkarība no testa parauga temperatūras izmaiņām: (
−
0)=f(T), atbilstoši kura leņķa koeficientam 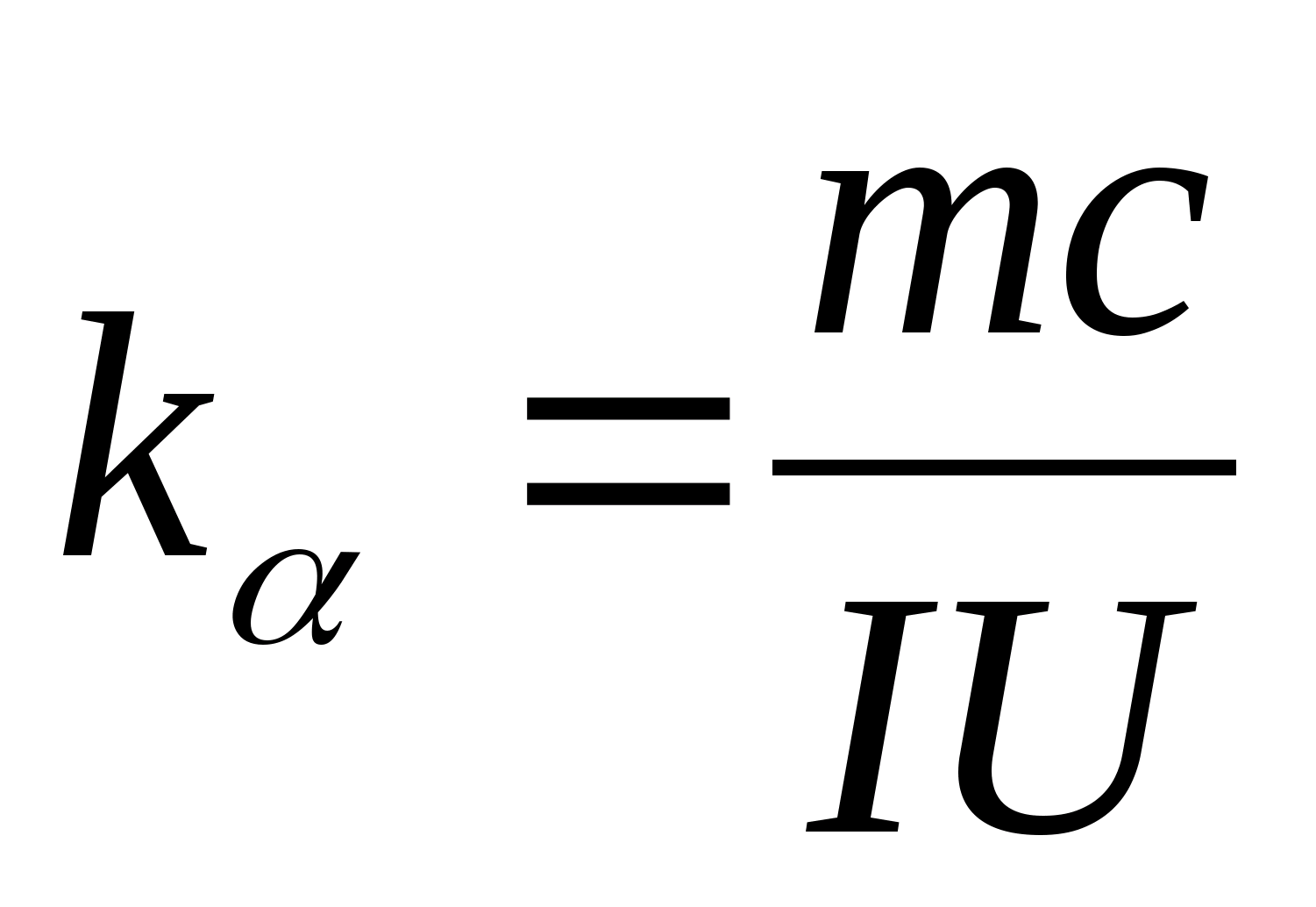 var noteikt parauga īpatnējo siltumietilpību.
var noteikt parauga īpatnējo siltumietilpību.
Laboratorijas iekārtojuma apraksts
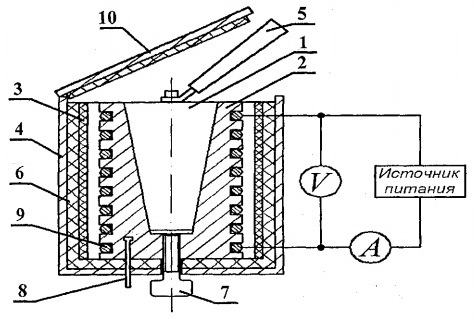
Lai noteiktu cietvielu siltumietilpību, ir izstrādāta FPT1-8 eksperimentālā iekārta, kuras vispārīgais skats ir parādīts attēlā. 8.1. Instalācija sastāv no trim galvenajām daļām: instrumentālā bloka 1, darbības elementa bloka 2 un plaukta 3.
Uz vadības bloka 1 priekšējā paneļa ir: pārslēgšanas slēdzis “NETWORK”, kas savieno iekārtu ar barošanas sprieguma tīklu; pārslēgšanas slēdzis "HEATING", kas ieslēdz sildītāju; regulators “APKURS”, ar kura palīdzību tiek regulēta sildītāja jauda; voltmetrs un ampērmetrs, kas mēra spriegumu un strāvu sildītāja ķēdē; hronometrs, kas mēra kalorimetra sildīšanas laiku. Hronometrs tiek aktivizēts, kad instrumentu bloks ir ieslēgts.
Darba elementa 2 bloks ir aizvērts priekšā ar noņemamu sietu no org. stikls. Veicot darbu, ekrāns tiek piekārts uz darba elementa bloka aizmugurējās sienas. Uz darba elementa paneļa bloka ir digitālais termometrs 6 temperatūras mērīšanai. Apakšā, ligzdās, ir no dažādiem materiāliem izgatavoti 5 testa paraugi un rokturis paraugu ievietošanai sildītājā.
Sildītājs 4 sastāv no metāla korpusa, siltumizolācijas materiāla un kalorimetra.

Paraugus karsē kalorimetrā, kura shēma parādīta att. 8.2.
Kalorimetrs ir misiņa korpuss 2 ar konisku atveri, kurā ievietots testa paraugs 1. Korpusa ārējā virsmā speciālās rievās ievietota sildīšanas spole 9. Ārpusē kalorimetra korpuss ir termiski izolēts ar azbesta slāņiem. 3 un stikla šķiedra 6 un noslēgta ar alumīnija apvalku 4. Kalorimetrs ir noslēgts ar siltumizolējošu vāku 10. Pēc eksperimenta beigām paraugu var izstumt no kalorimetra korpusa koniskā cauruma, izmantojot skrūvi 7. Lai izņemtu sakarsēto paraugu no kalorimetra un ievietotu paraugu sildītājā, tiek izmantots rokturis 5, kas atrodas speciālā kontaktligzdā blakus pētāmajiem paraugiem.
Kalorimetra temperatūru mēra ar digitālo termometru, kura temperatūras sensors 8 atrodas kalorimetra korpusā 2.
Drošība
Veicot darbu, tiek ievērotas vispārējās drošības prasības mehānikas laboratorijā.
Darba kārtība
UZMANĪBU! Kalorimetram nepieciešams ilgs laiks, lai atdziestu, tāpēc pēc visu laika vērtību mērīšanas 0 uzsildot tukšu kalorimetru, nekavējoties izslēdziet apkuri (skat. 4. punktu zemāk). Maksimālā apkures temperatūra šai iekārtai ir +44С.
1. Noņemiet instalācijas darba elementa bloka caurspīdīgo vāku un piekariet to uz aizmugurējā paneļa skrūvēm. Iestatiet HEAT vadības pogu līdz minimumam. Ieslēdziet instalēšanu ar pārslēgšanas slēdzi "NETWORK".
2. Cieši aizveriet tukšā kalorimetra vāku. Ieslēdziet pārslēgšanas slēdzi "HEAT". Izmantojot HEAT regulatoru, iestatiet spriegumu uz 10-20 V (jo augstāks spriegums, jo ātrāka apkure). Ierakstiet tabulā. 8.1 izvēlētās sprieguma vērtības U un pašreizējais es.
3. Sākot no kalorimetra temperatūras t 0, ko norādījis skolotājs, pēc intervāla 1С ievadiet tabulā. 8,1 laika vērtības 0, kas atbilst katrai sasniegtajai temperatūrai t.
4. Izslēdziet pārslēgšanas slēdzi "HEAT", atveriet vāku un atdzesējiet kalorimetru līdz sākotnējai temperatūrai. t 0 . Lai ātri atdzesētu kalorimetru, vienu no paraugiem var nolaist kalorimetrā, izņemot skolotāja norādīto (liekot paraugu kalorimetrā, pagrieziet kalorimetra apakšā esošo skrūvi pa kreisi). Temperatūra sāks kristies. Kad dzesēšanas ātrums samazinās, izņem uzkarsēto paraugu un ievieto nākamo (auksto), izņemot skolotāja norādīto. Lai noņemtu paraugu, pagrieziet skrūvi kalorimetra apakšā pa labi (pulksteņrādītāja virzienā) un pēc tam izvelciet paraugu ar rokturi.
8.1. tabula
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =ArM, J/(molK) |
||||||||
5. Pagriežot skrūvi pa kreisi, ievietojiet kalorimetrā vienu no testa paraugiem, kas ņemti saskaņā ar skolotāja norādījumiem. Cieši aizveriet kalorimetra vāku un pagaidiet 2-3 minūtes, līdz kalorimetra un parauga temperatūra izlīdzinās.
6. Ieslēdziet pārslēgšanas slēdzi "HEAT" un iestatiet ķēdē tādu pašu spriegumu kā sildot tukšo kalorimetru.
7. Sākot no tās pašas sākotnējās kalorimetra temperatūras t 0, pēc intervāla 1С ievadiet tabulā. 8,1 laika vērtības atbilst katrai sasniegtajai temperatūrai t.
8. Iestatiet regulatoru “HEATING” galējā kreisajā pozīcijā (līdz minimumam), izslēdziet “HEATING” pārslēgšanas slēdzi, atveriet kalorimetra vāku. Lai noņemtu paraugu no kalorimetra, pagrieziet skrūvi pa labi un pēc tam noņemiet uzkarsēto paraugu, izmantojot rokturi.
9. Izslēdziet ierīci ar pārslēgšanas slēdzi "NETWORK".
10. Tulkojiet visas daudzumu vērtības 0 un vērtībās sekundēs (bez minūtēs) un ievadiet tās tabulā. 8.1. Katrai tabulas rindai. 8.1 aprēķina vērtības = − 0 un T= t− t 0 .
11. Izmantojot formulu, veiciet parauga īpatnējās siltumietilpības aprēķinu 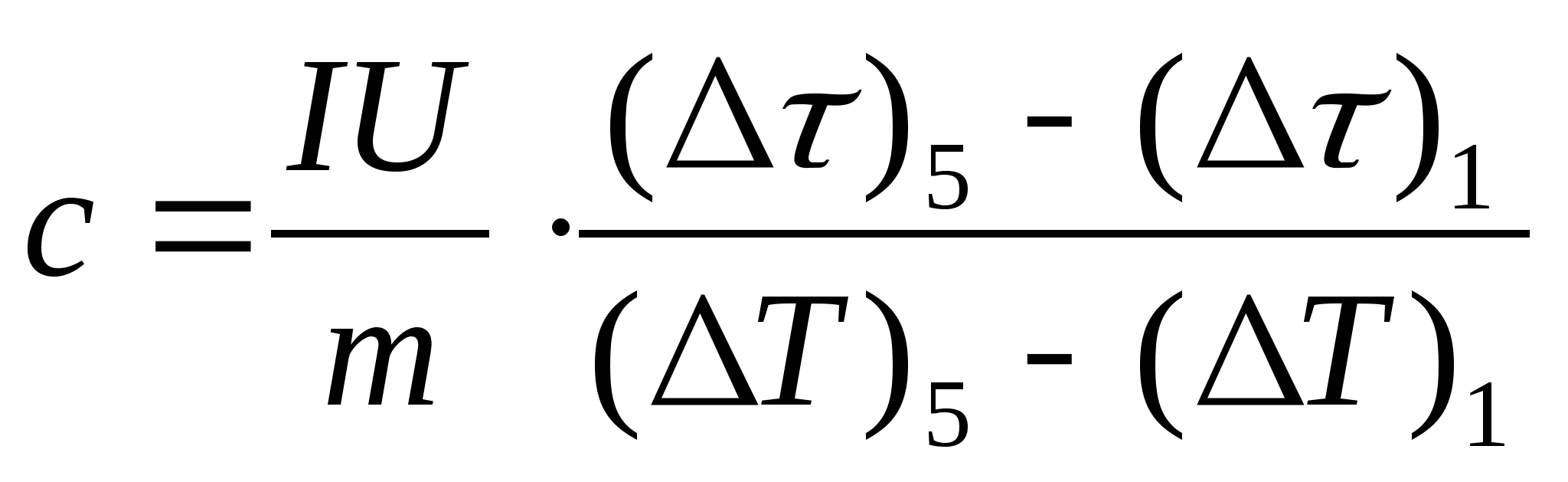 , kur parauga masa m=139,5 g (misiņš) vai m=129,7 g (tērauds) vai
m=46,05 g (duralumīnijs). Nāciet pie skolotāja, lai pārbaudītu.
, kur parauga masa m=139,5 g (misiņš) vai m=129,7 g (tērauds) vai
m=46,05 g (duralumīnijs). Nāciet pie skolotāja, lai pārbaudītu.
Mērījumu rezultātu apstrāde
1. Sižets
=f(T) kalorimetra ar paraugu un tukšā kalorimetra sildīšanas laika starpības atkarību no kalorimetra temperatūras izmaiņām, izvēlieties jebkurus divus punktus grafikā un nosakiet taisnes slīpumu, izmantojot formulu. 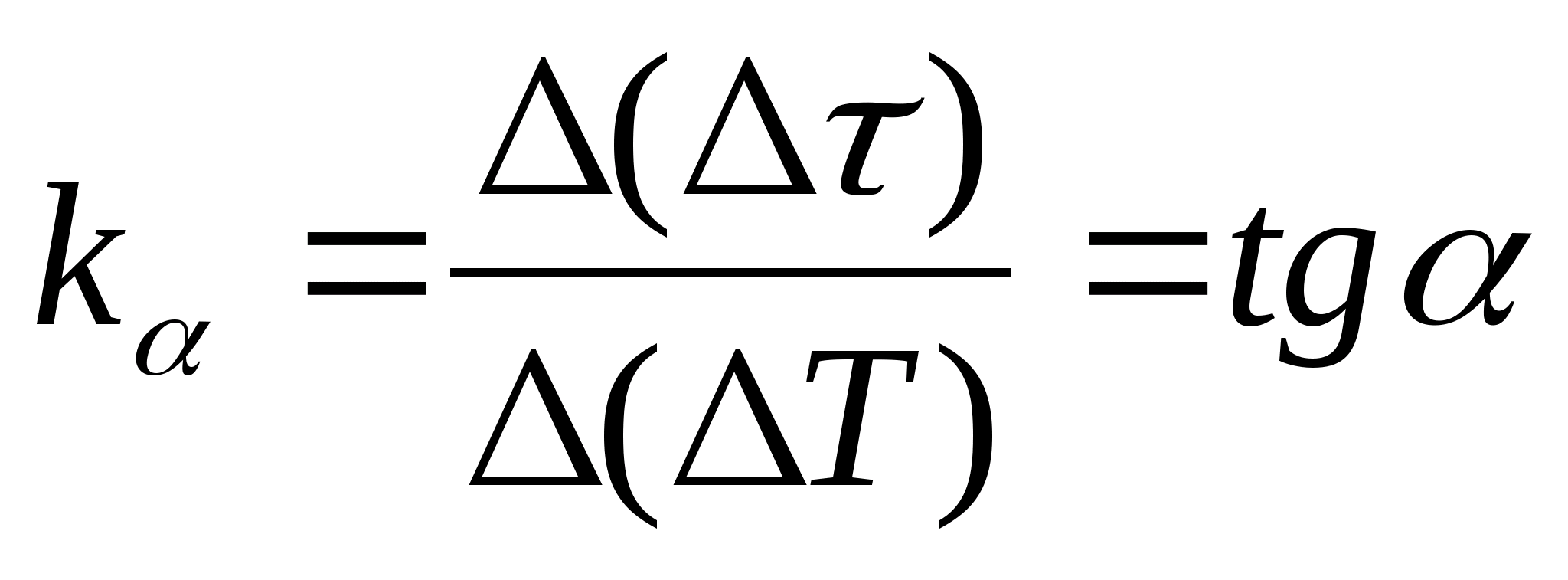 , kur
− grafika slīpuma leņķis pret asi T
(ja mērvienības
un T tiek parādīti uz abām asīm kā vienāda garuma segmenti).
, kur
− grafika slīpuma leņķis pret asi T
(ja mērvienības
un T tiek parādīti uz abām asīm kā vienāda garuma segmenti).
2. Izmantojot slīpuma vērtību k
, nosaka parauga īpatnējo siltumietilpību, izmantojot formulu 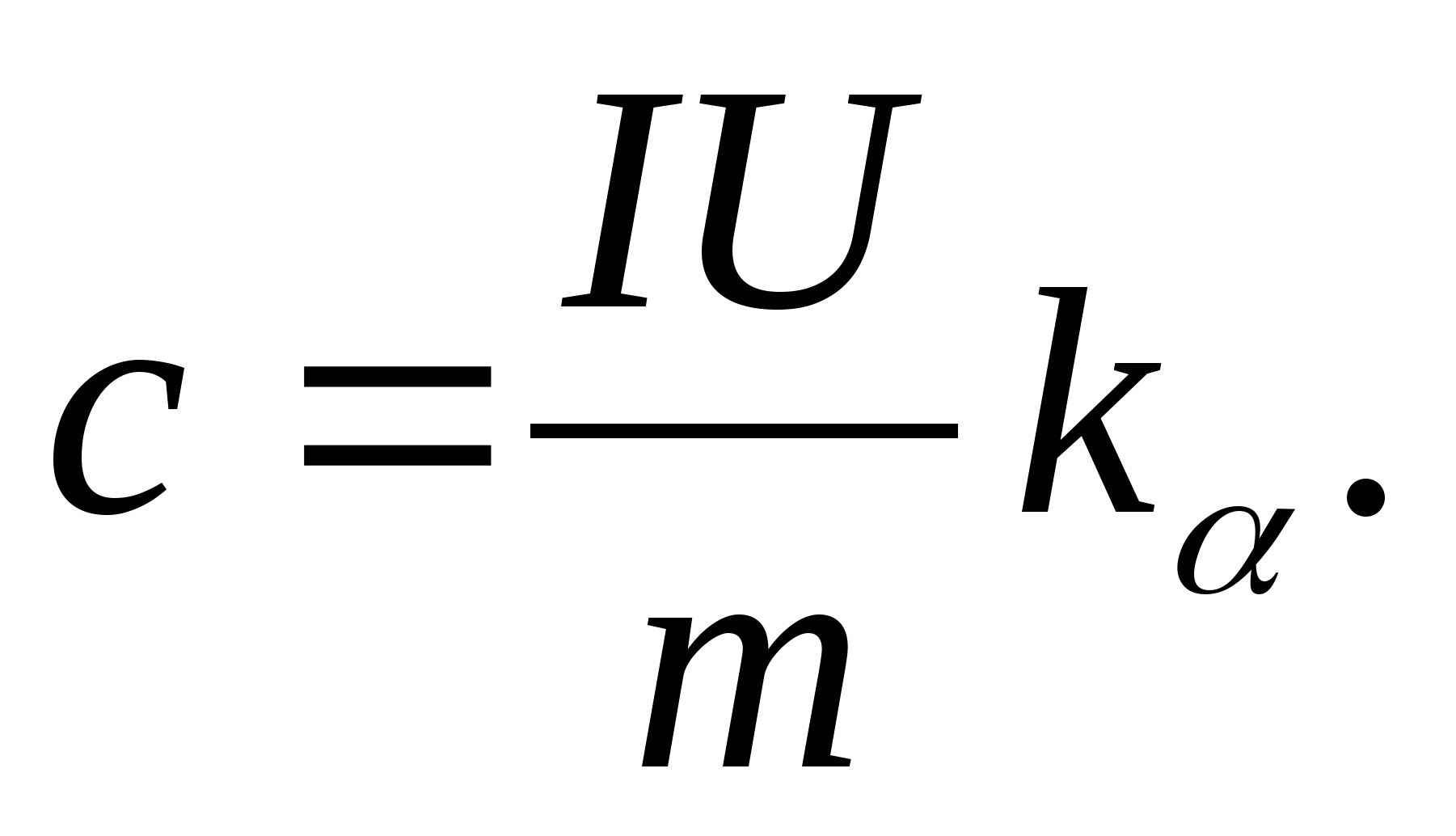
3. Izmantojot datus 8.2. tabulā (vai periodiskajā tabulā), nosakiet parauga molāro siltumietilpību, izmantojot formulu. C m =ArM.
8.2. tabula
|
Materiāla paraugs |
Atomu masa, kg/mol |
|
Par cieta ķermeņa modeli aplūkosim pareizi konstruētu kristāla režģi, kura mezglos daļiņas (atomi, joni, molekulas), kas ņemtas par materiālajiem punktiem, svārstās ap savām līdzsvara pozīcijām - režģa mezgliem - trīs savstarpēji perpendikulāros virzienos. . Tādējādi katrai daļiņai, kas veido kristāla režģi, ir piešķirtas trīs vibrācijas brīvības pakāpes, no kurām katrai saskaņā ar enerģijas līdzdalības likumu starp brīvības pakāpēm (sk. 50. §) ir enerģija. kT.
Cieta ķermeņa mola iekšējā enerģija
U m \u003d 3N A kT \u003d 3RT,
kur N A ir Avogadro konstante; N A k= R (R ir molārā gāzes konstante).
Cietas vielas molārā siltumietilpība
i., molārā (atomu) siltumietilpība ķīmiski vienkārši ķermeņi kristāliskā stāvoklī ir vienāds (vienāds ar 3 R) un tas nav atkarīgs no temperatūras. Šo likumu empīriski ieguva franču zinātnieki P. Dulongs (1785-1838) un L. Petit (1791-1820), un tas ir virsrakstsDulongas un Petita likums.
Ja cieta viela ir ķīmisks savienojums (piemēram, NaCl), tad daļiņu skaits molā nav vienāds ar Avogadro konstanti, bet ir vienāds ar nN A , kur n - atomu skaits molekulā (NaCl daļiņu skaits molā ir 2 N un tātad viens mols NaCl satur N A Na atomus un N A Cl atomus). Tātad molārā siltuma jauda cietie ķīmiskie savienojumi
C V \u003d 3R25n J / (mol K),
i., vienāds ar šo savienojumu veidojošo elementu atomu siltumietilpību summu.
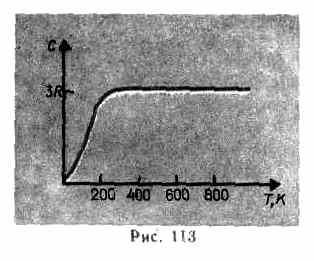
Kā liecina eksperimentālie dati (4. tabula), daudzām vielām Dulonga un Petita likums ir apmierināts ar diezgan labu tuvinājumu, lai gan dažām vielām (C, Be, B) ir būtiskas novirzes no aprēķinātajām siltuma jaudām. Turklāt, tāpat kā gāzu gadījumā (sk. 53. §), eksperimenti ar cietvielu siltumietilpības mērīšanu zemā temperatūrā ir parādījuši, ka tā ir atkarīga no temperatūras (113. att.). Tuvu nullei Kelvina ķermeņu siltumietilpība ir proporcionāla T 3 , un tikai pietiekami augstā temperatūrā, kas raksturīgs katrai vielai, tiek izpildīts nosacījums (73.1). Piemēram, dimanta siltuma jauda ir 3 R pie 1800 K! Tomēr lielākajai daļai cieto vielu istabas temperatūra jau ir pietiekami augsta.
Neatbilstība starp eksperimentālajām un teorētiskajām siltuma jaudu vērtībām, kas aprēķinātas
klasiskās teorijas pamats, skaidroja, balstoties uz siltuma jaudu kvantu teoriju, A. Einšteins un P. Debijs (1884-1966).
§ 74. Iztvaikošana, sublimācija, kausēšana un kristalizācija. Amorfie ķermeņi
Gan šķidrumos, gan cietās vielās vienmēr ir noteikts skaits molekulu, kuru enerģija ir pietiekama, lai pārvarētu pievilcību citām molekulām, un kuras spēj atrauties no šķidruma vai cietas vielas virsmas un nonākt apkārtējā telpā. Šo šķidruma procesu sauc iztvaikošana(vai iztvaikošana), cietvielām - sublimācija(vai sublimācija).
Šķidrumu iztvaikošana notiek jebkurā temperatūrā, bet tās intensitāte palielinās, palielinoties temperatūrai. Paralēli iztvaikošanas procesam notiek kompensācijas process kondensāts tvaiki par šķidrumu. Ja molekulu skaits, kas laika vienībā atstāj šķidrumu caur virsmas vienības virsmu, ir vienāds ar molekulu skaitu, kas pāriet no tvaiku uz šķidrumu, tad dinamiskais līdzsvars starp iztvaikošanas un kondensācijas procesiem. Tvaikus, kas ir līdzsvarā ar šķidrumu, sauc bagāts(sk. arī 62.§).
Lielākajai daļai cieto vielu sublimācijas process parastā temperatūrā ir niecīgs, un tvaika spiediens uz cietās vielas virsmas ir zems; tas palielinās, palielinoties temperatūrai. Intensīvi sublimē tādas vielas kā naftalīns, kampars, ko nosaka asa, raksturīga smarža. Īpaši intensīvi sublimācija notiek vakuumā – to izmanto spoguļu izgatavošanai. Labi zināms sublimācijas piemērs ir ledus pārvēršanās tvaikā – slapja veļa aukstumā izžūst.
Ja cietu ķermeni silda, tad tā iekšējā enerģija(daļiņu vibrāciju enerģijas summa režģa vietās un šo daļiņu mijiedarbības enerģija) palielinās. Temperatūrai paaugstinoties, daļiņu svārstību amplitūda
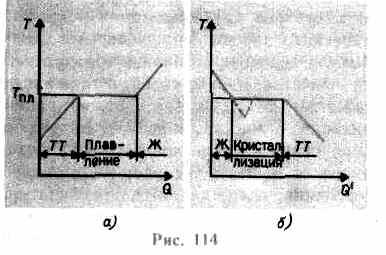
palielinās līdz kristāla režģa sabrukšanai - cietā viela kūst. Uz att. 114 a tiek parādīta aptuvenā atkarība T(J), kur J- siltuma daudzums, ko ķermenis saņem kušanas laikā. Kā vēstījums cietai ķermeņa siltums tā temperatūra paaugstinās, un kušanas temperatūrā T pl sākas ķermeņa pāreja no cieta stāvokļa uz šķidru. Temperatūra T pl paliek nemainīgs, līdz viss kristāls ir izkusis, un tikai tad šķidruma temperatūra atkal sāk celties.
Sildot cietu līdz T pl vēl nepārvērš to šķidrā stāvoklī, jo vielas daļiņu enerģijai jābūt pietiekamai, lai iznīcinātu kristālisko režģi. Kušanas procesā vielai piešķirtais siltums tiek izmantots, lai veiktu kristāla režģa iznīcināšanu, un tāpēc T pl \u003d const, līdz viss kristāls ir izkusis. Tad piegādātais siltums atkal iet, lai palielinātu šķidruma daļiņu enerģiju, un tā temperatūra sāks celties. Siltuma daudzumu, kas nepieciešams, lai izkausētu 1 kg vielas, sauc īpatnējais saplūšanas siltums.
Ja šķidrumu atdzesē, tad process notiek pretējā virzienā (114. att., b; J" - siltuma daudzums, ko ķermenis izdala kristalizācijas laikā): vispirms šķidruma temperatūra pazeminās, tad nemainīgā temperatūrā, kas vienāda ar T pl, sākas kristalizācija, pēc tā pabeigšanas kristāla temperatūra sāk pazemināties. Vielas kristalizācijai klātbūtne t.s kristalizācijas centri - kristāliskie kodoli, kas var būt ne tikai izveidotās vielas kristāli, bet arī piemaisījumi, kā arī putekļi, sodrēji u.c. Kristalizācijas centru neesamība tīrā šķidrumā apgrūtina mikroskopisku kristālu veidošanos, un viela, paliekot šķidrā stāvoklī, atdziest līdz temperatūrai, kas ir zemāka par kristalizācijas temperatūru, tādējādi veidojot pārdzesēts šķidrums(uz 114, b tas atbilst punktētai līknei). Ar spēcīgu pārdzesēšanu sākas spontāna kristalizācijas centru veidošanās un viela diezgan ātri kristalizējas.
Parasti kausējuma pārdzesēšana notiek no frakcijām līdz desmitiem grādu, bet vairākām vielām tā var sasniegt simtiem grādu. Augstās viskozitātes dēļ ļoti pārdzesēti šķidrumi zaudē plūstamību, saglabājot formu, līdzīgi kā cietām vielām. Šos ķermeņus sauc amorfas cietas vielas; tie ietver sveķus, vasku, blīvējuma vasku, stiklu. Amorfie ķermeņi, kas tādējādi ir pārdzesēti šķidrumi, izotropisks, i., to īpašības visos virzienos ir vienādas; tiem, tāpat kā šķidrumiem, tas ir raksturīgi īstermiņa pasūtījums daļiņu izkārtojumā; tajos, atšķirībā no šķidrumiem, daļiņu kustīgums ir diezgan mazs. Amorfo ķermeņu iezīme ir tāda, ka tiem nav noteiktas kušanas temperatūras, tas ir, nav iespējams norādīt konkrētu temperatūru, virs kuras varētu noteikt šķidru stāvokli, un zem cietā stāvokļa. No pieredzes zināms, ka amorfos ķermeņos laika gaitā var novērot kristalizācijas procesu, piemēram, stiklā parādās kristāli; tas, zaudējot caurspīdīgumu, sāk kļūt duļķains un pārvērsties par polikristālisku ķermeni.
Nesen plaši izmantots tautsaimniecība ieguva polimēri- organiski amorfi ķermeņi, kuru molekulas sastāv no liela skaita identisku garu molekulāro ķēžu, kas savienotas ar ķīmiskām (valences) saitēm. Pie polimēriem pieder gan dabīgas (ciete, olbaltumvielas, gumija, šķiedra u.c.), gan mākslīgās (plastmasa, gumija, polistirols, lavsāns, neilons u.c.) organiskās vielas. Polimēriem piemīt izturība un elastība; daži polimēri iztur stiepšanos 5-10 reizes lielāku par sākotnējo garumu. Tas izskaidrojams ar to, ka garās molekulārās ķēdes deformācijas rezultātā var salocīt blīvās bumbiņās vai izstiepties taisnās līnijās. Polimēru elastība izpaužas tikai noteiktā temperatūras diapazonā, zem kura tie kļūst cieti un trausli, bet augstāk - plastmasas. Lai gan ir radīts ļoti daudz sintētisko polimēru materiālu (mākslīgās šķiedras, ādas aizstājēji, būvmateriāli, metāla aizstājēji u.c.), polimēru teorija vēl nav pilnībā izstrādāta. Tās attīstību nosaka mūsdienu tehnoloģiju prasības, kas prasa polimēru sintēzi ar iepriekš noteiktām īpašībām.
Vielas īpatnējo siltumietilpību saprot kā vērtību
, (1)
kur ir ķermeņa nodotā siltuma daudzums.
ir temperatūras izmaiņas, kas notiek
siltuma pārneses uz ķermeni rezultātā,
m ir sakarsētā ķermeņa masa.
Pieredze parasti nosaka vidējo īpašs karstums viela c, skaitliski vienāds ar siltuma daudzumu, kas jāpiešķir šīs vielas masas vienībai, lai paaugstinātu tās temperatūru par:
(2),
kur ir atšķirība starp pētāmā ķermeņa galīgo un sākotnējo temperatūru.
Lai eksperimentāli noteiktu siltumietilpību, tiek izmantotas dažādas kalorimetriskās metodes. Šo metožu daudzveidība ir saistīta ar to, ka precīza ķermeņa nodotā siltuma daudzuma mērīšana prasa novērst siltuma zudumus, kas netiek ņemti vērā, sildot pētāmo ķermeni.
Parasti tā sauktajos kalorimetros ar izotermisku apvalku tiek ieviesta aprēķināta vai eksperimentāli noteikta korekcija starojumam, tas ir, siltuma daudzumam, ko kalorimetrs eksperimenta laikā ar starojumu saņem vai izdala ārējai videi.
Tomēr ir iespējams būtiski samazināt siltuma zudumus, ieviešot labu siltumizolāciju vai samazinot eksperimenta ilgumu, kas tiek panākts ar lielu parauga uzsildīšanas ātrumu ~ (impulsa metode siltumietilpības mērīšanai), pie kura siltuma zudumi tiks samazināti. jābūt mazam, salīdzinot ar kopējo piegādātās siltuma daudzumu.
Viena no precīzākajām siltuma jaudas noteikšanas metodēm ir adiabātiskā kalorimetra metode. Grūtības, kas saistītas ar nepieciešamību ņemt vērā siltuma zudumus šāda veida kalorimetros, novērš fakts, ka mērījumi tiek veikti termiskā līdzsvara apstākļos, tas ir, vienādas testa parauga un paraugu apņemošā bloka temperatūras apstākļos. Šīs metodes priekšrocības līdzās augstajai precizitātei ietver arī iespēju noteikt cieto vielu siltumietilpību plašā temperatūras diapazonā, kas ir īpaši svarīgi, ja vielās notiek fāzu pārvērtības.
Viena no adiabātiskā kalorimetra veida ierīce shematiski parādīta attēlā. Pārbaudāmo paraugu 1 ievieto vara blokā 3 un kopā ar to karsē krāsnī 4. Parauga iekšpusē tiek ievietots sildītājs 2, kas ļauj papildus uzsildīt paraugu.
Pēc 4. krāsns ieslēgšanas, kurā ievietots bloks ar paraugu, parauga temperatūra sāk celties, paliekot zem bloka temperatūras. Lai panāktu vienlīdzību starp parauga un bloka temperatūru, ieslēdziet parauga iekšpusē ievietoto sildītāju. Kad parauga temperatūra nedaudz pārsniedz bloka temperatūru, iekšējais sildītājs tiek izslēgts.
Pēc tam šis sildītājs tiek periodiski ieslēgts un izslēgts, lai temperatūras starpība starp paraugu un bloku visu laiku mainītu zīmi.
Brīdī, kad tas ir vienāds ar nulli (kad ir ieslēgts iekšējais sildītājs), starp paraugu un bloku nenotiek siltuma apmaiņa, un viss iekšējā sildītāja izdalītais siltuma daudzums tiek tērēts tikai parauga sildīšanai; īpatnējo siltumu šajā gadījumā var noteikt pēc formulas (2).
Iekšējā sildītāja izdalītā siltuma daudzumu nosaka pēc formulas:
kur I ir iekšējā sildītāja strāva;
V ir sprieguma kritums tajā;
- laika intervāls, kurā temperatūra paaugstinājās par .
Tad
(4)
kur ir laiks, kurā parauga temperatūra mainījās par .
Diferenciālā formā formulai (4) ir forma
(5)
Parauga temperatūru mēra ar termopāri T. Temperatūras starpību starp bloku un paraugu mēra ar diferenciālo termopāri. Parauga temperatūras noteikšanai tiek izmantota termopāra kalibrēšanas līkne T. Temperatūras starpību starp bloku un paraugu nosaka galvanometra skalas dalījumos (jo nepieciešams tikai fiksēt momentu, kad temperatūras starpība starp bloku un paraugu izmaiņu zīmes paraugs).
Darba pabeigšana.
Paraugu novieto uz sildītāja, kas ievietots vara blokā. Termopāra savienojumi T un ir savienoti ar paraugu un bloku. Cepeškrāsns ir aizvērta ar vāku. Tiek ieslēgts krāsns elektriskais tinums, kurā ievietots bloks. Parauga iekšpusē ievietotais sildītājs tiek periodiski ieslēgts un izslēgts, un I un V vērtības tiek ierakstītas iekšējā sildītāja ķēdē.
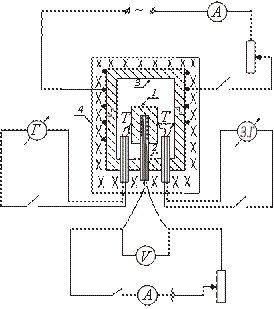
Pirms mērījumu sākšanas ir jāpārbauda spoguļa galvanometra nulles pozīcija. Lai to izdarītu, atvienojot termopāri no galvanometra, viņi sagaida, ka zaķis pārtrauks svārstības gar skalu. Ja pēc šī pavediena attēls nesakrīt ar nulli, tad, pārvietojot skalu, šī sakritība tiek panākta.
Tiek uzzīmētas T un laika atkarības līknes.
No līknes T(t) slīpuma vietā, kur tā maina zīmi (tas ir, kad ir izveidots termiskais līdzsvars), īpatnējo siltumu aprēķina, izmantojot formulu (5). Šī siltumietilpība attiecas uz temperatūru, kas nolasāma no līknes T(t) brīdī, kad temperatūras starpība starp bloku un paraugu maina zīmi.
