მყარი სხეულის სითბოს სიმძლავრის განსაზღვრის მეთოდი
რა არის HEAT CAPACITY
როდესაც სითბო მიეწოდება, სისტემის ტემპერატურა იზრდება. ტემპერატურის უსასრულოდ მცირე ცვლილების შემთხვევაში, პროპორციულობა მოქმედებს
dT=δQ, ან dT=constδQ
უფრო მოსახერხებელია ამ მიმართების დაწერა ფორმაში: δQ=СdT ან
მნიშვნელობა C ეწოდება სისტემის ნამდვილ სითბოს სიმძლავრეს.
სითბოს სიმძლავრე არის სისტემაში მიწოდებული სითბოს თანაფარდობა ტემპერატურის ცვლილებასთან, რომელიც ხდება.
ჭეშმარიტის გარდა, ასევე არსებობს საშუალო სითბოს სიმძლავრე:
სითბოს ტევადობა
თუ სითბოს სიმძლავრე მიეკუთვნება ნივთიერების ერთეულ მასას (მოლს), მაშინ იგი დამოუკიდებელი ხდება მთელი სისტემის მასისგან და იძენს ინტენსიური პარამეტრის თვისებებს. თუ სითბოს სიმძლავრე ეხება ნივთიერების მასის ერთეულს, მას უწოდებენ სპეციფიკურს, ხოლო 1 მოლს - სითბოს სიმძლავრე J / (მოლ * კ) განზომილებით.
ჩვენ განვიხილავთ მხოლოდ მოლარულ სითბოს სიმძლავრეებს, ვინაიდან მათთვის ყველა კანონზომიერება ბევრად უფრო მარტივია, ვიდრე სპეციფიკური სითბოს სიმძლავრე.
სითბოს სიმძლავრე დამოკიდებულია იმ პირობებზე, რომლებშიც ხდება სითბოს გადაცემა სისტემაში. თუ სისტემა ჩასმულია მუდმივ მოცულობაში, მაშინ ტემპერატურის მატება dT-ით მოხდება CvdT-ის ტოლი სითბოს გავლენის ქვეშ, სადაც Cv არის სითბოს სიმძლავრე მუდმივ მოცულობაზე. სისტემის გაფართოების დროს მუდმივი წნევის შემთხვევაში, ტემპერატურის dT-ით გაზრდისთვის საჭირო იქნება სითბოს CpdT, სადაც Cp არის სითბოს სიმძლავრე მუდმივ წნევაზე.
სითბოს გადაცემის პირობების გათვალისწინებით, როდესაც ერთი ან მეტი ცვლადი მუდმივია, ხოლო სხვები იცვლება, სითბოს სიმძლავრე შეიძლება გამოიხატოს ნაწილობრივი წარმოებულების გამოყენებით: ![]() . ვინაიდან δQ v = dU,
. ვინაიდან δQ v = dU,
δQ p =dH, შეგვიძლია დავწეროთ:
![]() (1)
(1)
Cv არის გაზების იზოქორული სითბოს სიმძლავრე, Cp არის გაზების იზობარული სითბოს სიმძლავრე.
განსხვავებები იზოქორიულ და იზობარულ სითბოს სიმძლავრეებს შორის განპირობებულია შიდა ენერგიისა და ენთალპიის სხვაობით. ენთალპიისა და შინაგანი ენერგიის ცვლილებები განსხვავდება სისტემის მიერ შესრულებული სამუშაოს რაოდენობით.
δW=∆nRT, ∆H-∆U=∆nRT
ამრიგად, სითბოს სიმძლავრეები მუდმივი მოცულობის Cv და მუდმივი წნევის Cp ასევე განსხვავდება სამუშაოს მოცულობით: Cp - Cv = δW.
გამონათქვამების (1) საფუძველზე შეგვიძლია დავწეროთ:
ამ ტოლობების ჩანაცვლება განტოლებაში ∆H- ∆U=∆nRT
და იმის გათვალისწინებით, რომ ∆n= 1, ჩვენ ვიპოვით ურთიერთობას აირების მოლარულ სითბოს სიმძლავრეებს შორის:
Cp– Cv= R ან Cp= Cv+ R
როგორც ჩანს, ისინი განსხვავდებიან გაზის მუდმივის მნიშვნელობით.
Cp= Cv+ R მდგომარეობიდან გამომდინარეობს, რომ Cp˃Cv, ანუ იზობარულ პროცესში, როდესაც P=const, სისტემის ტემპერატურის გასაზრდელად საჭიროა. დიდი რაოდენობითსითბო, ვიდრე იზოქორული პროცესის დროს.
აირების მოლური სითბოს სიმძლავრე აქვს R-ის რიგის მნიშვნელობებს, ამიტომ განსხვავება Cp და Cv-ს შორის ძალიან მნიშვნელოვანია. ასე რომ, ნახშირორჟანგისთვის CO 2 25 0 C Cp = 37, 14; და Cv = 28,83 J / (mol * K)
განსხვავება Cp - Cv არის ერთი მოლის იზობარული გაფართოების სამუშაო იდეალური გაზიროდესაც ტემპერატურა ერთი გრადუსით მოიმატებს. სხეულის სითხეები და მყარი ნივთიერებები გაცხელებისას მოცულობის უმნიშვნელო მატებით ხასიათდება. ამიტომ შედედებული სხეულებისთვის შეგვიძლია ვივარაუდოთ, რომ Ср ≈ Сv.
კირჩჰოფის განტოლება. თერმული ზემოქმედების დამოკიდებულება ტემპერატურაზე.
თერმული ეფექტების ადრე განხილული გამოთვლები ჰესის კანონის საფუძველზე წარმოქმნისა და წვის სითბოსთვის შეზღუდულია სტანდარტული პირობებით. პრაქტიკული მიზნებისათვის აუცილებელია თერმული ეფექტის გამოთვლა კონკრეტული პირობებისთვის, გარდა სტანდარტული პირობებისა.
გადადით ცნობილი თერმული ეფექტებიდან სტანდარტულ პირობებში, ე.ი. 25 0 C (298,15 K) ტემპერატურაზე და 1 ატმ წნევაზე. (1.013 * 10 5 Pa), შესაძლებელია თერმული ეფექტების გამოთვლა ჩვენთვის საინტერესო ნებისმიერ ტემპერატურაზე გამოყენებით კირჩჰოფის კანონი. სამრეწველო პირობებში პროცესები ხასიათდება ტემპერატურის მნიშვნელოვანი ცვალებადობით, რომლის დიაპაზონი განისაზღვრება არა მხოლოდ ტექნოლოგიური პირობებით, არამედ სეზონითაც, ეს დიაპაზონი შეიძლება მიაღწიოს ასობით გრადუსს - ბუნებრივია, რომ თერმული ეფექტი იქნება. მნიშვნელოვნად განსხვავდება და დამოკიდებულია ტემპერატურაზე.
განვიხილოთ კირჩჰოფის კანონი დიფერენციალური ფორმით. ამისათვის ჩვენ ვწერთ ენთალპიის ცვლილებებს იზობარულ და შინაგან ენერგიაში იზოქორიულ პროცესებში.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
განასხვავეთ ეს განტოლებები ტემპერატურის მიხედვით და მიიღეთ:
კირჩჰოფის განტოლებები:

და - იზობარული და იზოქორული პროცესების თერმული ეფექტის ტემპერატურული კოეფიციენტები, შესაბამისად; და - სისტემის თბოტევადობის ცვლილება, შესაბამისად, იზობარული და იზოქორული პროცესების შედეგად.
კირჩჰოფის განტოლების საფუძველზე, კირჩჰოფის კანონი ჩამოყალიბებულია დიფერენციალური ფორმით: პროცესის თერმული ეფექტის ტემპერატურული კოეფიციენტი უდრის სისტემის სითბოს სიმძლავრის ცვლილებას, რომელიც ხდება ამ პროცესის შედეგად.
ამრიგად, კირჩჰოფის კანონი დიფერენციალური ფორმით შესაძლებელს ხდის განისაზღვროს მხოლოდ თერმული ეფექტის ცვლილება ტემპერატურასთან და არა თავად თერმული ეფექტის სიდიდე.
გავაანალიზოთ კირჩჰოფის განტოლება
რეაქციისთვის: aA + bB = dD + rR იზობარულ პროცესში (р=const), კირჩჰოფის კანონის მიხედვით, სისტემაში სითბოს სიმძლავრის ცვლილებას ექნება ფორმა:
მსგავსი გამოხატულება შეიძლება მივიღოთ იზოქორული პროცესისთვის:
ვინაიდან კირჩჰოფის კანონი საშუალებას გაძლევთ განსაზღვროთ პროცესის თერმული ეფექტის ცვლილებები ტემპერატურის ცვლილებით, ჩვენ ვაშენებთ გრაფიკს:
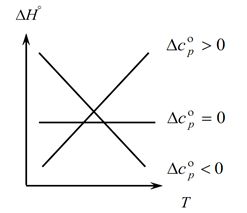
1. განვიხილოთ პირველი შემთხვევა, როდესაც ∆Ср(∆Сv)˃0, რადგან ∆Ср=∑С კონ. -∑С თავდაპირველი, აქედან გამომდინარეობს, რომ რეაქციის პროდუქტების სითბური შესაძლებლობების ჯამი მეტია საწყისი ნივთიერებების სითბოს სიმძლავრის ჯამს: ∑С კონ. ˃∑თავიდან ამ შემთხვევაში გრაფიკზე ვიღებთ მრუდს 1, რაც ნიშნავს, რომ ტემპერატურის მატებასთან ერთად იზრდება პროცესის თერმული ეფექტის ცვლილებაც (T და ∆H);
2. მეორე შემთხვევა, როცა ∆Ср(∆Сv)˂0. პირველი კანონის მსგავსად, გვაქვს ∑С con. ˂∑ ადრეულიდან (საბოლოო პროდუქტების სითბოს სიმძლავრეების ჯამი ნაკლებია საწყისი ნივთიერებების სითბოს სიმძლავრის ჯამზე). შემდეგ ვიღებთ მრუდს გრაფიკზე, რაც ნიშნავს, რომ ტემპერატურის მატებასთან ერთად პროცესის თერმული ეფექტის ცვლილება მცირდება (Т→∆H↓)
3. ხოლო მესამე შემთხვევა, როდესაც სისტემის სითბურ სიმძლავრეების ცვლილება ნულის ტოლია ∆Ср(∆Сv)=0. მაშინ რეაქციების საბოლოო პროდუქტების სითბოს სიმძლავრეების ჯამი უდრის საწყისი მასალების თბოტევადობის ჯამს ∑С con. \u003d ∑ თავიდანვე. ამ შემთხვევაში რეაქციის თერმული ეფექტი არ არის ტემპერატურის ფუნქცია (∆H ≠ f(T)) და ვიღებთ სწორ ხაზს გრაფიკზე.
თერმული ეფექტების გაანგარიშება მოცემულისთვის
ტემპერატურა. კირჩჰოფის განტოლების ინტეგრაცია
ტემპერატურის ფუნქციის მიხედვით თერმული ეფექტის მნიშვნელობის საპოვნელად აუცილებელია განტოლებების ინტეგრირება

T-დან T 0-მდე (სადაც T არის საჭირო ტემპერატურა, T 0 არის სტანდარტული ტემპერატურა), ∆H-დან ∆H 0-მდე ან ∆U-დან ∆U 0-მდე (სადაც ∆H და ∆U არის ენთალპია და შიდა ენერგია პირობები, რომლებიც განსხვავდება სტანდარტისგან). ინტეგრაცია ხორციელდება ორ შემთხვევაში:
ამისთვის არა ორგანული ნივთიერებებიორგანული ნივთიერებებისთვის:
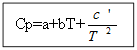
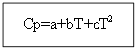
მაგალითი: H 2-სთვის (გ) - არაორგანული ნივთიერება
| Ср=f(T) | თ | |||
| ა | b*10 3 | გ*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (გ)) \u003d 27.28 + 3.26 * 10 -3 T +.
ა) სავარაუდო ინტეგრაცია:
იზობარული პროცესისთვის
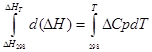
∆H T - ∆H 298 =∆Cp*(T-298)
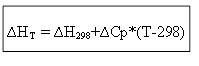
იზოქორული პროცესისთვის:
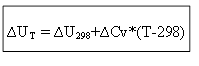
ამგვარად, თერმული ეფექტის ΔH ან ΔU შიდა ენერგიის განსასაზღვრად ნებისმიერ T ტემპერატურაზე, საჭიროა იცოდეთ პროცესის სიცხე სტანდარტულ პირობებში ∆H 0 (∆U 0) და სითბოს სიმძლავრეების ცვლილება ∆Ср, ∆. CV.
მაგალითი. გამოთვალეთ აცეტილენისგან ბენზოლის მიღების პროცესის თერმული ეფექტი ∆H:
3C 2 H 2 (გ) → C 6 H 6 (გ) 75 0 C (348K).
1. ცხრილებიდან ვხვდებით ბენზოლისა და აცეტილენის საშუალო მოლარულ იზობარულ სითბოს სიმძლავრეებს:
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. პროცესის სითბოს სიმძლავრის ცვლილებას ვპოულობთ:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) საწყისი \u003d Cp C6H6 (გ) - 3 * Cp C2H2 (გ) \u003d 81,67 - 3 * 43,93 \u003d - 50,12 კ/მ) (მ.
3. ცხრილის მონაცემების მიხედვით ვხვდებით თერმულ ეფექტს სტანდარტულ პირობებში:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 კჯ / მოლი
4. იპოვეთ თერმული ეფექტი მოცემულ ტემპერატურაზე:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 ჯ / მოლ
ბ) ზუსტი ინტეგრაცია:
განვიხილოთ მეორე, უფრო რთული შემთხვევა, როდესაც სითბოს სიმძლავრის ცვლილება დამოკიდებულია ტემპერატურაზე, ე.ი. Ср=f(T), Cv=f(T).
მოდით მივმართოთ რეაქციის განტოლებას ზოგადი ფორმით
dD + rR = qQ + pP
| ა | b*10 3 | გ*10 -5 | C*10 6 | |
| დ | + | + | - | + |
| რ | + | + | + | - |
| ქ | + | + | + | - |
| პ | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
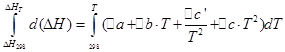
ჩვენ განვახორციელებთ იგივე ოპერაციებს იზოქორული პროცესისთვის:
დაშლის სიცხე
ენთალპიის ცვლილებას მყარი, თხევადი ან აირისებრი ნივთიერების ხსნარში გადასვლისას ეწოდება დაშლის თერმული ან ენთალპია.
დაშლის სითბო ზოგადად მოიცავს ბროლის გისოსის განადგურების სითბოს (ამისთვის მყარი), იონიზაცია და ხსნარი.
კრისტალური მარილის იონებს შორის კავშირის გასაწყვეტად საჭიროა ენერგია, ე.ი. ხოლო სითბო შეიწოვება. ამავდროულად, წყალხსნარში ხდება იონის დატენიანება; ბმა იქმნება H 2 O-ის იონებსა და მოლეკულებს შორის. დაშლის სითბოს ნიშანი განისაზღვრება ენერგიულად უფრო გამოხატული პროცესით.
LiBr: ∆H dist = - 49,02 კჯ / მოლი - სითბო გამოიყოფა
KCl: ∆H dist = 7,23 kJ/mol - სითბო შეიწოვება
განასხვავებენ: დაშლის ინტეგრალური სითბო არის სითბო, რომელიც გამოიყოფა ან შეიწოვება მოცემული ნივთიერების 1 მოლის გახსნისას მოცემული კონცენტრაციის ხსნარის წარმოქმნით. დაშლის ინტეგრალური სითბო განსხვავდება გახსნილი ნივთიერების ოდენობის მიხედვით.
განასხვავებენ: დაშლის დიფერენციალური სიცხე - ეს არის სითბო, რომელიც თან ახლავს მოცემული ნივთიერების 1 მოლის უსასრულოდ დაშლას. დიდი მოცულობაამ ნივთიერების ხსნარი. ინტეგრალური სიცხეები ფართოდ გამოიყენება ჰესის კანონის მიხედვით წარმოქმნის და სხვა რეაქციების სიცხეების გამოსათვლელად. დაშლის დიფერენციალური სიცხეები ახასიათებს ხსნარების თერმოდინამიკურ თვისებებს და მათი წარმოქმნის პროცესს.
ლაბორატორია #8
მყარი სხეულების სითბური სიმძლავრის განსაზღვრა
ინსტრუმენტები და აქსესუარები:ექსპერიმენტული დაყენება FPT1-8.
მიზანი:ლითონის ნიმუშების თბოტევადობის განსაზღვრა კალორიმეტრიული მეთოდით ელექტრო გათბობის გამოყენებით.
მოკლე თეორია
ნივთიერების სპეციფიკური თბოტევადობა - მნიშვნელობა უდრის სითბოს რაოდენობას, რომელიც საჭიროა 1 კგ ნივთიერების 1 K-ით გასათბობად:
მოლური სითბოს ტევადობა - მნიშვნელობა უდრის სითბოს რაოდენობას, რომელიც საჭიროა ნივთიერების 1 კ-ზე გასათბობად:
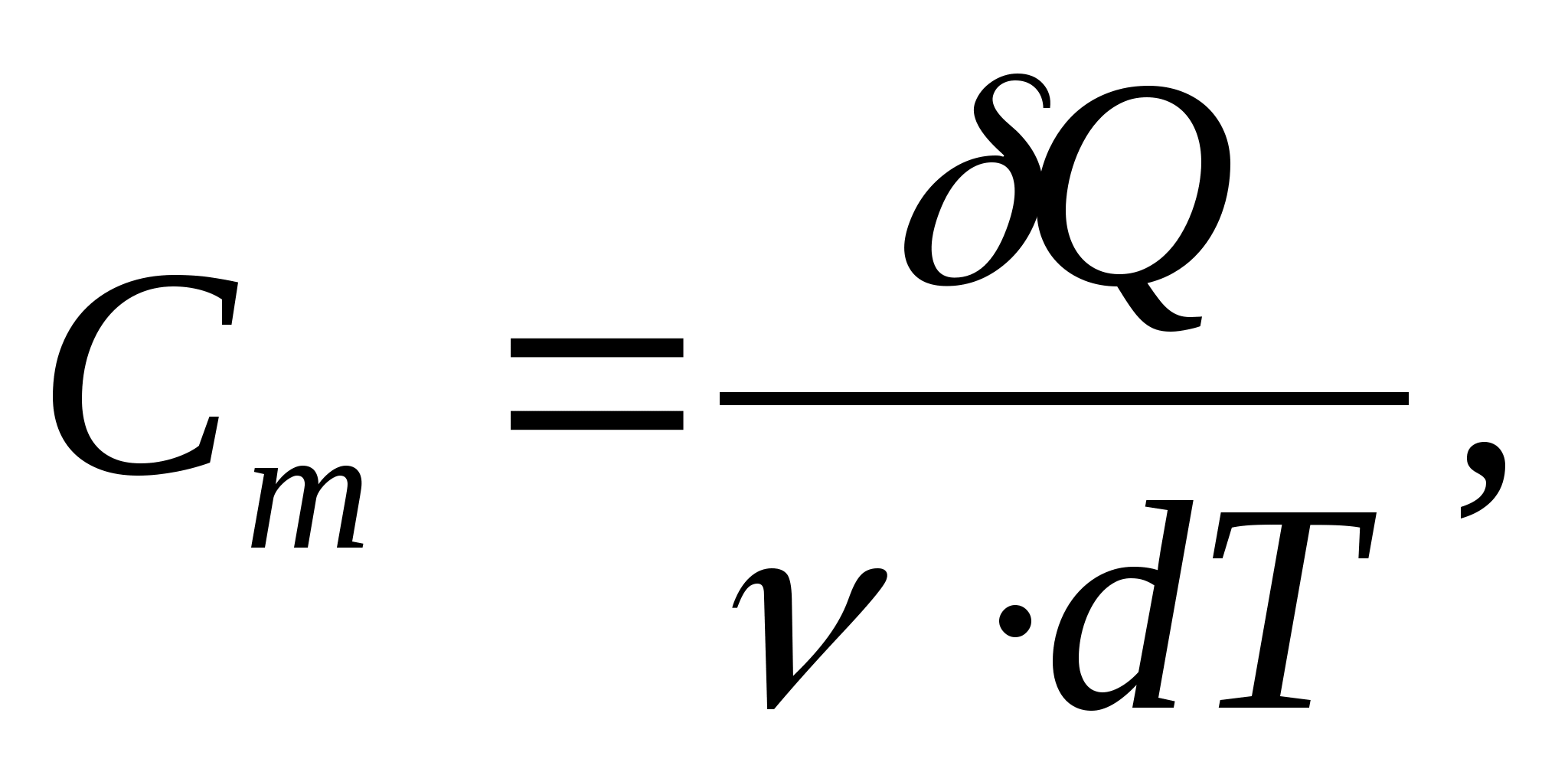
სადაც 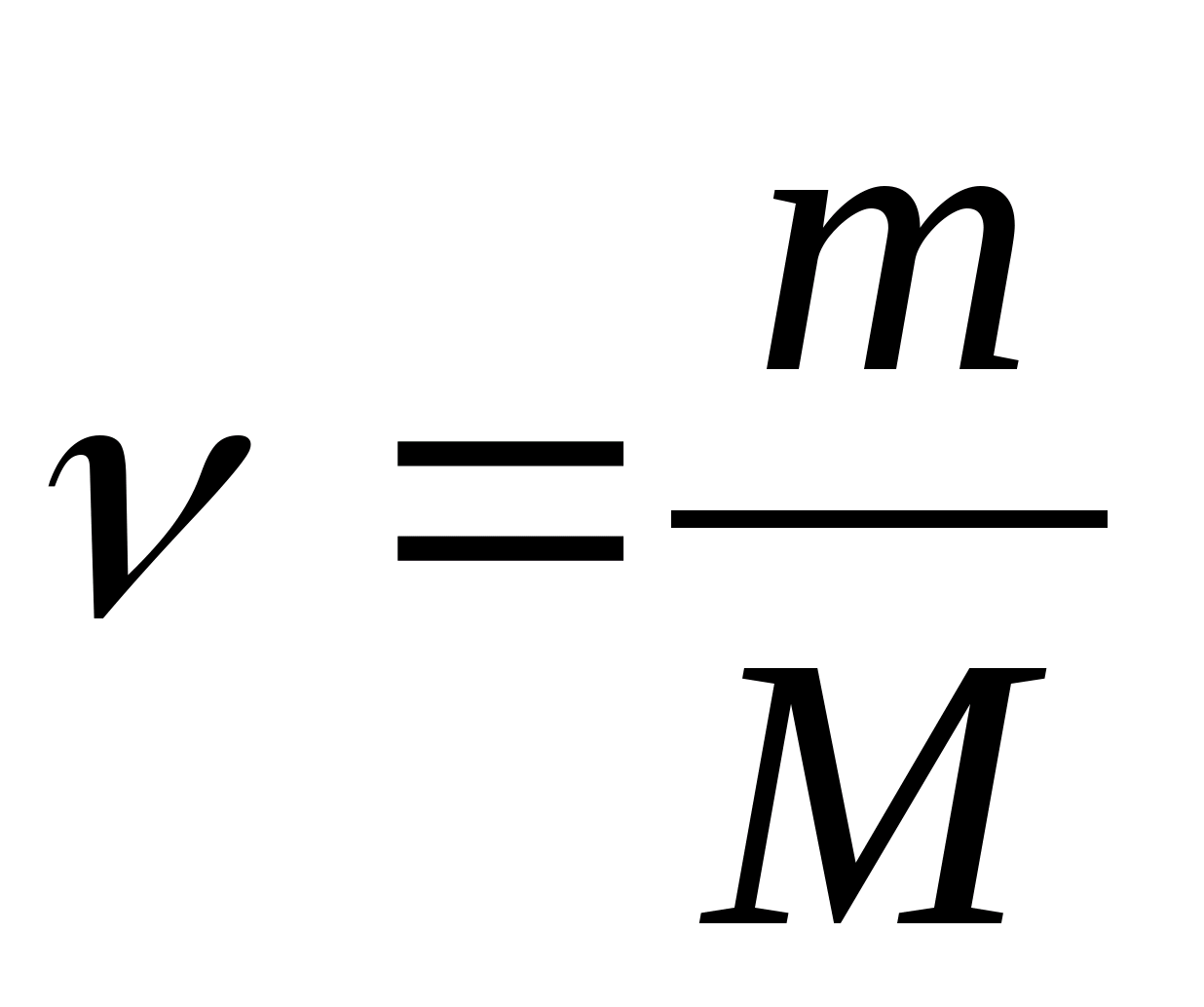 − ნივთიერების რაოდენობა.
− ნივთიერების რაოდენობა.
სპეციფიკური სითბო გასოცირდება მოლართან C მთანაფარდობა

სადაც მარის ნივთიერების მოლური მასა.
გამოარჩევენ სითბოს სიმძლავრე მუდმივი მოცულობითდა მუდმივი წნევათუ ნივთიერების გაცხელების პროცესში მისი მოცულობა ან წნევა მუდმივია.
დამოუკიდებელი ცვლადების (კოორდინატების) უმცირეს რაოდენობას, რომლებიც მთლიანად განსაზღვრავენ სისტემის პოზიციას სივრცეში, ეწოდება თავისუფლების ხარისხების რაოდენობა .
ბოლცმანის კანონის მიხედვით ენერგიის ერთგვაროვანი განაწილების შესახებ მოლეკულების თავისუფლების ხარისხებზე, თავისუფლების თითოეულ მთარგმნელობით და ბრუნვის ხარისხს აქვს საშუალო კინეტიკური ენერგია ტოლი
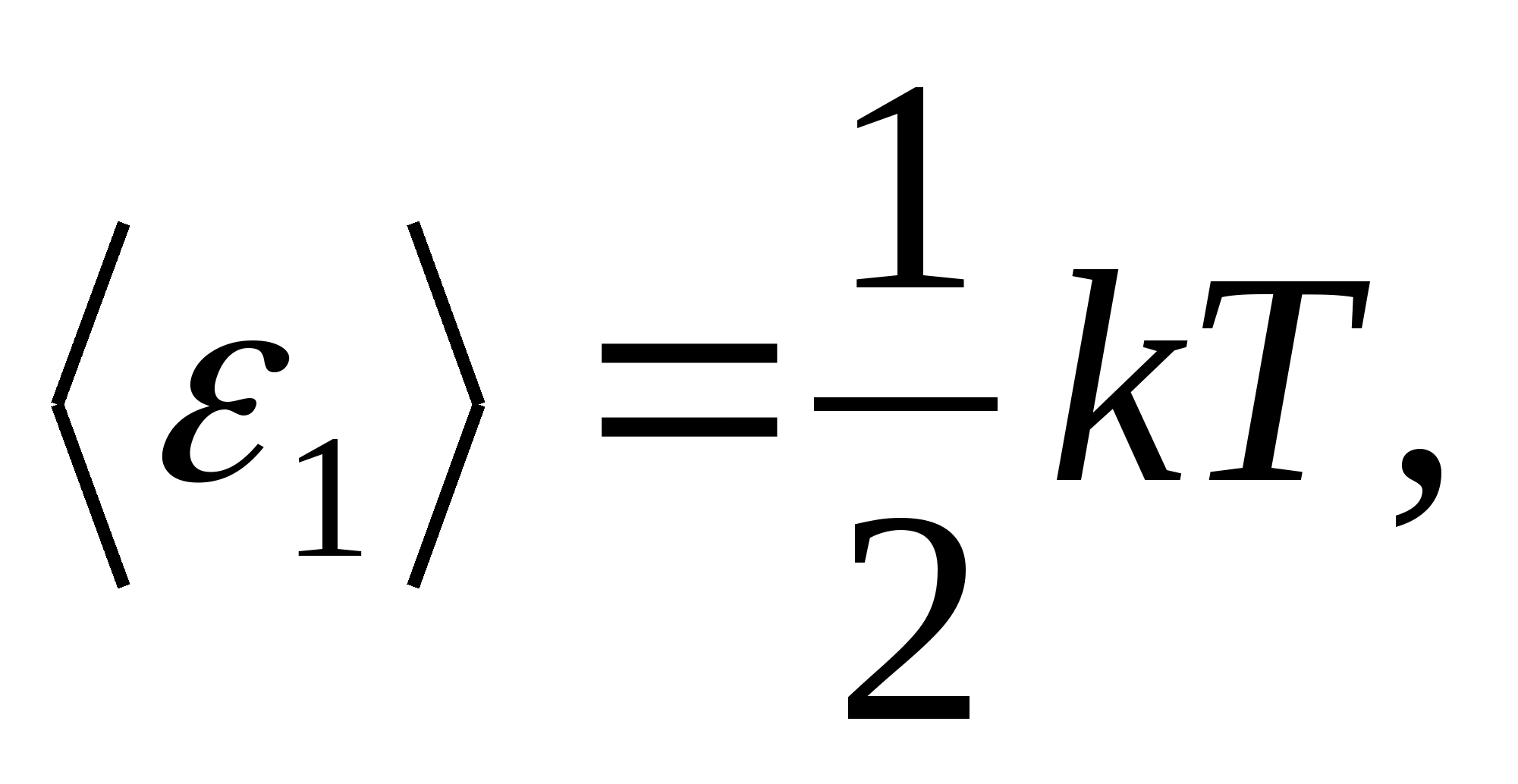
(სად კარის ბოლცმანის მუდმივი), ხოლო თავისუფლების თითოეული ვიბრაციული ხარისხისთვის, საშუალოდ, ენერგია უდრის
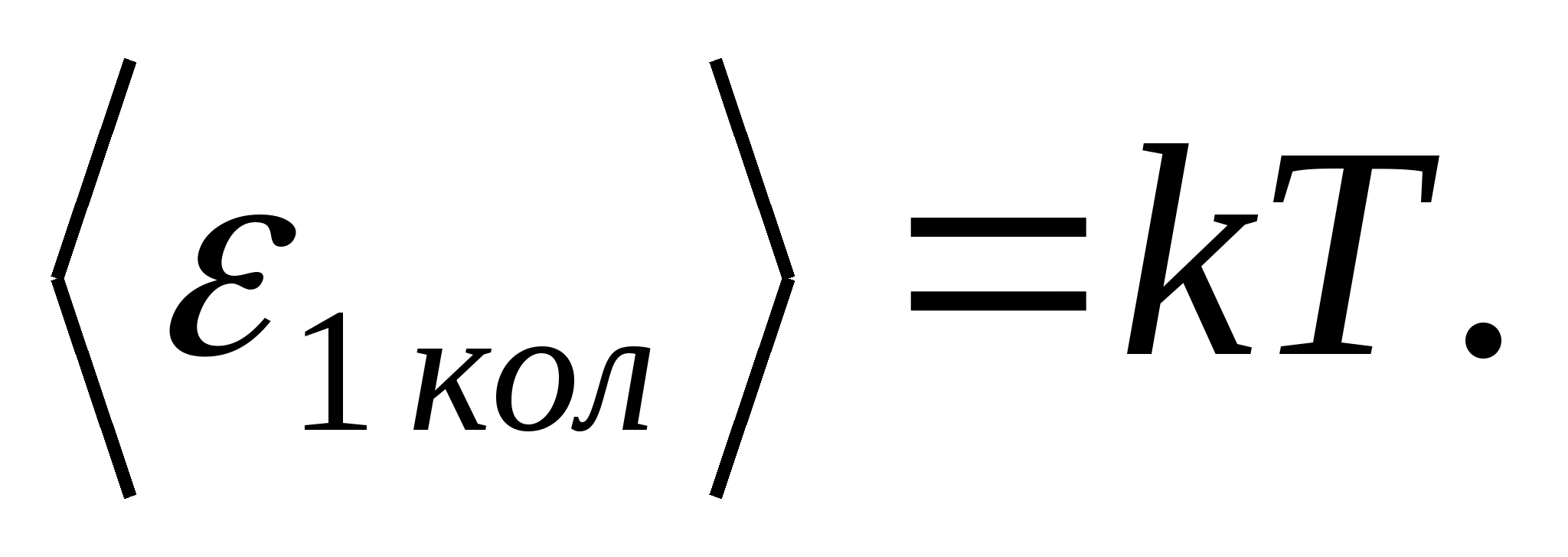
ამრიგად, მოლეკულის საშუალო ენერგია
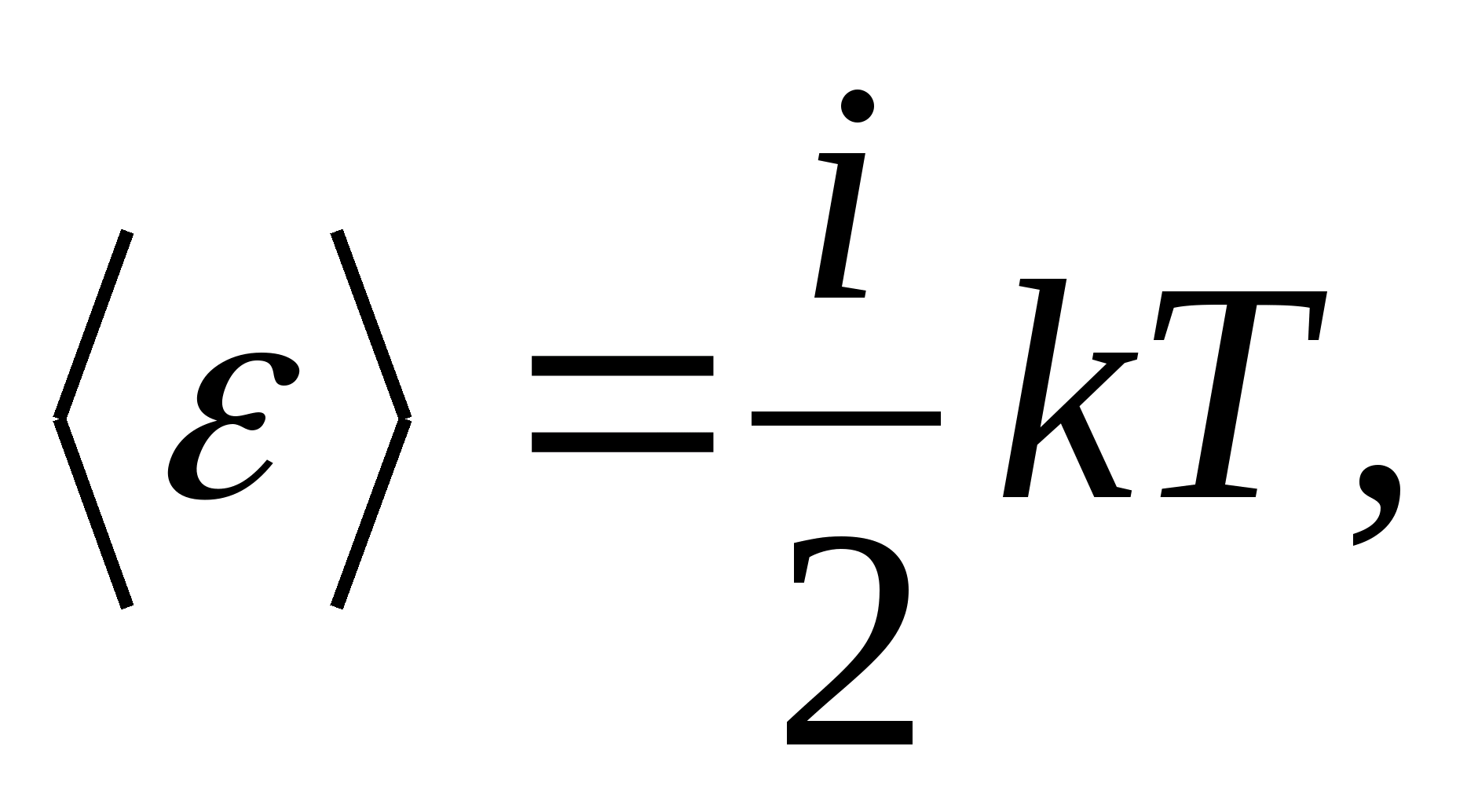
სადაც მეარის მოლეკულის მთარგმნელობითი, ბრუნვითი და ორჯერ მეტი თავისუფლების ვიბრაციული ხარისხების ჯამი:
![]()
მაგალითად, მონატომური იდეალური აირის მოლეკულების საშუალო კინეტიკური ენერგია ( 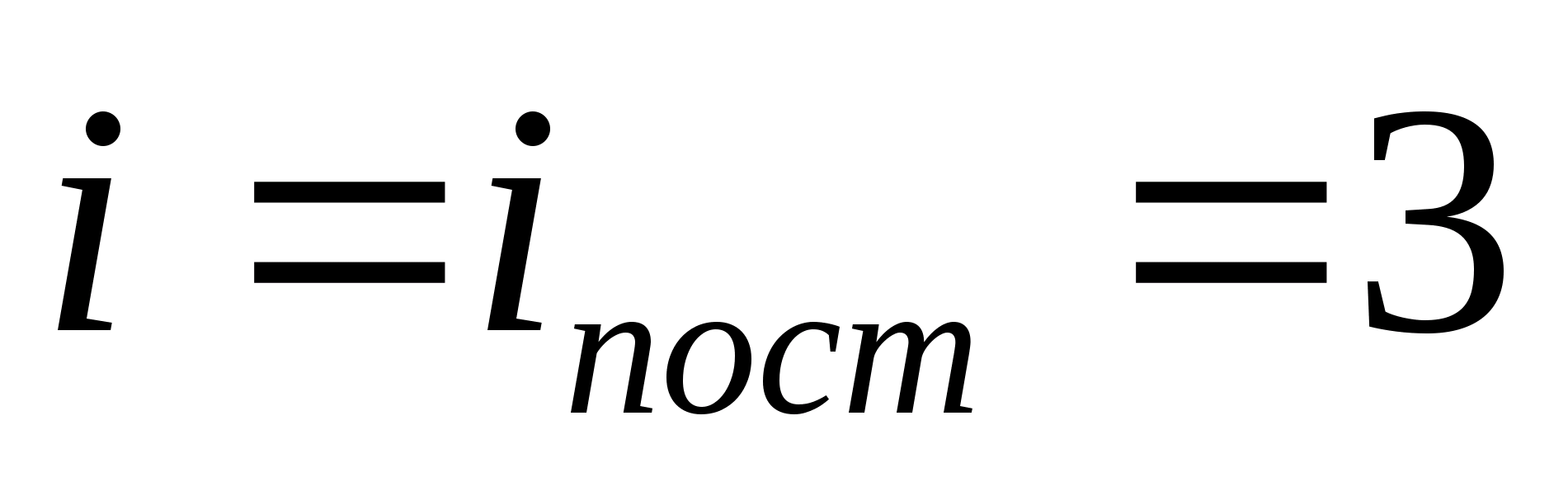 ) უდრის
) უდრის
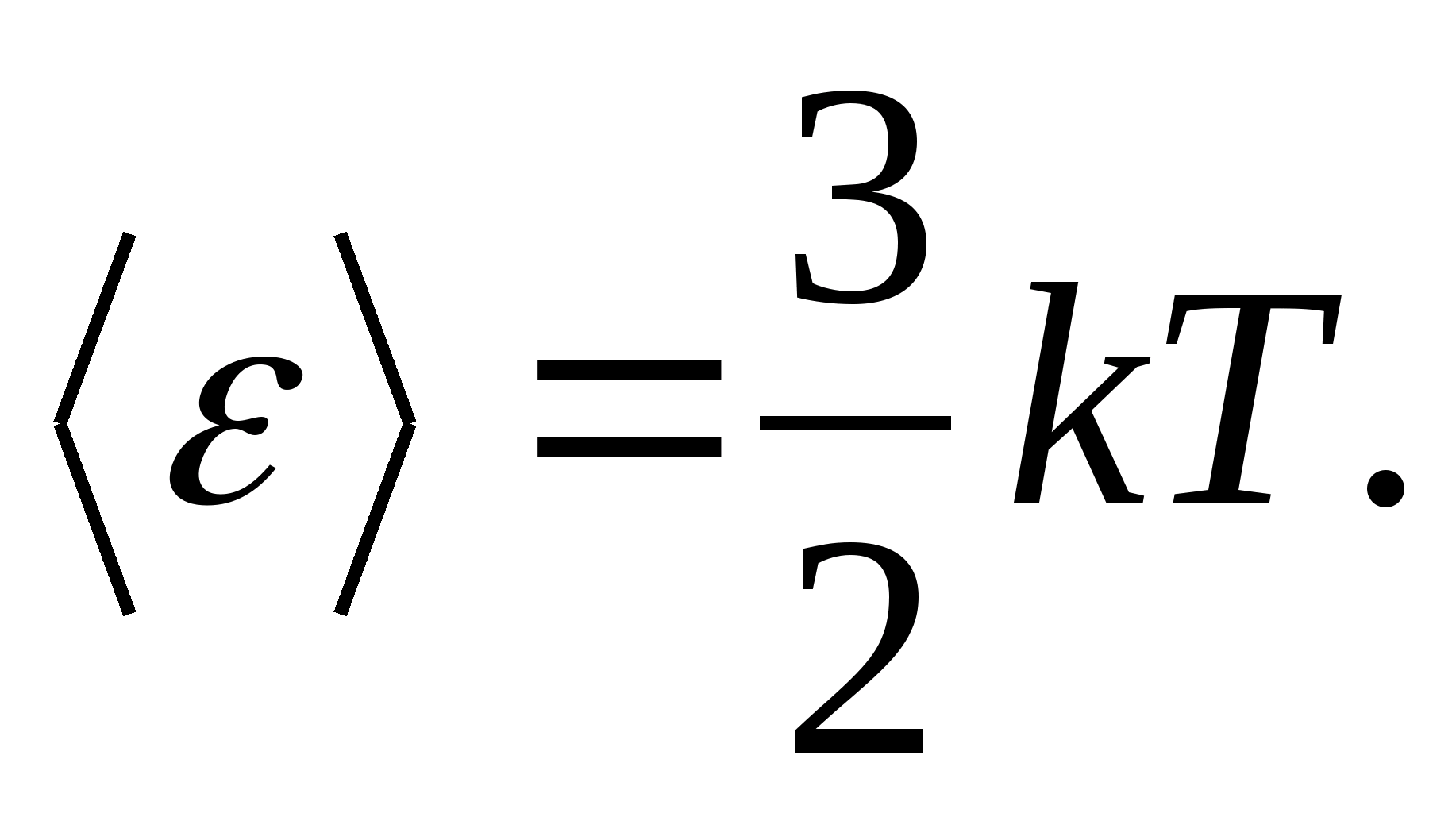
როგორც მოდელებიმყარი სხეულისთვის, განვიხილოთ სწორად აგებული კრისტალური გისოსი, რომლის კვანძებში ნაწილაკები (ატომები, იონები, მოლეკულები) აღებულია, როგორც მატერიალური ქულებირხევა მათი წონასწორობის პოზიციების ირგვლივ - გისოსების კვანძები -სამი ერთმანეთის პერპენდიკულარული მიმართულებით. ამრიგად, კრისტალური მედის შემადგენელ თითოეულ ნაწილაკს ენიჭება თავისუფლების სამი ვიბრაციული ხარისხი, რომელთაგან თითოეულს, თავისუფლების ხარისხებზე ენერგიის ერთგვაროვანი განაწილების კანონის თანახმად, აქვს ენერგია. კტ.
შემდეგ ნაწილაკების მთლიანი ენერგიის საშუალო მნიშვნელობა ბროლის ბადეში რხევითი მოძრაობის დროს
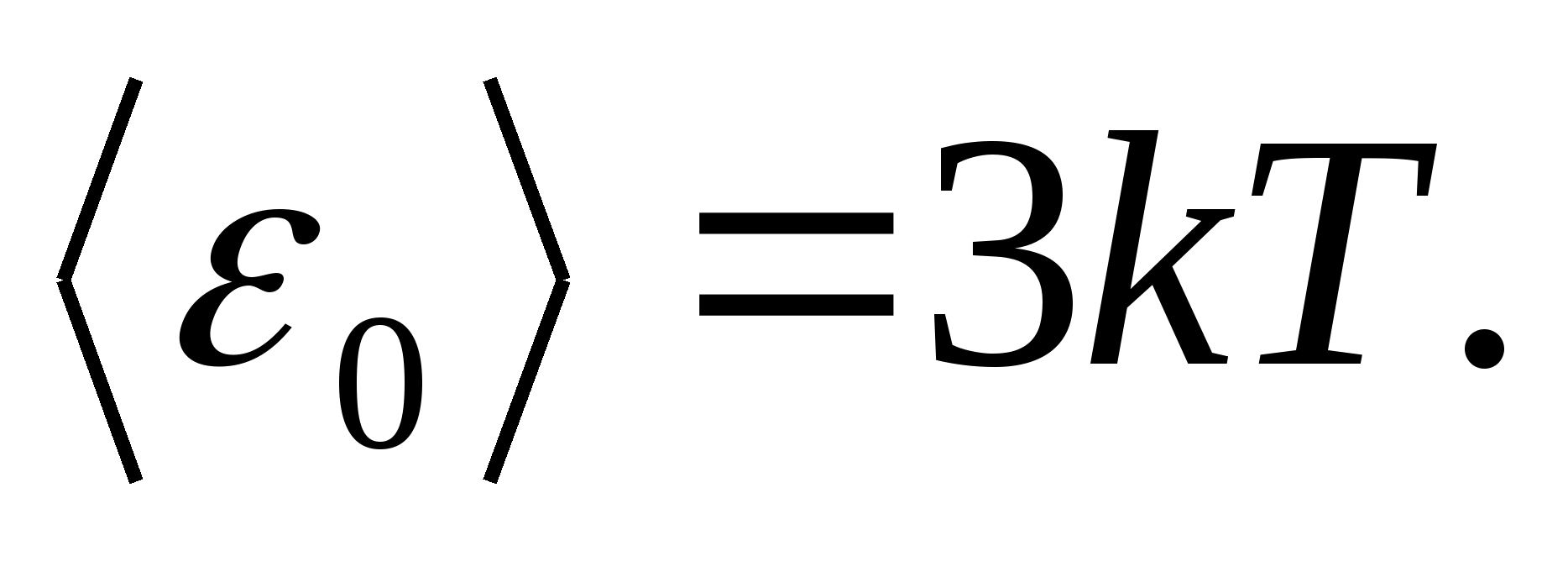
მყარი სხეულის ერთი მოლის მთლიანი შინაგანი ენერგია მიიღება ერთი ნაწილაკების საშუალო ენერგიის გამრავლებით ერთ მოლში შემავალი დამოუკიდებლად ვიბრაციული ნაწილაკების რაოდენობაზე, ე.ი. ავოგადროს მუდმივამდე ნ ა :
სადაც R=N ა კარის უნივერსალური (მოლარული) აირის მუდმივი, R= 8.31 ჯ/(მოლK).
მყარი სხეულებისთვის, თერმული გაფართოების მცირე კოეფიციენტის გამო, სითბოს სიმძლავრეები მუდმივი წნევისა და მუდმივი მოცულობის დროს პრაქტიკულად არ განსხვავდება. ამიტომ, (8.1) გათვალისწინებით, მყარი ნივთიერების მოლური სითბოს მოცულობა
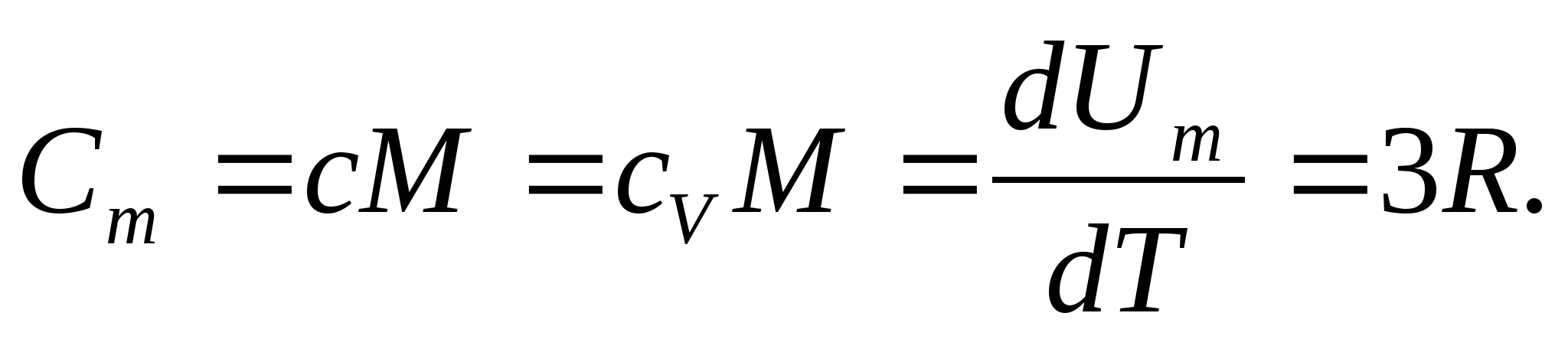 (8.2)
(8.2)
მოლარული აირის მუდმივის რიცხვითი მნიშვნელობის ჩანაცვლებით, მივიღებთ:
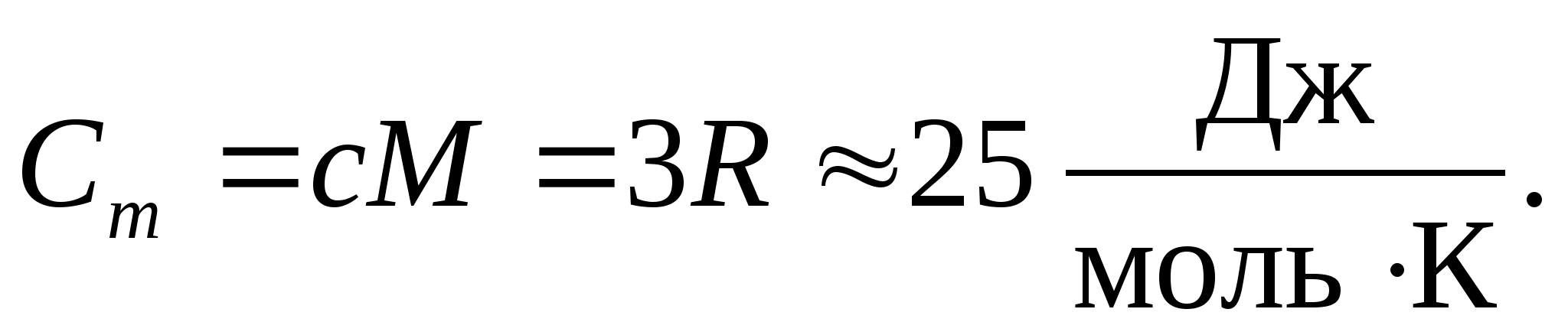
ეს თანასწორობა საკმაოდ კარგ მიახლოებას ფლობს ბევრი ნივთიერებისთვის ოთახის ტემპერატურაზე და ე.წ დულონგისა და პეტიტის კანონი : ყველა ქიმიურად მარტივი კრისტალური მოლური სითბოს მოცულობა მყარიდაახლოებით ტოლია 25 ჯ/(მოლ TO). ტემპერატურის კლებასთან ერთად, ყველა მყარი ნივთიერების სითბური სიმძლავრე მცირდება და უახლოვდება ნულს თ0. აბსოლუტური ნულის მახლობლად, ყველა სხეულის მოლური სითბოს ტევადობა პროპორციულია T 3-ის და მხოლოდ თითოეული ნივთიერებისთვის დამახასიათებელ საკმარისად მაღალ ტემპერატურაზე იწყება თანასწორობა (8.2). დაბალ ტემპერატურაზე მყარი ნივთიერებების სითბოს შესაძლებლობების ეს მახასიათებლები შეიძლება აიხსნას აინშტაინისა და დებაის მიერ შექმნილი სითბოს სიმძლავრის კვანტური თეორიის გამოყენებით.
სითბოს სიმძლავრის ექსპერიმენტულად დასადგენად, შესასწავლ სხეულს ათავსებენ კალორიმეტრში, რომელიც თბება ელექტრული დენით. თუ სატესტო ნიმუშთან კალორიმეტრის ტემპერატურა ძალიან ნელა იზრდება საწყისიდან თ 0-დან -მდე თ, მაშინ ელექტრული დენის ენერგია გამოყენებული იქნება ნიმუშის და კალორიმეტრის გასათბობად:
სადაც მედა უ− გამათბობელის დენი და ძაბვა; − გათბობის დრო; მ 0 და მარის კალორიმეტრის და ტესტის ნიმუშის მასები, თან 0 და თან− კალორიმეტრისა და საცდელი ნიმუშის სპეციფიკური სითბოს სიმძლავრეები, ქ− სითბოს დაკარგვა კალორიმეტრის თბოიზოლაციისა და მიმდებარე სივრცისთვის.
განტოლებიდან (8.3) რომ გამოირიცხოს კალორიმეტრის გაცხელებაზე დახარჯული სითბოს რაოდენობა და სითბოს დაკარგვა მიმდებარე სივრცეში, აუცილებელია, იმავე გამაცხელებლის სიმძლავრით, ცარიელი კალორიმეტრი (ნიმუშის გარეშე) გაცხელდეს საწყისი ტემპერატურიდან. თ 0 იგივე ტემპერატურის სხვაობისთვის თ. სითბოს დაკარგვა ორივე შემთხვევაში იქნება თითქმის იგივე და ძალიან მცირე, თუ კალორიმეტრის დამცავი გარსაცმის ტემპერატურა ორივე შემთხვევაში მუდმივია და ოთახის ტემპერატურის ტოლია:
განტოლებები (8.3) და (8.4) გულისხმობს
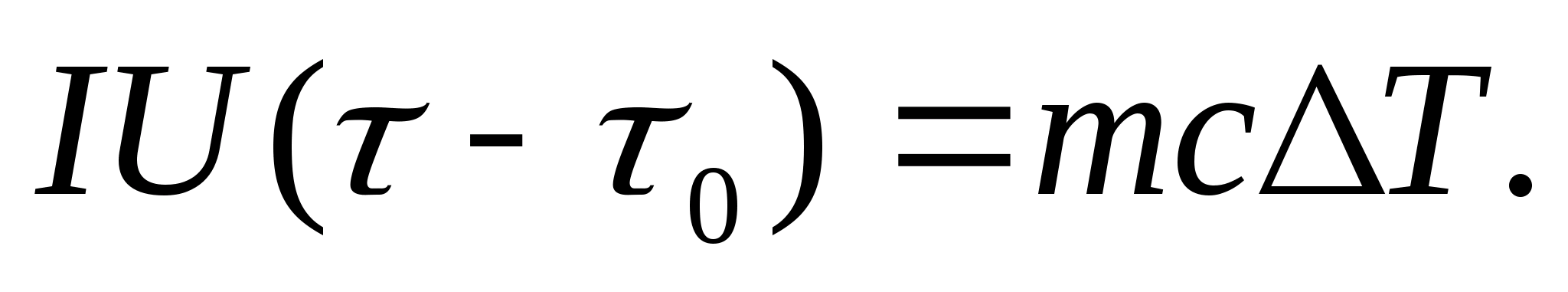 (8.5)
(8.5)
განტოლება (8.5) შეიძლება გამოყენებულ იქნას საცდელი ნიმუშის მასალის სპეციფიკური სითბოს სიმძლავრის ექსპერიმენტულად დასადგენად. კალორიმეტრის ტემპერატურის შეცვლით, აუცილებელია გამოვთვალოთ გათბობის დროის სხვაობის დამოკიდებულება ტესტის ნიმუშის ტემპერატურის ცვლილებაზე: (
−
0)=ვ(თ), რომლის კუთხური კოეფიციენტის მიხედვით 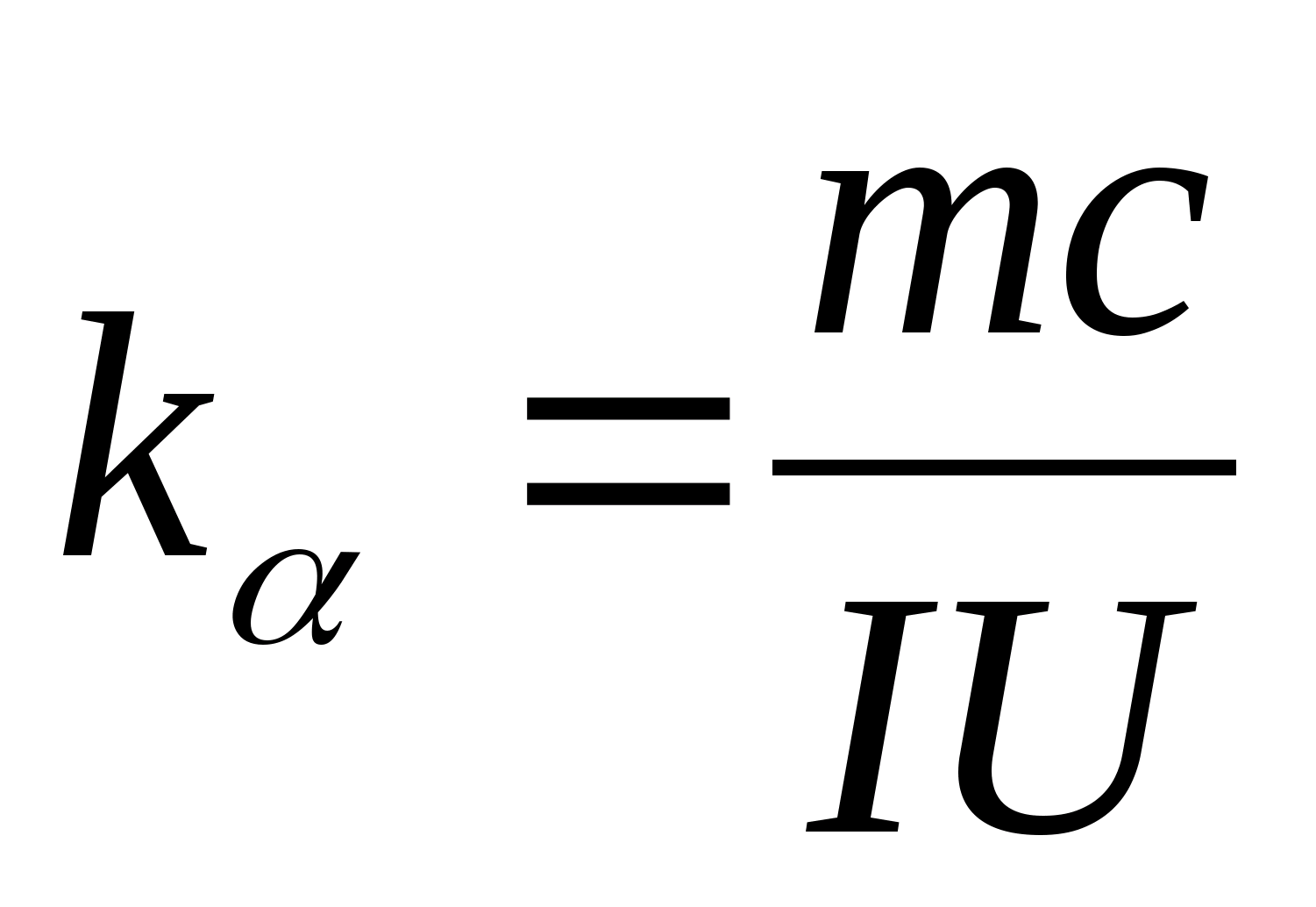 შეიძლება განისაზღვროს ნიმუშის სპეციფიკური სითბოს მოცულობა.
შეიძლება განისაზღვროს ნიმუშის სპეციფიკური სითბოს მოცულობა.
ლაბორატორიის აღწერილობა
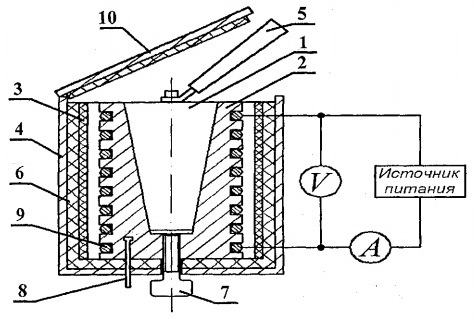
მყარი ნივთიერებების სითბოს სიმძლავრის დასადგენად, შექმნილია FPT1-8 ექსპერიმენტული კონფიგურაცია, რომლის ზოგადი ხედი ნაჩვენებია ნახ. 8.1. ინსტალაცია შედგება სამი ძირითადი ნაწილისგან: ინსტრუმენტული ბლოკი 1, ოპერაციული ელემენტის განყოფილება 2 და თარო 3.
საკონტროლო ერთეული 1-ის წინა პანელზე არის: „NETWORK“ გადამრთველი, რომელიც აკავშირებს ერთეულს მიწოდების ძაბვის ქსელთან; გადამრთველი "HEATING", რომელიც ჩართავს გამათბობელს; "HEATING" რეგულატორი, რომლის დახმარებით რეგულირდება გამათბობელი სიმძლავრე; ვოლტმეტრი და ამპერმეტრი, რომლებიც ზომავენ ძაბვას და დენს გამათბობელ წრეში; წამზომი, რომელიც ზომავს კალორიმეტრის გათბობის დროს. წამზომი ჩართულია ინსტრუმენტული ერთეულის ჩართვისას.
სამუშაო ელემენტის ბლოკი 2 დახურულია წინ მოსახსნელი ეკრანით org. მინა. სამუშაოს შესრულებისას ეკრანი ჩამოკიდებულია სამუშაო ელემენტის ბლოკის უკანა კედელზე. სამუშაო ელემენტის პანელის ბლოკზე არის ციფრული თერმომეტრი 6 ტემპერატურის გასაზომად. ბოლოში, ბუდეებში დგას სხვადასხვა მასალისგან დამზადებული 5 საცდელი ნიმუში და ნიმუშების გამათბობელში მოსათავსებელი სახელური.
გამათბობელი 4 შედგება ლითონის გარსაცმისგან, თბოიზოლაციის მასალისა და კალორიმეტრისგან.

ნიმუშები თბება კალორიმეტრში, რომლის სქემა ნაჩვენებია ნახ. 8.2.
კალორიმეტრი არის სპილენძის კორპუსი 2 კონუსური ნახვრეტით, სადაც ჩასმულია საცდელი ნიმუში 1. კორპუსის გარე ზედაპირზე სპეციალურ ღარებში მოთავსებულია გამაცხელებელი კოჭა 9. გარედან კალორიმეტრის კორპუსი თბოიზოლირებულია აზბესტის ფენებით. 3 და მინის ბოჭკოვანი 6 და დახურულია ალუმინის გარსაცმით 4. კალორიმეტრი იხურება თბოსაიზოლაციო საფარით 10. ექსპერიმენტის დასრულების შემდეგ ნიმუშის გამოძევება შესაძლებელია კალორიმეტრის კორპუსის კონუსური ხვრელიდან. ხრახნი 7. გაცხელებული ნიმუშის კალორიმეტრიდან ამოსაღებად და გამათბობელში ნიმუშის დასაყენებლად გამოიყენება სახელური 5, რომელიც განთავსებულია შესასწავლი ნიმუშების გვერდით სპეციალურ ბუდეში.
კალორიმეტრის ტემპერატურა იზომება ციფრული თერმომეტრით, რომლის ტემპერატურის სენსორი 8 მდებარეობს კალორიმეტრის 2 კორპუსში.
Უსაფრთხოება
სამუშაოს შესრულებისას დაცულია უსაფრთხოების ზოგადი მოთხოვნები მექანიკის ლაბორატორიაში.
სამუშაო შეკვეთა
ყურადღება!კალორიმეტრს დიდი დრო სჭირდება გაგრილებას, ამიტომ ყველა დროის მნიშვნელობის გაზომვის შემდეგ ცარიელი კალორიმეტრის 0 გათბობა, დაუყოვნებლივ გამორთეთ გათბობა (იხ. პუნქტი 4 ქვემოთ). ამ მოწყობილობის მაქსიმალური გათბობის ტემპერატურაა +44С.
1. ამოიღეთ დანადგარის სამუშაო ელემენტის გამჭვირვალე საფარი და ჩამოკიდეთ უკანა პანელის ხრახნებზე. დააყენეთ HEAT კონტროლის ღილაკი მინიმუმზე. ჩართეთ ინსტალაცია "NETWORK" გადამრთველით.
2. მჭიდროდ დაახურეთ თავსახური ცარიელ კალორიმეტრზე. ჩართეთ "HEAT" გადამრთველი. HEAT რეგულატორის გამოყენებით დააყენეთ ძაბვა 10-20 ვ-ზე (რაც უფრო მაღალია ძაბვა, მით უფრო სწრაფია გათბობა). ჩაწერეთ ცხრილში. 8.1 შერჩეული ძაბვის მნიშვნელობები უდა მიმდინარე მე.
3. დაწყებული კალორიმეტრის ტემპერატურიდან ტმასწავლებლის მიერ მითითებული 0, 1С ინტერვალის შემდეგ შეიყვანეთ ცხრილში. 8.1 დროის მნიშვნელობები 0 შეესაბამება თითოეულ მიღწეულ ტემპერატურას ტ.
4. გამორთეთ "HEAT" გადამრთველი, გახსენით სახურავი და გააციეთ კალორიმეტრი საწყის ტემპერატურამდე. ტ 0 . კალორიმეტრის სწრაფად გასაცივებლად, შეგიძლიათ ერთ-ერთი ნიმუში ჩაუშვათ კალორიმეტრში, გარდა მასწავლებლის მიერ მითითებულისა (მაგალითის კალორიმეტრში დაყენებისას, მარცხნივ გადააბრუნეთ ხრახნი კალორიმეტრის ქვედა ნაწილში). ტემპერატურა კლებას დაიწყებს. როდესაც გაგრილების სიჩქარე მცირდება, ამოიღეთ გახურებული ნიმუში და ჩადეთ შემდეგი (ცივი), გარდა მასწავლებლის მიერ მითითებულისა. ნიმუშის ამოსაღებად, კალორიმეტრის ბოლოში ხრახნი გადაატრიალეთ მარჯვნივ (საათის ისრის მიმართულებით) და შემდეგ ამოიღეთ ნიმუში სახელურით.
ცხრილი 8.1
|
თ= ტ− ტ 0 , |
= − 0 , |
J/(კგK) |
C მ =თანმ, J/(molK) |
||||||||
5. ხრახნიანი მარცხნივ მოატრიალეთ, კალორიმეტრში მოათავსეთ მასწავლებლის მითითების მიხედვით აღებული ტესტის ერთ-ერთი ნიმუში. მჭიდროდ დახურეთ კალორიმეტრის თავსახური და დაელოდეთ 2-3 წუთი კალორიმეტრისა და ნიმუშის ტემპერატურის გათანაბრებას.
6. ჩართეთ „HEAT“ გადამრთველი და დააყენეთ იგივე ძაბვა წრეში, როგორც ცარიელი კალორიმეტრის გაცხელებისას.
7. დაწყებული იგივე საწყისი კალორიმეტრის ტემპერატურიდან ტ 0, 1С ინტერვალის შემდეგ შეიყვანეთ ცხრილში. 8.1 დროის მნიშვნელობები თითოეული მიღწეული ტემპერატურის შესაბამისი ტ.
8. დააყენეთ „HEATING“ რეგულატორი უკიდურეს მარცხენა პოზიციაზე (მინიმუმზე), გამორთეთ „HEATING“ გადამრთველი, გახსენით კალორიმეტრის სახურავი. ნიმუშის კალორიმეტრიდან ამოსაღებად, გადაატრიალეთ ხრახნი მარჯვნივ, შემდეგ ამოიღეთ გახურებული ნიმუში სახელურის გამოყენებით.
9. გამორთეთ მოწყობილობა "NETWORK" გადამრთველით.
10. გადათარგმნეთ რაოდენობების ყველა მნიშვნელობა 0 და შეიტანეთ მნიშვნელობები წამებში (წუთების გარეშე) და შეიყვანეთ ისინი ცხრილში. 8.1. ცხრილის თითოეული ხაზისთვის. 8.1 გამოთვალეთ -ის მნიშვნელობები = − 0 და თ= ტ− ტ 0 .
11. გააკეთეთ ნიმუშის სპეციფიკური სითბოს სიმძლავრის სავარაუდო გამოთვლა ფორმულის გამოყენებით 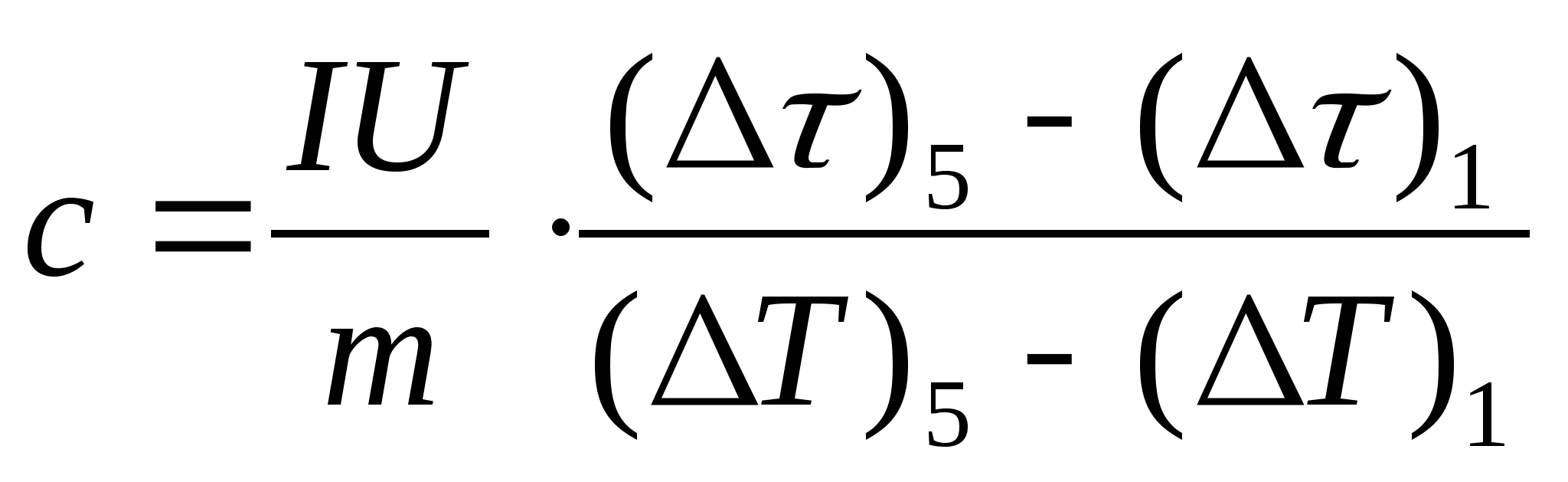 , სადაც ნიმუშის მასა მ=139,5 გ (სპილენძი) ან მ=129,7 გ (ფოლადი) ან
მ=46,05 გ (დურალუმინი). მოდი მასწავლებელთან შესამოწმებლად.
, სადაც ნიმუშის მასა მ=139,5 გ (სპილენძი) ან მ=129,7 გ (ფოლადი) ან
მ=46,05 გ (დურალუმინი). მოდი მასწავლებელთან შესამოწმებლად.
გაზომვის შედეგების დამუშავება
1. ნაკვეთი
=ვ(თ) კალორიმეტრის გათბობის დროის სხვაობის ნიმუშთან და ცარიელ კალორიმეტრთან დამოკიდებულება კალორიმეტრის ტემპერატურის ცვლილებაზე, აირჩიეთ გრაფიკზე ნებისმიერი ორი წერტილი და განსაზღვრეთ სწორი ხაზის დახრილობა ფორმულის გამოყენებით. 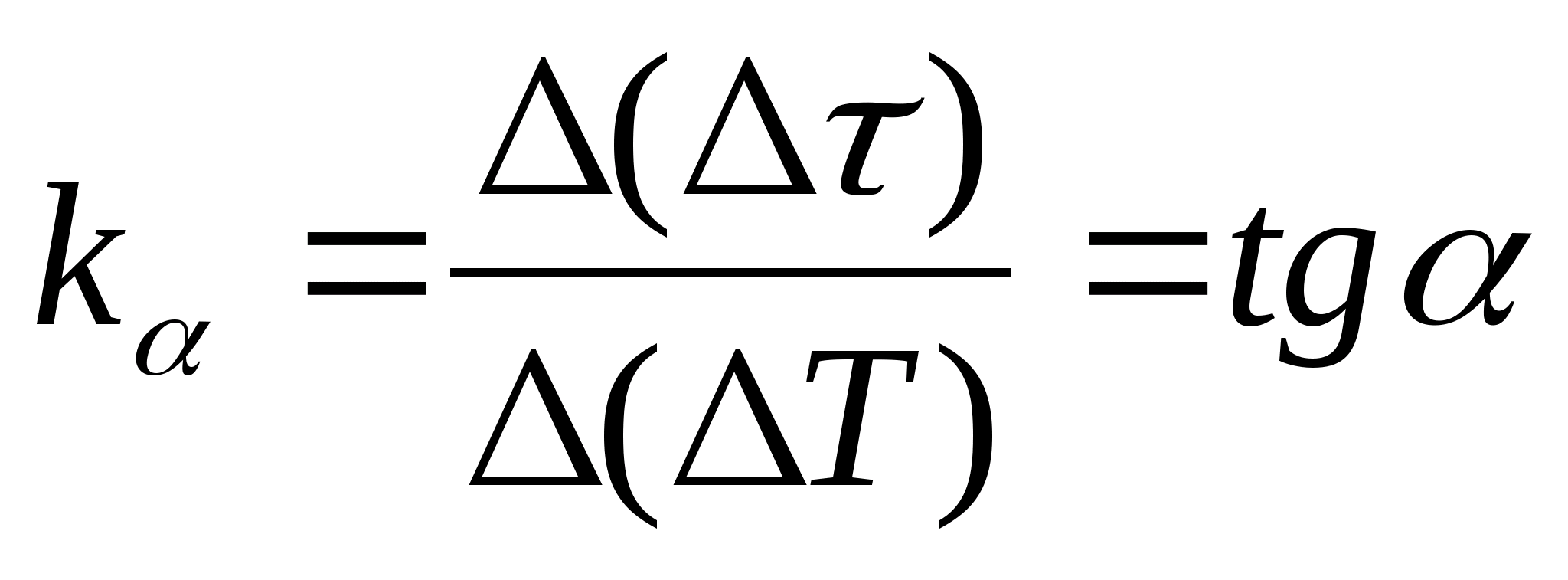 , სად
− გრაფიკის დახრილობის კუთხე ღერძზე თ
(თუ -ის ერთეულები
და თნაჩვენებია ორივე ღერძზე, როგორც ერთნაირი სიგრძის სეგმენტები).
, სად
− გრაფიკის დახრილობის კუთხე ღერძზე თ
(თუ -ის ერთეულები
და თნაჩვენებია ორივე ღერძზე, როგორც ერთნაირი სიგრძის სეგმენტები).
2. ფერდობის მნიშვნელობის გამოყენება კ
, განსაზღვრეთ ნიმუშის სპეციფიკური სითბოს მოცულობა ფორმულის გამოყენებით 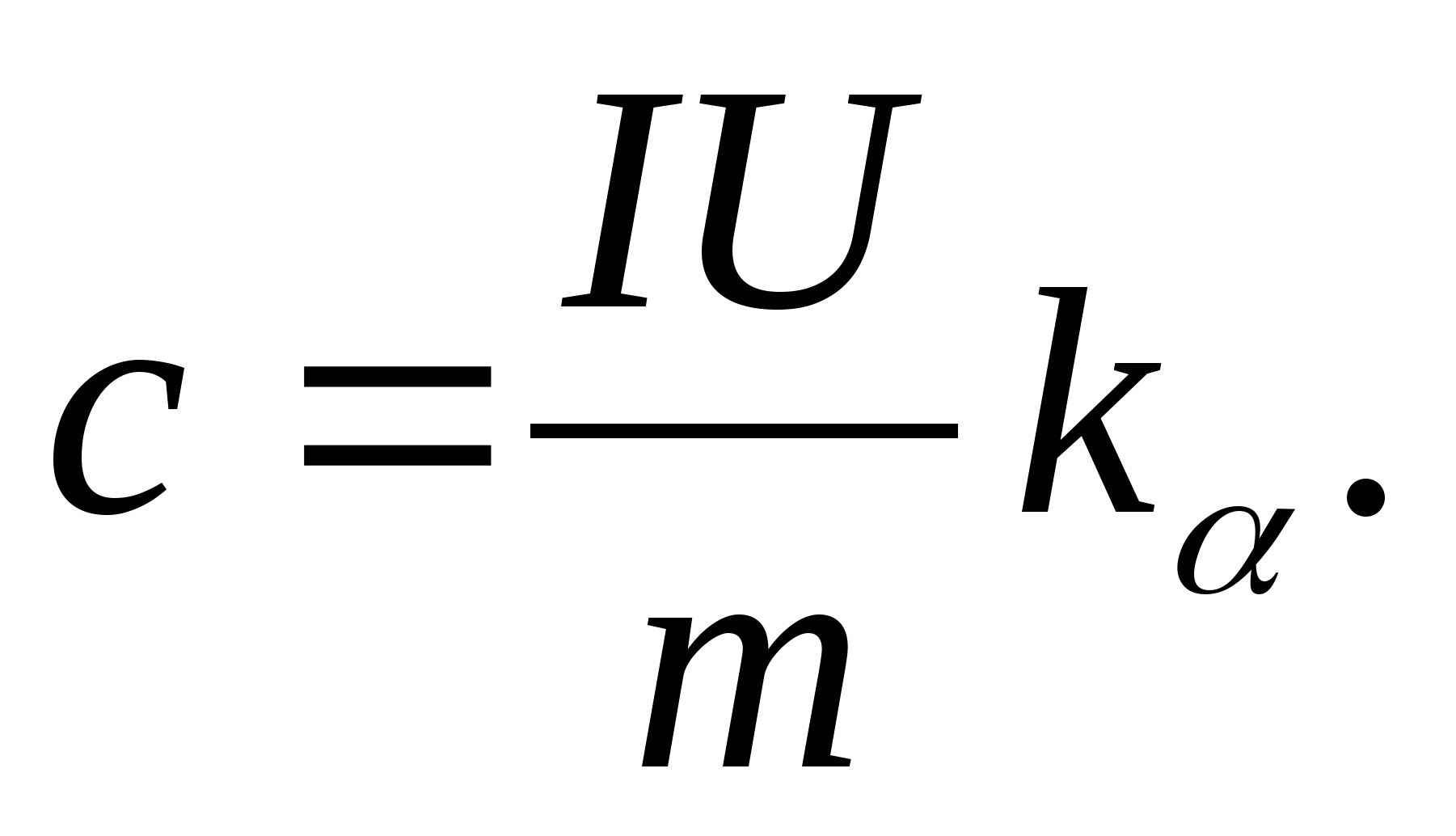
3. 8.2 ცხრილის (ან პერიოდული ცხრილის) მონაცემების გამოყენებით, განსაზღვრეთ ნიმუშის მოლური სითბოს სიმძლავრე ფორმულის გამოყენებით C მ =თანმ.
ცხრილი 8.2
|
მასალის ნიმუში |
ატომური მასა, კგ/მოლი |
|
როგორც მყარი სხეულის მოდელი, განვიხილოთ სწორად აგებული კრისტალური გისოსი, რომლის კვანძებში ნაწილაკები (ატომები, იონები, მოლეკულები), როგორც მატერიალური წერტილები, ირხევა მათი წონასწორობის პოზიციების ირგვლივ - მედის კვანძები - სამი ურთიერთ პერპენდიკულარული მიმართულებით. . ამრიგად, თითოეულ ნაწილაკს, რომელიც ქმნის კრისტალურ გისოსს, ენიჭება თავისუფლების სამი ვიბრაციული ხარისხი, რომელთაგან თითოეულს, ენერგიის თანაბარი გადანაწილების კანონის თანახმად, თავისუფლების ხარისხებზე (იხ. § 50), აქვს ენერგია. კტ.
მყარი სხეულის მოლის შინაგანი ენერგია
U m \u003d 3N A kT \u003d 3RT,
სადაც N A არის ავოგადროს მუდმივი; ნა კ= რ (რ არის მოლარული აირის მუდმივი).
მყარი ნივთიერების მოლური სითბოს ტევადობა
ანუ მოლური (ატომური) თბოტევადობა ქიმიურად მარტივი სხეულებიკრისტალურ მდგომარეობაში იგივეა (ტოლი 3 რ) და არ არის დამოკიდებული ტემპერატურაზე. ეს კანონი ემპირიულად მიიღეს ფრანგმა მეცნიერებმა P. Dulong (1785-1838) და L. Petit (1791-1820) და არის სათაურიდულონგისა და პეტიტის კანონი.
თუ მყარი არის ქიმიური ნაერთი (მაგალითად, NaCl), მაშინ მოლში ნაწილაკების რაოდენობა არ არის ავოგადროს მუდმივის ტოლი, მაგრამ ტოლია nNა , სადაც ნ - ატომების რაოდენობა მოლეკულაში (NaCl-სთვის, ნაწილაკების რაოდენობა მოლში არის 2 ნდა ასე რომ, ერთი მოლი NaCl შეიცავს N A Na ატომებს და N A Cl ატომებს). ასე რომ, მოლური სითბოს მოცულობა მყარი ქიმიური ნაერთები
C V \u003d 3R25n J / (მოლ K),
ანუ ტოლია ამ ნაერთების შემადგენელი ელემენტების ატომური სითბოს შესაძლებლობების ჯამისა.
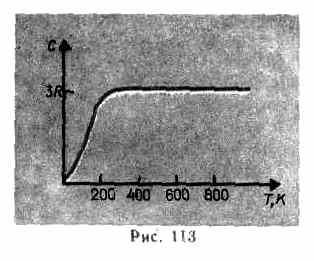
როგორც ექსპერიმენტული მონაცემები აჩვენებს (ცხრილი 4), ბევრი ნივთიერებისთვის დულონგისა და პეტიტის კანონი კმაყოფილდება საკმაოდ კარგი მიახლოებით, თუმცა ზოგიერთ ნივთიერებას (C, Be, B) აქვს მნიშვნელოვანი გადახრები გამოთვლილი სითბოს სიმძლავრეებისგან. გარდა ამისა, როგორც გაზების შემთხვევაში (იხ. § 53), ცდებმა დაბალ ტემპერატურაზე მყარი ნივთიერებების სითბოს სიმძლავრის გაზომვაზე აჩვენა, რომ ეს დამოკიდებულია ტემპერატურაზე (ნახ. 113). ნულ კელვინთან ახლოს, სხეულების თბოტევადობა პროპორციულია T 3-ის და მხოლოდ საკმარისად მაღალ ტემპერატურაზე, თითოეული ნივთიერებისთვის დამახასიათებელი პირობა (73.1) დაკმაყოფილებულია. მაგალითად, ალმასს აქვს 3 თბოტევადობა რ 1800 K-ზე! თუმცა, მყარი ნივთიერებების უმეტესობისთვის ოთახის ტემპერატურა უკვე საკმარისად მაღალია.
გამოთვლილი სითბოს სიმძლავრეების ექსპერიმენტულ და თეორიულ მნიშვნელობებს შორის შეუსაბამობა
კლასიკური თეორიის საფუძველს, ახსნეს სითბოს სიმძლავრეების კვანტური თეორიის საფუძველზე, ა. აინშტაინი და პ. დები (1884-1966).
§ 74. აორთქლება, სუბლიმაცია, დნობა და კრისტალიზაცია. ამორფული სხეულები
როგორც სითხეებში, ასევე მყარ სხეულებში, ყოველთვის არის მოლეკულების გარკვეული რაოდენობა, რომელთა ენერგიაც საკმარისია სხვა მოლეკულებისადმი მიზიდულობის დასაძლევად და რომლებსაც შეუძლიათ თხევადი ან მყარი ზედაპირიდან დაშორება და მათ მიმდებარე სივრცეში გადასვლა. სითხის ამ პროცესს ე.წ აორთქლება(ან აორთქლება),მყარისთვის - სუბლიმაცია(ან სუბლიმაცია).
სითხეების აორთქლება ხდება ნებისმიერ ტემპერატურაზე, მაგრამ მისი ინტენსივობა იზრდება ტემპერატურის მატებასთან ერთად. აორთქლების პროცესთან ერთად ხდება კომპენსაციის პროცესი კონდენსაციაორთქლი სითხეში. თუ მოლეკულების რაოდენობა, რომლებიც ტოვებენ სითხეს დროის ერთეულზე ერთეული ზედაპირის გავლით, უდრის ორთქლიდან სითხეში გადასული მოლეკულების რაოდენობას, მაშინ დინამიური ბალანსიაორთქლებისა და კონდენსაციის პროცესებს შორის. თავის სითხესთან წონასწორობაში მყოფ ორთქლს ეწოდება მდიდარი(იხ. ასევე § 62).
მყარი ნივთიერებების უმეტესობისთვის სუბლიმაციის პროცესი ჩვეულებრივ ტემპერატურაზე უმნიშვნელოა და ორთქლის წნევა მყარის ზედაპირზე დაბალია; ის იზრდება ტემპერატურის მატებასთან ერთად. ინტენსიურად სუბლიმირებული ნივთიერებები, როგორიცაა ნაფტალინი, კამფორი, რომელიც ვლინდება მკვეთრი, დამახასიათებელი სუნით. სუბლიმაცია განსაკუთრებით ინტენსიურად ხდება ვაკუუმში - ეს გამოიყენება სარკეების დასამზადებლად. სუბლიმაციის ცნობილი მაგალითია ყინულის ორთქლად გადაქცევა - სველი სამრეცხაო შრება სიცივეში.
თუ მყარი სხეული თბება, მაშინ ის შინაგანი ენერგია(ნაწილაკების ვიბრაციის ენერგიის ჯამი გისოსებზე და ამ ნაწილაკების ურთიერთქმედების ენერგია) იზრდება. ტემპერატურის მატებასთან ერთად, ნაწილაკების რხევების ამპლიტუდა
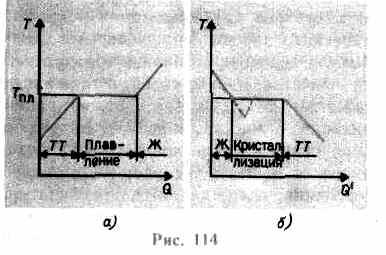
იზრდება მანამ, სანამ ბროლის ბადე არ იშლება - მყარი დნება. ნახ. 114 ანაჩვენებია სავარაუდო დამოკიდებულება თ(ქ), სადაც ქ- სხეულის მიერ მიღებული სითბოს რაოდენობა დნობის დროს. როგორც გზავნილი მყარი თბილი სხეულიმისი ტემპერატურა იზრდება და დნობის წერტილში თ pl იწყება სხეულის გადასვლა მყარი მდგომარეობიდან თხევადში. ტემპერატურა თ pl რჩება მუდმივი მანამ, სანამ მთელი ბროლი არ დნება და მხოლოდ ამის შემდეგ დაიწყება სითხის ტემპერატურა კვლავ მატებას.
გათბობა მყარი მდე თ pl ჯერ არ გარდაქმნის მას თხევად მდგომარეობაში, ვინაიდან ნივთიერების ნაწილაკების ენერგია საკმარისი უნდა იყოს ბროლის გისოსის გასანადგურებლად. დნობის პროცესში ნივთიერებაზე გადაცემული სითბო გამოიყენება ბროლის გისოსების განადგურების სამუშაოების შესასრულებლად და, შესაბამისად, T pl =const სანამ მთელი ბროლი არ გადნება. შემდეგ მიწოდებული სითბო კვლავ წავა სითხის ნაწილაკების ენერგიის გასაზრდელად და მისი ტემპერატურა დაიწყებს მატებას. 1 კგ ნივთიერების დნობისთვის საჭირო სითბოს რაოდენობას ეწოდება შერწყმის სპეციფიკური სითბო.
თუ სითხე გაცივდა, მაშინ პროცესი საპირისპირო მიმართულებით მიმდინარეობს (სურ. 114, ბ; ქ" - კრისტალიზაციის დროს სხეულის მიერ გამოყოფილი სითბოს რაოდენობა): ჯერ სითხის ტემპერატურა მცირდება, შემდეგ იწყება T pl-ის ტოლი მუდმივი ტემპერატურა. კრისტალიზაცია,მისი დასრულების შემდეგ, ბროლის ტემპერატურა იწყებს კლებას. ნივთიერების კრისტალიზაციისთვის ე.წ კრისტალიზაციის ცენტრები -კრისტალური ბირთვები, რომლებიც შეიძლება იყოს არა მხოლოდ წარმოქმნილი ნივთიერების კრისტალები, არამედ მინარევებიც, ასევე მტვერი, ჭვარტლი და ა.შ. სუფთა სითხეში კრისტალიზაციის ცენტრების არარსებობა ართულებს მიკროსკოპული კრისტალების წარმოქმნას და ნივთიერება, რჩება თხევად მდგომარეობაში, ცივდება კრისტალიზაციის ტემპერატურაზე დაბალ ტემპერატურამდე, რითაც წარმოიქმნება სუპერგაციებული სითხე(114-ზე, b შეესაბამება წყვეტილ მრუდს). ძლიერი სუპერგაგრილების დროს იწყება კრისტალიზაციის ცენტრების სპონტანური წარმოქმნა და ნივთიერება საკმაოდ სწრაფად კრისტალიზდება.
ჩვეულებრივ, დნობის სუპერგაცივება ხდება ფრაქციებიდან ათეულ გრადუსამდე, მაგრამ რიგი ნივთიერებებისთვის მას შეუძლია ასობით გრადუსამდე მიაღწიოს. მაღალი სიბლანტის გამო, ძალიან ზეგაციებული სითხეები კარგავენ სითხეს, ინარჩუნებენ ფორმას, როგორც მყარი. ამ სხეულებს ე.წ ამორფული მყარი;მათ შორისაა ფისები, ცვილი, დალუქვის ცვილი, მინა. ამორფული სხეულები, ამდენად, სუპერგაციებული სითხეები, იზოტროპული,ანუ მათი თვისებები ყველა მიმართულებით ერთნაირია; მათთვის, ისევე როგორც სითხეებისთვის, დამახასიათებელია მოკლე დიაპაზონის შეკვეთანაწილაკების განლაგებაში; მათში, სითხეებისგან განსხვავებით, ნაწილაკების მობილურობა საკმაოდ მცირეა. ამორფული სხეულების თავისებურება ის არის, რომ მათ არ აქვთ დნობის სპეციფიკური წერტილი, ანუ შეუძლებელია კონკრეტული ტემპერატურის მითითება, რომელზედაც შესაძლებელი იქნება თხევადი მდგომარეობის დადგენა და მყარი მდგომარეობის ქვემოთ. გამოცდილებიდან ცნობილია, რომ ამორფულ სხეულებში დროთა განმავლობაში შეიმჩნევა კრისტალიზაციის პროცესი, მაგალითად, კრისტალები ჩნდება მინაში; ის, კარგავს გამჭვირვალობას, იწყებს დაბინდვას და გადაიქცევა პოლიკრისტალურ სხეულად.
ბოლო დროს ფართოდ გამოიყენება ეროვნული ეკონომიკამიიღო პოლიმერები- ორგანული ამორფული სხეულები, რომელთა მოლეკულები შედგება დიდი რაოდენობით იდენტური გრძელი მოლეკულური ჯაჭვისგან, რომლებიც დაკავშირებულია ქიმიური (ვალენტური) ბმებით. პოლიმერებს მიეკუთვნება როგორც ბუნებრივი (სახამებელი, ცილა, რეზინი, ბოჭკოვანი და სხვ.) ასევე ხელოვნური (პლასტიკური, რეზინი, პოლისტირონი, ლავსანი, ნეილონი და სხვ.) ორგანული ნივთიერებები. პოლიმერები თანდაყოლილი სიმტკიცე და ელასტიურობაა; ზოგიერთი პოლიმერი უძლებს თავდაპირველ სიგრძეზე 5-10-ჯერ გაჭიმვას. ეს აიხსნება იმით, რომ გრძელ მოლეკულურ ჯაჭვებს შეუძლიათ დეფორმაციის დროს ან მკვრივ ბურთებად ჩამოყრა ან სწორ ხაზებად გადაჭიმვა. პოლიმერების ელასტიურობა ვლინდება მხოლოდ გარკვეულ ტემპერატურულ დიაპაზონში, რომლის ქვემოთ ისინი გახდებიან მყარი და მტვრევადი, ხოლო ზემოთ - პლასტიკური. მიუხედავად იმისა, რომ შეიქმნა მრავალი სინთეზური პოლიმერული მასალა (ხელოვნური ბოჭკოები, ტყავის შემცვლელები, სამშენებლო მასალები, ლითონის შემცვლელები და ა.შ.), პოლიმერების თეორია ჯერ კიდევ არ არის სრულად განვითარებული. მის განვითარებას განაპირობებს თანამედროვე ტექნოლოგიების მოთხოვნები, რაც მოითხოვს წინასწარ განსაზღვრული თვისებების მქონე პოლიმერების სინთეზს.
ნივთიერების სპეციფიკური სითბოს მოცულობა გაგებულია, როგორც მნიშვნელობა
, (1)
სად არის სხეულისთვის გადაცემული სითბოს რაოდენობა.
არის ტემპერატურის ცვლილება, რომელიც ხდება
სხეულისთვის სითბოს გადაცემის შედეგად,
m არის გახურებული სხეულის მასა.
გამოცდილება ჩვეულებრივ განსაზღვრავს საშუალოს სპეციფიკური სითბონივთიერება c, რიცხობრივად უდრის სითბოს რაოდენობას, რომელიც უნდა გადაეცეს ამ ნივთიერების მასის ერთეულს, რათა გაიზარდოს მისი ტემპერატურა:
(2),
სად არის სხვაობა შესასწავლი სხეულის საბოლოო და საწყის ტემპერატურას შორის.
სითბოს სიმძლავრის ექსპერიმენტულად დასადგენად გამოიყენება სხვადასხვა კალორიმეტრიული მეთოდი. ამ მეთოდების მრავალფეროვნება განპირობებულია იმით, რომ სხეულზე გადაცემული სითბოს ოდენობის ზუსტი გაზომვა მოითხოვს სითბოს დანაკარგების აღმოფხვრას, რომელიც არ არის გათვალისწინებული შესასწავლი სხეულის გაცხელებისას.
ჩვეულებრივ, იზოთერმული გარსით ეგრეთ წოდებულ კალორიმეტრებში შემოდის გამოსხივების გამოთვლილი ან ექსპერიმენტულად განსაზღვრული კორექტირება, ანუ სითბოს რაოდენობა, რომელსაც კალორიმეტრი იღებს ან აწვდის გარე გარემოს ექსპერიმენტის დროს გამოსხივებით.
თუმცა, შესაძლებელია მნიშვნელოვნად შემცირდეს სითბოს დანაკარგები კარგი თბოიზოლაციის შემოღებით ან ექსპერიმენტის ხანგრძლივობის შემცირებით, რაც მიიღწევა ნიმუშის მაღალი გათბობის სიჩქარით ~ (სითბოუნარიანობის გაზომვის პულსის მეთოდი), რომლის დროსაც სითბოს დანაკარგები იქნება. იყოს მცირე მიწოდებული სითბოს მთლიან რაოდენობასთან შედარებით.
სითბოს სიმძლავრის განსაზღვრის ერთ-ერთი ყველაზე ზუსტი მეთოდია ადიაბატური კალორიმეტრის მეთოდი. ამ ტიპის კალორიმეტრებში სითბოს დანაკარგების გათვალისწინების აუცილებლობასთან დაკავშირებული სირთულეები აღმოფხვრილია იმით, რომ გაზომვები ხდება თერმული წონასწორობის პირობებში, ანუ შესასწავლი ნიმუშისა და ნიმუშის მიმდებარე ბლოკის თანაბარი ტემპერატურის პირობებში. . ამ მეთოდის უპირატესობებში, მაღალ სიზუსტესთან ერთად, ასევე შედის მყარი ნივთიერებების სითბოს სიმძლავრის განსაზღვრის შესაძლებლობა ფართო ტემპერატურის დიაპაზონში, რაც განსაკუთრებით მნიშვნელოვანია, თუ ნივთიერებები განიცდიან ფაზურ გარდაქმნებს.
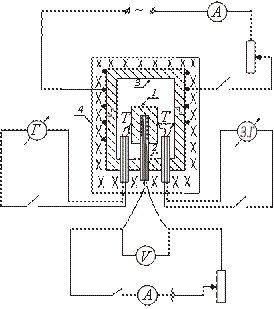
ადიაბატური კალორიმეტრის ერთ-ერთი ტიპის მოწყობილობა სქემატურად არის ნაჩვენები ნახატზე. საცდელი ნიმუში 1 მოთავსებულია სპილენძის ბლოკში 3 და მასთან ერთად თბება ღუმელში 4. გამაცხელებელი 2 შეყვანილია ნიმუშის შიგნით, რაც იძლევა ნიმუშის დამატებით გაცხელებას.
4 ღუმელის ჩართვის შემდეგ, რომელშიც მოთავსებულია ბლოკი ნიმუშით, ნიმუშის ტემპერატურა იწყებს მატებას, რჩება ბლოკის ტემპერატურის ქვემოთ. ნიმუშისა და ბლოკის ტემპერატურას შორის თანასწორობის დასამყარებლად, ჩართეთ ნიმუშის შიგნით მოთავსებული გამათბობელი. როდესაც ნიმუშის ტემპერატურა ოდნავ აღემატება ბლოკის ტემპერატურას, შიდა გამათბობელი გამორთულია.
შემდგომში, ეს გამათბობელი პერიოდულად ირთვება და გამორთულია ისე, რომ ტემპერატურული სხვაობა ნიმუშსა და ბლოკს შორის მუდმივად ცვლის ნიშანს.
იმ მომენტში, როცა ის ნულის ტოლია (როდესაც შიდა გამათბობელი ჩართულია), სინჯსა და ბლოკს შორის სითბოს გაცვლა არ ხდება და შიდა გამაცხელებლის მიერ გამოთავისუფლებული სითბოს მთელი რაოდენობა იხარჯება მხოლოდ ნიმუშის გაცხელებაზე; სპეციფიკური სითბო ამ შემთხვევაში შეიძლება განისაზღვროს ფორმულით (2).
შიდა გამათბობლის მიერ გამოთავისუფლებული სითბოს რაოდენობა განისაზღვრება ფორმულით:
სადაც I არის შიდა გამათბობლის დენი;
V არის ძაბვის ვარდნა მასზე;
- დროის ინტერვალი, რომლის დროსაც ტემპერატურა გაიზარდა.
მერე
(4)
სად არის დრო, რომლის დროსაც ნიმუშის ტემპერატურა შეიცვალა .
დიფერენციალური ფორმით, ფორმულას (4) აქვს ფორმა
(5)
ნიმუშის ტემპერატურა იზომება T თერმოწყვილით.ტემპერატურული სხვაობა ბლოკსა და ნიმუშს შორის იზომება დიფერენციალური თერმოწყვილით. ნიმუშის ტემპერატურის დასადგენად გამოიყენება თერმოწყვილის კალიბრაციის მრუდი T. ტემპერატურული სხვაობა ბლოკსა და ნიმუშს შორის განისაზღვრება გალვანომეტრის მასშტაბის განყოფილებებში (რადგან საჭიროა მხოლოდ იმ მომენტის დაფიქსირება, როდესაც ტემპერატურული სხვაობა ბლოკსა და ბლოკს შორის. ნიმუში იცვლება ნიშანი).
სამუშაოს დასრულება.
ნიმუში იდება სპილენძის ბლოკის შიგნით მოთავსებულ გამათბობელზე. თერმოწყვილი აკავშირებს T და უკავშირდება ნიმუშს და ბლოკს. ღუმელი დახურულია სახურავით. ჩართულია ღუმელის ელექტრო გრაგნილი, რომელშიც მოთავსებულია ბლოკი. ნიმუშის შიგნით მოთავსებული გამათბობელი პერიოდულად ირთვება და გამორთულია, ხოლო I და V-ის მნიშვნელობები ჩაიწერება შიდა გამაცხელებლის წრეში.
გაზომვების დაწყებამდე აუცილებელია სარკის გალვანომეტრის ნულოვანი პოზიციის შემოწმება. ამისათვის, თერმოწყვილის გალვანომეტრიდან გათიშვით, ისინი ელიან, რომ კურდღელი შეწყვეტს რყევას მასშტაბის გასწვრივ. თუ ამის შემდეგ ძაფის გამოსახულება არ ემთხვევა ნულს, მაშინ მასშტაბის გადაადგილებით მიიღწევა ეს დამთხვევა.
გამოსახულია T-ის და დროზე დამოკიდებულების მრუდები.
მრუდის T(t) დახრილობიდან იმ წერტილიდან, სადაც ის იცვლის ნიშანს (ანუ თერმული წონასწორობის დამყარებისას), სპეციფიკური სითბო გამოითვლება ფორმულით (5). ეს სითბოს სიმძლავრე ეხება ტემპერატურას, რომელიც უნდა ამოიკითხოს მრუდიდან T(t) იმ მომენტში, როდესაც ტემპერატურის სხვაობა ბლოკსა და ნიმუშს შორის ცვლის ნიშანს.
