Dans quelles unités la capacité calorifique est-elle mesurée ? Capacité calorifique des gaz. Types de capacités calorifiques
La capacité calorifique d'un corps est la quantité de chaleur qui doit être communiquée à un corps donné pour élever sa température d'un degré. Lorsqu'il est refroidi d'un degré, le corps dégage la même quantité de chaleur. La capacité calorifique est proportionnelle à la masse du corps. La capacité thermique d'une unité de masse d'un corps est appelée spécifique, et le produit de la capacité thermique spécifique par le poids atomique ou moléculaire est appelé atomique ou molaire, respectivement.
Capacités calorifiques diverses substances diffèrent grandement les uns des autres. Alors, chaleur spécifique l'eau à 20 ° C est de 4200 J / kg K, le bois de pin - 1700, l'air - 1010. Pour les métaux, c'est moins: aluminium - 880 J / kg K, fer - 460, cuivre - 385, plomb - 130. Chaleur spécifique augmente légèrement avec la température (à 90°C, la capacité calorifique de l'eau est de 4220 J/kg K) et varie fortement lors des transformations de phase : la capacité calorifique de la glace à 0°C est 2 fois inférieure à celle de l'eau ; la capacité calorifique de la vapeur d'eau à 100°C est d'environ 1500 J/kg K.
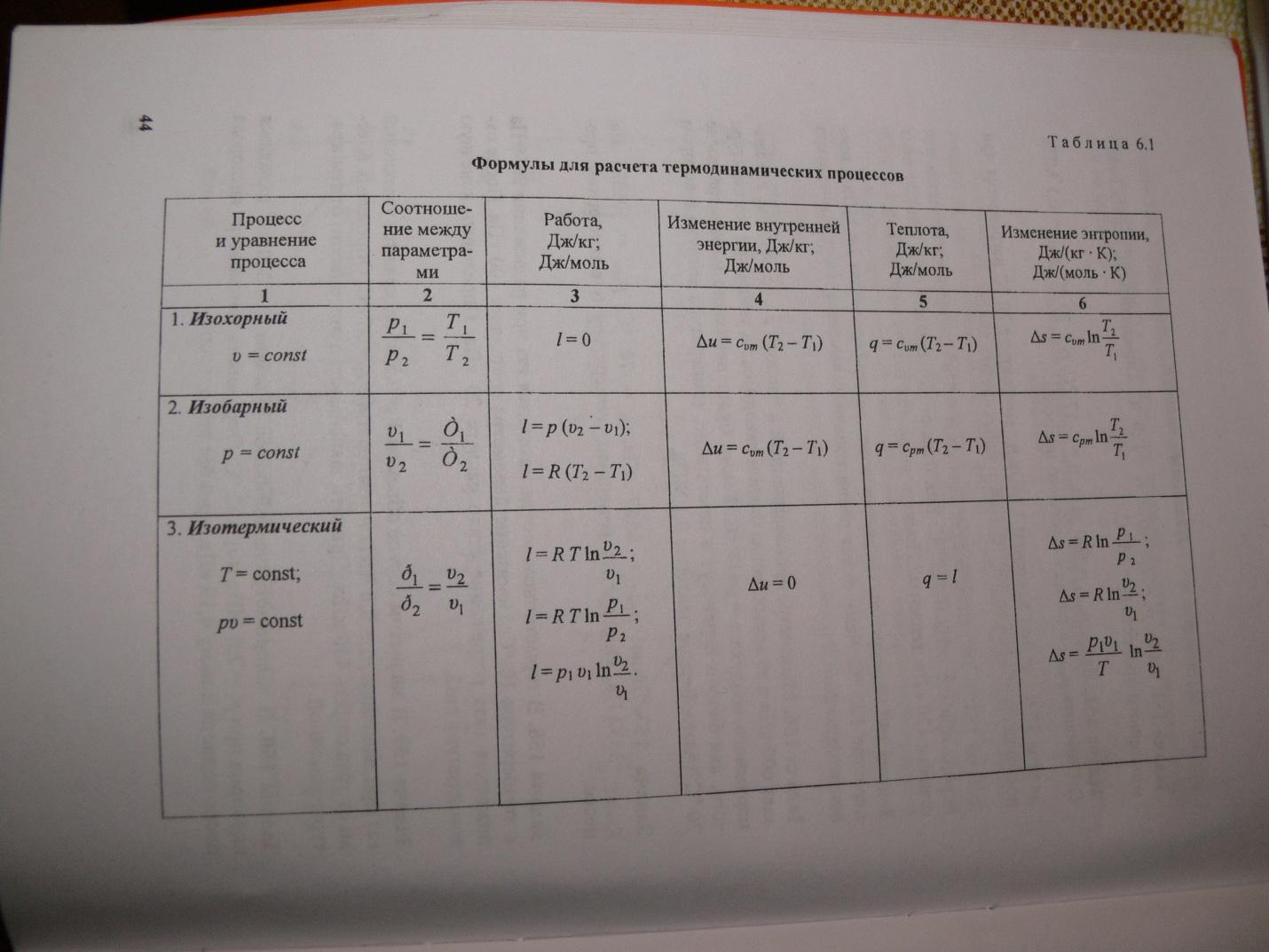
La capacité calorifique dépend des conditions dans lesquelles la température du corps change. Si les dimensions du corps ne changent pas, alors toute la chaleur va changer l'énergie interne. On parle ici de capacité calorifique à volume constant. À pression externe constante, en raison de la dilatation thermique, un travail mécanique est effectué contre les forces externes et le chauffage à une température particulière nécessite plus de chaleur. Par conséquent, la capacité calorifique à pression constante est toujours supérieure à . Pour gaz parfaits(voir figure), où R est la constante des gaz, égale à 8,32 J / mol K.
Habituellement mesuré. Manière classique les mesures de capacité calorifique sont les suivantes : un corps dont on veut mesurer la capacité calorifique est chauffé à une certaine température et placé dans un calorimètre de température initiale de , rempli d'eau ou d'un autre liquide de capacité calorifique connue et - la capacité calorifique de le calorimètre et le liquide).
En mesurant la température dans le calorimètre après l'établissement de l'équilibre thermique, la capacité calorifique du corps peut être calculée à l'aide de la formule :
![]()
où et sont les masses du corps, du liquide et du calorimètre.
La théorie la plus développée est celle de la capacité calorifique des gaz. Aux températures ordinaires, le chauffage entraîne principalement une modification de l'énergie du mouvement de translation et de rotation des molécules de gaz. Pour la capacité calorifique molaire des gaz monoatomiques, la théorie donne , diatomique et polyatomique - et . À très basse température, la capacité calorifique est quelque peu inférieure en raison des effets quantiques (voir Fig. Mécanique quantique). À hautes températures l'énergie vibratoire est ajoutée et la capacité calorifique des gaz polyatomiques augmente avec l'augmentation de la température.
La capacité calorifique atomique des cristaux, selon la théorie classique, est égale à , ce qui est conforme à la loi empirique de Dulong et Petit (établie en 1819 par les scientifiques français P. Dulong et A. Petit). Théorie des quanta la capacité thermique conduit à la même conclusion à des températures élevées, mais prédit une diminution de la capacité thermique avec une température décroissante. Près du zéro absolu, la capacité calorifique de tous les corps tend vers zéro (troisième loi de la thermodynamique).
Capacité calorifique du corps- c'est quantité physique, déterminé par le rapport entre la quantité de chaleur absorbée par le corps lorsqu'il est chauffé et la variation de sa température :
La signification physique de la capacité calorifique d'un corps : la capacité calorifique d'un corps est égale à la quantité de chaleur absorbée par le corps lorsqu'il est chauffé ou libérée lorsqu'il est refroidi de 1K.
Comme les capacités calorifiques sont variables, ils distinguent les capacités calorifiques moyennes et réelles. Sous la capacité calorifique moyenne comprendre le rapport de la quantité de chaleur q , résumé à une unité de quantité d'une substance (gaz), à un changement de sa température de t 1 avant de t 2 à condition que la différence de température t 2 – t 1 est une valeur finie. Les capacités thermiques massique, volumique et molaire moyennes, respectivement, sont désignées par c m , c m ' et m . De la définition de la capacité calorifique moyenne, il s'ensuit que si la température du gaz augmente de t 1 avant de t 2 puis sa capacité calorifique moyenne [kJ / (kg * K)]
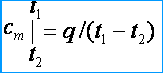
Sous la véritable capacité calorifique comprendre la capacité calorifique du gaz, correspondant à une variation infinitésimale de la température du gaz, correspondant à une variation infinitésimale de la température dt , c'est à dire.
c = dq/dt,
où dq=cdt.
Chaleur spécifique est la capacité de différentes substances à absorber la chaleur lorsqu'elles sont chauffées. La capacité calorifique spécifique d'une substance est déterminée par le rapport de la quantité de chaleur qu'elle reçoit lorsqu'elle est chauffée à la masse de la substance et à la variation de sa température, si: ![]()
la relation exprimant la relation entre les capacités calorifiques molaires Cp et CV a la forme (formule de Mayer) : Cp = CV + R. Capacité calorifique OU PLUS ÉLARGIE gaz parfait Si, à la suite d'un transfert de chaleur, une certaine quantité de chaleur est transférée au corps, l'énergie interne du corps et sa température changent. La quantité de chaleur Q nécessaire pour chauffer 1 kg d'une substance de 1 K est appelée chaleur spécifique de la substance c. c = Q / (mΔT). Dans de nombreux cas, il est pratique d'utiliser la capacité calorifique molaire C : C = M c, où M est la masse molaire de la substance. La capacité calorifique déterminée de cette manière n'est pas une caractéristique univoque d'une substance. Selon la première loi de la thermodynamique, la variation de l'énergie interne d'un corps dépend non seulement de la quantité de chaleur reçue, mais également du travail effectué par le corps. Selon les conditions dans lesquelles le processus de transfert de chaleur a été effectué, le corps pourrait effectuer divers travaux. Par conséquent, la même quantité de chaleur transférée au corps pourrait provoquer des changements différents dans son énergie interne et, par conséquent, sa température. Une telle ambiguïté dans la détermination de la capacité calorifique n'est typique que pour une substance gazeuse. Lorsque les corps liquides et solides sont chauffés, leur volume ne change pratiquement pas et le travail de dilatation s'avère égal à zéro. Par conséquent, toute la quantité de chaleur reçue par le corps va changer son énergie interne. Contrairement aux liquides et solides, le gaz en cours de transfert de chaleur peut modifier considérablement son volume et fonctionner. Par conséquent, la capacité calorifique d'une substance gazeuse dépend de la nature du processus thermodynamique. Deux valeurs de la capacité thermique des gaz sont généralement considérées : CV est la capacité thermique molaire dans un processus isochore (V = const) et Cp est la capacité thermique molaire dans un processus isobare (p = const). Dans le processus à volume constant, le gaz ne travaille pas : A = 0. De la première loi de la thermodynamique pour 1 mole de gaz découle QV = CVΔT = ΔU. La variation ΔU de l'énergie interne d'un gaz est directement proportionnelle à la variation ΔT de sa température. Pour un processus à pression constante, la première loi de la thermodynamique donne : Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, où ΔV est la variation de volume de 1 mole d'un gaz parfait lorsque sa température change de ΔT. Il en résulte : Le rapport ΔV / ΔT peut être trouvé à partir de l'équation d'état d'un gaz parfait, écrite pour 1 mole : pV = RT, où R est la constante universelle des gaz. A p = const Ainsi, la relation exprimant le rapport entre les capacités calorifiques molaires Cp et CV a la forme (formule de Mayer) : Cp = CV + R.
La constante des gaz est numériquement égale au travail d'expansion de 1 mole d'un gaz parfait sous pression constante lorsqu'il est chauffé par 1 K. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8.31(44) Dzh/ (mol K)
La constante universelle des gaz est une constante physique fondamentale universelle R, égale au produit de la constante de Boltzmann k et de la constante d'Avogadro
Signification physique : Constante de gaz i est numériquement égal au travail d'expansion d'une mole d'un gaz parfait dans un processus isobare avec une augmentation de température de 1 K
Dans le système CGS, la constante des gaz est :
La constante de gaz spécifique est :
Exposant adiabatique(appelé quelques fois coefficientPoisson) - le rapport de la capacité thermique à pression constante () à la capacité thermique à volume constant (). Parfois on l'appelle aussi facteur isentropique extensions. Désigné par la lettre grecque (gamma) ou (kappa). Le symbole de la lettre est principalement utilisé dans les disciplines du génie chimique. En génie thermique, la lettre latine est utilisée.
Un mélange de gaz appelé ensemble de plusieurs gaz hétérogènes qui, dans les conditions considérées, n'entrent pas en réaction chimique entre eux.
Un mélange de gaz est un système thermodynamique homogène (à l'intérieur duquel il n'y a pas d'interfaces séparant les parties macroscopiques du système les unes des autres, différant par leurs propriétés et leur composition).
Pression partielle P i du i-ième gaz dans le mélange est la pression sous laquelle ce gaz serait si tous les autres gaz étaient éliminés du mélange, et V et T restaient les mêmes.
Loi de Dalton - La pression d'un mélange de gaz qui n'interagissent pas chimiquement entre eux est égale à la somme des pressions partielles de ces gaz.
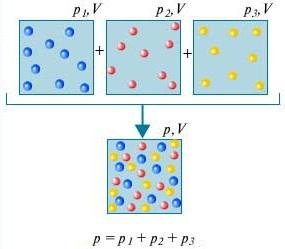
Afin de comprendre ce qui est loi de Dalton, considérez pour cela l'air de la pièce. C'est un mélange de plusieurs gaz : azote (80%), oxygène (20%). La pression partielle de chacun de ces gaz est la pression qu'aurait le gaz s'il occupait à lui seul tout le volume. Par exemple, si tous les gaz sauf l'azote étaient retirés de la pièce, la pression de ce qui restait serait la pression partielle d'azote. Loi de Dalton stipule que la pression totale de tous les gaz pris ensemble est égale à la somme des pressions partielles de chaque gaz pris séparément. (Strictement parlant, la loi ne s'applique qu'aux gaz idéaux, mais avec une assez bonne approximation, elle décrit également les gaz réels.)
Première loi de la thermodynamique est une généralisation de la loi de conservation et de transformation de l'énergie pour un système thermodynamique. Il est formulé comme suit :
Modifier ∆tu l'énergie interne d'un système thermodynamique non isolé est égale à la différence entre la quantité de chaleurQ transférées au système et travaillerUN , un système parfait sur les corps externes.
|
La relation exprimant la première loi de la thermodynamique s'écrit souvent sous une forme différente :
|
La quantité de chaleur reçue par le système est utilisée pour modifier son énergie interne et effectuer des travaux sur des corps externes.
La première loi de la thermodynamique est une généralisation de faits expérimentaux. Selon cette loi, l'énergie ne peut être ni créée ni détruite ; elle est transférée d'un système à un autre et se transforme d'une forme à une autre. Une conséquence importante de la première loi de la thermodynamique est l'affirmation qu'il est impossible de créer une machine capable de faire un travail utile sans consommer de l'énergie de l'extérieur et sans aucun changement à l'intérieur de la machine elle-même. Une telle machine hypothétique s'appelle machine à mouvement perpétuel (perpetuum mobile) du premier type . De nombreuses tentatives pour créer une telle machine se sont invariablement soldées par un échec. N'importe quelle machine peut faire un travail positif UN sur les corps extérieurs uniquement en obtenant une certaine quantité de chaleur Q des corps environnants ou une diminution de Δ tu son énergie interne.
Appliquons la première loi de la thermodynamique aux isoprocessus dans les gaz.
Avec expansion isobare Q> 0 - la chaleur est absorbée par le gaz et le gaz fait un travail positif. Avec compression isobare Q < 0 – тепло отдается внешним телам. В этом случае UN < 0. Температура газа при изобарном сжатии уменьшается, J 2 < J une ; l'énergie interne diminue, Δ tu < 0.
À processus isotherme la température du gaz ne change pas, par conséquent, l'énergie interne du gaz, Δ tu = 0.
À processus isochore (V= const) le gaz ne fonctionne pas, UN= 0. Par conséquent,
La première loi de la thermodynamique pour un processus isobare donne :
|
La première loi de la thermodynamique pour un processus isotherme est exprimée par la relation
|
Quantité de chaleur Q, obtenu par le gaz dans le processus d'expansion isotherme, se transforme en travail sur les corps extérieurs. Sous compression isotherme, le travail des forces externes produites sur le gaz est converti en chaleur, qui est transférée aux corps environnants.
Outre les processus isochoriques, isobares et isothermes, la thermodynamique considère souvent les processus qui se produisent en l'absence d'échange de chaleur avec les corps environnants. Les navires à parois isolantes sont appelés coques adiabatiques, et les processus d'expansion ou de compression de gaz dans de tels récipients sont appelés adiabatique.
À processus adiabatiqueQ= 0 ; donc la première loi de la thermodynamique prend la forme
|
|
|
Dans son sens physique, la première loi de la thermodynamique est la loi de conservation (changement) de l'énergie en thermodynamique. Si, selon la loi de changement d'énergie en mécanique, le travail des forces non conservatrices est égal à l'incrément de l'énergie mécanique du système (en particulier, le travail des forces de frottement de signe négatif est égal à la diminution de l'énergie mécanique du système), alors selon la première loi de la thermodynamique, l'incrément de l'énergie interne du système thermodynamique est égal à la somme du travail des forces extérieures, parfaites sur le système, et de l'énergie transférée au système par transfert de chaleur. Enthalpie(du grec. enthalpe- chauffer) est propriété de la matière, indiquant la quantité d'énergie qui peut être convertie en chaleur. Enthalpie est une propriété thermodynamique d'une substance qui indique le niveau d'énergie stockée dans sa structure moléculaire. Cela signifie que si la matière peut avoir de l'énergie en fonction de la température et de la pression, elle ne peut pas être entièrement convertie en chaleur. Une partie de l'énergie interne reste toujours dans la substance et maintient sa structure moléculaire. Une partie de l'énergie cinétique d'une substance n'est pas disponible lorsque sa température se rapproche de la température ambiante. Par conséquent, enthalpie est la quantité d'énergie disponible pour la conversion en chaleur à une température et une pression données. Les unités d'enthalpie sont BTU ou Joule pour l'énergie et Btu/lbm ou J/kg pour l'énergie spécifique. 11 questions |

Objectif: Détermination expérimentale de la capacité calorifique des matériaux.
Équipement: Balance, poids, calorimètre, cylindre métallique à capacité calorifique connue, bécher, réchauffeur, crochet.
Brève théorie :
Tous les corps et systèmes de corps macroscopiques, en plus de l'énergie mécanique due à leur mouvement et à leur interaction, ont une énergie qui dépend de leur état interne. Cette énergie, qui est l'énergie de mouvement et d'interaction entre toutes les particules qui composent le corps, est dite interne.
L'énergie interne comprend l'énergie cinétique du mouvement thermique des molécules et des atomes qui composent un corps donné, l'énergie cinétique des électrons se déplaçant dans les atomes autour des noyaux, l'énergie potentielle des interactions entre les molécules, les atomes, les électrons et les noyaux, les nucléons dans le noyau , etc. Le concept d'énergie interne n'inclut pas l'énergie cinétique et potentielle d'un corps donné dans son ensemble.
L'énergie interne est uniquement déterminée par l'ensemble des paramètres caractérisant l'état du système donné, c'est-à-dire est une fonction à valeur unique de l'état de ce système.
L'énergie interne est généralement désignée par la lettre U.
Dans les phénomènes thermiques se produisant à des températures éloignées des températures de transition de phase, une modification de l'énergie interne DU est associée à une modification de l'énergie cinétique et potentielle des molécules, tandis que les composants restants de l'énergie interne ne changent pas. Par conséquent, dans de tels processus, nous pouvons supposer que l'énergie interne d'un corps est égale à la somme des énergies cinétiques du mouvement thermique chaotique de toutes les molécules par rapport au centre de masse de ce corps et des énergies potentielles d'interaction de tous molécules les unes avec les autres.
Lorsque l'état du corps change, son énergie interne change. Par exemple, lorsque la température d'un corps s'élève, son énergie interne augmente, puisque l'énergie cinétique moyenne du mouvement des molécules de ce corps augmente. Lorsque la température diminue, l'énergie interne du corps diminue.
L'énergie interne des corps peut changer différentes façons. Par exemple, l'énergie interne change lorsqu'un travail mécanique est effectué par des forces externes sur un corps donné pendant sa déformation, et également sans travail, lorsque le corps est en contact avec un autre corps (ou milieu) qui a une température supérieure ou inférieure à le corps donné.
Le processus de modification de l'énergie interne d'un corps sans effectuer de travail mécanique est appelé transfert de chaleur ou transfert de chaleur. Il existe trois types de transfert de chaleur : la convection, la conduction et le rayonnement.
Lors de l'échange de chaleur, il n'y a pas de conversion d'énergie d'un type à un autre. Le processus de transfert de chaleur consiste dans le fait qu'une partie de l'énergie interne d'un corps plus chaud est transférée vers un corps (ou milieu) moins chaud.
Pour caractériser les processus de transfert de chaleur, le concept de quantité de chaleur est introduit, appelé quantité qui est une mesure quantitative de la variation de l'énergie interne du corps au cours du processus de transfert de chaleur.
Il faut se rappeler que le corps ne peut que donner ou recevoir de l'énergie, et la quantité de chaleur Q n'est qu'un équivalent numérique de l'énergie donnée ou reçue par le corps dans le processus de transfert de chaleur.
La quantité de chaleur dépend du type de procédé et n'est pas fonction de l'état du système.
La quantité de chaleur nécessaire pour chauffer le corps qui se produit sans transformations de phase (sans changer l'état d'agrégation de la substance) :
où c est la capacité thermique spécifique du corps, déterminée par le rapport de la quantité de chaleur transférée à la masse m du corps, et le changement de température résultant DT, m est la masse corporelle, DT est la différence entre la finale et les températures initiales du corps donné.
La quantité de chaleur qui doit être communiquée au corps afin d'augmenter sa température d'un Kelvin est appelée la capacité calorifique de cette substance. Lorsqu'il est refroidi d'un Kelvin, le corps dégage la même quantité de chaleur. La capacité calorifique d'un corps est proportionnelle à la masse du corps et dépend de la substance dont il est composé. Dans le système d'unités SI, la capacité calorifique est mesurée en J/K.
Pour caractériser les propriétés thermiques d'une substance, on prend la capacité calorifique d'une unité de masse de cette substance. Cette caractéristique est appelée capacité thermique spécifique. Elle est égale au rapport de la capacité calorifique d'un corps donné à sa masse. La capacité thermique spécifique avec le système SI est mesurée en J / (kg × K).
Expérimentalement, la chaleur spécifique d'un corps métallique est déterminée à l'aide d'un calorimètre et d'un thermomètre. Le calorimètre le plus simple est constitué d'un verre métallique poli placé à l'intérieur d'un autre verre sur bouchons (à des fins d'isolation thermique). Le verre intérieur est rempli d'eau ou d'un autre liquide avec une capacité calorifique spécifique connue. Un corps chauffé à une certaine température t est descendu dans un calorimètre. Que la température du liquide dans le calorimètre soit t 1 avant que le corps ne soit descendu, et après que l'équilibre thermique du liquide et du corps descendu dans celui-ci soit établi, leur température totale deviendra égale à q.
De la loi de conservation de l'énergie, il résulte que :
Q \u003d Q 1 + Q 2,(2)
où est la quantité de chaleur Q, donnée par un corps chauffé, est égale à la somme de la quantité de chaleur Q1, obtenu par l'eau, et Q2, reçu par le calorimètre.
Considérant (1), nous réécrivons (2) comme suit :
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
où c 1 et m 1- capacité calorifique spécifique et masse d'eau dans le calorimètre, c 2 et m2- capacité calorifique spécifique et masse du calorimètre. Cette équation est appelée équation du bilan thermique. De là, nous trouvons la capacité thermique spécifique du corps:
Il est possible d'aborder la solution de ce problème d'une manière différente, supposons que les pertes d'énergie dans le cadre d'une expérience soient les mêmes. Corps Avec capacité calorifique spécifique connue, chauffée à une certaine température t, descendu dans un calorimètre dont la température change. L'équation du bilan thermique prendra alors la forme :
cm(t-q) = c 1 m 1 (q-t 1) + Q perte,(5)
où Q perte est la quantité de chaleur reçue par le calorimètre et environnement, Par conséquent:
Q perte, = cm(t-q) - c 1 m 1 (q-t 1). (6)
Si un corps avec une capacité calorifique spécifique inconnue, chauffé à la même température, est abaissé dans un calorimètre, alors l'équation du bilan thermique prendra la forme :
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q pertes,(7)
où m¢ 1 est la masse d'eau dans le calorimètre, et t¢ 1- température de l'eau dans cette expérience. Alors:
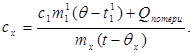 (8)
(8)
En substituant la valeur (6) dans (8) on obtient :
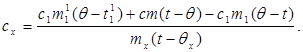 (9)
(9)
où est la quantité élémentaire de chaleur ; - un changement élémentaire de température.
La capacité calorifique est numériquement égale à la quantité de chaleur qui doit être fournie au système pour augmenter sa température de 1 degré dans des conditions données. Puisque l'unité de chaleur en SI est le joule et que la température est le degré K, l'unité de capacité calorifique est J/K.
En fonction de l'unité quantitative du corps à laquelle la chaleur est fournie en thermodynamique, on distingue les capacités thermiques massique, volumique et molaire.
Capacité thermique massique est la capacité calorifique par unité de masse du fluide de travail,
où et sont le volume et la densité du corps dans des conditions physiques normales.
La capacité calorifique volumétrique est mesurée en J/(m3 K).
Capacité calorifique molaire- capacité calorifique, rapportée à la quantité de fluide de travail (gaz) en moles,
| , |
où m3/mol est le volume molaire de gaz dans des conditions normales.
Considérant que la capacité thermique n'est pas constante, mais dépend de la température et d'autres paramètres thermiques, une distinction est faite entre la capacité thermique réelle et moyenne. Habituellement, la véritable capacité calorifique est comprise comme le rapport de la quantité élémentaire de chaleur qui est rapportée à un système thermodynamique dans tout processus à une augmentation infinitésimale de la température de ce système causée par la chaleur transmise. Nous considérerons la véritable capacité calorifique du système thermodynamique à une température du système égale à , et - vrai la capacité thermique spécifique fluide de travail à sa température égale à . Ensuite, la capacité thermique spécifique moyenne du fluide de travail lorsque sa température passe de à peut être déterminée comme
Détermination de l'énergie interne du corps.
Énergie interne corps (appelé E ou tu) est la somme des énergies des interactions moléculaires et des mouvements thermiques d'une molécule. En particulier, l'énergie interne d'un gaz parfait est égale à la somme des énergies cinétiques de toutes les particules de gaz en mouvement thermique continu et aléatoire. De là découle la loi de Joule, confirmée par de nombreuses expériences.
La théorie de la cinétique moléculaire conduit à l'expression suivante de l'énergie interne d'une mole d'un gaz monoatomique idéal (hélium, néon, etc.), dont les molécules n'effectuent qu'un mouvement de translation :
De cette façon, énergie interne tu corps est uniquement déterminé par des paramètres macroscopiques caractérisant l'état du corps. Cela ne dépend pas de la façon dont l'état donné a été réalisé. Il est d'usage de dire que l'énergie interne est une fonction d'état.
Dans TD, la variation de l'énergie interne est utilisée, et non sa valeur absolue.
Qu'est-ce que les travaux d'agrandissement. La première loi de TD.
Travail d'expansion - le travail mécanique effectué par le véhicule contre les forces de pression externe au cours de son expansion. Lorsque le volume change, le gaz fonctionne, le signe du changement de V coïncide avec le signe du travail
La première loi de TD : la chaleur transmise au système est utilisée pour convertir l'énergie interne et effectuer le travail.
Du point de vue de sa capacité à recevoir (ou à donner) de l'énergie sous forme de chaleur, il est d'usage de caractériser un système thermodynamique par sa capacité calorifique.
La capacité calorifique d'un corps (système) est une quantité physique qui est numériquement égale à la quantité de chaleur qui doit être communiquée au corps (système) pour modifier sa température d'un Kelvin.
Si le corps reçoit une quantité infinitésimale de chaleur Q, ce qui a provoqué une augmentation infinitésimale de la température réT, alors sa capacité calorifique DE est par définition égal à
L'unité SI de capacité calorifique est le joule divisé par le kelvin ( J/À).
Des expériences et des calculs théoriques montrent que la capacité calorifique d'un corps dépend de sa composition chimique, de sa masse et de son état thermodynamique(par exemple, sur la température), ainsi que sur le type de processus de modification de l'état du corps lorsque de la chaleur lui est transmise.
La capacité calorifique spécifique est la capacité calorifique par unité de masse d'une substance, c'est-à-dire pour une substance homogène
![]() , (25.2)
, (25.2)
où Avec- la capacité thermique spécifique, M est la masse de la substance.
L'unité SI de chaleur spécifique est le joule divisé par un kelvin-kilogramme [( J/(À . kg)].
La capacité thermique molaire est la capacité thermique d'une mole d'une substance, C'est
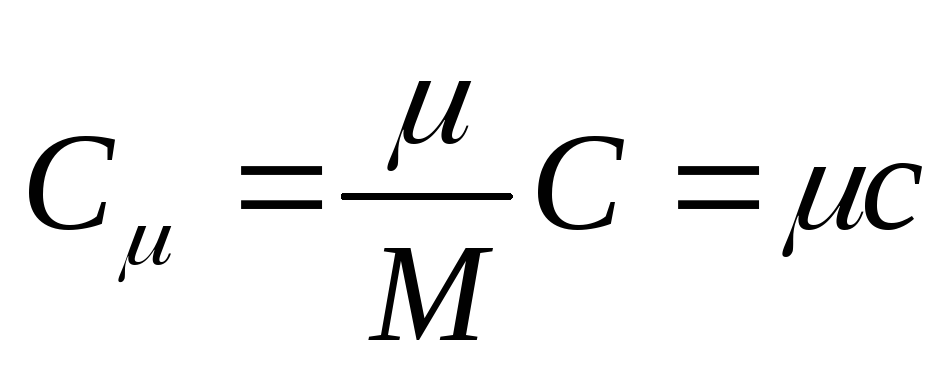 , (25.3)
, (25.3)
où DE - capacité calorifique molaire; est la masse molaire de la substance.
L'unité de capacité thermique molaire en SI est le joule divisé par le kelvin-mole [ J/(À . Môle)].
Quantité élémentaire de chaleur Q, nécessaire pour changer la température corporelle réJ, est défini comme
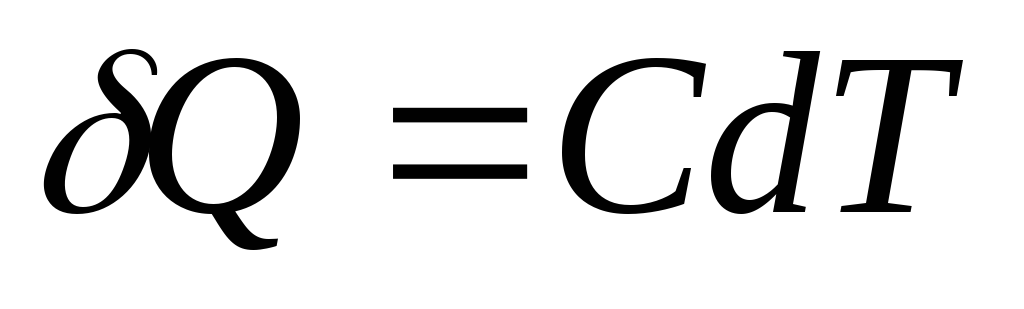 ,
,
et pour un corps homogène
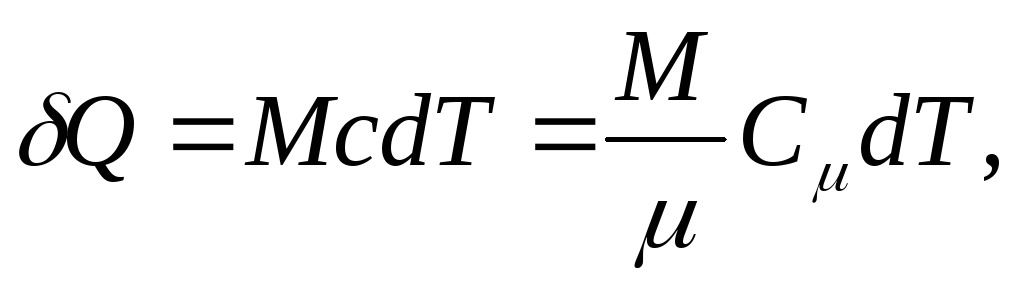 (25.4)
(25.4)
où M/ - quantité de substance (nombre de moles).
§26. Première loi de la thermodynamique
La première loi (première loi) de la thermodynamique est une expression mathématique de la loi de conservation et de transformation de l'énergie appliquée aux systèmes thermodynamiques. Il a été établi à la suite de recherches expérimentales et théoriques dans le domaine de la physique et de la chimie, dont l'étape finale a été la découverte de l'équivalence de la chaleur et du travail, c'est-à-dire la découverte que la conversion de la chaleur en travail et du travail en la chaleur s'effectue toujours dans le même rapport quantitatif strictement constant.
Au §24, il a été noté que l'énergie interne d'un système peut être modifiée de deux manières : en effectuant un travail et en transférant de la chaleur. Par conséquent, nous pouvons écrire :
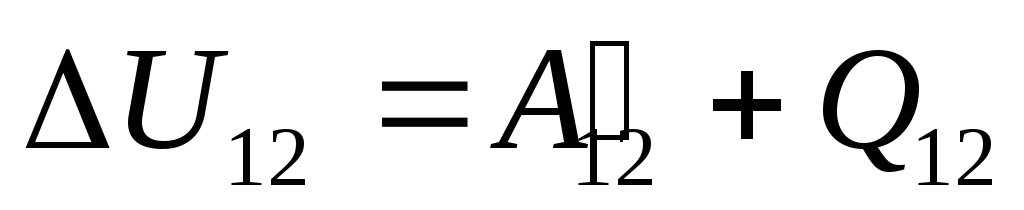 ,
(26.1)
,
(26.1)
où
tu 12
-
variation de l'énergie interne du système lors de sa transition de l'état 1
dans un état 2
suite à des travaux dessus 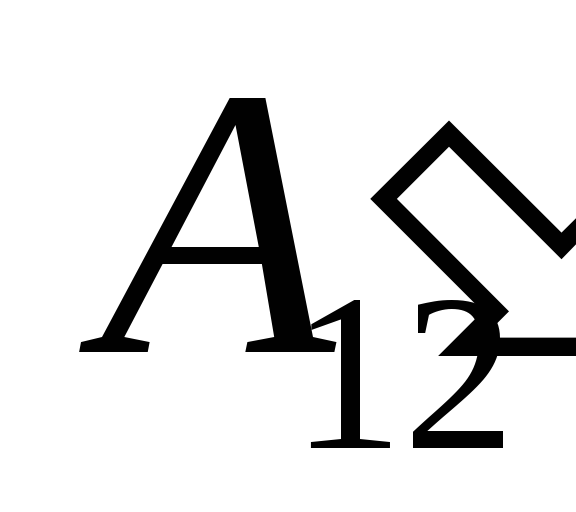 provenant de corps extérieurs et lui transférant de l'extérieur une certaine quantité de chaleur
provenant de corps extérieurs et lui transférant de l'extérieur une certaine quantité de chaleur  .
.
Nous savons que le travail 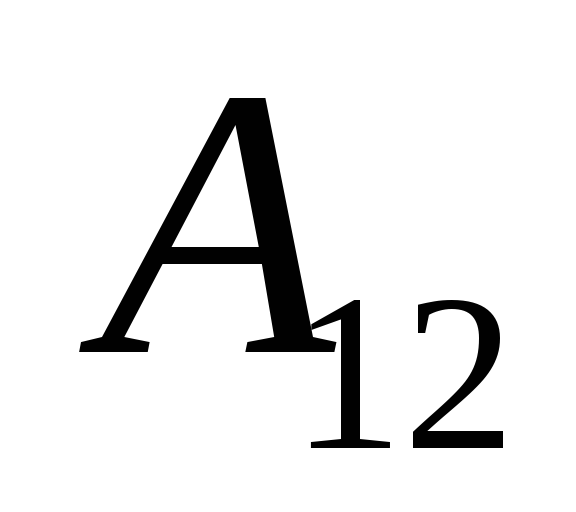 effectué par le système lui-même sur des corps externes est numériquement égal et de signe opposé au travail
effectué par le système lui-même sur des corps externes est numériquement égal et de signe opposé au travail  corps externes au-dessus du système, c'est-à-dire
corps externes au-dessus du système, c'est-à-dire
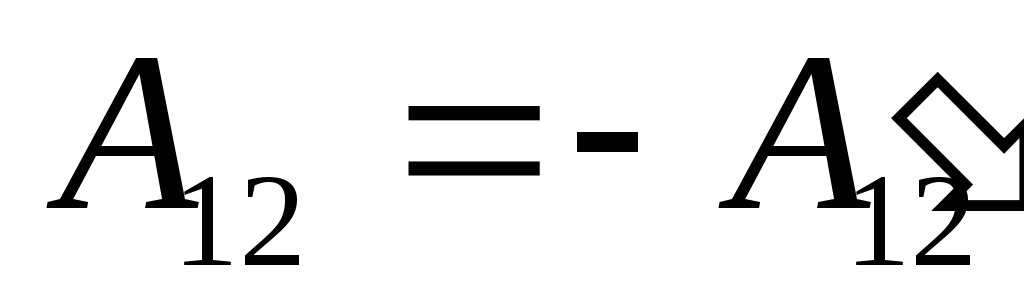 ,
(26.2)
,
(26.2)
donc l'expression (26.1) peut être réécrite comme
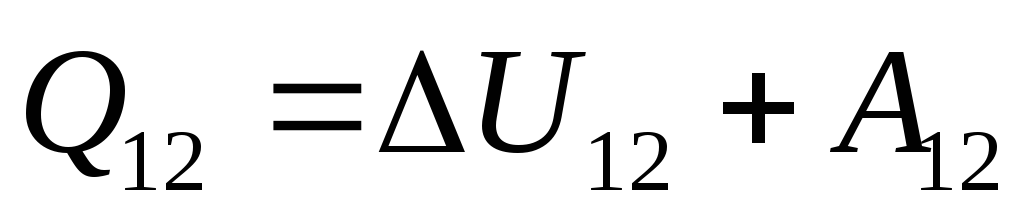 . (26.3)
. (26.3)
Cette équation est un enregistrement mathématique de la première loi de la thermodynamique : la quantité de chaleur communiquée au système est dépensée pour modifier son énergie interne et pour effectuer des travaux sur des corps externes par le système.
Avec un changement infinitésimal de l'état du système, l'équation (26.3) prend la forme
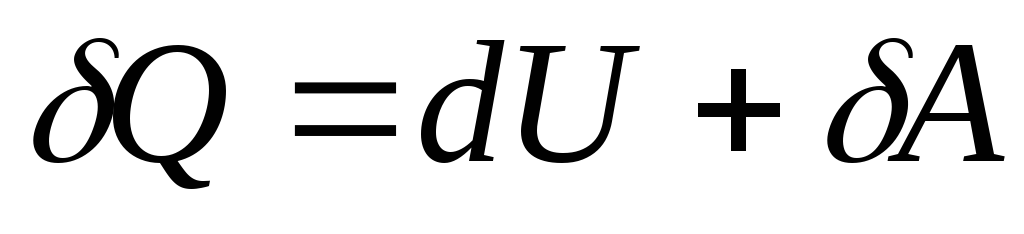 , (26.4)
, (26.4)
où 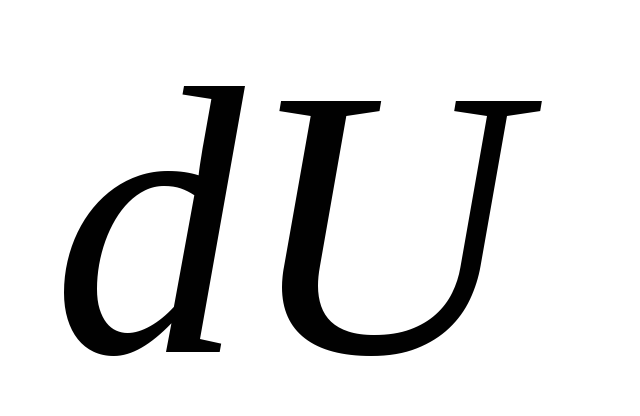 - une variation infinitésimale de l'énergie interne du système lorsqu'une quantité élémentaire de chaleur lui est communiquée
Q et effectuer un travail élémentaire par le système
MAIS sur les corps extérieurs.
- une variation infinitésimale de l'énergie interne du système lorsqu'une quantité élémentaire de chaleur lui est communiquée
Q et effectuer un travail élémentaire par le système
MAIS sur les corps extérieurs.
