Théorie moléculaire-cinétique des gaz parfaits
Le saviez-vous,
qu'est-ce qu'une expérience de pensée, une expérience de gedanken ?
C'est une pratique inexistante, une expérience d'un autre monde, l'imagination de ce qui n'est pas vraiment là. Les expériences de pensée sont comme des rêveries. Ils donnent naissance à des monstres. Contrairement à une expérience physique, qui est un test expérimental d'hypothèses, une "expérience de pensée" remplace comme par magie un test expérimental par les conclusions souhaitées et non testées, manipulant des constructions logiques qui violent en fait la logique elle-même en utilisant des prémisses non prouvées comme des prémisses prouvées, c'est-à-dire en substitution. Ainsi, la tâche principale des candidats aux "expériences de pensée" est de tromper l'auditeur ou le lecteur en remplaçant une expérience physique réelle par sa "poupée" - raisonnement fictif sur parole sans vérification physique elle-même.
Remplir la physique d'"expériences de pensée" imaginaires a conduit à une image absurde, surréaliste et déroutante du monde. Un vrai chercheur doit distinguer ces "emballages" des vraies valeurs.
Les relativistes et les positivistes soutiennent que «l'expérience de pensée» est un outil très utile pour tester la cohérence des théories (qui surgissent également dans nos esprits). En cela, ils trompent les gens, car toute vérification ne peut être effectuée que par une source indépendante de l'objet de la vérification. Le demandeur de l'hypothèse lui-même ne peut pas être un test de sa propre déclaration, puisque la raison de cette déclaration elle-même est l'absence de contradictions visibles pour le demandeur dans la déclaration.
Nous le voyons dans l'exemple de SRT et GTR, qui se sont transformés en une sorte de religion qui régit la science et opinion publique. Aucune somme de faits qui les contredisent ne peut venir à bout de la formule d'Einstein : « Si le fait ne correspond pas à la théorie, changeons le fait » (Dans une autre version, « Le fait ne correspond-il pas à la théorie ? - Tant pis pour le fait ").
Le maximum qu'une "expérience de pensée" peut revendiquer n'est que la cohérence interne de l'hypothèse dans le cadre de la propre logique, souvent nullement vraie, du demandeur. Le respect de la pratique ne vérifie pas cela. Un véritable test ne peut avoir lieu que dans une véritable expérience physique.
Une expérience est une expérience, car ce n'est pas un raffinement de pensée, mais un test de pensée. La pensée qui est cohérente en elle-même ne peut pas se tester. Cela a été prouvé par Kurt Gödel.
Dans un gaz raréfié, la distance entre les molécules est plusieurs fois supérieure à leur taille. Dans ce cas, l'interaction entre molécules est négligeable et l'énergie cinétique des molécules est bien supérieure à l'énergie potentielle de leur interaction.
Pour expliquer les propriétés d'une substance à l'état gazeux, au lieu d'un gaz réel, son modèle physique est utilisé - un gaz idéal. Le modèle suppose :
la distance entre les molécules est légèrement supérieure à leur diamètre ;
les molécules sont des boules élastiques ;
il n'y a pas de forces attractives entre les molécules ;
lorsque les molécules entrent en collision les unes avec les autres et avec les parois du vaisseau, des forces répulsives agissent ;
Le mouvement moléculaire obéit aux lois de la mécanique.
L'équation de base pour un gaz parfait mkt :
L'équation de base du MKT permet de calculer la pression d'un gaz si la masse de la molécule, la valeur moyenne du carré de la vitesse, et la concentration des molécules sont connues.
Pression de gaz idéale réside dans le fait que les molécules en collision avec les parois du vaisseau interagissent avec elles selon les lois de la mécanique comme des corps élastiques. Lorsqu'une molécule heurte la paroi du vaisseau, la projection de la vitesse vx du vecteur vitesse sur l'axe OX, perpendiculaire à la paroi, change de signe dans le sens contraire, mais reste constante en valeur absolue. Ainsi, suite aux collisions d'une molécule avec une paroi, la projection de son impulsion sur l'axe OX passe de mv 1x = -mv x à mv 2x =mv x . Une modification de la quantité de mouvement d'une molécule lors d'une collision avec une paroi provoque une force F 1 agissant sur elle depuis le côté de la paroi. La variation de quantité de mouvement d'une molécule est égale à la quantité de mouvement de cette force :
Lors de la collision, selon la troisième loi de Newton, la molécule agit sur la paroi avec une force F 2 égale en valeur absolue à la force F 1 et de sens opposé.
Il existe de nombreuses molécules, et chacune donne le même élan au mur lors de la collision. En une seconde ils transmettent une impulsion 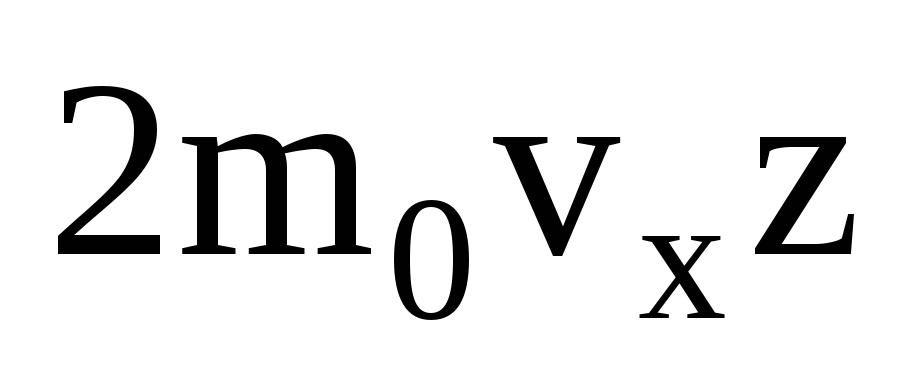 , où z est le nombre de collisions de toutes les molécules avec la paroi, qui est proportionnel à la concentration de molécules dans le gaz, à la vitesse des molécules et à la surface de la paroi :
, où z est le nombre de collisions de toutes les molécules avec la paroi, qui est proportionnel à la concentration de molécules dans le gaz, à la vitesse des molécules et à la surface de la paroi : 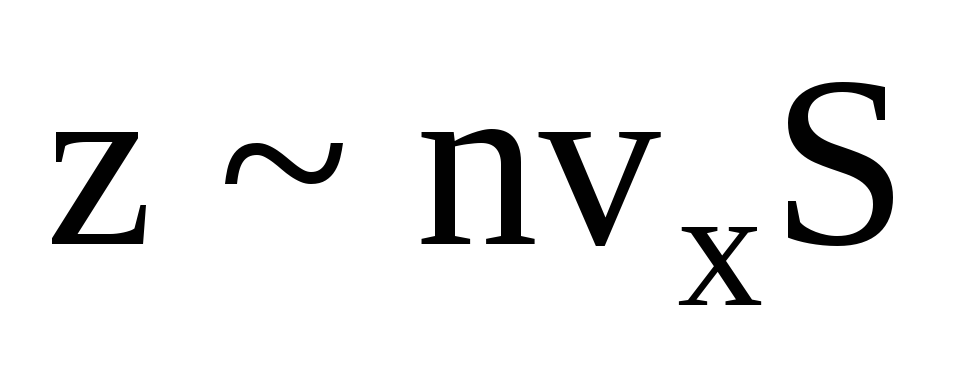 . Seule la moitié des molécules se déplacent vers la paroi, les autres se déplacent dans la direction opposée :
. Seule la moitié des molécules se déplacent vers la paroi, les autres se déplacent dans la direction opposée : 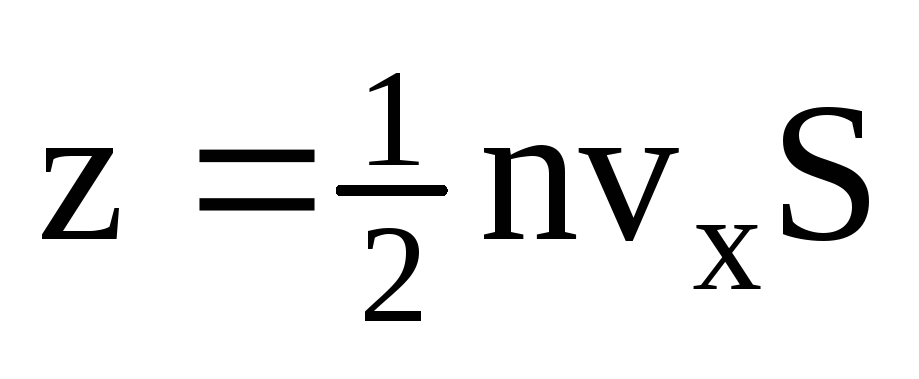 . Ensuite, la quantité de mouvement totale transférée au mur en 1 seconde :
. Ensuite, la quantité de mouvement totale transférée au mur en 1 seconde : 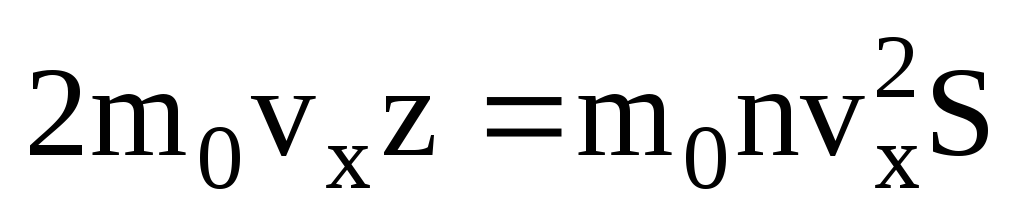 . Selon la deuxième loi de Newton, la variation de quantité de mouvement d'un corps par unité de temps est égale à la force agissant sur lui :
. Selon la deuxième loi de Newton, la variation de quantité de mouvement d'un corps par unité de temps est égale à la force agissant sur lui :
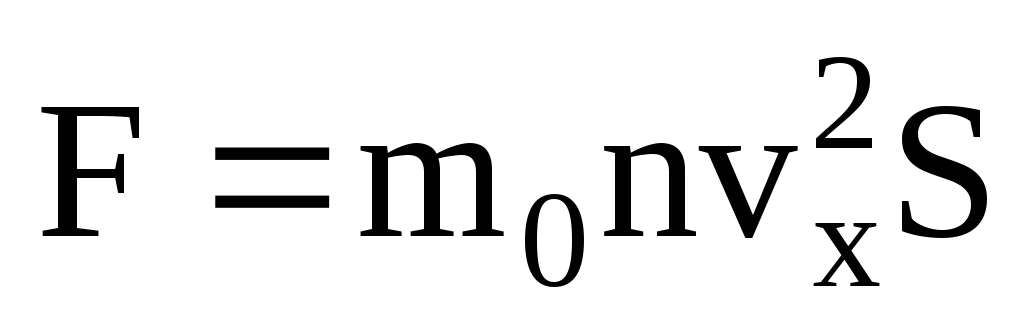
Étant donné que toutes les molécules n'ont pas la même vitesse, la force agissant sur la paroi sera proportionnelle au carré moyen de la vitesse. Puisque les molécules se déplacent dans toutes les directions, les valeurs moyennes des carrés des projections de vitesse sont égales. Par conséquent, le carré moyen de la projection de vitesse est : 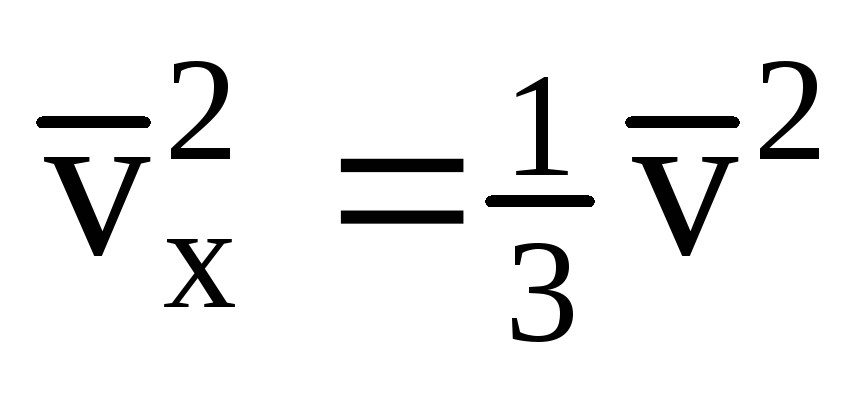 ;
;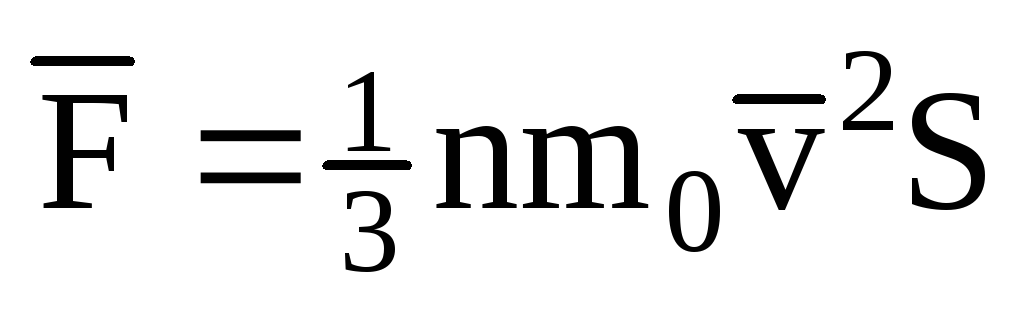 . Alors la pression du gaz sur la paroi de la cuve est :
. Alors la pression du gaz sur la paroi de la cuve est :
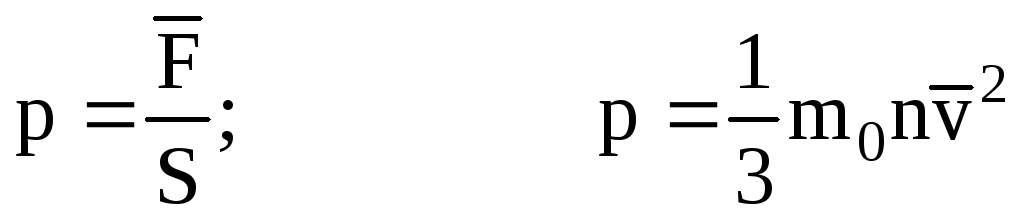 - l'équation de base du MKT.
- l'équation de base du MKT.
Désignant la valeur moyenne de l'énergie cinétique du mouvement de translation des molécules gaz parfait:
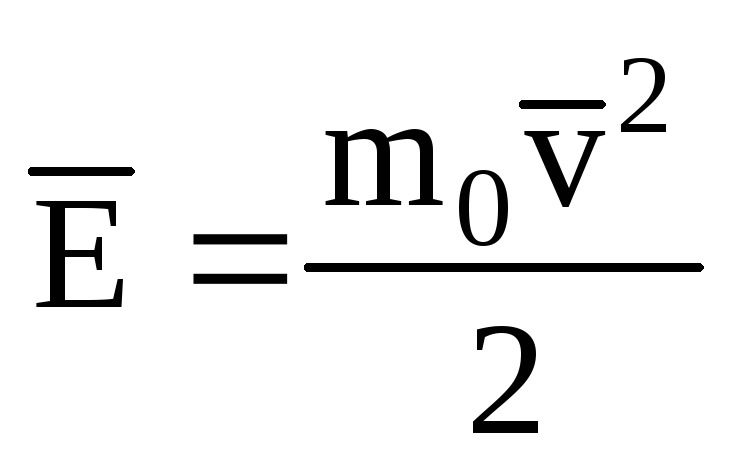 , on a
, on a
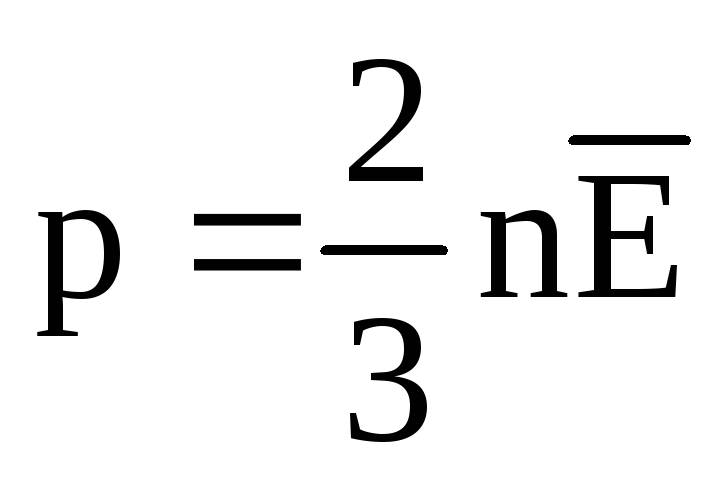
La température et sa mesure :
L'équation MKT de base pour un gaz parfait relie un paramètre macroscopique facilement mesurable - la pression - à des paramètres de gaz microscopiques tels que l'énergie cinétique moyenne et la concentration des molécules. Mais, n'ayant mesuré que la pression, nous ne pouvons connaître ni la valeur moyenne de l'énergie cinétique des molécules séparément, ni leur concentration. Par conséquent, pour trouver les paramètres microscopiques du gaz, des mesures d'une autre grandeur physique liée à l'énergie cinétique moyenne des molécules sont nécessaires. Cette valeur est Température.
Tout corps macroscopique ou groupe de corps macroscopiques, dans des conditions extérieures constantes, passe spontanément dans un état d'équilibre thermique. Équilibre thermique - c'est un état dans lequel tous les paramètres macroscopiques restent inchangés pendant une durée arbitrairement longue.
La température caractérise l'état d'équilibre thermique d'un système de corps : tous les corps du système qui sont en équilibre thermique entre eux ont la même température.
Pour mesurer la température, on peut utiliser la variation de n'importe quelle grandeur macroscopique en fonction de la température : volume, pression, résistance électrique, etc.
Le plus souvent en pratique, on utilise la dépendance du volume de liquide (mercure ou alcool) à la température. Lors de l'étalonnage d'un thermomètre, la température de la glace fondante est généralement prise comme point de référence (0); le deuxième point constant (100) est le point d'ébullition de l'eau à la pression atmosphérique normale (échelle Celsius). Étant donné que différents liquides se dilatent différemment lorsqu'ils sont chauffés, l'échelle ainsi établie dépendra dans une certaine mesure des propriétés du liquide donné. Bien sûr, 0 et 100°C correspondront pour tous les thermomètres, mais 50°C ne correspondra pas.
Contrairement aux liquides, tous les gaz raréfiés se dilatent de la même manière lorsqu'ils sont chauffés et changent de pression de la même manière avec un changement de température. Par conséquent, en physique, pour établir une échelle de température rationnelle, on utilise un changement de pression d'une certaine quantité de gaz raréfié à volume constant ou un changement de volume d'un gaz à pression constante. Cette échelle est parfois appelée échelle de température des gaz parfaits.
A l'équilibre thermique, l'énergie cinétique moyenne du mouvement de translation des molécules de tous les gaz est la même. La pression est directement proportionnelle à l'énergie cinétique moyenne du mouvement de translation des molécules : 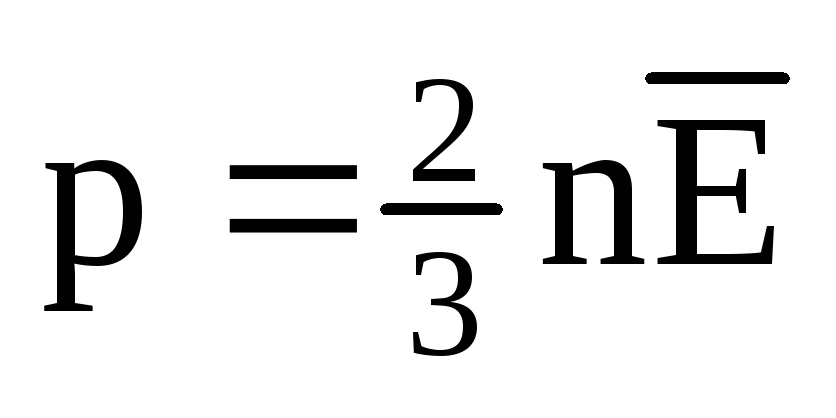 . A l'équilibre thermique, si la pression d'un gaz d'une masse donnée et son volume sont fixes, l'énergie cinétique moyenne des molécules de gaz doit avoir une valeur strictement définie, comme la température. Car
. A l'équilibre thermique, si la pression d'un gaz d'une masse donnée et son volume sont fixes, l'énergie cinétique moyenne des molécules de gaz doit avoir une valeur strictement définie, comme la température. Car  , alors
, alors 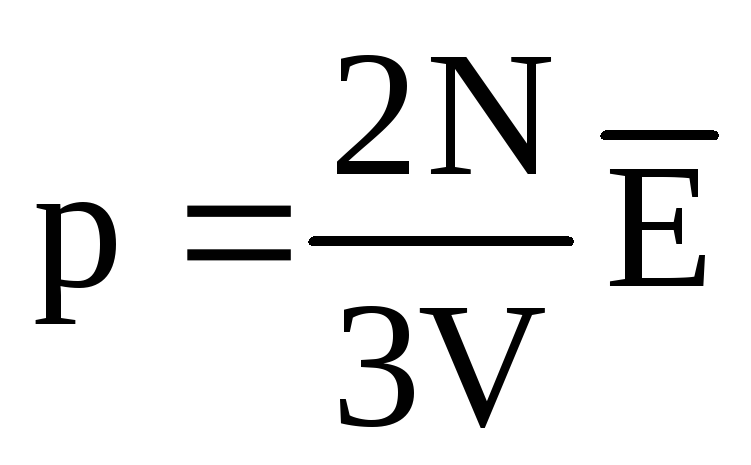 , ou
, ou 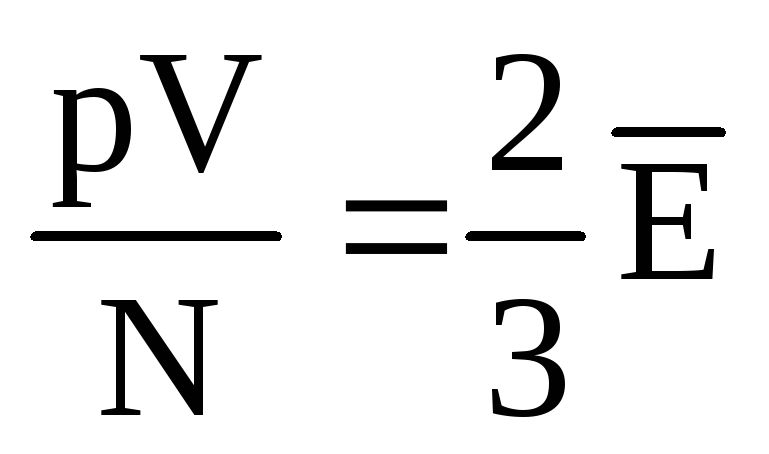 .
.
Dénoter 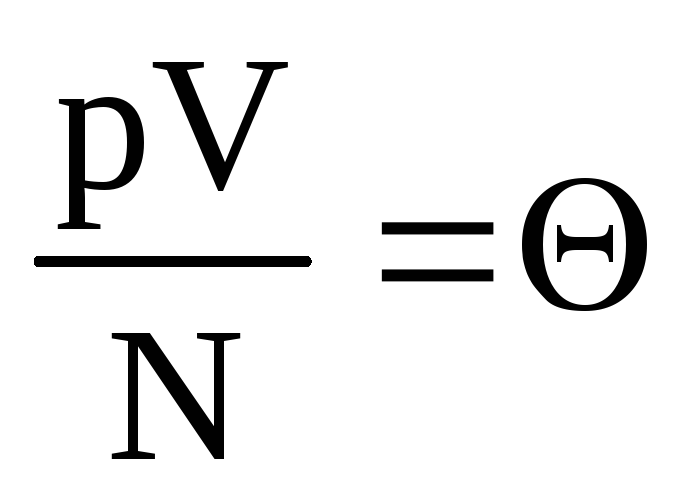 . Évaluer
. Évaluer  augmente avec la température et ne dépend de rien d'autre que de la température. Par conséquent, il peut être considéré comme une mesure naturelle de la température.
augmente avec la température et ne dépend de rien d'autre que de la température. Par conséquent, il peut être considéré comme une mesure naturelle de la température.
La théorie cinétique moléculaire décrit le comportement et les propriétés d'un objet idéal spécial appelé gaz parfait. Ce modèle physique est basé sur la structure moléculaire de la matière. La création de la théorie moléculaire est associée aux travaux de R. Clausius, J. Maxwell, D. Joule et L. Boltzmann.
Gaz parfait. Théorie moléculaire-cinétique des gaz parfaits est construit sur les hypothèses suivantes :
les atomes et les molécules peuvent être considérés comme points matériels, qui sont en mouvement continu ;
le volume intrinsèque de molécules de gaz est négligeable par rapport au volume de la cuve ;
tous les atomes et molécules sont distinguables, c'est-à-dire qu'il est en principe possible de suivre le mouvement de chaque particule ;
avant la collision des molécules de gaz entre elles, il n'y a pas de forces d'interaction, et les collisions des molécules entre elles et avec les parois de la cuve sont supposées absolument élastiques ;
le mouvement de chaque atome ou molécule d'un gaz est décrit par les lois de la mécanique classique.
Les lois obtenues pour un gaz parfait peuvent être utilisées dans l'étude des gaz réels. Pour cela, des modèles expérimentaux d'un gaz parfait sont créés, dans lesquels les propriétés d'un gaz réel sont proches de celles d'un gaz parfait (par exemple, à basse pression et à haute température).
Lois des gaz parfaits
Loi Boyle-Mariotte:
pour une masse de gaz donnée à température constante, le produit de la pression du gaz par son volume est une valeur constante : pV = const , (1.1)
à J = constante , m = const .
Courbe montrant la relation entre les quantités R et V, caractérise les propriétés d'une substance à température constante, et s'appelle isotherme il s'agit d'une hyperbole (Fig. 1.1.), et le processus se déroulant à température constante est dit isotherme.
Les lois de Gay-Lussac:
Le volume d'une masse donnée de gaz à pression constante varie linéairement avec la température
V = V 0 (1 + t ) à P = constante , m = const . (1.2)

p = p 0 (1 + t ) à V = constante , m = const . (1.3)
Dans les équations (1.2) et (1.3), la température est exprimée sur l'échelle Celsius, la pression et le volume - à
0 С, tandis que
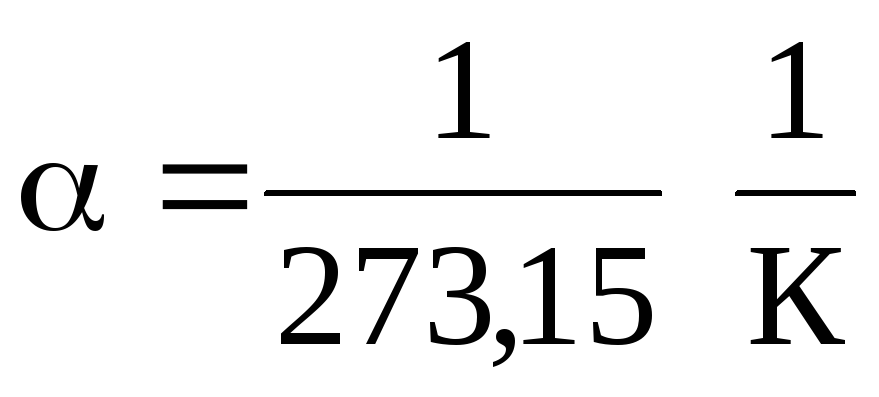 .
.
Un processus qui se déroule à pression constante est appelé isobare, elle peut être représentée comme une fonction linéaire (Fig. 1.2.).
Un processus qui se déroule à volume constant est appelé isochore(Fig. 1.3.).
Il découle des équations (1.2) et (1.3) que les isobares et les isochores coupent l'axe de la température au point t =1/ \u003d - 273,15 С . Si nous déplaçons l'origine jusqu'à ce point, nous passons à l'échelle Kelvin.
Introduire dans les formules (1.2) et (1.3) température thermodynamique, on peut donner aux lois de Gay-Lussac une forme plus commode :
V = V 0 (1+t) = = V 0 = =V 0 J;
p = p 0 (1+t) = p 0 = p 0 J;
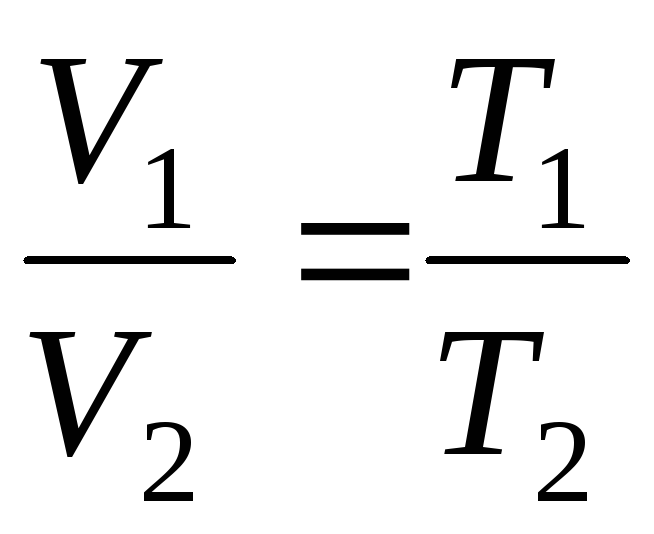 à
p=const, m=const
;
(1.4)
à
p=const, m=const
;
(1.4)
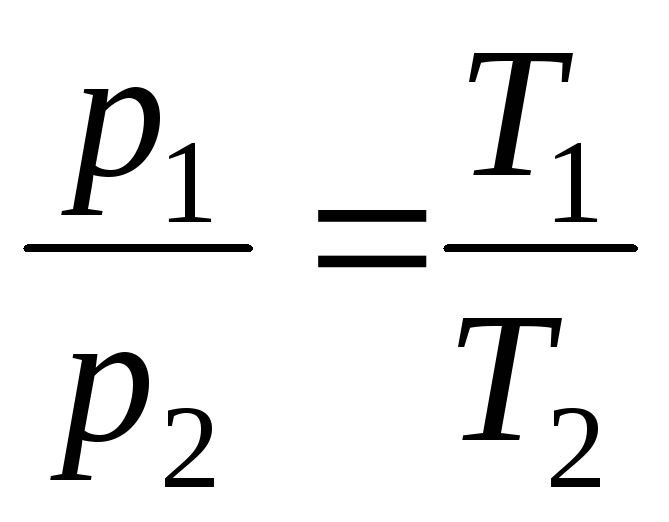 à V = const, m = const
,
(1.5)
à V = const, m = const
,
(1.5)
où les indices 1 et 2 font référence à des états arbitraires situés sur le même isobare ou isochore .
Loi d'Avogadro:
les moles de tous les gaz aux mêmes températures et pressions occupent les mêmes volumes.
Dans des conditions normales, ce volume est égal à V,0 \u003d 22,4110 -3 m 3 / mol . Par définition, dans une taupe diverses substances contient le même nombre de molécules, égal à Avogadro constant:N UN = 6,02210 23 mole -1 .
loi de Dalton:
pression de mélange gaz parfaitségale à la somme des pressions partielles R 1 , R 2 , R 3 … R n, gaz inclus:
p = p 1 +p 2 + R 3 + …+p n .
Pression partielle – c'est la pression que le gaz dans la composition produirait mélange de gaz s'il occupait seul un volume égal au volume du mélange à la même température.
Équation d'état des gaz parfaits
(équation de Clapeyron-Mendeleïev)
Il existe une relation bien définie entre la température, le volume et la pression. Cette relation peut être représentée par une dépendance fonctionnelle :
f(p, V, T)= 0.
À son tour, chacune des variables ( p, v, t) est une fonction de deux autres variables. Le type de dépendance fonctionnelle pour chaque état de phase d'une substance (solide, liquide, gazeux) est trouvé expérimentalement. C'est un processus très laborieux et l'équation d'état n'a été établie que pour les gaz qui sont à l'état raréfié, et sous une forme approchée pour certains gaz comprimés. Pour les substances qui ne sont pas à l'état gazeux, ce problème n'est pas encore résolu.
Le physicien français B. Clapeyron a apporté équation d'état des gaz parfaits, en combinant les lois de Boyle-Mariotte, Gay-Lussac, Charles :
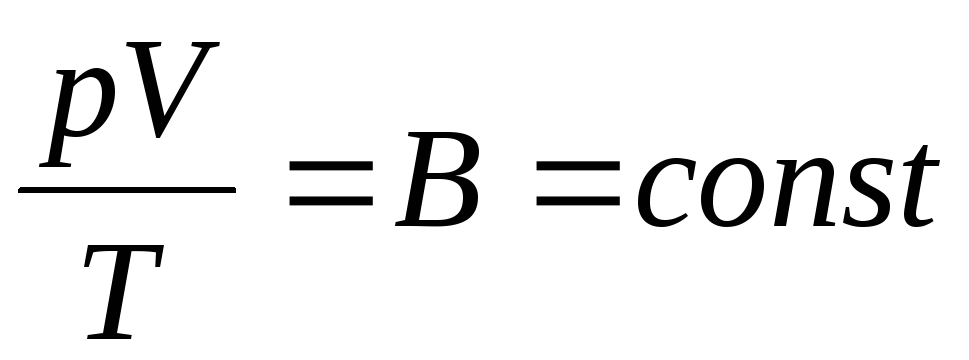 . (1.6)
. (1.6)
L'expression (1.6) est l'équation de Clapeyron, où À est la constante des gaz. C'est différent pour différents gaz.
DI. Mendeleev a combiné l'équation de Clapeyron avec la loi d'Avogadro, en référant l'équation (1.6) à une mole et en utilisant le volume molaire V . Selon la loi d'Avogadro, pour le même R et J les moles de tous les gaz occupent le même volume molaire V .
.
Par conséquent, la constante À sera le même pour tous les gaz parfaits. Cette constante est généralement notée R et égal à R=
8,31
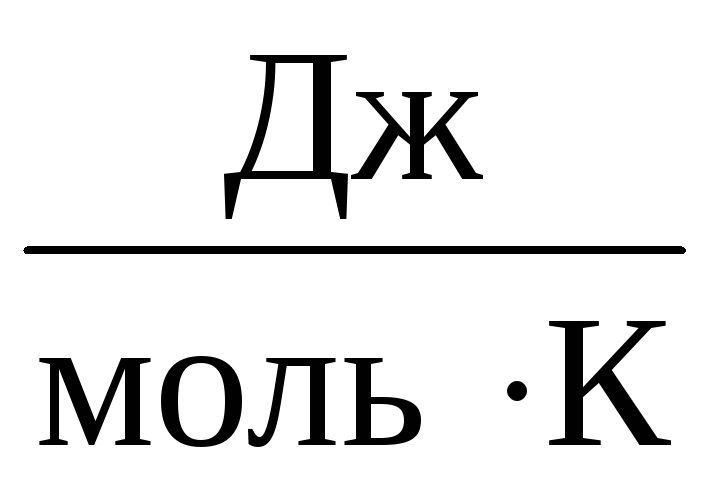 .
.
Équation de Clapeyron-Mendeleïev a la forme suivante :
p V . = RT.
À partir de l'équation (1.7) pour une mole de gaz, on peut passer à à l'équation de Clapeyron-Mendeleïev pour une masse arbitraire de gaz:
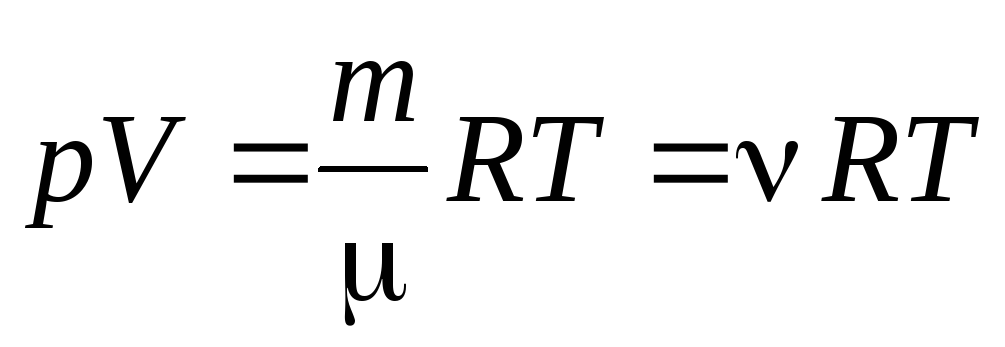 , (1.7)
, (1.7)
où
–
masse molaire
(masse d'une mole de substance, kg/mol); m
masse de gaz ;
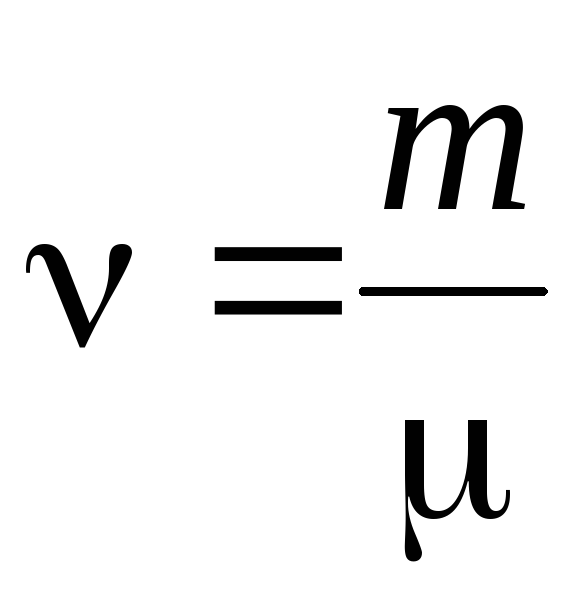 - quantité de matière .
- quantité de matière .
Plus souvent, une autre forme de l'équation d'état des gaz parfaits est utilisée, introduisant Constante de Boltzmann: 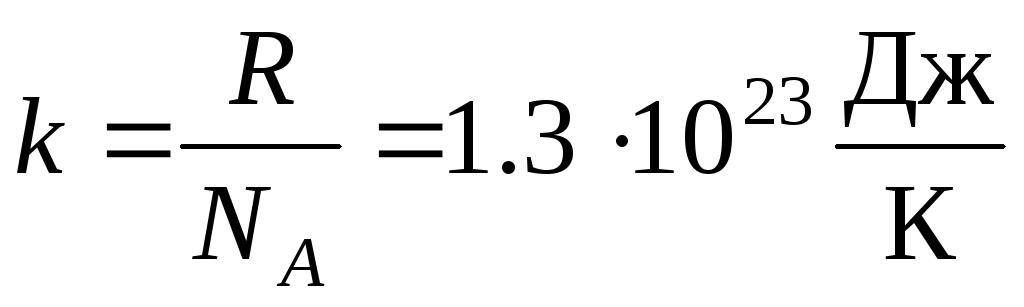 .
.
Alors l'équation (1.7) ressemble à ceci :
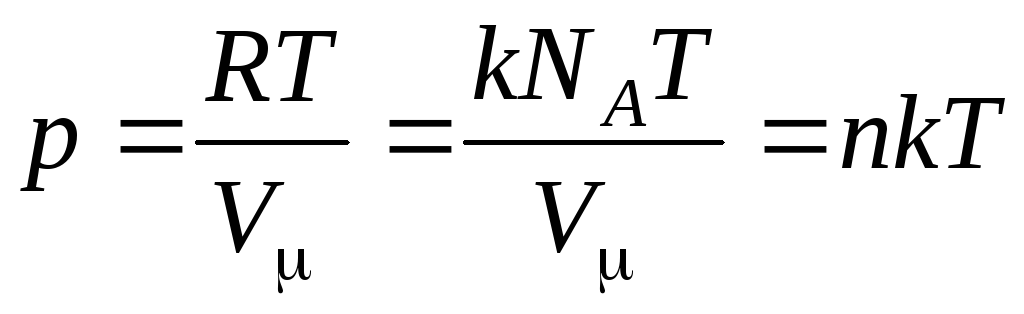 ,
(1.8)
,
(1.8)
où
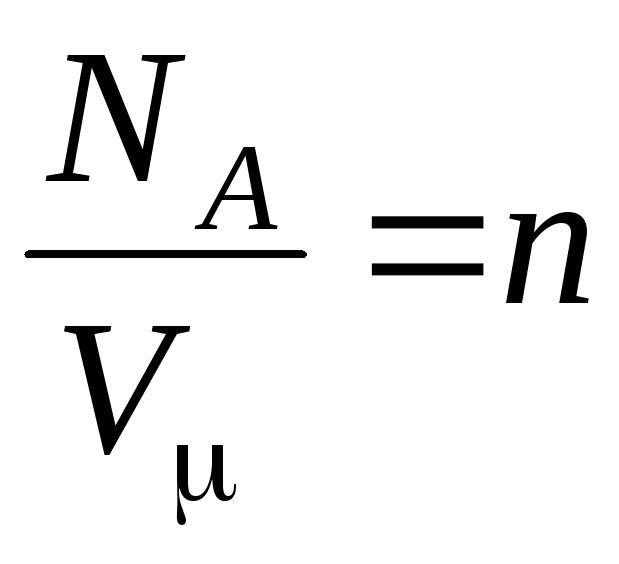 –
concentration de molécules (nombre de molécules par unité de volume). Il découle de cette expression que la pression d'un gaz parfait est directement proportionnelle à la concentration de ses molécules ou à la densité du gaz. Aux mêmes températures et pressions, tous les gaz contiennent le même nombre de molécules par unité de volume. Le nombre de molécules contenues dans 1 m 3 dans des conditions normales est appelé
Nombre de Loschmidt:
–
concentration de molécules (nombre de molécules par unité de volume). Il découle de cette expression que la pression d'un gaz parfait est directement proportionnelle à la concentration de ses molécules ou à la densité du gaz. Aux mêmes températures et pressions, tous les gaz contiennent le même nombre de molécules par unité de volume. Le nombre de molécules contenues dans 1 m 3 dans des conditions normales est appelé
Nombre de Loschmidt:
N L = 2.68 10 25 m -3.
Équation de base de la cinétique moléculaire
théorie des gaz parfaits
La tâche la plus importante La théorie cinétique des gaz est le calcul théorique de la pression d'un gaz parfait basé sur des concepts de cinétique moléculaire. L'équation de base de la théorie cinétique moléculaire des gaz parfaits est dérivée en utilisant Méthodes statistiques.
On suppose que les molécules de gaz se déplacent de manière aléatoire, le nombre de collisions mutuelles entre les molécules de gaz est négligeable devant le nombre d'impacts sur les parois de la cuve, et ces collisions sont absolument élastiques. Sur la paroi de la cuve, une zone élémentaire S et calculer la pression que les molécules de gaz exerceront sur cette zone.
Il faut tenir compte du fait qu'en réalité les molécules peuvent se déplacer vers le site sous différents angles et peuvent avoir différentes vitesses, qui, de plus, peut changer à chaque collision. Dans les calculs théoriques, les mouvements chaotiques des molécules sont idéalisés, ils sont remplacés par des mouvements selon trois directions mutuellement perpendiculaires.
Si l'on considère un récipient en forme de cube, dans lequel N molécules de gaz dans six directions, il est facile de voir qu'à tout moment, 1/3 du nombre de toutes les molécules se déplace le long de chacune d'elles, et la moitié d'entre elles (c'est-à-dire 1/6 du nombre de toutes les molécules) se déplace dans une direction, et la seconde moitié (également 1/6) - dans la direction opposée. À chaque collision, une molécule individuelle se déplaçant perpendiculairement au site, réfléchissant, lui transfère de l'élan, tandis que son élan (momentum) change de la quantité
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Le nombre d'impacts de molécules se déplaçant dans une direction donnée sur le site sera égal à : N = 1/6 n Svt. En entrant en collision avec la plate-forme, ces molécules lui transféreront de l'élan.
P= N P 1 =2 m 0 vnSvt=m 0 v 2 nSt,
où n est la concentration de molécules. Alors la pression que le gaz exerce sur la paroi de la cuve sera égale à :
p = 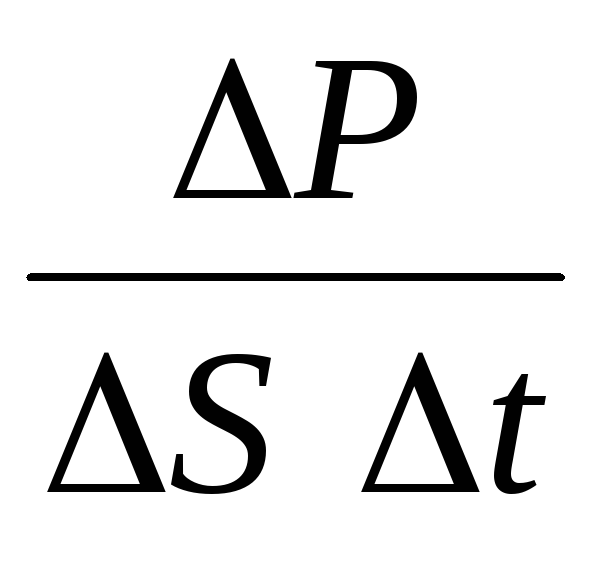 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
Cependant, les molécules de gaz se déplacent à des vitesses différentes : v 1 , v 2 , …,v n, donc les vitesses doivent être moyennées. La somme des carrés des vitesses des molécules de gaz, divisée par leur nombre, détermine la vitesse quadratique moyenne :
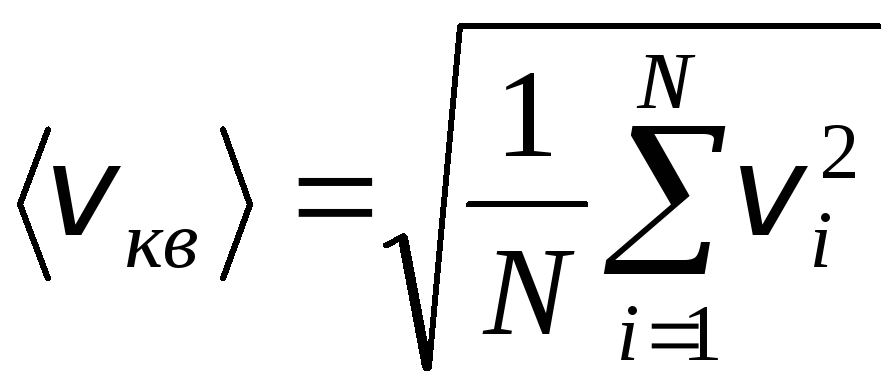 .
.
Équation (1.9) prendra la forme :
![]() (1.10)
(1.10)
l'expression (1.10) est appelée l'équation de base de la théorie de la cinétique moléculaire gaz parfaits.
Étant donné que 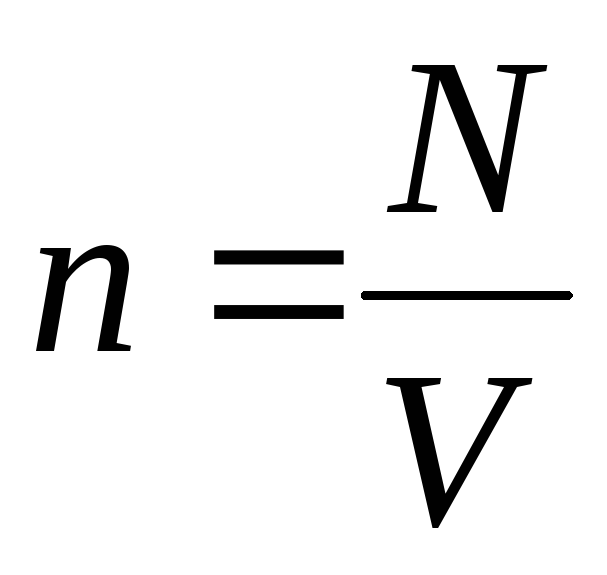 , on a:
, on a:
p V = N 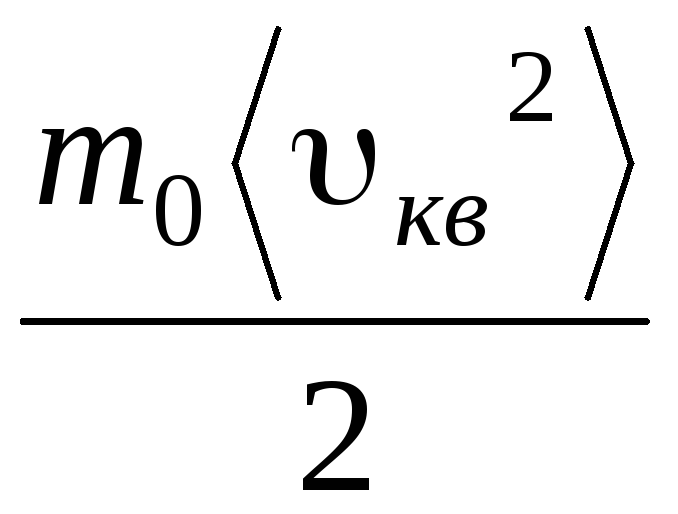 =E,
(1.11)
=E,
(1.11)
où E est l'énergie cinétique totale du mouvement de translation de toutes les molécules de gaz. Par conséquent, la pression du gaz est directement proportionnelle à l'énergie cinétique du mouvement de translation des molécules de gaz.
Pour une mole de gaz m =, et l'équation de Clapeyron-Mendeleïev a la forme suivante :
p V . = R T,
et comme il résulte de (1.11) que p V . = v m² 2 , on obtient :
R.T.= v m² 2 .
Par conséquent, la vitesse quadratique moyenne des molécules de gaz est égale à
v
m²
=
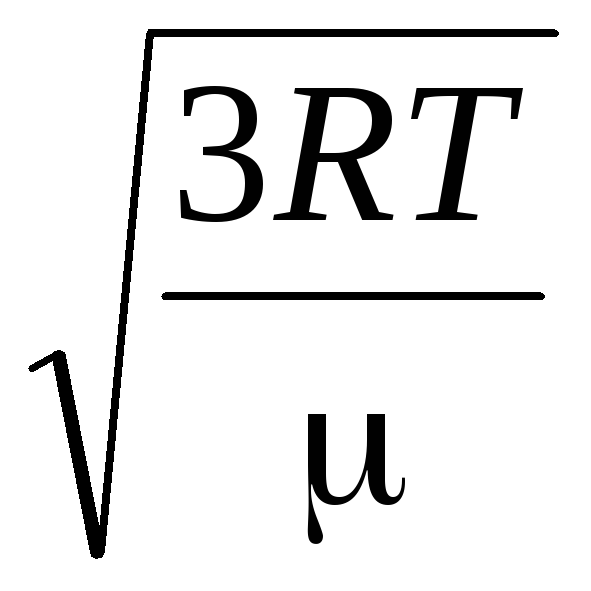 =
=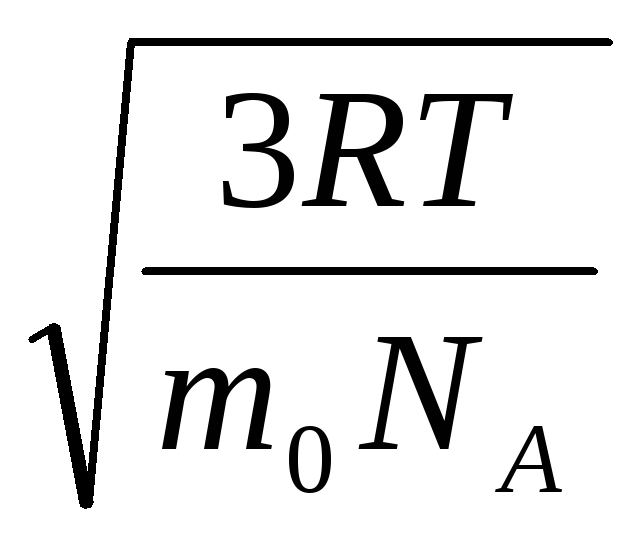 =
= ,
,
où k = R/N UN = 1,3810 -23 J/K – Constante de Boltzmann. De là, vous pouvez trouver la vitesse carrée moyenne des molécules d'oxygène à température ambiante - 480 m/s, hydrogène - 1900 m/s.
Signification moléculaire-cinétique de la température
La température est une mesure quantitative de la chaleur d'un corps. Clarifier la signification physique de la température thermodynamique absolue J Comparons l'équation de base de la théorie moléculaire-cinétique des gaz (1.14) avec l'équation de Clapeyron-Mendeleïev p V = R.T.
En égalant les parties droites de ces équations, nous trouvons la valeur moyenne de l'énergie cinétique 0 d'une molécule ( = N/N UN , k=R/N UN):
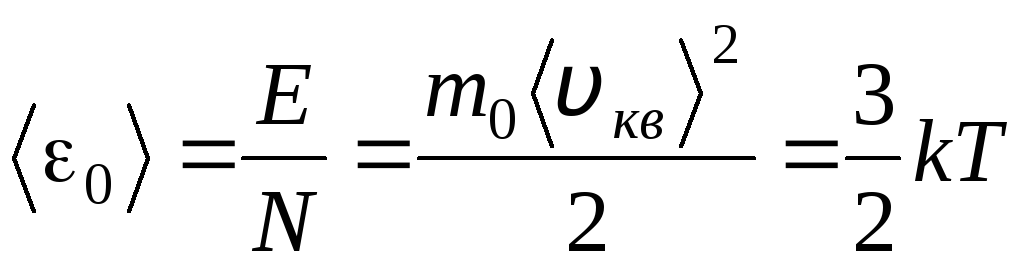 .
.
La conclusion la plus importante de la théorie de la cinétique moléculaire découle de cette équation : l'énergie cinétique moyenne du mouvement de translation d'une molécule d'un gaz parfait ne dépend que de la température, alors qu'elle est directement proportionnelle à la température thermodynamique. Ainsi, l'échelle de température thermodynamique acquiert une signification physique directe : à J= 0 l'énergie cinétique des molécules de gaz parfait est nulle. Par conséquent, sur la base de cette théorie, le mouvement de translation des molécules de gaz s'arrêtera et sa pression deviendra égale à zéro.
Théorie des propriétés d'équilibre d'un gaz parfait
Nombre de degrés de liberté des molécules. La théorie cinétique moléculaire des gaz parfaits conduit à une conséquence très importante : les molécules de gaz se déplacent de manière aléatoire et l'énergie cinétique moyenne du mouvement de translation de la molécule est déterminée uniquement par la température.
L'énergie cinétique du mouvement moléculaire n'est pas épuisée par la cinétique énergie de mouvement vers l'avant: il se compose également de cinétique énergies rotation et fluctuation molécules. Afin de calculer l'énergie entrant dans tous les types de mouvement moléculaire, il est nécessaire de définir nombre de degrés de liberté.
En dessous de nombre de degrés de liberté (je) du corps est sous-entendu le nombre de coordonnées indépendantes qui doivent être saisies pour déterminer la position du corps dans l'espace.
H  Par exemple, un point matériel possède trois degrés de liberté, puisque sa position dans l'espace est déterminée par trois coordonnées : x, y et z. Par conséquent, une molécule monoatomique a trois degrés de liberté de mouvement de translation.
Par exemple, un point matériel possède trois degrés de liberté, puisque sa position dans l'espace est déterminée par trois coordonnées : x, y et z. Par conséquent, une molécule monoatomique a trois degrés de liberté de mouvement de translation.
ré 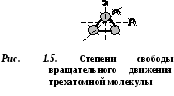 une molécule buchatomique a 5 degrés de liberté (Fig. 1.4) : 3 degrés de liberté de mouvement de translation et 2 degrés de liberté de mouvement de rotation.
une molécule buchatomique a 5 degrés de liberté (Fig. 1.4) : 3 degrés de liberté de mouvement de translation et 2 degrés de liberté de mouvement de rotation.
Les molécules de trois atomes ou plus ont 6 degrés de liberté : 3 degrés de liberté de mouvement de translation et 3 degrés de liberté de mouvement de rotation (Fig. 1.5).
Chaque molécule de gaz possède un certain nombre de degrés de liberté dont trois correspondent à son mouvement de translation.
Règlement sur la répartition équitable de l'énergie
par degrés de liberté
La prémisse de base de la théorie moléculaire-cinétique des gaz est l'hypothèse d'un caractère aléatoire complet dans le mouvement des molécules. Cela s'applique à la fois aux mouvements oscillatoires et rotatifs, et pas seulement à la translation. On suppose que toutes les directions de mouvement des molécules dans un gaz sont également probables. Par conséquent, nous pouvons supposer que pour chaque degré de liberté d'une molécule, il y a en moyenne la même quantité d'énergie - c'est la position sur l'équipartition de l'énergie sur les degrés de liberté. L'énergie par degré de liberté d'une molécule est :
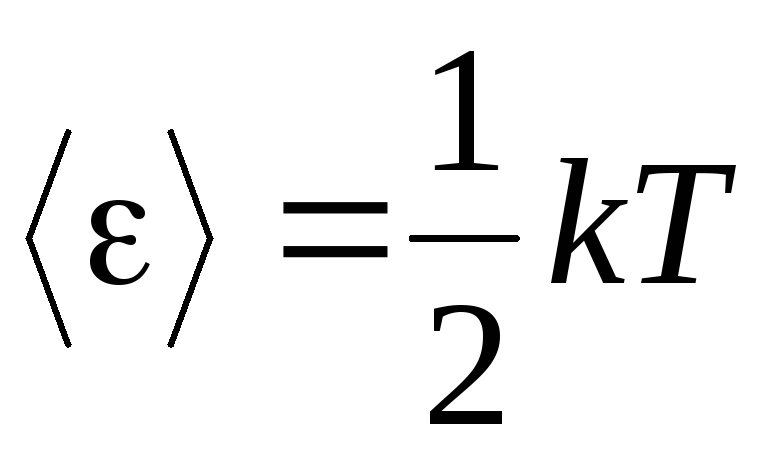 . (1.12)
. (1.12)
Si la molécule a je degrés de liberté, alors pour chaque degré de liberté il y a en moyenne :
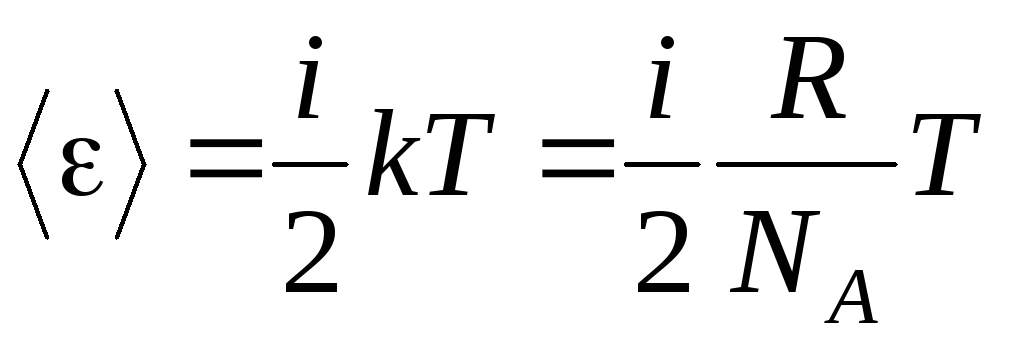 .
(1.13)
.
(1.13)
Energie interne d'un gaz parfait
Si nous attribuons l'apport total d'énergie interne du gaz à une mole, nous obtenons sa valeur en multipliant par le nombre d'Avogadro :
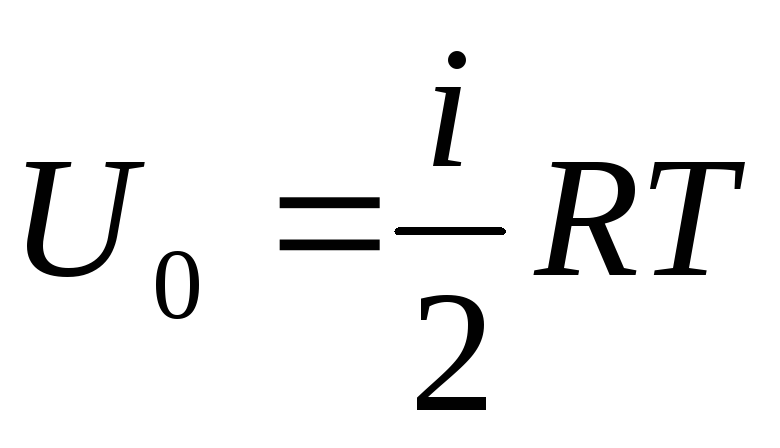 .
(1.14)
.
(1.14)
Il s'ensuit que l'énergie interne d'une mole d'un gaz parfait ne dépend que de la température et du nombre de degrés de liberté des molécules de gaz.
Distributions de Maxwell et de Boltzmann
Distribution des molécules d'un gaz parfait en termes de vitesses et d'énergies de mouvement thermique (distribution de Maxwell). A une température de gaz constante, toutes les directions du mouvement moléculaire sont supposées être également probables. Dans ce cas, la vitesse quadratique moyenne de chaque molécule reste constante et est égale à
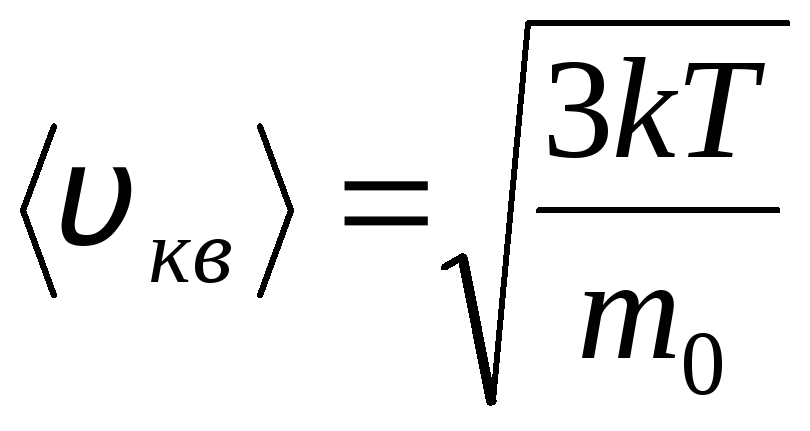 .
.
Cela s'explique par le fait que dans un gaz parfait, qui est dans un état d'équilibre, une certaine distribution de vitesse stationnaire des molécules qui ne change pas avec le temps est établie. cette distribution est soumise à une certaine loi statistique, qui a été théoriquement dérivée par J. Maxwell. La loi de Maxwell est décrite par la fonction
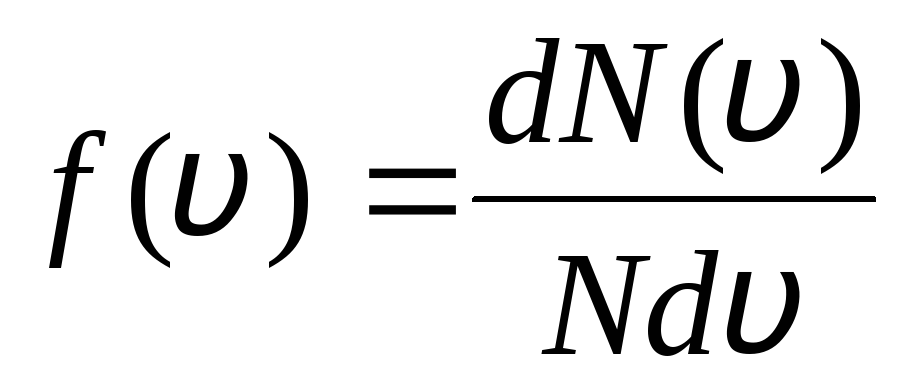 ,
,
c'est la fonction F(v) détermine le nombre relatif de molécules  , dont les vitesses se situent dans l'intervalle de v
avant de v+dv. En appliquant les méthodes de la théorie des probabilités, Maxwell a trouvé la loi de répartition des molécules d'un gaz parfait en termes de vitesses :
, dont les vitesses se situent dans l'intervalle de v
avant de v+dv. En appliquant les méthodes de la théorie des probabilités, Maxwell a trouvé la loi de répartition des molécules d'un gaz parfait en termes de vitesses :
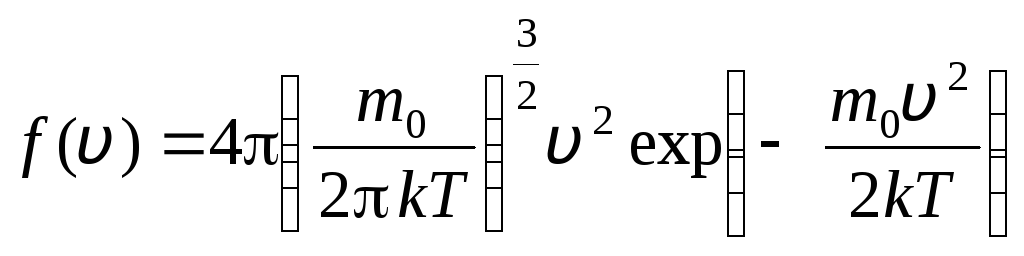 . (1.15)
. (1.15)
La fonction de distribution est représentée graphiquement sur la fig. 1.6. La zone délimitée par la courbe de distribution et l'axe des abscisses est égale à un. Cela signifie que la fonction F(v) satisfait la condition de normalisation :
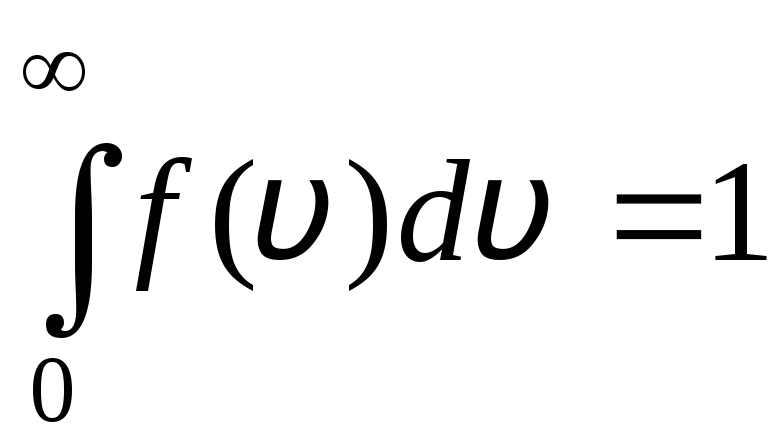 .
.
DE  vitesse à laquelle la fonction de distribution des molécules de gaz parfait en termes de vitesses F(v) est maximale, s'appelle probablement
la rapidité
v B .
vitesse à laquelle la fonction de distribution des molécules de gaz parfait en termes de vitesses F(v) est maximale, s'appelle probablement
la rapidité
v B .
Valeurs v = 0 et v = correspondent aux minima d'expression (1.15). La vitesse la plus probable peut être trouvée en différenciant l'expression (1.23) et en l'assimilant à zéro :
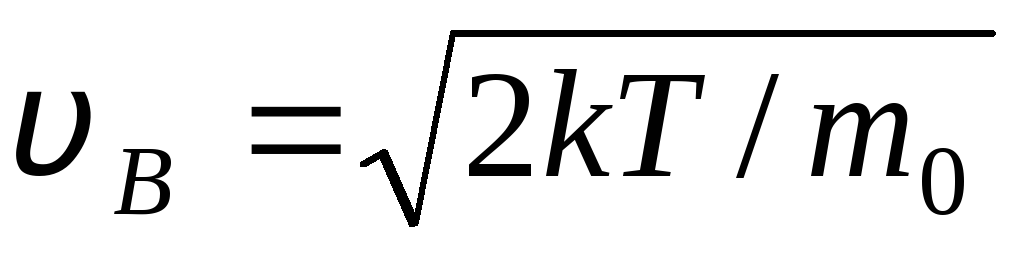 =
=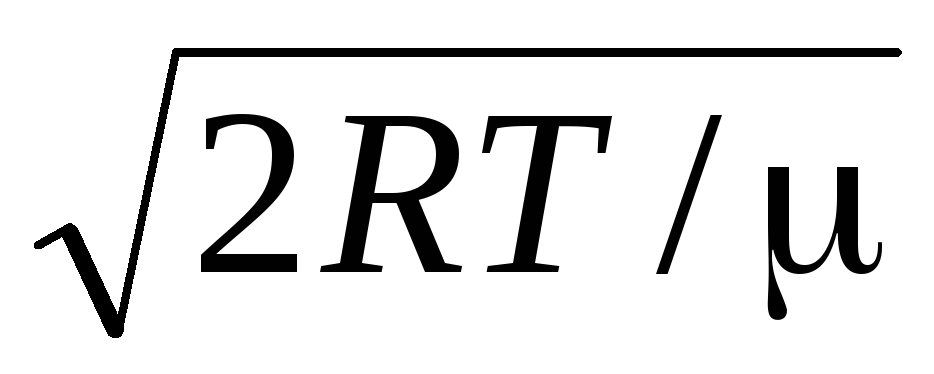 =
1,41
=
1,41
Avec une augmentation de la température, le maximum de la fonction se déplacera vers la droite (Fig. 1.6), c'est-à-dire qu'avec une augmentation de la température, la vitesse la plus probable augmente également, cependant, la zone délimitée par la courbe reste inchangée. Il convient de noter que dans les gaz et à basse température, il y a toujours un petit nombre de molécules qui se déplacent à grande vitesse. La présence de telles molécules "chaudes" a grande importance au cours de nombreux processus.
Vitesse moyenne arithmétique molécules est déterminé par la formule
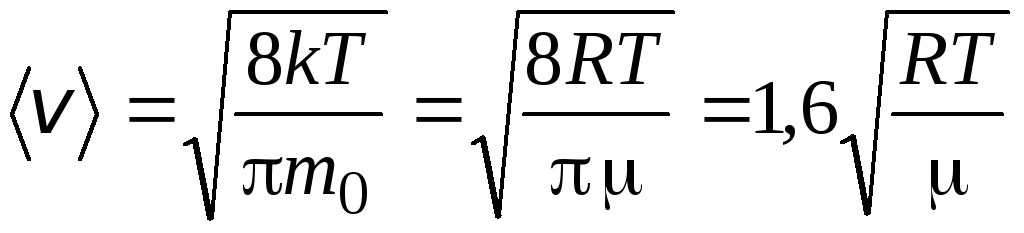 .
.
Vitesse quadratique moyenne
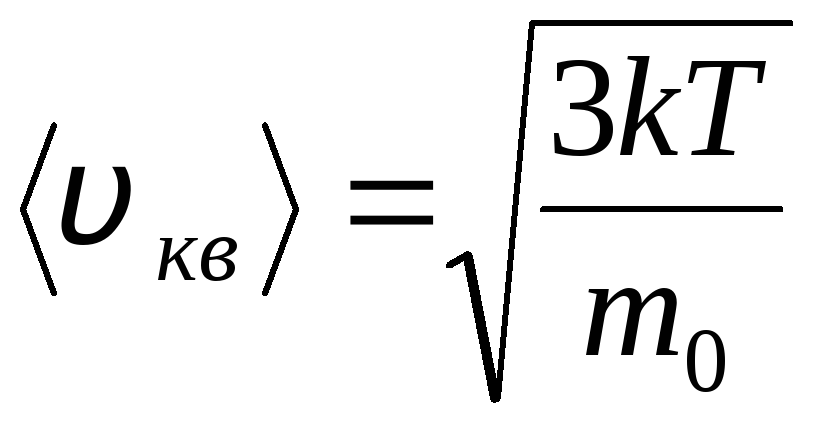 =
1,73
=
1,73 .
.
Le rapport de ces vitesses ne dépend pas de la température ni du type de gaz.
Fonction de distribution des molécules par les énergies de mouvement thermique. Cette fonction peut être obtenue en substituant la valeur de l'énergie cinétique au lieu de la vitesse dans l'équation de distribution des molécules (1.15) :
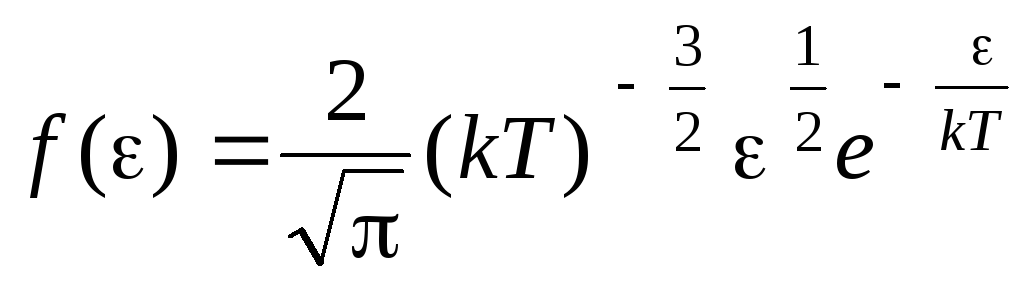 .
.
Après avoir intégré l'expression sur les valeurs énergétiques de  avant de
avant de 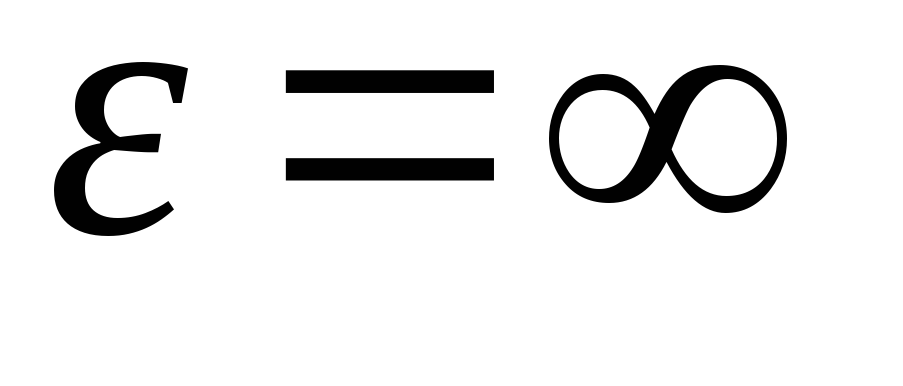
 , on a énergie cinétique moyenne molécules de gaz parfaits :
, on a énergie cinétique moyenne molécules de gaz parfaits :
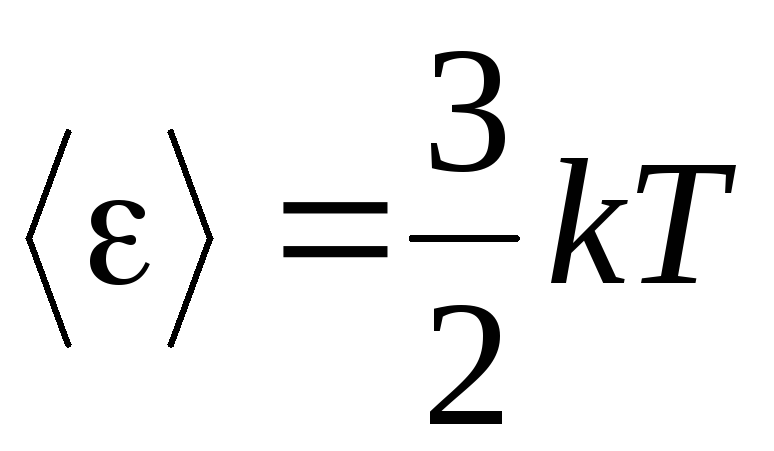 .
.
formule barométrique. Distribution de Boltzmann. Lors de la dérivation de l'équation de base de la théorie cinétique moléculaire des gaz et de la distribution de Maxwell des molécules par vitesses, on a supposé que les molécules d'un gaz parfait ne sont pas affectées par des forces externes, donc les molécules sont uniformément réparties dans tout le volume. Cependant, les molécules de tout gaz se trouvent dans le champ gravitationnel de la Terre. Lors de la dérivation de la loi de dépendance de la pression sur la hauteur, on suppose que le champ gravitationnel est uniforme, la température est constante et la masse de toutes les molécules est la même:
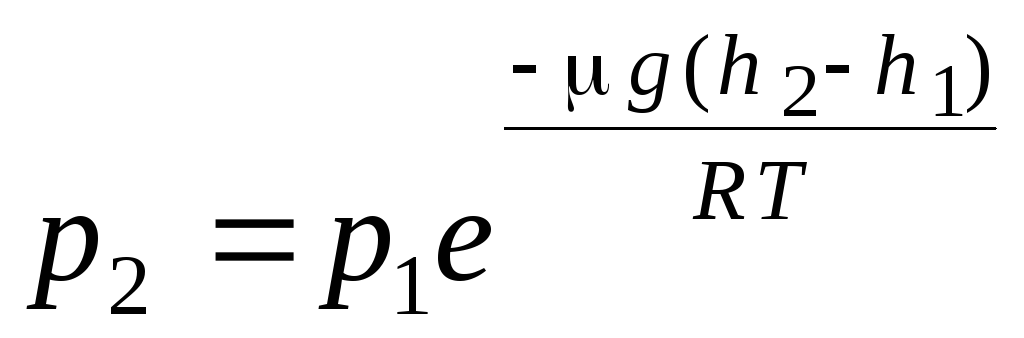 . (1.16)
. (1.16)
L'expression (1.16) est appelée formule barométrique. Il permet de trouver la pression atmosphérique en fonction de l'altitude, ou en mesurant la pression, on peut trouver l'altitude. Car h 1 est la hauteur au-dessus du niveau de la mer, où la pression est considérée comme normale, alors l'expression peut être modifiée :
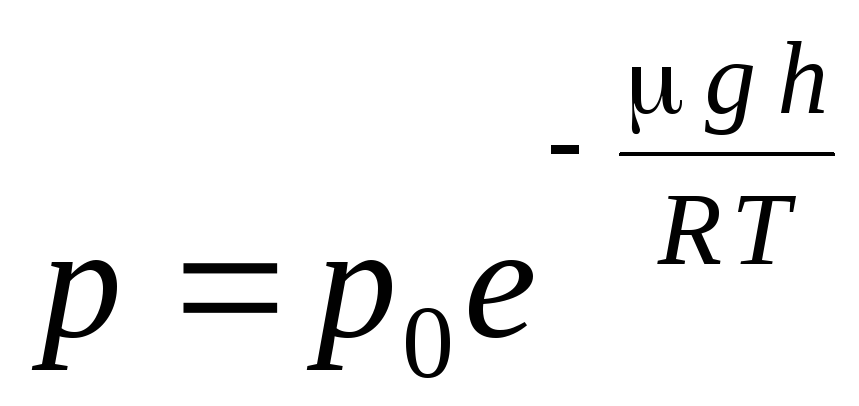 .
.
La formule barométrique peut être convertie à l'aide de l'expression p = nkT:
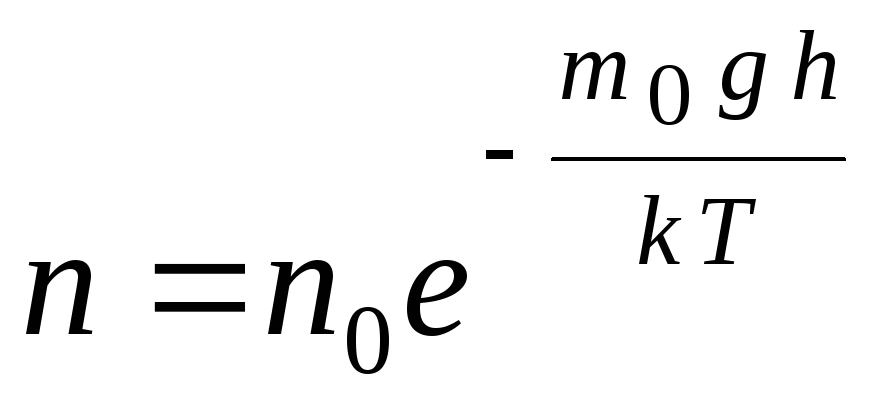 ,
,
g  de n
–
concentration de molécules en altitude h,
m 0
gh=P–
énergie potentielle d'une molécule dans un champ gravitationnel. A température constante, la densité du gaz est d'autant plus grande que l'énergie potentielle de la molécule est plus faible. Graphiquement, la loi de diminution du nombre de particules par unité de volume avec la hauteur ressemble à celle illustrée à la Fig. 1.7.
de n
–
concentration de molécules en altitude h,
m 0
gh=P–
énergie potentielle d'une molécule dans un champ gravitationnel. A température constante, la densité du gaz est d'autant plus grande que l'énergie potentielle de la molécule est plus faible. Graphiquement, la loi de diminution du nombre de particules par unité de volume avec la hauteur ressemble à celle illustrée à la Fig. 1.7.
Pour un champ de potentiel externe quelconque, on écrit l'expression générale suivante
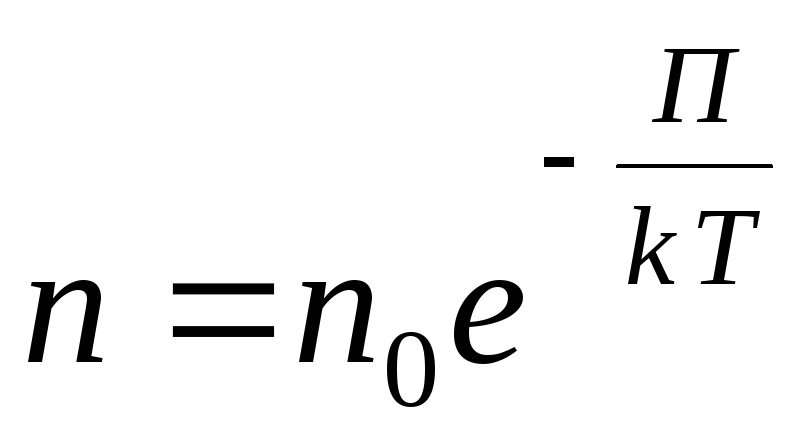 ,
,
