روشی برای تعیین ظرفیت گرمایی جسم جامد
HEAT CAPACITY چیست؟
هنگامی که گرما تامین می شود، دمای سیستم افزایش می یابد. در مورد تغییر بی نهایت کوچک در دما، تناسب معتبر است
dT=δQ یا dT=constδQ
نوشتن این رابطه به شکل: δQ=СdT یا راحت تر است
مقدار C را ظرفیت حرارتی واقعی سیستم می نامند.
ظرفیت حرارتی نسبت مقدار گرمای عرضه شده به سیستم به تغییر دمایی است که رخ می دهد.
علاوه بر واقعیت، ظرفیت گرمایی متوسط نیز وجود دارد:
ظرفیت گرمایی
اگر ظرفیت گرمایی به یک واحد جرم (مول) یک ماده نسبت داده شود، آنگاه از جرم کل سیستم مستقل می شود و خواص یک پارامتر فشرده را به دست می آورد. اگر ظرفیت گرمایی به واحد جرم یک ماده اشاره داشته باشد، آن را خاص و به 1 مول - ظرفیت گرمایی با ابعاد J / (mol * k) می گویند.
ما فقط ظرفیت گرمای مولی را در نظر خواهیم گرفت، زیرا برای آنها، همه نظم ها بسیار ساده تر از ظرفیت گرمایی خاص است.
ظرفیت گرمایی بستگی به شرایطی دارد که در آن انتقال گرما به سیستم انجام می شود. اگر سیستم در یک حجم ثابت محصور باشد، آنگاه افزایش دما به میزان dT تحت تأثیر حرارت برابر با CvdT اتفاق میافتد، جایی که Cv ظرفیت گرمایی در حجم ثابت است. در موارد فشار ثابت در حین انبساط سیستم، برای افزایش دما به میزان dT، گرما CpdT مورد نیاز خواهد بود که Cp ظرفیت گرمایی در فشار ثابت است.
با توجه به شرایط انتقال گرما، زمانی که یک یا چند متغیر ثابت نگه داشته می شوند، در حالی که بقیه تغییر می کنند، ظرفیت گرمایی را می توان با استفاده از مشتقات جزئی بیان کرد: ![]() . از آنجایی که δQ v = dU،
. از آنجایی که δQ v = dU،
δQ p =dH، می توانیم بنویسیم:
![]() (1)
(1)
Cv ظرفیت گرمایی ایزوکریک گازها است، Cp ظرفیت گرمایی ایزوباریک گازها است.
تفاوت بین ظرفیت حرارتی ایزوکوریک و ایزوباریک به دلیل تفاوت در انرژی داخلی و آنتالپی است. تغییرات در آنتالپی و انرژی داخلی بر اساس میزان کار انجام شده توسط سیستم متفاوت است.
δW=∆nRT، ∆H-∆U=∆nRT
بنابراین، ظرفیت گرمایی در حجم ثابت Cv و فشار ثابت Cp نیز بر اساس مقدار کار متفاوت است: Cp - Cv = δW
بر اساس عبارت (1) می توانیم بنویسیم:
جایگزینی این برابری ها در معادله ∆H- ∆U=∆nRT
و با توجه به اینکه ∆n= 1، رابطه بین ظرفیت حرارتی مولی گازها را خواهیم یافت:
Cp– Cv= R یا Cp= Cv+ R
همانطور که مشاهده می شود، آنها با مقدار ثابت گاز متفاوت هستند.
از شرط Cp= Cv+ R چنین برمیآید که Cp˃Cv، یعنی در یک فرآیند همبار، وقتی P=const، برای افزایش دمای سیستم لازم است. مقدار زیادگرما نسبت به فرآیند ایزوکوریک.
ظرفیت گرمایی مولی گازها دارای مقادیری در حد R است، بنابراین تفاوت بین Cp و Cv بسیار قابل توجه است. بنابراین، برای دی اکسید کربن CO 2 در 25 0 C Cp = 37، 14؛ و Cv = 28.83 J / (mol * K)
تفاوت Cp - Cv کار انبساط ایزوباریک یک مول است گاز ایده آلزمانی که دما یک درجه افزایش می یابد. مایعات و جامدات بدن هنگام گرم شدن با افزایش جزئی در حجم مشخص می شوند. بنابراین، برای اجسام متراکم، می توانیم فرض کنیم که Ср ≈ Сv.
معادله کیرشهوف. وابستگی اثرات حرارتی به دما.
محاسبات قبلاً در نظر گرفته شده اثرات حرارتی بر اساس قانون هس برای گرمای تشکیل و احتراق توسط شرایط استاندارد محدود شده است. برای اهداف عملی، محاسبه اثرات حرارتی برای شرایط خاص غیر از شرایط استاندارد ضروری است.
از اثرات حرارتی شناخته شده تحت شرایط استاندارد، یعنی. در دمای 25 0 C (298.15 K) و فشار 1 atm. (1.013 * 10 5 Pa)، محاسبه اثرات حرارتی در هر دمای مورد علاقه ما با استفاده از امکان پذیر است. قانون کیرشهوف. فرآیندها در شرایط صنعتی با تغییرات دما قابل توجهی مشخص می شوند که دامنه آن نه تنها با شرایط تکنولوژی، بلکه بر اساس فصل نیز تعیین می شود. این محدوده می تواند به صدها درجه برسد - طبیعی است که اثرات حرارتی خواهد بود. به طور قابل توجهی متفاوت است و به دما بستگی دارد.
قانون کیرشهوف را به شکل دیفرانسیل در نظر بگیرید. برای انجام این کار، تغییرات آنتالپی در ایزوباریک و انرژی داخلی در فرآیندهای ایزوکوریک را یادداشت می کنیم.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
این معادلات را از نظر دما متمایز کرده و بدست آورید:
معادلات کیرشهوف:

و - ضرایب دمایی اثر حرارتی فرآیندهای ایزوباریک و ایزوکوریک به ترتیب. و - تغییر ظرفیت حرارتی سیستم به ترتیب در نتیجه فرآیندهای ایزوباریک و ایزوکوریک.
بر اساس معادله Kirchhoff، قانون Kirchhoff به شکل دیفرانسیل فرموله می شود: ضریب دمایی اثر حرارتی فرآیند برابر با تغییر ظرفیت گرمایی سیستم است که در نتیجه این فرآیند رخ می دهد.
بنابراین، قانون کیرشهوف به شکل دیفرانسیل، تعیین تنها تغییر در اثر حرارتی با دما، و نه میزان خود اثر حرارتی را ممکن میسازد.
اجازه دهید معادله Kirchhoff را تجزیه و تحلیل کنیم
برای واکنش: aA + bB = dD + rR در یک فرآیند ایزوباریک (р=const)، طبق قانون کیرشهوف، تغییر ظرفیت گرمایی در سیستم به شکل زیر خواهد بود:
یک عبارت مشابه را می توان برای یک فرآیند ایزوکوریک به دست آورد:
از آنجایی که قانون Kirchhoff به شما امکان می دهد تغییرات در اثر حرارتی فرآیند را با تغییر دما تعیین کنید، یک نمودار می سازیم:
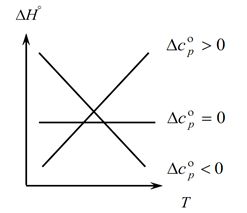
1. مورد اول را در نظر بگیرید، زمانی که ∆Ср(∆Сv)˃0، زیرا ∆Ср=∑С con. -∑С اولیه، از این رو نتیجه می شود که مجموع ظرفیت های گرمایی محصولات واکنش بیشتر از مجموع ظرفیت های گرمایی مواد اولیه است: ∑С con. ˃∑از ابتدا در این حالت، منحنی 1 را در نمودار بدست می آوریم، به این معنی که با افزایش دما، تغییر در اثر حرارتی فرآیند نیز افزایش می یابد (T و ∆H).
2. حالت دوم وقتی ∆Ср(∆Сv)˂0. مشابه قانون اول، ∑С con را داریم. ˂∑از اوایل (مجموع ظرفیت های حرارتی محصولات نهایی کمتر از مجموع ظرفیت های حرارتی مواد اولیه است). سپس یک منحنی بر روی نمودار می گیریم، به این معنی که با افزایش دما، تغییر در اثر حرارتی فرآیند کاهش می یابد (Т→∆H↓)
3. و حالت سوم زمانی که تغییر ظرفیت های حرارتی سیستم برابر با صفر ∆Ср(∆Сv)=0 باشد. سپس مجموع ظرفیت های حرارتی محصولات نهایی واکنش ها برابر است با مجموع ظرفیت های حرارتی مواد اولیه ∑С con. \u003d ∑ از ابتدا. در این حالت اثر حرارتی واکنش تابعی از دما نیست (∆H ≠ f(T)) و یک خط مستقیم روی نمودار می گیریم.
محاسبه اثرات حرارتی برای یک داده
درجه حرارت. ادغام معادله کیرشهوف
برای یافتن مقدار اثر حرارتی به عنوان تابعی از دما، لازم است معادلات را یکپارچه کنیم

از T تا T 0 (که T دمای مورد نیاز است، T 0 دمای استاندارد است)، از ∆H تا ∆H 0 یا از ∆U تا ∆U 0 (که ∆H و ∆U آنتالپی و انرژی داخلی تحت شرایطی که با استاندارد متفاوت است). ادغام برای دو مورد انجام می شود:
برای نه مواد آلی: برای مواد آلی:
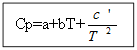
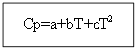
به عنوان مثال: برای H 2 (g) - ماده معدنی
| Ср=f(T) | تی | |||
| آ | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27.28 + 3.26 * 10 -3 T +.
آ) ادغام تقریبی:
برای فرآیند ایزوباریک
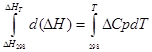
∆H T - ∆H 298 =∆Cp*(T-298)
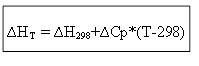
برای فرآیند ایزوکوریک:
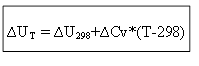
بنابراین، برای تعیین اثر حرارتی ∆H یا انرژی داخلی ∆U در هر دمای T، لازم است که گرمای فرآیند در شرایط استاندارد ∆H 0 (∆U 0) و تغییر ظرفیتهای حرارتی ∆Ср, ∆ دانست. رزومه.
مثال. اثر حرارتی ∆H فرآیند به دست آوردن بنزن از استیلن را محاسبه کنید:
3C 2 H 2 (g) → C 6 H 6 (g) در 75 0 C (348K).
1. از جداول میانگین ظرفیت گرمایی همبار مولی بنزن و استیلن را مییابیم:
Ср С6Н6 (g) \u003d 81.67 J / (mol * K)؛
Cp C2H2 (g) \u003d 43.93 J / (mol * K).
2. ما تغییر در ظرفیت گرمایی فرآیند را پیدا می کنیم:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) اولیه \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 K j/m.
3. با توجه به داده های جدولی، ما اثر حرارتی را در شرایط استاندارد پیدا می کنیم:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82.93 - 3 * 226.73 \u003d - 597.26 kJ / mol
4. اثر حرارتی را در دمای معین بیابید:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597.26 * 10 3 + (50.12-) * (348- 298) = -599766 J / mol
ب) ادغام دقیق:
اجازه دهید مورد دوم پیچیده تر را در نظر بگیریم، زمانی که تغییر ظرفیت گرمایی به دما بستگی دارد، یعنی. Ср=f(T)، Cv=f(T).
اجازه دهید به معادله واکنش به شکل کلی بپردازیم
dD + rR = qQ + pP
| آ | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| آر | + | + | + | - |
| س | + | + | + | - |
| پ | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
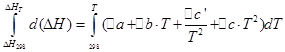
ما همان عملیات را برای فرآیند ایزوکوریک انجام خواهیم داد:
گرمای انحلال
تغییر آنتالپی در هنگام تبدیل یک ماده جامد، مایع یا گاز به محلول نامیده می شود حرارتی یا آنتالپی انحلال.
گرمای انحلال عموماً شامل گرمای تخریب شبکه کریستالی (برای مواد جامدیونیزاسیون و حلالیت.
برای شکستن پیوند بین یونهای نمک کریستالی، به انرژی نیاز است. در حالی که گرما جذب می شود. در همان زمان، هیدراتاسیون یونی در محلول آبی رخ می دهد. پیوندی بین یونها و مولکولهای H 2 O تشکیل میشود. علامت گرمای انحلال توسط فرآیندی مشخص میشود که از نظر انرژی بارزتر است.
LiBr: ∆H dist = - 49.02 kJ / mol - گرما آزاد می شود
KCl: ∆H dist = 7.23 kJ/mol - گرما جذب می شود
تمایز: گرمای یکپارچه انحلال گرمایی است که با حل شدن 1 مول از یک ماده معین برای تشکیل محلولی با غلظت معین آزاد یا جذب می شود. گرمای یکپارچه انحلال بسته به مقدار ماده محلول متفاوت است.
تمایز: گرمای تفاضلی انحلال - این گرمایی است که با انحلال 1 مول از یک ماده معین در بی نهایت همراه است. حجم زیادمحلول این ماده گرمای انتگرال به طور گسترده ای در محاسبه گرمای تشکیل و گرمای سایر واکنش ها طبق قانون هس استفاده می شود. گرمای دیفرانسیل انحلال ویژگی های ترمودینامیکی محلول ها و فرآیند تشکیل آنها را مشخص می کند.
آزمایشگاه شماره 8
تعیین ظرفیت حرارتی اجسام جامد
ابزار و لوازم جانبی:راه اندازی آزمایشی FPT1-8.
هدف، واقعگرایانه:تعیین ظرفیت حرارتی نمونه های فلزی به روش کالریمتری با استفاده از گرمایش الکتریکی.
نظریه مختصر
ظرفیت گرمایی ویژه یک ماده - مقداری برابر با مقدار گرمای مورد نیاز برای گرم کردن 1 کیلوگرم یک ماده با 1 K:
ظرفیت حرارتی مولی - مقداری برابر با مقدار گرمای مورد نیاز برای گرم کردن 1 مول از یک ماده در هر K1:
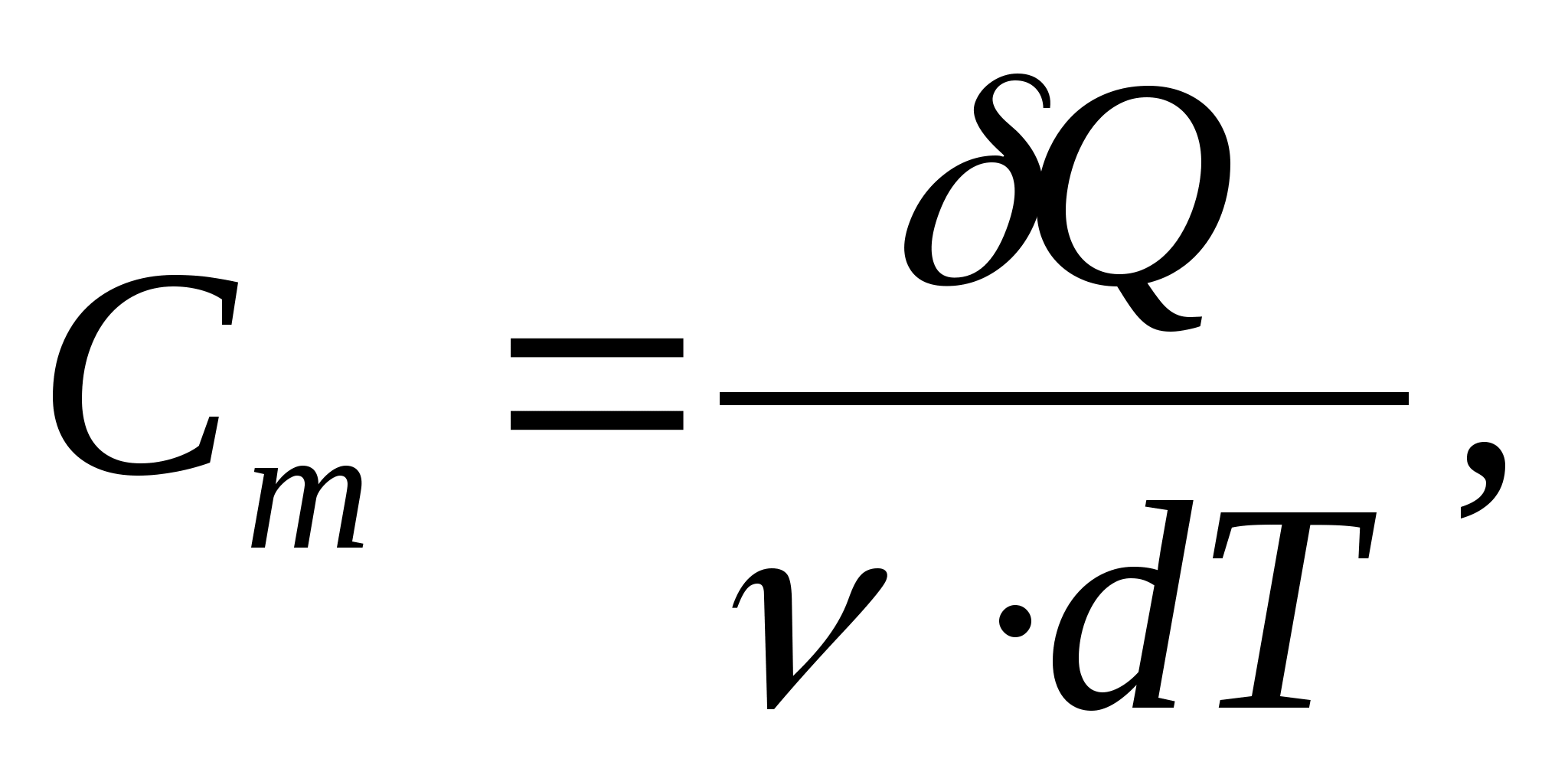
جایی که 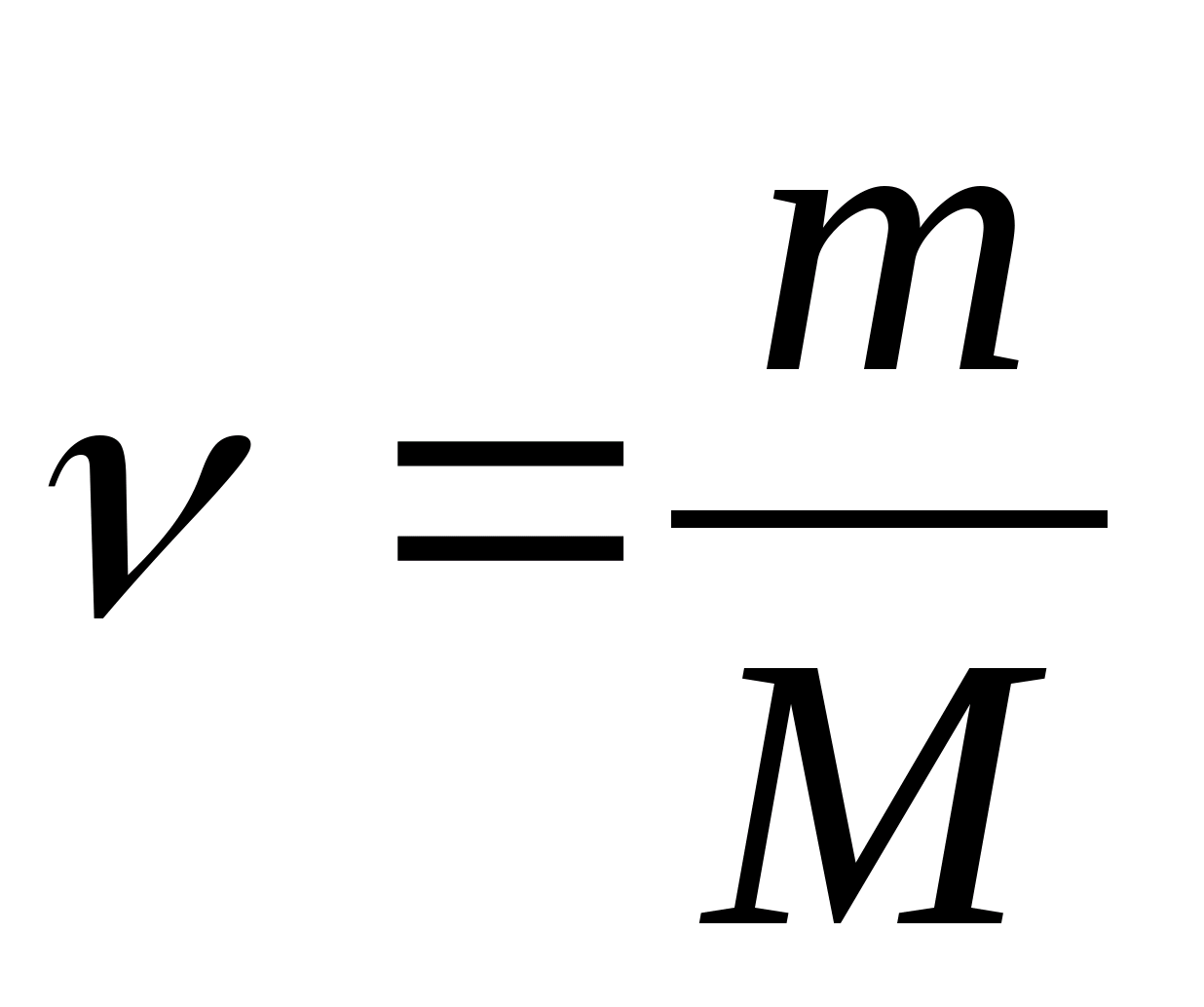 - مقدار ماده
- مقدار ماده
گرمای خاص جمرتبط با مولر سی مترنسبت

جایی که مجرم مولی ماده است.
تمیز دادن ظرفیت گرمایی در حجم ثابتو فشار ثابتاگر در فرآیند گرم کردن یک ماده، حجم یا فشار آن ثابت بماند.
کوچکترین تعداد متغیرهای مستقل (مختصات) که موقعیت سیستم را در فضا کاملاً تعیین می کند نامیده می شود تعداد درجات آزادی .
طبق قانون بولتزمن در مورد توزیع یکنواخت انرژی بر درجات آزادی مولکول ها، هر درجه آزادی انتقالی و چرخشی دارای انرژی جنبشی متوسط برابر با
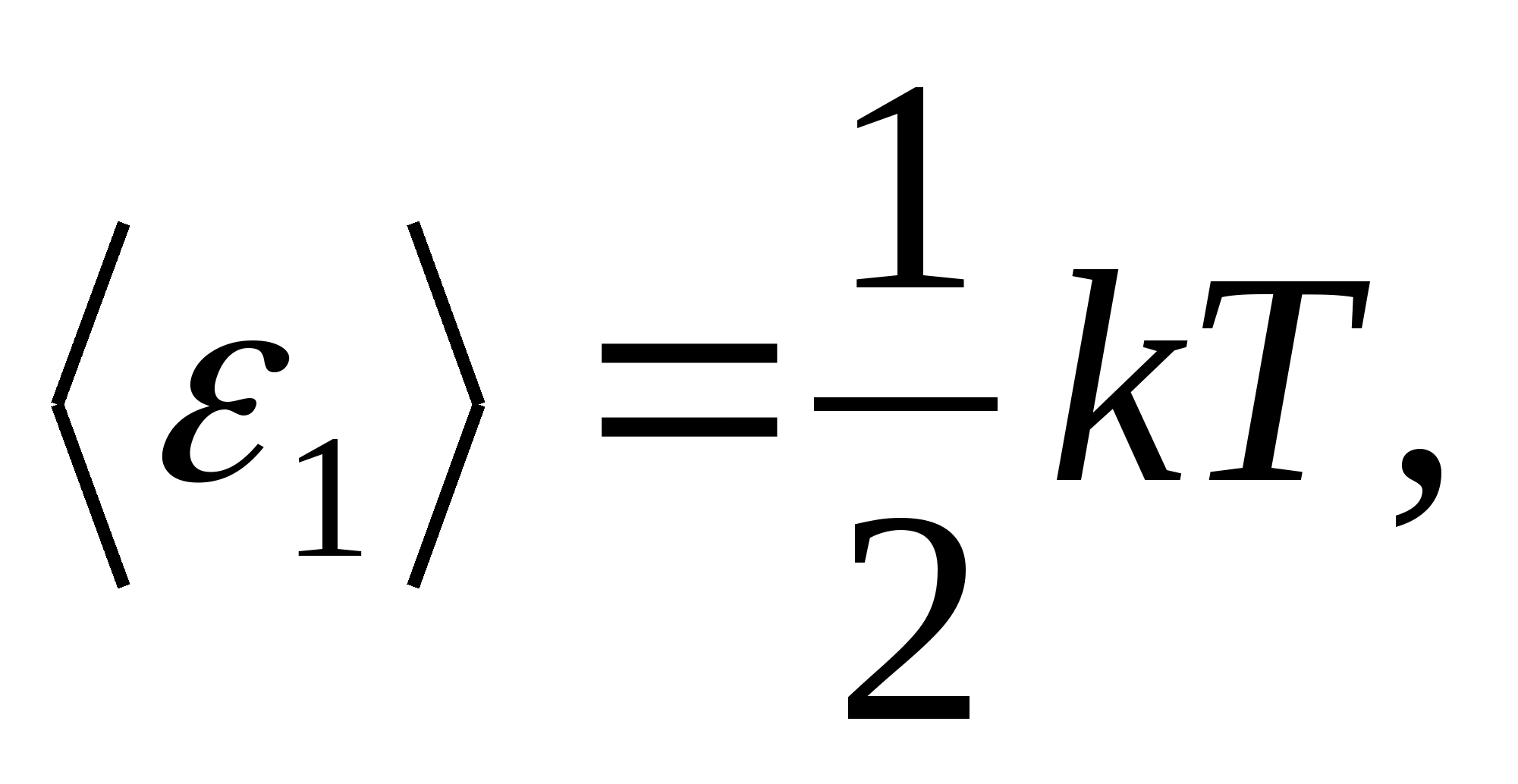
(جایی که کثابت بولتزمن است)، و برای هر درجه آزادی ارتعاشی، به طور متوسط، انرژی برابر است با
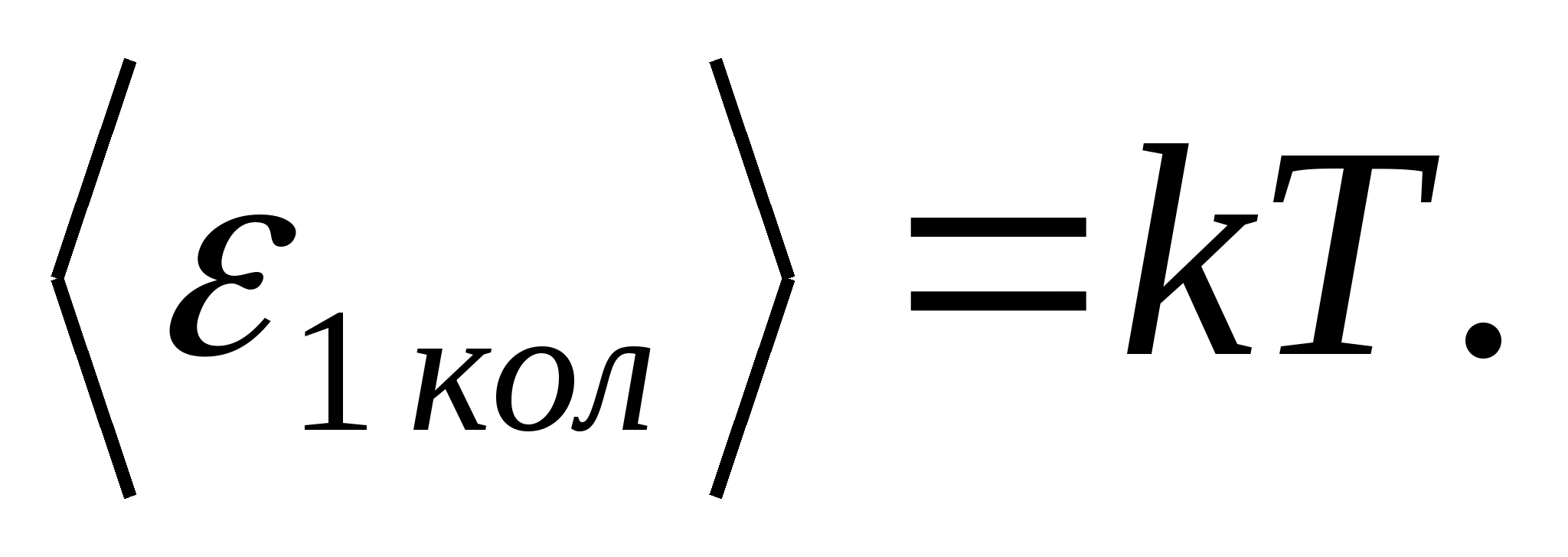
بنابراین، میانگین انرژی یک مولکول
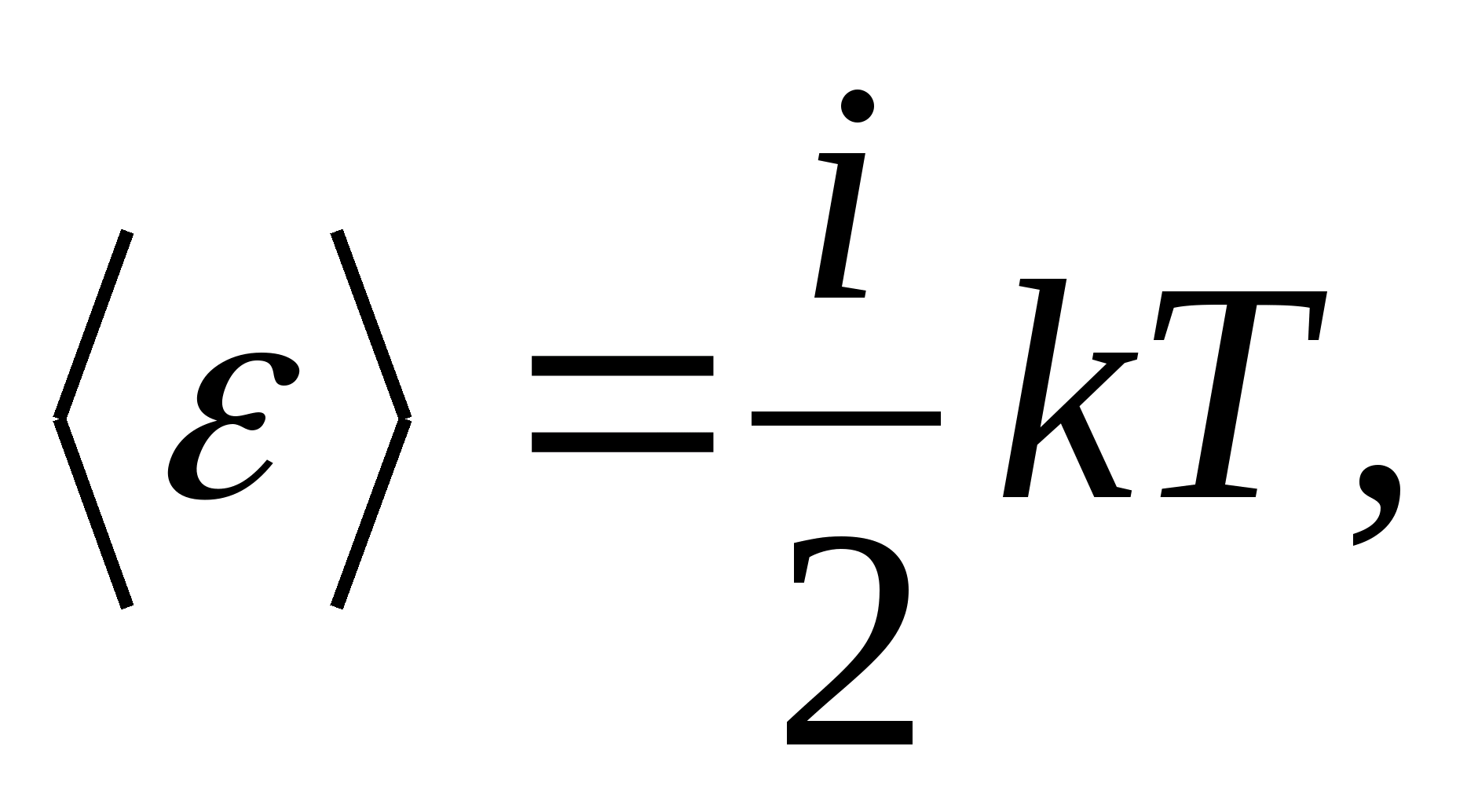
جایی که منمجموع تعداد انتقالی، تعداد چرخشی و دو برابر تعداد درجات آزادی ارتعاشی مولکول است:
![]()
به عنوان مثال، میانگین انرژی جنبشی مولکول های گاز ایده آل تک اتمی ( 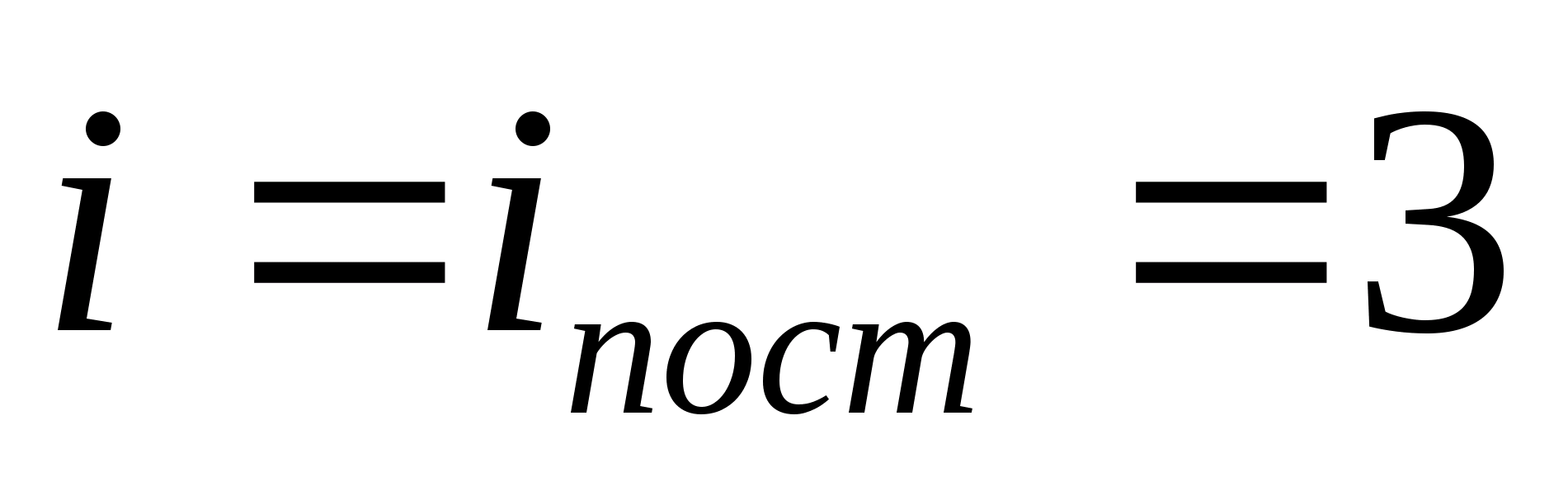 ) برابر است با
) برابر است با
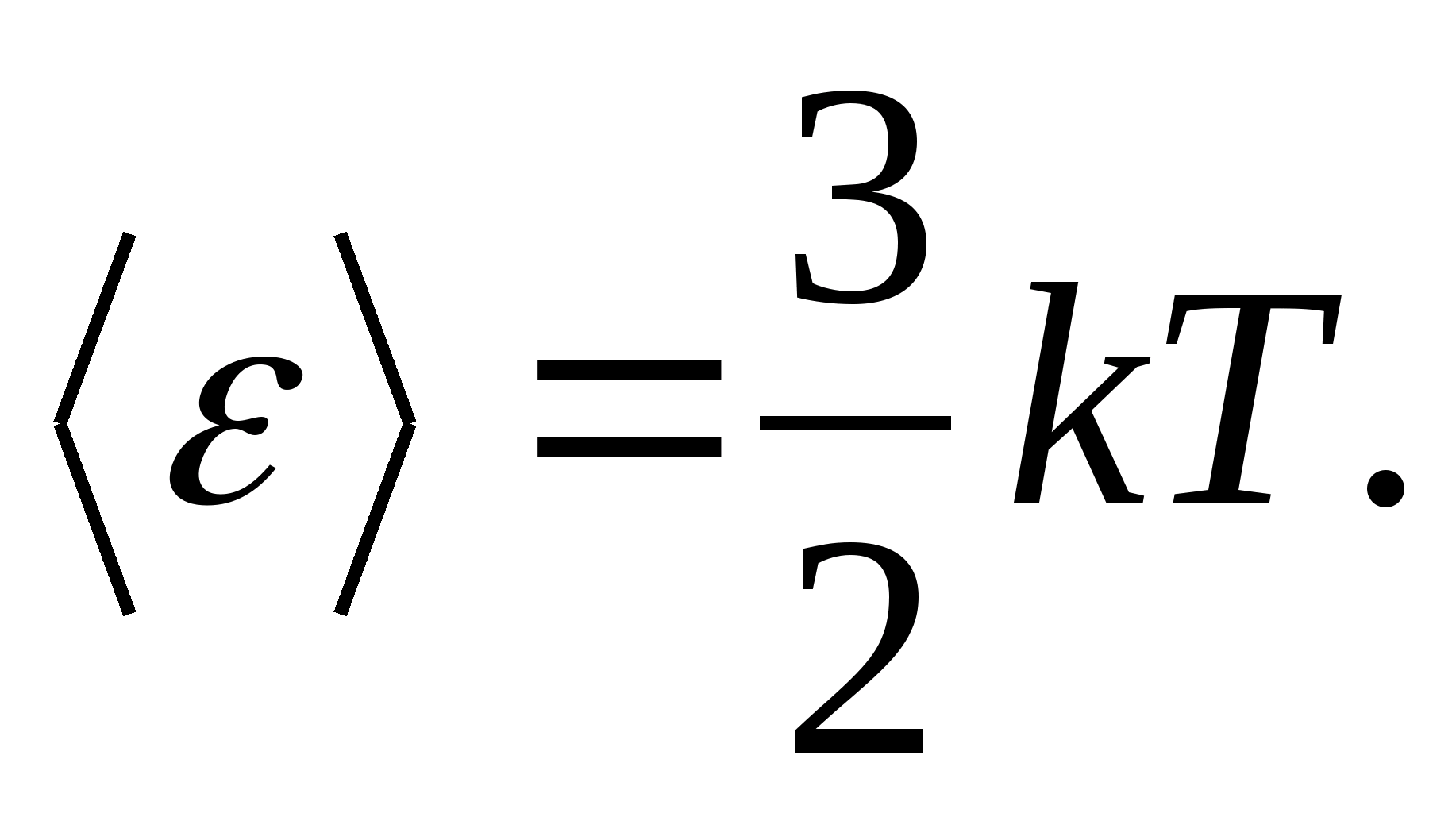
مانند مدل هااز یک جسم جامد، یک شبکه کریستالی درست ساخته شده را در نظر بگیرید که در گره های آن ذرات (اتم ها، یون ها، مولکول ها) به عنوان در نظر گرفته می شوند. نقاط مادی، حول موقعیت های تعادلی خود در نوسان هستند - گره های شبکه -در سه جهت عمود بر یکدیگر بنابراین، هر ذره ای که شبکه کریستالی را تشکیل می دهد، دارای سه درجه آزادی ارتعاشی است که طبق قانون توزیع یکنواخت انرژی بر درجات آزادی، هر یک دارای انرژی هستند. kT.
سپس مقدار متوسط انرژی کل ذره در حین حرکت نوسانی در شبکه کریستالی
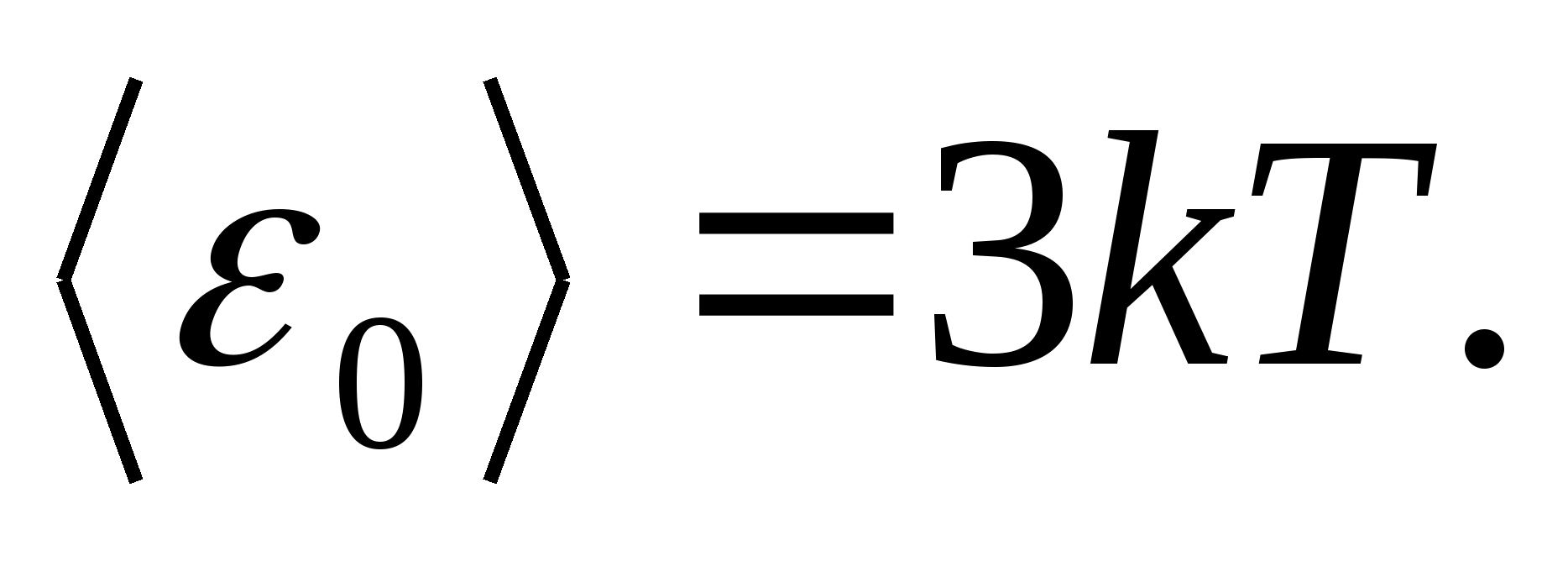
کل انرژی داخلی یک مول از یک جسم جامد از ضرب میانگین انرژی یک ذره در تعداد ذرات ارتعاشی مستقل موجود در یک مول به دست می آید. به ثابت آووگادرو ن آ :
جایی که R=N آ کثابت گاز جهانی (مولری) است، R= 8.31 J/(molK).
برای جامدات، به دلیل ضریب انبساط حرارتی کوچک، ظرفیت گرمایی در فشار ثابت و حجم ثابت عملاً تفاوتی ندارد. بنابراین، با در نظر گرفتن (8.1)، ظرفیت گرمایی مولی یک جامد
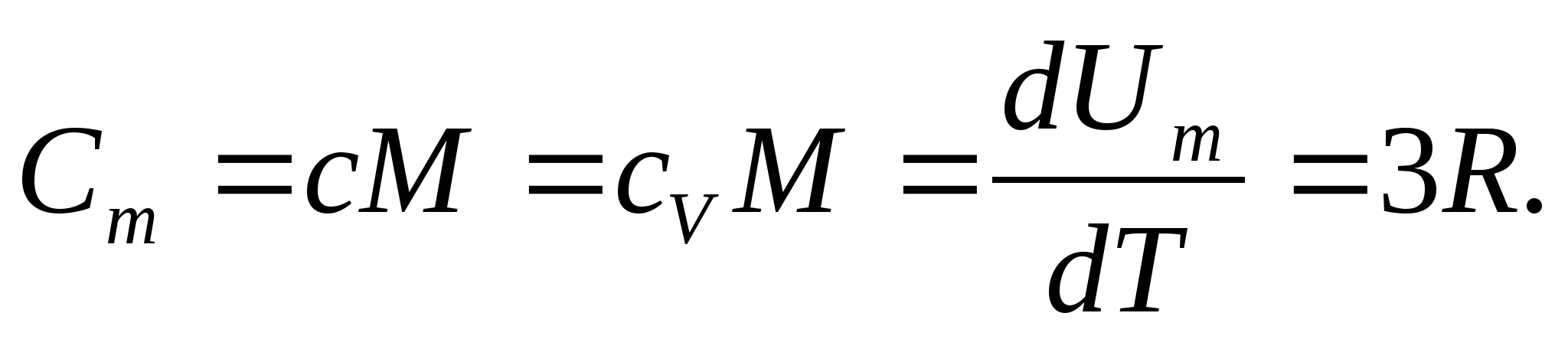 (8.2)
(8.2)
با جایگزینی مقدار عددی ثابت گاز مولی، به دست می آوریم:
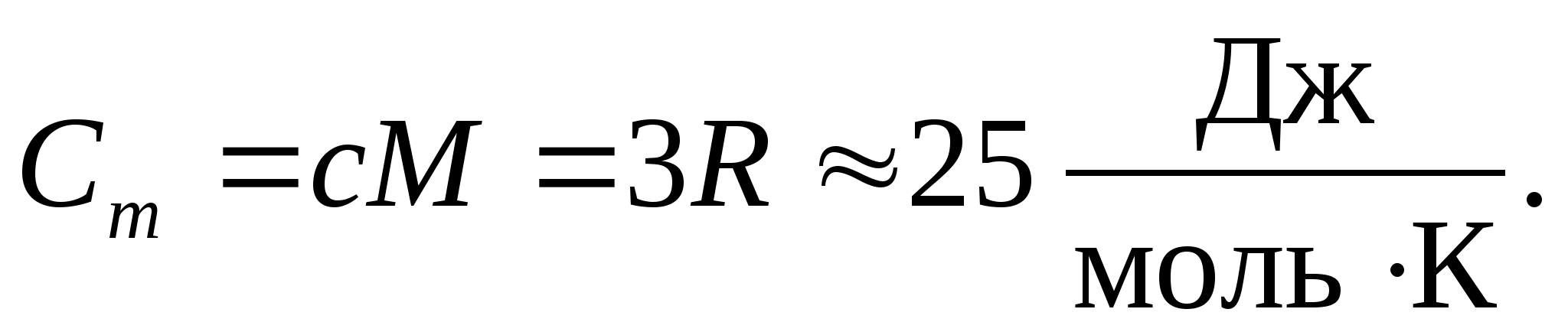
این برابری برای بسیاری از مواد در دمای اتاق تقریب نسبتاً خوبی دارد و نامیده می شود قانون Dulong و Petit : ظرفیت گرمایی مولی تمام بلورهای ساده شیمیایی مواد جامدتقریباً برابر با 25 J/(mol به). با کاهش دما، ظرفیت گرمایی همه جامدات کاهش می یابد و به صفر نزدیک می شود تی0. نزدیک به صفر مطلق، ظرفیت گرمایی مولی همه اجسام متناسب با T 3 است، و تنها در دمای به اندازه کافی بالا مشخصه هر ماده، برابری (8.2) شروع به برقراری می کند. این ویژگی های ظرفیت گرمایی جامدات در دماهای پایین را می توان با استفاده از نظریه کوانتومی ظرفیت گرمایی ایجاد شده توسط انیشتین و دبای توضیح داد.
برای تعیین تجربی ظرفیت گرمایی، بدن مورد مطالعه را در یک کالریسنج قرار میدهند که توسط جریان الکتریکی گرم میشود. اگر دمای کالری سنج با نمونه آزمایشی بسیار آهسته از دمای اولیه افزایش یابد تی 0 تا تیسپس از انرژی جریان الکتریکی برای گرم کردن نمونه و کالریسنج استفاده میشود:
جایی که منو U- جریان و ولتاژ بخاری؛ - زمان گرمایش؛ متر 0 و مترجرم کالری سنج و نمونه آزمایشی هستند، با 0 و با- ظرفیت حرارتی ویژه گرماسنجی و نمونه آزمایشی، س- اتلاف حرارت به عایق حرارتی کالریمتر و فضای اطراف.
برای حذف مقدار حرارتی که برای گرم کردن کالریسنج صرف میشود و اتلاف حرارت به فضای اطراف از رابطه (8.3) حذف میشود، لازم است با همان قدرت بخاری، گرماسنج خالی (بدون نمونه) از دمای اولیه گرم شود. تی 0 برای اختلاف دما یکسان تی. اتلاف حرارت در هر دو حالت تقریباً یکسان و بسیار کم خواهد بود، اگر دمای پوشش محافظ کالریمتر در هر دو حالت ثابت و برابر با دمای اتاق باشد:
معادلات (8.3) و (8.4) دلالت دارند
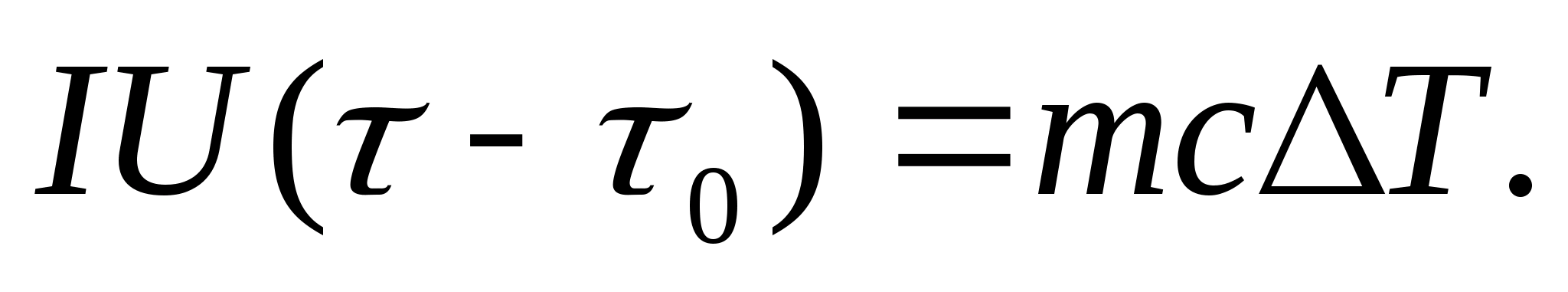 (8.5)
(8.5)
از رابطه (8.5) می توان برای تعیین تجربی ظرفیت گرمایی ویژه ماده نمونه آزمایشی استفاده کرد. با تغییر دمای کالری سنج، لازم است وابستگی اختلاف زمان گرمایش را به تغییر دمای نمونه آزمایش ترسیم کرد:
−
0)=f(تی) با توجه به ضریب زاویه ای آن 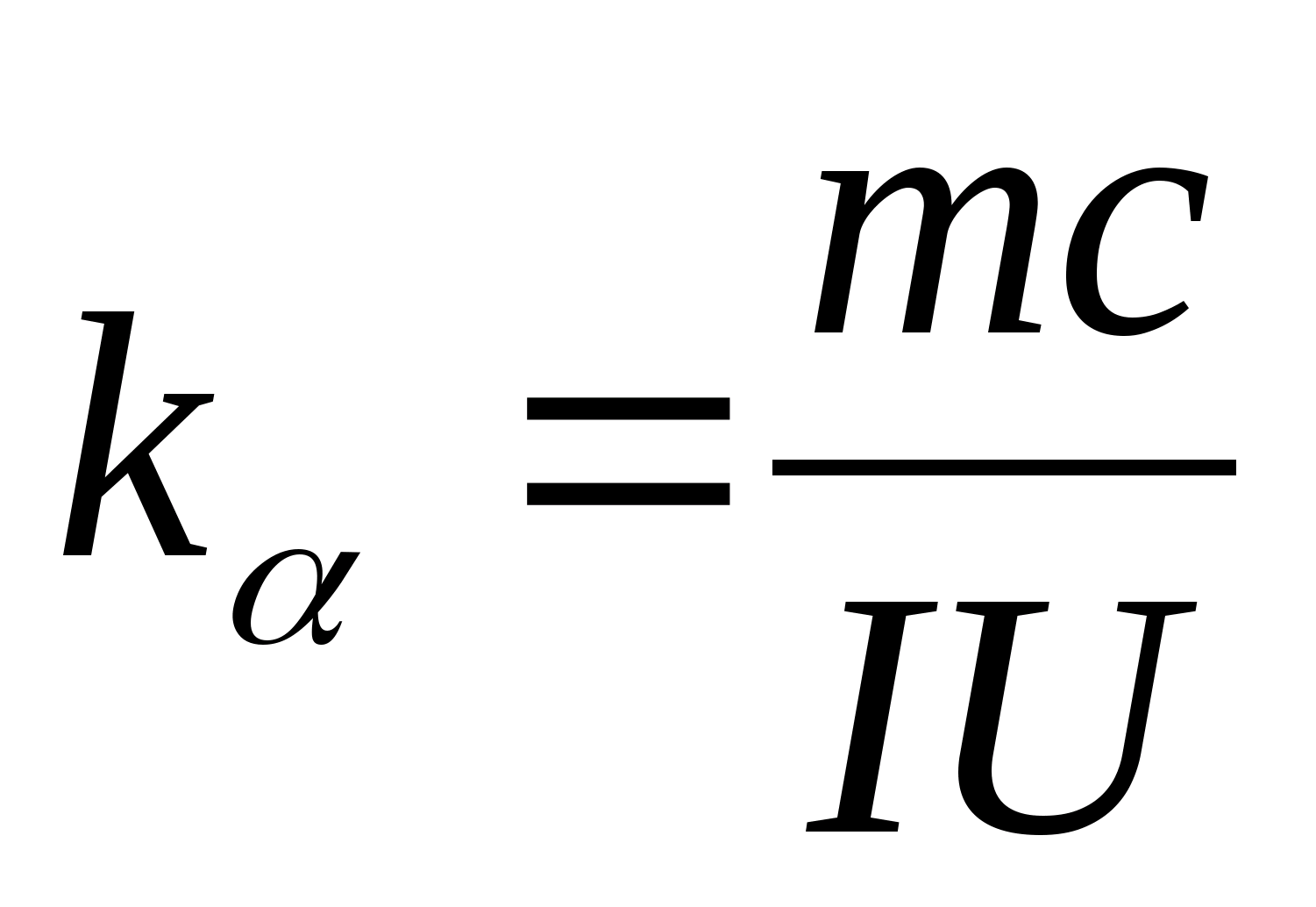 ظرفیت گرمایی ویژه نمونه را می توان تعیین کرد.
ظرفیت گرمایی ویژه نمونه را می توان تعیین کرد.
شرح تنظیمات آزمایشگاهی
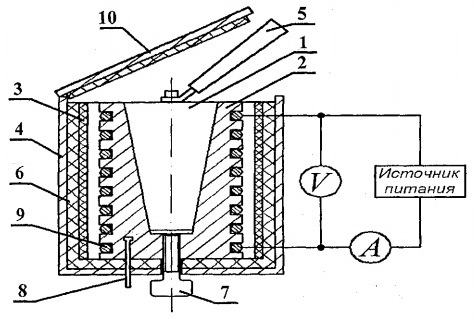
برای تعیین ظرفیت گرمایی جامدات، تنظیمات آزمایشی FPT1-8 طراحی شده است که نمای کلی آن در شکل 1 نشان داده شده است. 8.1. نصب از سه بخش اصلی تشکیل شده است: واحد ابزار 1، واحد عنصر عامل 2 و رک 3.
در پانل جلویی واحد کنترل 1 وجود دارد: کلید ضامن "NETWORK" که واحد را به شبکه ولتاژ تغذیه متصل می کند. سوئیچ "HEATING" که بخاری را روشن می کند. تنظیم کننده "HEATING" که با کمک آن قدرت بخاری تنظیم می شود. ولت متر و آمپرمتر که ولتاژ و جریان را در مدار بخاری اندازه گیری می کنند. کرونومتر، که زمان گرم شدن کالری سنج را اندازه گیری می کند. کرونومتر وقتی دستگاه ابزار روشن است فعال می شود.
بلوک عنصر کار 2 در جلو با یک صفحه قابل جابجایی از org بسته شده است. شیشه. هنگام انجام کار، صفحه نمایش بر روی دیواره پشتی بلوک عنصر کار آویزان می شود. روی بلوک پانل عنصر کار یک دماسنج دیجیتال 6 برای اندازه گیری دما قرار دارد. در پایین، در لانه ها، 5 نمونه آزمایشی از مواد مختلف و یک دسته برای قرار دادن نمونه ها در بخاری وجود دارد.
هیتر 4 از یک محفظه فلزی، مواد عایق حرارتی و یک گرماسنج تشکیل شده است.

نمونه ها در یک کالریمتر گرم می شوند که طرح آن در شکل نشان داده شده است. 8.2.
گرماسنج یک محفظه برنجی 2 با سوراخ مخروطی شکل است که نمونه آزمایشی 1 در آن وارد می شود.در سطح بیرونی کیس یک کویل گرمایشی 9 در شیارهای مخصوص قرار داده شده است.خارج محفظه کالری سنج با لایه هایی از آزبست عایق حرارتی شده است. 3 و الیاف شیشه 6 و با محفظه آلومینیومی بسته می شود 4. گرماسنج با پوشش عایق حرارت 10 بسته می شود. پس از پایان آزمایش می توان نمونه را با کمک از سوراخ مخروطی بدنه کالری سنج به بیرون هل داد. پیچ 7. برای خارج کردن نمونه گرم شده از گرماسنجی و نصب نمونه در بخاری از دستگیره 5 استفاده می شود که در یک سوکت مخصوص در کنار نمونه های مورد مطالعه قرار دارد.
دمای کالری سنج توسط دماسنج دیجیتالی اندازه گیری می شود که سنسور دمای 8 آن در محفظه 2 کالری سنج قرار دارد.
ایمنی
هنگام انجام کار، الزامات ایمنی عمومی در آزمایشگاه مکانیک رعایت می شود.
سفارش کار
توجه!گرماسنج مدت زیادی طول می کشد تا خنک شود، بنابراین پس از اندازه گیری تمام مقادیر زمانی 0 گرم کردن یک کالریمتر خالی، فوراً گرمایش را خاموش کنید (نقطه 4 را در زیر ببینید). حداکثر دمای گرمایش برای این واحد +44С است.
1. پوشش شفاف یونیت المنت کار نصب را بردارید و آن را روی پیچ های پنل پشتی آویزان کنید. دکمه کنترل HEAT را روی حداقل تنظیم کنید. نصب را با کلید ضامن "NETWORK" روشن کنید.
2. درب گرماسنج خالی را محکم ببندید. کلید ضامن "HEAT" را روشن کنید. با استفاده از رگولاتور HEAT، ولتاژ را روی 10-20 ولت تنظیم کنید (هر چه ولتاژ بالاتر باشد، گرمایش سریعتر است). در جدول بنویسید. 8.1 مقادیر ولتاژ انتخاب شده Uو جاری من.
3. شروع از دمای کالری سنج تی 0 مشخص شده توسط معلم، پس از یک فاصله زمانی 1С در جدول وارد کنید. 8.1 مقادیر زمانی 0 مربوط به هر دمای رسیده است تی.
4. کلید ضامن "HEAT" را خاموش کنید، درب آن را باز کنید و کالری سنج را تا دمای اولیه خنک کنید. تی 0 . برای خنک کردن سریع کالریمتر، می توانید یکی از نمونه ها را به کالری سنج پایین بیاورید، به جز نمونه ای که معلم نشان داده است (هنگام نصب نمونه در کالری سنج، پیچ پایین کالری سنج را به سمت چپ بچرخانید). دما شروع به کاهش خواهد کرد. هنگامی که سرعت خنک کننده کاهش یافت، نمونه گرم شده را بردارید و نمونه بعدی (سرد) را به جز نمونه ای که معلم نشان داده است وارد کنید. برای برداشتن نمونه، پیچ پایین کالریمتر را به سمت راست (در جهت عقربه های ساعت) بچرخانید و سپس نمونه را با دسته بیرون بکشید.
جدول 8.1
|
تی= تی− تی 0 , |
= − 0 , |
J/(kgK) |
سی متر =بام, J/(molK) |
||||||||
5. پیچ را به سمت چپ بچرخانید، یکی از نمونه های آزمایشی را که طبق دستور معلم گرفته شده است، در کالری سنج قرار دهید. درب کالری سنج را محکم ببندید و 2-3 دقیقه صبر کنید تا دمای کالری و نمونه یکسان شود.
6. کلید ضامن "HEAT" را روشن کنید و همان ولتاژی را در مدار تنظیم کنید که هنگام گرم کردن کالری سنج خالی.
7. شروع از همان دمای کالری سنج اولیه تی 0، پس از فاصله 1С در جدول وارد کنید. 8.1 مقادیر زمانی مربوط به هر دمای رسیده است تی.
8. تنظیم کننده "HEATING" را در سمت چپ قرار دهید (به حداقل)، کلید "HEATING" را خاموش کنید، درب کالری سنج را باز کنید. برای خارج کردن نمونه از کالری سنج، پیچ را به سمت راست بچرخانید، سپس نمونه گرم شده را با استفاده از دسته جدا کنید.
9. دستگاه را با کلید ضامن "NETWORK" خاموش کنید.
10. تمام مقادیر کمیت ها را ترجمه کنید 0 و مقادیر را در ثانیه (بدون دقیقه) وارد کنید و آنها را در جدول وارد کنید. 8.1. برای هر خط جدول 8.1 مقادیر را محاسبه کنید = − 0 و تی= تی− تی 0 .
11. با استفاده از فرمول، ظرفیت حرارتی ویژه نمونه را تخمین زده کنید 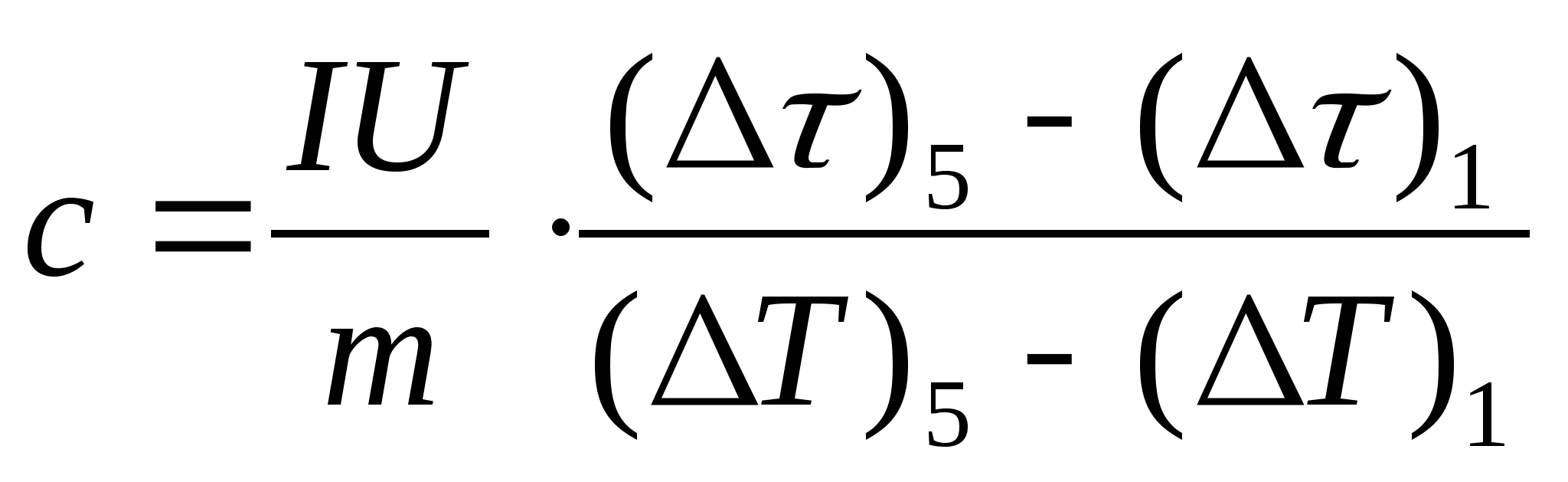 ، جایی که جرم نمونه است متر= 139.5 گرم (برنج) یا متر=129.7 گرم (فولاد) یا
متر=46.05 گرم (دورالومین). برای تأیید به معلم مراجعه کنید.
، جایی که جرم نمونه است متر= 139.5 گرم (برنج) یا متر=129.7 گرم (فولاد) یا
متر=46.05 گرم (دورالومین). برای تأیید به معلم مراجعه کنید.
پردازش نتایج اندازه گیری
1. طرح
=f(تی) وابستگی تفاوت زمان گرم شدن کالری سنج با نمونه و کالری سنج خالی به تغییر دمای کالری سنج، هر دو نقطه از نمودار را انتخاب کنید و شیب خط مستقیم را با استفاده از فرمول تعیین کنید. 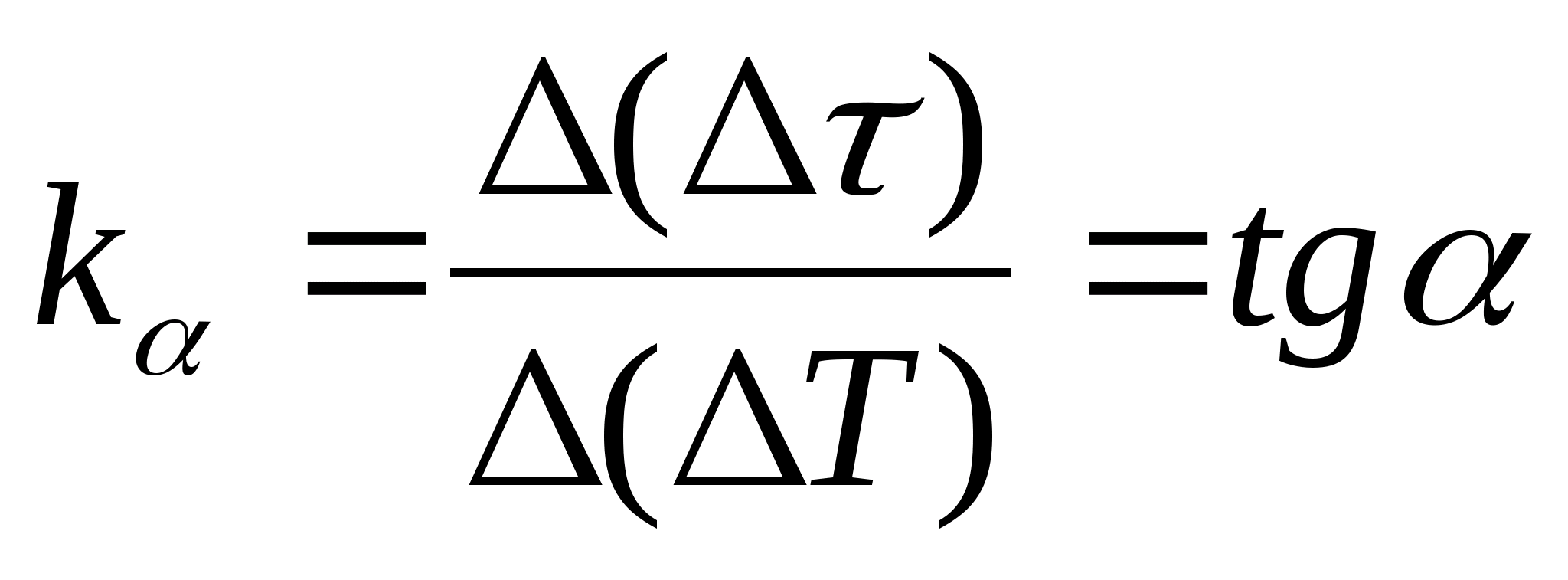 ، جایی که
− زاویه تمایل نمودار به محور تی
(اگر واحدهای
و تیدر هر دو محور به عنوان بخش هایی با طول یکسان نشان داده شده است).
، جایی که
− زاویه تمایل نمودار به محور تی
(اگر واحدهای
و تیدر هر دو محور به عنوان بخش هایی با طول یکسان نشان داده شده است).
2. استفاده از مقدار شیب ک
، ظرفیت گرمایی ویژه نمونه را با استفاده از فرمول تعیین کنید 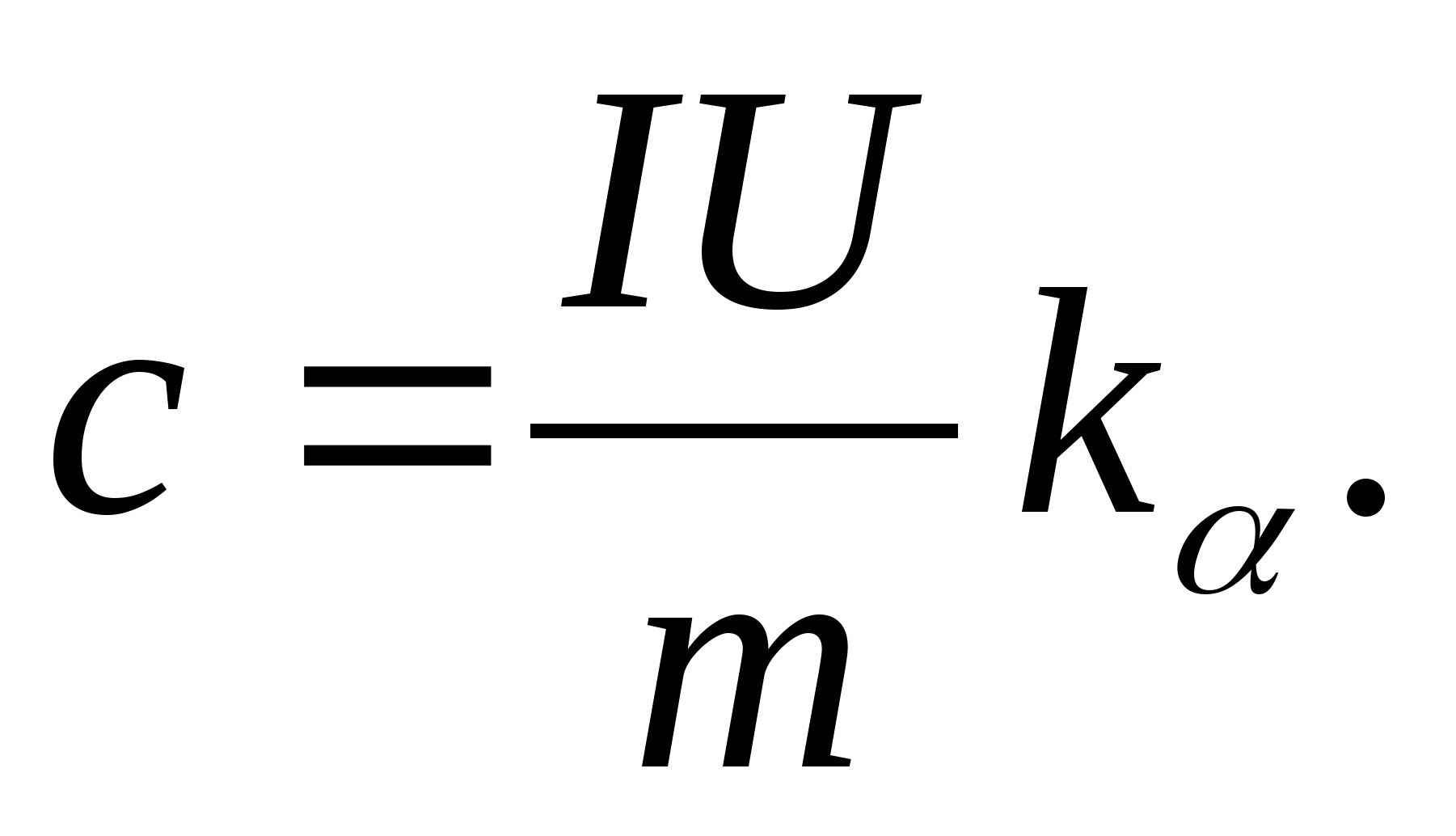
3. با استفاده از داده های جدول 8.2 (یا جدول تناوبی)، ظرفیت گرمایی مولی نمونه را با استفاده از فرمول تعیین کنید. سی متر =بام.
جدول 8.2
|
مواد نمونه |
جرم اتمی، کیلوگرم بر مول |
|
به عنوان مدلی از یک جسم جامد، اجازه دهید یک شبکه کریستالی درست ساخته شده را در نظر بگیریم که در گره های آن ذرات (اتم ها، یون ها، مولکول ها) که به عنوان نقاط مادی در نظر گرفته شده اند، در اطراف موقعیت های تعادلی خود - گره های شبکه - در سه جهت متقابل عمود بر هم در نوسان هستند. . بنابراین، به هر ذره ای که شبکه کریستالی را تشکیل می دهد، سه درجه آزادی ارتعاشی نسبت داده می شود، که هر یک، طبق قانون برابری انرژی بر درجات آزادی (به بند 50 مراجعه کنید)، دارای انرژی هستند. kT.
انرژی درونی مول یک جسم جامد
U m \u003d 3N A kT \u003d 3RT،
که در آن N A ثابت آووگادرو است. نآ ک= آر (آر ثابت گاز مولی است).
ظرفیت گرمایی مولی یک جامد
یعنی ظرفیت گرمایی مولی (اتمی). اجسام ساده از نظر شیمیاییدر حالت کریستالی یکسان است (برابر با 3 آر) و به دما بستگی ندارد. این قانون به طور تجربی توسط دانشمندان فرانسوی P. Dulong (1785-1838) و L. Petit (1791-1820) به دست آمده است. عنوانقانون Dulong و Petit.
اگر جامد یک ترکیب شیمیایی (مثلا NaCl) باشد، تعداد ذرات موجود در مول برابر با ثابت آووگادرو نیست، بلکه برابر است با nNآ , جایی که n - تعداد اتم های یک مولکول (برای NaCl، تعداد ذرات یک مول 2 است. نو بنابراین، یک مول NaCl حاوی اتم های N A Na و اتم های N A Cl است). بنابراین ظرفیت حرارتی مولی ترکیبات شیمیایی جامد
C V \u003d 3R25n J / (mol K)،
یعنی برابر با مجموع ظرفیت های گرمایی اتمی عناصر تشکیل دهنده این ترکیب.
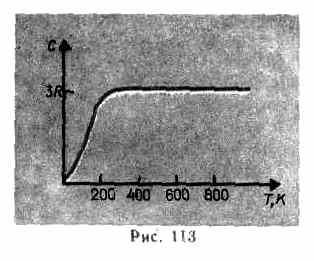
همانطور که داده های تجربی نشان می دهد (جدول 4)، برای بسیاری از مواد، قانون Dulong و Petit با تقریب نسبتا خوبی برآورده می شود، اگرچه برخی از مواد (C، Be، B) دارای انحرافات قابل توجهی از ظرفیت حرارتی محاسبه شده هستند. علاوه بر این، مانند گازها (نگاه کنید به § 53)، آزمایشها روی اندازهگیری ظرفیت گرمایی جامدات در دماهای پایین نشان دادهاند که به دما بستگی دارد (شکل 113). نزدیک به صفر کلوین، ظرفیت گرمایی اجسام متناسب با T 3 است و فقط در دماهای به اندازه کافی بالا، مشخصه هر ماده، شرط (73.1) برآورده می شود. به عنوان مثال الماس دارای ظرفیت حرارتی 3 است آر در 1800 K! با این حال، برای اکثر مواد جامد، دمای اتاق در حال حاضر به اندازه کافی بالا است.
اختلاف بین مقادیر تجربی و نظری ظرفیت های حرارتی محاسبه شده بر روی
اساس نظریه کلاسیک، بر اساس نظریه کوانتومی ظرفیت های گرمایی، A. Einstein and P. Debye (1884-1966) توضیح داده شده است.
§ 74. تبخیر، تصعید، ذوب و تبلور. اجسام آمورف
هم در مایعات و هم در جامدات، همیشه تعداد معینی مولکول وجود دارد که انرژی آنها برای غلبه بر جاذبه به مولکول های دیگر کافی است و می توانند از سطح یک مایع یا جامد جدا شده و به فضای اطراف آنها عبور کنند. این فرآیند برای مایع نامیده می شود تبخیر(یا تبخیر)،برای جامدات - تصعید(یا تصعید).
تبخیر مایعات در هر دمایی رخ می دهد، اما شدت آن با افزایش دما افزایش می یابد. همراه با فرآیند تبخیر، یک فرآیند جبرانی نیز صورت می گیرد متراکم شدنبخار به مایع اگر تعداد مولکول هایی که مایع را در واحد زمان از یک واحد سطح خارج می کنند برابر باشد با تعداد مولکول هایی که از بخار به مایع می گذرند، آنگاه تعادل پویابین فرآیندهای تبخیر و تراکم بخار در حالت تعادل با مایع خود نامیده می شود ثروتمند(همچنین به بند 62 مراجعه کنید).
برای اکثر جامدات، فرآیند تصعید در دماهای معمولی ناچیز است و فشار بخار روی سطح جامد کم است. با افزایش دما افزایش می یابد. به شدت موادی مانند نفتالین، کافور را تصعید می کند که با بوی تند و مشخص تشخیص داده می شود. تصعید به ویژه در خلاء به شدت رخ می دهد - این برای ساخت آینه استفاده می شود. یک مثال شناخته شده از تصعید تبدیل یخ به بخار است - لباس های خیس در سرما خشک می شوند.
اگر یک جسم جامد گرم شود، آنگاه آن را گرم می کنند انرژی درونی(مجموع انرژی ارتعاشات ذرات در محل های شبکه و انرژی برهمکنش این ذرات) افزایش می یابد. با افزایش دما، دامنه نوسانات ذرات
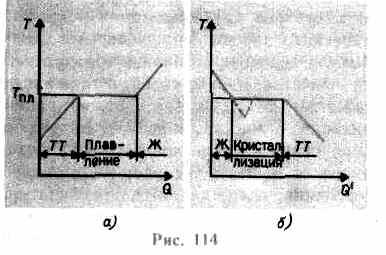
افزایش می یابد تا زمانی که شبکه کریستالی فرو می ریزد - جامد ذوب می شود. روی انجیر 114 آیک وابستگی تقریبی نشان داده شده است تی(س), جایی که س- میزان گرمای دریافتی بدن در حین ذوب. به عنوان پیام به جامد بدن گرمدمای آن بالا می رود و در نقطه ذوب تی pl انتقال جسم از حالت جامد به مایع را آغاز می کند. درجه حرارت تی pl ثابت می ماند تا زمانی که کل کریستال ذوب شود و تنها پس از آن دمای مایع دوباره شروع به افزایش می کند.
گرم کردن یک جامد تا تی pl هنوز آن را به حالت مایع تبدیل نمی کند، زیرا انرژی ذرات ماده باید برای از بین بردن شبکه کریستالی کافی باشد. در فرآیند ذوب، گرمای وارد شده به ماده برای انجام کار بر روی تخریب شبکه کریستالی استفاده می شود و بنابراین T pl =const تا زمانی که کل کریستال ذوب شود. سپس گرمای عرضه شده دوباره برای افزایش انرژی ذرات مایع رفته و دمای آن شروع به افزایش می کند. مقدار حرارت لازم برای ذوب 1 کیلوگرم یک ماده را می گویند گرمای ویژه همجوشی
اگر مایع خنک شود، فرآیند در جهت مخالف پیش می رود (شکل 114، b; س" - مقدار حرارتی که بدن در هنگام تبلور متصاعد می کند: ابتدا دمای مایع کاهش می یابد سپس در دمای ثابت برابر با T pl شروع می شود. تبلور،پس از اتمام آن، دمای کریستال شروع به کاهش می کند. برای تبلور یک ماده، وجود به اصطلاح مراکز تبلور -هسته های کریستالی که نه تنها می توانند کریستال های ماده تشکیل شده باشند، بلکه می توانند ناخالصی ها و همچنین گرد و غبار، دوده و غیره باشند. عدم وجود مراکز تبلور در مایع خالص، تشکیل بلورهای میکروسکوپی را دشوار می کند و ماده، در حالت مایع باقی می ماند، تا دمای کمتر از دمای تبلور سرد می شود و در نتیجه تشکیل می شود مایع فوق خنک(در 114، b با منحنی نقطه چین مطابقت دارد). با ابرسرد شدن قوی، تشکیل خود به خودی مراکز کریستالیزاسیون شروع می شود و ماده نسبتاً سریع متبلور می شود.
معمولاً فوق سرد شدن مذاب از کسری تا ده ها درجه رخ می دهد، اما برای تعدادی از مواد می تواند به صدها درجه برسد. به دلیل ویسکوزیته بالا، مایعات بسیار فوق سرد سیالیت خود را از دست می دهند و شکل خود را مانند جامدات حفظ می کنند. این اجسام نامیده می شوند جامدات آمورف؛اینها شامل رزین، موم، موم آب بندی، شیشه است. اجسام آمورف که در نتیجه مایعات فوق سرد هستند، همسانگرد،یعنی خواص آنها در همه جهات یکسان است; برای آنها، و همچنین برای مایعات، مشخصه است سفارش کوتاه برددر آرایش ذرات؛ در آنها، برخلاف مایعات، تحرک ذرات نسبتاً کم است. یکی از ویژگیهای اجسام آمورف این است که نقطه ذوب خاصی ندارند، یعنی نمیتوان دمای خاصی را نشان داد که بالاتر از آن حالت مایع و در زیر حالت جامد مشخص شود. از تجربه مشخص است که در اجسام آمورف فرآیند تبلور را می توان در طول زمان مشاهده کرد، به عنوان مثال، کریستال ها در شیشه ظاهر می شوند. با از دست دادن شفافیت، شروع به کدر شدن می کند و به یک بدنه پلی کریستالی تبدیل می شود.
اخیراً استفاده گسترده در اقتصاد ملیبدست آورد پلیمرها- اجسام آمورف آلی که مولکول های آنها از تعداد زیادی زنجیره مولکولی طولانی یکسان تشکیل شده است که با پیوندهای شیمیایی (ظرفیتی) به هم متصل شده اند. پلیمرها هم شامل مواد آلی طبیعی (نشاسته، پروتئین، لاستیک، الیاف و غیره) و مصنوعی (پلاستیک، لاستیک، پلی استایرن، لاوسان، نایلون و غیره) هستند. پلیمرها قدرت و کشش ذاتی هستند. برخی از پلیمرها کشش 5-10 برابر طول اولیه خود را تحمل می کنند. این با این واقعیت توضیح داده می شود که زنجیره های مولکولی طولانی می توانند تحت تغییر شکل یا به توپ های متراکم تا شوند یا به خطوط مستقیم کشیده شوند. خاصیت ارتجاعی پلیمرها فقط در یک محدوده دمایی خاص خود را نشان می دهد که در زیر آن سخت و شکننده می شوند و در بالای آن - پلاستیک. اگرچه بسیاری از مواد پلیمری مصنوعی (الیاف مصنوعی، جایگزینهای چرم، مصالح ساختمانی، جایگزینهای فلزی و غیره) ایجاد شدهاند، نظریه پلیمرها هنوز به طور کامل توسعه نیافته است. توسعه آن با نیازهای فناوری مدرن تعیین می شود که نیاز به سنتز پلیمرهایی با خواص از پیش تعیین شده دارد.
ظرفیت گرمایی ویژه یک ماده به عنوان مقدار درک می شود
, (1)
مقدار گرمای وارد شده به بدن کجاست.
تغییر دمایی است که در
در نتیجه انتقال گرما به بدن
m جرم جسم گرم شده است.
معمولاً تجربه میانگین را تعیین می کند گرمای ویژهماده c از نظر عددی برابر با مقدار گرمایی است که باید به یک واحد جرم از این ماده داده شود تا دمای آن به میزان زیر افزایش یابد:
(2),
تفاوت بین دمای نهایی و اولیه بدن مورد مطالعه کجاست.
برای تعیین تجربی ظرفیت گرمایی از روش های کالریمتری مختلفی استفاده می شود. تنوع این روش ها به این دلیل است که اندازه گیری دقیق مقدار گرمای وارد شده به بدن مستلزم حذف تلفات حرارتی است که در هنگام گرم کردن بدن مورد مطالعه در نظر گرفته نمی شود.
معمولاً در کالریسنجهایی که دارای پوسته همدما هستند، یک تصحیح محاسبهشده یا تجربی تعیین شده برای تشعشع، یعنی مقدار گرمایی که کالریسنج در طول آزمایش توسط تابش به محیط خارجی دریافت میکند یا میدهد، معرفی میشود.
با این حال، می توان با معرفی عایق حرارتی خوب یا با کاهش مدت زمان آزمایش، تلفات حرارتی را به میزان قابل توجهی کاهش داد، که با نرخ گرمایش بالای نمونه (روش پالس برای اندازه گیری ظرفیت گرمایی) حاصل می شود، که در آن تلفات حرارتی خواهد بود. در مقایسه با مقدار کل گرمای عرضه شده کوچک باشد.
یکی از دقیق ترین روش ها برای تعیین ظرفیت حرارتی، روش کالریمتر آدیاباتیک است. مشکلات مربوط به نیاز به در نظر گرفتن تلفات حرارتی در کالریسنجهای این نوع با این واقعیت حذف میشوند که اندازهگیریها در شرایط تعادل حرارتی انجام میشوند، یعنی در شرایط دمای مساوی نمونه مورد مطالعه و بلوک اطراف نمونه. . از مزایای این روش در کنار دقت بالا می توان به امکان تعیین ظرفیت گرمایی جامدات در محدوده دمایی وسیع نیز اشاره کرد که به ویژه در صورتی که مواد دچار دگرگونی فازی شوند از اهمیت ویژه ای برخوردار است.
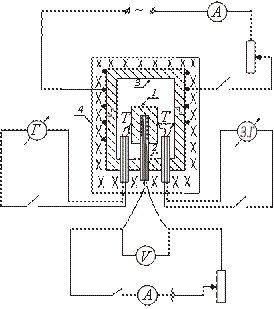
دستگاه یکی از انواع گرماسنج آدیاباتیک به صورت شماتیک در شکل نشان داده شده است. نمونه آزمایشی 1 در بلوک مسی 3 قرار می گیرد و همراه با آن در کوره 4 گرم می شود. هیتر 2 در داخل نمونه وارد می شود که امکان گرمایش اضافی نمونه را فراهم می کند.
پس از روشن کردن کوره 4 که بلوک با نمونه در آن قرار می گیرد، دمای نمونه شروع به افزایش می کند و زیر دمای بلوک باقی می ماند. برای ایجاد برابری بین دمای نمونه و بلوک، بخاری قرار داده شده در داخل نمونه را روشن کنید. هنگامی که دمای نمونه کمی بالاتر از دمای بلوک باشد، بخاری داخلی خاموش می شود.
متعاقباً این بخاری به صورت دورهای روشن و خاموش میشود تا اختلاف دمای بین نمونه و بلوک علامت تغییر دائمی باشد.
در لحظه ای که برابر با صفر است (هنگامی که بخاری داخلی روشن است) هیچ تبادل حرارتی بین نمونه و بلوک وجود ندارد و کل مقدار گرمای آزاد شده توسط بخاری داخلی فقط صرف گرم کردن نمونه می شود. گرمای ویژه در این حالت را می توان با فرمول (2) تعیین کرد.
مقدار گرمای آزاد شده توسط بخاری داخلی با فرمول تعیین می شود:
جایی که I جریان بخاری داخلی است.
V افت ولتاژ در آن است.
- فاصله زمانی که در طی آن دما به میزان .
سپس
(4)
زمانی که در طی آن دمای نمونه تغییر کرده است.
در فرم دیفرانسیل، فرمول (4) دارای فرم است
(5)
دمای نمونه با ترموکوپل T اندازه گیری می شود اختلاف دمای بلوک و نمونه با ترموکوپل دیفرانسیل اندازه گیری می شود. برای تعیین دمای نمونه، از یک منحنی کالیبراسیون ترموکوپل T استفاده می شود. اختلاف دمای بین بلوک و نمونه در تقسیم بندی های مقیاس گالوانومتر تعیین می شود (زیرا فقط لازم است لحظه ای را که اختلاف دما بین بلوک و بلوک وجود دارد ثابت شود. علامت تغییر نمونه).
تکمیل کار.
نمونه بر روی بخاری قرار داده شده در داخل یک بلوک مسی قرار می گیرد. ترموکوپل T را به هم متصل می کند و به نمونه و بلوک متصل می شود. فر با درب بسته می شود. سیم پیچ الکتریکی کوره، که بلوک در آن قرار می گیرد، روشن می شود. بخاری قرار داده شده در داخل نمونه به صورت دوره ای روشن و خاموش می شود و مقادیر I و V در مدار بخاری داخلی ثبت می شود.
قبل از شروع اندازه گیری، لازم است موقعیت صفر گالوانومتر آینه را بررسی کنید. برای انجام این کار، با جدا کردن ترموکوپل از گالوانومتر، انتظار دارند که خرگوش از نوسانات در طول ترازو دست بردارد. اگر بعد از این تصویر نخ منطبق بر صفر نباشد، با حرکت دادن مقیاس این همزمانی حاصل می شود.
منحنی های وابستگی T و به زمان رسم می شوند.
از شیب منحنی T(t) در نقطه ای که علامت تغییر می کند (یعنی زمانی که تعادل حرارتی برقرار می شود)، گرمای ویژه با استفاده از فرمول (5) محاسبه می شود. این ظرفیت گرمایی به دمایی اشاره دارد که باید از منحنی T(t) در لحظه ای که اختلاف دما بین بلوک و نمونه علامت تغییر می کند خوانده شود.
