Método para determinar la capacidad calorífica de un cuerpo sólido.
¿Qué es la CAPACIDAD CALORÍFICA?
Cuando se suministra calor, la temperatura del sistema aumenta. En el caso de un cambio de temperatura infinitamente pequeño, la proporcionalidad es válida
dT=δQ, o dT=constδQ
Es más conveniente escribir esta relación en la forma: δQ=СdT o
El valor C se denomina capacidad calorífica verdadera del sistema.
La capacidad calorífica es la relación entre la cantidad de calor suministrada al sistema y el cambio de temperatura que se produce.
Además de la verdadera, también hay una capacidad calorífica promedio:
Capacidad calorífica
Si la capacidad calorífica se atribuye a una unidad de masa (mol) de una sustancia, entonces se vuelve independiente de la masa de todo el sistema y adquiere las propiedades de un parámetro intensivo. Si la capacidad de calor se refiere a una unidad de masa de una sustancia, se llama específica, y a 1 mol - capacidad de calor con la dimensión de J / (mol * k)
Consideraremos solo las capacidades caloríficas molares, ya que para ellos, todas las regularidades son mucho más simples que para la capacidad calorífica específica.
La capacidad calorífica depende de las condiciones bajo las cuales tiene lugar la transferencia de calor al sistema. Si el sistema está encerrado en un volumen constante, entonces ocurrirá un aumento de temperatura de dT bajo la acción del calor igual a CvdT, donde Cv es la capacidad calorífica a volumen constante. En casos de presión constante durante la expansión del sistema, para aumentar la temperatura en dT, se requerirá calor CpdT, donde Cp es la capacidad calorífica a presión constante.
Dadas las condiciones para la transferencia de calor, cuando una o más variables se mantienen constantes, mientras que otras cambian, la capacidad calorífica se puede expresar mediante derivadas parciales: ![]() . Como δQ v = dU,
. Como δQ v = dU,
δQ p =dH, podemos escribir:
![]() (1)
(1)
Cv es la capacidad calorífica isocórica de los gases, Cp es la capacidad calorífica isobárica de los gases.
Las diferencias entre las capacidades caloríficas isocóricas e isobáricas se deben a la diferencia en energía interna y entalpía. Los cambios en la entalpía y la energía interna difieren según la cantidad de trabajo realizado por el sistema.
δW=∆nRT, ∆H-∆U=∆nRT
Por lo tanto, las capacidades caloríficas a volumen constante Cv y presión constante Cp también difieren según la cantidad de trabajo: Cp - Cv = δW
Con base en las expresiones (1), podemos escribir:
Sustituyendo estas igualdades en la ecuación ∆H- ∆U=∆nRT
y teniendo en cuenta que ∆n= 1, encontraremos la relación entre las capacidades caloríficas molares de los gases:
Cp– Cv= R o Cp= Cv+ R
Como puede verse, se diferencian por el valor de la constante de los gases.
De la condición Cp= Cv+ R se sigue que Cp˃Cv, es decir, en un proceso isobárico, cuando P=const, para aumentar la temperatura del sistema, se requiere gran cantidad calor que en un proceso isocórico.
La capacidad calorífica molar de los gases tiene valores del orden de R, por lo que la diferencia entre Cp y Cv es muy significativa. Entonces, para el dióxido de carbono CO 2 a 25 0 C Cp = 37, 14 y Cv = 28,83 J / (mol * K)
La diferencia Cp - Cv es el trabajo de la expansión isobárica de un mol gas ideal cuando la temperatura sube un grado. Los líquidos y sólidos del cuerpo se caracterizan por un ligero aumento de volumen cuando se calientan. Por lo tanto, para cuerpos condensados, podemos suponer que Ср ≈ Сv.
ECUACIÓN DE KIRCHHOFF. DEPENDENCIA DE LOS EFECTOS TÉRMICOS DE LA TEMPERATURA.
Los cálculos de efectos térmicos basados en la ley de Hess para el calor de formación y combustión considerados anteriormente están limitados por condiciones estándar. A efectos prácticos, es necesario calcular los efectos térmicos para condiciones específicas distintas a las estándar.
Pasar de efectos térmicos conocidos en condiciones estándar, es decir, a una temperatura de 25 0 C (298.15 K) y una presión de 1 atm. (1.013 * 10 5 Pa), es posible calcular los efectos térmicos a cualquier temperatura que nos interese usando ley de Kirchhoff. Los procesos en condiciones industriales se caracterizan por una variación de temperatura significativa, cuyo rango está determinado no solo por las condiciones de la tecnología, sino también por la temporada.Este rango puede alcanzar cientos de grados; es natural que los efectos térmicos sean significativamente diferentes y dependen de la temperatura.
Considere la ley de Kirchhoff en forma diferencial. Para ello, anotamos los cambios de entalpía en procesos isobáricos y de energía interna en procesos isocóricos.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
Derive estas ecuaciones con respecto a la temperatura y obtenga:
Ecuaciones de Kirchhoff:

Y - coeficientes de temperatura del efecto térmico de los procesos isobáricos e isocóricos, respectivamente; y - cambio en la capacidad calorífica del sistema como resultado de procesos isobáricos e isocóricos, respectivamente.
Sobre la base de la ecuación de Kirchhoff, la ley de Kirchhoff se formula en forma diferencial: el coeficiente de temperatura del efecto térmico del proceso es igual al cambio en la capacidad calorífica del sistema que se produce como resultado de este proceso.
Por lo tanto, la ley de Kirchhoff en forma diferencial permite determinar solo el cambio en el efecto térmico con la temperatura y no la magnitud del efecto térmico en sí.
Analicemos la ecuación de Kirchhoff
Para la reacción: aA + bB = dD + rR en un proceso isobárico (р=const), según la ley de Kirchhoff, el cambio de capacidad calorífica en el sistema tendrá la forma:
Se puede obtener una expresión similar para un proceso isocórico:
Dado que la ley de Kirchhoff le permite determinar los cambios en el efecto térmico del proceso con un cambio de temperatura, construimos un gráfico:
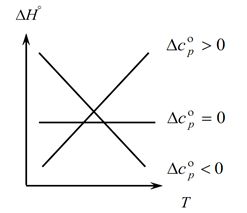
1. Considere el primer caso, cuando ∆Ср(∆Сv)˃0, porque ∆Ср=∑С con. -∑С inicial, por lo tanto, la suma de las capacidades caloríficas de los productos de reacción es mayor que la suma de las capacidades caloríficas de las sustancias iniciales: ∑С con. ˃∑Desde el principio En este caso, obtenemos la curva 1 en el gráfico, lo que significa que a medida que aumenta la temperatura, también aumenta el cambio en el efecto térmico del proceso (T y ∆H);
2. El segundo caso, cuando ∆Ср(∆Сv)˂0. De manera similar a la primera ley, tenemos ∑С con. ˂∑Desde temprano (la suma de las capacidades caloríficas de los productos finales es menor que la suma de las capacidades caloríficas de las sustancias iniciales). Luego obtenemos una curva en el gráfico, lo que significa que con un aumento de la temperatura, el cambio en el efecto térmico del proceso disminuye (Т→∆H↓)
3. Y el tercer caso, cuando el cambio en las capacidades caloríficas del sistema es igual a cero ∆Ср(∆Сv)=0. Entonces, la suma de las capacidades caloríficas de los productos finales de las reacciones es igual a la suma de las capacidades caloríficas de los materiales de partida ∑С con. \u003d ∑ Desde el principio. En este caso, el efecto térmico de la reacción no es función de la temperatura (∆H ≠ f(T)) y obtenemos una línea recta en el gráfico.
CÁLCULO DE EFECTOS TÉRMICOS PARA UN DADO
LA TEMPERATURA. INTEGRACIÓN DE LA ECUACIÓN DE KIRCHHOFF
Para encontrar el valor del efecto térmico en función de la temperatura, es necesario integrar las ecuaciones

De T a T 0 (donde T es la temperatura requerida, T 0 es la temperatura estándar), de ∆H a ∆H 0 o de ∆U a ∆U 0 (donde ∆H y ∆U son la entalpía y la energía interna bajo condiciones que difieren del estándar). La integración se realiza para dos casos:
Para no materia orgánica: Para sustancias orgánicas:
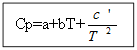
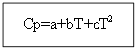
Ejemplo: para H 2 (g) - sustancia inorgánica
| Сr=f(T) | T | |||
| a | b*10 3 | c'*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27.28 + 3.26 * 10 -3 T +.
a) Integración aproximada:
para proceso isobárico
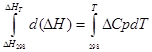
∆H T - ∆H 298 =∆Cp*(T-298)
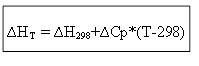
para el proceso isocórico:
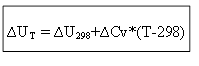
Por lo tanto, para determinar el efecto térmico ∆H o la energía interna ∆U a cualquier temperatura T, es necesario conocer el calor del proceso en condiciones estándar ∆H 0 (∆U 0) y el cambio en las capacidades caloríficas ∆Ср, ∆ CV.
Ejemplo. Calcular el efecto térmico ∆H del proceso de obtención de benceno a partir de acetileno:
3C 2 H 2 (g) → C 6 H 6 (g) a 75 0 C (348K).
1. Encontramos en las tablas las capacidades caloríficas isobáricas molares promedio de benceno y acetileno:
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43.93 J / (mol * K).
2. Encontramos el cambio en la capacidad calorífica del proceso:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) inicial \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 J / (mol * K) .
3. De acuerdo con los datos tabulares, encontramos el efecto térmico en condiciones estándar:
∆H 0 \u003d ∆H 0 y C6H6 (g) - ∆H 0 y C2H2 (g) \u003d 82.93 - 3 * 226.73 \u003d - 597.26 kJ / mol
4. Encuentra el efecto térmico a una temperatura dada:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
b) Integración exacta:
Consideremos el segundo caso, más complicado, cuando el cambio en la capacidad calorífica depende de la temperatura, es decir Сr=f(T), Cv=f(T).
Pasemos a la ecuación de reacción en forma general.
dD + rR = qQ + pP
| a | b*10 3 | c'*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| q | + | + | + | - |
| PAGS | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
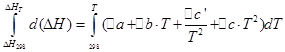
Realizaremos las mismas operaciones para el proceso isocórico:
CALOR DE DISOLUCIÓN
El cambio de entalpía durante la transición de una sustancia sólida, líquida o gaseosa a una solución se llama térmica o entalpía de disolución.
El calor de disolución generalmente incluye el calor de destrucción de la red cristalina (por sólidos), ionización y solvatación.
Para romper el enlace entre los iones de una sal cristalina se necesita energía, es decir mientras se absorbe el calor. Al mismo tiempo, se produce la hidratación de iones en la solución acuosa; se forma un enlace entre los iones y las moléculas de H 2 O. El signo del calor de disolución está determinado por el proceso que es energéticamente más pronunciado.
LiBr: ∆H dist = - 49,02 kJ / mol - se libera calor
KCl: ∆H dist = 7,23 kJ/mol - se absorbe calor
Distinguir: el calor integral de disolución es el calor que se libera o se absorbe cuando se disuelve 1 mol de una sustancia dada para formar una solución de una concentración dada. El calor integral de disolución varía según la cantidad de sustancia disuelta.
Distinguir: calor diferencial de disolución: este es el calor que acompaña a la disolución de 1 mol de una sustancia dada en infinitamente gran volumen solución de esta sustancia. Los calores integrales se utilizan ampliamente para calcular los calores de formación y los calores de otras reacciones de acuerdo con la ley de Hess. Los calores diferenciales de disolución caracterizan las propiedades termodinámicas de las soluciones y el proceso de su formación.
LABORATORIO #8
DETERMINACIÓN DE LA CAPACIDAD CALORÍFICA DE LOS CUERPOS SÓLIDOS
Instrumentos y accesorios: configuración experimental FPT1-8.
Objetivo: determinación de la capacidad calorífica de muestras metálicas por el método calorimétrico utilizando calentamiento eléctrico.
Breve teoría
Capacidad calorífica específica de una sustancia. - un valor igual a la cantidad de calor necesaria para calentar 1 kg de una sustancia en 1 K:
Capacidad calorífica molar - un valor igual a la cantidad de calor necesaria para calentar 1 mol de una sustancia por 1 K:
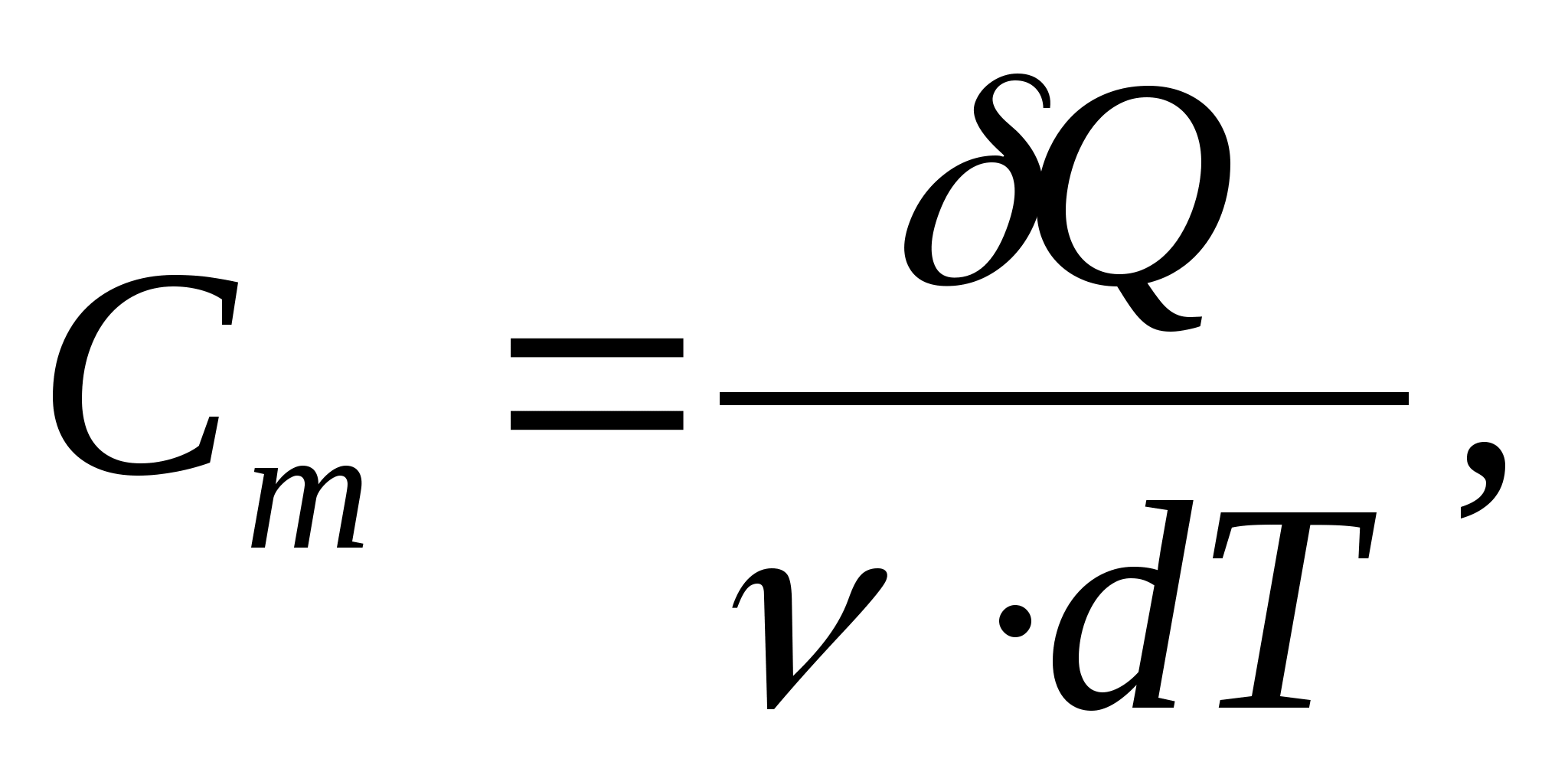
dónde 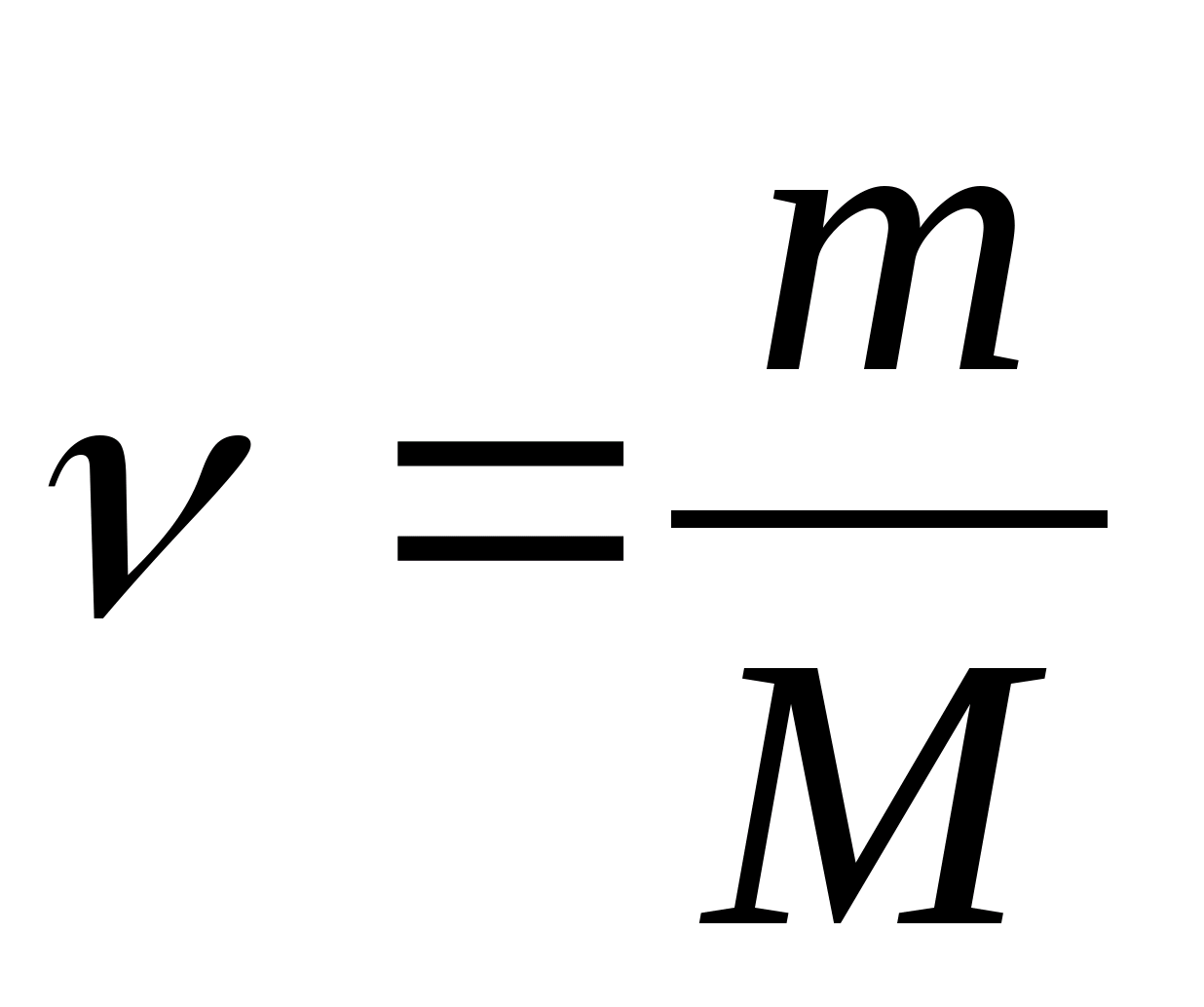 − cantidad de sustancia.
− cantidad de sustancia.
Calor especifico C asociado con molares C metro relación

dónde METRO es la masa molar de la sustancia.
Distinguir capacidad calorífica a volumen constante y presión constante, si en el proceso de calentamiento de una sustancia se mantiene constante su volumen o presión.
El número más pequeño de variables independientes (coordenadas) que determinan completamente la posición del sistema en el espacio se llama número de grados de libertad .
De acuerdo con la ley de Boltzmann sobre la distribución uniforme de la energía sobre los grados de libertad de las moléculas, cada grado de libertad de traslación y rotación tiene una energía cinética promedio igual a
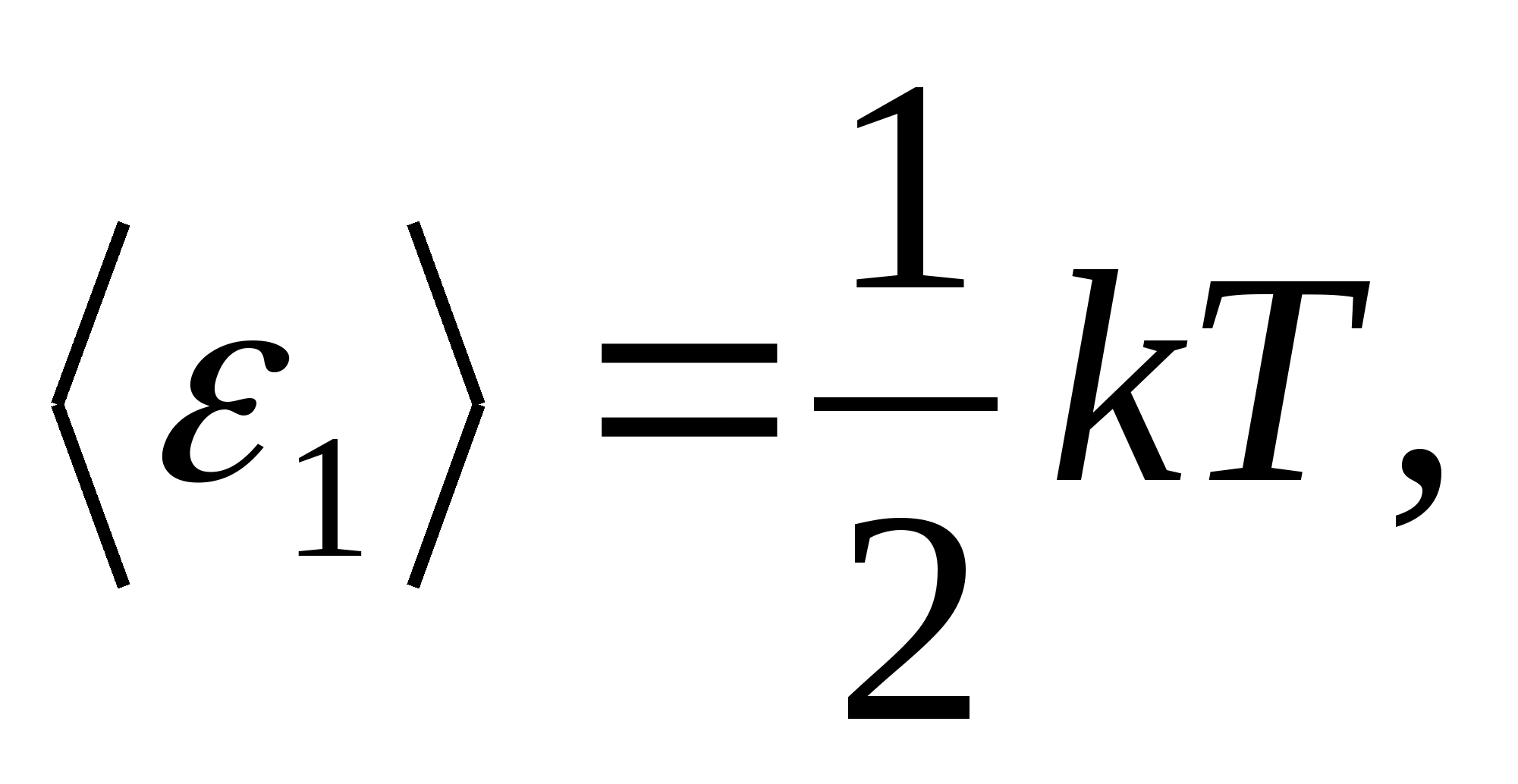
(dónde k es la constante de Boltzmann), y para cada grado de libertad vibratorio, en promedio, la energía igual a
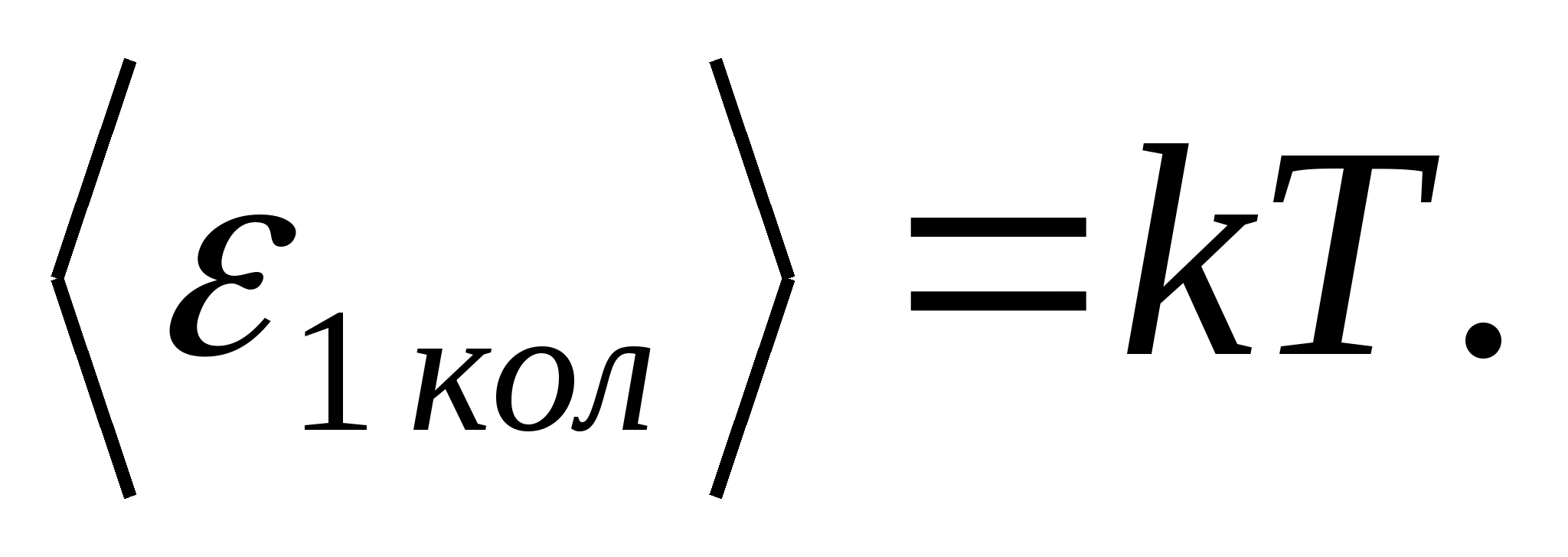
Así, la energía media de una molécula
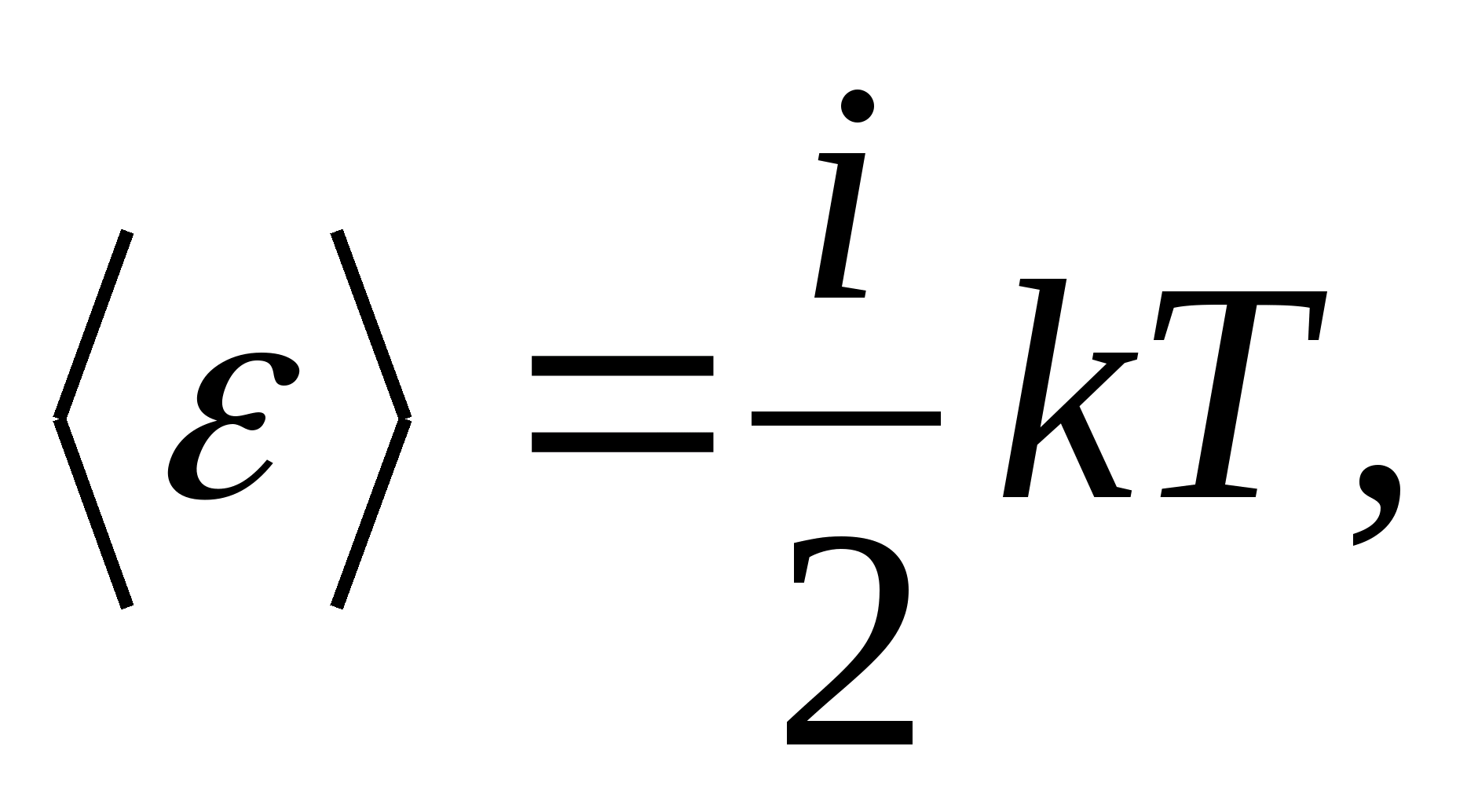
dónde i es la suma del número de traslacionales, el número de rotacionales y el doble del número de grados de libertad vibracionales de la molécula:
![]()
Por ejemplo, la energía cinética promedio de las moléculas de un gas ideal monoatómico ( 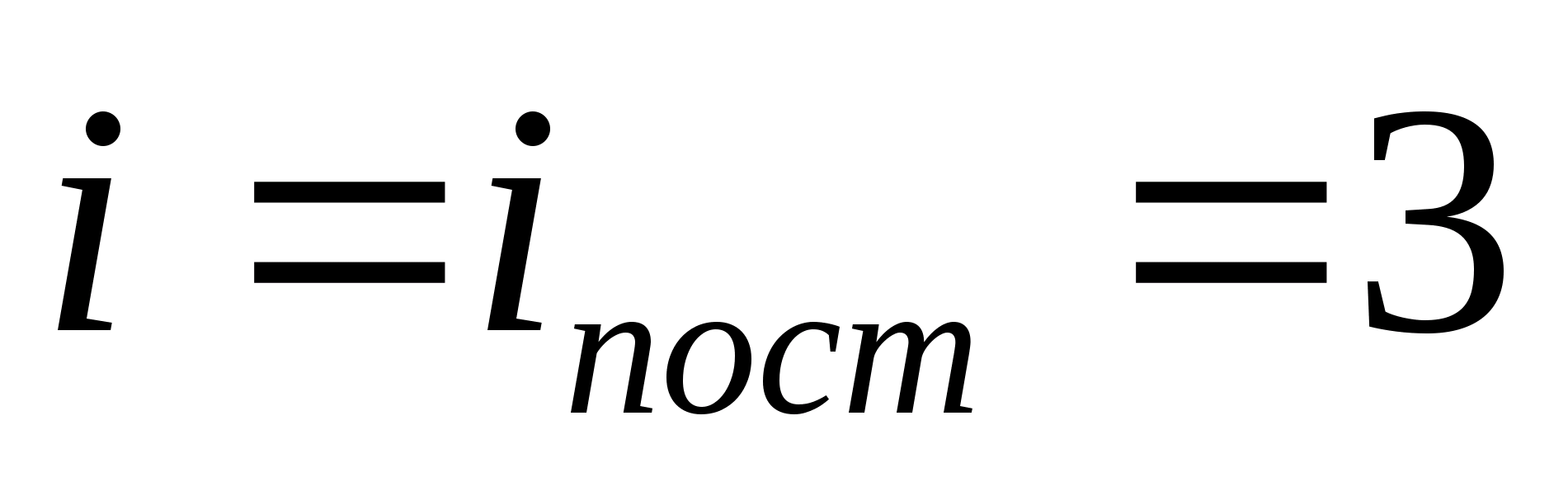 ) es igual a
) es igual a
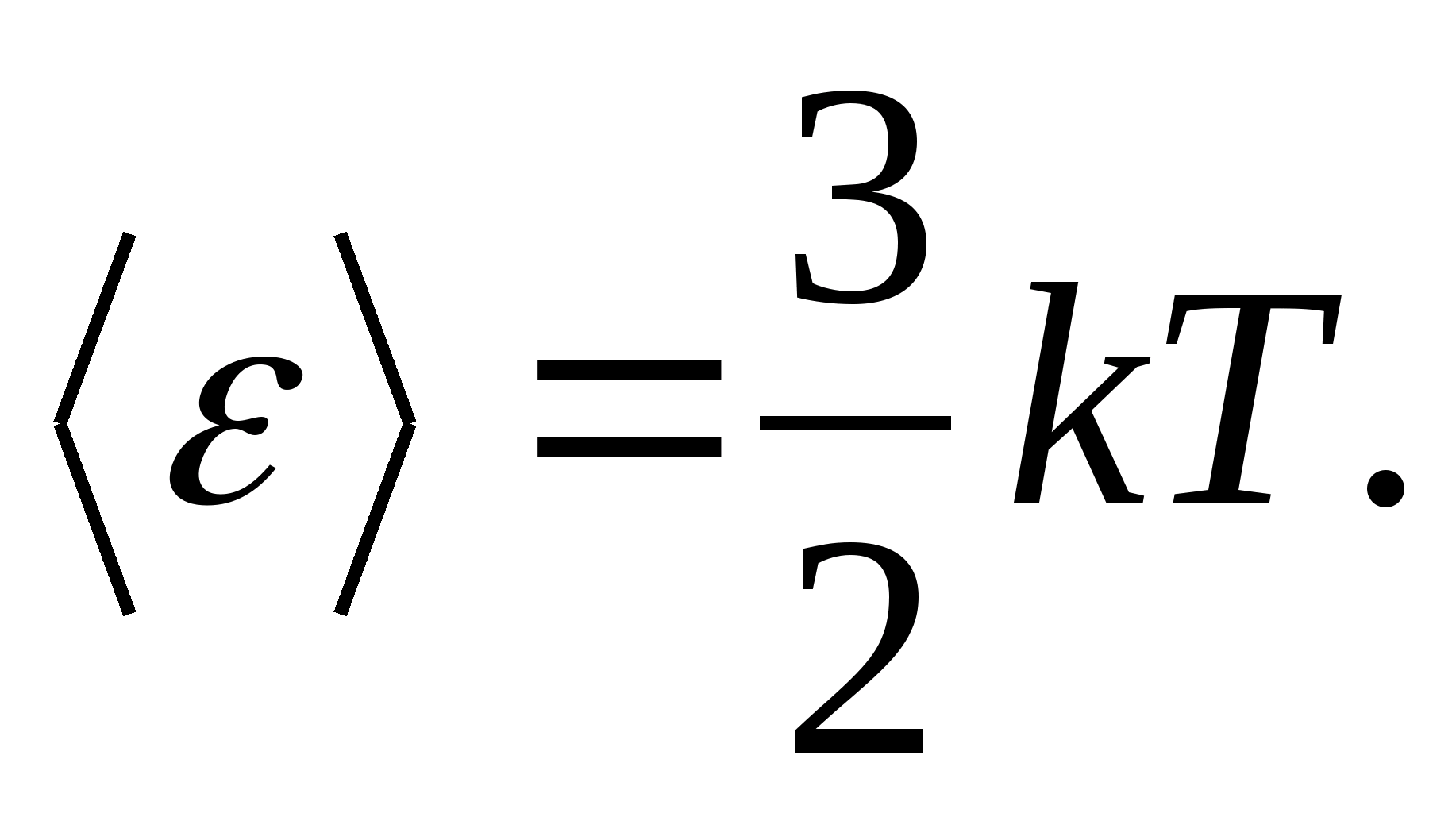
Como modelos de un cuerpo sólido, considere una red cristalina correctamente construida, en los nodos de los cuales las partículas (átomos, iones, moléculas) se toman como puntos materiales, oscilan alrededor de sus posiciones de equilibrio - nudos reticulares - en tres direcciones mutuamente perpendiculares. Así, a cada partícula que constituye la red cristalina se le asignan tres grados de libertad vibratorios, cada uno de los cuales, según la ley de la distribución uniforme de la energía en grados de libertad, tiene la energía kT.
Entonces el valor promedio de la energía total de la partícula durante el movimiento oscilatorio en la red cristalina
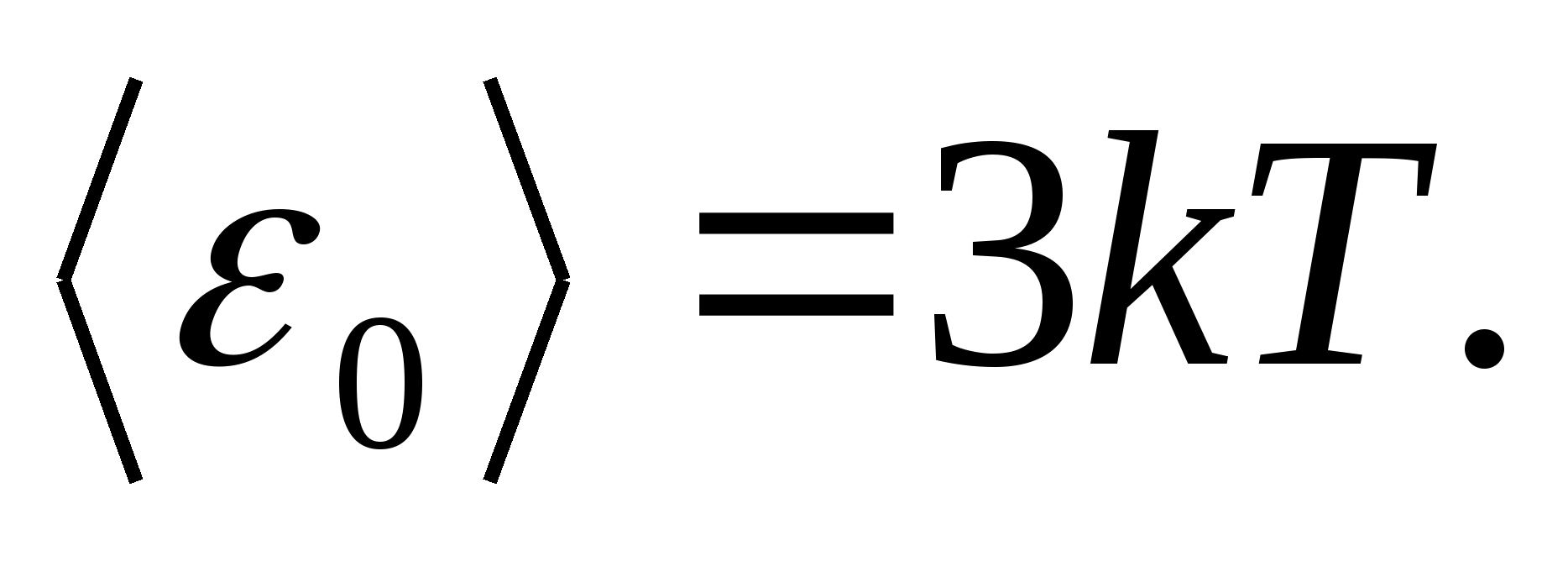
La energía interna total de un mol de un cuerpo sólido se obtiene multiplicando la energía promedio de una partícula por el número de partículas que vibran independientemente contenidas en un mol, es decir a la constante de Avogadro norte A :
dónde R=N A k es la constante universal (molar) de los gases, R= 8,31 J/(molK).
Para los sólidos, debido al pequeño coeficiente de expansión térmica, las capacidades caloríficas a presión constante y volumen constante prácticamente no difieren. Por tanto, teniendo en cuenta (8.1), la capacidad calorífica molar de un sólido
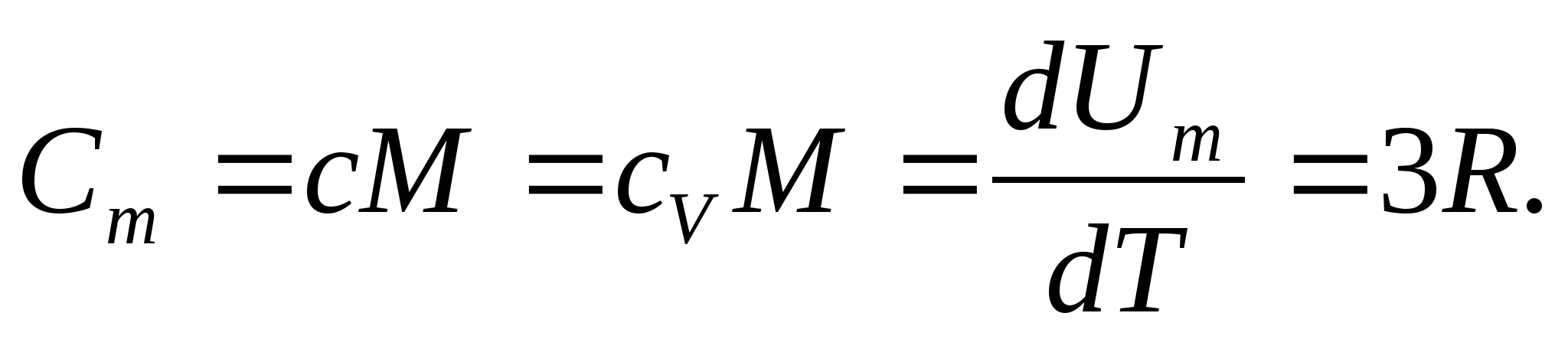 (8.2)
(8.2)
Sustituyendo el valor numérico de la constante molar de los gases, obtenemos:
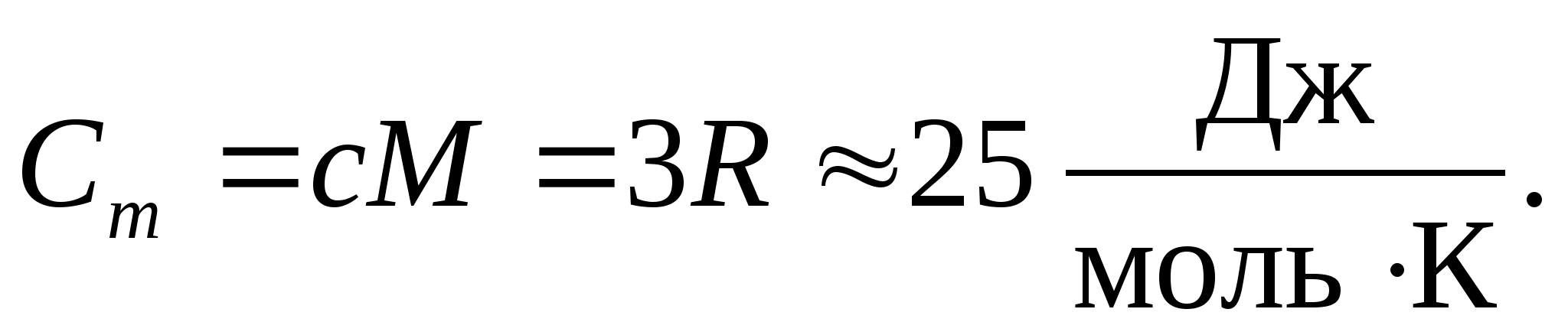
Esta igualdad tiene una aproximación bastante buena para muchas sustancias a temperatura ambiente y se llama Ley de Dulong y Petit : capacidad calorífica molar de todos los cristalinos químicamente simples sólidos aproximadamente igual a 25 J/(mol A). A medida que la temperatura disminuye, las capacidades caloríficas de todos los sólidos disminuyen, acercándose a cero en T0. Cerca del cero absoluto, la capacidad calorífica molar de todos los cuerpos es proporcional a T 3, y sólo a una temperatura suficientemente alta característica de cada sustancia comienza a mantenerse la igualdad (8.2). Estas características de las capacidades caloríficas de los sólidos a bajas temperaturas se pueden explicar utilizando la teoría cuántica de la capacidad calorífica creada por Einstein y Debye.
Para determinar experimentalmente la capacidad calorífica, el cuerpo en estudio se coloca en un calorímetro, que se calienta con una corriente eléctrica. Si la temperatura del calorímetro con la muestra de prueba se incrementa muy lentamente desde la inicial T 0 a T, entonces la energía de la corriente eléctrica se utilizará para calentar la muestra y el calorímetro:
dónde yo y tu− corriente y voltaje del calentador; − tiempo de calentamiento; metro 0 y metro son las masas del calorímetro y la muestra de prueba, Con 0 y Con− capacidades caloríficas específicas del calorímetro y muestra de prueba, q− pérdida de calor al aislamiento térmico del calorímetro y al espacio circundante.
Para excluir de la ecuación (8.3) la cantidad de calor gastado al calentar el calorímetro y la pérdida de calor al espacio circundante, es necesario, con la misma potencia del calentador, calentar el calorímetro vacío (sin muestra) desde la temperatura inicial T 0 para la misma diferencia de temperatura T. La pérdida de calor en ambos casos será casi la misma y muy pequeña, si la temperatura de la carcasa protectora del calorímetro en ambos casos es constante e igual a la temperatura ambiente:
Las ecuaciones (8.3) y (8.4) implican
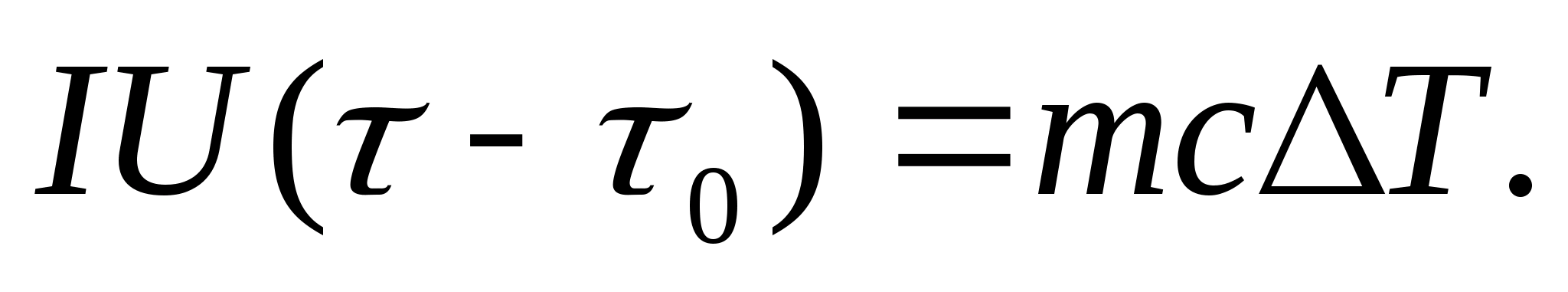 (8.5)
(8.5)
La ecuación (8.5) se puede usar para determinar experimentalmente la capacidad calorífica específica del material de la muestra de prueba. Al cambiar la temperatura del calorímetro, es necesario trazar la dependencia de la diferencia en el tiempo de calentamiento del cambio de temperatura de la muestra de prueba: (
−
0)=F(T), según el coeficiente angular del cual 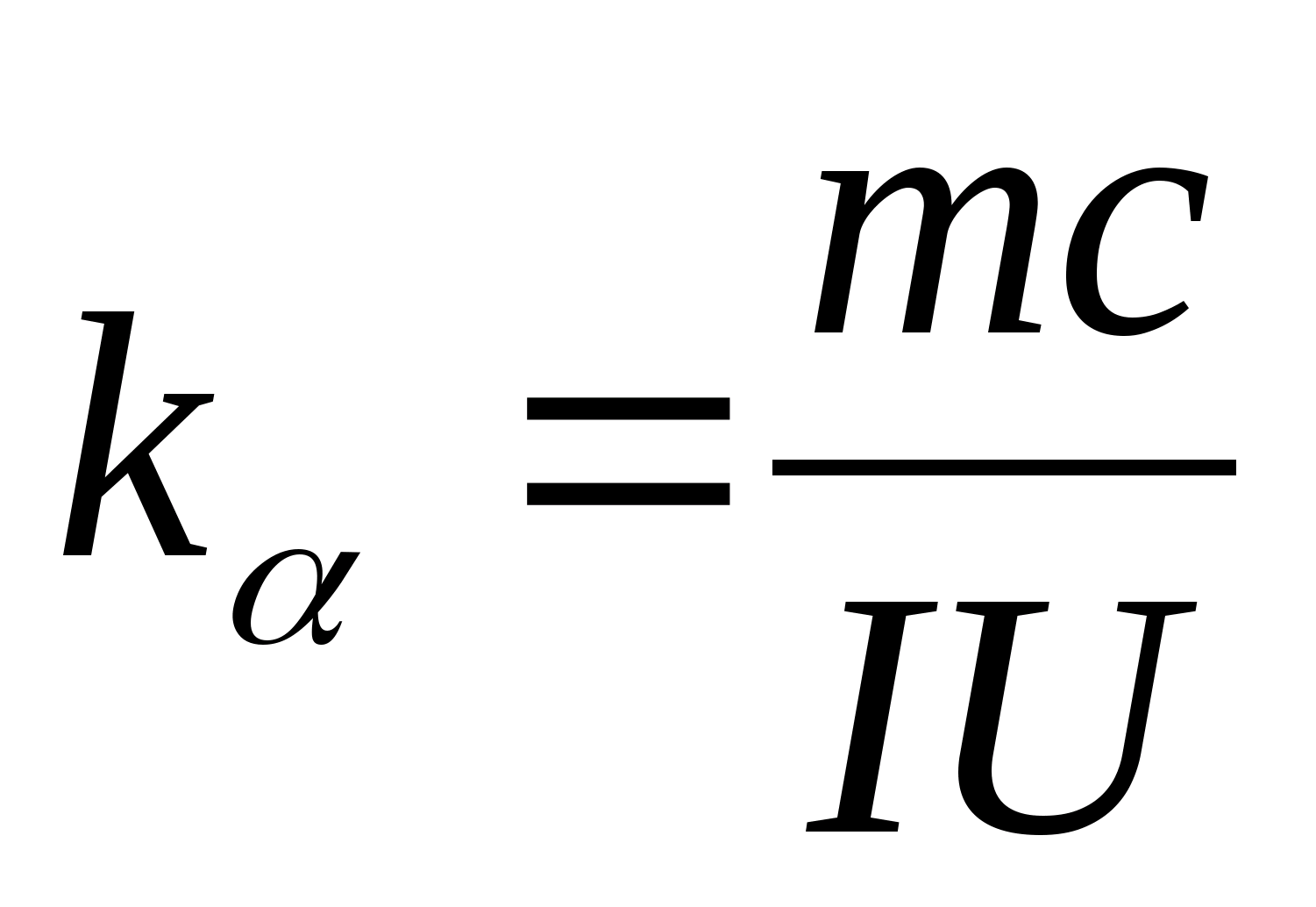 se puede determinar la capacidad calorífica específica de la muestra.
se puede determinar la capacidad calorífica específica de la muestra.
Descripción de la instalación del laboratorio.
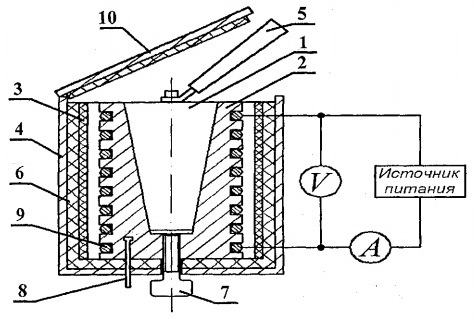
Para determinar la capacidad calorífica de los sólidos, se diseña el montaje experimental FPT1-8, cuya vista general se muestra en la Fig. 8.1. La instalación consta de tres partes principales: unidad instrumental 1, unidad de elementos operativos 2 y bastidor 3.
En el panel frontal de la unidad de control 1 se encuentran: el interruptor de palanca "RED", que conecta la unidad a la red de tensión de alimentación; interruptor de palanca "CALEFACCIÓN", que enciende el calentador; el regulador "CALEFACCIÓN", con la ayuda del cual se regula la potencia del calentador; voltímetro y amperímetro, que miden el voltaje y la corriente en el circuito del calentador; cronómetro, que mide el tiempo de calentamiento del calorímetro. El cronómetro se activa cuando se enciende la unidad del instrumento.
El bloque del elemento de trabajo 2 está cerrado en el frente con una pantalla extraíble de org. vidrio. Al realizar el trabajo, la pantalla se cuelga en la pared posterior del bloque del elemento de trabajo. En el bloque del panel del elemento de trabajo hay un termómetro digital 6 para medir la temperatura. En la parte inferior, en los nidos, hay 5 muestras de prueba hechas de varios materiales y un asa para colocar las muestras en el calentador.
El calentador 4 consta de una carcasa de metal, material termoaislante y un calorímetro.

Las muestras se calientan en un calorímetro, cuyo esquema se muestra en la Fig. 8.2.
El calorímetro es una caja de latón 2 con un orificio cónico, donde se inserta la muestra de prueba 1. En la superficie exterior de la caja, se coloca una bobina de calentamiento 9 en ranuras especiales. En el exterior, la caja del calorímetro está aislada térmicamente con capas de asbesto. 3 y fibra de vidrio 6 y cerrado con una carcasa de aluminio 4. El calorímetro está cerrado con una cubierta termoaislante 10. Después del final del experimento, la muestra se puede empujar fuera del orificio cónico del cuerpo del calorímetro con la ayuda de tornillo 7. Para retirar la muestra calentada del calorímetro e instalar la muestra en el calentador, se usa el mango 5, ubicado en un zócalo especial al lado de las muestras en estudio.
La temperatura del calorímetro se mide mediante un termómetro digital, cuyo sensor de temperatura 8 está situado en la carcasa 2 del calorímetro.
La seguridad
Al realizar el trabajo, se observan los requisitos generales de seguridad en el laboratorio de mecánica.
Orden de trabajo
¡ATENCIÓN! El calorímetro tarda mucho en enfriarse, por lo que después de medir todos los valores de tiempo 0 calentamiento de un calorímetro vacío, apague inmediatamente el calentamiento (consulte el punto 4 a continuación). La temperatura máxima de calefacción para esta unidad es +44С.
1. Retire la cubierta transparente de la unidad del elemento de trabajo de la instalación y cuélguela en los tornillos del panel posterior. Ajuste la perilla de control de CALOR al mínimo. Encienda la instalación con el interruptor de palanca "RED".
2. Cierre bien la tapa del calorímetro vacío. Encienda el interruptor de palanca "HEAT". Usando el regulador HEAT, ajuste el voltaje a 10-20 V (cuanto mayor sea el voltaje, más rápido se calentará). Escribe en la tabla. 8.1 valores de tensión seleccionados tu y actual yo.
3. A partir de la temperatura del calorímetro t 0 especificado por el profesor, después de un intervalo de 1С ingrese en la tabla. 8.1 valores de tiempo 0 correspondiente a cada temperatura alcanzada t.
4. Apague el interruptor de palanca "HEAT", abra la tapa y enfríe el calorímetro a la temperatura inicial t 0 Para enfriar rápidamente el calorímetro, puede bajar una de las muestras en el calorímetro, excepto la indicada por el maestro (al instalar la muestra en el calorímetro, gire el tornillo en la parte inferior del calorímetro hacia la izquierda). La temperatura comenzará a bajar. Cuando la velocidad de enfriamiento disminuya, retire la muestra calentada e inserte la siguiente (fría), excepto la indicada por el profesor. Para retirar la muestra, gire el tornillo en la parte inferior del calorímetro hacia la derecha (en el sentido de las agujas del reloj) y luego extraiga la muestra con el asa.
Tabla 8.1
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C metro =ConMETRO, J/(molK) |
||||||||
5. Girando el tornillo hacia la izquierda, coloque una de las muestras de prueba, tomada según las instrucciones del maestro, en el calorímetro. Cierre bien la tapa del calorímetro y espere de 2 a 3 minutos para que se igualen las temperaturas del calorímetro y de la muestra.
6. Encienda el interruptor de palanca "HEAT" y configure el mismo voltaje en el circuito que cuando calienta el calorímetro vacío.
7. Partiendo de la misma temperatura calorimétrica inicial t 0, después de un intervalo de 1С ingrese en la tabla. 8.1 valores de tiempo correspondiente a cada temperatura alcanzada t.
8. Coloque el regulador de "CALENTAMIENTO" en la posición extrema izquierda (al mínimo), apague el interruptor de palanca de "CALENTAMIENTO", abra la tapa del calorímetro. Para retirar la muestra del calorímetro, gire el tornillo hacia la derecha y luego retire la muestra calentada con el mango.
9. Apague la unidad con el interruptor de palanca "RED".
10. Traducir todos los valores de las cantidades 0 y en valores en segundos (sin minutos) e ingresarlos en la tabla. 8.1. Para cada línea de la tabla. 8.1 calcular los valores de = − 0 y T= t− t 0 .
11. Haga un cálculo estimado de la capacidad calorífica específica de la muestra usando la fórmula 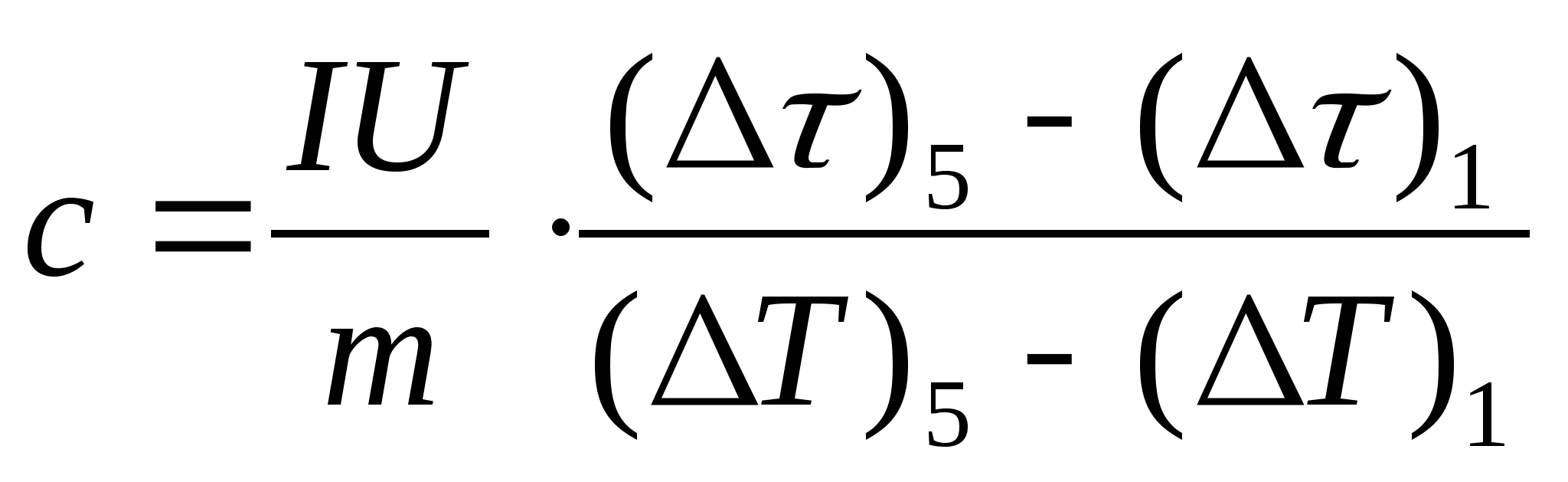 , donde la masa de la muestra metro=139,5 g (latón) o metro=129,7 g (acero) o
metro=46,05 g (duraluminio). Ven al maestro para la verificación.
, donde la masa de la muestra metro=139,5 g (latón) o metro=129,7 g (acero) o
metro=46,05 g (duraluminio). Ven al maestro para la verificación.
Procesamiento de resultados de medición
1. Trama
=f(T) la dependencia de la diferencia en el tiempo de calentamiento del calorímetro con la muestra y el calorímetro vacío en el cambio de temperatura del calorímetro, seleccione dos puntos cualquiera en el gráfico y determine la pendiente de la línea recta utilizando la fórmula 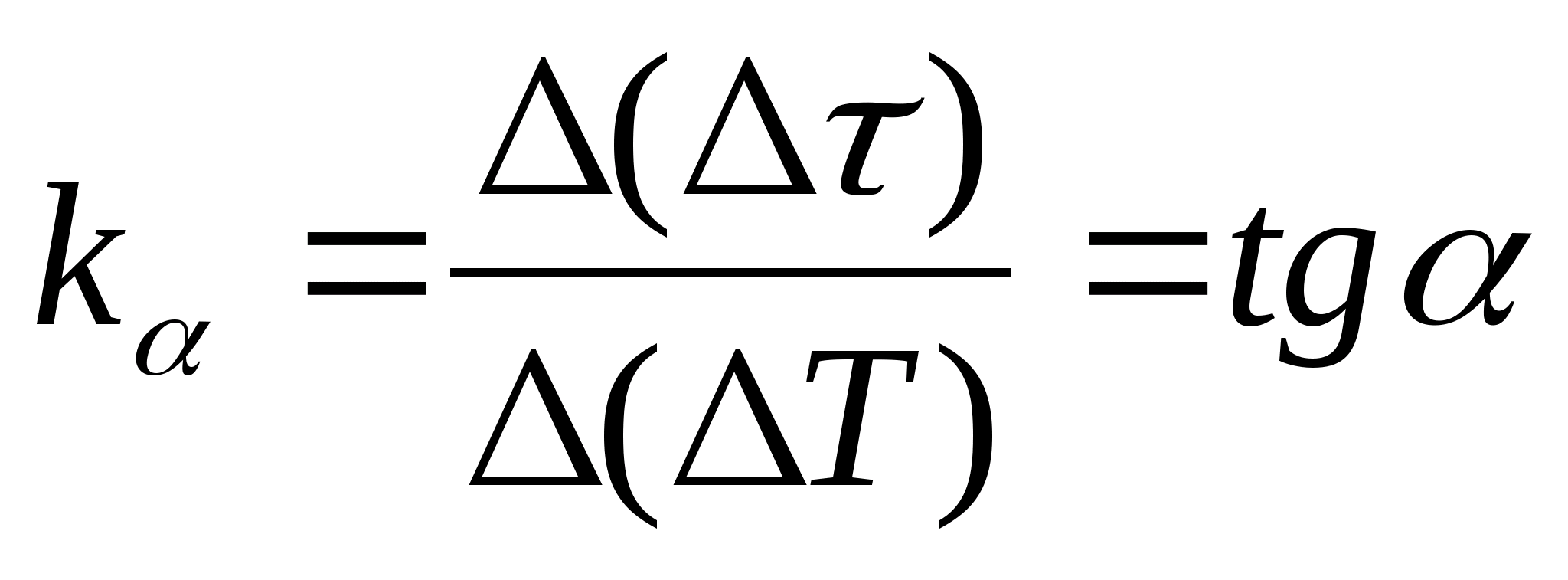 , dónde
− el ángulo de inclinación de la gráfica respecto al eje T
(si las unidades de
y T se muestran en ambos ejes como segmentos de la misma longitud).
, dónde
− el ángulo de inclinación de la gráfica respecto al eje T
(si las unidades de
y T se muestran en ambos ejes como segmentos de la misma longitud).
2. Usando el valor de la pendiente k
, determine la capacidad calorífica específica de la muestra usando la fórmula 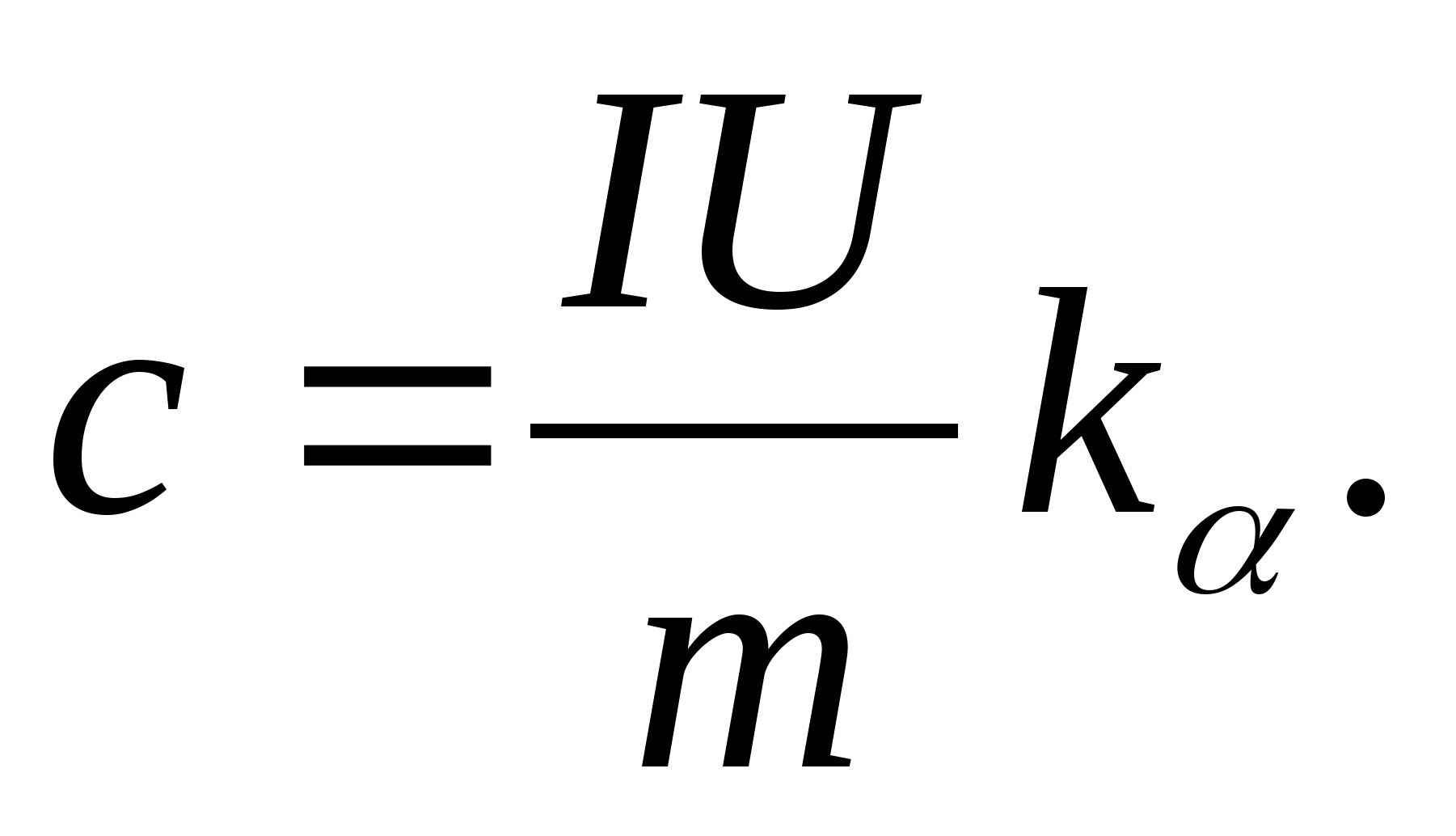
3. Usando los datos de la tabla 8.2 (o la tabla periódica), determine la capacidad calorífica molar de la muestra usando la fórmula C metro =ConMETRO.
Tabla 8.2
|
material de muestra |
Masa atómica, kg/mol |
|
Como modelo de un cuerpo sólido, consideremos una red cristalina correctamente construida, en cuyos nodos las partículas (átomos, iones, moléculas), tomadas como puntos materiales, oscilan alrededor de sus posiciones de equilibrio - nodos de red - en tres direcciones mutuamente perpendiculares . Así, a cada partícula que constituye la red cristalina se le asignan tres grados de libertad vibratorios, cada uno de los cuales, de acuerdo con la ley de equipartición de energía sobre grados de libertad (ver § 50), tiene la energía kT.
Energía interna de un mol de un cuerpo sólido
U m \u003d 3N A kT \u003d 3RT,
donde N A es la constante de Avogadro; norte A k= R (R es la constante molar de los gases).
Capacidad calorífica molar de un sólido
es decir, capacidad calorífica molar (atómica) cuerpos químicamente simples en el estado cristalino es el mismo (igual a 3 R) y no depende de la temperatura. Esta ley fue obtenida empíricamente por los científicos franceses P. Dulong (1785-1838) y L. Petit (1791-1820) y es títuloLey de Dulong y Petit.
Si el sólido es un compuesto químico (por ejemplo, NaCl), entonces el número de partículas en el mol no es igual a la constante de Avogadro, pero es igual a nN A , dónde norte - número de átomos en una molécula (para NaCl, el número de partículas en un mol es 2 norte y, por lo tanto, un mol de NaCl contiene átomos de N A Na y átomos de N A Cl). Entonces la capacidad calorífica molar compuestos químicos sólidos
C V \u003d 3R25n J / (mol K),
es decir, igual a la suma de las capacidades caloríficas atómicas de los elementos que forman este compuesto.
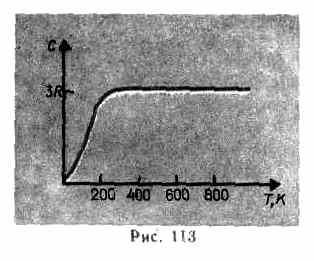
Como muestran los datos experimentales (Tabla 4), para muchas sustancias la ley de Dulong y Petit se cumple con una aproximación bastante buena, aunque algunas sustancias (C, Be, B) tienen desviaciones significativas de las capacidades caloríficas calculadas. Además, como en el caso de los gases (ver § 53), los experimentos sobre la medición de la capacidad calorífica de los sólidos a bajas temperaturas han demostrado que depende de la temperatura (Fig. 113). Cerca de cero Kelvin, la capacidad calorífica de los cuerpos es proporcional a T 3 , y sólo a temperaturas suficientemente altas, características de cada sustancia, se satisface la condición (73.1). El diamante, por ejemplo, tiene una capacidad calorífica de 3 R a 1800 K! Sin embargo, para la mayoría de los sólidos, la temperatura ambiente ya es lo suficientemente alta.
La discrepancia entre los valores experimentales y teóricos de las capacidades caloríficas calculadas en
la base de la teoría clásica, explicada, basada en la teoría cuántica de las capacidades caloríficas, A. Einstein y P. Debye (1884-1966).
§ 74. Evaporación, sublimación, fusión y cristalización. Cuerpos amorfos
Tanto en los líquidos como en los sólidos, siempre hay un cierto número de moléculas cuya energía es suficiente para vencer la atracción de otras moléculas y que pueden desprenderse de la superficie de un líquido o sólido y pasar al espacio que las rodea. Este proceso para líquidos se llama evaporación(o vaporización), para sólidos - sublimación(o sublimación).
La evaporación de los líquidos ocurre a cualquier temperatura, pero su intensidad aumenta al aumentar la temperatura. Junto con el proceso de evaporación, tiene lugar un proceso de compensación. condensación vapor a líquido. Si el número de moléculas que salen del líquido por unidad de tiempo a través de una unidad de superficie es igual al número de moléculas que pasan de vapor a líquido, entonces balance dinámico entre los procesos de evaporación y condensación. Un vapor en equilibrio con su líquido se llama rico(ver también § 62).
Para la mayoría de los sólidos, el proceso de sublimación a temperaturas ordinarias es insignificante y la presión de vapor sobre la superficie del sólido es baja; aumenta con el aumento de la temperatura. Sublima intensamente sustancias como la naftalina, el alcanfor, que se detecta por un olor fuerte y característico. La sublimación ocurre de manera especialmente intensa en el vacío; esto se usa para hacer espejos. Un ejemplo bien conocido de sublimación es la transformación del hielo en vapor: la ropa mojada se seca con el frío.
Si se calienta un cuerpo sólido, entonces energía interna(la suma de la energía de las vibraciones de las partículas en los sitios de la red y la energía de interacción de estas partículas) aumenta. A medida que aumenta la temperatura, la amplitud de las oscilaciones de las partículas
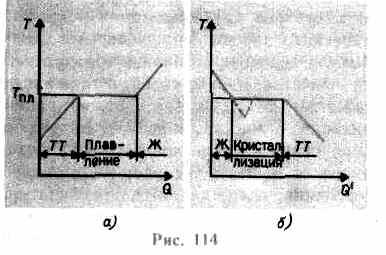
aumenta hasta que la red cristalina colapsa - el sólido se derrite. En la fig. 114 a se muestra una dependencia aproximada T(q), dónde q- la cantidad de calor recibido por el cuerpo durante la fusión. Como el mensaje al sólido calor corporal su temperatura aumenta, y en el punto de fusión T pl comienza la transición del cuerpo de un estado sólido a un estado líquido. La temperatura T pl permanece constante hasta que todo el cristal se derrite, y solo entonces la temperatura del líquido comienza a aumentar nuevamente.
Calentar un sólido hasta T pl aún no lo convierte en estado líquido, ya que la energía de las partículas de la sustancia debe ser suficiente para destruir la red cristalina. En el proceso de fusión, el calor impartido a la sustancia se usa para realizar un trabajo sobre la destrucción de la red cristalina y, por lo tanto, T pl = constante hasta que se funde todo el cristal. Entonces el calor aportado irá de nuevo a aumentar la energía de las partículas del líquido y su temperatura empezará a subir. La cantidad de calor necesaria para fundir 1 kg de una sustancia se denomina calor específico de fusión.
Si el líquido se enfría, el proceso continúa en la dirección opuesta (Fig. 114, b; q" - la cantidad de calor emitido por el cuerpo durante la cristalización): primero, la temperatura del líquido disminuye, luego a una temperatura constante igual a T pl, comienza cristalización, después de su finalización, la temperatura del cristal comienza a disminuir. Para la cristalización de una sustancia, la presencia de los llamados centros de cristalizacion - núcleos cristalinos, que pueden ser no solo cristales de la sustancia formada, sino también impurezas, así como polvo, hollín, etc. La ausencia de centros de cristalización en un líquido puro dificulta la formación de cristales microscópicos, y la sustancia, permanece en estado líquido, se enfría a una temperatura inferior a la temperatura de cristalización, formando así liquido sobreenfriado(en 114, b corresponde a la curva discontinua). Con un fuerte sobreenfriamiento, comienza la formación espontánea de centros de cristalización y la sustancia cristaliza con bastante rapidez.
Por lo general, el sobreenfriamiento de la masa fundida ocurre desde fracciones hasta decenas de grados, pero para varias sustancias puede alcanzar cientos de grados. Debido a la alta viscosidad, los líquidos altamente sobreenfriados pierden su fluidez y conservan su forma, como los sólidos. Estos cuerpos se llaman sólidos amorfos; estos incluyen resinas, cera, lacre, vidrio. Los cuerpos amorfos, siendo así líquidos sobreenfriados, isotrópico, es decir, sus propiedades son las mismas en todas las direcciones; para ellos, al igual que para los líquidos, es característico orden de corto alcance en la disposición de las partículas; en ellos, a diferencia de los líquidos, la movilidad de las partículas es bastante pequeña. Una característica de los cuerpos amorfos es que no tienen un punto de fusión específico, es decir, es imposible indicar una temperatura específica por encima de la cual se pueda determinar un estado líquido y por debajo de un estado sólido. Por experiencia se sabe que en los cuerpos amorfos se puede observar el proceso de cristalización a lo largo del tiempo, por ejemplo, aparecen cristales en el vidrio; éste, perdiendo transparencia, comienza a enturbiarse y convertirse en un cuerpo policristalino.
Recientemente, el uso generalizado en economía nacional obtuvo polímeros- cuerpos amorfos orgánicos, cuyas moléculas consisten en una gran cantidad de cadenas moleculares largas idénticas conectadas por enlaces químicos (valencia). Los polímeros incluyen sustancias orgánicas naturales (almidón, proteína, caucho, fibra, etc.) y artificiales (plástico, caucho, poliestireno, lavsan, nailon, etc.). Los polímeros son resistencia y elasticidad inherentes; algunos polímeros resisten un estiramiento de 5 a 10 veces su longitud original. Esto se explica por el hecho de que las cadenas moleculares largas pueden, bajo deformación, doblarse en bolas densas o estirarse en líneas rectas. La elasticidad de los polímeros se manifiesta solo en un cierto rango de temperatura, por debajo del cual se vuelven duros y quebradizos, y por encima, plástico. Aunque se han creado muchos materiales poliméricos sintéticos (fibras artificiales, sustitutos del cuero, materiales de construcción, sustitutos de metales, etc.), la teoría de los polímeros aún no se ha desarrollado por completo. Su desarrollo está determinado por las exigencias de la tecnología moderna, que requiere la síntesis de polímeros con propiedades predeterminadas.
La capacidad calorífica específica de una sustancia se entiende como el valor
, (1)
donde es la cantidad de calor impartida al cuerpo.
es el cambio de temperatura que se produce en
como resultado de la transferencia de calor al cuerpo,
m es la masa del cuerpo calentado.
La experiencia suele determinar el promedio calor especifico sustancia c, numéricamente igual a la cantidad de calor que debe impartirse a una unidad de masa de esta sustancia para elevar su temperatura en:
(2),
donde es la diferencia entre las temperaturas final e inicial del cuerpo en estudio.
Se utilizan varios métodos calorimétricos para determinar experimentalmente la capacidad calorífica. La variedad de estos métodos se debe al hecho de que la medición precisa de la cantidad de calor impartida al cuerpo requiere la eliminación de pérdidas de calor que no se tienen en cuenta al calentar el cuerpo en estudio.
Habitualmente, en los llamados calorímetros de coraza isotérmica se introduce una corrección calculada o determinada experimentalmente por radiación, es decir, la cantidad de calor que el calorímetro recibe o cede al medio exterior por radiación durante el experimento.
Sin embargo, es posible reducir significativamente las pérdidas de calor introduciendo un buen aislamiento térmico o reduciendo la duración del experimento, lo que se logra mediante una alta tasa de calentamiento de la muestra ~ (método de pulso para medir la capacidad calorífica), a la cual las pérdidas de calor se reducirán. ser pequeño en comparación con la cantidad total de calor suministrado.
Uno de los métodos más precisos para determinar la capacidad calorífica es el método del calorímetro adiabático. Las dificultades asociadas con la necesidad de tener en cuenta las pérdidas de calor en calorímetros de este tipo se eliminan por el hecho de que las mediciones se realizan en condiciones de equilibrio térmico, es decir, en condiciones de igualdad de temperaturas de la muestra en estudio y el bloque que rodea la muestra. . Las ventajas de este método, junto con la alta precisión, también incluyen la posibilidad de determinar la capacidad calorífica de los sólidos en un amplio rango de temperatura, lo que es especialmente importante si las sustancias sufren transformaciones de fase.
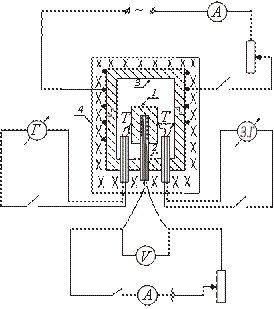
El dispositivo de uno de los tipos de calorímetro adiabático se muestra esquemáticamente en la figura. La muestra de prueba 1 se coloca en el bloque de cobre 3 y junto con ella se calienta en el horno 4. El calentador 2 se introduce dentro de la muestra, lo que permite un calentamiento adicional de la muestra.
Después de encender el horno 4, en el que se coloca el bloque con la muestra, la temperatura de la muestra comienza a subir, quedando por debajo de la temperatura del bloque. Para establecer la igualdad entre las temperaturas de la muestra y el bloque, encienda el calentador colocado dentro de la muestra. Cuando la temperatura de la muestra está ligeramente por encima de la temperatura del bloque, el calentador interno se apaga.
Posteriormente, este calentador se enciende y apaga periódicamente, de modo que la diferencia de temperatura entre la muestra y el bloque cambia de signo todo el tiempo.
En el momento en que es igual a cero (cuando el calentador interno está encendido), no hay intercambio de calor entre la muestra y el bloque, y todo el calor liberado por el calentador interno se gasta solo en calentar la muestra; el calor específico en este caso se puede determinar mediante la fórmula (2).
La cantidad de calor liberado por el calentador interno está determinada por la fórmula:
donde I es la corriente del calentador interno;
V es la caída de voltaje a través de él;
- el intervalo de tiempo durante el cual la temperatura aumentó en .
Después
(4)
donde es el tiempo durante el cual la temperatura de la muestra cambió en .
En forma diferencial, la fórmula (4) tiene la forma
(5)
La temperatura de la muestra se mide con un termopar T. La diferencia de temperatura entre el bloque y la muestra se mide con un termopar diferencial. Para determinar la temperatura de la muestra se utiliza una curva de calibración de termopar T. La diferencia de temperatura entre el bloque y la muestra se determina en divisiones de la escala del galvanómetro (ya que solo es necesario fijar el momento en que la diferencia de temperatura entre el bloque y la muestra la muestra cambia de signo).
Finalización de la obra.
La muestra se pone en un calentador colocado dentro de un bloque de cobre. Las uniones de termopar T y están conectadas a la muestra y al bloque. El horno está cerrado con una tapa. Se enciende el devanado eléctrico del horno, en el que se coloca el bloque. El calentador colocado dentro de la muestra se enciende y apaga periódicamente, y los valores de I y V se registran en el circuito del calentador interno.
Antes de comenzar las mediciones, es necesario verificar la posición cero del galvanómetro de espejo. Para ello, al desconectar el termopar del galvanómetro, esperan que el conejito deje de fluctuar a lo largo de la escala. Si después de esto la imagen del hilo no coincide con el cero, entonces al mover la escala se logra esta coincidencia.
Se trazan las curvas de dependencia de T y del tiempo.
A partir de la pendiente de la curva T(t) en el punto donde cambia de signo (es decir, cuando se establece el equilibrio térmico), se calcula el calor específico mediante la fórmula (5). Esta capacidad calorífica se refiere a la temperatura a leer en la curva T(t) en el momento en que la diferencia de temperatura entre el bloque y la muestra cambia de signo.
