مخاليط الغاز. السعة الحرارية للغازات. الوقود ومخاليط الغاز والسعة الحرارية
1.3 معادلة الغاز المثالية للدولة
شكل معادلات الحالة (1.1) للمواد الحقيقية معقد نوعًا ما.
في هذا الصدد ، يتم استخدام النماذج الفيزيائية المبسطة للأجسام العاملة في الديناميكا الحرارية.
بالنسبة لسوائل العمل في الحالة الغازية ، فإن النموذج الأبسط والأول تاريخيًا هو غاز مثالي. الغاز المثالي هو الغاز الذي تكون فيه قوى التفاعل بين الجزيئات (التجاذب والتنافر) غائبة ، وتعتبر الجزيئات نفسها نقاط مادية. الغاز المثالي يطيع معادلة كلابيرون– مندليف
أين مهي كتلة الغاز في النظام ؛ μ هي الكتلة المولية للغاز ؛ صμ = 8314 J / (kmol K) هو ثابت الغاز العالمي ، والذي لا يعتمد على نوع الغاز أو ظروف وجوده. يتم الحصول على معادلة الحالة (1.2) عن طريق الدمج قوانين بويل ماريوتو مثلي الجنس لوساكأخذا بالإعتبار قانون أفوجادرو.
الكتلة المولية μ = م/ن، كجم / مول ، هو كتلة مادة مأخوذة بكمية مول واحد. 1 مولهي وحدة من كمية مادة تحتوي على العديد من الجسيمات مثل 12 جرامًا من الكربون. كمية الجوهر– ن = ن / ن أ، الخلد ، أين نهو عدد الجسيمات (الذرات والجزيئات) ، ن أ ≈ 6.02 10 23 - عدد الذرات في 12 جرامًا من الكربون ( رقم أفوجادرو). عدديا μ = Мr 10 -3 ، حيث السيد هو الوزن الجزيئي النسبي للمادة ( التبويب. مندليف) (على سبيل المثال: = 2 كجم / كمول).
بعبارات محددة (أي 1 كجم من الغاز) ، سيكون للمعادلة (1.2) الشكل
أين ص- ثابت الغاز النوعي ، J / (kg · K).
دعونا نشرح المعنى المادي لثابت الغاز المحدد ص. سيتم كتابة معادلة الحالة الأولى (1.2) على أنها ، للحالة الثانية بنفس الضغط -. اطرح المعادلة الأولى من المعادلة الثانية وابحث عن ذلك ، أي ثابت الغاز المحدد هو الشغل الذي يقوم به 1 كجم من الغاز عند تسخينه بمقدار 1 درجة عند ضغط ثابت.
تظهر البيانات التجريبية أن الغاز الحقيقي كلما اقترب من الغاز المثالي ، كلما قلت كثافته. بمعنى آخر ، مع انخفاض حجم كمية معينة من الغاز بسبب زيادة الضغط أو انخفاض درجة الحرارة ، فإن أي غاز سيعطي المزيد والمزيد من الانحرافات عن خصائص الغاز المثالي. وهكذا ، تحت مفهوم "الغاز المثالي" تناسب جميع الغازات الحقيقية في درجات حرارة عالية وضغوط منخفضة.
1.4 يمزج غازات مثالية
من الناحية العملية ، غالبًا ما يكون سائل العمل مزيجًا من الغازات المتجانسة (على سبيل المثال ، الهواء) ، يمكن اعتبار كل منها مثاليًا والتي لا تدخل في تفاعلات كيميائية.
مثل هذا الخليط هو أيضًا غاز مثالي ويخضع لمعادلة الحالة (1.2) للخليط
أين ص = ص μ / μ هو ثابت الغاز للخليط ؛ ميكرومتر هو متوسط الكتلة المولية (الظاهرة) للخليط(قيمة شرطية تشير إلى غاز تمثيلي متجانس ، حيث يكون عدد الجزيئات والكتلة الإجمالية مساوياً لعدد الجزيئات وكتلة الخليط).
كتلة الخليط تساوي كتلة جميع المكونات
القانون الرئيسي الذي يحدد سلوك خليط الغازات هو قانون دالتون:
يتصرف كل غاز فردي في خليط غازي كما لو كان وحده ، عند درجة حرارة الخليط ، يحتل الحجم الكامل للخليط ،
كل غاز يدخل إلى خليط الغاز له نفس الضغط الذي كان سيحدث إذا احتل وحده الحجم الكامل لخليط الغاز.
ومن هنا القيمة ص(ضغط الخليط المطلق) يعرف بأنه
أين ص أنا – ضغط جزئي أناالمكون الخامس ، أي الضغط من شأنه أناالمكون الخامس ، إذا احتل وحده حجم الخليط بأكمله عند نفس درجة الحرارة ().
يتم إعطاء تكوين الخليط بالكتلة أو الكسور الجزيئية للمكونات المكونة للخليط ، وكذلك بالكسور الحجمية (التركيزات).
جزء الشاملهي نسبة كتلة كل غاز إلى الكتلة الكلية للخليط:.
المعادلة (1.3) تعني ذلك.
حجم الكسريسمى النسبة الحجم الجزئي(الحجم الذي سيشغله الغاز إذا كان ضغطه ودرجة حرارته مساويين لضغط ودرجة حرارة خليط الغاز ، أي) إلى الحجم الكلي لخليط الغاز:. من تعريفات الضغط الجزئي والحجم وثبات درجة الحرارة ، يلي:
![]() (1.5)
(1.5)
تلخيصًا للمساواة الأخيرة على جميع مكونات الخليط ، نحصل عليها ، أي مجموع الأحجام الجزئية للغازات التي يتكون منها الخليط يساوي حجم خليط الغازات.
مجموع كسور الحجم يساوي واحدًا:.
الكسر المولييسمى المكون نسبة كمية مادة كل غاز ن أنا لكمية مادة خليط الغازات ن. من العلاقات و قانون أفوجادرو(في أحجام متساوية من الغازات المثالية المختلفة في نفس درجات الحرارة ونفس الضغوط ، يتم إرفاق عدد متساوٍ من الجزيئات ، أي) التالي:
أولئك. تحديد خليط بواسطة الكسور الجزيئية يعادل تحديد حجم الكسور.
ترتبط كسور الكتلة والحجم بالنسب:
![]() .
.
إذا تم إعطاء الخليط بواسطة الكسور الكتلية ز أنا، ثم يتم حساب ثابت الغاز للخليط والكتلة المولية للخليط على النحو التالي:
![]()
![]()
إذا تم إعطاء الخليط بواسطة كسور الحجم ص أنا، فإن صيغ حساب الكتلة المولية للخليط وثابت الغاز للخليط هي كما يلي:
![]() (1.6)
(1.6)
يتم تحديد الضغوط وأحجام الغازات الجزئية بواسطة قانون بويل–ماريوت(عند درجة حرارة ثابتة للغاز ، يكون ناتج ضغط الغاز وحجمه قيمة ثابتة ، أي):
![]() .
.
أسئلة الاختبار
النظام الدولي للوحدات (SI) ووحداته الأساسية.
البارامترات الأساسية للديناميكا الحرارية وأبعادها.
ما المقصود بحالة توازن النظام الحراري الديناميكي؟
مفهوم حالات التوازن وعدم التوازن.
ما هي معادلة حالة النظام؟
التفسير الهندسي لحالة النظام ، العملية الديناميكية الحرارية.
ما هو الغاز المثالي؟ ما هو الفرق بين الغاز المثالي والغاز الحقيقي؟
ما هو ثابت الغاز؟ معناه المادي وأبعاده وطرق تعريفه.
2. السعة الحرارية
تؤدي رسالة الحرارة إلى الجسم العامل في أي عملية إلى تغيير في حالتها ، وفي الحالة العامة ، يكون مصحوبًا بتغيير في درجة الحرارة. لا يعتمد التغيير في درجة الحرارة ، وكذلك أي معلمة أخرى لحالة مائع العمل ، على نوع العملية ، ولكنه يعتمد على بدايتها ( 1 ) ونهائي ( 2 ) الدول ، أي (بالنسبة لعملية أولية ، يتم استبدال التغيير في المعلمة بفارقها).
نسبة كمية الحرارة δ سإلى الجسم لتغيير درجة حرارة الجسم دي تيفي عملية الديناميكا الحرارية الأولية يسمى السعة الحرارية الحقيقيةالهيئات في هذه العملية:
يشير الرمز السفلي هنا إلى حقيقة أن السعة الحرارية ، مثل الحرارة ، تعتمد على طبيعة العملية. بالإضافة إلى ذلك ، تعتمد السعة الحرارية على كمية الجسم وحالته الديناميكية الحرارية. وتجدر الإشارة أيضًا إلى أنه في هذه العملية لا يتغير التركيب الكيميائي للجسم ، ولا يوجد انتقال لمادة من حالة تجميع إلى أخرى ، ولا يوجد انحلال للمكونات ، وما إلى ذلك.
اعتمادًا على الوحدة المختارة لكمية المادة ، يتم تمييز السعات الحرارية النوعية للكتلة والحجم والمول:
غالبًا ما يستخدم مفهوم السعة الحرارية الجماعية في الممارسة العملية.
2.1. السعة الحرارية الحقيقية والمتوسطة
السعة الحرارية لمادة حقيقية ليست قيمة ثابتة. يتغير مع درجة الحرارة ، ويمكن أن يكون هذا الاعتماد مهمًا جدًا (الشكل 2.1).
يتم حساب الكمية المحددة للحرارة العملية بواسطة الصيغة
يتم استخدام الطرق التالية لتحديد هذه القيمة:
وفقًا لنتائج التجربة ، يتم تمثيل اعتماد السعة الحرارية على درجة الحرارة على أنها كثيرة الحدود التقريبية
أين معاملات التقريب. يتم إعطاء هذه المعاملات في الأدبيات المرجعية. ثم
في الحسابات العملية في نطاق درجة الحرارة ر 1 , ر 2 تعتبر السعة الحرارية قيمة ثابتة تساوي
اتصل متوسط السعة الحراريةفي هذه الفترة ، على عكس السعة الحرارية الحقيقية المقدمة في (2.1). تعطي البيانات المرجعية متوسط السعات الحرارية من 0 إلى درجة حرارة ثابتة رتم الحصول عليها تجريبيا ، أي
متوسط السعة الحرارية في نطاق درجة الحرارة ر 1 , ر 2 وفقًا لهذه البيانات المرجعية يمكن حسابها بواسطة الصيغة
ثم كمية محددةيتم تعريف حرارة العملية على أنها
2.2. السعات الحرارية المتوازنة والمتساوية الضغط
لها أهمية كبيرة في الديناميكا الحرارية.
متساوي الصدرالسعة الحرارية
يساوي نسبة كمية الحرارة في العملية عند حجم ثابت إلى التغير في درجة حرارة الجسم ،
متساوى الضغطالسعة الحرارية
يساوي نسبة كمية الحرارة في العملية عند ضغط ثابت إلى التغير في درجة حرارة الجسم.
في حسابات هندسة الحرارة ، يتم استخدام الجداول التي تسرد القيم العددية التي تم الحصول عليها تجريبياً للسعات الحرارية متساوية الضغط ومتساوية الصدور للمواد المختلفة حسب درجة الحرارة.
2.3 السعة الحرارية لمخاليط الغاز
في الحسابات ، غالبًا ما يكون من الضروري التعامل مع مخاليط الغازات ، والسعة الحرارية معطاة في الجداول للغازات الفردية فقط.
إذا تم إعطاء خليط الغازات بواسطة الكسور الكتلية ز أنا، ثم يتم تحديد السعات الحرارية للكتلة النوعية للخليط بواسطة الصيغ
![]()
إذا تم إعطاء خليط الغازات بواسطة كسور الحجم ص أنا، ثم يتم تحديد السعات الحرارية الحجمية المحددة للخليط بواسطة الصيغ
![]()
أسئلة الاختبار
اكتب وحدات السعة الحرارية النوعية.
كيف يتم تقديم مفهوم متوسط السعة الحرارية؟
3. قانون الحفاظ على الطاقة وتحويلها
يرتبط مفهوم الطاقة بحركة المادة.
يمكن أن تتخذ الطاقة أشكالًا عديدة - العمل الميكانيكي ، والحرارة ، والطاقة الكيميائية ، وطاقة المجالات الكهربائية والمغناطيسية.
في عملية الديناميكا الحرارية ، يتم تنفيذ تفاعل البيئة والنظام الديناميكي الحراري المغلق من خلال تبادل الطاقة في شكل حرارة وعمل ميكانيكي.
3.1. الطاقة الداخلية
أي بيئة لها بعض الهامش الطاقة الداخليةيو(J) ، والتي يتم تمثيلها في الديناميكا الحرارية التقنية كمجموع الطاقات الحركية والمحتملة لجزيئات وذرات الوسط. يتم تحديد الطاقة الحركية لهذه الجسيمات من خلال سرعتها وكتلتها ، بينما يتم تحديد الطاقة الكامنة من خلال قوى التفاعل بينها ، والتي تعتمد على موقعها النسبي. الطاقة الداخلية للنظام هي الطاقة الموجودة في النظام نفسه. هذا يعني أن الطاقة الداخلية يمكن أن تميز حالة الجسم إلى جانب الكميات ص, الخامس, تي.
الطاقة الداخلية لها خاصية الإضافة ، أي الطاقة الداخلية لنظام معقد تساوي مجموع الطاقات الداخلية للأجزاء المكونة له:
الطاقة الداخلية من 1 كجم من مادة تسمى طاقة داخلية محددة ش= يو/ م (J / كجم).
بالنسبة لمعظم التطبيقات التقنية للديناميكا الحرارية ، ليست القيمة المطلقة هي المهمة يووالتغير في هذه القيمة. لذلك ، غالبًا ما يتم تحديد التعريف الكمي للطاقة الداخلية لنظام متجانس فيما يتعلق ببعض الحالات القياسية المختارة تقليديًا.
3.2 قانون حفظ الطاقة في الديناميكا الحرارية
عند إجراء عملية ديناميكية حرارية ، يتفاعل نظام مغلق مع البيئة الخارجية (الهيئات والمجالات الخارجية) ، أي يتبادل الطاقة. في الديناميكا الحرارية التقنية ، يتم النظر في نوعين من نقل الطاقة - عن طريق نقل الحرارة وأداء العمل الميكانيكي.
يحدث انتقال الحرارة بين أجسام ذات درجات حرارة مختلفة ومتلامسة ، أو بين أجسام ذات درجات حرارة مختلفة ، وتقع على مسافة ، عن طريق الموجات الكهرومغناطيسية ( الإشعاع الحراري). إذاعة الدفءيحدث على المستوى الجزيئي (الميكروفيزيائي) بدون حركة مرئية للأجسام.
يحدث نقل الطاقة في شكل عمل مع حركة الجسم بأكمله أو جزء منه في الفضاء. بهذه الطريقة ، يتحرك الجسم إما في مجال قوة ، أو يغير حجمه تحت تأثير الضغط الخارجي. عملهو شكل كبير من أشكال نقل الطاقة.
وتجدر الإشارة إلى أن الحرارة والعمل ، على عكس طاقة الجسم ، ليسا من وظائف حالته ، بل يعتمدان على نوع العملية ، وتحديد هذه العملية ، أي هي وظائف العملية نفسها.
أدت العديد من التجارب والملاحظات إلى اكتشاف قانون أساسي للطبيعة - قانون حفظ الطاقة: الطاقة في الطبيعة لا تنشأ من العدم ولا تختفي ،أو كمية الطاقة لا تتغير ، إنها تتغير فقط من شكل إلى آخر ،أو
أين سهي الحرارة المتضمنة في العملية ؛ إل- العمل الجاري ؛ Δ ههو التغيير في طاقة النظام. هنا وأدناه ، نتفق على النظر في:
الشغل إيجابيإذا تم تنفيذ هذا العمل من قبل الهيئة العاملة ، و نفي، إذا تم العمل على الجسم العامل للنظام ؛
إمداد الجسم بالحرارة إيجابي، والمخصص - نفي
بالإضافة إلى ذلك ، سيتم الإشارة إلى تغيير أي معلمة حالة في العملية النهائية بالرمز Δ (دلتا) ، وفي العملية الأولية - د(تفاضل المعلمة المقابلة). بالنسبة لأي عملية ديناميكية حرارية محدودة ، لا يعتمد التغيير في معلمة الحالة (الضغط ، درجة الحرارة ، الطاقة الداخلية ، المحتوى الحراري ، الانتروبيا ، إلخ) على نوع العملية ، ولكن يتم تحديده بواسطة الحالة الأولية والنهائية.
بشكل عام ، يحتوي النظام الديناميكي الحراري على طاقة داخلية يو، الطاقة الحركية (في الديناميكا الحرارية ، يعتبر النظام ككل يتحرك بسرعة ث) – ميغاواط 2/2 ، إمكانية - mgz (ضهو الارتفاع الذي يقع عنده النظام). التغيير في إجمالي الطاقة في العملية 1 –2 يمكن تخيله على النحو التالي:
العمل المنجز في هذه العملية هو مجموع العمل إلحول ، المرتبطة بتغيير حجم السائل العامل للنظام (تشوه العمل) ، والعمل إل dv على حركة النظام في الفضاء ، عمل تقنيتلك (عند تحريك النظام في مختلف الأجهزة التقنية ، على سبيل المثال ، في المحرك ، والمراجل البخارية ، والضاغط ، وما إلى ذلك) ، تعمل ضد قوى الاحتكاك إل tr:
L \ u003d L حول + L dv + L تلك + L tr.
الحرارة المتضمنة في العملية هي مجموع الحرارة سخارجي ، يشارك في التبادل مع البيئة الخارجية ، وحرارة الاحتكاك س tr:
س = سخارجي + سآر.
بشرط س tr = إل tr (أظهرت العديد من التجارب أن عمل التدفق المنفق على التغلب على الاحتكاك يتحول تمامًا إلى حرارة يتصورها التدفق) ، وهو قانون حفظ الطاقة في الديناميكا الحرارية لكل 1 كجم من مادة متجانسة عاملة (أي في قيم كتلة محددة ) في عملية ابتدائية يمكن كتابتها:
![]() , (3.1)
, (3.1)
(تم حذف الفهرس الخارجي باعتباره غير ضروري).
يجب التأكيد على أنه على الجانب الأيمن من (3.1) تحت علامة التفاضل توجد وظائف الحالة ، والباقي عبارة عن كميات تعتمد على طبيعة العملية الديناميكية الحرارية. نظرًا لأن العمل والحرارة من وظائف العملية ، وليست وظائف الحالة ، فإن العلامة تشير فقط إلى حقيقة أن الكميات التي تتبعها في عملية أولية تكون عشوائية متناهية الصغر ، وليست زيادات في أي وظائف محددة. وهكذا ، δ فو δ ل- كميات من الحرارة والعمل.
إذا لم يغير النظام الديناميكي الحراري موضعه في الفضاء وكان النوع الوحيد من العمل هو العمل المرتبط بتغيير حجم النظام ، فإن المعادلة (3.1) تتخذ شكلاً أبسط:
الوظيفة δ لحول يتم إجراؤها إما ضد قوى الضغط الخارجي ، ثم يتوسع حجم مائع العمل ، أو على العكس من ذلك ، تؤدي البيئة الخارجية العمل على الجسم ، وتضغطه. بالنسبة لعمليات التوازن ، عندما يكون ضغط الوسط مساويًا للضغط في مائع العمل ، يتم حساب هذا العمل على أنه صدي في، أين الخامسهو الحجم المحدد لمادة العمل.
المعادلة
اتصل القانون الأول للديناميكا الحرارية: يتم إنفاق الحرارة المزودة إلى نظام ديناميكي حراري مغلق أثناء الراحة على تغيير الطاقة الداخلية للنظام وعلى القيام بعمل لتغيير حجم النظام. تسمى علاقة التوازن (3.2) أيضًا بالمحاضرات علىالأدب النظري. 1. الباروك: ...
L. A. Eliseeva © مؤسسة موازنة الدولة الفيدرالية للعلوم مكتبة الدولة العلمية والتقنية العامة التابعة لفرع سيبيريا التابع لأكاديمية العلوم الروسية ، 2013
المؤشرمناحي عشوائي / أ. بورودين، I. A. Ibragimov؛ تحت ... 241. Dorogokupets P.I. الديناميكا الحراريةالمعادن وتوازن المعادن ... كتالوجات: خلاصة وافية محاضرات علىبالطبع "المرجع ... الدولة تقنيجامعة. سلسلة، اِصطِلاحِيّعلوم. - ...
N.V Basova [وآخرون] ؛ أد. N.V Basova. روستوف غير متوفر: فينيكس ، 2008
كتاب مدرسيبالطبع) كتابي D. T. خلاصة محاضرات علىالرياضيات العليا [نص]: ... اِصطِلاحِيّ الديناميكا الحرارية Rudobashta، S.P. الهندسة الحرارية [نص]: كتاب مدرسي للطلاب. جامعات تدرس على... 2008. - 204 ص. عشرة بورودين، أولاً - واو أتمتة العمليات التكنولوجية ...
قائمة الأعمال العلمية للخزينة للفترة 2008-1 يونيو 2013 (1)
وثيقة... "طرق البحث بالأشعة السينية" محاضرات علىعلم الأورام السريري. ألماتي ... من القانون الثاني الديناميكا الحرارية»2- دولي ... و مراجعة الخبراء تقنيتجهيز منظمات الرعاية الصحية ... أكاديمي في الأكاديمية الروسية للعلوم الطبية Yu.I. بورودين، بيشكيك ، 2009 ، ص. ...
في الممارسة الهندسية ، غالبًا ما يتعين على المرء ألا يتعامل مع الغازات المتجانسة ، ولكن مع خليط من الغازات غير المرتبطة كيميائيًا. من أمثلة مخاليط الغاز: الهواء الجوي ، والغاز الطبيعي ، والمنتجات الغازية لاحتراق الوقود ، وما إلى ذلك.
بالنسبة لمخاليط الغاز ، فإن الأحكام التالية صالحة.
1. كل غاز يدخل الخليط له درجة حرارة ، يساوي درجة الحرارةمخاليط.
2. يتم توزيع أي من الغازات الموجودة في الخليط في جميع أنحاء حجم الخليط ، وبالتالي فإن حجم كل غاز يساوي حجم الخليط بأكمله.
3. يخضع كل غاز من الغازات الموجودة في الخليط لمعادلة الحالة الخاصة به.
4. يشبه الخليط ككل غازًا جديدًا ويخضع لمعادلة الحالة الخاصة به.
تعتمد دراسة مخاليط الغاز على قانون دالتون ، والذي بموجبه ، عند درجة حرارة ثابتة ، يكون ضغط الخليط مساويًا لمجموع الضغوط الجزئية للغازات الموجودة في الخليط:
حيث p سم هو ضغط الخليط ؛
p i - الضغط الجزئي للغاز i الموجود في الخليط ؛
n هو عدد الغازات الموجودة في الخليط.
الضغط الجزئي هو الضغط الذي يمارسه الغاز الذي يدخل الخليط إذا احتل وحده الحجم الكامل للخليط عند نفس درجة الحرارة.
طرق ضبط مخاليط الغاز
يمكن تحديد تكوين خليط الغاز بالكتلة والحجم والكسور الجزيئية.
الكسور الجماعية. الجزء الكتلي لأي غاز متضمن في الخليط هو نسبة كتلة هذا الغاز إلى كتلة الخليط.
م 1 \ u003d م 1 / م سم ؛ م 2 \ u003d م 2 / م سم ؛ .......... م ن \ u003d م ن / م سم ،
حيث م 1 ، م 2 ، ... ، م ن - الكسور الكتلية للغازات ؛
M 1 ، M 2 ، ... ، M n - كتل الغازات الفردية ؛
كتلة الخليط م سم.
من السهل رؤية ذلك  و
و  (100%).
(100%).
حجم الأسهم.الجزء الحجمي لأي غاز متضمن في الخليط هو نسبة الحجم (الجزئي) المنخفض لهذا الغاز إلى حجم الخليط.
ص 1 \ u003d V 1 / V سم ؛ ص 2 \ u003d V 2 / V سم ؛ ......... ، r n = V n / V cm ؛
حيث V 1 ، V 2 ، ... ، V n - أحجام الغازات المخفضة ؛
V سم هو حجم الخليط.
r 1 ، r 2 ، ... ، r n - الكسور الحجمية للغازات.
الحجم المخفض هو حجم الغاز تحت ظروف الخليط (عند درجة حرارة وضغط الخليط).
يمكن تمثيل الحجم المخفض على النحو التالي: إذا تمت إزالة جميع الغازات باستثناء الغازات من الوعاء الذي يحتوي على الخليط ، وضغط الغاز المتبقي على ضغط الخليط مع الحفاظ على درجة الحرارة ، فسيتم تقليل حجمه أو جزئيًا.
يمكن إثبات أن حجم الخليط سيكون مساويًا لمجموع الأحجام المخفضة للغازات.
 (100%).
(100%).
كسور الخلد.الجزء الجزيئي لأي غاز متضمن في الخليط هو نسبة عدد الكيلومولات لهذا الغاز إلى عدد الكيلومولات في الخليط.
ص 1 \ u003d ن 1 / ن سم ؛ ص 2 \ u003d ن 2 / ن سم ؛ ......... ، r n \ u003d n n / n cm ،
حيث r 1 ، r 2 ، ... ، r n - الكسور الجزيئية للغازات ؛
n سم هو عدد الكيلومولات من الخليط ؛
n 1، n 2، ...، n n هو عدد الكيلومولات من الغازات.
يتطابق تحديد خليط بواسطة الكسور الجزيئية مع تحديد خليط بواسطة الكسور الحجمية ، أي الكسور المولية والحجم لها نفس القيم العددية لكل غاز مدرج في الخليط.
ثابت الغاز والوزن الجزيئي الظاهري (المتوسط) للخليط.لحساب ثابت خليط الغاز المعطى بواسطة الكسور الكتلية ، نكتب معادلات الحالة:
للخليط
p cm × V cm = M cm R cm T ؛ (1.9)
للغازات
 .
(1.10)
.
(1.10)
نجمع الأجزاء اليمنى واليسرى من المعادلات (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
لان  ,
,
ثم p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
المعادلتان (1.9) و (1.11) تدلان على ذلك
M سم R سم T \ u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R سم \ u003d M 1 / M سم R 1 + M 2 / M سم R 2 + ...... + M n / M سم R n \ u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
أو  ,
(1.12)
,
(1.12)
حيث R cm هو ثابت الغاز للخليط.
منذ ثابت الغاز للغاز i
R i = 8314 / م أنا ،
ثم يتم إعادة كتابة المعادلة (1.12) على النحو التالي:
 .
(1.13)
.
(1.13)
عند تحديد معلمات خليط الغاز ، من الملائم استخدام قيمة شرطية معينة تسمى الوزن الجزيئي الظاهري (المتوسط) لخليط الغاز. يسمح لنا مفهوم الوزن الجزيئي الظاهري للخليط بالنظر تقليديًا إلى الخليط على أنه غاز متجانس ، مما يبسط العمليات الحسابية إلى حد كبير.
لغاز منفصل ، التعبير
بالقياس ، لخليط ، يمكننا أن نكتب
م سم R سم = 8314 ، (1.14)
حيث m سم هو الوزن الجزيئي الظاهري للخليط.
من المعادلة (1.14) ، باستخدام التعبيرات (1.12) و (1.13) ، نحصل عليها
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
بالمجادلة بهذه الطريقة ، يمكن الحصول على صيغ لحساب R cm و m cm من خلال الكسور الحجمية ، والصيغ لتحويل الكسور الكتلية إلى كسور الحجم ، وعلى العكس ، الكسور الحجمية إلى كسور الكتلة ، وصيغ لحساب الحجم المحدد لخليط u cm و كثافة الخليط r سم من خلال أجزاء الكتلة والحجم ، وأخيراً ، الصيغ لحساب الضغوط الجزئية للغازات المتضمنة في الخليط ، من خلال كسور الحجم والكتلة. نقدم هذه الصيغ بدون اشتقاق في الجدول.
صيغ لحساب مخاليط الغازات
|
ضبط تكوين الخليط |
نقل من تركيبة إلى أخرى |
الكثافة والحجم المحدد للخليط |
الوزن الجزيئي الظاهر للخليط |
ثابت خليط الغاز |
ضغط جزئي |
|
الكسور الجماعية |
|
|
|
|
|
|
الكسور الحجمية |
|
|
|
|
|
السعة الحرارية للغازات
السعة الحرارية للجسم هي كمية الحرارة المطلوبة لتسخين أو تبريد الجسم بمقدار 1 كلفن. تسمى السعة الحرارية لوحدة كمية من مادة السعة الحرارية النوعية.
لذا ، فإن السعة الحرارية النوعية لمادة ما هي كمية الحرارة التي يجب الإبلاغ عنها أو طرحها من وحدة مادة ما من أجل تغيير درجة حرارتها بمقدار 1 كلفن في هذه العملية.
نظرًا لأنه سيتم النظر في السعات الحرارية المحددة فقط في ما يلي ، فسنشير إلى السعة الحرارية المحددة ببساطة على أنها السعة الحرارية.
يمكن تحديد كمية الغاز بالكتلة والحجم وعدد الكيلومولات. وتجدر الإشارة إلى أنه عند ضبط حجم الغاز ، يتم إعادة هذا الحجم إلى الظروف الطبيعية ويتم قياسه بالمتر المكعب العادي (نانومتر 3).
اعتمادًا على طريقة تحديد كمية الغاز ، يتم تمييز السعات الحرارية التالية:
ج - السعة الحرارية للكتلة ، J / (كجم × ك) ؛
ج ¢ - السعة الحرارية الحجمية ، J / (نانومتر 3 × كلفن) ؛
ج م - السعة الحرارية المولية ، J / (kmol × K).
بين هذه السعات الحرارية هناك العلاقات التالية:
ج = ج م / م ؛ مع م = مع × م ؛
с ¢ = с م / 22.4 ؛ مع m = s ¢ × 22.4 ،
من هنا  ؛ s ¢ = s × r n ،
؛ s ¢ = s × r n ،
حيث u n و r n - الحجم والكثافة النوعية في ظل الظروف العادية.
السعات الحرارية المتوازنة والمتساوية الضغط
تعتمد كمية الحرارة المنقولة إلى مائع العمل على ميزات العملية الديناميكية الحرارية. هناك نوعان من السعة الحرارية لهما أهمية عملية اعتمادًا على العملية الديناميكية الحرارية: متساوي الضغط ومتساوي الضغط.
السعة الحرارية عند u = const متساوية.
ج ش - السعة الحرارية متساوية الصدور الكتلة ،
ج ¢ شهي السعة الحرارية الحجمية متساوية الصدور ،
سم شهي السعة الحرارية متساوية الصدمات المولية.
السعة الحرارية عند p = const متساوية الضغط.
ج ع - السعة الحرارية متساوية الضغط الكتلة ،
ج ¢ р - السعة الحرارية متساوية الضغط الحجمية ،
ج م ع - السعة الحرارية متساوي الضغط المولي.
مع نفس التغيير في درجة الحرارة في العملية التي يتم إجراؤها عند p = const ، يتم استهلاك المزيد من الحرارة مقارنة بالعملية عند u = const. يفسر ذلك من خلال حقيقة أنه عند u = const الحرارة المنقولة إلى الجسم يتم إنفاقها فقط على تغيير طاقته الداخلية ، بينما في p = const يتم إنفاق الحرارة على زيادة الطاقة الداخلية وأداء عمل التمدد. الفرق بين السعات الحرارية متساوية الضغط والكتلة متساوية الضغط وفقًا لمعادلة ماير
ج ص - ج ش= ص. (1.17)
إذا تم ضرب الجانبين الأيمن والأيسر من المعادلة (1.17) في كتلة الكيلومول m ، فإننا نحصل على
ج م ع - ج م ش= 8314 جول / (كمول × ك) (1.18)
في الديناميكا الحرارية وتطبيقاتها ، تعتبر نسبة السعات الحرارية متساوية الضغط والمتساوية ذات أهمية كبيرة:
 ,
(1.19)
,
(1.19)
أين ك هو الأس ثابت الحرارة.
تظهر الحسابات أنه بالنسبة للغازات أحادية الذرة k »1.67 ، والغازات ثنائية الذرة k» 1.4 ، والغازات ثلاثية الذرات k »1.29.
من السهل أن نرى أن القيمة إلىحسب درجة الحرارة. في الواقع ، يستنتج من المعادلتين (1.17) و (1.19) ذلك
 ,
(1.20)
,
(1.20)
ومن المعادلتين (1.18) و (1.19)
 .
(1.21)
.
(1.21)
نظرًا لزيادة السعات الحرارية مع زيادة درجة حرارة الغاز ، تقل قيمة k ، وتقترب من الوحدة ، ولكنها تظل دائمًا أكبر منها.
معرفة قيمة k ، يمكن للمرء أن يحدد قيمة السعة الحرارية المقابلة. لذلك ، على سبيل المثال ، من المعادلة (1.20) لدينا
 ,
(1.22)
,
(1.22)
ومنذ ذلك الحين مع p = k × s ش، ثم نحصل عليه
 .
(1.23)
.
(1.23)
وبالمثل ، بالنسبة للسعات الحرارية المولية ، نحصل عليها من المعادلة (1.21)
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
السعة الحرارية المتوسطة والحقيقية
تعتمد السعة الحرارية للغازات على درجة الحرارة وإلى حد ما على الضغط. إن اعتماد السعة الحرارية على الضغط ضئيل ويتم إهماله في معظم العمليات الحسابية. يعتبر اعتماد السعة الحرارية على درجة الحرارة أمرًا مهمًا ويجب أخذه في الاعتبار. يتم التعبير عن هذا الاعتماد بدقة من خلال المعادلة
ج = أ + فير + وآخرون 2 (1.26)
اين ا، فيو e هي قيم ثابتة لغاز معين.
غالبًا في حسابات الهندسة الحرارية ، يتم استبدال الاعتماد غير الخطي (1.26) بآخر خطي:
ج = أ + فير. (1.27)
|
إذا قمنا ببناء اعتماد السعة الحرارية بشكل بياني على درجة الحرارة وفقًا للمعادلة (1.26) ، فسيكون هذا اعتمادًا منحنيًا (الشكل 1.4). كما هو موضح في الشكل ، كل قيمة درجة حرارة لها قيمة السعة الحرارية الخاصة بها ، والتي تسمى عادةً السعة الحرارية الحقيقية. رياضيا ، يتم كتابة التعبير عن السعة الحرارية الحقيقية على النحو التالي:
|
|
|
|
لذلك ، فإن السعة الحرارية الحقيقية هي نسبة كمية متناهية الصغر من الحرارة dq إلى تغيير متناهي الصغر في درجة الحرارة dt. بمعنى آخر ، السعة الحرارية الحقيقية هي السعة الحرارية للغاز عند درجة حرارة معينة. على التين. 1.4 ، تتم الإشارة إلى السعة الحرارية الحقيقية عند درجة حرارة t 1 مع t1 ويتم تصويرها على أنها قطعة 1-4 ، عند درجة حرارة t 2 - مع t2 ويتم تصويرها على أنها قطعة 2-3. من المعادلة (1.28) نحصل عليها دق = cdt. (1.29) في الحسابات العملية ، نحدد دائمًا كمية الحرارة عند التغيير النهائي |
درجة الحرارة. من الواضح أن مقدار الحرارة q ، التي يتم الإبلاغ عنها لوحدة كمية مادة عند تسخينها من t 1 إلى t 2 ، يمكن إيجادها من خلال تكامل (1.29) من t 1 إلى t 2.
 .
(1.30)
.
(1.30)
بيانيًا ، يتم التعبير عن التكامل (1.30) بالمساحة 4-1-2-3. إذا قمنا في التعبير (1.30) باستبدال قيمة السعة الحرارية الحقيقية وفقًا للاعتماد الخطي (1.27) ، فإننا نحصل على
 (1.31)
(1.31)
أين  - متوسط السعة الحرارية في نطاق درجة الحرارة من t 1 إلى t 2.
- متوسط السعة الحرارية في نطاق درجة الحرارة من t 1 إلى t 2.
 ,
(1.32)
,
(1.32)
لذلك ، فإن متوسط السعة الحرارية هو نسبة الكمية النهائية للحرارة q إلى التغير النهائي في درجة الحرارة t 2 - t 1:
 .
(1.33)
.
(1.33)
إذا تم بناء مستطيل 4-1 ¢ -2 ¢ -3 ، على أساس 4-3 (الشكل 1.4) ، مساوٍ في الحجم للشكل 4-1-2-3 ، فإن ارتفاع هذا المستطيل سيكون تكون مساوية لمتوسط السعة الحرارية ، حيث  في نطاق درجة الحرارة t 1 - t 2.
في نطاق درجة الحرارة t 1 - t 2.
عادة ، يتم إعطاء قيم متوسط السعات الحرارية في جداول الخصائص الديناميكية الحرارية للمواد. ومع ذلك ، لتقليل حجم هذه الجداول ، فإنها توفر قيم متوسط السعات الحرارية المحددة في نطاق درجة الحرارة من 0 درجة مئوية إلى درجة مئوية.
إذا كان من الضروري حساب قيمة متوسط السعة الحرارية في نطاق درجة حرارة معينة t 1 - t 2 ، فيمكن القيام بذلك على النحو التالي.
تتوافق المنطقة 0a14 أسفل المنحنى c \ u003d f (t) (الشكل 1.4) مع مقدار الحرارة q 1 المطلوبة لزيادة درجة حرارة الغاز من 0 درجة مئوية إلى تي 1 درجة مئوية.

وبالمثل ، فإن المنطقة 0a23 تقابل q 2 عندما ترتفع درجة الحرارة من 0 درجة مئوية إلى t 2 درجة مئوية:

وبالتالي ، يمكن تمثيل q \ u003d q 2 - q 1 (المنطقة 4123) كـ
![]() (1.34)
(1.34)
باستبدال قيمة q وفقًا لـ (1.34) في تعبير (1.33) ، نحصل على صيغة لمتوسط السعة الحرارية في أي نطاق درجة حرارة:
 .
(1.35)
.
(1.35)
وبالتالي ، يمكن حساب متوسط السعة الحرارية من متوسط السعات الحرارية الجدولية باستخدام المعادلة (1.35). علاوة على ذلك ، نحصل على اعتماد غير خطي c = f (t). يمكنك أيضًا إيجاد متوسط السعة الحرارية باستخدام المعادلة (1.32) باستخدام علاقة خطية. القيم أ و فيفي المعادلة (1.32) لمختلف الغازات ترد في الأدبيات.
يمكن حساب كمية الحرارة التي يتم توفيرها أو إزالتها من مائع العمل باستخدام أي من المعادلات:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
أين 

 - على التوالي ، متوسط الكتلة والحجم وسعة الحرارة المولية ؛ M هي كتلة الغاز. ن هو عدد الكيلومولات من الغاز ؛ V n - حجم الغاز في الظروف العادية.
- على التوالي ، متوسط الكتلة والحجم وسعة الحرارة المولية ؛ M هي كتلة الغاز. ن هو عدد الكيلومولات من الغاز ؛ V n - حجم الغاز في الظروف العادية.
يمكن العثور على حجم الغاز V n على النحو التالي. بعد كتابة معادلة الحالة للشروط المعينة: pV = MRT وللظروف العادية: p n V n = MRT n ، ننسب المعادلة الثانية إلى الأولى:
 ,
,
من هنا  .
(1.39)
.
(1.39)
السعة الحرارية لمخاليط الغاز
يمكن حساب السعة الحرارية لخليط الغاز إذا تم إعطاء تركيبة الخليط وكانت السعة الحرارية للمكونات المتضمنة في الخليط معروفة.
لتسخين خليط كتلته M سم × 1 كلفن ، يجب أيضًا زيادة درجة حرارة كل مكون بمقدار 1 كلفن. في الوقت نفسه ، يتم إنفاق كمية الحرارة التي تساوي c i M i على تسخين المكون i من الخليط بكتلة М i. لخليط كامل مقدار الحرارة  ,
,
حيث c i و c cm هي السعات الحرارية الكتلية للمكون والمزيج i.
بقسمة التعبير الأخير على M cm ، نحصل على صيغة حساب السعة الحرارية لكتلة الخليط:
 ,
(1.40)
,
(1.40)
حيث m i هو الكسر الكتلي للمكون i.
بالمثل ، نجد السعة الحرارية الحجمية ج ¢ سم والسعة الحرارية المولية ج م سم للخليط:
 (1.41)
(1.41)
حيث c ¢ i - السعة الحرارية الحجمية للمكون i ، r i - جزء الحجم للمكون i ،
 ,
(1.42)
,
(1.42)
حيث c m i هي السعة الحرارية المولارية للمكون i ،
r i - جزء الخلد (الحجم) من المكون الأول.
في المحركات الحرارية (الآلات) ، يكون سائل العمل مزيجًا من غازات مختلفة. إذا لم تدخل مكونات الخليط في تفاعلات كيميائية مع بعضها البعض ، وكان كل مكون يخضع لمعادلة كلابيرون للحالة ، فإن هذا الخليط يعتبر غازًا مثاليًا.
لحساب الخليط ، من الضروري تحديد μ cm - متوسط الكتلة المولية و R c m - ثابت الغاز المحدد للخليط. لتحديدها ، من الضروري معرفة تركيبة الخليط ، أي المكونات والكميات التي تشكل هذا الخليط ، وما هي المعلمات التي يحتوي عليها كل مكون في الخليط.
يتصرف كل مكون من مكونات الخليط كما لو لم يكن هناك غازات أخرى في الخليط ، ويحتل الحجم الكامل المتاح الذي يوجد فيه الخليط ، ويتبع معادلته الخاصة بالحالة ويمارس ما يسمى بالضغط الجزئي على الجدران ، بينما درجة الحرارة جميع مكونات الخليط هي نفسها وتساوي درجة حرارة الخليط.
وفقًا لقانون دالتون ، فإن ضغط الخليط P يساوي مجموع الضغوط الجزئية للمكونات الفردية الموجودة في الخليط:
حيث n هو عدد مكونات الخليط.
وفقًا لقانون Amag ، فإن حجم الخليط V يساوي مجموع الأحجام الجزئية للمكونات الفردية الموجودة في الخليط عند درجة حرارة وضغط الخليط:
 , (1.21)
, (1.21)
حيث - الحجم الجزئي ، م 3 ؛ V- حجم الخليط ، م 3
يتم إعطاء تكوين الخليط بالحجم (المولي) أو الكسور الكتلية.
حجم الكسر للمكوِّن الأولهي نسبة الحجم الجزئي للمكون إلى حجم الخليط ، أي أن مجموع الكسور الحجمية لمكونات الخليط هو 1 ، أي. إذا كانت القيمة معطاة٪ ، فإن مجموعها = 100٪.
الكسر المولي للمكون i n iهي نسبة عدد الكيلومولات للمكون N i إلى عدد كيلو مولات الخليط N ، أي أين ![]() ، أي أن عدد الكيلومولات لكل مكون والمزيج ككل يساوي نسبة المكون المقابل والمزيج ككل إلى الحجم الذي يشغله الكيلومول الواحد.
، أي أن عدد الكيلومولات لكل مكون والمزيج ككل يساوي نسبة المكون المقابل والمزيج ككل إلى الحجم الذي يشغله الكيلومول الواحد.
بالنظر إلى أن الغاز المثالي في نفس الظروف له نفس الحجم من الكيلومول ، ثم بعد الاستبدال نحصل على: أي بالنسبة للغازات المثالية ، فإن كسور الضرس والحجم متساويان عدديًا.
الكسر الكتلي للمكون iهي نسبة كتلة المكون إلى كتلة الخليط: يتبع ذلك أن كتلة الخليط تساوي مجموع كتل المكونات ، وكذلك مجموع الكسور الكتلية للمكونات متساوية إلى 1 (أو 100٪).
يعتمد تحويل الكسور الحجمية إلى الكسور الكتلية والعكس على النسب التالية:
![]() ,
,
حيث ρ = μ / 22.4، كجم / م 3.
ومن هنا يتبع ذلك أن الجزء الكتلي للمكون i سيتم تحديده من العلاقة:
 ,
,
أين كثافة الخليط ، كجم / م 3 ، هو جزء الحجم من المكون الأول.
في المستقبل ، يمكن تحديده من خلال الكسور الحجمية.
 .
.
كثافةيتم تحديد مخاليط الكسور الحجمية من العلاقة
 ، أين
، أين  , (1.22)
, (1.22)
 .
.
يتم تحديد الضغط الجزئي من خلال الصيغ:
![]() أو
أو  (1.23)
(1.23)
معادلات حالة المكونات والمزيج ككل لها الشكل:
![]() ;
;
![]() ,
,
من أين ، بعد التحولات ، نحصل عليه جَسِيمتشارك
 ,
,  . (1.24)
. (1.24)
الكثافة والحجم المحدد للخليط جَسِيمشارك:
;  . (1.25)
. (1.25)
لحساب الضغوط الجزئية ، يتم استخدام الصيغة:
 . (1.26)
. (1.26)
يتم تحويل الكسور الكتلية إلى كسور حجمية وفقًا للصيغة التالية:
 .
.
عند تحديد السعة الحرارية لمزيج من الغازات ، يُفترض أنه من أجل تسخين (تبريد) خليط غازي ، من الضروري تسخين (تبريد) كل مكون من مكونات الخليط
حيث Q i = M i c i ∆t هي الحرارة التي يتم إنفاقها على تغيير درجة حرارة المكون i من الخليط ، c i هي السعة الحرارية الكتلية للمكون i من الخليط.
يتم تحديد السعة الحرارية للخليط من النسبة (إذا تم إعطاء الخليط بواسطة الكسور الكتلية)
 ، بصورة مماثلة
، بصورة مماثلة  . (1.28)
. (1.28)
يتم تحديد السعات الحرارية المولية والحجمية لمزيج من خلال الكسور الحجمية
 ;
;  ;
;
 ;
; 
مثال 1.5يتكون الهواء الجاف بالكتلة من g O2 \ u003d 23.3٪ أكسجين و g N 2 \ u003d 76.6٪ نيتروجين. حدد تركيبة الهواء بالحجم (r O2 و r N 2) وثابت الغاز للخليط.
المحلول.
1. من الجدول 1 نجد كجم / كمول و كجم / كمول
2. تحديد حجم كسور الأكسجين والنيتروجين:
1. يتم تحديد ثابت غاز الهواء (الخليط) بالصيغة التالية:
 ، J / كجم ك
، J / كجم ك
مثال 1.6. حدد مقدار الحرارة المطلوبة لتسخين خليط غازي بكتلة M = 2 كجم عند P = const ، والتي تتكون في٪ من الوزن: ، ، ، عندما تتغير درجة الحرارة من t 1 = 900 ° C إلى t 2 = 1200 درجة مئوية.
المحلول:
1. حدد متوسط السعة الحرارية للكتلة للمكونات التي يتكون منها خليط الغاز عند P = const و t 1 = 900 o C (من P2):
1.0258 كيلو جول / كجم كلفن ؛ = 1.1045 كيلو جول / كجم كلفن ؛
1.1078 كج / كغ ك ؛ = 2.1097 كيلوجول / كيلوجرام كلفن ؛
2. نحدد متوسط السعة الحرارية للكتلة للمكونات التي يتكون منها خليط الغاز عند P = const و t 1 = 1200 درجة مئوية (من P2):
1.0509 كيلو جول / كجم كلفن ؛ = 1.153 كيلوجول / كيلوجرام كلفن ؛
1.1359 كيلوجول / كيلوجرام كلفن ؛ = 2.2106 كيلوجول / كيلوجرام كلفن ؛
3. نحدد متوسط السعة الحرارية لكتلة الخليط لنطاق درجة الحرارة: t 2 \ u003d 1200 ° C و t 1 \ u003d 900 ° C:
4. كمية الحرارة لتسخين 2 كجم من الخليط عند P = const:
القانون الأول للديناميكا الحراريةينشئ علاقة كمية بين التغيير في الطاقة الداخلية للنظام والعمل الميكانيكي الذي يتم إجراؤه ضد قوى الضغط الخارجي للبيئة نتيجة لتزويد الحرارة إلى مائع العمل.
بالنسبة للنظام الحراري الديناميكي المغلق ، فإن معادلة القانون الأول لها الشكل
تُستخدم الحرارة المنقولة إلى سائل (أو نظام) العمل لزيادة طاقته الداخلية (dU) بسبب زيادة درجة حرارة الجسم ، ولأداء العمل الخارجي (dL) بسبب تمدد سائل العمل وزيادة في الصوت.
يمكن كتابة القانون الأول بالصيغة dH = dq + VdP = dq-dL 0 ،
حيث dL 0 \ u003d VdP - يسمى العمل الأولي لتغيير الضغط العمل الخارجي المفيد (الفني).
dU هو التغيير في الطاقة الداخلية للسائل العامل (النظام) ، والذي يتضمن طاقة الحركة الحرارية للجزيئات (متعدية ، دورانية واهتزازية) والطاقة الكامنة لتفاعل الجزيئات.
نظرًا لأن انتقال النظام من حالة إلى أخرى يحدث نتيجة لإمداد الحرارة ، فإن مائع العمل يسخن وترتفع درجة حرارته بمقدار dT ويزداد الحجم بمقدار dV.
تؤدي زيادة درجة حرارة الجسم إلى زيادة الطاقة الحركية لجزيئاته ، وتؤدي الزيادة في حجم الجسم إلى تغيير في الطاقة الكامنة للجسيمات. نتيجة لذلك ، تزداد الطاقة الداخلية للجسم بمقدار dU ، وبالتالي فإن الطاقة الداخلية U هي وظيفة لحالة الجسم ويمكن تمثيلها كدالة لمعلمتين مستقلتين U = f 1 (P ، V) ؛ U = f 2 (P، T)، U = f 3 (υ، T). يتم تحديد التغيير في الطاقة الداخلية في عملية الديناميكا الحرارية فقط من خلال الحالات الأولية (U 1) والنهائية (U 2) ، أي
في الشكل التفاضلي ، يتم كتابة التغيير في الطاقة الداخلية
أ) كدالة للحجم المحدد ودرجة الحرارة

ب) كدالة لدرجة الحرارة ، منذ ذلك الحين ، ومن بعد
بالنسبة للحسابات العملية ، التي من الضروري فيها مراعاة التغير في درجة الحرارة C v مع درجة الحرارة ، توجد صيغ تجريبية وجداول للطاقة الداخلية المحددة (غالبًا ضرس). بالنسبة للغازات المثالية ، يتم تحديد الطاقة الداخلية المولارية لخليط U m بواسطة الصيغة
 ، ي / كمول
، ي / كمول
لمزيج معطى بواسطة الكسور الكتلية. في هذا الطريق الطاقة الداخليةيوجد خاصية النظام وتميز حالة النظام.
الطاقة الداخلية الكامنةهي وظيفة الحالة الحرارية التي قدمها Kamerling-Onnes ، (الفائز جائزة نوبل، 1913) ، وهو مجموع الطاقة الداخلية للنظام U ومنتج ضغط النظام P وحجمه V.
نظرًا لأن الكميات المدرجة فيه هي وظائف حالة ، فإن H أيضًا وظيفة حالة ، أي H \ u003d f 1 (P ، V) ؛ H = f 2 (V ، T) ؛ H = f 3 (P ، T).
يتم تحديد التغيير في المحتوى الحراري dH في أي عملية ديناميكية حرارية بواسطة حالات H 1 الأولية وحالات H 2 النهائية ولا يعتمد على طبيعة العملية. إذا كان النظام يحتوي على 1 كجم من مادة ما ، فسيتم استخدام المحتوى الحراري المحدد ، J / kg.
بالنسبة للغاز المثالي ، فإن المعادلة التفاضلية لها الشكل
وفقًا لذلك ، يتم تحديد المحتوى الحراري المحدد بواسطة الصيغة
معادلة القانون الأول للديناميكا الحرارية هي dq = dU + Pdυ ، عندما يكون نوع العمل الوحيد هو عمل التوسيع Pdυ = d (Pυ) -dP ، ثم dq = d (U + Pυ) -dP ، من أين
العمل التطبيقي№ 2
الموضوع: السعة الحرارية ، المحتوى الحراري ، مزيج الغازات المثالية ، الطاقة الداخلية ، العمل ، العمليات الديناميكية الحرارية.
الغرض من العمل: ترسيخ المعرفة المكتسبة أثناء التدريب النظري ، واكتساب المهارات في تنفيذ حسابات الهندسة الحرارية.
أنا.التعريفات الأساسية والصيغ والمعادلات
1. مخاليط الغازات المثالية
خليط الغازات هو خليط ميكانيكي من عدة غازات لا تتفاعل كيميائيًا مع بعضها البعض. كل غاز في الخليط يسمى مكون غاز. يتصرف كما لو لم يكن هناك غازات أخرى في الخليط ، أي موزعة بالتساوي في جميع أنحاء الخليط. يسمى الضغط الذي يمارسه كل غاز من الخليط على جدران الوعاء بالضغط الجزئي. القانون الأساسي لمخاليط الغازات المثالية هو قانون دالتون ، والذي بموجبه يكون ضغط الخليط مساويًا لمجموع الضغوط الجزئية للغازات التي تشكل الخليط:
2. الطاقة الداخلية
الطاقة الداخلية للجسم هي مزيج من الطاقة الحركية لحركة الجسيمات الدقيقة التي يتكون منها الجسم وطاقتها الكامنة. تعريف التفاعل. قوى الجذب أو التنافر المتبادل. من المستحيل تحديد القيمة المطلقة للطاقة الداخلية ، لذلك ، في الحسابات الديناميكية الحرارية ، لا يتم حساب القيمة المطلقة للطاقة الداخلية ، ولكن تغييرها ، أي
![]() أو
أو ![]()
حيث U 1 و U 2 - الطاقة الداخلية للحالة الأولية والنهائية لسائل العمل (الغاز) ؛
ش 1 و 2 - دقات. الطاقة الداخلية للحالة الأولية والنهائية لسائل العمل.
ويترتب على ذلك أن التغيير في الطاقة الداخلية لا يعتمد على طبيعة العملية ومسارها ، ولكن يتم تحديده من خلال حالة مائع العمل في بداية ونهاية عملية التغيير.
من سمات الغاز المثالي عدم وجود قوى للتفاعلات الجزيئية فيه ، وبالتالي غياب الطاقة الكامنة الداخلية ، أي U n \ u003d 0 و U „\ u003d 0. لذلك ، الطاقة الداخلية للغاز المثالي:
U = U k = f (T) unu u = uk = f (T).
ح. العمل بالغاز.
في الديناميكا الحرارية ، أي تغيير في حالة مائع العمل نتيجة تبادل الطاقة مع بيئةتسمى عملية. في هذه الحالة ، يتم تغيير المعلمات الرئيسية لجسم العمل:
يرتبط تحويل الحرارة إلى عمل ميكانيكي بعملية تغيير حالة سائل العمل. يمكن أن تكون عمليات تغيير حالة الغاز عمليات تمدد وانكماش. بالنسبة لكتلة عشوائية من الغاز M (كجم) ، فإن الشغل يساوي:
L \ u003d M l \ u003d Mp (v 2 - v 1) \ u003d ، J
حيث l \ u003d p (v 2 -v 1) J / kg هو عمل 1 كجم من الغاز أو عمل محدد.
4. المحتوى الحراري للغاز ،
المحتوى الحراري هو معلمة تميز الطاقة الكامنة لتوصيل مائع العمل (الغاز) بالبيئة. المحتوى الحراري والمحتوى الحراري النوعي:
أنا \ u003d U + pV و J و i \ u003d و + pv ، J / كجم.
5. السعة الحرارية.
السعة الحرارية النوعية هي كمية الحرارة التي يجب توفيرها لـ 1 كجم من الغاز لتسخينه بمقدار 1 درجة مئوية في نطاق درجة حرارة معينة.
السعة الحرارية النوعية هي الكتلة والحجم والكيلومول. هناك علاقة بين السعات الحرارية للكتلة C والحجم C والكيلومول C:
 ;
; 
حيث Vo 22.4 م 3 / كمول - يدق. حجم الغاز في الظروف العادية.
كتلة عود. السعة الحرارية لخليط الغاز:

الحجمي حرارة نوعيةخليط الغاز:

كيلومولار للحرارة النوعية لخليط الغاز:

6. معادلة تحديد كمية الحرارة
يمكن تحديد كمية الحرارة المنبعثة أو المأخوذة من سائل العمل (الغاز) من خلال المعادلة:
Q \ u003d M C m (t 2 -t 1) ، J أو Q \ u003d VC (t-t) ، J ، حيث M و V هما الوزن أو كمية الغاز ، كجم أو م 3 ؛
t u t - درجة حرارة الغاز في نهاية وبداية العملية ° С ؛
C و C - دقات متوسط الكتلة والحجم. السعة الحرارية للغاز
عند t cp \ u003d J / kgK أو J / m 3 K
7. القانون الأول للديناميكا الحرارية
يراعي هذا القانون تداخلات العمل الحراري والميكانيكي. وفقًا لهذا القانون ، يتم تحويل الحرارة إلى عمل ميكانيكي والعكس صحيح ، يتم تحويل العمل الميكانيكي إلى حرارة بكميات مكافئة تمامًا. معادلة التكافؤ للحرارة والعمل لها الشكل:
مع الأخذ في الاعتبار مبدأ تكافؤ الحرارة والعمل ، فإن معادلة توازن الحرارة لكتلة عشوائية من الغاز:
Q \ u003d U + L و q \ u003d u + l \ u003d u -u + l
حل المشاكلII
المهمة رقم 1 (رقم 1)
يحتوي الهواء الجاف في الغلاف الجوي على تركيبة الكتلة التقريبية التالية: g 02 = 23.2٪ ، g N 2 = 76.8٪.
حدد التركيب الحجمي للهواء ، وثابت الغاز ، والوزن الجزيئي الظاهري ، والضغط الجزئي للأكسجين والنيتروجين ، إذا كان الهواء P = 101325 باسكال باستخدام مقياس الضغط.
أحدد التركيب الحجمي للهواء:
 ;
; ;
;
أين ص هو الكسر الكتلي ؛
م هو الوزن الجزيئي النسبي ؛
g هو الكسر الحجمي.
م الهواء. = م O2 ص O2 + م N2 ص N2 = 32 0.209 + 28 0.7908 = 6.688 + 22.14 = 28.83 ؛

 ;
;
حيث R 0 هو ثابت الغاز.
أحدد الضغوط الجزئية للغازات المختلفة:
P O 2 \ u003d P cm r O2 \ u003d 101325 0.209 \ u003d 21176.9 (Pa) ؛
P N 2 \ u003d P cm r N 2 \ u003d 101325 0.7908 = 80127.81 (Pa) ؛
حيث P O 2 ، P N 2 - ضغط جزئي ؛
P سم هو ضغط الخليط.
المهمة رقم 2 (رقم 2)
ينقسم الإناء إلى قسمين ، أحجامهما V 1 = 1.5 م 3 و V 2 = 1.0 م 3. يحتوي الجزء الأول من المجلد V 1 على CO 2 عند P 1 = 0.5 ميجا باسكال و t 1 = 30 درجة مئوية ؛ يحتوي الجزء الثاني من المجلد V 2 على O 2 عند P 2 = 0.2 ميجا باسكال و t 2 = 57 درجة مئوية. حدد الكسور الكتلية والحجمية لثاني أكسيد الكربون والأكسجين ، والوزن الجزيئي الظاهر للخليط وثابت الغاز بعد إزالة القسم واكتمال عملية الخلط.
أحدد ثوابت الغاز الفردية:
للقيام بذلك ، أحدد الوزن الجزيئي النسبي: m (CO 2) \ u003d 32 + 12 \ u003d 44 ؛ م (يا 2) = 32 ؛

 ;
;
![]()
 ;
;
وفقًا لمعادلة Klaiperon المميزة ، أحدد كتل الغازات:
 (كلغ)؛
(كلغ)؛
 (كلغ)؛
(كلغ)؛
أحدد الكسور الكتلية:


أحدد الكسور الحجمية:


تحديد الوزن الجزيئي الظاهري للهواء:
م الهواء. \ u003d m O2 r O 2 + m CO2 r CO2 \ u003d 32 0.21 + 44 0.79 \ u003d 6.72 + 34.74 \ u003d 41.48 ؛
أحدد ثابت الغاز الفردي للهواء (R):

 ;
;
المهمة رقم 3 (رقم 6)
في وعاء بحجم 300 لتر ، يوجد أكسجين عند ضغط P 1 \ u003d 0.2 ميجا باسكال و t 1 \ u003d 20 0 درجة مئوية.كمية الحرارة التي يجب توفيرها بحيث ترتفع درجة حرارة الأكسجين إلى t 2 \ u003d 300 0 C ؟ ما هو الضغط الذي سيؤسس في الوعاء؟ لحساب ، خذ متوسط الحرارة النوعية للأكسجين عند n.o. ج 02 \ u003d 0.935 
وفقًا لقانون تشارلز ، أحدد الضغط النهائي للعملية:
;  (باسكال) ؛
(باسكال) ؛
حيث P ، T هي معلمات الغاز.
أحدد ثابت الغاز الفردي للأكسجين (R):

 ;
;
نظرًا لأن العملية متساوية الصدمات ، فأنا أحدد كمية الحرارة التي يجب توفيرها وفقًا للصيغة المناسبة: Q v \ u003d M C cv (T 2 -T 1) لهذا ، وفقًا لمعادلة Claiperon المميزة ، أحدد الكتلة من الغاز
 (كلغ)؛ Q v \ u003d M C cv (T 2 -T 1) \ u003d 1.27935280 \ u003d 332486 (J).
(كلغ)؛ Q v \ u003d M C cv (T 2 -T 1) \ u003d 1.27935280 \ u003d 332486 (J).
المهمة رقم 4 (رقم 7)
مقدار الحرارة التي يجب إنفاقها لتسخين 2 م 3 من الهواء عند ضغط زائد ثابت P ex. \ u003d 0.2 ميجا باسكال من درجة حرارة 100 0 درجة مئوية إلى درجة حرارة 500 درجة مئوية ما العمل الذي سيفعله الهواء في هذه الحالة؟ للحساب ، خذ: الضغط الجوي P at. \ u003d 0.1 ميجا باسكال ، متوسط السعة الحرارية متساوي الضغط للكتلة للهواء C pm \ u003d 1.022  ؛ احسب ثابت الغاز مع الأخذ في الاعتبار أن الوزن الجزيئي الظاهري للهواء M الهواء. = 29.
؛ احسب ثابت الغاز مع الأخذ في الاعتبار أن الوزن الجزيئي الظاهري للهواء M الهواء. = 29.
أحدد ثابت الغاز الفردي للهواء:

 ;
;
الضغط المطلق يساوي مجموع الزيادة والجو P = P est. + P في. = 0.1 + 0.2 = 0.3 ميجا باسكال
 (كلغ)؛
(كلغ)؛
نظرًا لأن العملية متساوية الضغط ، أحدد Q و L وفقًا للصيغ المقابلة:
وفقًا لقانون Gay-Lussac ، أحدد الحجم النهائي:
 م 3 ؛
م 3 ؛
Q \ u003d M C pm (T 2 -T 1) = 5.56 1022400 = 2272928 (J) ؛
L \ u003d P (V 2 -V 1) = 300000 2.15 = 645000 (J).
المهمة رقم 5 (رقم 8)
يوجد هواء في الأسطوانة عند ضغط P = 0.5 ميجا باسكال ودرجة حرارة t 1 = 400 0 درجة مئوية. تتم إزالة الحرارة من الهواء عند P = const بحيث تكون درجة الحرارة t 2 = 0 0 C في نهاية العملية ضبط حجم الاسطوانة التي الهواء V 1 \ u003d 400l.
حدد مقدار الحرارة المزالة والحجم النهائي والتغير في الطاقة الداخلية والعمل المثالي للضغط C م = 1.028  .
.
نظرًا لأن العملية متساوية الضغط ، فوفقًا لقانون Gay-Lussac ، أحدد الحجم النهائي:
 م 3 ؛
م 3 ؛
وفقًا لمعادلة Klaiperon المميزة ، أحدد كتلة الغاز:
من المشكلة السابقة R = 286.7 
 (كلغ)؛
(كلغ)؛
أحدد مقدار الحرارة المنبعثة:
Q = M C pm (T 2 -T 1) = 1.03 1028 (273-673) = - 423536 (J) ؛
أحدد مقدار العمل الذي تم إنفاقه:
L = P (V 2 -V 1) = 500000 (0.16-0.4) = - 120.000 (J) ؛
من المعادلة التي يتم من خلالها تحديد المبلغ الإجمالي ، أحدد التغيير في كمية الطاقة الداخلية:
![]() ؛ (ي)
؛ (ي)
المشكلة رقم 6 (رقم 9)
الهواء الذي له حجم V 1 = 0.02 م 3 عند ضغط P 1 = 1.1 ميجا باسكال و t 1 = 25 ثانية يتمدد في أسطوانة بمكبس متحرك إلى ضغط P 2 = 0.11 ميجا باسكال. أوجد الحجم النهائي V 2 ، ودرجة الحرارة النهائية t 2 ، والشغل الذي يقوم به الهواء ، والحرارة المزودة ، إذا حدث التمدد في الأسطوانة:
أ) متساوي الحرارة
ب) ثابت الحرارة مع الأس ثابت الحرارة k = 1.4
ج) متعدد الاتجاهات مع مؤشر متعدد الاتجاهات ن = 1.3
عملية متساوية الحرارة:
P 1 / P 2 \ u003d V 2 / V 1
V 2 \ u003d 0.02 1.1 / 0.11 = 0.2 م 3
Q = L = RMT 1 Ln (V 2 / V 1) = P 1 V 1 Ln (V 2 / V 1) = 1.1 10 6 0.02Ln (0.2 / 0.02) = 22000 J
عملية ثابت الحرارة:
V 1 / V 2 \ u003d (P 2 / P 1) 1 / ك
V 2 \ u003d V 1 / (P 2 / P 1) 1 / ك \ u003d 0.02 / (0.11 / 1.1) 1 / 1.4 \ u003d 0.1036 م 3
T 2 / T 1 \ u003d (P 2 / P 1) ك -1 / ك
T 2 \ u003d (P 2 / P 1) k-1 / k T 1 \ u003d (0.11 / 1.1) 1.4-1 / 1.4 298 \ u003d 20.32k
C v \ u003d 727.4 J / kg · k
L \ u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \ u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0، 1) = 2.0275 10 6 J
عملية متعددة الاتجاهات:
V 1 / V 2 \ u003d (P 2 / P 1) 1 / n
V 2 \ u003d V 1 / (P 2 / P 1) 1 / n \ u003d 0.02 / (0.11 / 1.1) 1 / 1.3 \ u003d 0.118 م 3
T 2 / T 1 \ u003d (P 2 / P 1) n-1 / n
T 2 \ u003d (P 2 / P 1) n-1 / n T 1 \ u003d (0.11 / 1.1) 1.3-1 / 1.3 298 \ u003d 175 كيلو
L \ u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \ u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118) = 30000J
Q = (k-n / k-1) l M = ((1.4-1.3) / (1.4-1)) 30000 = 7500J
المؤلفات:
1. الطاقة ، موسكو ، 1975.
2. ليتفين أ. "الأسس النظرية للهندسة الحرارية" ، دار النشر "الطاقة" ، موسكو ، 1969.
3. Tugunov P.I. ، Samsonov AA ، "أساسيات الهندسة الحرارية والمحركات الحرارية ومرافق الطاقة البخارية" ، دار نشر Nedra ، موسكو ، 1970.
4. Krutov V.I. "الهندسة الحرارية" ، دار النشر "الهندسة" ، موسكو ، 1986.
مخاليط الغاز. السعة الحرارية للغازات
تُفهم مخاليط الغاز على أنها خليط ميكانيكي من عدة غازات لا تتفاعل كيميائيًا مع بعضها البعض. خليط من الغازات المثالية يخضع لجميع القوانين المتعلقة غازات مثالية. يتم تحديد تركيبة خليط الغاز بكمية كل من الغازات الموجودة في الخليط ، ويمكن تحديدها بالكتلة أو الحجم:
أين هي كتلة المكون -th ، وهي حجم المكون -th ، وهل كتلة وحجم الخليط بأكمله ، على التوالي.
من الواضح أن
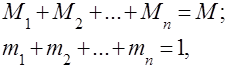
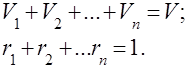
لتسهيل حل المشكلات العملية المتعلقة بمخاليط الغازات ، تم إدخال مفهوم الوزن الجزيئي الظاهري لمزيج من الغازات ، وهو متوسط كتلة الأوزان الجزيئية الفعلية للمكونات الفردية للخليط.
معادلة الحالة لمزيج من الغازات لها الشكل:
مخاليط الغاز تخضع لمفهوم ثابت الغاز العام
العلاقة بين ضغط خليط الغاز والضغط الجزئي للمكونات الفردية الموجودة في الخليط يحددها قانون دالتون:
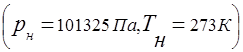
1 غاز له كتلة مختلفة حسب الضغط ودرجة الحرارة. في هذا الصدد ، يُشار دائمًا إلى السعة الحرارية الحجمية إلى كتلة الغاز الموجودة في 1 في ظل الظروف العادية. في هذه الحالة ، يبلغ حجم 1 كيلو مول من الغازات المختلفة 22.4 / كمول ، وثابت الغاز العام هو. اعتمادًا على طريقة إمداد الغاز بالحرارة ، توجد سعات حرارية متساوية الضغط ومتساوية الصدمات. نسبة هذه الكميات تسمى الأس ثابت الحرارة
السعات الحرارية وترتبط أيضًا بعلاقة ماير
يتم تحديد كمية الحرارة التي يجب إنفاقها في عملية تسخين 1 كجم من الغاز في نطاق درجة الحرارة من إلى بواسطة الصيغة:
أين و ، على التوالي ، متوسط السعات الحرارية ضمن 0 درجة - و 0 درجة -.
إذا كان (كجم) أو () غاز متورطين في العملية ، إذن
يجب تحديد السعة الحرارية لخليط الغاز من خلال الصيغ:
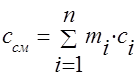
كتلة - ؛
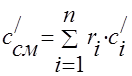
الحجمي -
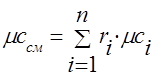
الضرس -.
لاستخدام حرارة الغازات الناتجة عن احتراق الوقود في وحدة الغلاية ، يتم تثبيت سخانات الهواء اللازمة لاحتراق الوقود في قنوات الغاز الأخيرة (الشكل 1). تدخل الغازات الخارجة من المرجل إلى سخان الهواء بدرجة حرارة ويتم تبريدها ، مما يؤدي إلى إطلاق حرارة للهواء ، حتى. في مجرى الغاز لوحدة الغلاية ، تحت تأثير تشغيل عادم الدخان ، يتم ضبط الضغط قليلاً عن الغلاف الجوي. يتم تسخين الهواء الموجود في سخان الهواء من درجة حرارة إلى درجة حرارة.
غازات المداخن
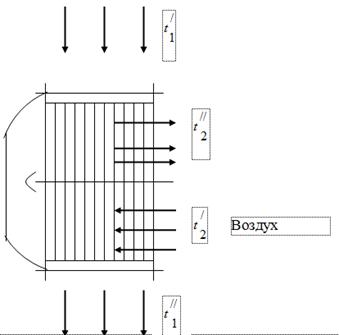
عند اختبار وحدة المرجل تم الحصول على البيانات التالية:
درجة حرارة الغازات عند مدخل سخان الهواء = 450 درجة مئوية.
درجة حرارة الغازات عند مخرج سخان الهواء = 150 درجة مئوية.
درجة حرارة الهواء عند مدخل سخان الهواء = 26 درجة مئوية.
درجة حرارة الهواء عند مخرج سخان الهواء = 260 درجة مئوية.
التركيب الحجمي لغازات المداخن - = 11.5٪ ؛ = 6.5٪ ؛ = 17.2٪ ؛ = 64.8٪
معدل استهلاك الغازات في الساعة هو 50 · / ساعة.
فراغ في أنبوب الغاز - 15 ملم من الماء. فن.
الضغط الجوي 760 ملم زئبق. فن.
حدد:
الوزن الجزيئي الظاهر لغازات المداخن ؛
ثابت غاز المداخن
أجزاء الوزن (الكتلة) للمكونات الفردية التي تتكون منها غازات المداخن ؛
ضغوط جزئية للمكونات:
تدفق الهواء كل ساعة.
افترض أن كل الحرارة المنبعثة من الغاز يمتصها الهواء.
يعتبر اعتماد السعة الحرارية على درجة الحرارة منحنيًا.
1. الوزن الجزيئي الظاهر لغازات المداخن
0.115 44 + 0.065 18 + 0.172 32 + 0.648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. ثابت غاز المداخن
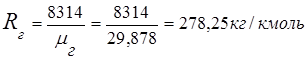
3. الكسور الجماعيةمكونات الغاز
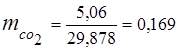
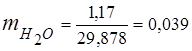
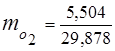
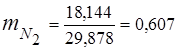
4. ضغوط جزئية للمكونات
سيتم إدخال نتائج الحساب في الجدول
|
خيارات |
خليط الغاز |
|||
|
|
||||
|
|
||||
|
|
5. استهلاك الهواء كل ساعة
يتم تحديد استهلاك الهواء من معادلة توازن الحرارة لسخان الهواء
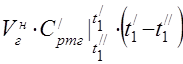
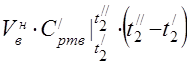
متوسط السعة الحرارية المولية عند 450 درجة مئوية
متوسط السعة الحرارية النوعية للمكونات في نطاق درجة الحرارة 0 ... 450 درجة مئوية.













 .
(1.28)
.
(1.28)