النظرية الحركية الجزيئية للغازات المثالية
هل كنت تعلم،
ما هي التجربة الفكرية ، تجربة gedanken؟
إنها ممارسة غير موجودة ، تجربة دنيوية أخرى ، تخيل ما هو غير موجود بالفعل. تجارب الفكر مثل أحلام اليقظة. يلدون الوحوش. على عكس التجربة الفيزيائية ، التي تُعد اختبارًا تجريبيًا للفرضيات ، فإن "التجربة الفكرية" تحل بطريقة سحرية محل الاختبار التجريبي بالاستنتاجات المرغوبة غير المختبرة ، وتتلاعب بالتركيبات المنطقية التي تنتهك المنطق نفسه فعليًا باستخدام مقدمات غير مثبتة على أنها فرضيات مثبتة ، أي عن طريق الاستبدال. وبالتالي ، فإن المهمة الرئيسية لمقدمي "التجارب الفكرية" هي خداع المستمع أو القارئ عن طريق استبدال التجربة الجسدية الحقيقية بـ "الدمية" - التفكير الوهمي عند الإفراج المشروط دون التحقق المادي نفسه.
أدى ملء الفيزياء بـ "تجارب فكرية" خيالية إلى صورة سخيفة وسريالية ومربكة للعالم. يجب على الباحث الحقيقي أن يميز هذه "الأغلفة" عن القيم الحقيقية.
يجادل النسبيون والوضعيون بأن "التجربة الفكرية" هي أداة مفيدة للغاية لاختبار النظريات (الناشئة أيضًا في أذهاننا) من أجل الاتساق. في هذا يخدعون الناس ، لأن أي تحقق لا يمكن أن يتم إلا من قبل مصدر مستقل عن موضوع التحقق. لا يمكن لمقدم طلب الفرضية نفسه أن يكون اختبارًا لبيانه ، لأن سبب هذا البيان نفسه هو عدم وجود تناقضات مرئية لمقدم الطلب في البيان.
نرى هذا في مثال SRT و GTR ، اللذين تحولا إلى نوع من الدين الذي يحكم العلم و الرأي العام. لا يمكن لأي قدر من الحقائق التي تتعارض معها التغلب على صيغة أينشتاين: "إذا كانت الحقيقة لا تتوافق مع النظرية ، فغيّر الحقيقة" (في نسخة أخرى ، "ألا تتوافق الحقيقة مع النظرية؟ - أسوأ بكثير بالنسبة للحقيقة ").
الحد الأقصى الذي يمكن أن تدعيه "التجربة الفكرية" هو فقط الاتساق الداخلي للفرضية في إطار المنطق الخاص بمقدم الطلب ، وغالبًا لا يكون ذلك صحيحًا بأي حال من الأحوال. الامتثال للممارسة لا يتحقق من ذلك. لا يمكن إجراء الاختبار الحقيقي إلا في تجربة فيزيائية حقيقية.
التجربة هي تجربة ، لأنها ليست تنقيحًا للفكر ، بل اختبارًا للفكر. الفكر المتسق داخل نفسه لا يمكن أن يختبر نفسه. وقد أثبت ذلك كيرت جودل.
في الغاز المخلخل ، تكون المسافة بين الجزيئات أكبر بعدة مرات من حجمها. في هذه الحالة ، يكون التفاعل بين الجزيئات ضئيلًا وتكون الطاقة الحركية للجزيئات أكبر بكثير من الطاقة الكامنة لتفاعلها.
لشرح خصائص مادة في الحالة الغازية ، بدلاً من الغاز الحقيقي ، يتم استخدام نموذجها الفيزيائي - غاز مثالي. يفترض النموذج:
المسافة بين الجزيئات أكبر بقليل من قطرها ؛
الجزيئات كرات مرنة.
لا توجد قوى جذب بين الجزيئات ؛
عندما تصطدم الجزيئات ببعضها البعض ومع جدران الوعاء ، تعمل قوى التنافر ؛
تخضع الحركة الجزيئية لقوانين الميكانيكا.
المعادلة الأساسية لـ mkt الغازي المثالي:
تتيح المعادلة الأساسية لـ MKT حساب ضغط الغاز إذا كانت كتلة الجزيء ومتوسط قيمة مربع السرعة وتركيز الجزيئات معروفة.
ضغط الغاز المثالييكمن في حقيقة أن الجزيئات التي تصطدم بجدران الوعاء تتفاعل معها وفقًا لقوانين الميكانيكا كأجسام مرنة. عندما يصطدم جزيء بجدار الوعاء ، فإن إسقاط السرعة v x لمتجه السرعة على المحور OX ، عموديًا على الجدار ، يغير علامته إلى العكس ، لكنه يظل ثابتًا في القيمة المطلقة. لذلك ، نتيجة لتصادم جزيء مع جدار ، يتغير إسقاط زخمه على محور OX من mv 1x = -mv x إلى mv 2x = mv x. يؤدي التغيير في زخم الجزيء عند الاصطدام بجدار إلى حدوث قوة F 1 عليه من جانب الجدار. التغيير في زخم الجزيء يساوي زخم هذه القوة:
أثناء الاصطدام ، وفقًا لقانون نيوتن الثالث ، يعمل الجزيء على الحائط بقوة F 2 تساوي القيمة المطلقة للقوة F 1 وتوجه بشكل معاكس.
هناك العديد من الجزيئات ، ويضفي كل منها نفس الزخم على الجدار عند الاصطدام. في الثانية ينقلون الدافع 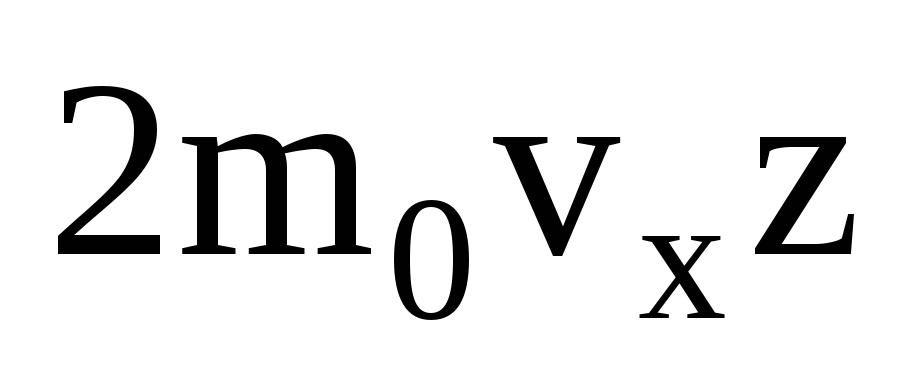 ، حيث z هو عدد اصطدامات جميع الجزيئات بالجدار ، والذي يتناسب مع تركيز الجزيئات في الغاز ، وسرعة الجزيئات ، ومساحة سطح الجدار:
، حيث z هو عدد اصطدامات جميع الجزيئات بالجدار ، والذي يتناسب مع تركيز الجزيئات في الغاز ، وسرعة الجزيئات ، ومساحة سطح الجدار: 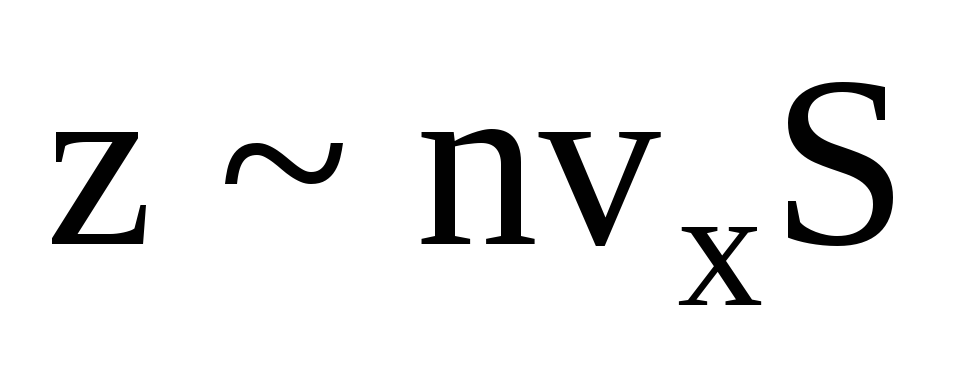 . يتحرك نصف الجزيئات فقط باتجاه الجدار ، والباقي يتحرك في الاتجاه المعاكس:
. يتحرك نصف الجزيئات فقط باتجاه الجدار ، والباقي يتحرك في الاتجاه المعاكس: 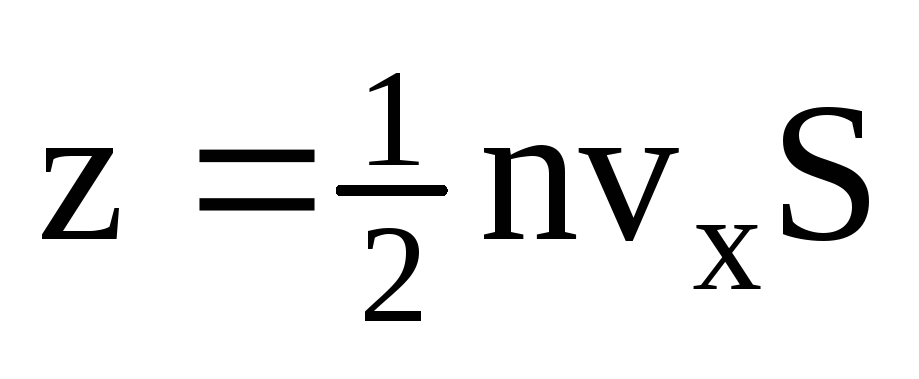 . ثم انتقل الزخم الكلي إلى الحائط في ثانية واحدة:
. ثم انتقل الزخم الكلي إلى الحائط في ثانية واحدة: 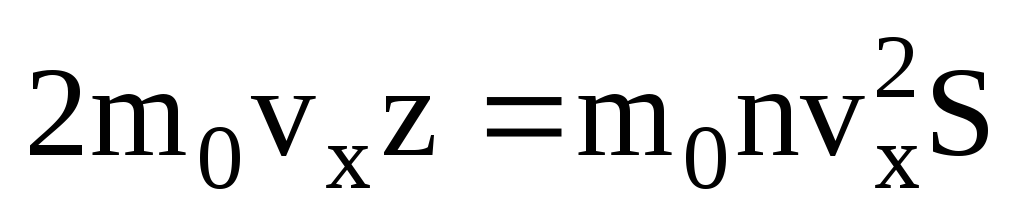 . وفقًا لقانون نيوتن الثاني ، فإن التغير في زخم الجسم لكل وحدة زمنية يساوي القوة المؤثرة عليه:
. وفقًا لقانون نيوتن الثاني ، فإن التغير في زخم الجسم لكل وحدة زمنية يساوي القوة المؤثرة عليه:
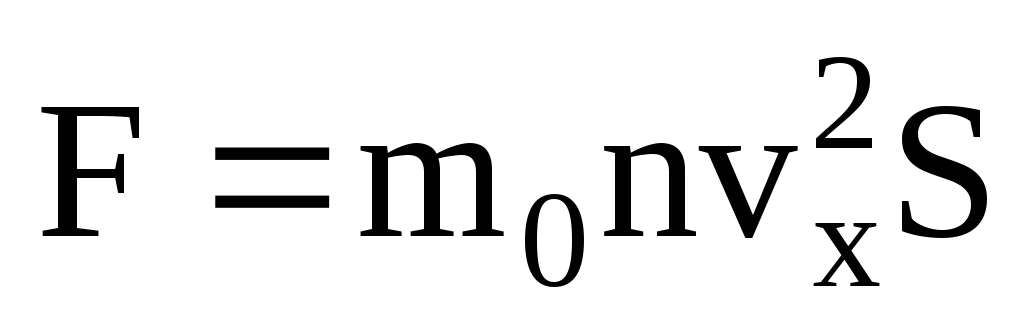
بالنظر إلى أنه ليست كل الجزيئات لها نفس السرعة ، فإن القوة المؤثرة على الجدار ستكون متناسبة مع متوسط مربع السرعة. نظرًا لأن الجزيئات تتحرك في جميع الاتجاهات ، فإن القيم المتوسطة لمربعات إسقاطات السرعة متساوية. لذلك ، فإن متوسط مربع إسقاط السرعة هو: 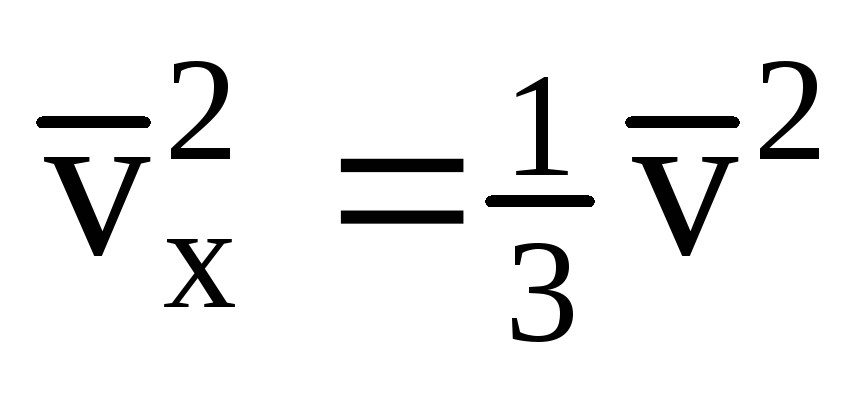 ;
;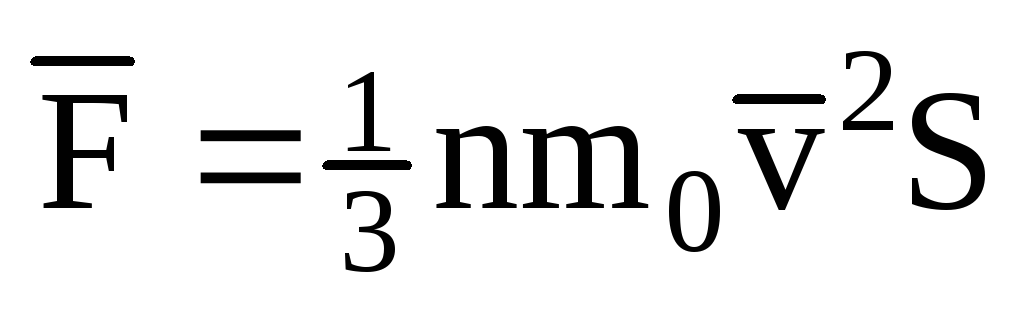 . ثم يكون ضغط الغاز على جدار الوعاء:
. ثم يكون ضغط الغاز على جدار الوعاء:
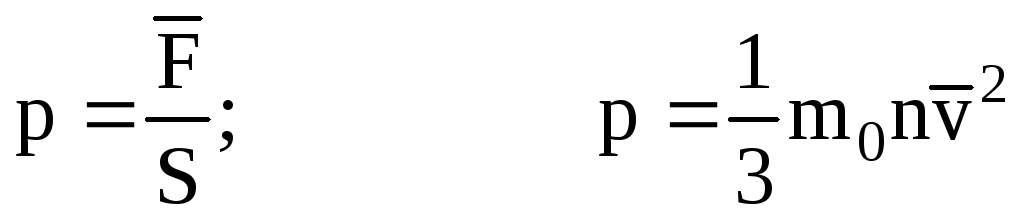 - المعادلة الأساسية لـ MKT.
- المعادلة الأساسية لـ MKT.
للدلالة على متوسط قيمة الطاقة الحركية للحركة الانتقالية للجزيئات غاز مثالي:
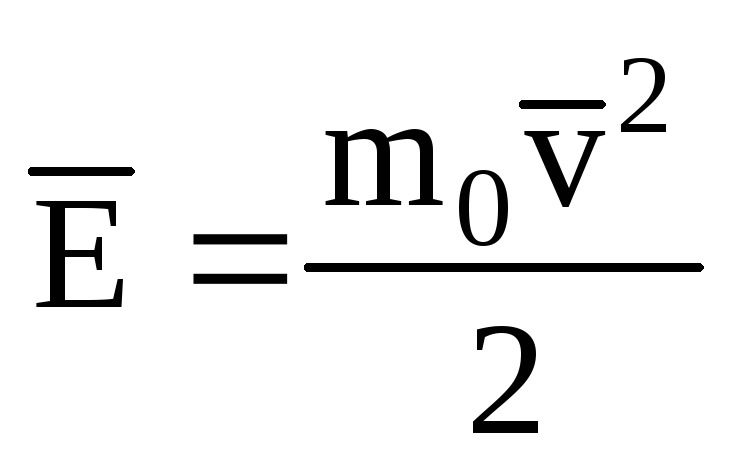 ، نحن نحصل
، نحن نحصل
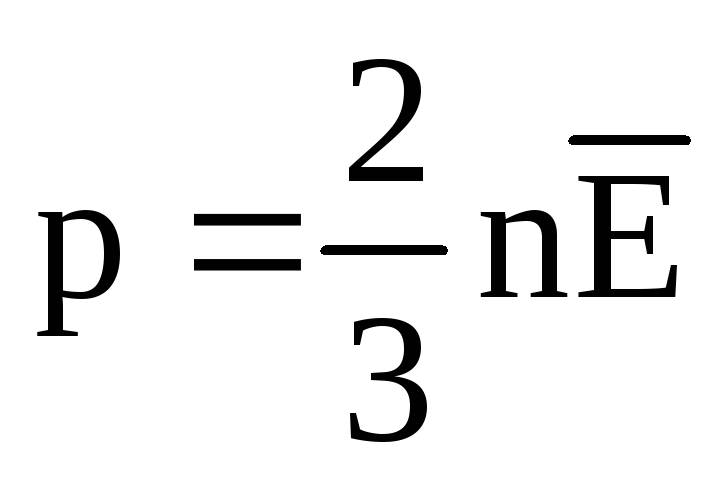
درجة الحرارة وقياسها:
ترتبط معادلة MKT الأساسية للغاز المثالي بالمعامل العياني القابل للقياس بسهولة - الضغط - بمعلمات الغاز المجهرية مثل متوسط الطاقة الحركية وتركيز الجزيئات. لكن بعد قياس الضغط فقط ، لا يمكننا معرفة متوسط قيمة الطاقة الحركية للجزيئات بشكل منفصل ، أو تركيزها. لذلك ، للعثور على المعلمات المجهرية للغاز ، يلزم إجراء قياسات لبعض الكمية الفيزيائية الأخرى المتعلقة بمتوسط الطاقة الحركية للجزيئات. هذه القيمة درجة الحرارة.
أي جسم عياني أو مجموعة من الأجسام العيانية ، في ظل ظروف خارجية ثابتة ، تنتقل تلقائيًا إلى حالة توازن حراري. توازن حراري -هذه حالة تظل فيها جميع المعلمات العيانية دون تغيير لفترة طويلة بشكل تعسفي.
تميز درجة الحرارة حالة التوازن الحراري لنظام الأجسام: جميع أجسام النظام التي تكون في حالة توازن حراري مع بعضها البعض لها نفس درجة الحرارة.
لقياس درجة الحرارة ، يمكنك استخدام التغيير في أي كمية عيانية اعتمادًا على درجة الحرارة: الحجم ، والضغط ، والمقاومة الكهربائية ، وما إلى ذلك.
في أغلب الأحيان في الممارسة العملية ، يتم استخدام اعتماد حجم السائل (الزئبق أو الكحول) على درجة الحرارة. عند معايرة مقياس حرارة ، عادة ما تؤخذ درجة حرارة ذوبان الجليد كنقطة مرجعية (0) ؛ النقطة الثابتة الثانية (100) هي نقطة غليان الماء عند الضغط الجوي العادي (مقياس سيليزيوس). نظرًا لأن السوائل المختلفة تتوسع بشكل مختلف عند تسخينها ، فإن المقياس الذي تم إنشاؤه بهذه الطريقة سيعتمد إلى حد ما على خصائص السائل المحدد. بالطبع ، 0 و 100 درجة مئوية سوف تتطابق مع جميع موازين الحرارة ، لكن 50 درجة مئوية لن تتطابق.
على عكس السوائل ، تتمدد جميع الغازات المتخلخلة بنفس الطريقة عند تسخينها وتغير ضغطها بنفس الطريقة مع تغير درجة الحرارة. لذلك ، في الفيزياء ، لإنشاء مقياس درجة حرارة منطقي ، يتم استخدام تغيير في ضغط كمية معينة من الغاز المخلخل عند حجم ثابت أو تغيير في حجم الغاز عند ضغط ثابت. هذا المقياس يسمى في بعض الأحيان مقياس درجة حرارة الغاز المثالي.
في حالة التوازن الحراري ، يكون متوسط الطاقة الحركية للحركة الانتقالية لجزيئات جميع الغازات هو نفسه. يتناسب الضغط طرديًا مع متوسط الطاقة الحركية للحركة الانتقالية للجزيئات: 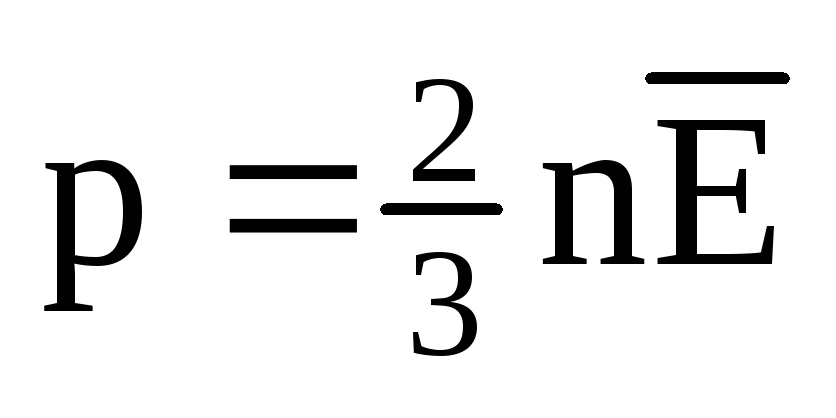 . عند التوازن الحراري ، إذا كان ضغط غاز لكتلة معينة وحجمه ثابتًا ، يجب أن يكون لمتوسط الطاقة الحركية لجزيئات الغاز قيمة محددة بدقة ، مثل درجة الحرارة. لان
. عند التوازن الحراري ، إذا كان ضغط غاز لكتلة معينة وحجمه ثابتًا ، يجب أن يكون لمتوسط الطاقة الحركية لجزيئات الغاز قيمة محددة بدقة ، مثل درجة الحرارة. لان 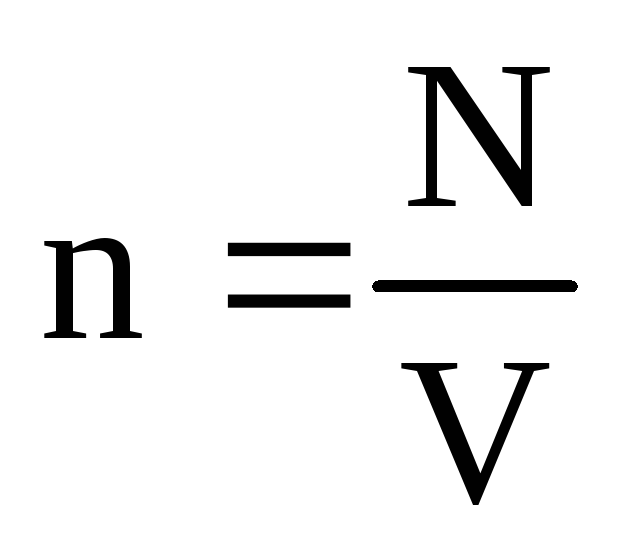 ، ومن بعد
، ومن بعد 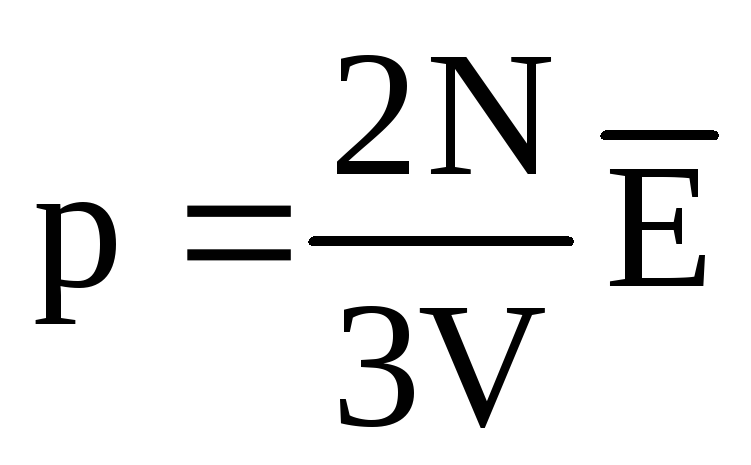 ، أو
، أو 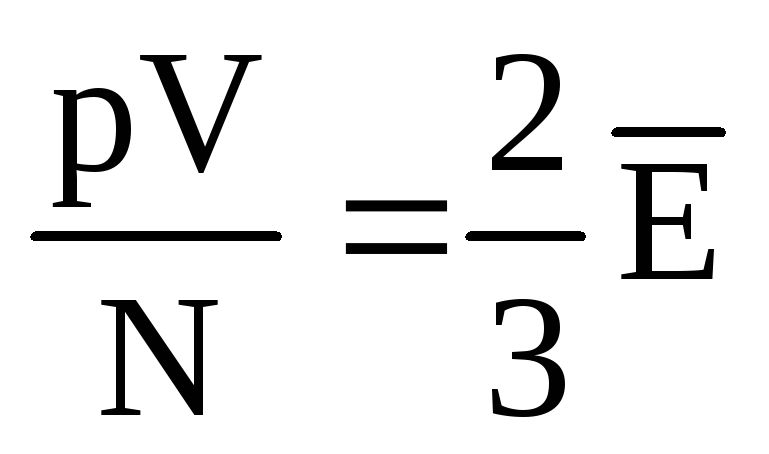 .
.
دل 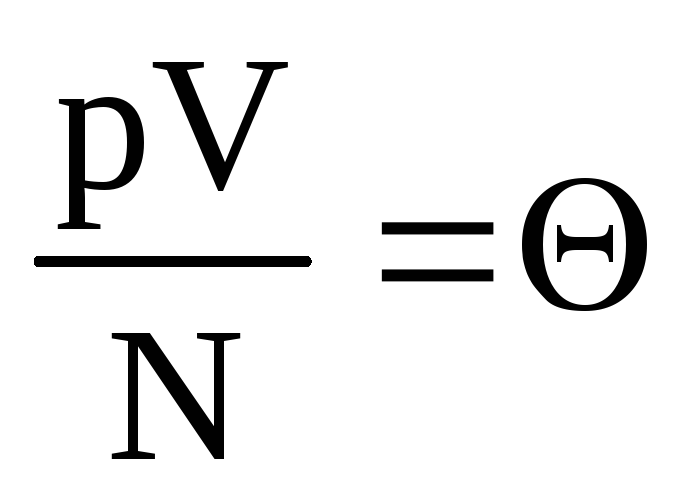 . قيمة
. قيمة  يزيد مع درجة الحرارة ولا يعتمد على أي شيء آخر غير درجة الحرارة. لذلك ، يمكن اعتباره مقياسًا طبيعيًا لدرجة الحرارة.
يزيد مع درجة الحرارة ولا يعتمد على أي شيء آخر غير درجة الحرارة. لذلك ، يمكن اعتباره مقياسًا طبيعيًا لدرجة الحرارة.
تصف النظرية الحركية الجزيئية سلوك وخصائص كائن مثالي خاص يسمى غاز مثالي. يعتمد هذا النموذج الفيزيائي على التركيب الجزيئي للمادة. يرتبط إنشاء النظرية الجزيئية بأعمال R. Clausius و J. Maxwell و D.Joule و L. Boltzmann.
غاز مثالي. النظرية الحركية الجزيئية للغاز المثالي مبني على الافتراضات التالية:
يمكن رؤية الذرات والجزيئات على أنها نقاط مادية، التي هي في حالة حركة مستمرة ؛
الحجم الجوهري لجزيئات الغاز ضئيل مقارنة بحجم الوعاء ؛
يمكن تمييز جميع الذرات والجزيئات ، أي أنه من الممكن من حيث المبدأ متابعة حركة كل جسيم ؛
قبل اصطدام جزيئات الغاز بينهما ، لا توجد قوى تفاعل ، ويُفترض أن تكون اصطدامات الجزيئات بينها وبين جدران الوعاء مرنة تمامًا ؛
توصف قوانين الميكانيكا الكلاسيكية حركة كل ذرة أو جزيء غاز.
يمكن استخدام القوانين التي تم الحصول عليها للغاز المثالي في دراسة الغازات الحقيقية. لهذا الغرض ، يتم إنشاء نماذج تجريبية للغاز المثالي ، تكون فيها خصائص الغاز الحقيقي قريبة من خصائص الغاز المثالي (على سبيل المثال ، عند الضغط المنخفض ودرجات الحرارة المرتفعة).
قوانين الغاز المثالي
قانون بويل ماريوت:
بالنسبة لكتلة معينة من الغاز عند درجة حرارة ثابتة ، يكون ناتج ضغط الغاز وحجمه قيمة ثابتة: pV = const , (1.1)
في تي = مقدار ثابت , م = ثابت .
منحنى يوضح العلاقة بين الكميات رو الخامس، يميز خصائص مادة عند درجة حرارة ثابتة ، ويسمى متساوي الحرارة هذا قطع زائد (الشكل 1.1.) ، وتسمى العملية الجارية عند درجة حرارة ثابتة متساوي الحرارة.
قوانين جاي لوساك:
يختلف حجم كتلة معينة من الغاز عند ضغط ثابت خطيًا مع درجة الحرارة
الخامس = الخامس 0 (1 + ر ) في P = const , م = ثابت . (1.2)

ص = ص 0 (1 + ر ) في V = const , م = ثابت . (1.3)
في المعادلتين (1.2) و (1.3) ، يتم التعبير عن درجة الحرارة على مقياس سيليزيوس والضغط والحجم - عند
0 درجة مئوية ، بينما
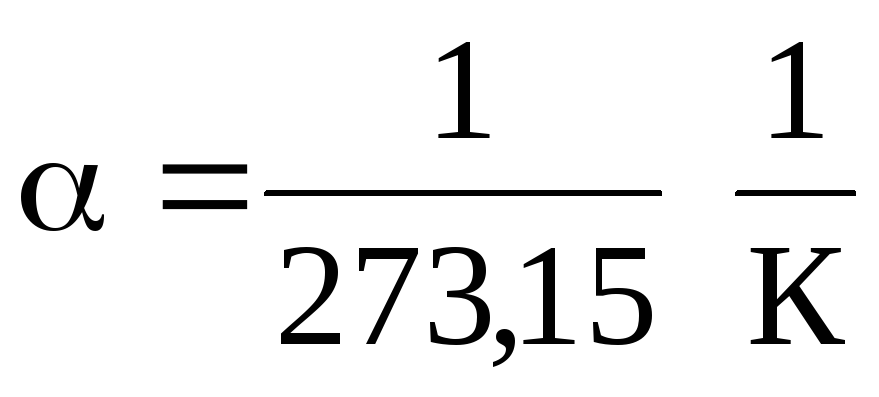 .
.
تسمى العملية التي تحدث عند ضغط مستمر متساوى الضغط، يمكن تمثيلها كدالة خطية (الشكل 1.2).
تسمى العملية التي تحدث بحجم ثابت متساوي الصدر(الشكل 1.3).
يتبع من المعادلتين (1.2) و (1.3) أن تتقاطع خطوط متساوية الأضلاع ونقاط متساوية مع محور درجة الحرارة عند النقطة ر =1/ = - 273.15 درجة مئوية . إذا نقلنا الأصل إلى هذه النقطة ، فإننا ننتقل إلى مقياس كلفن.
إدخال في الصيغ (1.2) و (1.3) درجة الحرارة الديناميكية الحرارية ، يمكن إعطاء قوانين Gay-Lussac شكلاً أكثر ملاءمة:
الخامس = الخامس 0 (1+ر) = = الخامس 0 = =الخامس 0 تي;
ص = ص 0 (1+ر) = ص 0 = ص 0 تي;
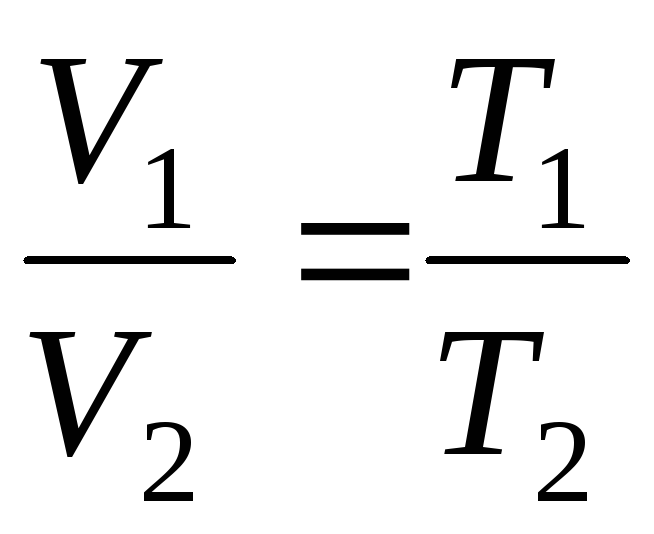 في
ع = const ، م = ثوابت
;
(1.4)
في
ع = const ، م = ثوابت
;
(1.4)
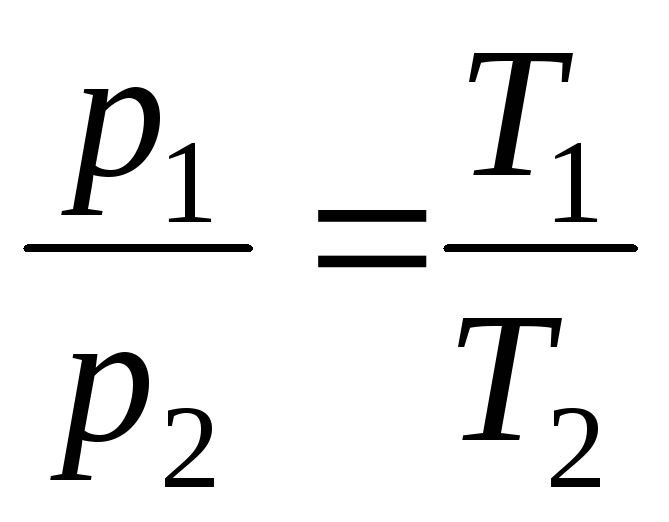 في V = const ، m = const
,
(1.5)
في V = const ، m = const
,
(1.5)
حيث يشير المؤشران 1 و 2 إلى حالات تعسفية تقع على نفس الإيزوبار أو الإيزوكور .
قانون أفوجادرو:
مولات أي غازات في نفس درجات الحرارة والضغط تحتل نفس الأحجام.
في ظل الظروف العادية ، هذا الحجم يساوي الخامس ، 0 = 22.4110 -3 م 3 / مول . بحكم التعريف ، في الخلد الواحد مواد مختلفةيحتوي على نفس عدد الجزيئات ، يساوي أفوجادرو المستمر:ن أ = 6,02210 23 مول -1 .
قانون دالتون:
ضغط الخليط غازات مثاليةيساوي مجموع الضغوط الجزئية ر 1 , ر 2 , ر 3 … رن ، الغازات المضمنة فيه:
ع = ص 1 + ص 2 + ر 3 + ... + ص ن .
ضغط جزئي – هو - هي الضغط الذي سينتجه الغاز في التركيبة خليط الغازإذا احتل وحده حجمًا مساويًا لحجم الخليط عند نفس درجة الحرارة.
معادلة الغاز المثالية للدولة
(معادلة كلابيرون مينديليف)
هناك علاقة محددة بين درجة الحرارة والحجم والضغط. يمكن تمثيل هذه العلاقة بتبعية وظيفية:
و (ع ، الخامس ، تي)= 0.
في المقابل ، كل من المتغيرات ( ص ، ت ، ت) هي دالة لمتغيرين آخرين. تم العثور على نوع الاعتماد الوظيفي لكل حالة مرحلة من مادة (صلبة ، سائلة ، غازية) تجريبيًا. هذه عملية شاقة للغاية وقد تم إنشاء معادلة الحالة فقط للغازات التي تكون في حالة نادرة ، وفي شكل تقريبي لبعض الغازات المضغوطة. بالنسبة للمواد التي ليست في حالة غازية ، لم يتم حل هذه المشكلة بعد.
أحضر الفيزيائي الفرنسي ب.كلابيرون معادلة الغاز المثالية للدولةمن خلال الجمع بين قوانين بويل ماريوت وجاي-لوساك وتشارلز:
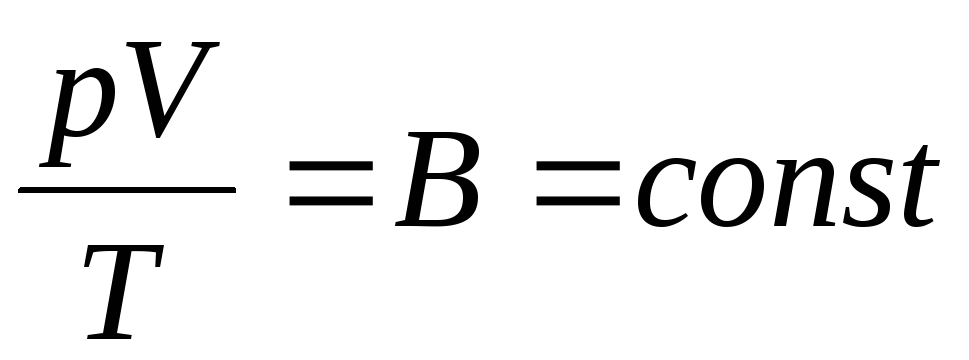 . (1.6)
. (1.6)
التعبير (1.6) هو معادلة كلابيرون ، حيث فيهو ثابت الغاز. يختلف باختلاف الغازات.
دي. دمج منديليف معادلة كلابيرون مع قانون أفوجادرو ، مشيرًا إلى المعادلة (1.6) إلى مول واحد واستخدام الحجم المولي الخامس. وفقا لقانون أفوجادرو ، لنفسه رو تيتحتل مولات جميع الغازات نفس الحجم المولي الخامس .
.
لذلك ، الثابت فيسيكون هو نفسه بالنسبة لجميع الغازات المثالية. عادة ما يتم الإشارة إلى هذا الثابت رويساوي ر=
8,31
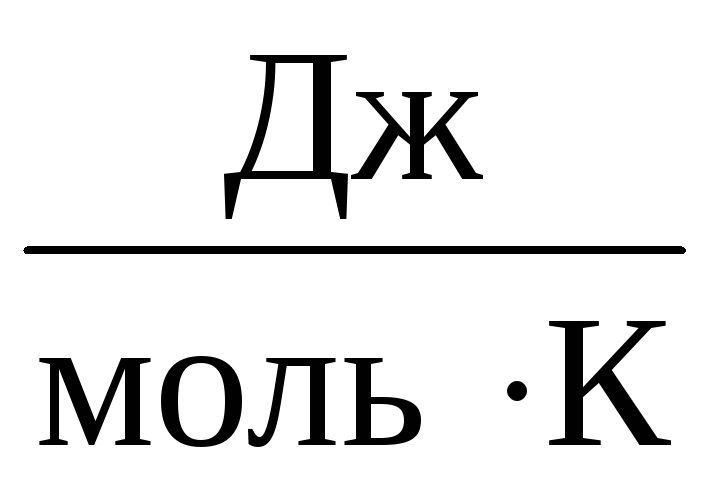 .
.
معادلة كلابيرون مندليف لديه الشكل التالي:
ص الخامس . = آر تي.
من المعادلة (1.7) لمول واحد من الغاز ، يمكن للمرء أن يذهب إلى إلى معادلة Clapeyron-Mendeleev للحصول على كتلة عشوائية من الغاز:
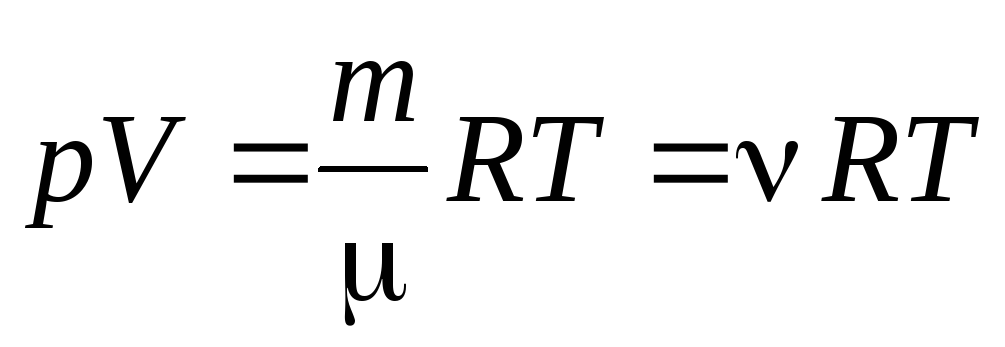 , (1.7)
, (1.7)
أين
–
الكتلة المولية
(كتلة مول واحد من المادة ، كجم / مول) ؛ م
كتلة الغاز
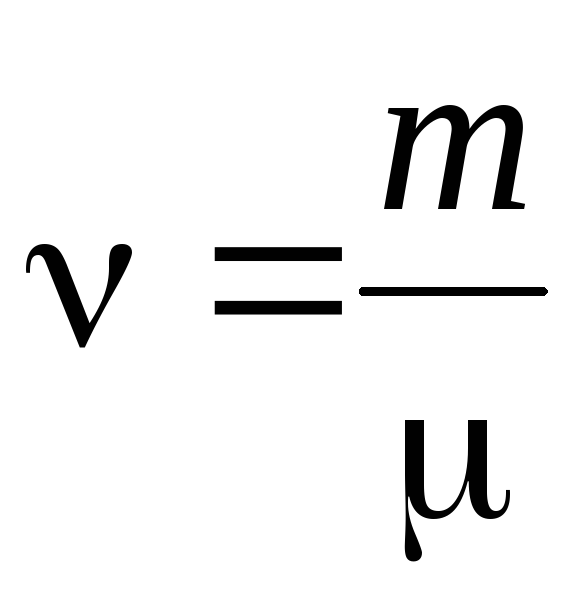 - كمية المادة .
- كمية المادة .
في كثير من الأحيان ، يتم استخدام شكل آخر من أشكال معادلة الغاز المثالية للحالة ثابت بولتزمان: 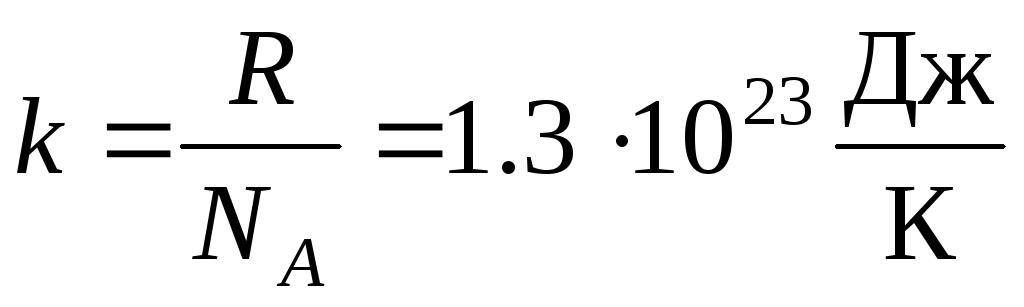 .
.
ثم تبدو المعادلة (1.7) كما يلي:
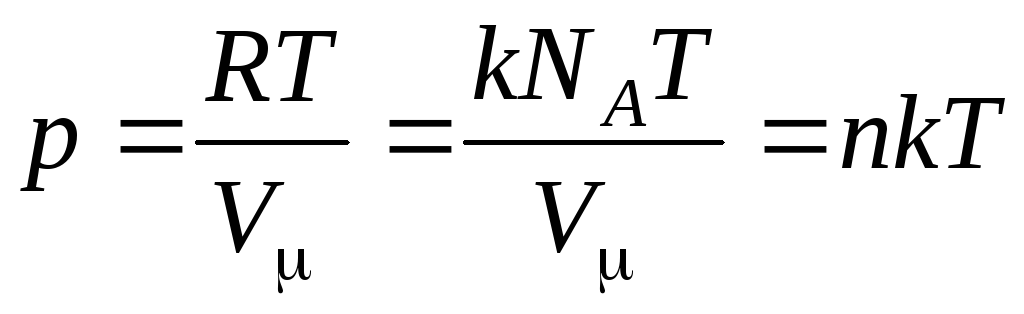 ,
(1.8)
,
(1.8)
أين
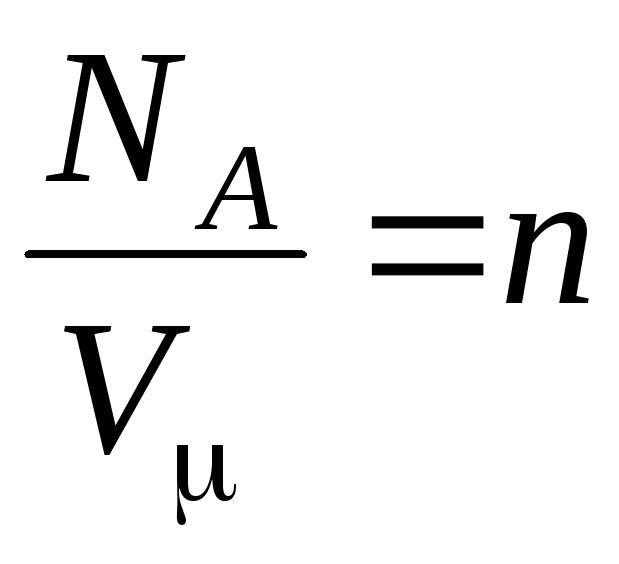 –
تركيز الجزيئات (عدد الجزيئات لكل وحدة حجم). ويترتب على هذا التعبير أن ضغط الغاز المثالي يتناسب طرديًا مع تركيز جزيئاته أو كثافة الغاز. في نفس درجات الحرارة والضغط ، تحتوي جميع الغازات على نفس عدد الجزيئات لكل وحدة حجم. يسمى عدد الجزيئات الموجودة في 1 م 3 في ظل الظروف العادية
رقم Loschmidt:
–
تركيز الجزيئات (عدد الجزيئات لكل وحدة حجم). ويترتب على هذا التعبير أن ضغط الغاز المثالي يتناسب طرديًا مع تركيز جزيئاته أو كثافة الغاز. في نفس درجات الحرارة والضغط ، تحتوي جميع الغازات على نفس عدد الجزيئات لكل وحدة حجم. يسمى عدد الجزيئات الموجودة في 1 م 3 في ظل الظروف العادية
رقم Loschmidt:
ن إل = 2.68 10 25 م -3.
المعادلة الأساسية للحركية الجزيئية
نظرية الغازات المثالية
أهم مهمة النظرية الحركية للغازات هي الحساب النظري لضغط الغاز المثالي على أساس المفاهيم الحركية الجزيئية. يتم اشتقاق المعادلة الأساسية للنظرية الحركية الجزيئية للغازات المثالية باستخدام أساليب إحصائية.
من المفترض أن جزيئات الغاز تتحرك بشكل عشوائي ، وعدد الاصطدامات المتبادلة بين جزيئات الغاز لا يكاد يذكر مقارنة بعدد التأثيرات على جدران الوعاء ، وهذه الاصطدامات مرنة تمامًا. على جدار الوعاء ، منطقة أولية سوحساب الضغط الذي ستمارسه جزيئات الغاز على هذه المنطقة.
من الضروري مراعاة حقيقة أن الجزيئات في الواقع يمكن أن تنتقل إلى الموقع بزوايا مختلفة ويمكن أن تنتقل سرعات مختلفة، والتي ، علاوة على ذلك ، يمكن أن تتغير مع كل تصادم. في الحسابات النظرية ، تكون الحركة الفوضوية للجزيئات مثالية ، ويتم استبدالها بالحركة على طول ثلاثة اتجاهات متعامدة بشكل متبادل.
إذا اعتبرنا إناء على شكل مكعب ، فيه نجزيئات الغاز في ستة اتجاهات ، من السهل أن نرى أنه في أي لحظة يتحرك 1/3 من عدد الجزيئات على طول كل منها ، ونصفها (أي 1/6 من عدد الجزيئات) يتحرك إلى الداخل اتجاه واحد ، والنصف الثاني (أيضًا 1/6) - في الاتجاه المعاكس. مع كل تصادم ، يتحرك جزيء فردي بشكل عمودي على الموقع ، ويعكس ، وينقل الزخم إليه ، بينما يتغير زخمه (الزخم) بمقدار
ر 1 =م 0 الخامس – (– م 0 الخامس) = 2 م 0 الخامس.
سيكون عدد تأثيرات الجزيئات التي تتحرك في اتجاه معين على الموقع مساويًا لـ: ن = 1/6 ن سالخامسر. عند الاصطدام بالمنصة ، ستنقل هذه الجزيئات الزخم إليها.
ص= ن ص 1 =2 م 0 الخامسنسالخامسر = م 0 الخامس 2 نسر,
أين نهو تركيز الجزيئات. ثم يكون الضغط الذي يمارسه الغاز على جدار الوعاء مساوياً لـ:
ع = 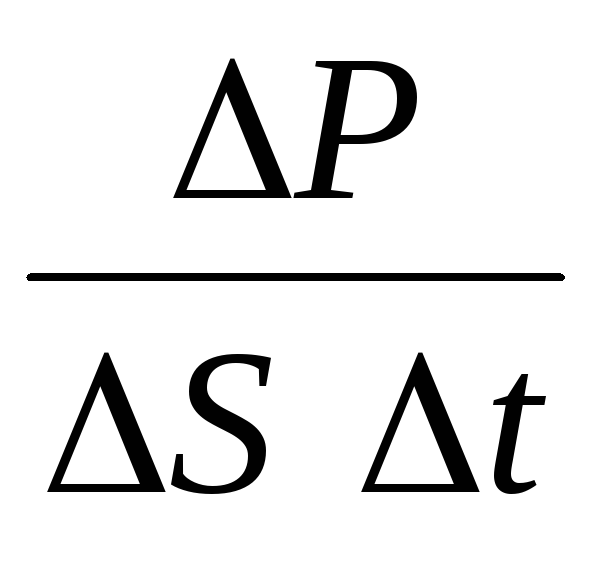 =
ن م 0
الخامس 2
.
(1.9)
=
ن م 0
الخامس 2
.
(1.9)
ومع ذلك ، تتحرك جزيئات الغاز بسرعات مختلفة: الخامس 1 , الخامس 2 , …,الخامس ن، لذلك يجب حساب متوسط السرعات. يحدد مجموع مربعات سرعات جزيئات الغاز ، مقسومًا على عددها ، الجذر التربيعي المتوسط للسرعة:
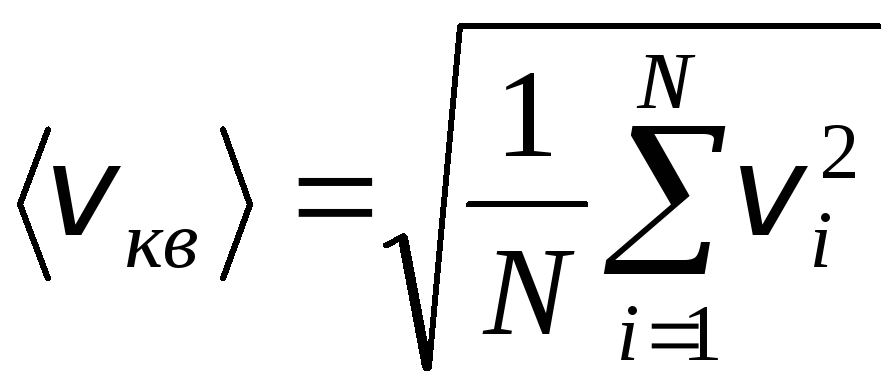 .
.
المعادلة (1.9) سوف يأخذ النموذج:
![]() (1.10)
(1.10)
التعبير (1.10) يسمى المعادلة الأساسية للنظرية الحركية الجزيئيةغازات مثالية.
بشرط 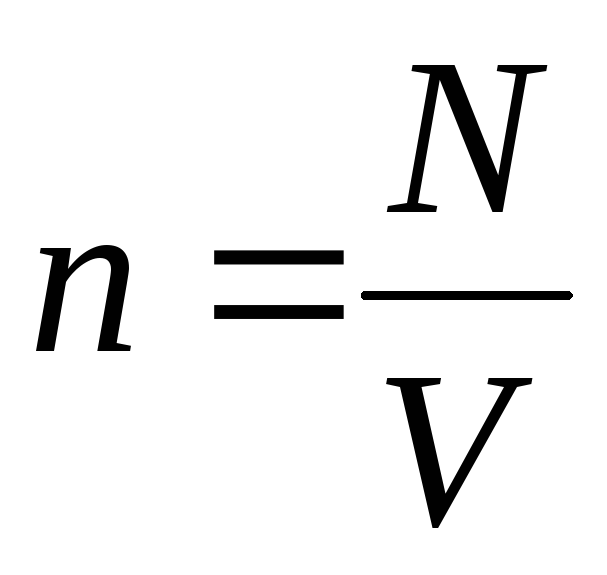 ، نحن نحصل:
، نحن نحصل:
ع V = ن 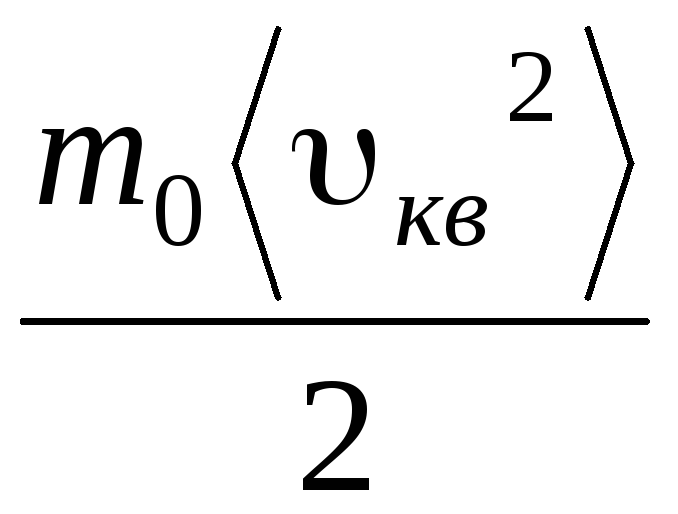 = هـ,
(1.11)
= هـ,
(1.11)
أين ههي الطاقة الحركية الكلية للحركة الانتقالية لجميع جزيئات الغاز. لذلك ، فإن ضغط الغاز يتناسب طرديًا مع الطاقة الحركية للحركة الانتقالية لجزيئات الغاز.
لمول واحد من الغاز م = ، وتحتوي معادلة كلابيرون-مندليف على الشكل التالي:
ص الخامس . = R T,
وبما أنه يتبع من (1.11) ذلك ص الخامس . = الخامس قدم مربع 2 ، نحصل على:
آر تي = الخامس قدم مربع 2 .
ومن ثم ، فإن سرعة الجذر التربيعي لجزيئات الغاز تساوي
الخامس
قدم مربع
=
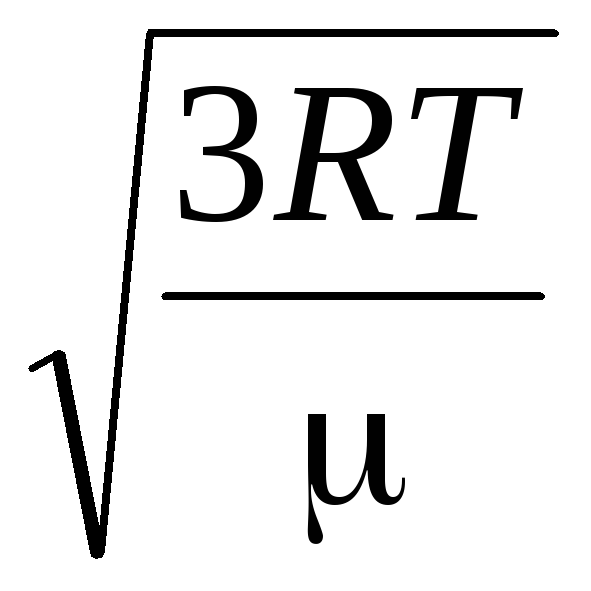 =
=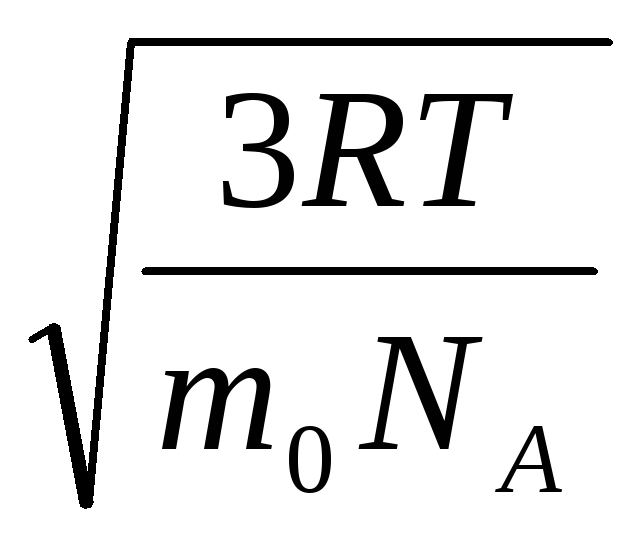 =
= ,
,
أين ك = ر/ن أ = 1.3810 -23 جول / كلفن - ثابت بولتزمان. من هنا يمكنك إيجاد متوسط السرعة المربعة لجزيئات الأكسجين عند درجة حرارة الغرفة - 480 م / ث ، الهيدروجين - 1900 م / ث.
المعنى الجزيئي الحركي لدرجة الحرارة
درجة الحرارة هي مقياس كمي لمدى حرارة الجسم. لتوضيح المعنى الفيزيائي لدرجة الحرارة الديناميكية الحرارية المطلقة تيدعونا نقارن المعادلة الأساسية للنظرية الحركية الجزيئية للغازات (1.14) مع معادلة كلابيرون-مندليف. صالخامس = ر.
معادلة الأجزاء الصحيحة من هذه المعادلات ، نجد متوسط قيمة الطاقة الحركية 0 لجزيء واحد ( = ن/ن أ ، ك=ر/ن أ):
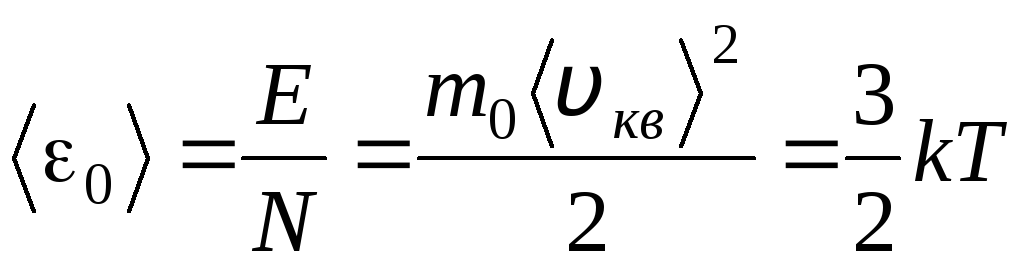 .
.
يتبع أهم استنتاج للنظرية الحركية الجزيئية من هذه المعادلة: متوسط الطاقة الحركية للحركة الانتقالية لجزيء واحد من الغاز المثالي يعتمد فقط على درجة الحرارة ، بينما يتناسب طرديًا مع درجة الحرارة الديناميكية الحرارية. وبالتالي ، يكتسب مقياس درجة الحرارة الديناميكي الحراري معنى فيزيائيًا مباشرًا: at تي= 0 الطاقة الحركية لجزيئات الغاز المثالية هي صفر. لذلك ، بناءً على هذه النظرية ، ستتوقف الحركة الانتقالية لجزيئات الغاز وسيصبح ضغطها مساويًا للصفر.
نظرية خصائص التوازن للغاز المثالي
عدد درجات حرية الجزيئات. تؤدي النظرية الحركية الجزيئية للغازات المثالية إلى نتيجة مهمة للغاية: تتحرك جزيئات الغاز بشكل عشوائي ، ومتوسط الطاقة الحركية للحركة الانتقالية للجزيء يتحدد بدرجة الحرارة فقط.
لا تستنفد الحركية الطاقة الحركية للحركة الجزيئية طاقة الحركة إلى الأمام: يتكون أيضًا من حركية الطاقات دورانو تقلباتالجزيئات. من أجل حساب الطاقة التي تدخل في جميع أنواع الحركة الجزيئية ، من الضروري تحديدها عدد درجات الحرية.
تحت عدد درجات الحرية (أنا) من الجسد ضمنيًا عدد الإحداثيات المستقلة التي يجب إدخالها لتحديد موضع الجسم في الفضاء.
ح  على سبيل المثال ، النقطة المادية لها ثلاث درجات من الحرية ، حيث يتم تحديد موضعها في الفضاء بثلاثة إحداثيات: س ، صو ض. لذلك ، يمتلك الجزيء أحادي الذرة ثلاث درجات من حرية الحركة الانتقالية.
على سبيل المثال ، النقطة المادية لها ثلاث درجات من الحرية ، حيث يتم تحديد موضعها في الفضاء بثلاثة إحداثيات: س ، صو ض. لذلك ، يمتلك الجزيء أحادي الذرة ثلاث درجات من حرية الحركة الانتقالية.
د 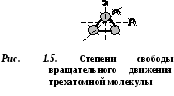 يمتلك الجزيء البوتشاتومي 5 درجات من الحرية (الشكل 1.4): 3 درجات من حرية الحركة الانتقالية ودرجتان من حرية الحركة الدورانية.
يمتلك الجزيء البوتشاتومي 5 درجات من الحرية (الشكل 1.4): 3 درجات من حرية الحركة الانتقالية ودرجتان من حرية الحركة الدورانية.
تمتلك جزيئات ثلاث ذرات أو أكثر 6 درجات من الحرية: 3 درجات من حرية الحركة الانتقالية و 3 درجات من حرية الحركة الدورانية (الشكل 1.5).
يحتوي كل جزيء غاز على عدد معين من درجات الحرية ، ثلاثة منها تتوافق مع حركته الانتقالية.
لائحة التوزيع العادل للطاقة
بدرجات الحرية
الفرضية الأساسية للنظرية الحركية الجزيئية للغازات هي افتراض العشوائية الكاملة في حركة الجزيئات. هذا ينطبق على كل من الحركات التذبذبية والدورانية ، وليس فقط الترجمة. من المفترض أن جميع اتجاهات حركة الجزيئات في الغاز متساوية في الاحتمال. لذلك ، يمكن الافتراض أنه لكل درجة حرية للجزيء ، في المتوسط ، هناك نفس كمية الطاقة - هذا هو الموضع في تقسيم الطاقة على درجات الحرية. الطاقة لكل درجة حرية واحدة للجزيء هي:
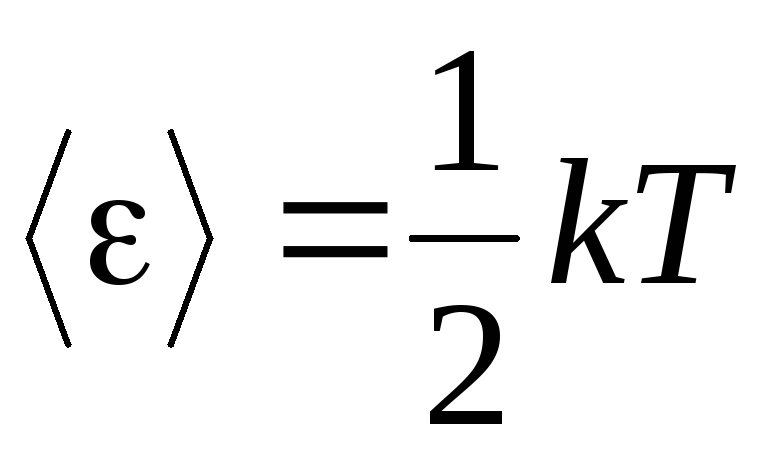 . (1.12)
. (1.12)
إذا كان للجزيء أنادرجات الحرية ، إذن لكل درجة من الحرية يوجد في المتوسط:
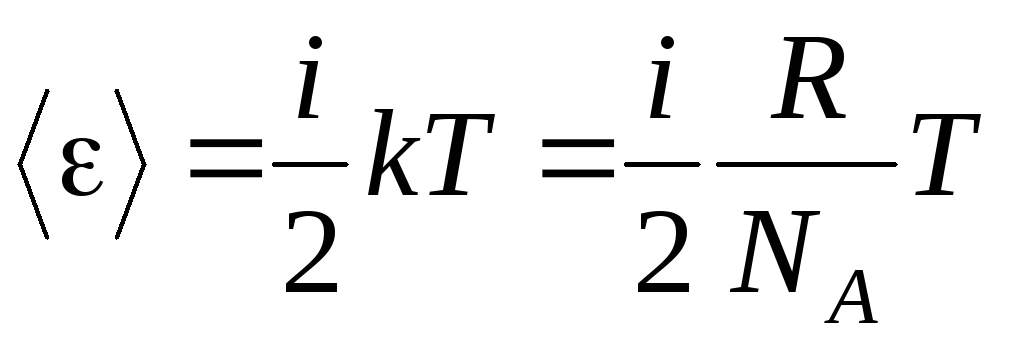 .
(1.13)
.
(1.13)
الطاقة الداخلية للغاز المثالي
إذا نسبنا إجمالي العرض للطاقة الداخلية للغاز إلى مول واحد ، فإننا نحصل على قيمته بضرب في رقم Avogadro:
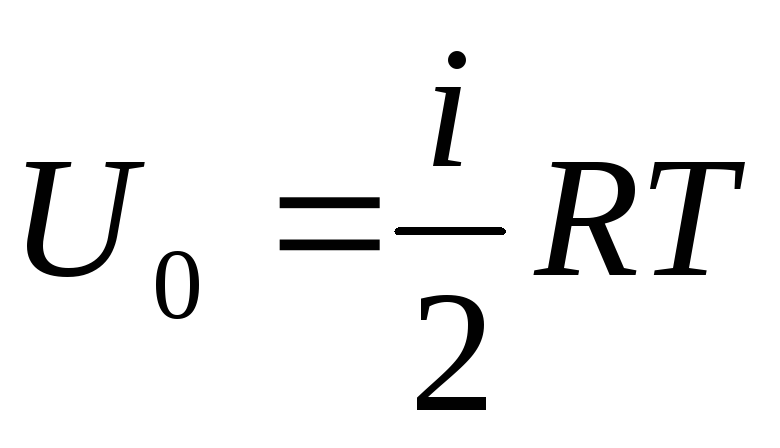 .
(1.14)
.
(1.14)
ويترتب على ذلك أن الطاقة الداخلية لمول واحد من الغاز المثالي تعتمد فقط على درجة الحرارة وعدد درجات الحرية لجزيئات الغاز.
توزيعات ماكسويل وبولتزمان
توزيع جزيئات الغاز المثالي من حيث سرعات وطاقات الحركة الحرارية (توزيع ماكسويل). عند درجة حرارة غاز ثابتة ، يُفترض أن تكون جميع اتجاهات الحركة الجزيئية محتملة بشكل متساوٍ. في هذه الحالة ، تظل سرعة الجذر التربيعي لكل جزيء ثابتة وتساوي
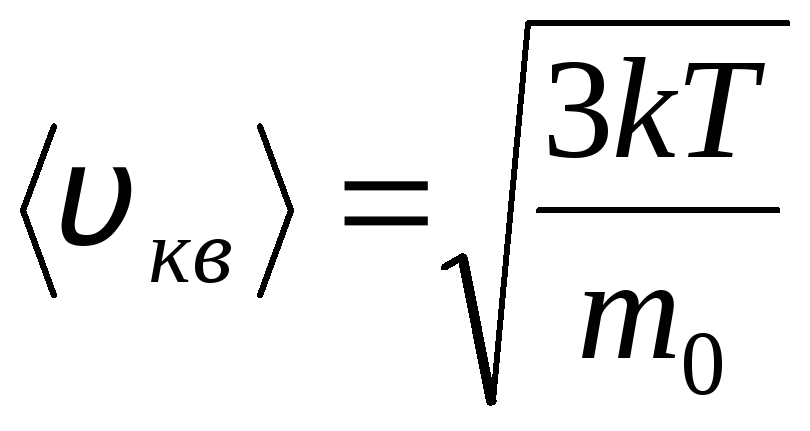 .
.
ويفسر ذلك حقيقة أنه في الغاز المثالي ، الذي يكون في حالة توازن ، يتم إنشاء توزيع معين للسرعة الثابتة للجزيئات التي لا تتغير بمرور الوقت. يخضع هذا التوزيع لقانون إحصائي معين ، اشتق نظريًا بواسطة J. Maxwell. قانون ماكسويل موصوف بالوظيفة
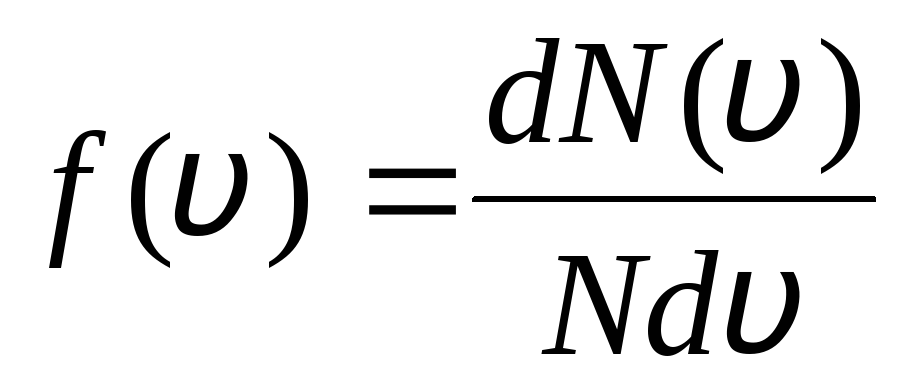 ,
,
هذه هي الوظيفة F(الخامس) يحدد العدد النسبي للجزيئات  ، التي تقع سرعاتها في الفترة من الخامس
قبل الخامس+ دالخامس. وجد ماكسويل تطبيق طرق نظرية الاحتمالات قانون توزيع جزيئات الغاز المثالي من حيث السرعات:
، التي تقع سرعاتها في الفترة من الخامس
قبل الخامس+ دالخامس. وجد ماكسويل تطبيق طرق نظرية الاحتمالات قانون توزيع جزيئات الغاز المثالي من حيث السرعات:
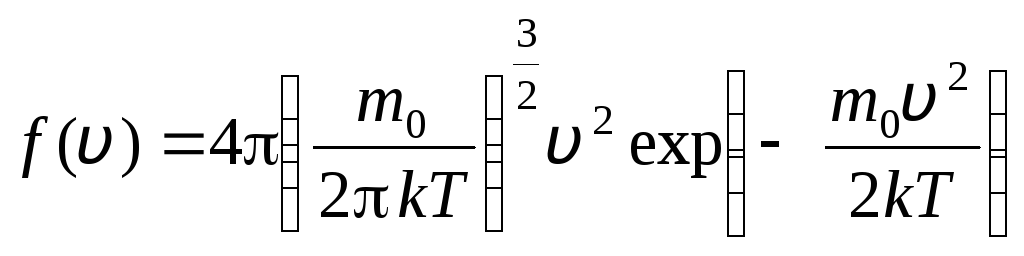 . (1.15)
. (1.15)
تظهر دالة التوزيع بيانياً في الشكل. 1.6 المساحة التي يحدها منحنى التوزيع والمحور x يساوي واحدًا. هذا يعني أن الوظيفة F(الخامس) يفي بشرط التطبيع:
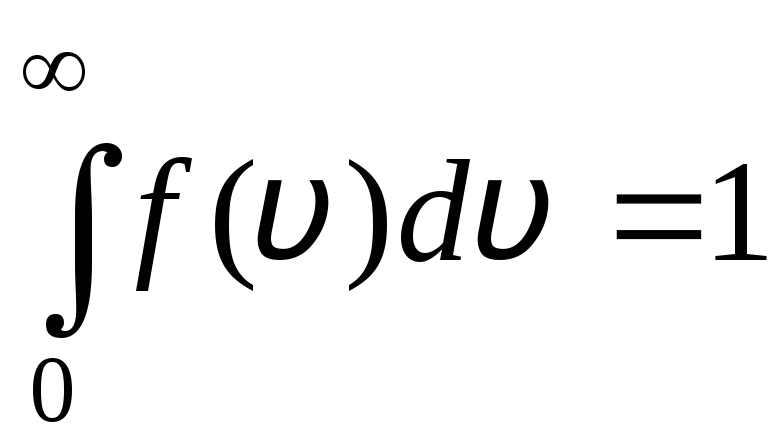 .
.
مع  السرعة التي بها دالة توزيع جزيئات الغاز المثالية من حيث السرعات F(الخامس) هو الحد الأقصى ، يسمى على الأرجح
سرعة
الخامس ب .
السرعة التي بها دالة توزيع جزيئات الغاز المثالية من حيث السرعات F(الخامس) هو الحد الأقصى ، يسمى على الأرجح
سرعة
الخامس ب .
قيم الخامس = 0 و الخامس = تتوافق مع الحد الأدنى للتعبير (1.15). يمكن إيجاد السرعة الأكثر احتمالًا عن طريق التمييز بين التعبير (1.23) ومعادلته بالصفر:
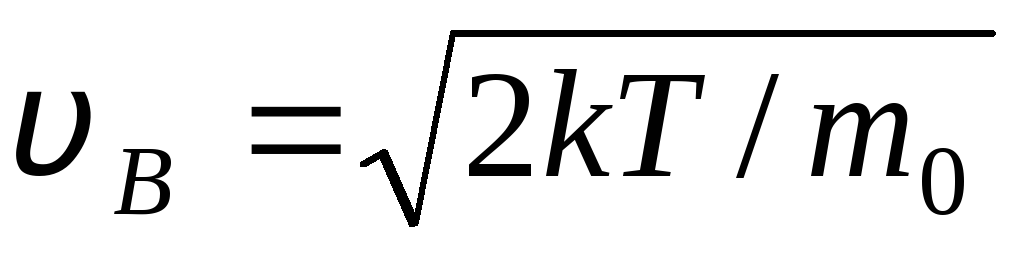 =
=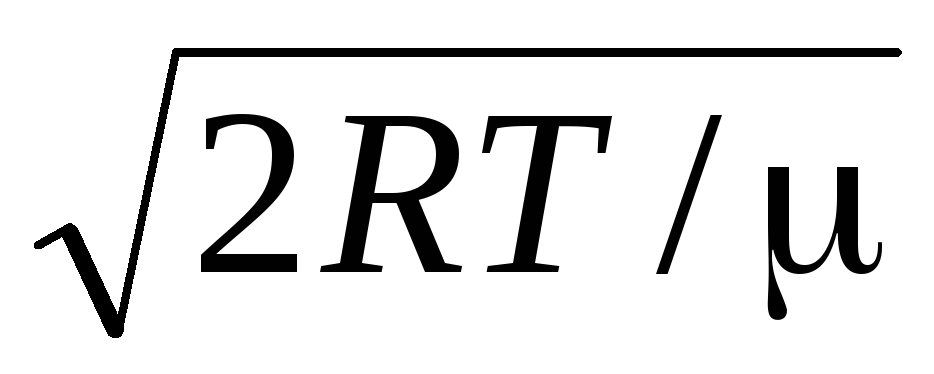 =
1,41
=
1,41
مع زيادة درجة الحرارة ، سيتحول الحد الأقصى للدالة إلى اليمين (الشكل 1.6) ، أي مع زيادة درجة الحرارة ، تزداد السرعة الأكثر احتمالية أيضًا ، ومع ذلك ، تظل المنطقة التي يحدها المنحنى دون تغيير. وتجدر الإشارة إلى أنه في الغازات وفي درجات الحرارة المنخفضة يوجد دائمًا عدد قليل من الجزيئات التي تتحرك بسرعات عالية. وجود مثل هذه الجزيئات "الساخنة" له أهمية عظيمةخلال العديد من العمليات.
متوسط السرعة الحسابيةيتم تحديد الجزيئات بواسطة الصيغة
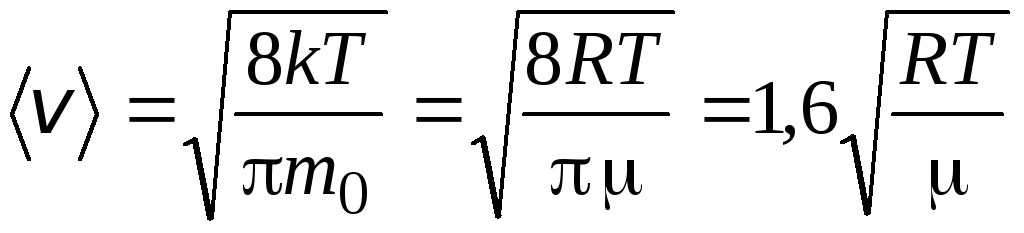 .
.
الجذر يعني سرعة التربيعية
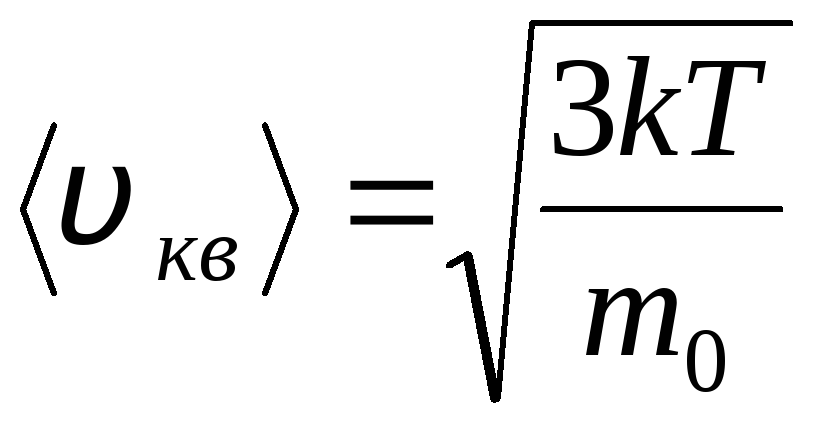 =
1,73
=
1,73 .
.
لا تعتمد نسبة هذه السرعات على درجة الحرارة أو نوع الغاز.
وظيفة توزيع الجزيئات بواسطة طاقات الحركة الحرارية. يمكن الحصول على هذه الوظيفة عن طريق استبدال قيمة الطاقة الحركية بدلاً من السرعة في معادلة توزيع الجزيئات (1.15):
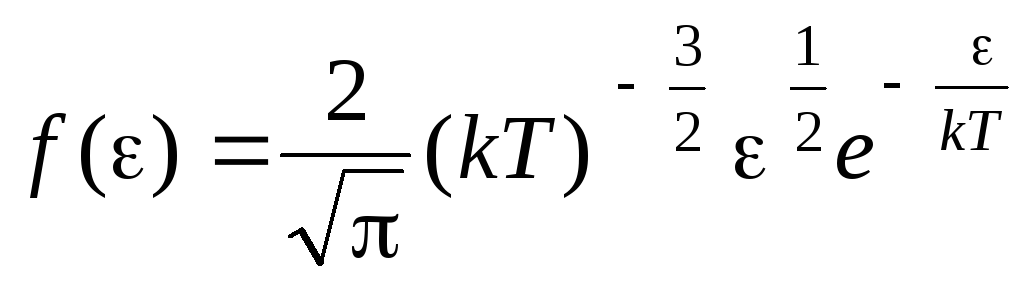 .
.
بعد دمج التعبير على قيم الطاقة من  قبل
قبل 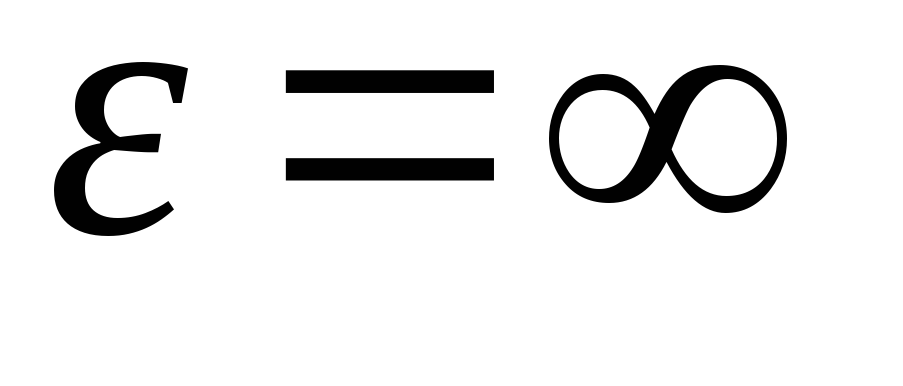
 ، نحن نحصل متوسط الطاقة الحركيةجزيئات الغاز المثالية:
، نحن نحصل متوسط الطاقة الحركيةجزيئات الغاز المثالية:
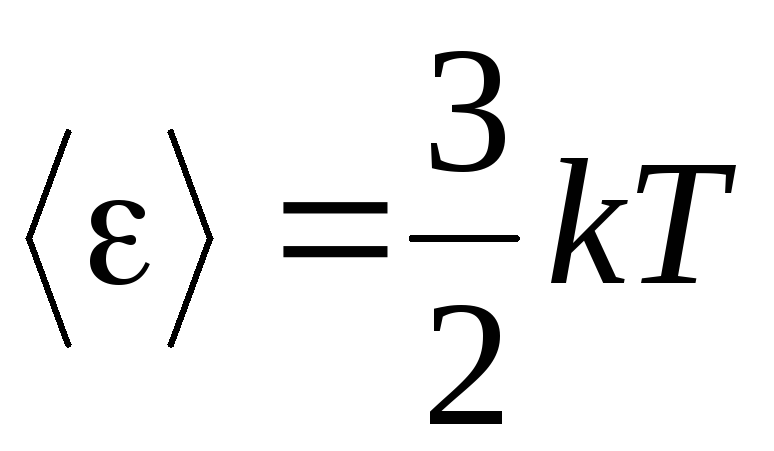 .
.
الصيغة البارومترية. توزيع بولتزمان. عند اشتقاق المعادلة الأساسية للنظرية الحركية الجزيئية للغازات وتوزيع ماكسويل للجزيئات بالسرعات ، كان من المفترض أن جزيئات الغاز المثالي لا تتأثر بالقوى الخارجية ، وبالتالي يتم توزيع الجزيئات بشكل موحد في جميع أنحاء الحجم. ومع ذلك ، فإن جزيئات أي غاز موجودة في مجال الجاذبية الأرضية. عند اشتقاق قانون اعتماد الضغط على الارتفاع ، يُفترض أن مجال الجاذبية موحد ، ودرجة الحرارة ثابتة ، وكتلة جميع الجزيئات هي نفسها:
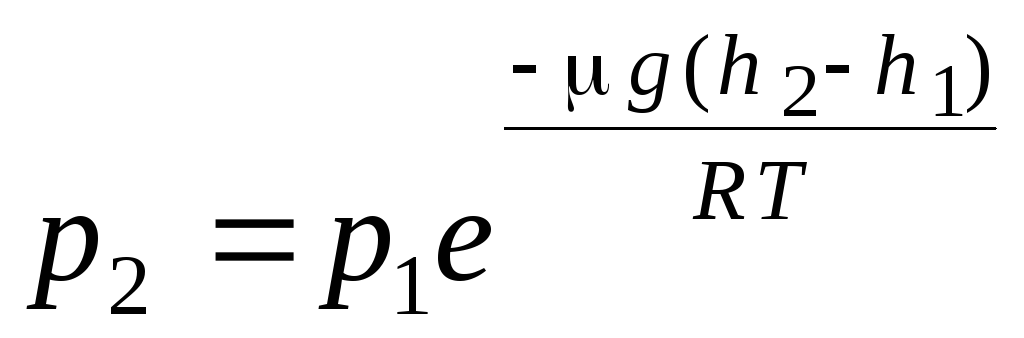 . (1.16)
. (1.16)
التعبير (1.16) يسمى الصيغة البارومترية. يسمح لك بإيجاد الضغط الجوي اعتمادًا على الارتفاع ، أو عن طريق قياس الضغط ، يمكنك معرفة الارتفاع. لان ح 1 هو الارتفاع فوق مستوى سطح البحر ، حيث يعتبر الضغط طبيعيًا ، ثم يمكن تعديل التعبير:
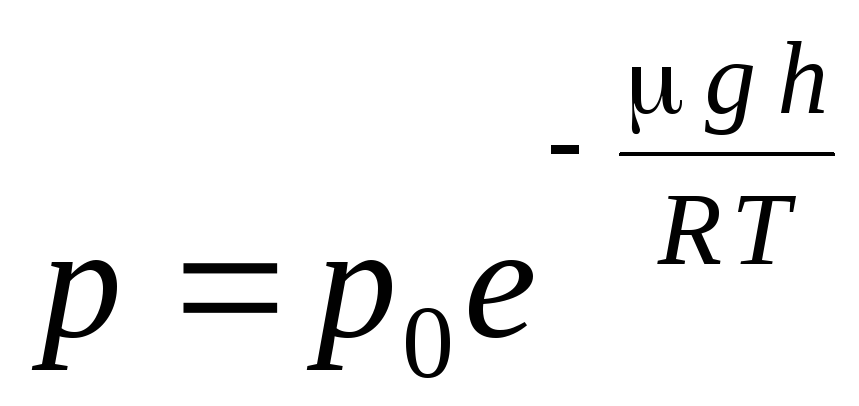 .
.
يمكن تحويل الصيغة البارومترية باستخدام التعبير ع = nkT:
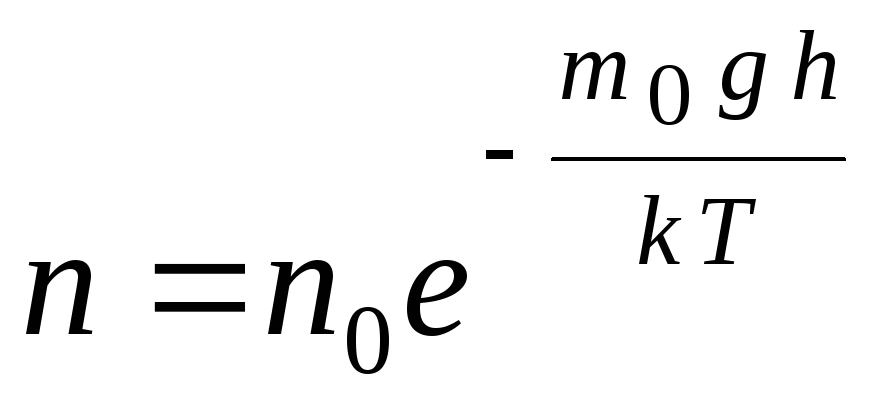 ,
,
جي  دي ن
–
تركيز الجزيئات على ارتفاع ح,
م 0
gh=ص–
الطاقة الكامنة للجزيء في مجال الجاذبية. عند درجة حرارة ثابتة ، تكون كثافة الغاز أكبر حيث تكون الطاقة الكامنة للجزيء أقل. بيانياً ، يبدو قانون التناقص في عدد الجسيمات لكل وحدة حجم مع ارتفاع كما هو موضح في الشكل. 1.7
دي ن
–
تركيز الجزيئات على ارتفاع ح,
م 0
gh=ص–
الطاقة الكامنة للجزيء في مجال الجاذبية. عند درجة حرارة ثابتة ، تكون كثافة الغاز أكبر حيث تكون الطاقة الكامنة للجزيء أقل. بيانياً ، يبدو قانون التناقص في عدد الجسيمات لكل وحدة حجم مع ارتفاع كما هو موضح في الشكل. 1.7
بالنسبة لحقل محتمل خارجي تعسفي ، نكتب التعبير العام التالي
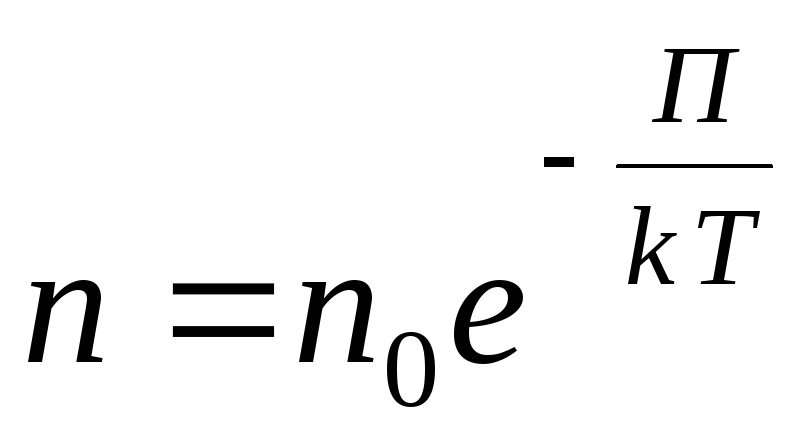 ,
,
