У яких одиницях вимірюють теплоємність. Теплоємність газів. Види теплоємностей
Теплоємністю тіла називають кількість теплоти, яку потрібно повідомити дане тіло, щоб підвищити його температуру на один градус. При остиганні на один градус тіло віддає таку ж кількість тепла. Теплоємність пропорційна масі тіла. Теплоємність одиниці маси тіла називається питомою, а добуток питомої теплоємності на атомну чи молекулярну масу - відповідно атомної чи молярної.
Теплоємності різних речовинсильно різняться між собою. Так, питома теплоємністьводи при 20 ° С становить 4200 Дж/кг К, соснового дерева - 1700, повітря - 1010. У металів вона менше: алюмінію - 880 Дж/кг К, заліза - 460, міді - 385, свинцю - 130. Питома теплоємність слабо зростає з температурою (при 90° З теплоємність води становить 4220 Дж/кг) і сильно змінюється при фазових перетвореннях: теплоємність льоду при 0° З в 2 рази менше, ніж води; теплоємність водяної пари при 100° близько 1500 Дж/кг До.
Теплоємність залежить від умов, у яких відбувається зміна температури тіла. Якщо розміри тіла не змінюються, то вся теплота йде зміну внутрішньої енергії. Тут йдеться про теплоємність при постійному обсязі. При постійному зовнішньому тиску завдяки тепловому розширенню відбувається механічна робота проти зовнішніх сил, і нагрівання на ту чи іншу температуру потребує більшого тепла. Тому теплоємність при постійному тиску завжди більша, ніж . Для ідеальних газів(див. рис.), де R - постійна газова, рівна 8,32 Дж/моль До.
Зазвичай вимірюється. Класичний спосібвимірювання теплоємності наступний: тіло, теплоємність якого хочуть виміряти, нагрівають до певної температури і поміщають у калориметр з початковою температурою (наповнений водою або іншою рідиною з відомою теплоємністю та - теплоємності калориметра та рідини).
Вимірюючи температуру в калориметрі після встановлення теплової рівноваги можна обчислити теплоємність тіла за формулою:
![]()
де і - маси тіла, рідини та калориметра.
Найбільш розвинена теорія теплоємності газів. При нормальних температурах нагрівання призводить в основному до зміни енергії поступального і обертального руху молекул газу. Для молярної теплоємності одноатомних газів теорія дає двоатомних і багатоатомних-і. При дуже низьких температурах теплоємність дещо менша через квантові ефекти (див. Квантова механіка). При високих температурахдодається коливальна енергія, і теплоємність багатоатомних газів зростає із зростанням температури.
Атомна теплоємність кристалів, за класичною теорією, дорівнює , що узгоджується з емпіричним законом Дюлонга і Пті (встановлений в 1819 французькими вченими П. Дюлонгом і А. Пті). Квантова теоріятеплоємності призводить до такого ж висновку при високих температурах, але передбачає зменшення теплоємності при зниженні температури. Поблизу абсолютного нуля теплоємність всіх тіл прагне нуля (третій закон термодинаміки).
Теплоємність тіла- це фізична величина, що визначається ставленням кількості теплоти, поглиненої тілом при нагріванні, до зміни його температури:
Фізичний зміст теплоємності тіла: теплоємність тіла дорівнює кількості теплоти, поглиненому тілом при нагріванні або виділеному при охолодженні на 1К.
Оскільки теплоємності змінні величини, то розрізняють середню та справжню теплоємності. Під середньою теплоємністю розуміють відношення кількості теплоти q , підведеної до одиниці кількості речовини (газу), до зміни її температури від t 1 до t 2 за умови, що різниця температур t 2 - t 1 є величиною кінцевою. Середні масова, об'ємна та мольна теплоємності відповідно позначаються через c m , c m ' і m . З визначення середньої теплоємності слід, що й температура газу підвищується від t 1 до t 2 то його середня теплоємність [кДж/(кг*К)]
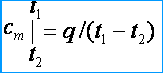
Під справжньою теплоємністю розуміють теплоємність газу, що відповідає нескінченно малій зміні температури газу, що відповідає нескінченно малій зміні температури. dt , тобто.
c = dq/dt,
звідки dq = cdt.
Питома теплоємність- Це здатність різних речовин до поглинання теплоти при їх нагріванні. Питома теплоємність речовини визначається відношенням кількості теплоти, отриманої ним при нагріванні, до маси речовини та зміни її температури, якщо: ![]()
співвідношення, що виражає зв'язок між молярними теплоємностями Cp і CV, має вигляд (формула Майєра): Cp = CV + R. ідеального газуЯкщо в результаті теплообміну тілу передається деяка кількість теплоти, то внутрішня енергія тіла та її температура змінюються. Кількість теплоти Q, необхідне нагрівання 1 кг речовини на 1 До називають питомої теплоємністю речовини c. c = Q/(mΔT). У багатьох випадках зручно використовувати молярну теплоємність C: C = M · c де M - молярна маса речовини. Певна таким чином теплоємність не є однозначною характеристикою речовини. Відповідно до першого закону термодинаміки зміна внутрішньої енергії тіла залежить тільки від отриманої кількості теплоти, а й від роботи, досконалої тілом. Залежно та умовами, за яких здійснювався процес теплопередачі, тіло могло здійснювати різну роботу. Тому однакова кількість теплоти, передана тілу, могла викликати різні зміни внутрішньої енергії і, отже, температури. Така неоднозначність визначення теплоємності характерна лише для газоподібної речовини. При нагріванні рідких і твердих тіл їх обсяг практично не змінюється і робота розширення виявляється рівною нулю. Тому вся кількість теплоти, отримана тілом, йде зміну його внутрішньої енергії. На відміну від рідин та твердих тіл, газ у процесі теплопередачі може сильно змінювати свій обсяг та виконувати роботу. Тому теплоємність газоподібної речовини залежить від характеру термодинамічного процесу. Зазвичай розглядаються два значення теплоємності газів: CV – молярна теплоємність у ізохорному процесі (V = const) та Cp – молярна теплоємність у ізобарному процесі (p = const). У процесі при постійному обсязі газ роботи не здійснює: A = 0. З першого закону термодинаміки для 1 моля газу випливає QV = CVΔT = ΔU. Зміна ΔU внутрішньої енергії газу прямо пропорційно до зміни ΔT його температури. Для процесу при постійному тиску перший закон термодинаміки дає: Qp = U + p (V2 - V1) = CV T + p V, де V - зміна об'єму 1 моля ідеального газу при зміні його температури на T. Звідси випливає: Відношення ΔV / ΔT може бути знайдено з рівняння стану ідеального газу, записаного для 1 моля: pV = RT, де R - універсальна постійна газова. Таким чином, співвідношення, що виражає зв'язок між молярними теплоємностями Cp і CV, має вигляд (формула Майєра): Cp = CV + R.
Газова постійна чисельно дорівнює роботі розширення 1 моля ідеального газу під постійним тиском при нагріванні на 1 K. (моль K)
Універсальна газова постійна - універсальна, фундаментальна фізична константа R, що дорівнює твору постійної Больцмана k на постійну Авогадро
Фізичний зміст: Газова постійная чисельно дорівнює роботі розширення одного моля ідеального газу в ізобарному процесі зі збільшенням температури на 1 К
У системі СГС Газова постійна дорівнює:
Питома газова постійна дорівнює:
Показник адіабати(іноді званий коефіцієнтомПуассона) - Відношення теплоємності при постійному тиску () до теплоємності при постійному обсязі (). Іноді його ще називають фактором ізоентропійного розширення. Позначається грецькою літерою (гамма) або (каппа). Літерний символ переважно використовується в хімічних інженерних дисциплінах. У теплотехніці використовується латинська буква.
Суміш газів називається сукупність декількох різнорідних газів, які за умов, що розглядаються, не вступають один з одним у хімічні реакції.
Суміш газів – гомогенна термодинамічна система (всередині якої немає поверхонь розділу, що відокремлюють один від одного макроскопічні частини системи, що відрізняються за своїми властивостями та складом).
Парціальним тиском P i i-го газу в суміші називається тиск, під яким знаходився цей газ, якби з суміші були видалені всі інші гази, а V і T залишилися колишніми.
Закон Дальтона - Тиск суміші газів, що не взаємодіють один з одним хімічно, дорівнює сумі парціальних тисків цих газів.
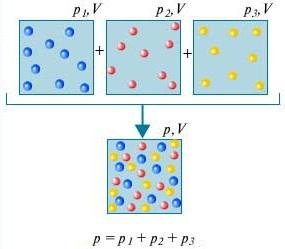
Для того щоб зрозуміти, що являє собою закон ДальтонаРозглянемо для цього повітря в кімнаті. Він є сумішшю кількох газів: азоту (80%), кисню (20%). Парціальний тиск кожного з цих газів – це тиск, який мав би газ, якби він один займав увесь обсяг. Наприклад, якби всі гази, крім азоту, видалили з кімнати, тиск того, що залишилося, і був би парціальним тиском азоту. Закон Дальтонастверджує, що загальний тиск усіх газів разом узятих дорівнює сумі парціальних тисків кожного газу в окремості. (Строго кажучи, закон застосовний тільки до ідеальних газів, але з досить гарним наближенням він описує також і реальні гази.)
Перший закон термодинаміки є узагальненням закону збереження та перетворення енергії для термодинамічної системи. Він формулюється так:
Зміна ΔU внутрішньої енергії неізольованої термодинамічної системи дорівнює різниці між кількістю теплотиQ , переданій системі, та роботоюA досконалою системою над зовнішніми тілами.
|
Співвідношення, що виражає перший закон термодинаміки, часто записують в іншій формі:
|
Кількість теплоти, отримана системою, йде на зміну її внутрішньої енергії та виконання роботи над зовнішніми тілами.
Перший закон термодинаміки є узагальненням дослідних фактів. Відповідно до цього закону, енергія не може бути створена або знищена; вона передається від однієї системи до іншої і перетворюється з однієї форми на іншу. p align="justify"> Важливим наслідком першого закону термодинаміки є твердження про неможливість створення машини, здатної здійснювати корисну роботу без споживання енергії ззовні і без будь-яких змін усередині самої машини. Така гіпотетична машина отримала назву вічного двигуна (perpetuum mobile) першого роду . Численні спроби створити таку машину незмінно закінчувалися провалом. Будь-яка машина може виконувати позитивну роботу Aнад зовнішніми тілами лише за рахунок отримання деякої кількості теплоти Qвід навколишніх тіл або зменшення Δ Uсвоєї внутрішньої енергії.
Застосуємо перший закон термодинаміки до ізопроцесів у газах.
При ізобарному розширенні Q> 0 – тепло поглинається газом, і здійснює позитивну роботу. При ізобарному стисканні Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T 1; внутрішня енергія зменшується, Δ U < 0.
У ізотермічному процесітемпература газу не змінюється, отже, не змінюється і внутрішня енергія газу, Δ U = 0.
У ізохорному процесі (V= const) газ роботи не здійснює, A= 0. Отже,
Перший закон термодинаміки для ізобарного процесу дає:
|
Перший закон термодинаміки для ізотермічного процесу виражається співвідношенням
|
Кількість теплоти Q, отриманої газом у процесі ізотермічного розширення, перетворюється на роботу над зовнішніми тілами. При ізотермічному стисканні робота зовнішніх сил, вироблена над газом, перетворюється на тепло, яке передається оточуючим тілам.
Поряд із ізохорним, ізобарним та ізотермічним процесами в термодинаміці часто розглядаються процеси, що протікають у відсутність теплообміну з оточуючими тілами. Судини з теплонепроникними стінками називаються адіабатичними оболонкамиа процеси розширення або стиснення газу в таких судинах називаються адіабатичними.
У адіабатичному процесіQ= 0; тому перший закон термодинаміки набуває вигляду
|
|
|
За своїм фізичним змістом перший початок термодинаміки є закон збереження (зміни) енергії в термодинаміці. Якщо, згідно із законом зміни енергії в механіці, робота неконсервативних сил дорівнює збільшенню механічної енергії системи (зокрема, робота негативних знаків роботи тертя дорівнює зменшенню механічної енергії системи), то згідно з першим початком термодинаміки, приріст внутрішньої енергії термодинамічної системи дорівнює сумі роботи зовнішніх сил. , досконалої над системою, та енергії, переданої системі шляхом теплопередачі. Ентальпія(Від грец. enthalpo- Нагріваю) - це властивість речовини, що вказує кількість енергії, яку можна перетворити на теплоту. Ентальпія- це термодинамічна властивість речовини, яка вказує на рівень енергії, збереженої в його молекулярній структурі. Це означає, що, хоча речовина може мати енергію на підставі температури і тиску, не всю її можна перетворити на теплоту. Частина внутрішньої енергії завжди залишається у речовині та підтримує його молекулярну структуру. Частина кінетичної енергії речовини недоступна, коли її температура наближається до температури навколишнього середовища. Отже, ентальпія- це кількість енергії, яка доступна для перетворення в теплоту за певної температури і тиску. Одиниці ентальпії - британська теплова одиниця або Джоуль для енергії та Btu/lbm або Дж/кг для питомої енергії. 11 питання |

Мета роботи:Експериментальне визначення теплоємності матеріалів.
Обладнання:Ваги, разновес, калориметр, металевий циліндр з відомою теплоємністю, мензурка, нагрівач, гачок.
Коротка теорія:
Всі макроскопічні тіла і системи тіл крім механічної енергії, обумовленої їх рухом і взаємодією, мають енергію, яка залежить від їх внутрішнього стану. Цю енергію, що є енергією руху та взаємодії між собою всіх частинок, з яких складається тіло, називають внутрішньою.
До внутрішньої енергії відноситься кінетична енергія теплового руху молекул і атомів, що входять до складу даного тіла, кінетична енергія електронів, що рухаються в атомах навколо ядер, потенційна енергія взаємодій між собою молекул, атомів, електронів і ядер, нуклонів в ядрі і т.д. До поняття внутрішньої енергії не входить кінетична та потенційна енергія даного тіла як єдиного цілого.
Внутрішня енергія однозначно визначається сукупністю властивостей, що характеризують стан цієї системи, тобто. є однозначною функцією стану системи.
Внутрішню енергію прийнято позначати буквою U.
У теплових явищах, що протікають при температурах, далеких від температур фазових переходів, зміна внутрішньої енергії DU пов'язана зі зміною кінетичної та потенційної енергії молекул, інші компоненти внутрішньої енергії при цьому не змінюються. Тому в подібних процесах можна вважати, що внутрішня енергія тіла дорівнює сумі кінетичних енергій хаотичного теплового руху всіх молекул щодо центру мас цього тіла та потенційних енергій взаємодії всіх молекул між собою.
За зміни стану тіла його внутрішня енергія змінюється. Наприклад, у разі підвищення температури тіла його внутрішня енергія збільшується, оскільки збільшується середня кінетична енергія руху молекул цього тіла. Зі зниженням температури внутрішня енергія тіла зменшується.
Внутрішня енергія тіл може змінюватись у різний спосіб. Наприклад, внутрішня енергія змінюється при здійсненні механічної роботи зовнішніми силами над цим тілом при його деформації, а також без виконання роботи, коли тіло перебуває в контакті з іншим ялом (або середовищем), що має більш високу або нижчу температуру, ніж це тіло.
Процес зміни внутрішньої енергії тіла без механічної роботи називають теплообміном або теплопередачею. Існують три види теплопередачі: конвекція, теплопровідність та випромінювання.
При теплообміні не відбувається перетворення енергії з одного виду на інший. Процес теплообміну полягає в тому, що частина внутрішньої енергії від гарячішого тіла передається менш гарячому тілу (або середовищу).
Для характеристики процесів теплопередачі введено поняття кількості теплоти називають величину, яка є кількісною мірою зміни внутрішньої енергії тіла у процесі теплообміну.
Необхідно пам'ятати, що тіло може віддавати або отримувати тільки енергію, а кількість теплоти Q лише чисельним еквівалентом енергії, відданої або отриманої тілом в процесі теплообміну.
Кількість теплоти залежить від роду процесу не є функцією стану системи.
Кількість теплоти, необхідне нагрівання тіла, що відбувається без фазових перетворень (без зміни агрегатного стану речовини):
де с - питома теплоємність тіла, що визначається відношенням кількості переданої теплоти до маси m тіла, і зміні температури DT, що відбулася при цьому, m - маса тіла, DT - різниця кінцевої і початкової температур даного тіла.
Кількість теплоти, яку потрібно повідомити тілу, щоб підвищити його температуру на один Кельвін, називається теплоємністю цієї речовини. При охолодженні на один Кельвін тіло віддає таку ж кількість теплоти. Теплоємність тіла пропорційна масі тіла і залежить від речовини, з якої воно складається. У системі одиниць СІ теплоємність вимірюється Дж/К.
Для характеристики теплових властивостей речовини приймають теплоємність одиниці цієї речовини. Ця характеристика називається питомою теплоємністю. Вона дорівнює відношенню теплоємності даного тіла до його маси. Питома теплоємність із системою СІ вимірюється в Дж/(кг×К).
Експериментально питому теплоємність металевого тіла визначається за допомогою калориметра та термометра. Найпростіший калориметр складається з відполірованої металевої склянки, поставленої всередині іншої склянки на пробках (з метою теплової ізоляції). Внутрішня склянка наповнюється водою або іншою рідиною із відомою питомою теплоємністю. Тіло, нагріте до певної температури t, опускають калориметр. Нехай до опускання тіла температура рідини в калориметрі була t 1, а після того, як встановиться теплова рівновага рідини та опущеного в нього тіла, їх загальна температура стане рівною q.
З закону збереження енергії випливає, що:
Q = Q 1 + Q 2(2)
де кількість теплоти Q, віддане нагрітим тілом, дорівнює сумі кількості теплоти Q 1 ,отриманого водою, та Q 2 ,отриманого калориметром.
Враховуючи (1) перепишемо (2) у вигляді:
сm(t-q) = c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
де з 1і m 1- питома теплоємність та маса води в калориметрі, з 2і m 2- Питома теплоємність та маса калориметра. Це рівняння називається рівнянням теплового балансу. З нього знайдемо питому теплоємність тіла:
Можна підійти до вирішення цієї задачі по іншому, припустимо, що втрати енергії в рамках одного експерименту будуть однакові. Тіло звідомою питомою теплоємністю, нагріту до певної температури t, опускають у калориметр, температура у якому змінюється. Тоді рівняння теплового балансу набуде вигляду:
cm(t-q) = c 1 m 1 (q-t 1) + Q втрати,(5)
де Q втрати- кількість теплоти, що отримується калориметром і довкіллям, отже:
Q втрати = cm(t-q) - c 1 m 1 (q-t 1). (6)
Якщо тіло з невідомою питомою теплоємністю, нагріте до тієї ж температури, опустити в калориметр, тоді рівняння теплового балансу набуде вигляду:
c x m x (t-q x) = c 1 m 1 (q - t 1) + Q втрати,(7)
де m¢ 1- Маса води в калориметрі, а t¢ 1- Температура води в даному експерименті. Тоді:
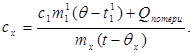 (8)
(8)
Підставивши значення (6) у (8) отримаємо:
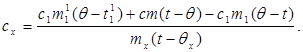 (9)
(9)
де – елементарна кількість теплоти; - Елементарна зміна температури.
Теплоємність чисельно дорівнює кількості теплоти, яку необхідно підвести до системи, щоб за заданих умов підвищити її температуру на 1 градус. Оскільки одиницею кількості теплоти СІ є джоуль, а температури - градус До, то одиницею теплоємності буде Дж/К.
Залежно від кількісної одиниці тіла, до якого підводиться теплота в термодинаміці, розрізняють масову, об'ємну та мольну теплоємності.
Масова теплоємність- це теплоємність, віднесена до одиниці маси робочого тіла,
де і - об'єм та щільність тіла за нормальних фізичних умов.
Об'ємна теплоємність вимірюється Дж/(м3 К).
Мольна теплоємність- теплоємність, віднесена до кількості робочого тіла (газу) в молях,
| , |
де м3/моль - мольний обсяг газу за нормальних умов.
Враховуючи, що теплоємність непостійна, а залежить від температури та інших термічних параметрів, розрізняють справжню та середню теплоємність. Зазвичай під справжньою теплоємністю розуміють відношення елементарної кількості теплоти, що повідомляється термодинамічній системі в будь-якому процесі до нескінченно малого збільшення температури цієї системи, викликаного повідомленою теплотою. Вважатимемо істинною теплоємністю термодинамічної системи при температурі системи рівної, а - істинної питомою теплоємністюробочого тіла за його температури рівної . Тоді середню питому теплоємність робочого тіла при зміні температури від до можна визначити як
Визначення внутрішньої енергії тіла.
Внутрішня енергіятіла (позначається як Eабо U) - це сума енергій молекулярних взаємодій та теплових рухів молекули. Зокрема, внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій усіх частинок газу, що перебувають у безперервному та безладному тепловому русі. Звідси випливає закон Джоуля, який підтверджують численні експерименти.
Молекулярно-кінетична теорія призводить до наступного виразу для внутрішньої енергії одного молю ідеального одноатомного газу (гелій, неон та ін), молекули якого здійснюють тільки поступальний рух:
Таким чином, внутрішня енергія Uтіла однозначно визначається макроскопічними параметрами, що характеризують стан тіла. Вона залежить від цього, яким шляхом було реалізовано цей стан. Вважається, що внутрішня енергія є функцією стану.
У ТД використовується зміна внутрішньої енергії, а чи не її абсолютна величина.
Що таке робота з розширення. Перший закон ТД.
Робота розширення - механічна робота, що здійснюється ТЗ проти сил зовнішнього тиску в процесі її розширення. При зміні обсягу газ здійснює роботу, знак зміни V збігається зі знаком роботи
Перший закон ТД: теплота, яку повідомляє система, йде на перетворення внутрішньої енергії та здійснення роботи.
Термодинамічну систему з погляду її здатності приймати (або віддавати) енергію у формі теплоти прийнято характеризувати теплоємністю.
Теплоємністю тіла (системи) називається фізична величина, чисельно рівна кількості теплоти, яку потрібно повідомити тілу (системі), щоб змінити його температуру на один Кельвін.
Якщо тілу повідомлено нескінченно мала кількість теплоти Q, що викликало нескінченно мале підвищення температури dТ,то його теплоємність Зза визначенням дорівнює
Одиниця теплоємності в СІ - джоуль, поділений на кельвін ( Дж/До).
Експерименти та теоретичні розрахунки показують, що теплоємність тіла залежить від його хімічного складу, маси та термодинамічного стану(Наприклад, від температури), а також від виду процесу зміни стану тіла при повідомленні йому теплоти.
Питомою теплоємністю називається теплоємність одиниці маси речовини,тобто для однорідної речовини
![]() , (25.2)
, (25.2)
де з- питома теплоємність, М- Маса речовини.
Одиниця питомої теплоємності в СІ - джоуль, поділений на кельвін-кілограм [( Дж/(До . кг)].
Молярною теплоємністю називається теплоємність одного моля речовини,тобто
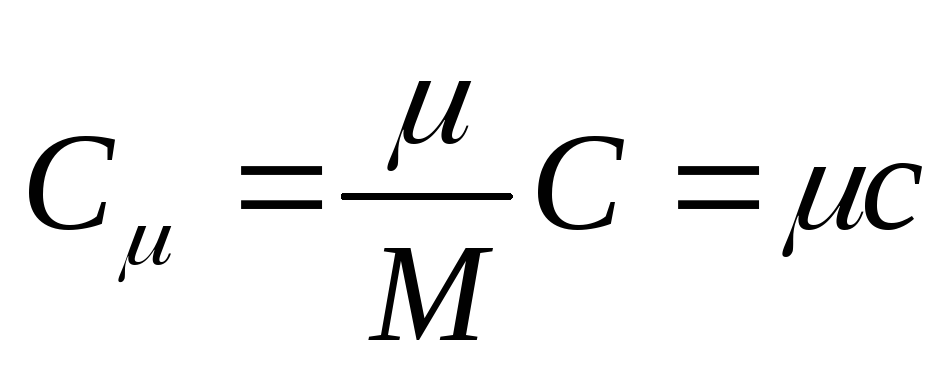 , (25.3)
, (25.3)
де З - молярна теплоємність; - Молярна маса речовини.
Одиниця молярної теплоємності в СІ - джоуль, поділений на кельвін-моль [ Дж/(До . моль)].
Елементарна кількість теплоти Q, необхідне зміни температури тіла на dТ, визначається як
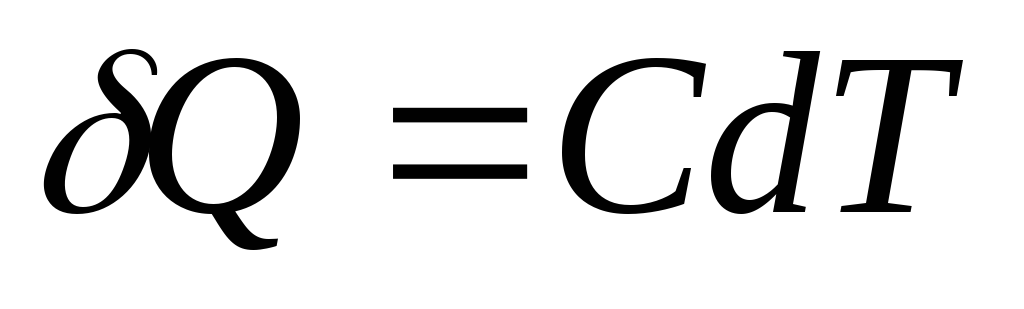 ,
,
а для однорідного тіла
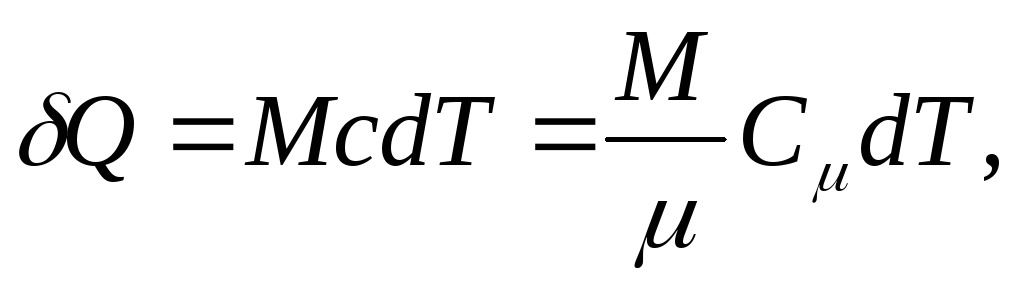 (25.4)
(25.4)
де М/ - кількість речовини (кількість молей).
§26. Перший закон термодинаміки
Перший закон (перший початок) термодинаміки є математичним виразом закону збереження та перетворення енергії у застосуванні до термодинамічних систем. Він був встановлений в результаті експериментальних і теоретичних досліджень у галузі фізики та хімії, завершальним етапом яких стало відкриття еквівалентності теплоти та роботи, тобто виявлення того, що перетворення теплоти на роботу і роботи на теплоту здійснюється завжди в тому самому строго постійному кількісному співвідношенні .
У §24 було зазначено, що внутрішня енергія системи може бути змінена двома шляхами: виконанням роботи та теплопередачею. Отже, можна записати:
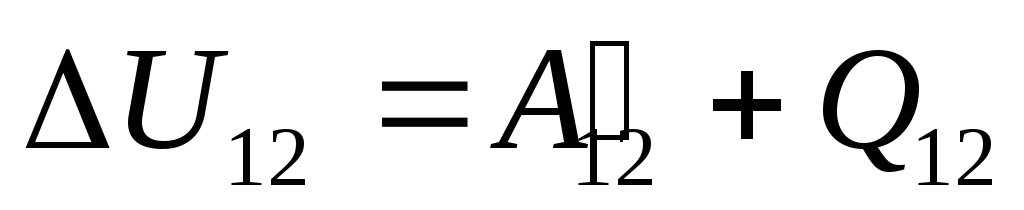 ,
(26.1)
,
(26.1)
де
U 12
-
зміна внутрішньої енергії системи при її переході зі стану 1
у стан 2
внаслідок здійснення над нею роботи 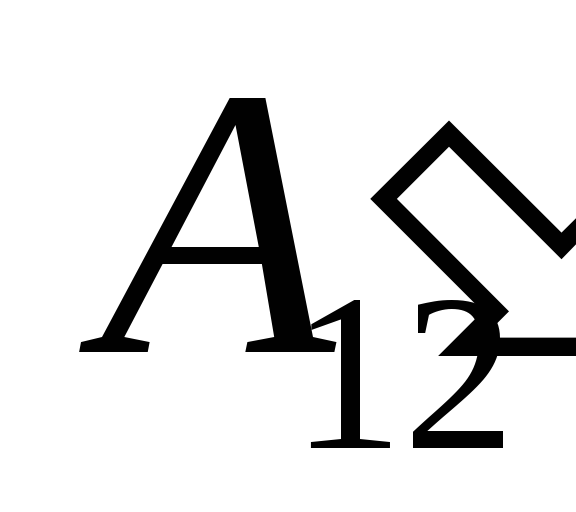 з боку зовнішніх тіл та передачі їй ззовні деякої кількості теплоти
з боку зовнішніх тіл та передачі їй ззовні деякої кількості теплоти  .
.
Врахуємо, що робота 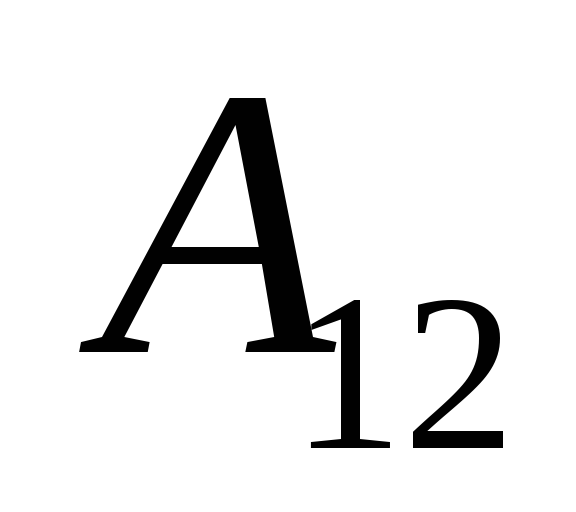 , що здійснюється самою системою над зовнішніми тілами, чисельно дорівнює і протилежна за знаком роботи
, що здійснюється самою системою над зовнішніми тілами, чисельно дорівнює і протилежна за знаком роботи  зовнішніх тіл над системою, тобто
зовнішніх тіл над системою, тобто
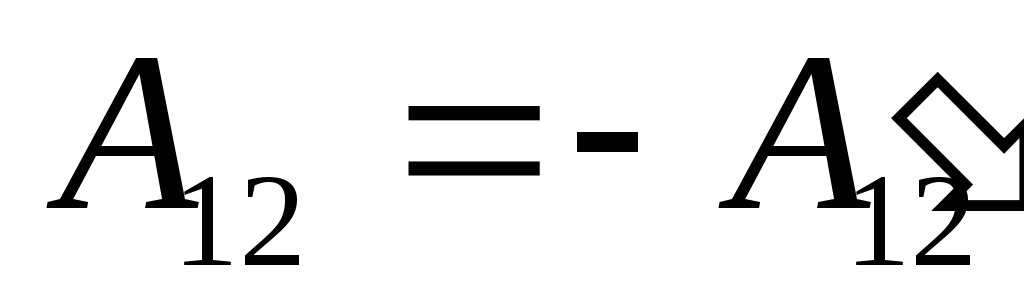 ,
(26.2)
,
(26.2)
тому вираз (26.1) можна переписати як
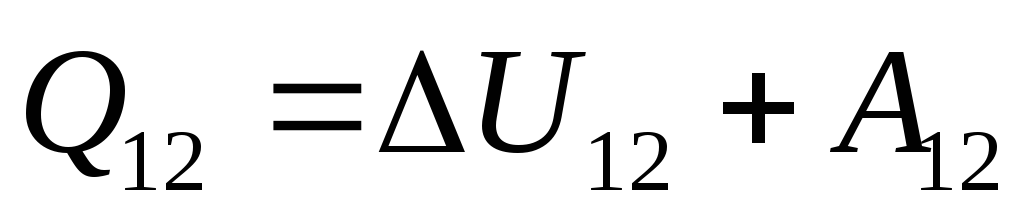 . (26.3)
. (26.3)
Це рівняння є математичним записом першого закону термодинаміки: кількість теплоти, повідомлена системі, витрачається зміну її внутрішньої енергії і здійснення системою роботи над зовнішніми тілами.
При нескінченно малій зміні стану системи рівняння (26.3) набуває вигляду
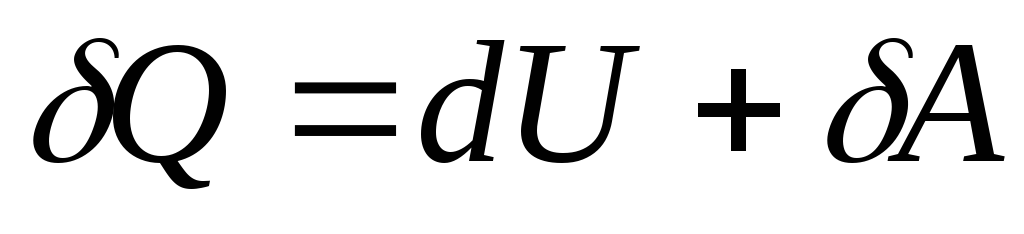 , (26.4)
, (26.4)
де 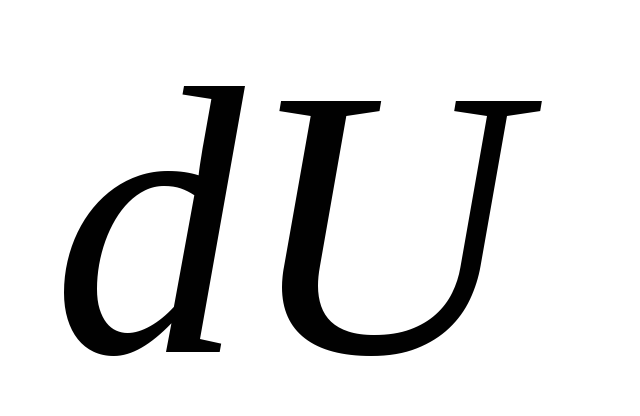 - нескінченно мала зміна внутрішньої енергії системи при повідомленні їй елементарної кількості теплоти
Qта здійснення системою елементарної роботи
Анад зовнішніми тілами.
- нескінченно мала зміна внутрішньої енергії системи при повідомленні їй елементарної кількості теплоти
Qта здійснення системою елементарної роботи
Анад зовнішніми тілами.
