Ідеальний газ. Молекулярно-кінетична теорія ідеальних газів
Молекулярно-кінетична теорія описує поведінку та властивості особливого ідеального об'єкта, званого ідеальним газом. В основі цієї фізичної моделі лежить молекулярна будова речовини. Створення молекулярної теорії пов'язане з роботами Р. Клаузіуса, Дж. Максвелла, Д. Джоуля та Л. Больцмана.
Ідеальний газ. Молекулярно-кінетична теорія ідеального газу будується на наступних посилках:
атоми та молекули можна розглядати як матеріальні точки, що у безперервному русі;
власний обсяг молекул газу дуже малий в порівнянні з обсягом судини;
всі атоми та молекули є помітними, тобто існує важлива можливість стежити за рухом кожної частки;
до зіткнення молекул газу між ними відсутні сили взаємодії, а зіткнення молекул між собою та зі стінками судини передбачаються абсолютно пружними;
рух кожного атома чи молекули газу описується законами класичної механіки.
Закони, отримані для ідеального газу, можна використовувати при вивченні реальних газів. Для цього створюють експериментальні моделі ідеального газу, в яких властивості реального газу близькі до характеристик ідеального газу (наприклад, при низьких тисках і високих температурах).
Закони ідеального газу
Закон Бойля-Маріотта:
для даної маси газу при постійній температурі тиск тиску газу на його обсяг є величина постійна: рV = const , (1.1)
при T = const , m = const .
Крива, що зображує залежність між величинами рі V, характеризує властивості речовини при постійній температурі, і називається ізотермою це гіпербола (рис.1.1.), а процес, що протікає за постійної температури, називається ізотермічним.
Закони Гей-Люссака:
Об'єм даної маси газу при постійному тиску змінюється лінійною температурою
V = V 0 (1 + t ) при Р = const , m = const . (1.2)

p = p 0 (1 + t ) при V = const , m = const . (1.3)
У рівняннях (1.2) та (1.3) температура виражена за шкалою Цельсія, тиск та об'єм – при
0 С, при цьому
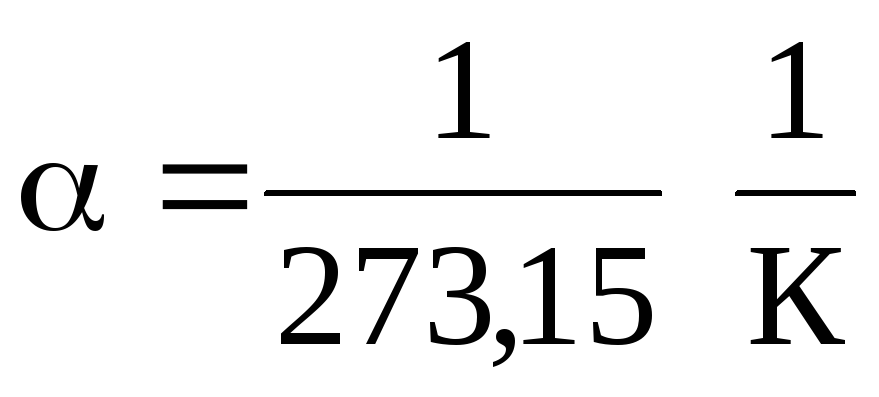 .
.
Процес, що протікає при постійному тиску, називається ізобарним, його можна подати у вигляді лінійної функції (Рис. 1.2.).
Процес, що протікає при постійному обсязі, називається ізохорним(Рис. 1.3.).
З рівнянь (1.2) і (1.3) випливає, що ізобари та ізохори перетинають вісь температур у точці t =1/ = 273,15 С . Якщо перенести початок відліку до цієї точки, то перейдемо до шкали Кельвіна.
Вводячи у формули (1.2) та (1.3) термодинамічну температуру, законам Гей-Люссака можна надати зручніший вигляд:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
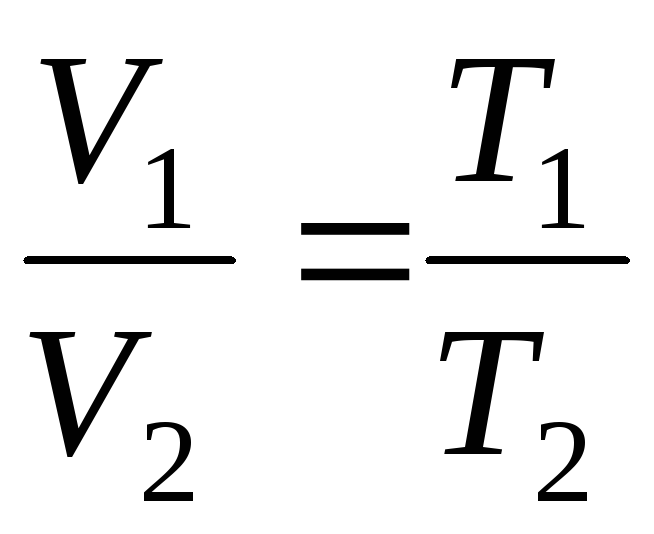 при
p = const, m = const
;
(1.4)
при
p = const, m = const
;
(1.4)
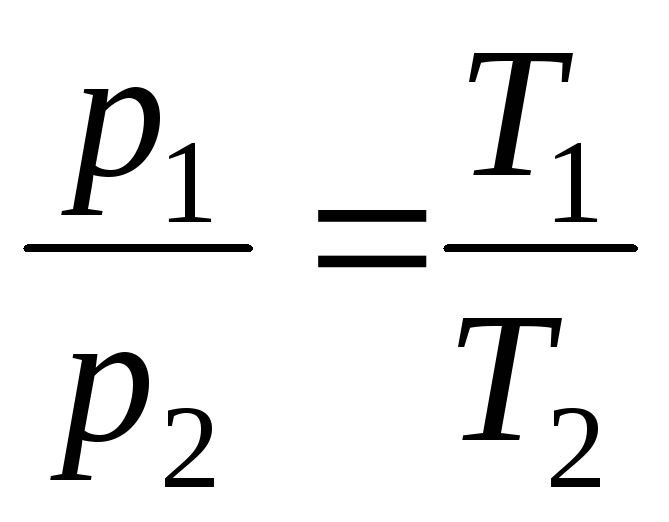 при V = const, m = const
,
(1.5)
при V = const, m = const
,
(1.5)
де індекси 1 і 2 відносяться до довільних станів, що лежать на одній ізобарі або ізохорі .
Закон Авогадро:
молі будь-яких газів при тих самих температурах і тисках займають однакові обсяги.
За нормальних умов цей обсяг дорівнює V ,0 = 22,4110 -3 м 3 /моль . За визначенням, в одному молі різних речовинміститься те саме число молекул, рівне постійної Авогадро:N A = 6,02210 23 міль -1 .
Закон Дальтона:
тиск суміші різних ідеальних газівдорівнює сумі парціальних тисків р 1 , р 2 , р 3 … р n , що входять до неї газів:
р = р 1 + р 2 + р 3 + …+ р n .
Парціальний тиск – це тиск, який виробляв би газ, що входить до складу газової сумішіякщо б він один займав об'єм, рівний обсягу суміші при тій же температурі.
Рівняння стану ідеального газу
(Рівняння Клапейрона-Менделєєва)
Між температурою, об'ємом та тиском існує певний зв'язок. Цей зв'язок може бути представлений функціональною залежністю:
f (p, V, T)= 0.
У свою чергу кожна зі змінних ( р, V, T) є функцією двох інших змінних. Вид функціональної залежності для кожного фазового стану речовини (твердого, рідкого, газоподібного) знаходиться експериментально. Це дуже трудомісткий процес і рівняння стану встановлено лише газів, які у розрідженому стані, й у наближеною формі – деяких стиснутих газів. Для речовин, що знаходяться не в газоподібному стані, це завдання досі не вирішене.
Французький фізик Б. Клапейрон вивів рівняння стану ідеального газу, об'єднавши закони Бойля-Маріотта, Гей-Люссака, Шарля:
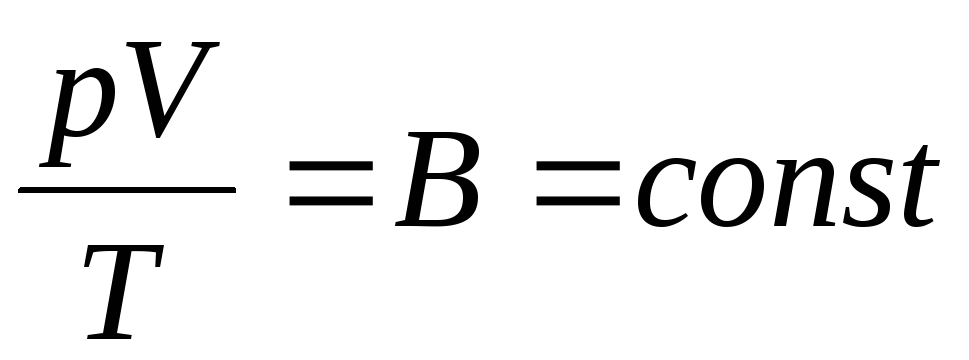 . (1.6)
. (1.6)
Вираз (1.6) і є рівняння Клапейрона, де У- Постійна газова. Вона різна для різних газів.
Д.І. Менделєєв об'єднав рівняння Клапейрона із законом Авогадро, віднісши рівняння (1.6) до одного молю та використавши молярний об'єм V . Відповідно до закону Авогадро, за однакових рі Тмолі всіх газів займають однаковий молярний об'єм V .
.
Тому постійна Убуде однаковою для всіх ідеальних газів. Ця постійна зазвичай позначається Rі дорівнює R=
8,31
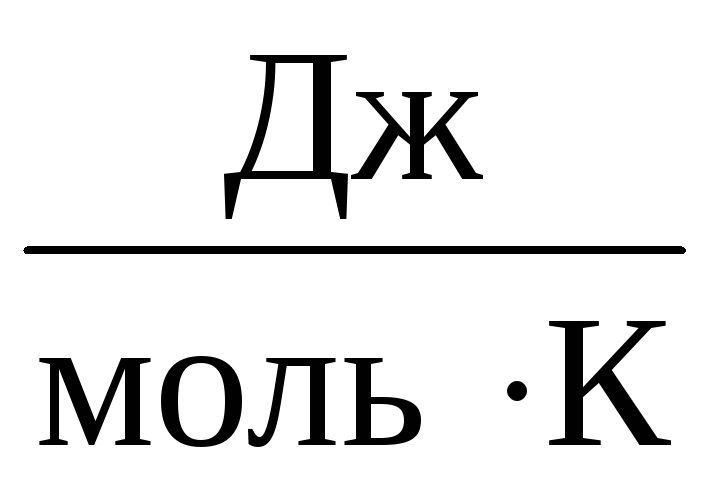 .
.
Рівняння Клапейрона-Менделєєва має такий вигляд:
p V . = R T.
Від рівняння (1.7) для одного моля газу можна перейти до рівняння Клапейрона-Менделєєва для довільної маси газу:
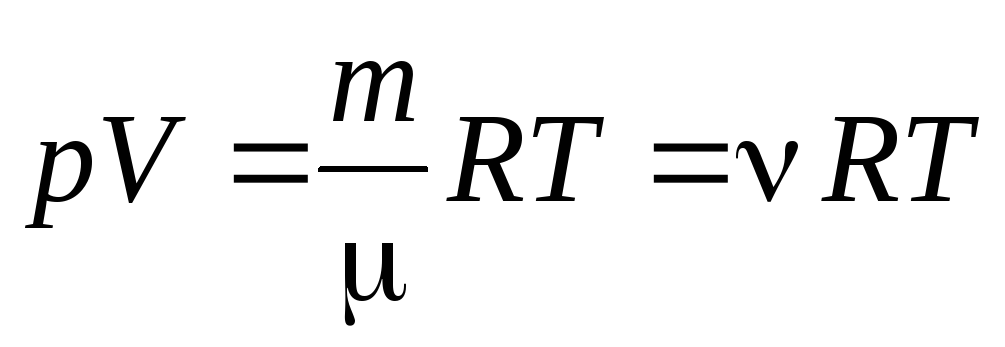 , (1.7)
, (1.7)
де
–
молярна маса
(Маса одного моля речовини, кг/моль); m
маса газу;
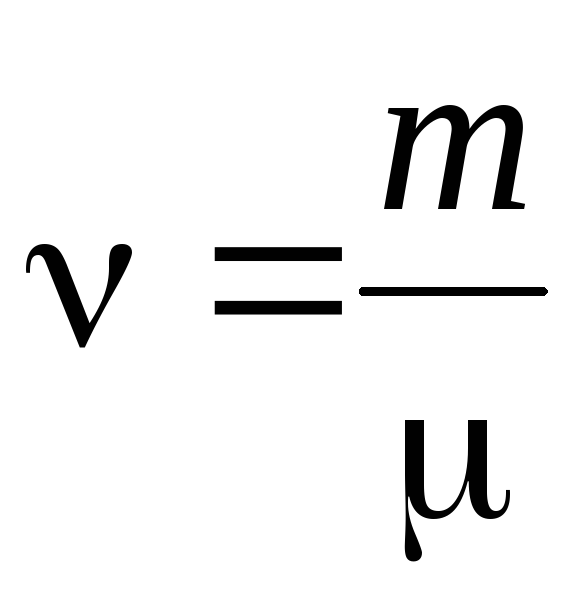 кількість речовини .
кількість речовини .
Найчастіше користуються іншою формою рівняння стану ідеального газу, вводячи постійну Больцмана: 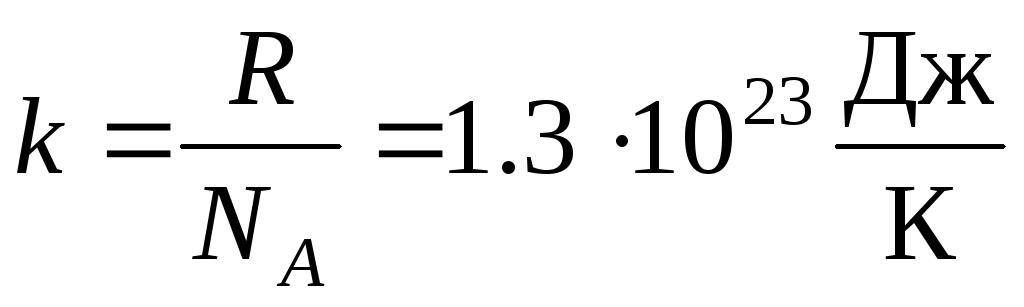 .
.
Тоді рівняння (1.7) виглядає так:
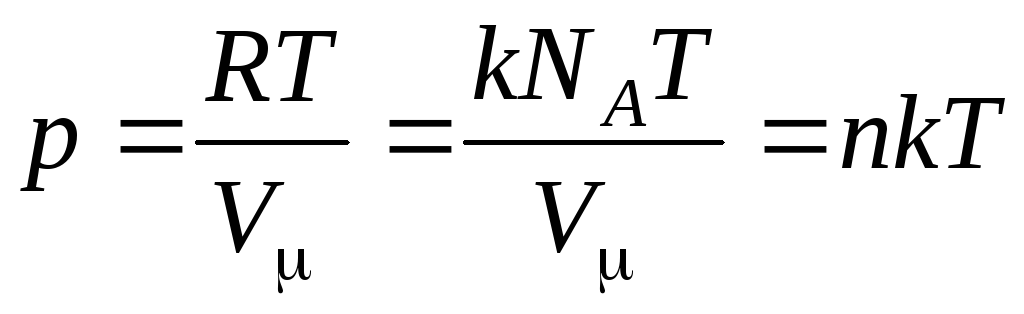 ,
(1.8)
,
(1.8)
де
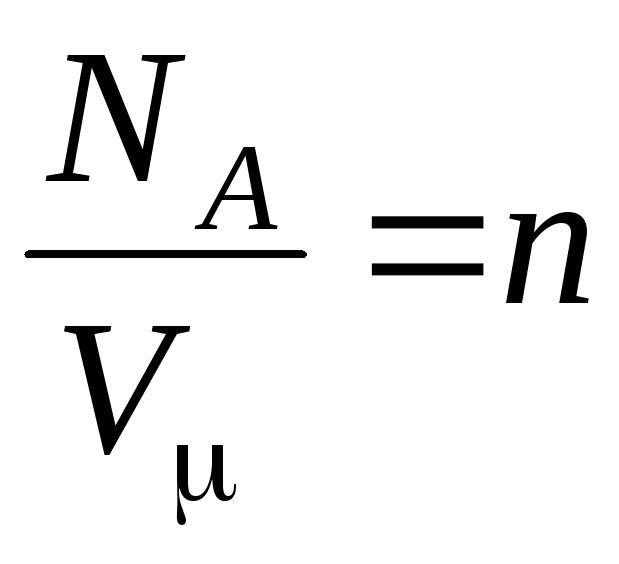 –
концентрація молекул (кількість молекул в одиниці об'єму). З цього виразу випливає, що тиск ідеального газу прямо пропорційно концентрації його молекул або густини газу. При тих самих температурах і тисках всі гази містять у одиниці обсягу однакове число молекул. Число молекул, що містяться в 1 м 3 за нормальних умов, називається
числом Лошмідта:
–
концентрація молекул (кількість молекул в одиниці об'єму). З цього виразу випливає, що тиск ідеального газу прямо пропорційно концентрації його молекул або густини газу. При тих самих температурах і тисках всі гази містять у одиниці обсягу однакове число молекул. Число молекул, що містяться в 1 м 3 за нормальних умов, називається
числом Лошмідта:
N L = 2,68 10 25 м -3 .
Основне рівняння молекулярно-кінетичної
теорії ідеальних газів
Найважливішим завданням кінетичної теорії газів є теоретичний розрахунок тиску ідеального газу на основі молекулярно-кінетичних уявлень. Основне рівняння молекулярно-кінетичної теорії ідеальних газів виводиться з використанням статистичних методів.
Передбачається, що молекули газу рухаються хаотично, число взаємних зіткнень між молекулами газу дуже мало в порівнянні з числом ударів об стінки судини, і ці зіткнення абсолютно пружні. На стінці судини виділяють деякий елементарний майданчик Sі обчислюють тиск, який чинитимуть молекули газу на цей майданчик.
Реально молекули можуть рухатися до майданчика під різними кутами і можуть мати різні швидкостіякі до того ж при кожному зіткненні можуть змінюватися. У теоретичних розрахунках хаотичні рухи молекул ідеалізується, їх замінюють рухом вздовж трьох взаємно перпендикулярних напрямків.
Якщо розглянути посуд у вигляді куба, в якому безладно рухається Nмолекул газу в шести напрямках, то нескладно помітити, що в будь-який момент часу вздовж кожного з них рухається 1/3 кількості всіх молекул, причому половина з них (тобто 1/6 кількості всіх молекул) рухається в один бік, а друга половина (теж 1/6) - у протилежну. При кожному зіткненні окрема молекула, що рухається перпендикулярно до майданчика, відбиваючись, передає їй імпульс, при цьому її кількість руху (імпульс) змінюється на величину
Р 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Число ударів молекул, що рухаються в заданому напрямку, про майданчик дорівнює: N = 1/6 n Svt. При зіткненні з майданчиком ці молекули передадуть їй імпульс
P= N P 1 =2 m 0 vnSvt= m 0 v 2 nSt,
де n- Концентрація молекул. Тоді тиск, який газ чинить на стінку судини, дорівнюватиме:
р = 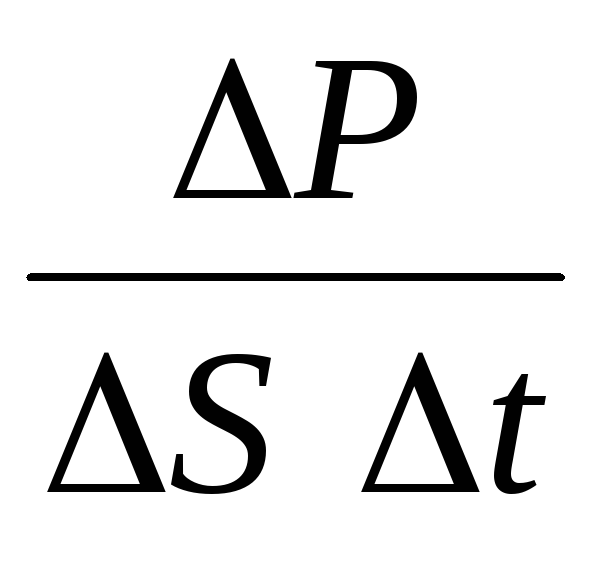 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
Однак молекули газу рухаються з різними швидкостями: v 1 , v 2 , …,v nТому швидкості необхідно усереднити. Сума квадратів швидкостей руху молекул газу, поділена на їх кількість, визначає середньоквадратичну швидкість:
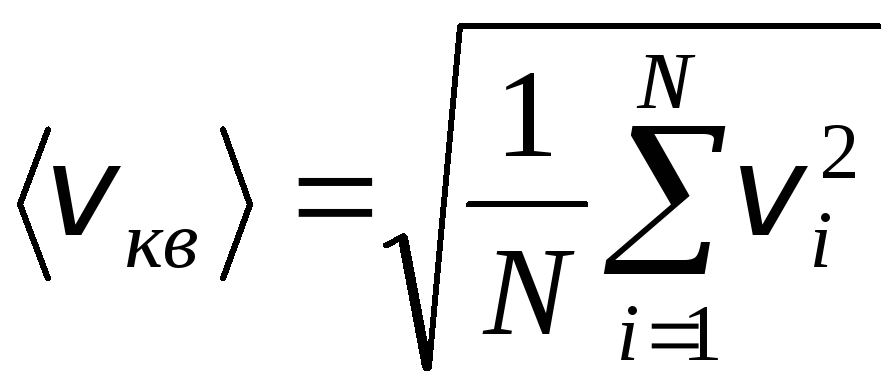 .
.
Рівняння (1.9) набуде вигляду:
![]() (1.10)
(1.10)
вираз (1.10) називається основним рівнянням молекулярно-кінетичної теоріїідеальних газів.
Враховуючи що 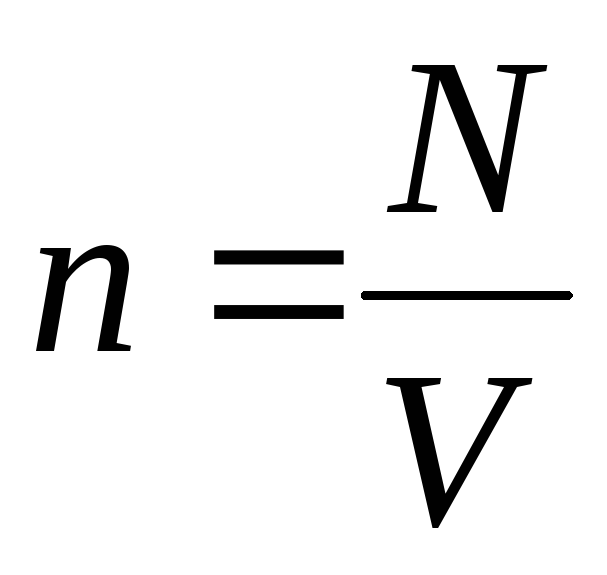 , Отримаємо:
, Отримаємо:
р V = N 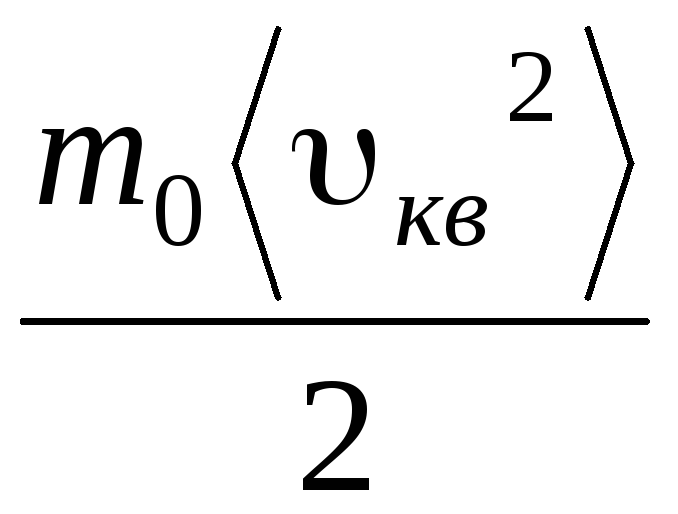 =Е,
(1.11)
=Е,
(1.11)
де Е- Сумарна кінетична енергія поступального руху всіх молекул газу. Отже, тиск газу прямо пропорційно кінетичній енергії поступального руху молекул газу.
Для одного молячи газу m =, і рівняння Клапейрона-Менделєєва має такий вигляд:
p V . = R T,
і оскільки з (1.11) випливає, що p V . = v кв 2 , отримаємо:
RT = v кв 2 .
Звідси середня квадратична швидкість молекул газу дорівнює
v
кв
=
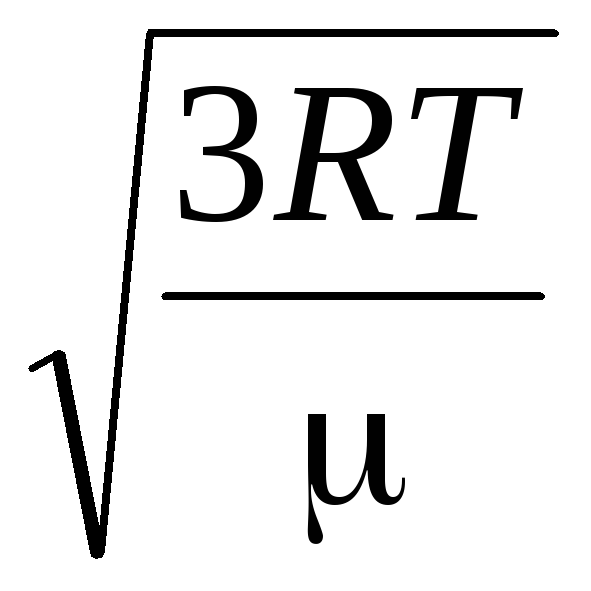 =
=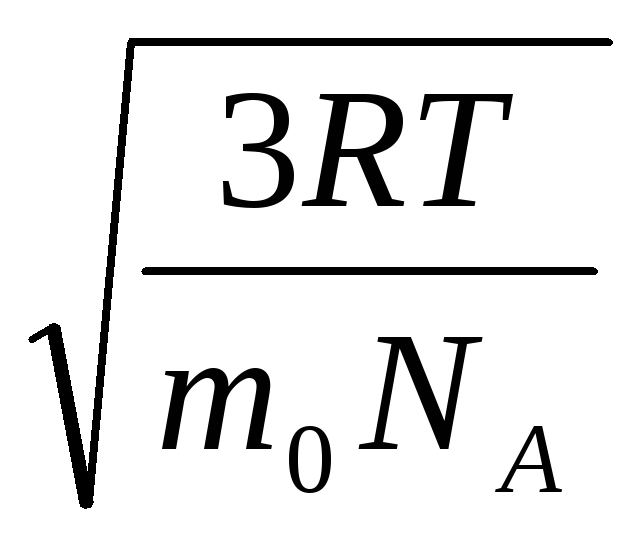 =
= ,
,
де k = R/N A = 1,3810 -23 Дж/К – постійна Больцмана. Звідси можна знайти середню квадратичну швидкість молекул кисню за кімнатної температури – 480 м/с, водню – 1900 м/с.
Молекулярно-кінетичний зміст температури
Температура є кількісним заходом «нагрітості» тіла. Для з'ясування фізичного сенсу абсолютної термодинамічної температури Тзіставимо основне рівняння молекулярно-кінетичної теорії газів (1.14) з рівнянням Клапейрона-Менделєєва p V = R T.
Прирівнявши праві частини цих рівнянь, знайдемо середнє значення кінетичної енергії 0 однієї молекули ( = N/N A , k=R/N A):
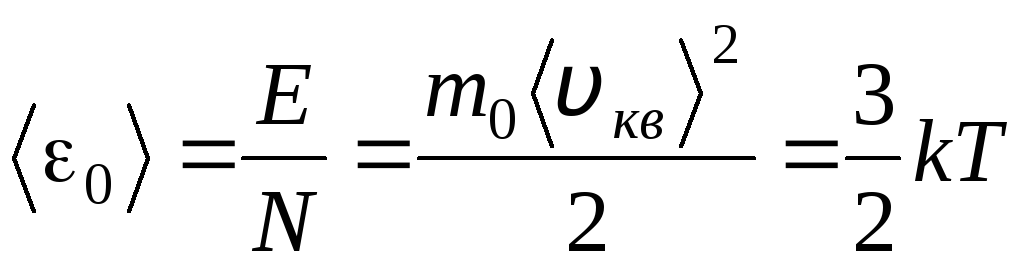 .
.
З цього рівняння випливає найважливіший висновок молекулярно-кінетичної теорії: середня кінетична енергія поступального руху однієї молекули ідеального газу залежить тільки від температури, при цьому вона прямо пропорційна до термодинамічної температури. Таким чином, термодинамічна шкала температур набуває безпосереднього фізичного змісту: Т= 0 Кінетична енергія молекул ідеального газу дорівнює нулю. Отже, з цієї теорії, поступальний рух молекул газу припиниться та її тиск стане рівним нулю.
Теорія рівноважних властивостей ідеального газу
Число ступенів свободи молекул. Молекулярно-кінетична теорія ідеальних газів призводить до дуже важливого наслідку: молекули газу роблять безладний рух, причому середня кінетична енергія поступального руху молекули визначається виключно температурою.
Кінетична енергія руху молекул не вичерпується кінетичною. енергією поступального руху: вона також складається з кінетичних. енергій обертанняі коливаннямолекул. Для того щоб підрахувати енергію, що йде на всі види руху молекул, необхідно дати визначення числу ступенів свободи.
Під числом ступенів свободи (i) тіла мається на увазі кількість незалежних координат, які необхідно ввести для визначення положення тіла у просторі.
Н  наприклад, матеріальна точка має три ступені свободи, так як її положення в просторі визначається трьома координатами: х, уі z. Отже, одноатомна молекула має три ступені свободи поступального руху.
наприклад, матеріальна точка має три ступені свободи, так як її положення в просторі визначається трьома координатами: х, уі z. Отже, одноатомна молекула має три ступені свободи поступального руху.
Д  вухатомна молекула має 5 ступенів свободи (рис. 1.4): 3 ступеня свободи поступального руху та 2 ступеня свободи обертального руху.
вухатомна молекула має 5 ступенів свободи (рис. 1.4): 3 ступеня свободи поступального руху та 2 ступеня свободи обертального руху.
Молекули з трьох і більше атомів мають 6 ступенів свободи: 3 ступені свободи поступального руху та 3 ступені свободи обертального руху (рис. 1.5).
Кожна молекула газу має певну кількість ступенів свободи, три з яких відповідають її поступальному руху.
Положення про рівнорозподіл енергії
за ступенями свободи
Основною причиною молекулярно-кінетичної теорії газів є припущення про повну безладність руху молекул. Це відноситься і до коливального, і до обертального рухів, а не лише поступального. Вважається, що всі напрямки руху молекул у газі є рівноймовірними. Тому можна припустити, що на кожний ступінь свободи молекули в середньому припадає одна і та ж кількість енергії – це положення про рівнорозподіл енергії за ступенями свободи. Енергія, що припадає на один ступінь свободи молекули, дорівнює:
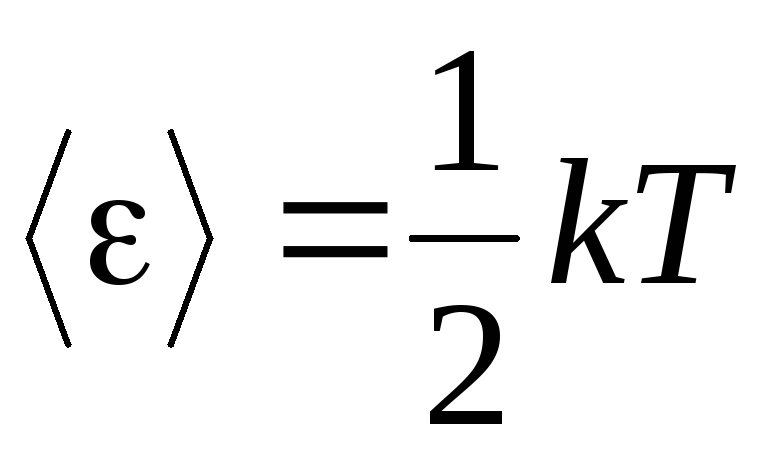 . (1.12)
. (1.12)
Якщо молекула має iступенями свободи, то на кожен ступінь свободи припадає в середньому:
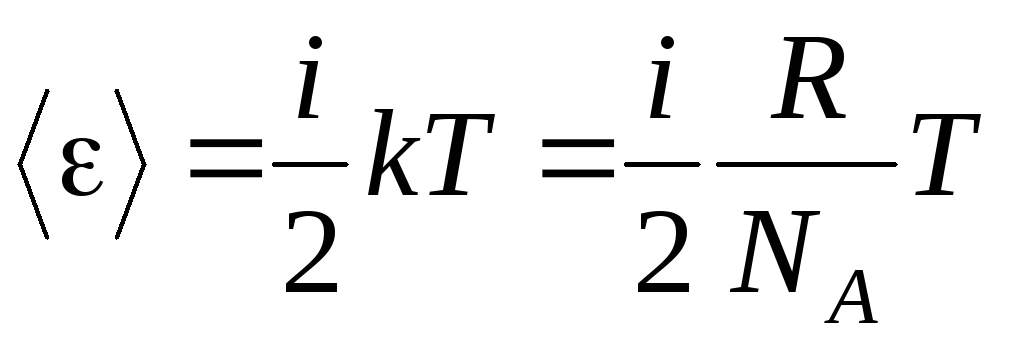 .
(1.13)
.
(1.13)
Внутрішня енергія ідеального газу
Якщо віднести повний запас внутрішньої енергії газу до одного молю, то отримаємо її значення, помноживши на число Авогадро:
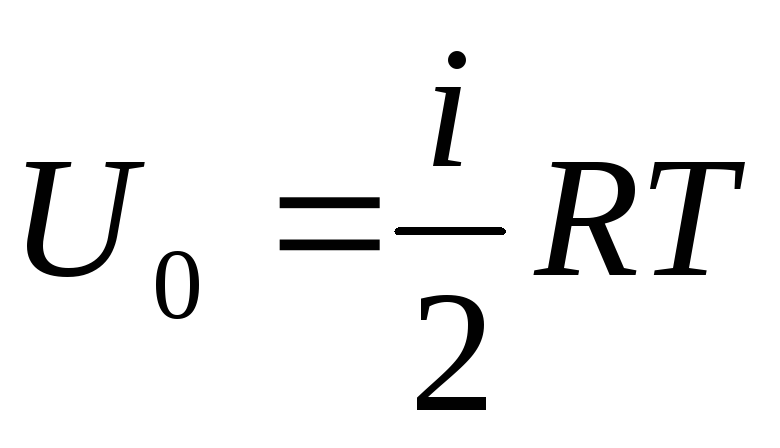 .
(1.14)
.
(1.14)
Звідси випливає, що внутрішня енергія одного моля ідеального газу залежить лише від температури та кількості ступенів свободи молекул газу.
розподілу Максвелла та Больцмана
Розподіл молекул ідеального газу за швидкостями та енергіями теплового руху (розподіл Максвелла). За постійної температури газу всі напрями руху молекул передбачаються рівноймовірними. У цьому випадку середня квадратична швидкість кожної молекули залишається постійною та дорівнює
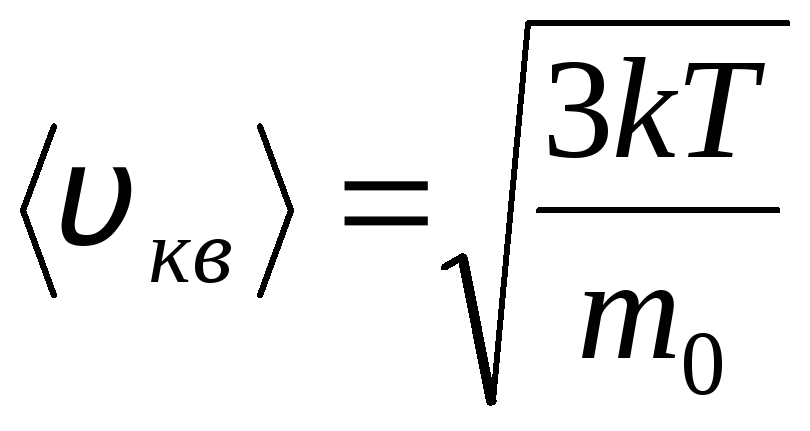 .
.
Це тим, що у ідеальному газі, що у стані рівноваги, встановлюється деяке стаціонарне, не змінюється згодом розподіл молекул за швидкостями. цей розподіл підпорядковується певному статистичному закону, який теоретично вивів Дж. Максвелл. Закон Максвелла описується функцією
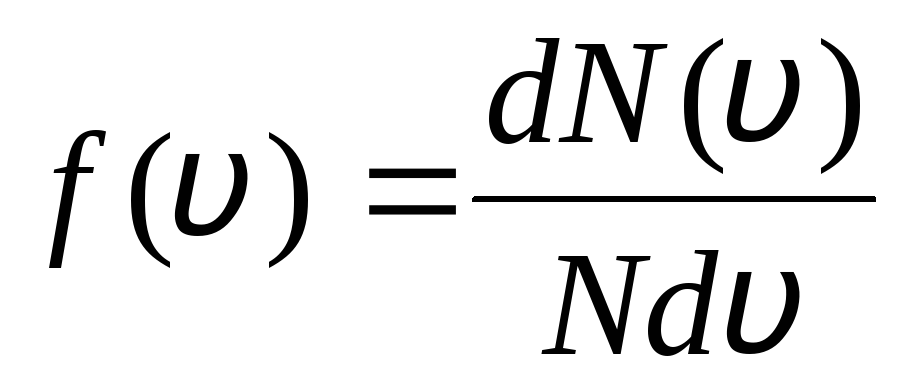 ,
,
тобто функція f(v) визначає відносну кількість молекул  , швидкості яких лежать в інтервалі від v
до v+ dv. Застосовуючи методи теорії ймовірностей, Максвел знайшов закон розподілу молекул ідеального газу за швидкостями:
, швидкості яких лежать в інтервалі від v
до v+ dv. Застосовуючи методи теорії ймовірностей, Максвел знайшов закон розподілу молекул ідеального газу за швидкостями:
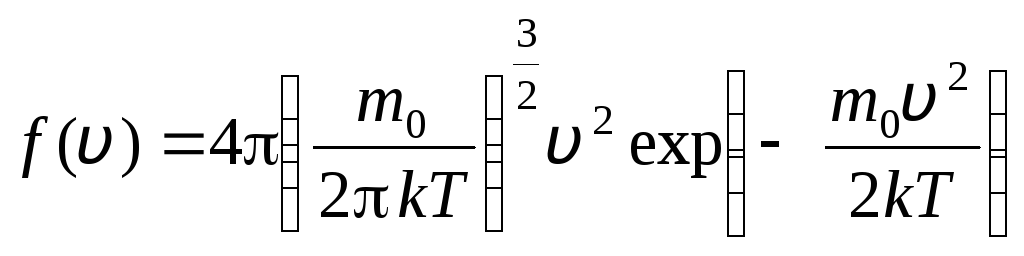 . (1.15)
. (1.15)
Функція розподілу у графічному вигляді представлена на рис. 1.6. Площа, обмежена кривою розподілу та віссю абсцис, дорівнює одиниці. Це означає, що функція f(v) задовольняє умову нормування:
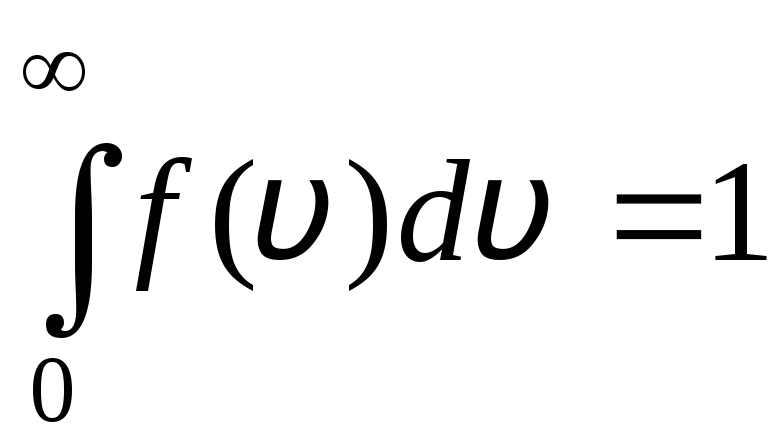 .
.
З  швидкість, при якій функція розподілу молекул ідеального газу за швидкостями f(v) максимальна, називається найбільш імовірною
швидкістю
v B .
швидкість, при якій функція розподілу молекул ідеального газу за швидкостями f(v) максимальна, називається найбільш імовірною
швидкістю
v B .
Значення v = 0 і v = відповідають мінімумам виразу (1.15). Найбільш ймовірну швидкість можна знайти, продиференціювавши вираз (1.23) і прирівнявши його до нуля:
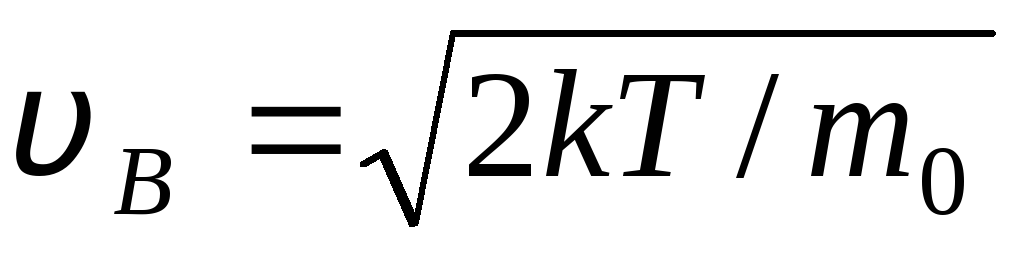 =
=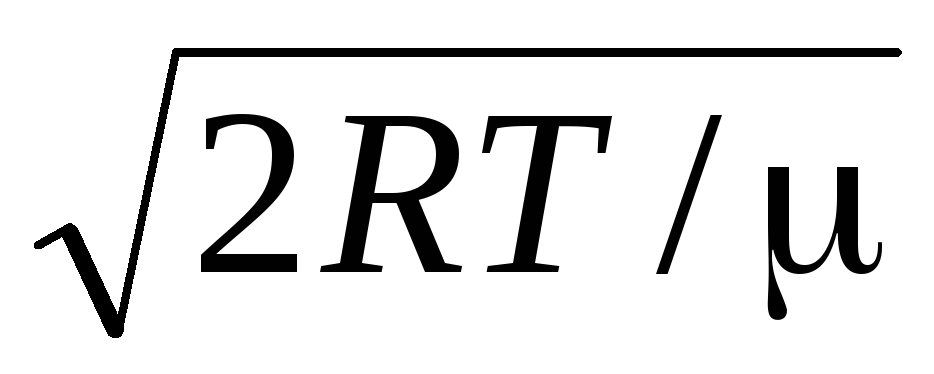 =
1,41
=
1,41
При збільшенні температури максимум функції зміститься вправо (рис.1.6), тобто зі збільшенням температури збільшується і найімовірніша швидкість, проте, обмежена кривою площу залишається незмінною. Слід зауважити, що в газах і при невеликих температурах завжди є невелика кількість молекул, які рухаються з великими швидкостями. Наявність таких «гарячих» молекул має велике значенняпри перебігу багатьох процесів.
Середня арифметична швидкістьмолекули визначається за формулою
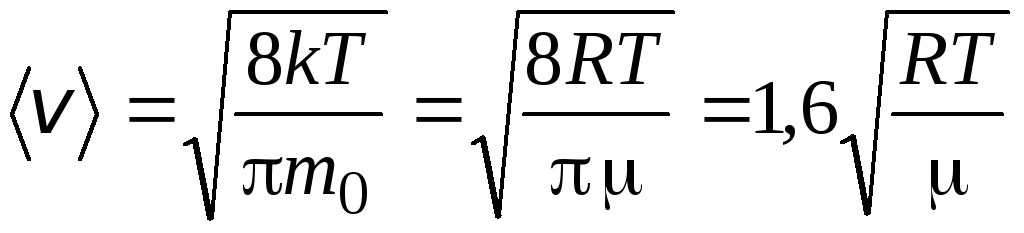 .
.
Середня квадратична швидкість
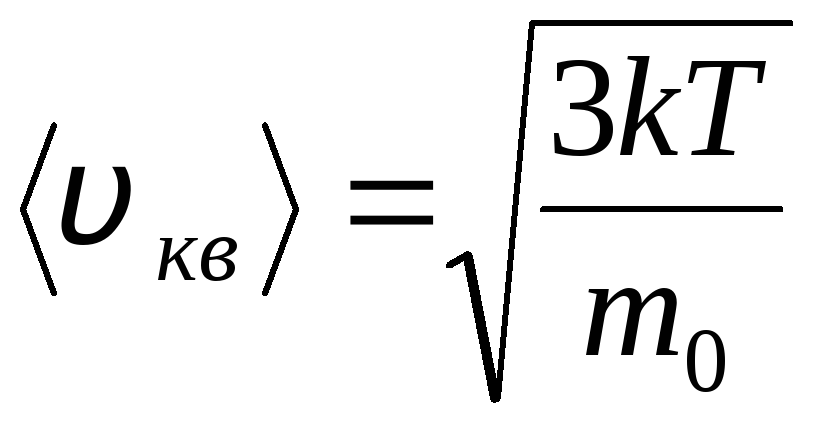 =
1,73
=
1,73 .
.
Ставлення цих швидкостей залежить від температури, ні від виду газу.
Функція розподілу молекул за енергіями теплового руху. Цю функцію можна отримати, підставивши рівняння розподілу молекул (1.15) замість швидкості значення кінетичної енергії:
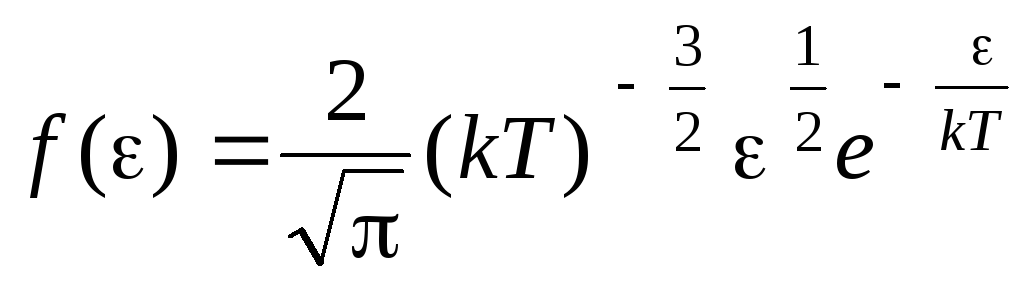 .
.
Проінтегрувавши вираз за значеннями енергії від  до
до 
 , отримаємо середню кінетичну енергіюмолекули ідеального газу:
, отримаємо середню кінетичну енергіюмолекули ідеального газу:
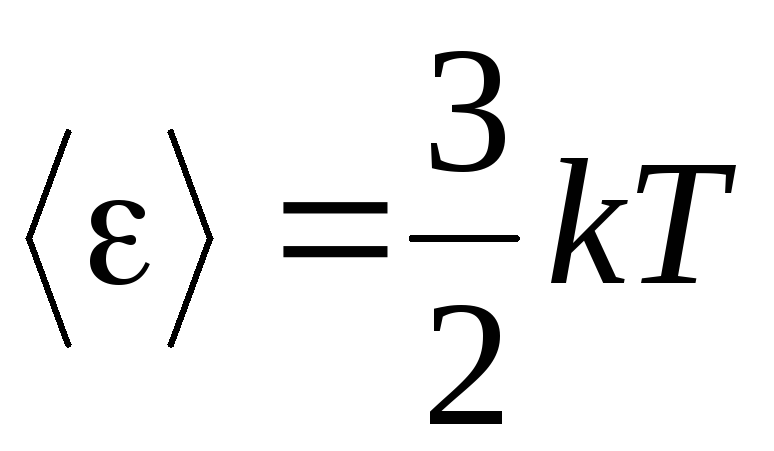 .
.
Барометричні формули. Розподіл Больцмана. При виведенні основного рівняння молекулярно-кінетичної теорії газів і розподілу Максвелла молекул за швидкостями передбачалося, що у молекули ідеального газу діють зовнішні сили, тому молекули рівномірно розподілені у всьому обсязі. Проте молекули будь-якого газу перебувають у полі тяжіння Землі. При виведенні закону залежності тиску від висоти передбачається, що поле тяжіння однорідне, температура постійна і маса всіх молекул однакова:
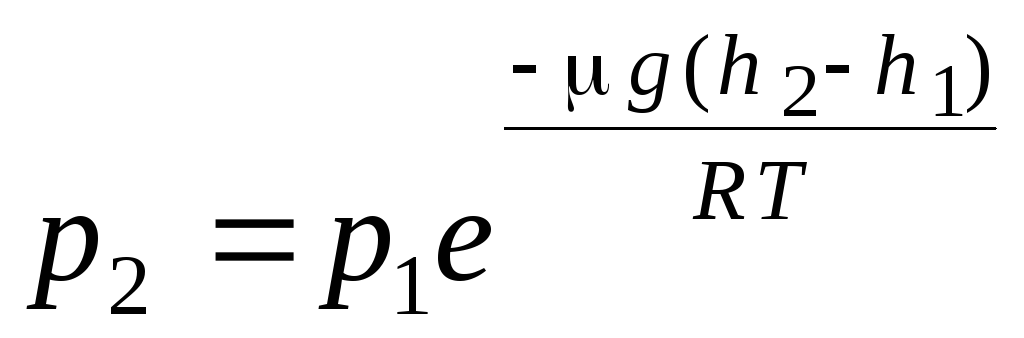 . (1.16)
. (1.16)
Вираз (1.16) називається барометричною формулою. Воно дозволяє знайти атмосферний тиск залежно від висоти або, вимірявши тиск, можна знайти висоту. Так як h 1 - Це висота над рівнем моря, де тиск вважається нормальним, то вираз можна модифікувати:
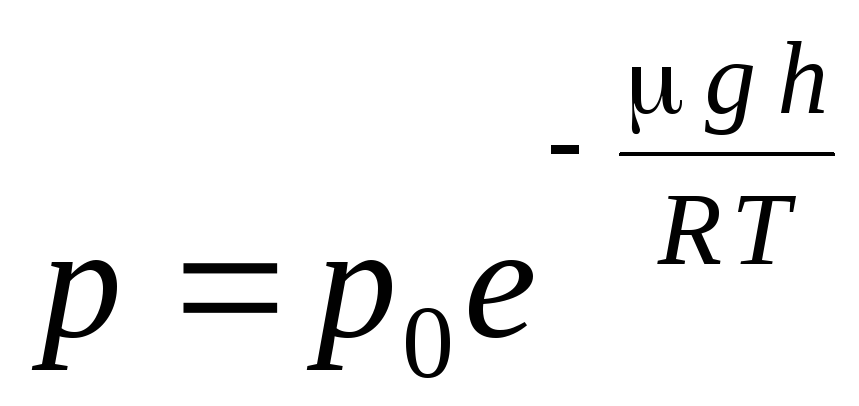 .
.
Барометричну формулу можна перетворити, якщо скористатися виразом р = nkT:
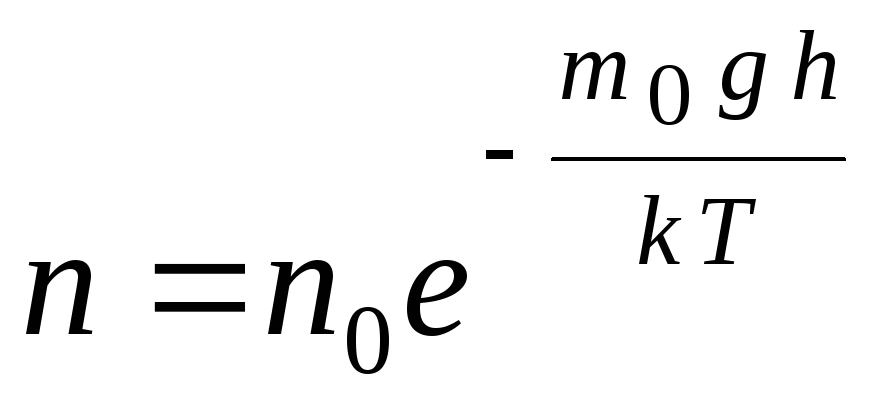 ,
,
г  де n
–
концентрація молекул на висоті h,
m 0
gh=П–
потенційна енергія молекули у полі тяжіння. При постійній температурі щільність газу більша там, де менша потенційна енергія молекули. Графічно закон зменшення кількості частинок в одиниці об'єму з висотою виглядає, як показано на рис. 1.7.
де n
–
концентрація молекул на висоті h,
m 0
gh=П–
потенційна енергія молекули у полі тяжіння. При постійній температурі щільність газу більша там, де менша потенційна енергія молекули. Графічно закон зменшення кількості частинок в одиниці об'єму з висотою виглядає, як показано на рис. 1.7.
Для довільного зовнішнього потенційного поля запишемо такий загальний вираз
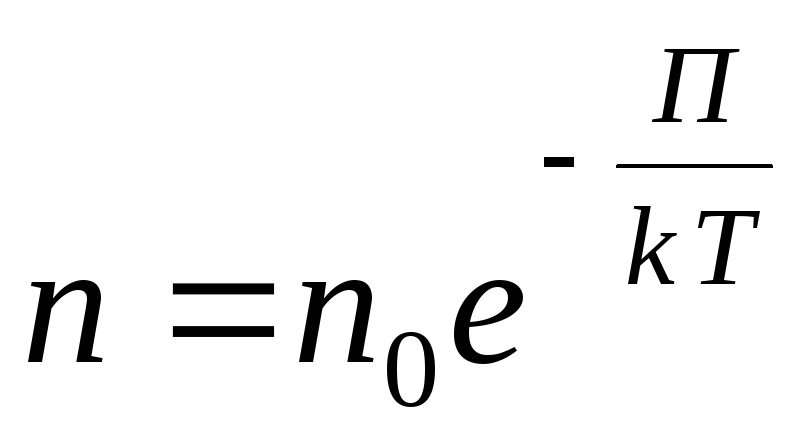 ,
,
У розрідженого газу відстань між молекулами значно перевищує їх розміри. У цьому випадку взаємодія між молекулами зневажливо мало і кінетична енергія молекул набагато більша за потенційну енергію їх взаємодії.
Для пояснення властивостей речовини у газоподібному стані замість реального газу використовується його фізична модель – ідеальний газ. У моделі передбачається:
відстань між молекулами трохи більша за їх діаметр;
молекули – пружні кульки;
між молекулами не діють сили тяжіння;
при зіткненні молекул одна з одною і зі стінками судини діють сили відштовхують;
рух молекул підпорядковується законам механіки.
Основне рівняння мкт ідеального газу:
Основне рівняння МКТ дозволяє обчислити тиск газу, якщо відомі маса молекули, середнє значення квадрата швидкості та концентрація молекул.
Тиск ідеального газуполягає в тому, що молекули при зіткненнях зі стінками судини взаємодіють із ними за законами механіки як пружні тіла. При зіткненні молекули зі стінкою судини проекція швидкості v x вектора швидкості на вісь OX, перпендикулярну до стінки, змінює свій знак на протилежний, але залишається постійною по модулю. Тому в результаті зіткнень молекули зі стінкою проекція її імпульсу на вісь OX змінюється від mv1x=-mvx до mv2x=mvx. Зміна імпульсу молекули при зіткненні зі стінкою викликає сила F 1 діє на неї з боку стінки. Зміна імпульсу молекули дорівнює імпульсу цієї сили:
Під час зіткнення, згідно з третім законом Ньютона, молекула діє на стінку з силою F 2 , що дорівнює модулю силі F 1 і спрямованої протилежно.
Молекул багато, і кожна передає стінці при зіткненні такий самий імпульс. За секунду вони передають імпульс 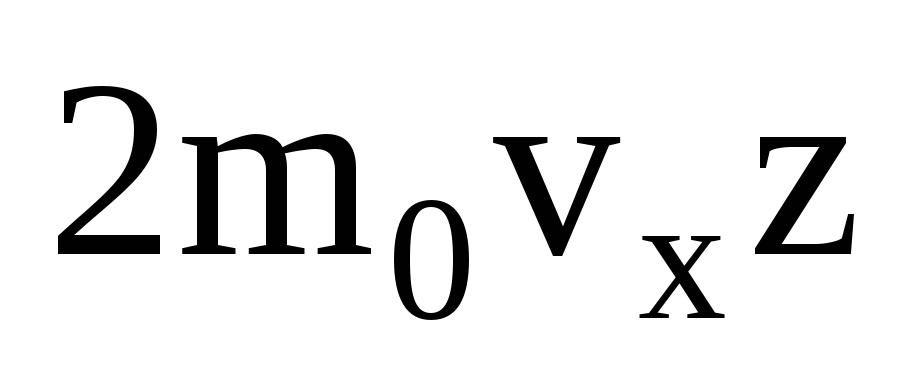 , деz – число зіткнень всіх молекул зі стінкою, яке пропорційне концентрації молекул у газі, швидкості молекул та площі поверхні стінки:
, деz – число зіткнень всіх молекул зі стінкою, яке пропорційне концентрації молекул у газі, швидкості молекул та площі поверхні стінки: 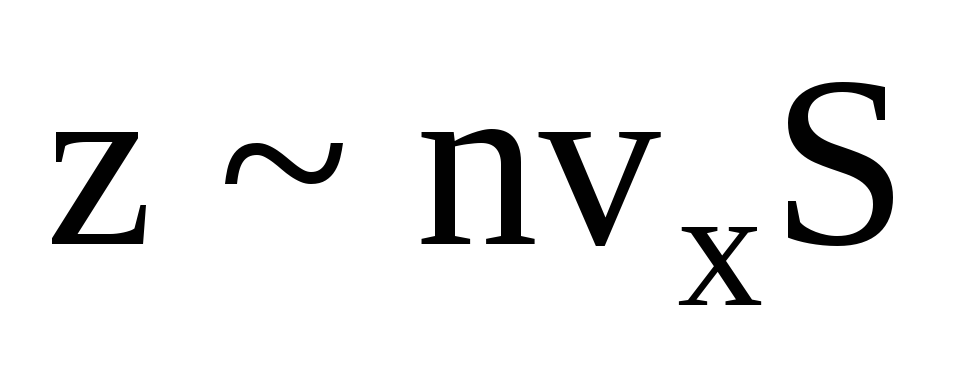 . До стінки рухається лише половина молекул, інші рухаються у зворотний бік:
. До стінки рухається лише половина молекул, інші рухаються у зворотний бік: 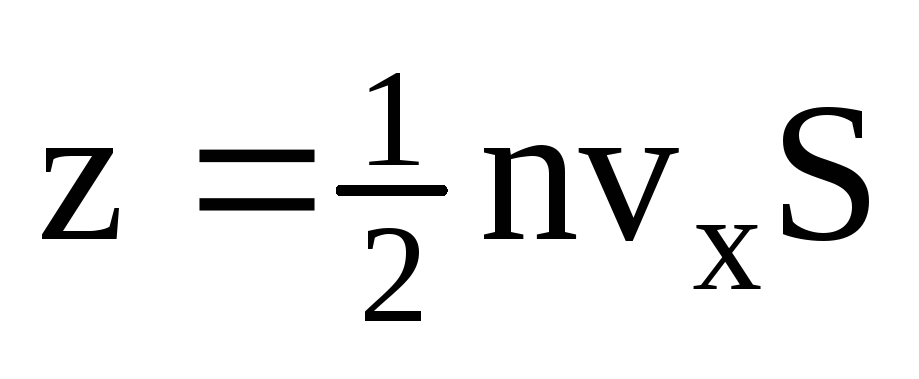 . Тоді повний імпульс, переданий стінці за 1 секунду:
. Тоді повний імпульс, переданий стінці за 1 секунду: 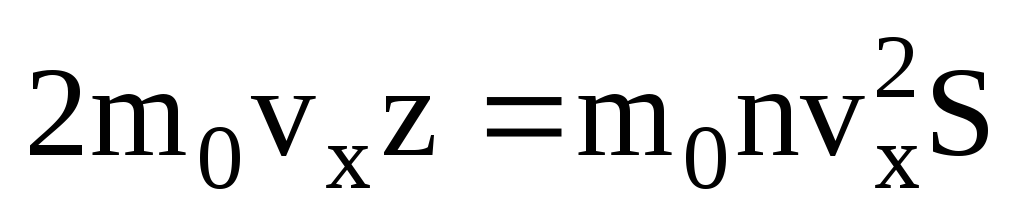 . Відповідно до другого закону Ньютона зміна імпульсу тіла за одиницю часу дорівнює силі, що діє на нього:
. Відповідно до другого закону Ньютона зміна імпульсу тіла за одиницю часу дорівнює силі, що діє на нього:
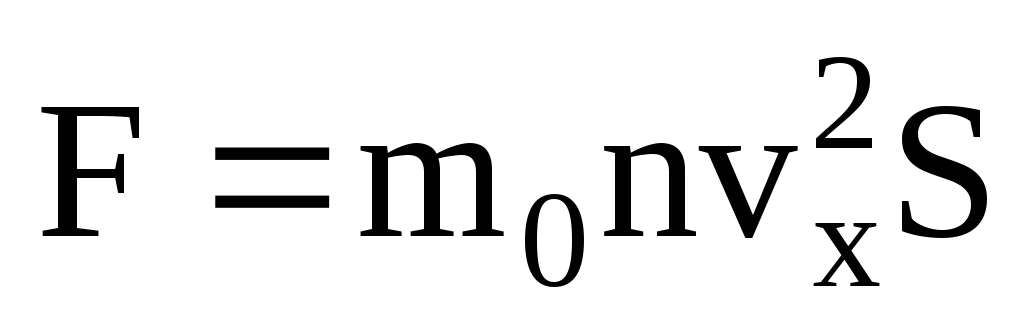
Враховуючи, що не всі молекули мають однакову швидкість, сила, що діє на стінку, буде пропорційна середньому квадрату швидкості. Оскільки молекули рухаються у всіх напрямках, середні значення квадратів проекцій швидкості рівні. Отже, середній квадрат проекції швидкості: 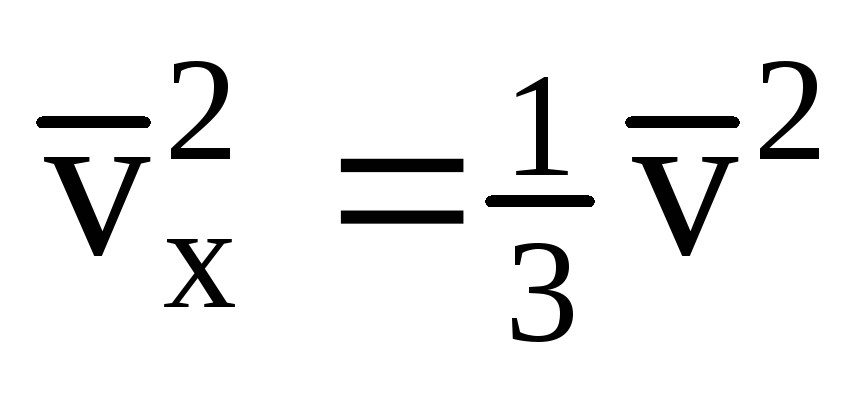 ;
;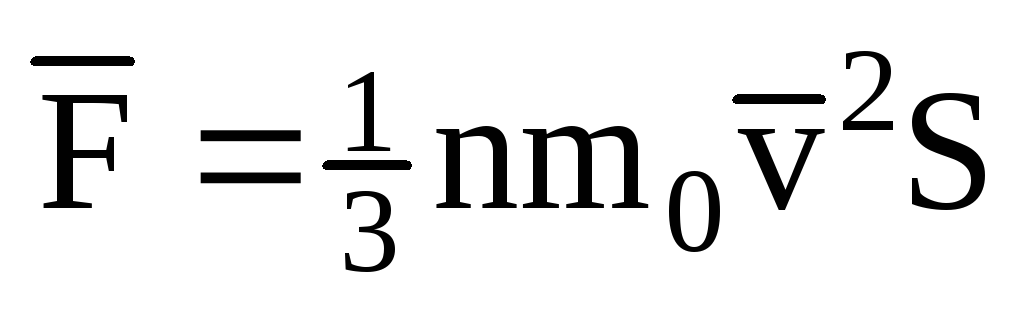 . Тоді тиск газу на стінку судини дорівнює:
. Тоді тиск газу на стінку судини дорівнює:
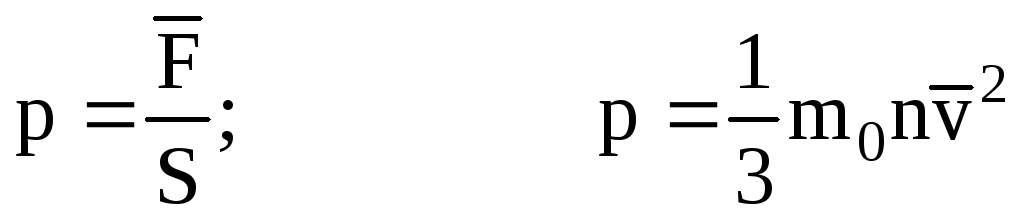 - Основне рівняння МКТ.
- Основне рівняння МКТ.
Позначивши середнє значення кінетичної енергії поступального руху молекул ідеального газу:
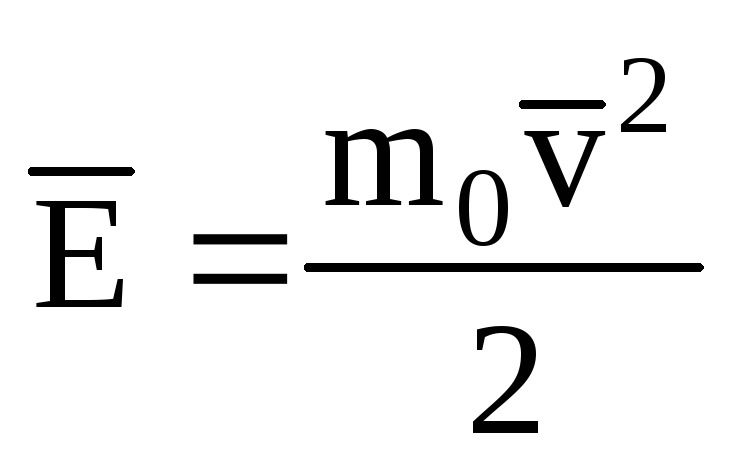 , отримаємо
, отримаємо
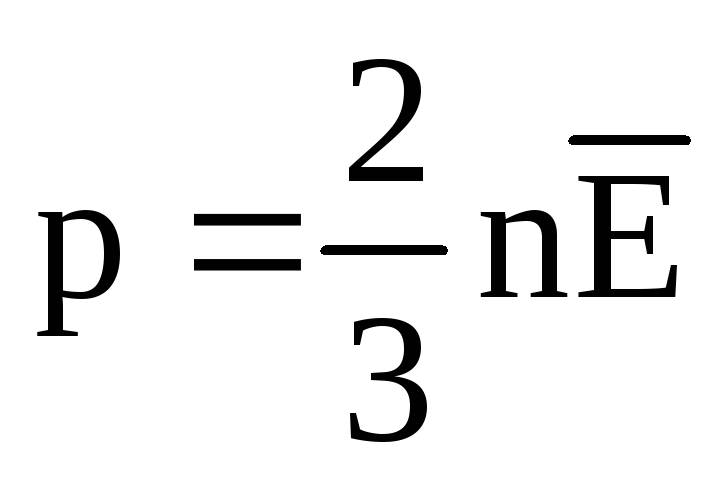
Температура та її вимір:
Основне рівняння МКТ для ідеального газу встановлює зв'язок макроскопічного параметра, що легко вимірюється, - тиску - з такими мікроскопічними параметрами газу, як середня кінетична енергія і концентрація молекул. Але, вимірявши лише тиск, ми можемо дізнатися ні середнє значення кінетичної енергії молекул окремо, ні їх концентрацію. Отже, для знаходження мікроскопічних параметрів газу потрібні виміри ще якоїсь фізичної величини, пов'язаної із середньою кінетичною енергією молекул. Такою величиною є температура.
Будь-яке макроскопічне тіло чи група макроскопічних тіл за незмінних зовнішніх умов мимоволі перетворюється на стан теплового рівноваги. Теплова рівновага –це такий стан, при якому всі макроскопічні параметри як завгодно довго залишаються незмінними.
Температура характеризує стан теплової рівноваги системи тіл: всі тіла системи, що знаходяться один з одним у тепловій рівновазі, мають одну й ту саму температуру.
Для вимірювання температури можна скористатися зміною будь-якої макроскопічної величини залежно від температури: об'єму, тиску, електричного опору тощо.
Найчастіше на практиці використовують залежність об'єму рідини (ртуть або спирт) від температури. При градуюванні термометра зазвичай за початок відліку (0) приймають температуру льоду, що тане; другою постійною точкою (100) вважають температуру кипіння води за нормального атмосферного тиску (шкала Цельсія). Так як різні рідини розширюються при нагріванні неоднаково, встановлена таким чином шкала до певної міри залежатиме від властивостей даної рідини. Звичайно, 0 і 100С збігатимуться у всіх термометрів, але 50С збігатися не будуть.
На відміну від рідин, всі розріджені гази розширюються при нагріванні однаково і однаково змінюють свій тиск при зміні температури. Тому у фізиці для встановлення раціональної температурної шкали використовують зміну тиску певної кількості розрідженого газу при постійному обсязі або зміну обсягу газу при постійному тиску. Таку шкалу іноді називають ідеальною газовою шкалою температур.
При тепловому рівновазі середня кінетична енергія поступального руху молекул всіх газів однакова. Тиск прямо пропорційно до середньої кінетичної енергії поступального руху молекул: 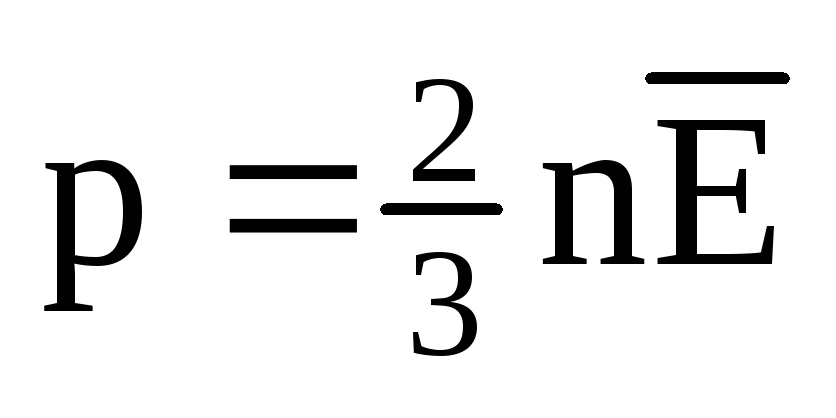 . При тепловій рівновазі, якщо тиск газу даної маси та його об'єм фіксовані, середня кінетична енергія молекул газу повинна мати певне значення, як і температура. Т.к.
. При тепловій рівновазі, якщо тиск газу даної маси та його об'єм фіксовані, середня кінетична енергія молекул газу повинна мати певне значення, як і температура. Т.к.  , то
, то 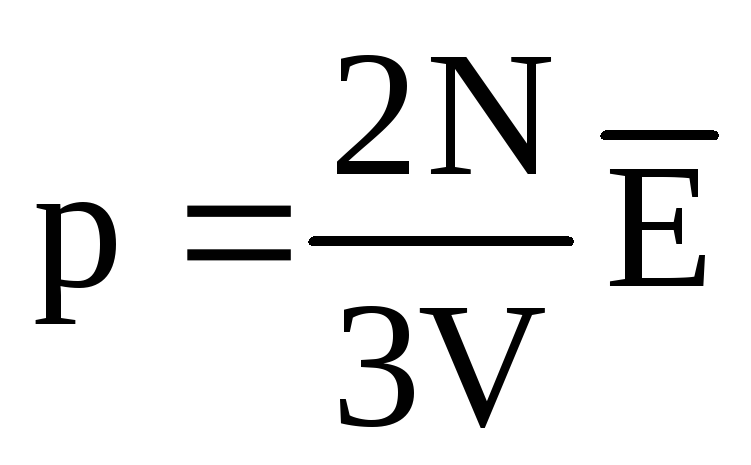 , або
, або 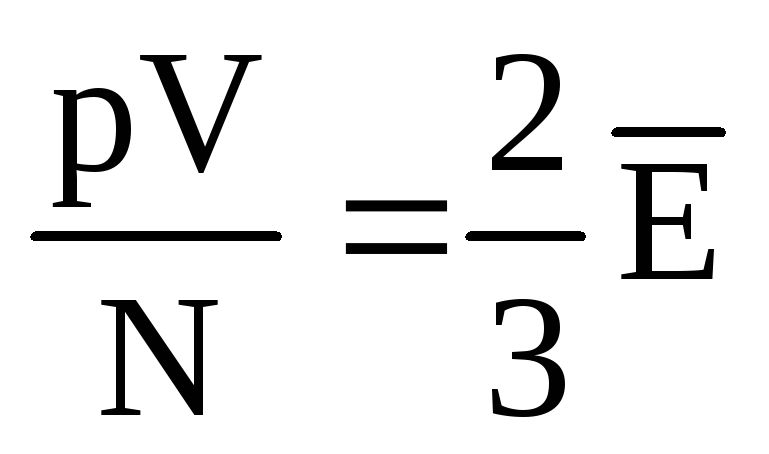 .
.
Позначимо 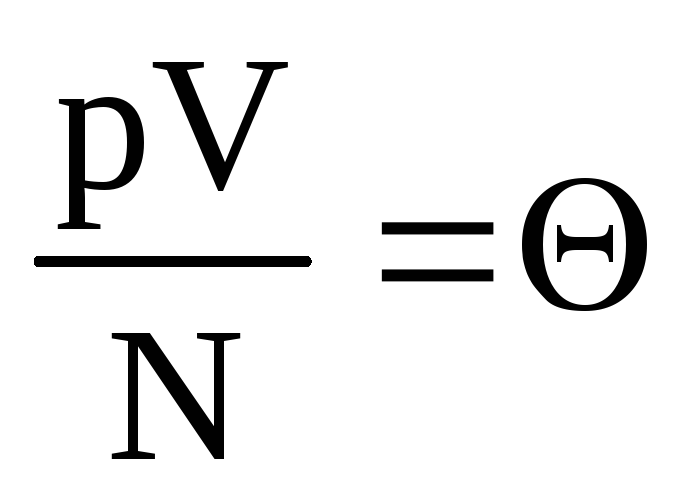 . Величина
. Величина  зростає із підвищенням температури і ні від чого, крім температури, не залежить. Отже, її вважатимуться природною мірою температури.
зростає із підвищенням температури і ні від чого, крім температури, не залежить. Отже, її вважатимуться природною мірою температури.
Чи знаєте ви,
що таке уявний експеримент, gedanken experiment?
Це неіснуюча практика, потойбічний досвід, уяву того, чого немає насправді. Думкові експерименти подібні до снам наяву. Вони народжують чудовиськ. На відміну від фізичного експерименту, який є досвідченою перевіркою гіпотез, "думковий експеримент" фокусічно підміняє експериментальну перевірку бажаними, не перевіреними на практиці висновками, маніпулюючи логікоподібними побудовами, що реально порушують саму логіку шляхом використання недоведених посилок як доведені. Отже, основним завданням заявників " уявних експериментів " є обман слухача чи читача шляхом заміни справжнього фізичного експерименту його " лялькою " - фіктивними міркуваннями під слово слово без самої фізичної перевірки.
Заповнення фізики уявними, " уявними експериментами " призвело до виникнення абсурдної сюрреалістичної, сплутано-заплутаної картини світу. Справжній дослідник має відрізняти такі "фантики" від справжніх цінностей.
Релятивісти і позитивісти стверджують, що "думковий експеримент" дуже корисний інструмент для перевірки теорій (також виникають у нашому розумі) на несуперечність. У цьому вони дурять людей, оскільки будь-яка перевірка може здійснюватися лише незалежним від об'єкта перевірки джерелом. Сам заявник гіпотези не може бути перевіркою своєї ж заяви, оскільки причиною самої цієї заяви є відсутність видимих для заявника протиріч у заяві.
Це ми бачимо на прикладі СТО та ОТО, які перетворилися на своєрідний вид релігії, керуючої наукою та громадською думкою. Жодна кількість фактів, що суперечать їм, не може подолати формулу Ейнштейна: "Якщо факт не відповідає теорії - змініть факт" (В іншому варіанті "- Факт не відповідає теорії? - Тим гірше для факту").
Максимально, потім може претендувати " уявний експеримент " - це лише внутрішню несуперечність гіпотези у межах своєї, часто зовсім на істинної логіки заявника. Відповідно до практики це не перевіряє. Ця перевірка може відбутися тільки в дійсному фізичному експерименті.
Експеримент на те й експеримент, що він не витончення думки, а перевірка думки. Несуперечлива в собі думка не може сама себе перевірити. Це доведено Куртом Геделем.
