Газові суміші Теплоємність газів. Паливо, газові суміші та теплоємність
1.3. Рівняння стану ідеального газу
Вигляд рівнянь станів (1.1) реальних речовин досить складний.
У зв'язку з цим у термодинаміці використовуються спрощені фізичні моделі робочих тіл.
Для робочих тіл у газоподібному стані найпростішою та історично першою є модель ідеального газу. Під ідеальним газом розуміється газ, у якому сили міжмолекулярної взаємодії (тяжіння та відштовхування) відсутні, а самі молекули розглядаються як матеріальні точки. Ідеальний газ підкоряється рівняння Клайперону– Менделєєва
де m- Маса газу в системі; μ – молярна маса газу; Rμ = 8314 Дж/(кмоль К) – універсальна газова постійна, яка не залежить ні від виду газу, ні від умов його існування. Рівняння стану (1.2) одержано шляхом об'єднання законів Бойля-Маріоттаі Гей-Люссаказ урахуванням закону Авогадро.
Молярна маса μ = m/n, кг/моль – маса речовини, взятої в кількості одного моля. 1 моль- Це одиниця кількості речовини, в якій міститься стільки ж частинок, скільки в 12 грамах вуглецю. Кількість речовини– n = N/N A, моль, де N- Число частинок (атомів, молекул), N A ≈ 6,02·10 23 – число атомів у 12 грамах вуглецю ( число Авогадро). Чисельно μ = Мr·10 -3 , де Mr - відносна молекулярна маса речовини ( табл. Менделєєва) (наприклад: =2 кг/кмоль).
У питомих величинах (тобто для 1 кг газу) рівняння (1.2) матиме вигляд
де R- Питома газова постійна, Дж / (кг К).
Пояснимо фізичний зміст питомої газової постійної R. Для першого стану рівняння (1.2) запишеться як , другого стану при тому ж тиску – . Віднімемо з другого рівняння перше і знайдемо, що , тобто. питома газова стала є робота, що здійснюється 1 кг газу при його нагріванні на 1 градус при постійному тиску.
Експериментальні дані показують, що реальний газ тим ближче до ідеального, чим нижча його щільність. Іншими совами, зі зменшенням обсягу даної кількості газу, що викликається підвищенням тиску або зниженням температури, будь-який газ даватиме все більші відхилення від властивостей ідеального газу. Таким чином, під поняття «ідеальний газ» підходять усі реальні гази за високих температур і малих тисків.
1.4. Суміші ідеальних газів
У практиці найчастіше робочим тілом є суміш однорідних газів (наприклад, повітря), кожен з яких можна вважати ідеальним і які не вступають між собою в хімічні реакції.
Така суміш є ідеальним газом і підпорядковується рівнянню стану (1.2) для суміші.
де R=R μ / μ - Постійна газова суміші; μ -Середня (здається) молярна маса суміші(умовна величина, що відноситься до однорідного газу, у якого число молекул і загальна маса дорівнюють числу молекул і масі суміші).
Маса суміші дорівнює масі всіх складових компонент
Основним законом, визначальним поведінка газової суміші є закон Дальтона:
кожен окремий газ поводиться в газовій суміші так, ніби він один при температурі суміші займає весь об'єм суміші,
кожен окремий газ, що входить у газову суміш, має такий тиск, який би він мав би, якби він один займав весь об'єм газової суміші.
Звідси величина р(абсолютний тиск суміші) визначається як
де р i – парціальний тиск i-го компонента, тобто. тиск, який мав би i-й компонент, якщо він один займав весь обсяг суміші при тій же температурі ().
Склад суміші визначається масовими або молярними частками складових суміш компонент, а також об'ємними частками (концентраціями).
Масовою часткоюназивається відношення маси кожного газу до загальної маси суміші: .
З рівняння (1.3) випливає, що .
Об'ємною часткоюназивається відношення парціального обсягу(Обсяг, який займав би газ, якщо його тиск і температура дорівнювали тиску і температурі суміші газів, тобто) до загального обсягу суміші газів: . З визначень парціального тиску та обсягу та сталості температури випливає:
![]() (1.5)
(1.5)
Просумувавши останню рівність за всіма компонентами суміші, отримаємо , тобто. сума парціальних обсягів газів, що становлять суміш, дорівнює обсягу суміші газів.
Сума об'ємних часток дорівнює одиниці: .
Молярною часткоюкомпонента називають відношення кількості речовини кожного газу n i до кількості речовини суміші газів n. Зі співвідношень та і закону Авогадро(В рівних обсягах різних ідеальних газів, що знаходяться при однакових температурах і однакових тисках, укладено рівну кількість молекул, тобто)
тобто. Завдання суміші молярними частками рівнозначне завдання її об'ємними частками.
Масові та об'ємні частки пов'язані співвідношенням:
![]() .
.
Якщо суміш задана масовими частками g i, то газова стала суміші і молярна маса суміші обчислюються наступним чином:
![]()
![]()
Якщо суміш задана об'ємними частками r iформули для обчислення молярної маси суміші і газової постійної суміші наступні:
![]() (1.6)
(1.6)
Парціальні тиски та обсяги газів визначаються за закону Бойля–Маріотта(При постійній температурі газу добуток тиску газу на його обсяг є величина постійна, тобто):
![]() .
.
Контрольні питання
Міжнародна система одиниць (СІ) та її основні одиниці.
Основні термодинамічні параметри та їх розмірність.
Що розуміють під рівноважним станом термодинамічної системи?
Поняття рівноважного та нерівноважного станів.
Що таке рівняння стану системи?
Геометрична інтерпретація стану системи, термодинамічний процес.
Що називається ідеальним газом? У чому відмінність ідеального газу від реального?
Що таке постійна газова? Її фізичний зміст, розмірність та способи визначення.
2. Теплоємність
Повідомлення робочому тілу теплоти у будь-якому процесі викликає зміну його стану та, у випадку, супроводжується зміною температури. Зміна температури, як будь-якого іншого параметра стану робочого тіла, не залежить від виду процесу, а залежить від його початкового ( 1 ) та кінцевого ( 2 ) стану, тобто. (Для елементарного процесу зміна параметра замінюється його диференціалом).
Відношення кількості теплоти δ Q, що повідомляється тілу, до зміни температури тіла dTв елементарному термодинамічному процесі називається справжньою теплоємністютіла в даному процесі:
Нижній індекс тут свідчить про те обставина, що теплоємність як і, як і теплота, залежить від характеру процесу. Крім того, теплоємність залежить від кількості тіла та його термодинамічного стану. Слід також зазначити, що в цьому процесі не змінюється хімічний склад тіла, не міститься перехід речовини з одного агрегатного стану в інший, не відбувається розчинення компонентів та ін.
Залежно від обраної одиниці кількості речовини розрізняють масову, об'ємну та мольну питомі теплоємності:
Найчастіше практично використовується поняття масової теплоємності.
2.1. Справжня та середня теплоємності
Теплоємність реальної речовини не є постійною величиною. Вона змінюється зі зміною температури, причому ця залежність може бути значною (рис. 2.1).
Питома кількість теплоти процесу обчислюється за формулою
Застосовують такі способи визначення цієї величини:
за результатами експерименту залежність теплоємності від температури подають у вигляді апроксимаційного полінома
де - Коефіцієнти апроксимації. У довідковій літературі наводяться ці коефіцієнти. Тоді
у практичних розрахунках в інтервалі температур t 1 , t 2 теплоємність вважають постійною величиною, що дорівнює
яку називають середньою теплоємністюв даному інтервалі на відміну від істинної теплоємності, введеної (2.1). У довідкових даних наводяться середні теплоємності від 0 до фіксованої температури tотримані дослідним шляхом, тобто.
Середню теплоємність в інтервалі температур t 1 , t 2 за цими довідковими даними можна обчислити за формулою
Тоді питома кількістьтеплоти процесу визначиться як
2.2. Ізохорна та ізобарна теплоємності
У термодинаміці мають велике значення
ізохорнатеплоємність
рівна відношенню кількості теплоти в процесі при постійному обсязі до зміни температури тіла,
ізобарнатеплоємність
рівна відношенню кількості теплоти в процесі при постійному тиску до зміни температури тіла.
У теплотехнічних розрахунках використовують таблиці, в яких наводяться отримані дослідним шляхом числові значення питомих ізобарної та ізохорної теплоємностей для різних речовин залежно від температури.
2.3. Теплоємність сумішей газів
При розрахунках часто доводиться мати справу з сумішами газів, а таблицях наводяться теплоємності лише окремих газів.
Якщо суміш газів задана масовими частками g i, то питомі масові теплоємності суміші визначаються за формулами
![]()
Якщо суміш газів задана об'ємними частками r i, то питомі об'ємні теплоємності суміші визначаються за формулами
![]()
Контрольні питання
Випишіть одиниці виміру питомої теплоємності.
Як запроваджується поняття середньої теплоємності?
3. Закон збереження та перетворення енергії
Поняття енергії пов'язані з рухом матерії.
Енергія може набувати багатьох форм – механічної роботи, теплоти, хімічної енергії, енергії електричного та магнітного полів.
У термодинамічному процесі взаємодія довкілля та закритої термодинамічної системи здійснюється шляхом обміну енергією у формі теплоти та механічної роботи.
3.1. Внутрішня енергія
Будь-яке середовище має деякий запас внутрішньою енергієюU(Дж), яку у технічній термодинаміці представляють як суму кінетичної та потенційної енергій молекул та атомів середовища. Кінетична енергія цих частинок визначається їх швидкістю та масою, потенційна – силами взаємодії між ними, які залежать від їхнього взаємного розташування. Внутрішня енергія системи – це енергія, що міститься у самій системі. Отже, внутрішня енергія може характеризувати стан тіла поруч із величинами р, V, T.
Внутрішня енергія має властивість адитивності, тобто. внутрішня енергія складної системи дорівнює сумі внутрішніх енергій складових її частин:
Внутрішня енергія 1 кг речовини називається питомою внутрішньою енергією u= U/ m (Дж/кг).
Для більшості технічних додатків термодинаміки важливо не абсолютне значення U, А зміна цієї величини. Тому кількісне визначення внутрішньої енергії однорідної системи часто визначається стосовно деякого умовно обраного стандартного стану.
3.2. Закон збереження енергії у термодинаміці
Здійснюючи термодинамічний процес, закрита система взаємодіє із довкіллям (зовнішніми тілами і полями), тобто. обмінюється енергією. У технічній термодинаміці розглядаються два види передачі енергії – шляхом передачі теплоти та здійсненням механічної роботи.
Передача теплоти відбувається між тілами, що мають різну температуру та наведеними в дотик, або між тілами з різними температурами, що знаходяться на відстані, за допомогою електромагнітних хвиль ( теплове випромінювання). Передача теплотивідбувається на молекулярному (мікрофізичному) рівні без видимого руху тел.
Передача енергії у формі роботи відбувається з переміщенням всього тіла чи його частини у просторі. При цьому способі тіло рухається в силовому полі, або змінює свій об'єм під дією зовнішнього тиску. Роботає макрофізичною формою передачі енергії.
Слід зазначити, що теплота і на відміну енергії тіла є функціями його стану, а залежить від виду процесу, визначають цей процес, тобто. є функціями самого процесу.
Численні досліди та спостереження призвели до відкриття фундаментального закону природи – закону збереження енергії: енергія в природі не виникає з нічого і не зникає,або кількість енергії незмінно, вона тільки переходить з однієї форми до іншої,або
де Q– теплота, що у процесі; L- Здійснювана робота; Δ Е- Зміна енергії системи. Тут і далі умовимося вважати:
роботу позитивною, якщо ця робота здійснюється робочим тілом, та негативною, якщо відбувається робота над робочим тілом системи;
теплоту, підведену до тіла, – позитивною, А відведену - негативною,
крім того, зміна будь-якого параметра стану в кінцевому процесі позначатимемо символом Δ (дельта), а в елементарному процесі – d(Диференціал відповідного параметра). За будь-якого кінцевого термодинамічного процесу зміна параметра стану (тиск, температура, внутрішня енергія, ентальпія, ентропія і т.д.) не залежить від виду процесу, а визначається початковим і кінцевим станом.
У загальному випадку термодинамічна система має внутрішню енергію. U, кінетичною енергією (у термодинаміці система розглядається як ціле, що рухається зі швидкістю w) – mw 2/2, потенційною – mgz (z- Висота, на якій знаходиться система). Зміна повної енергії у процесі 1 –2 можна уявити як:
Робота, що здійснюється в цьому процесі, складається з роботи Lпро, пов'язану із зміною об'єму робочого тіла системи (деформаційна робота), роботи Lдв по переміщенню системи у просторі, технічної роботи L тих (при переміщенні системи до різних технічних пристроїв, наприклад, у двигуні, паровому котлі, компресорі тощо), роботи проти сил тертя Lтр:
L = L про + L дв + L тих + L тр.
Теплота, що бере участь у процесі, є сумою теплоти Qзовніш, задіяної в обміні із зовнішнім середовищем, та теплоти тертя Qтр:
Q = Qвнеш + Qтр.
Враховуючи що Qтр = Lтр (чисельні експерименти показали, що робота потоку, витрачена на подолання тертя, повністю перетворюється на теплоту, що сприймається потоком), закон збереження енергії в термодинаміці для 1 кг робочої однорідної речовини (тобто у питомих масових величинах) в елементарному процесі можна записати :
![]() , (3.1)
, (3.1)
(індекс зовніш пропущений через непотрібність).
Слід наголосити, що у правій частині (3.1) під знаком диференціала знаходяться функції стану, а інші – величини, що залежать від характеру перебігу термодинамічного процесу. Так як робота і теплота є функціями процесу, а не функціями стану, то знак δ позначає лише той факт, що в елементарному процесі величини, що йдуть за ним – довільні нескінченно малі, а не збільшення будь-яких певних функцій. Таким чином, δ qта δ l-Елементарні (тобто відповідні нескінченно малим змінам стану системи) кількості теплоти та роботи.
Якщо термодинамічна система не змінює свого положення у просторі і єдиним видом роботи є робота, пов'язана зі зміною об'єму системи, то рівняння (3.1) набуває більш простого вигляду:
Робота δ lпро відбувається або проти сил зовнішнього тиску і, тоді, обсяг робочого тіла розширюється, або, навпаки, зовнішнє середовище виконує роботу над тілом, стискаючи його. Для рівноважних процесів, коли тиск середовища дорівнює тиску в робочому тілі, ця робота обчислюється як рdv, де v- Питомий обсяг робочої речовини.
Рівняння
називають першим початком термодинаміки: підведена до закритої термодинамічної системи, що спочиває, теплота витрачається на зміну внутрішньої енергії системи і на здійснення роботи зі зміни обсягу системи. Балансове співвідношення (3.2) називають ще лекціями потеоретичного літературознавства. 1. Бароко: ...
Л. А. Єлісєєва © Федеральна державна бюджетна установа науки Державна публічна науково-технічна бібліотека Сибірського відділення ран (гпнтб з ран), 2013
ПокажчикВипадкових блукань / О. М. Бородін, І. А. Ібрагімов; під... 241. Дорогокупець П.І. Термодинамікамінералів та мінеральних рівноваг... каталогів: конспект лекції покурсу "Довідково... державного технічногоуніверситету. Серія, Технічнінауки. - ...
Н. В. Басова [та ін]; під заг ред. Н. В. Басової. Ростов н/Д: Фенікс, 2008
ПідручникКурс) Письмовий Д. Т. Конспект лекцій повищої математики [Текст]: ... Технічна термодинамікаРудобашта, С. П. Теплотехніка [Текст]: підручник для студ. вузів, які навчаються по... 2008. – 204 с. 10 Бородін, І. Ф. Автоматизація технологічних процесів...
Список наукових праць страти за період 2008 - 1 06 2013 р. (1)
Документ... «Рентгенологічні методи дослідження» Лекції поклінічної онкології. Алмати... другого закону термодинаміки» 2-Міжнародний... і експертна оцінка технічногообладнання організацій охорони здоров'я... академіка РАМН Ю.І. Бородіна, Бішкек, 2009,С. ...
В інженерній практиці часто доводиться мати справу не з однорідними газами, а із сумішами хімічно не пов'язаних між собою газів. Прикладами газових сумішей можуть бути: атмосферне повітря, природний газ, газоподібні продукти згоряння палив тощо.
Для газових сумішей справедливі такі положення.
1. Кожен газ, що входить у суміш, має температуру, рівну температурісуміші.
2. Будь-який з газів, що входять до суміші, поширюється по всьому об'єму суміші і тому об'єм кожного газу дорівнює об'єму всієї суміші.
3. Кожен із газів, що входять у суміш, підпорядковується своєму рівнянню стану.
4. Суміш загалом є хіба що новим газом і підпорядковується своєму рівнянню стану.
В основі вивчення газових сумішей лежить закон Дальтона, згідно з яким при постійній температурі тиск суміші дорівнює сумі парціальних тисків газів, що входять до суміші:
де p см – тиск суміші;
p i - парціальний тиск i-го газу, що входить до суміші;
n - кількість газів, що входять до суміші.
Парціальним називають тиск, який чинитиме газ, що входить у суміш, якщо він один займатиме весь об'єм суміші при тій же температурі.
Способи завдання газових сумішей
Склад газової суміші може бути заданий масовими, об'ємними та мольними частками.
Масові частки. Масовою часткою будь-якого газу, що входить у суміш, називається відношення маси цього газу до маси суміші.
m1 = M1/M см; m2 = M2/M см; ..........; m n = M n / M см,
де m 1 , m 2 , ..., m n - масові частки газів;
М 1 , М 2 ..., М n - маси окремих газів;
М см – маса суміші.
Неважко бачити, що  і
і  (100%).
(100%).
Об'ємні частки.Об'ємною часткою будь-якого газу, що входить у суміш, називається відношення наведеного (парціального) обсягу цього газу до обсягу суміші.
r 1 = V 1 / V см; r 2 = V 2 /V див; ........., r n = V n / V см;
де V 1 , V 2 ..., V n - наведені обсяги газів;
V см – обсяг суміші;
r 1 , r 2 , ..., r n - об'ємні частки газів.
Наведений обсяг - це обсяг газу за умов суміші (при температурі та тиску суміші).
Наведений обсяг можна подати наступним чином: якщо з посудини, де знаходиться суміш, видалити всі гази, крім одного, і газ, що залишився, стиснути до тиску суміші, зберігши температуру, то його об'єм і буде наведеним або парціальним.
Можна довести, що обсяг суміші дорівнюватиме сумі наведених обсягів газів.
 (100%).
(100%).
Молільні частки.Мольною часткою будь-якого газу, що входить в суміш, називається відношення числа кіломолей цього газу до кіломолей суміші.
r 1 = n 1 /n див; r 2 = n 2 /n см; ........., r n = n n / n см,
де r 1 , r 2 , ..., r n - мольні частки газів;
n см - число кіломолей суміші;
n 1 , n 2 , ..., n n - Число кіломолей газів.
Завдання суміші мольними частками тотожне завдання суміші об'ємними частками, тобто. мольні та об'ємні частки мають для кожного газу, що входить в суміш, однакові чисельні значення.
Газова стала і середня молекулярна маса суміші.Для обчислення постійної газової суміші, заданої масовими частками, запишемо рівняння стану:
для суміші
p см × V см = М см R см Т; (1.9)
для газів
 .
(1.10)
.
(1.10)
Підсумовуємо ліві та праві частини рівнянь (1.10)
(p 1 + p 2 + .... + p n) V см = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Так як  ,
,
то p см V см = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
З рівнянь (1.9) та (1.11) випливає, що
М см R см Т = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R см = М 1 / М см R 1 + М 2 / М см R 2 + ...... + М n / М см R n =
M 1 R 1 + m 2 R 2 + ...... + m n R n
або  ,
(1.12)
,
(1.12)
де R см - Постійна газова суміші.
Оскільки газова постійна i-го газу
R i = 8314 / m i ,
то рівняння (1.12) перепишеться так:
 .
(1.13)
.
(1.13)
Визначаючи параметри газової суміші, зручно користуватися деякою умовною величиною, яка називається уявною (середньою) молекулярною масою газової суміші. Поняття молекулярної маси суміші, що здається, дозволяє умовно розглядати суміш як однорідний газ, що істотно спрощує розрахунки.
Для окремого газу справедливий вираз
За аналогією для суміші можна записати
m см R см = 8314, (1.14)
де m см - молекулярна маса суміші, що здається.
З рівняння (1.14), використовуючи вирази (1.12) та (1.13), отримаємо
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Розмірковуючи подібним чином, можна отримати формули для розрахунку R см і m см через об'ємні частки, формули для перерахунку масових часток в об'ємні частки і, навпаки, об'ємних часток масові, формули для розрахунку питомого об'єму суміші u см і щільності суміші r см через масові і об'ємні частки і, нарешті, формули для розрахунку парціальних тисків газів, що входять до суміші, через об'ємні та масові частки. Наведемо ці формули без висновку таблиці.
Формули для розрахунку газових сумішей
|
Завдання складу суміші |
Переклад з одного складу до іншого |
Щільність та питомий обсяг суміші |
Здається молекулярна маса суміші |
Газова постійна суміші |
Парціальний тиск |
|
Масовими частками |
|
|
|
|
|
|
Об'ємними частками |
|
|
|
|
|
Теплоємність газів
Теплоємністю тіла називають кількість теплоти, необхідну для нагрівання чи охолодження тіла на 1 К. Теплоємність одиниці кількості речовини називають питомою теплоємністю.
Отже, питомою теплоємністю речовини називають кількість теплоти, яку необхідно повідомити або відібрати від одиниці речовини, щоб змінити її температуру на 1 К в даному процесі.
Оскільки надалі розглядатимуться лише питомі теплоємності, то називатимемо питому теплоємність просто теплоємністю.
Кількість газу може бути задана масою, обсягом та числом кіломолей. Слід зазначити, що при заданні газу обсягом цей обсяг призводять до нормальних умов і вимірюють кубічними метрами (нм 3).
Залежно від способу завдання кількості газу розрізняють такі теплоємності:
з - масову теплоємність, Дж/(кг×К);
с¢ - об'ємну теплоємність, Дж/(нм 3 К);
з m - мольну теплоємність, Дж/(кмоль К).
Між названими теплоємностями існують такі залежності:
з = з m/m; з m = с × m;
с¢ = з m/22,4; з m = с¢ × 22,4,
звідси  ; с¢ = с × r н,
; с¢ = с × r н,
де u н і r н - питомий обсяг та щільність за нормальних умов.
Ізохорна та ізобарна теплоємності
Кількість теплоти, що повідомляється робочому тілу, залежить від особливостей термодинамічного процесу. Практичне значення мають два види теплоємності залежно від термодинамічного процесу: ізохорна та ізобарна.
Теплоємність при u = const – ізохорна.
c u - масова ізохорна теплоємність,
c¢ u- об'ємна ізохорна теплоємність,
c m u- мольна ізохорна теплоємність.
Теплоємність при p = const – ізобарна.
c р - масова ізобарна теплоємність,
c¢ р - об'ємна ізобарна теплоємність,
c m р - мольна ізобарна теплоємність.
При однаковій зміні температури в процесі, що здійснюється за p = const, витрачається теплоти більше, ніж у процесі при u = const. Це тим, що з u = const теплота, сообщаемая тілу, витрачається лише зміну його внутрішньої енергії, тоді як із p = const теплота витрачається і збільшення внутрішньої енергії, і скоєння роботи розширення. Різниця між масовою ізобарною та масовою ізохорною теплоємністю за рівнянням Майєра
c р - c u=R. (1.17)
Якщо ліву та праву частини рівняння (1.17) помножити на масу кіломолю m, то отримаємо
c m р - c m u= 8314 Дж/(кмоль×К) (1.18)
У термодинаміці та її додатках велике значення має відношення ізобарних та ізохорних теплоємностей:
 ,
(1.19)
,
(1.19)
де до – показник адіабати.
Розрахунки показують, що приблизно можна прийняти для одноатомних газів до » 1,67, двоатомних до » 1,4, триатомних до » 1,29.
Неважко бачити, що значення дозалежить від температури. Справді, з рівнянь (1.17) та (1.19) випливає, що
 ,
(1.20)
,
(1.20)
а з рівнянь (1.18) та (1.19)
 .
(1.21)
.
(1.21)
Так як зі збільшенням температури газу теплоємності збільшуються, то значення зменшується, наближаючись до одиниці, але завжди залишається більше за неї.
Знаючи величину, можна визначити значення відповідної теплоємності. Так, наприклад, із рівняння (1.20) маємо
 ,
(1.22)
,
(1.22)
а т.к. з р = до × с u, то отримаємо
 .
(1.23)
.
(1.23)
Аналогічно для мольних теплоємностей із рівняння (1.21) отримаємо
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Середня та справжня теплоємність
Теплоємність газів залежить від температури та певною мірою від тиску. Залежність теплоємності від тиску невелика і нею здебільшого нехтують. Залежність теплоємності від температури значна і її необхідно враховувати. Ця залежність досить точно виражається рівнянням
с = а + в t + еt 2 , (1.26)
де а, вта е - величини, постійні для даного газу.
Часто у теплотехнічних розрахунках нелінійну залежність (1.26) замінюють лінійною:
с = а + в t. (1.27)
|
Якщо побудувати графічно залежність теплоємності від температури за рівнянням (1.26), це буде криволінійна залежність (рис.1.4). Як показано на малюнку кожному значення температури відповідає своє значення теплоємності, яке прийнято називати істинною теплоємністю. Математично вираз для справжньої теплоємності запишеться так:
|
|
|
|
Отже, справжня теплоємність є відношення нескінченно малої кількості теплоти dq до нескінченно малої зміни температури dt. Інакше кажучи, справжня теплоємність - це теплоємність газу за даної температурі. На рис. 1.4 справжня теплоємність при температурі t 1 позначена з t1 і зображується відрізком 1-4, при температурі t 2 - з t2 і зображується відрізком 2-3. З рівняння (1.28) отримаємо dq = cdt. (1.29) У практичних розрахунках завжди визначають кількість теплоти при кінцевій зміні |
температури. Очевидно, що кількість теплоти q, яку повідомляють одиниці кількості речовини при нагріванні його від t 1 до t 2 можна знайти, проінтегрувавши (1.29) від t 1 до t 2 .
 .
(1.30)
.
(1.30)
Графічно інтеграл (1.30) виражається площею 4-1-2-3. Якщо вираз (1.30) підставити значення істинної теплоємності по лінійній залежності (1.27), то отримаємо
 (1.31)
(1.31)
де  - Середня теплоємність в інтервалі температур від t1 до t2.
- Середня теплоємність в інтервалі температур від t1 до t2.
 ,
(1.32)
,
(1.32)
Отже, середня теплоємність є відношенням кінцевої кількості теплоти q до кінцевої зміни температури t 2 - t 1:
 .
(1.33)
.
(1.33)
Якщо на підставі 4-3 (рис.1.4) побудувати прямокутник 4-1¢-2¢-3, рівновеликий фігурі 4-1-2-3, то висота цього прямокутника дорівнюватиме середньої теплоємності, де  знаходиться в інтервалі температур t1-t2.
знаходиться в інтервалі температур t1-t2.
Зазвичай значення середніх теплоємностей наводяться у таблицях термодинамічних властивостей речовин. Однак для скорочення обсягу цих таблиць в них наводяться значення середніх теплоємностей, визначених в діапазоні зміни температури від 0 до t про З.
Якщо необхідно обчислити значення середньої теплоємності в заданому інтервалі температур t 1 - t 2 то це можна зробити наступним чином.
Площа 0а14 під кривою з = f(t) (рис.1.4) відповідає кількості теплоти q 1 необхідного для підвищення температури газу від 0 про С до t 1 про С.

Аналогічно площа 0а23 відповідає q 2 при підвищенні температури від 0 до t 2 про З:

Таким чином, q = q 2 - q 1 (площа 4123) може бути представлена у вигляді
![]() (1.34)
(1.34)
Підставляючи значення q (1.34) у вираз (1.33), отримаємо формулу для середньої теплоємності в будь-якому діапазоні температур:
 .
(1.35)
.
(1.35)
Таким чином, середню теплоємність можна обчислити за табличними середніми теплоємностями за рівнянням (1.35). Причому отримаємо нелінійну залежність = f(t). Можна також знайти середню теплоємність за рівнянням (1.32) за лінійною залежністю. Значення а і ву рівнянні (1.32) для різних газів наводяться у літературі.
Кількість теплоти, підведеної або відведеної від робочого тіла, можна розрахувати за будь-яким із рівнянь:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
де 

 - відповідно середня масова, об'ємна та мольна теплоємності; М – маса газу; n – число кіломолей газу; V н - обсяг газу за нормальних умов.
- відповідно середня масова, об'ємна та мольна теплоємності; М – маса газу; n – число кіломолей газу; V н - обсяг газу за нормальних умов.
Об'єм газу V н може бути знайдений в такий спосіб. Записавши рівняння стану для заданих умов: pV = MRT та для нормальних умов: p н V н = MRT н, віднесемо друге рівняння до першого:
 ,
,
звідси  .
(1.39)
.
(1.39)
Теплоємність газових сумішей
Теплоємність газової суміші може бути обчислена, якщо заданий склад суміші і відомі теплоємності компонентів, що входять до суміші.
Для нагрівання суміші масою М см на 1К необхідно температуру кожного компонента також підвищити на 1К. При цьому на нагрівання i-го компонента суміші масою М i витрачається кількість теплоти, що дорівнює c i M i . Для всієї суміші кількість теплоти  ,
,
де c i та c см - масові теплоємності i-го компонента та суміші.
Поділивши останній вираз на М см, отримаємо розрахункову формулу для масової теплоємності суміші:
 ,
(1.40)
,
(1.40)
де mi - масова частка i-го компонента.
Розмірковуючи аналогічно, знайдемо об'ємну c¢ см та мольну c m см теплоємності суміші:
 (1.41)
(1.41)
де c¢ i - об'ємна теплоємність i-го компонента, r i - об'ємна частка i-го компонента,
 ,
(1.42)
,
(1.42)
де c mi - мольна теплоємність i-го компонента,
r i - мольна (об'ємна) частка i-го компонента.
У теплових двигунах (машинах) робочим тілом є суміші різних газів. Якщо компоненти суміші не вступають у хімічні реакції між собою, і кожен компонент підпорядковується рівнянню стану Клайперону, така суміш розглядається як ідеальний газ.
Для розрахунку суміші необхідно визначити μ см - середньомолярну масу та R c м -питому газову постійну суміші. Для їх визначення необхідно знати склад суміші, тобто які компоненти і в яких кількостях утворюють цю суміш, які параметри має кожен компонент, що входить в суміш.
Кожен компонент суміші поводиться так, як якби в суміші не було інших газів, займає весь наявний об'єм, в якому знаходиться суміш, слід свого рівняння стану і надає на стінки свій так званий парціальний тиск, при цьому температура всіх компонентів суміші однакова і дорівнює температурі суміші.
За законом Дальтона тиск суміші Р дорівнює сумі парціальних тисків окремих компонентів, що входять до суміші:
де n-число компонентів суміші.
За законом Амага - обсяг суміші V дорівнює сумі парціальних обсягів окремих компонентів, що входять в суміш при температурі та під тиском суміші:
 , (1.21)
, (1.21)
де - парціальний обсяг, м 3; V-об'єм суміші, м 3
Склад суміші задають об'ємними (молярними) чи масовими частками.
Об'ємна частка i-го компонента- це відношення парціального обсягу компонента до обсягу суміші, тобто тоді сума об'ємних часток компонентів суміші дорівнює 1, тобто. Якщо значення задані у %, їх сума = 100%.
Молярна частка i-го компонента n i– це відношення числа кіломолей компонента N i до кіломолей суміші N, тобто де ![]() , , тобто число кіломолів кожного компонента і суміші в цілому дорівнює відношенню відповідного на об'єм, що займає один кіломоль компонента і суміші в цілому .
, , тобто число кіломолів кожного компонента і суміші в цілому дорівнює відношенню відповідного на об'єм, що займає один кіломоль компонента і суміші в цілому .
Враховуючи, що ідеальний газ за однакових умов має однаковий об'єм кіломолю, то після підстановки отримуємо: , тобто для ідеальних газів молярні та об'ємні частки чисельно рівні.
Масова частка i-го компонента- це відношення маси компонента до маси суміші: , Звідси випливає, що маса суміші дорівнює сумі мас компонентів, а так само сума масових часток компонентів дорівнює 1 (або 100%).
Перерахунок об'ємних часток у масові та назад проводиться на основі наступних співвідношень:
![]() ,
,
де ρ = μ/22,4 кг/м 3 .
Звідки випливає, що масова частка i-го компонента визначиться із співвідношення:
 ,
,
де - щільність суміші, кг/м 3 - об'ємна частка i-го компонента.
Надалі можна визначити через об'ємні частки.
 .
.
густинасуміші для об'ємних часток визначається із співвідношення
 , звідки
, звідки  , (1.22)
, (1.22)
 .
.
Парціальний тиск визначається за формулами:
![]() або
або  (1.23)
(1.23)
Рівняння стану компонентів та суміші в цілому мають вигляд:
![]() ;
;
![]() ,
,
звідки після перетворень отримуємо для масовихчасткою
 ,
,  . (1.24)
. (1.24)
Щільність та питомий об'єм суміші для масовихчасткою:
;  . (1.25)
. (1.25)
Для розрахунку парціальних тисків використовується формула:
 . (1.26)
. (1.26)
Перерахунок масових часток в об'ємні виконується за формулою:
 .
.
При визначенні теплоємності суміші газів виходять із положення про те, що для нагрівання (охолодження) газової суміші необхідно нагріти (охолодити) кожен із компонентів суміші
де Q i = M i c i ∆t – теплота, витрачена зміну температури i-го компонента суміші, з i – масова теплоємність i-го компонента суміші.
Теплоємність суміші визначається із співвідношення (якщо суміш задана масовими частками)
 , аналогічно
, аналогічно  . (1.28)
. (1.28)
Молярна та об'ємна теплоємності для суміші заданої об'ємними частками визначаються
 ;
;  ;
;
 ;
; 
приклад 1.5Сухе повітря масою складається з g О2 =23,3% кисню і g N 2 =76,6% азоту. Визначити склад повітря за обсягом (r О2 та r N 2) та газову постійну суміші.
Рішення.
1. З табл.1 знаходимо кг/кмоль та кг/кмоль
2. Визначаємо об'ємні частки кисню та азоту:
1. Газова постійна повітря (суміші) визначиться за такою формулою:
 , Дж/кг К
, Дж/кг К
Приклад 1.6. Визначити кількість теплоти необхідне нагрівання газової суміші масою М=2 кг при Р=const, що перебуває у % за масою: , , , , за зміни температури від t 1 =900 про З до t 2 =1200 про З.
Рішення:
1. Визначаємо середню масову теплоємність компонентів, що становлять газову суміш при Р=const і t 1 =900 про (з П2):
1,0258 кДж/кг·К; =1,1045 кДж/кг·К;
1,1078 кДж/кг·К; =2,1097 кДж/кг·К;
2. Визначаємо середню масову теплоємність компонентів, що становлять газову суміш при Р=const і t 1 =1200 про (з П2):
1,0509 кДж/кг·К; =1,153 кДж/кг·К;
1,1359 кДж/кг·К; =2,2106 кДж/кг·К;
3. Визначаємо середню масову теплоємність суміші для інтервалу температур: t 2 =1200 про З та t 1 =900 про З:
4. Кількість теплоти для нагрівання 2 кг суміші при Р=const:
Перший закон термодинамікивстановлює кількісний зв'язок між зміною внутрішньої енергії системи та механічною роботою, що здійснюється проти сил зовнішнього тиску навколишнього середовища в результаті підведення теплоти до робочого тіла.
Для закритої термодинамічної системи рівняння першого закону має вигляд
Теплота, що повідомляється робочому тілу (або системі) йде на збільшення її внутрішньої енергії (dU), внаслідок підвищення температури тіла, і на здійснення зовнішньої роботи (dL), внаслідок розширення робочого тіла та збільшення його об'єму.
Перший закон може бути записаний у вигляді dH = dq + VdP = dq-dL 0
де dL 0 = VdP - елементарна робота зміни тиску називається корисною зовнішньою (технічною) роботою.
dU – зміна внутрішньої енергії робочого тіла (системи), що включає енергію теплового руху молекул (поступальний, обертальний і коливальний) і потенційну енергію взаємодії молекул.
Оскільки перехід системи з одного стану в інший відбувається в результаті підведення теплоти, тому робоче тіло нагрівається і його температура підвищується на dT і збільшується обсяг на dV.
Підвищення температури тіла викликає збільшення кінетичної енергії частинок, а збільшення обсягу тіла призводить до зміни потенційної енергії частинок. В результаті внутрішня енергія тіла збільшується на dU, тому внутрішня енергія U є функція стану тіла і може бути представлена у вигляді двох незалежних параметрів U=f 1 (P,V); U = f 2 (P, T), U = f 3 (?, T). Зміна внутрішньої енергії термодинамическом процесі визначається лише початковим (U 1) і кінцевим (U 2) станом тобто.
У диференціальному вигляді зміна внутрішньої енергії запишеться
а) у функції від питомого об'єму та температури

б) функції від температури, т.к. , то
Для практичних розрахунків, у яких необхідно врахувати зміну З від температури, є емпіричні формули і таблиці питомої внутрішньої енергії (часто молярної). Для ідеальних газів молярна внутрішня енергія суміші U м визначається за формулою
 , Дж/кмоль
, Дж/кмоль
Для суміші заданої масовими частками. Таким чином внутрішня енергіяє властивість системи та характеризує стан системи.
Ентальпія– теплова функція стану, введена Камерлінг-Оннесом (лауреат Нобелівської премії, 1913 р.), що є сумою внутрішньої енергії, системи U і добуток тиску системи P на її обсяг V.
Оскільки входять до неї величини є функціями стану, тому H також функція стану т. е. Н=f 1 (P,V); H = f 2 (V, T); H = f 3 (P, T).
Зміна ентальпії dH у будь-якому термодинамічному процесі визначається початковим H 1 і кінцевим H 2 станом і не залежить від характеру процесу. Якщо система містить 1 кг речовини, застосовується питома ентальпія , Дж/кг.
Для ідеального газу диференціальне рівняння має вигляд
відповідно питома ентальпія визначається за формулою
Рівняння першого закону термодинаміки dq=dU+Pdυ, коли єдиним видом роботи є робота розширення Pdυ=d(Pυ)- υdP, тоді dq=d(U+Pυ)-υdP, звідки
Практична робота№ 2
Тема: Теплоємність, ентальпія, суміші ідеальних газів, внутрішня енергія, робота, термодинамічні процеси.
Мета роботи: Закріплення знань, здобутих при теоретичному навчанні, набуття навичок у здійсненні теплотехнічних розрахунків.
I.Основні визначення, формули та рівняння
1. Суміші ідеальних газів
Газовою сумішшю називається механічна суміш кількох газів, що хімічно не взаємодіють між собою. Кожен із газів, що входять у суміш, називається газовим компонентом; поводиться так, ніби інших газів у суміші не було, тобто. рівномірно розподіляється по всьому об'єму суміші. Тиск, який чинить кожен газ суміші на стінки судини, називається парціальним. Основним законом для сумішей ідеальних газів є закон Дальтона, згідно з яким тиск суміші дорівнює сумі парціальних тисків газів, що утворюють суміш:
2. Внутрішня енергія
Внутрішня енергія тіла є сукупністю кінетичної енергії руху мікрочастинок, що становлять тіло, і потенційної енергії їх. взаємодії, що визначається. силами взаємного тяжіння чи відштовхування. Абсолютну величину внутрішньої енергії визначити неможливо, у термодинамічних розрахунках вичіслюється не абсолютна величина внутрішньої енергії, та її зміна, тобто.
![]() або
або ![]()
де U 1 і U 2 - внутрішня енергія початкового та кінцевого стану робочого тіла (газу);
u 1 і 2 - уд. внутрішня енергія початкового та кінцевого стану робочого тіла.
Звідси випливає, що зміна внутрішньої енергії не залежить від характеру та шляху процесу, а визначається станом робочого тіла на початку та наприкінці процесу зміни.
Особливістю ідеального газу є відсутність у ньому сил молекулярних взаємодій, отже і відсутність внутрішньої потенційної енергії, тобто. U n =0 і = 0. Отже, внутрішня енергія ідеального газу:
U = U k = f (T) unu = f (T).
З.Робота газу.
У термодинаміці всяка зміна стану робочого тіла в результаті обміну енергією з довкіллямназивається процесом. При цьому змінюються основні параметри робочого тіла:
Перетворення теплоти на механічну роботу пов'язані з процесом зміни стану робочого тіла. Процеси зміни стану газу можуть бути процесами розширення та стиснення. Для довільної маси газу М (кг) робота дорівнює:
L = М l = Мр (v 2 - v 1) = , Дж
де l = р (v2-v1) Дж/кг - робота 1 кг газу або питома робота.
4. Ентальпія газу,
Ентальпія - це параметр, що характеризує потенційну енергію зв'язку робочого тіла (газу) з довкіллям. Ентальпія та питома ентальпія:
I = U + pV, Дж та i i = і +pv, Дж/кг.
5. Теплоємність.
Питомою теплоємністю називається кількість тепла, яке потрібно підвести до 1 кг газу, щоб нагріти його на 1°С у цьому інтервалі температур.
Питома теплоємність буває масовою, об'ємною та кіломольною. Між масовою С, об'ємною C та киломольною З теплоємностями існує зв'язок:
 ;
; 
де Vo 22,4 м-коду 3 /кмоль - уд. обсяг газу за нормальних умов.
Масова уд. теплоємність газової суміші:

Об'ємна питома теплоємністьгазової суміші:

Кіломольна питома теплоємність газової суміші:

6.Рівняння для визначення кількості тепла
Кількість тепла, що віддається або сприймається робочим тілом (газом), можна визначити за рівнянням:
Q = M C m (t 2 -t 1), Дж або Q = VC (t-t), Дж, де М і V - вагова або об'ємна кількість газу, кг або м 3;
t u t - температура газу в кінці та на початку процесу ° С;
С і С - масова та об'ємна середня уд. теплоємність газу
При t cp = Дж/кгК або Дж/м3К
7. Перший закон термодинаміки
Цей закон розглядає взаємоперетворення тепла та механічної роботи. За цим законом тепло перетворюється на механічну роботу і навпаки, механічна робота на тепло в строго еквівалентних кількостях. Рівняння еквівалентності тепла та роботи має вигляд:
З урахуванням принципу еквівалентності тепла та роботи, рівняння теплового балансу для довільної маси газу:
Q = U + L і q = + l = u -u + l
Розв'язання задачII
Завдання №1 (№1)
Атмосферне сухе повітря має такий зразковий масовий склад: g 02 =23,2%, g N 2 =76,8%.
Визначити об'ємний склад повітря, його газову постійну, здається молекулярну масу, парціальний тиск кисню та азоту, якщо повітря барометром Р=101325 Па.
Визначаю об'ємний склад повітря:
 ;
; ;
;
де r – масова частка;
m – відносна молекулярна маса;
g – об'ємна частка.
m пов. = m O2 r O2 + m N2 r N2 = 32 · 0,209 + 28 · 0,7908 = 6,688 +22,14 = 28,83;

 ;
;
де R 0 - Постійна газова.
Визначаю парціальний тиск різних газів:
P O 2 = P см · r О2 = 101325 · 0,209 = 21176,9 (Па);
P N 2 = P см · r N 2 = 101325 · 0,7908 = 80127,81 (Па);
де P O 2 P N 2 - парціальний тиск;
P см – тиск суміші.
Завдання №2 (№2)
Посудина розділена перегородкою на 2 частини, обсяги яких V 1 =1,5 м 3 і V 2 =1,0 м 3 . У першій частині обсягом V 1 міститься 2 при Р 1 =0,5 Мпа і t 1 =30°С; у другій частині об'ємом V 2 міститься Про 2 при Р 2 =0,2 МПа та t 2 =57°С. Визначити масові і об'ємні частки СО 2 і О 2 молекулярну масу суміші, що здається, і її газову постійну після того, як перегородка буде прибрана і процес змішування закінчиться.
Визначаю індивідуальні газові постійні:
Для цього визначаю відносну молекулярну масу: m(2) =32+12=44; m(Про 2)=32;

 ;
;
![]()
 ;
;
Відповідно до характеристичного рівняння Клайперона, визначаю маси газів:
 (Кг);
(Кг);
 (Кг);
(Кг);
Визначаю масові частки:


Визначаю об'ємні частки:


Визначаю уявну молекулярну масу повітря:
m пов. = m О2 r O 2 +m СО2 r СО2 = 32 · 0,21 + 44 · 0,79 = 6,72 +34,74 = 41,48;
Визначаю індивідуальну газову постійну для повітря (R):

 ;
;
Завдання №3 (№6)
У посудині об'ємом 300л знаходиться кисень при тиску Р 1 =0,2 МПа та t 1 =20 0 С. Яку кількість теплоти потрібно підвести, щоб температура кисню підвищилася до t 2 =300 0 С? Який тиск установиться при цьому в посудині? Для розрахунку прийняти середню об'ємну питому теплоємність кисню за н.у. З 02 = 0,935 
За законом Шарля визначаю кінцевий тиск процесу:
;  (Па);
(Па);
де Р, Т - Параметри газу.
Визначаю індивідуальну газову постійну для кисню (R):

 ;
;
Оскільки процес ізохорний то визначаю кількість теплоти, яку потрібно підвести за відповідною формулою: Q v =M·С cv ·(T 2 -T 1) для цього згідно з характерним рівнянням Клайперону, визначаю масу газу
 (Кг); Q v = M · З cv · (T 2 -T 1) = 1,27 · 935 · 280 = 332486 (Дж).
(Кг); Q v = M · З cv · (T 2 -T 1) = 1,27 · 935 · 280 = 332486 (Дж).
Завдання №4 (№7)
Яку кількість теплоти необхідно витратити, щоб нагріти 2м 3 повітря при постійному надлишковому тиску Р хат. =0,2 МПа від температури 100 0 С до температури 500 0 С. Яку роботу при цьому здійснить повітря? Для розрахунку прийняти: тиск атмосфери Рат. =0,1 Мпа, середню масову ізобарну теплоємність повітря pm =1,022  ; газову постійну розрахувати маючи на увазі, що здається молекулярна маса повітря М пов. =29.
; газову постійну розрахувати маючи на увазі, що здається молекулярна маса повітря М пов. =29.
Визначаю індивідуальну газову постійну для повітря:

 ;
;
Абсолютний тиск дорівнює сумі надлишкового та атмосферного Р=Р хат. +Р ат. =0,1+0,2=0,3 МПа
 (Кг);
(Кг);
Так як процес ізобарний визначаю Q і L за відповідними формулами:
згідно із законом Гей-Люссака визначаю кінцевий обсяг:
 м 3;
м 3;
Q = M · C pm · (T 2 -T 1) = 5,56 · 1022 · 400 = 2272928 (Дж);
L = P · (V 2 -V 1) = 300000 · 2,15 = 645000 (Дж).
Завдання №5 (№8)
У циліндрі знаходиться повітря при тиску Р = 0,5 МПа і температурі t 1 = 400 0 C. Від повітря віднімається теплота при Р = const так, що в кінці процесу встановлюється температура t 2 = 0 0 C. Об'єм циліндра, в якому знаходиться повітря V 1 = 400л.
Визначити кількість відібраної теплоти, кінцевий об'єм, зміну внутрішньої енергії та досконалу роботу стиснення C pm =1,028  .
.
Оскільки процес ізобарний, то за законом Гей-Люссака визначаю кінцевий обсяг:
 м 3;
м 3;
Відповідно до характеристичного рівняння Клайперона, визначаю масу газу:
Із попередньої задачі R=286,7 
 (Кг);
(Кг);
Визначаю кількість теплоти, що виділяється:
Q = M · C pm · (T 2 -T 1) = 1,03 · 1028 · (273-673) = -423536 (Дж);
Визначаю кількість витраченої роботи:
L = P · (V 2 -V 1) = 500000 · (0,16-0,4) = -120000 (Дж);
З рівняння, за яким визначається повна кількість, визначаю зміну кількості внутрішньої енергії:
![]() ; (Дж)
; (Дж)
Завдання №6 (№9)
Повітря, що має об'єм V 1 =0,02 м3 при тиску Р 1 =1,1 МПа і t 1 =25с розширюється в циліндрі з рухомим поршнем до тиску Р 2 =0,11 МПа. Знайти кінцевий об'єм V 2 кінцеву температуру t 2 роботу, зроблену повітрям, і підведену теплоту, якщо розширення в циліндрі відбувається:
а) ізотермічно
б) адіабатно з показником адіабати к=1,4
в) політропно з показником політропи n=1,3
Ізотермічний процес:
P 1 / P 2 = V 2 / V 1
V 2 = 0,02 · 1,1 / 0,11 = 0,2 M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1·10 6 ·0,02Ln(0,2/0,02)=22000Дж
Адіабатний процес:
V 1 /V 2 =(P 2 /P 1) 1/k
V 2 = V 1 / (P 2 / P 1) 1 / k = 0,02 / (0,11 / 1,1) 1 / 1,4 = 0,1036M 3
T 2 /T 1 =(P 2 /P 1) k-1/k
T 2 = (P 2 / P 1) k-1/k · T 1 = (0,11/1,1) 1,4-1/1,4 · 298 = 20,32k
З v =727,4Дж/кг·k
L=1/k-1(P 1 V 1 -P 2 V 2) =(1/1,4-1)· (1,1·10 6 ·0,02 -0,11·10 6 ·0, 1) = 2,0275 · 10 6 Дж
Політропний процес:
V 1 /V 2 =(P 2 /P 1) 1/n
V 2 =V 1 /(P 2 /P 1) 1/n =0,02/(0,11/1,1) 1/1,3 =0,118M 3
T 2 /T 1 =(P 2 /P 1) n-1/n
T 2 = (P 2 / P 1) n-1/n · T 1 = (0,11/1,1) 1,3-1/1,3 · 298 = 175k
L= 1/n-1(P 1 V 1 -P 2 V 2)= (1/(1,3-1))· (1,1·10 6 ·0,02 -0,11·10 6 · 0,118) = 30000Дж
Q=(k-n/k-1)·l·M=((1,4-1,3)/(1,4-1))·30000=7500Дж
Література:
1. "Енергія", Москва, 1975.
2. Литвин О.М. "Теоретичні основи теплотехніки", видавництво "Енергія", Москва,1969.
3. Тугунов П.І., Самсонов А.А., «Основи теплотехніки, теплові двигуни та паросилове господарство», видавництво «Надра», Москва, 1970.
4. Крутов В.І., "Теплотехніка", видавництво "Машинобудування", Москва, 1986.
Газові суміші. Теплоємність газів
Під газовими сумішами розуміють механічну суміш кількох газів, що хімічно між собою не взаємодіють. Суміш ідеальних газів підпорядковується всім законам, які стосуються ідеальним газам. Склад газової суміші визначається кількістю кожного з газів, що входять до суміші, і може бути заданий масовими або об'ємними частками:
де - маса -ого компонента, - обсяг -ого компонента, а -маса і обсяг всієї суміші відповідно.
Очевидно, що
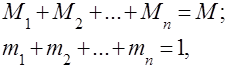
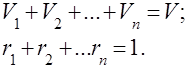
Для зручності розв'язання практичних завдань із сумішами газів введено поняття про молекулярну масу суміші газів, яка представляє собою середню масу з дійсних молекулярних мас окремих компонентів суміші.
Рівняння стану суміші газів має вигляд:
На суміші газів поширюється поняття універсальної газової постійної
Зв'язок між тиском газової суміші та парціальним тиском окремих компонентів, що входять до суміші, встановлюється законом Дальтона:
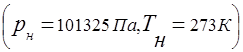
1 газу має різну масу в залежності від тиску та температури. У зв'язку з цим об'ємну теплоємність завжди відносять до маси газу, укладеної в 1 за нормальних умов. При цьому обсяг 1 кмоль різних газів дорівнює 22,4 /кмоль, а універсальна газова постійна - . Залежно від способу підведення тепла до газу розрізняють ізобарну та ізохорну теплоємності. Відношення цих величин носить назву показника адіабати
Теплоємності та пов'язані також співвідношенням Майєра
Кількість теплоти, яку необхідно витратити в процесі нагрівання 1 кг газу в інтервалі температур від до, визначається за формулою:
де - відповідно середні теплоємності в межах 0° - і 0° - .
Якщо у процесі беруть участь (кг) або () газу, то
Теплоємність газової суміші слід визначати за формулами:
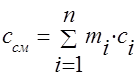
масова -;
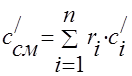
об'ємна -;
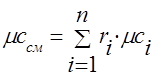
мольна - .
Для використання теплоти газів, що є продуктами згоряння палива в котельному агрегаті, в газоходах останніх встановлюються повітропідігрівачі повітря, необхідного для горіння палива (рис.1). Гази, що йдуть з котла, надходять до повітропідігрівача з температурою і охолоджуються, віддаючи теплоту повітрі, до. У газоході котельного агрегату під впливом роботи димососа встановлюється тиск дещо нижчий за атмосферний. Повітря в повітропідігрівачі нагрівається від температури до температури.
Димові гази
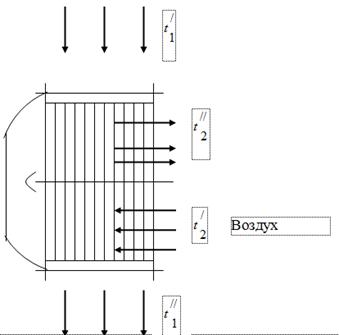
При випробуванні котельного агрегату було отримано такі дані:
Температура газів при вході в повітропідігрівач, = 450 °С.
Температура газів при виході з підігрівача повітря, = 150° С.
Температура повітря при вході в повітропідігрівач, = 26°С.
Температура повітря при виході з повітропідігрівача, = 260°С.
Об'ємний склад димових газів - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Годинна витрата газів становить 50 ·/год.
Розрядження в газоході – 15 мм вод. ст.
Барометричний тиск 760 мм рт. ст.
Визначити:
здається молекулярна вага димових газів;
газову постійну димових газів;
вагові (масові) частки окремих компонентів, що входять до складу димових газів;
парціальний тиск компонентів:
годинна витрата повітря.
Прийняти, що це тепло, віддане газом, сприйнято повітрям.
Залежність теплоємності від температури вважати криволінійною.
1. Здається молекулярна вага димових газів
0,115 · 44 + 0,065 · 18 + 0,172 · 32 + 0,648 · 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Газова постійна димових газів
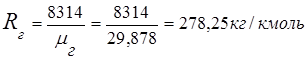
3. Масові часткикомпонентів газів
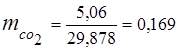
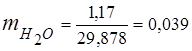
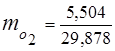
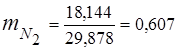
4. Парціальний тиск компонентів
Результати розрахунку занесемо до таблиці
|
Параметри |
Газова суміш |
|||
|
|
||||
|
|
||||
|
|
5. Годинна витрата повітря
Витрата повітря визначаємо з рівняння теплового балансу повітропідігрівача
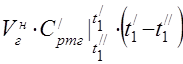
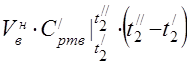
середня молярна теплоємність при 450°С
Середня питома теплоємність компонентів при інтервалі температур 0 ... 450 ° С.













 .
(1.28)
.
(1.28)