Método para determinar a capacidade calorífica de um corpo sólido
O que é CAPACIDADE DE CALOR
Quando o calor é fornecido, a temperatura do sistema aumenta. No caso de uma mudança infinitamente pequena na temperatura, a proporcionalidade é válida
dT=δQ, ou dT=constδQ
É mais conveniente escrever esta relação na forma: δQ=СdT ou
O valor C é chamado de capacidade calorífica real do sistema.
A capacidade calorífica é a razão entre a quantidade de calor fornecida ao sistema e a mudança de temperatura que ocorre neste caso.
Além do verdadeiro, há também uma capacidade calorífica média:
Capacidade de calor
Se a capacidade calorífica for atribuída a uma unidade de massa (mol) de uma substância, ela se tornará independente da massa de todo o sistema e adquirirá as propriedades de um parâmetro intensivo. Se a capacidade calorífica se refere a uma unidade de massa de uma substância, ela é chamada específica e a 1 mol - capacidade calorífica com a dimensão de J / (mol * k)
Consideraremos apenas as capacidades caloríficas molares, uma vez que para eles, todas as regularidades são muito mais simples do que para a capacidade calorífica específica.
A capacidade calorífica depende das condições em que ocorre a transferência de calor para o sistema. Se o sistema estiver contido em um volume constante, então ocorrerá um aumento de temperatura de dT sob a ação de calor igual a CvdT, onde Cv é a capacidade calorífica a volume constante. Em casos de pressão constante durante a expansão do sistema, para aumentar a temperatura em dT, é necessário calor CpdT, onde Cp é a capacidade calorífica a pressão constante.
Dadas as condições para a transferência de calor, quando uma ou mais variáveis são mantidas constantes, enquanto outras mudam, a capacidade calorífica pode ser expressa usando derivadas parciais: ![]() . Como δQ v = dU,
. Como δQ v = dU,
δQ p = dH, podemos escrever:
![]() (1)
(1)
Cv é a capacidade calorífica isocórica dos gases, Cp é a capacidade calorífica isobárica dos gases.
As diferenças entre as capacidades térmicas isocóricas e isobáricas são devidas à diferença de energia interna e entalpia. As mudanças na entalpia e na energia interna diferem pela quantidade de trabalho realizado pelo sistema.
δW=∆nRT, ∆H-∆U=∆nRT
Portanto, as capacidades caloríficas a volume constante Cv e pressão constante Cp também diferem pela quantidade de trabalho: Cp - Cv = δW
Com base nas expressões (1), podemos escrever:
Substituindo essas igualdades na equação ∆H- ∆U=∆nRT
e levando em conta que ∆n= 1, encontraremos a relação entre as capacidades caloríficas molares dos gases:
Cp– Cv= R ou Cp= Cv+ R
Como pode ser visto, eles diferem pelo valor da constante do gás.
Da condição Cp= Cv+ R segue que Cp˃Cv, ou seja, em um processo isobárico, quando P=const, para aumentar a temperatura do sistema, é necessário grande quantidade calor do que em um processo isocórico.
A capacidade calorífica molar dos gases tem valores da ordem de R, então a diferença entre Cp e Cv é muito significativa. Assim, para dióxido de carbono CO 2 a 25 0 C Cp = 37, 14; e Cv = 28,83 J / (mol * K)
A diferença Cp - Cv é o trabalho da expansão isobárica de um mol gás ideal quando a temperatura aumenta um grau. Líquidos e sólidos do corpo são caracterizados por um ligeiro aumento de volume quando aquecidos. Portanto, para corpos condensados, podemos supor que Ср ≈ Сv.
EQUAÇÃO DE KIRCHOFF. DEPENDÊNCIA DOS EFEITOS TÉRMICOS DA TEMPERATURA.
Os cálculos previamente considerados de efeitos térmicos baseados na lei de Hess para o calor de formação e combustão são limitados por condições padrão. Para fins práticos, é necessário calcular os efeitos térmicos para condições específicas diferentes das padrão.
Vá de efeitos térmicos conhecidos sob condições padrão, ou seja, a uma temperatura de 25 0 C (298,15 K) e uma pressão de 1 atm. (1,013 * 10 5 Pa), é possível calcular os efeitos térmicos em qualquer temperatura de nosso interesse usando Lei de Kirchhoff. Os processos em condições industriais são caracterizados por uma variação significativa de temperatura, cuja faixa é determinada não apenas pelas condições da tecnologia, mas também pela estação do ano. Essa faixa pode chegar a centenas de graus - naturalmente, os efeitos térmicos serão significativamente diferentes e dependem da temperatura.
Considere a lei de Kirchhoff na forma diferencial. Para fazer isso, anotamos as mudanças de entalpia em energia isobárica e interna em processos isocóricos.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
Diferencie essas equações em relação à temperatura e obtenha:
Equações de Kirchhoff:

E - coeficientes de temperatura do efeito térmico de processos isobáricos e isocóricos, respectivamente; e - alteração na capacidade calorífica do sistema como resultado de processos isobáricos e isocóricos, respectivamente.
Com base na equação de Kirchhoff, a lei de Kirchhoff é formulada na forma diferencial: o coeficiente de temperatura do efeito térmico do processo é igual à mudança na capacidade calorífica do sistema que ocorre como resultado desse processo.
Assim, a lei de Kirchhoff na forma diferencial permite determinar apenas a variação do efeito térmico com a temperatura, e não a magnitude do efeito térmico em si.
Analisemos a equação de Kirchhoff
Para a reação: aA + bB = dD + rR em um processo isobárico (р=const), de acordo com a lei de Kirchhoff, a mudança na capacidade calorífica do sistema terá a forma:
Uma expressão semelhante pode ser obtida para um processo isocórico:
Como a lei de Kirchhoff permite determinar as mudanças no efeito térmico do processo com uma mudança na temperatura, construímos um gráfico:
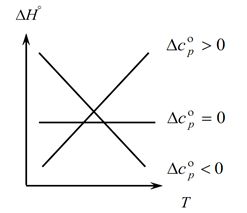
1. Considere o primeiro caso, quando ∆Ср(∆Сv)˃0, porque ∆Ср=∑С con. -∑С inicial, daí segue-se que a soma das capacidades caloríficas dos produtos da reação é maior que a soma das capacidades caloríficas das substâncias iniciais: ∑С con. ˃∑ Desde o início Neste caso, obtemos a curva 1 no gráfico, o que significa que à medida que a temperatura aumenta, a mudança no efeito térmico do processo também aumenta (T e ∆H);
2. O segundo caso, quando ∆Ср(∆Сv)˂0. Da mesma forma que a primeira lei, temos ∑С con. ˂∑ Desde cedo (a soma das capacidades caloríficas dos produtos finais é menor que a soma das capacidades caloríficas das substâncias iniciais). Então obtemos uma curva no gráfico, o que significa que com o aumento da temperatura, a mudança no efeito térmico do processo diminui (Т→∆H↓)
3. E o terceiro caso, quando a variação das capacidades caloríficas do sistema é igual a zero ∆Ср(∆Сv)=0. Então a soma das capacidades caloríficas dos produtos finais das reações é igual à soma das capacidades caloríficas dos materiais de partida ∑С con. \u003d ∑ Desde o início. Neste caso, o efeito térmico da reação não é função da temperatura (∆H ≠ f(T)) e obtemos uma linha reta no gráfico.
CÁLCULO DOS EFEITOS TÉRMICOS PARA UM DETERMINADO
TEMPERATURA. INTEGRAÇÃO DA EQUAÇÃO DE KIRCHHOFF
Para encontrar o valor do efeito térmico em função da temperatura, é necessário integrar as equações

De T a T 0 (onde T é a temperatura necessária, T 0 é a temperatura padrão), de ∆H a ∆H 0 ou de ∆U a ∆U 0 (onde ∆H e ∆U são a entalpia e a energia interna sob condições que diferem do padrão). A integração é realizada para dois casos:
Por não matéria orgânica: Para substâncias orgânicas:
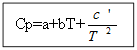
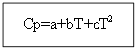
Exemplo: para H 2 (g) - substância inorgânica
| Ср=f(T) | T | |||
| uma | b*10 3 | c'*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27,28 + 3,26 * 10 -3 T +.
a) Integração aproximada:
para processo isobárico
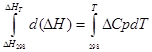
∆H T - ∆H 298 =∆Cp*(T-298)
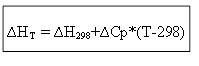
para o processo isocórico:
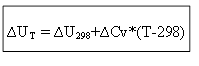
Assim, para determinar o efeito térmico ∆H ou energia interna ∆U em qualquer temperatura T, é necessário conhecer o calor do processo sob condições padrão ∆H 0 (∆U 0) e a variação nas capacidades caloríficas ∆Ср, ∆ Cv.
Exemplo. Calcule o efeito térmico ∆H do processo de obtenção do benzeno a partir do acetileno:
3C 2 H 2 (g) → C 6 H 6 (g) a 75 0 C (348K).
1. Encontramos nas tabelas as capacidades térmicas isobáricas molares médias do benzeno e do acetileno:
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. Encontramos a mudança na capacidade calorífica do processo:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) inicial \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81,67 - 3 * 43,93 \u003d - 50,12 J / (mol * K) .
3. De acordo com os dados tabulares, encontramos o efeito térmico em condições padrão:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Encontre o efeito térmico a uma determinada temperatura:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348-298) = -599766 J / mol
b) Integração exata:
Consideremos o segundo caso, mais complicado, quando a mudança na capacidade calorífica depende da temperatura, ou seja, Ср=f(T), Cv=f(T).
Vamos nos voltar para a equação da reação na forma geral
dD + rR = qQ + pP
| uma | b*10 3 | c'*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c'= q*c'(Q) + p*c'(P) - ;
![]()
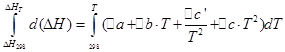
Vamos realizar as mesmas operações para o processo isocórico:
CALOR DE DISSOLUÇÃO
A mudança na entalpia durante a transição de uma substância sólida, líquida ou gasosa para uma solução é chamada de térmica ou entalpia de dissolução.
O calor de dissolução geralmente inclui o calor de destruição da rede cristalina (por sólidos), ionização e solvatação.
Para quebrar a ligação entre os íons de um sal cristalino, é necessária energia, ou seja, enquanto o calor é absorvido. Ao mesmo tempo, a hidratação dos íons ocorre na solução aquosa; uma ligação é formada entre íons e moléculas de H 2 O. O sinal do calor de dissolução é determinado pelo processo que é energeticamente mais pronunciado.
LiBr: ∆H dist = - 49,02 kJ / mol - calor é liberado
KCl: ∆H dist = 7,23 kJ/mol - o calor é absorvido
Distinguir: o calor integral de dissolução é o calor que é liberado ou absorvido quando 1 mol de uma dada substância é dissolvido para formar uma solução de uma dada concentração. O calor de dissolução integral varia dependendo da quantidade da substância dissolvida.
Distinguir: calor diferencial de dissolução - este é o calor que acompanha a dissolução de 1 mol de uma dada substância em infinitas grande volume solução desta substância. Os calores integrais são amplamente utilizados no cálculo dos calores de formação e de outras reações de acordo com a lei de Hess. Os calores diferenciais de dissolução caracterizam as propriedades termodinâmicas das soluções e o processo de sua formação.
LABORATÓRIO Nº 8
DETERMINAÇÃO DA CAPACIDADE DE CALOR DE CORPOS SÓLIDOS
Instrumentos e acessórios: configuração experimental FPT1-8.
Objetivo: determinação da capacidade calorífica de amostras metálicas pelo método calorimétrico utilizando aquecimento elétrico.
Breve teoria
Capacidade calorífica específica de uma substância - um valor igual à quantidade de calor necessária para aquecer 1 kg de uma substância em 1 K:
Capacidade de calor molar - um valor igual à quantidade de calor necessária para aquecer 1 mol de uma substância por 1 K:
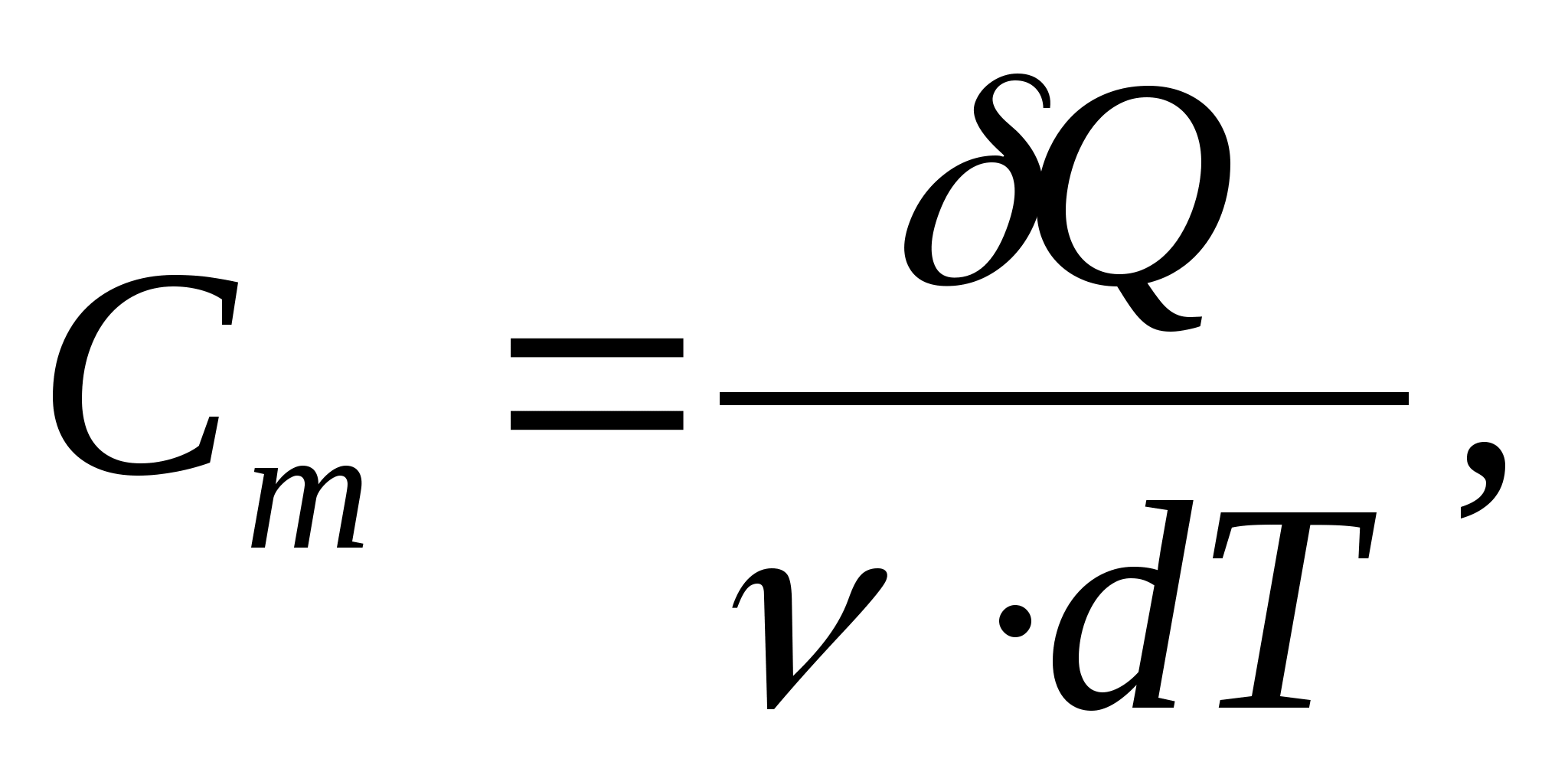
Onde 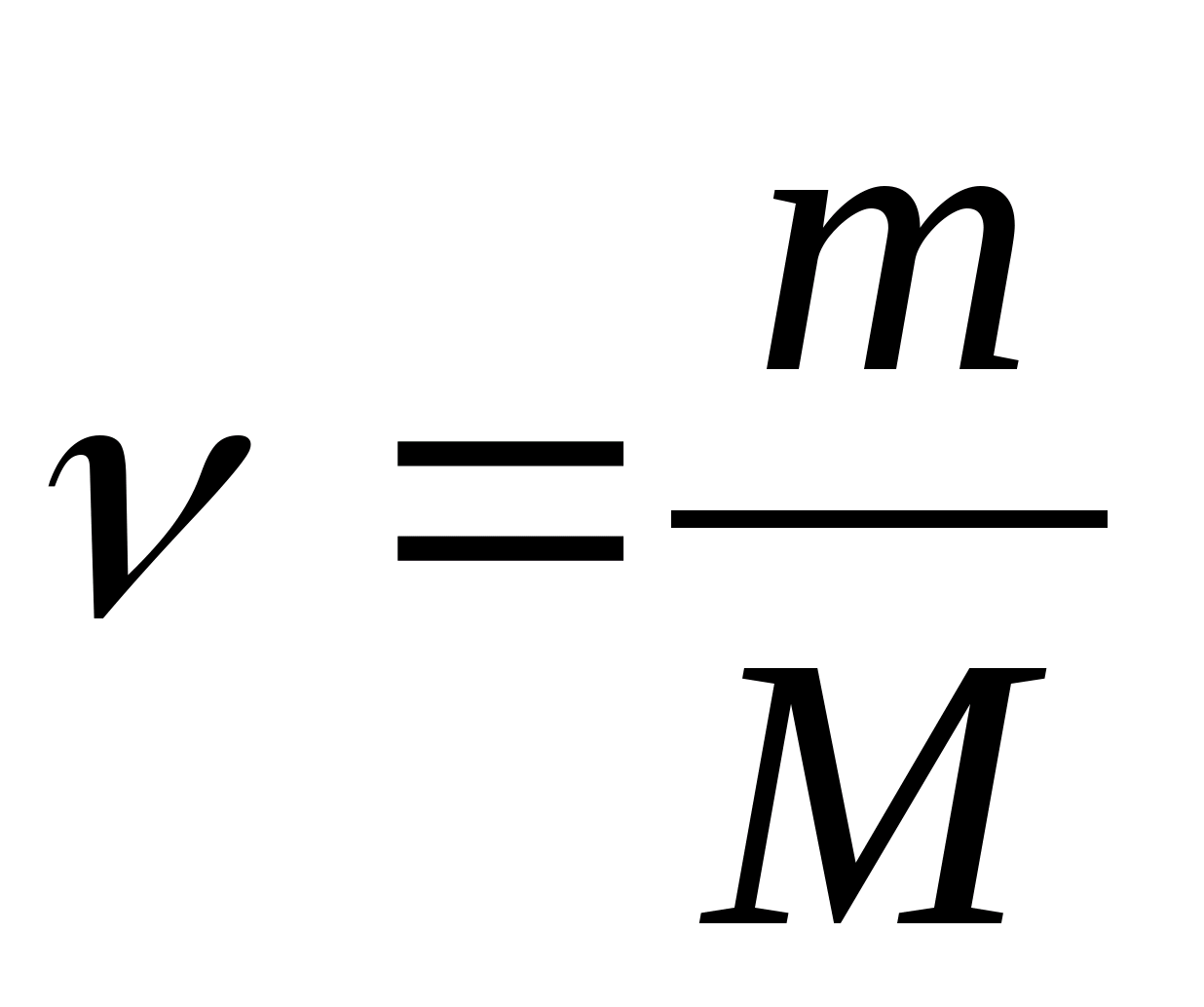 − quantidade de substância.
− quantidade de substância.
Calor específico c associado a molares C m Razão

Onde Mé a massa molar da substância.
Distinguir capacidade calorífica a volume constante e pressão constante, se no processo de aquecimento de uma substância seu volume ou pressão é mantido constante.
O menor número de variáveis independentes (coordenadas) que determinam completamente a posição do sistema no espaço é chamado número de graus de liberdade .
De acordo com a lei de Boltzmann sobre a distribuição uniforme de energia sobre os graus de liberdade das moléculas, cada grau de liberdade translacional e rotacional é responsável por uma energia cinética média igual a
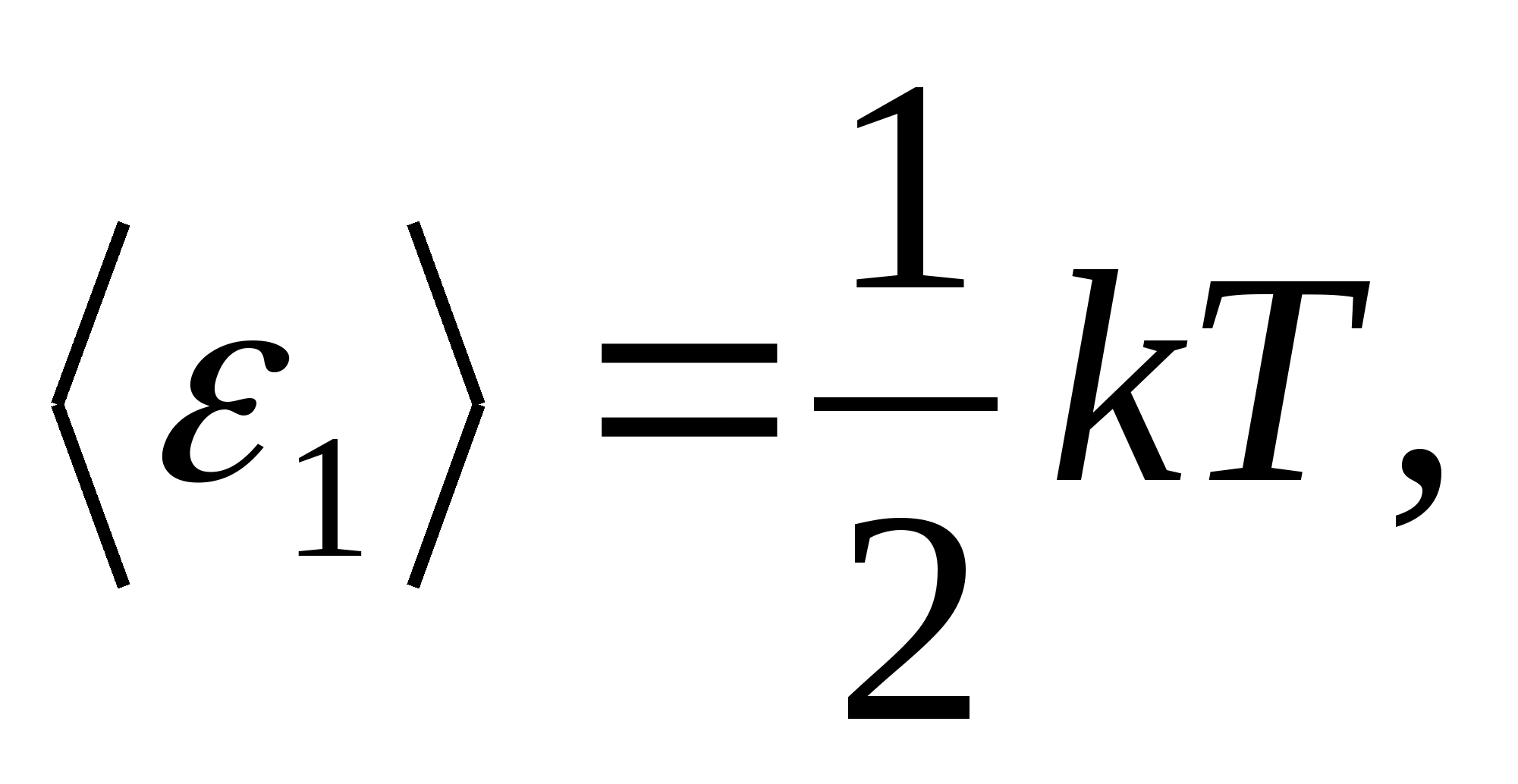
(Onde ké a constante de Boltzmann), e para cada grau de liberdade vibracional, em média, a energia igual a
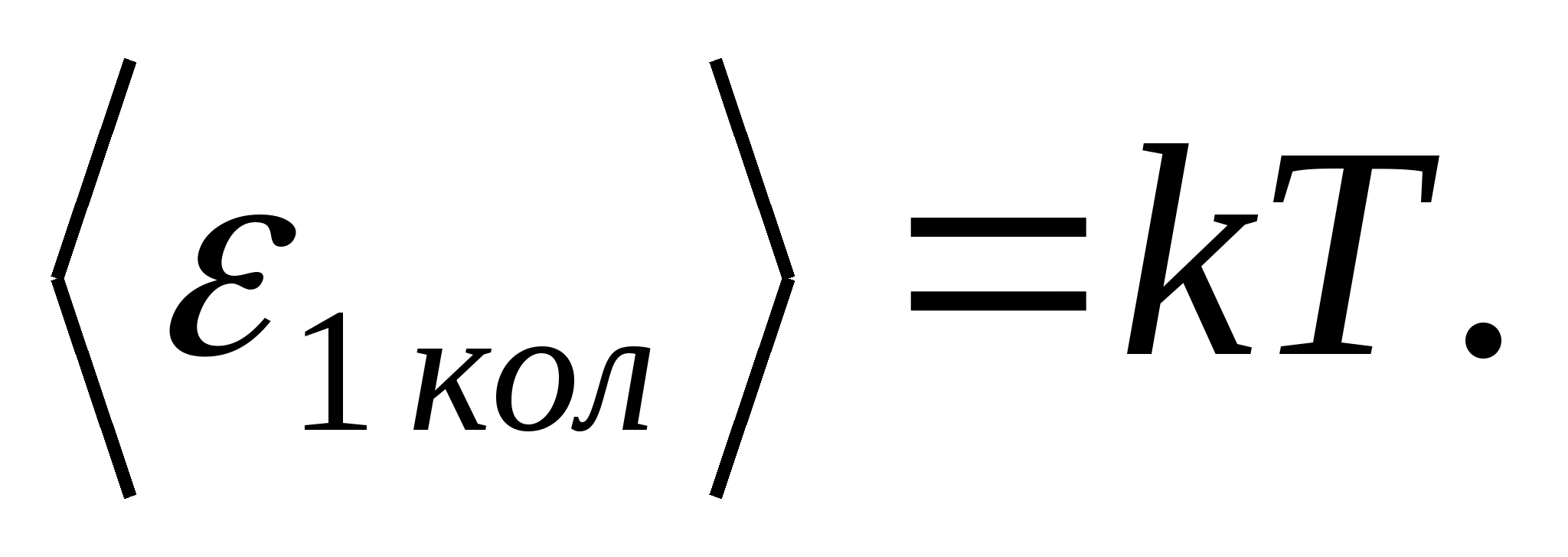
Assim, a energia média de uma molécula
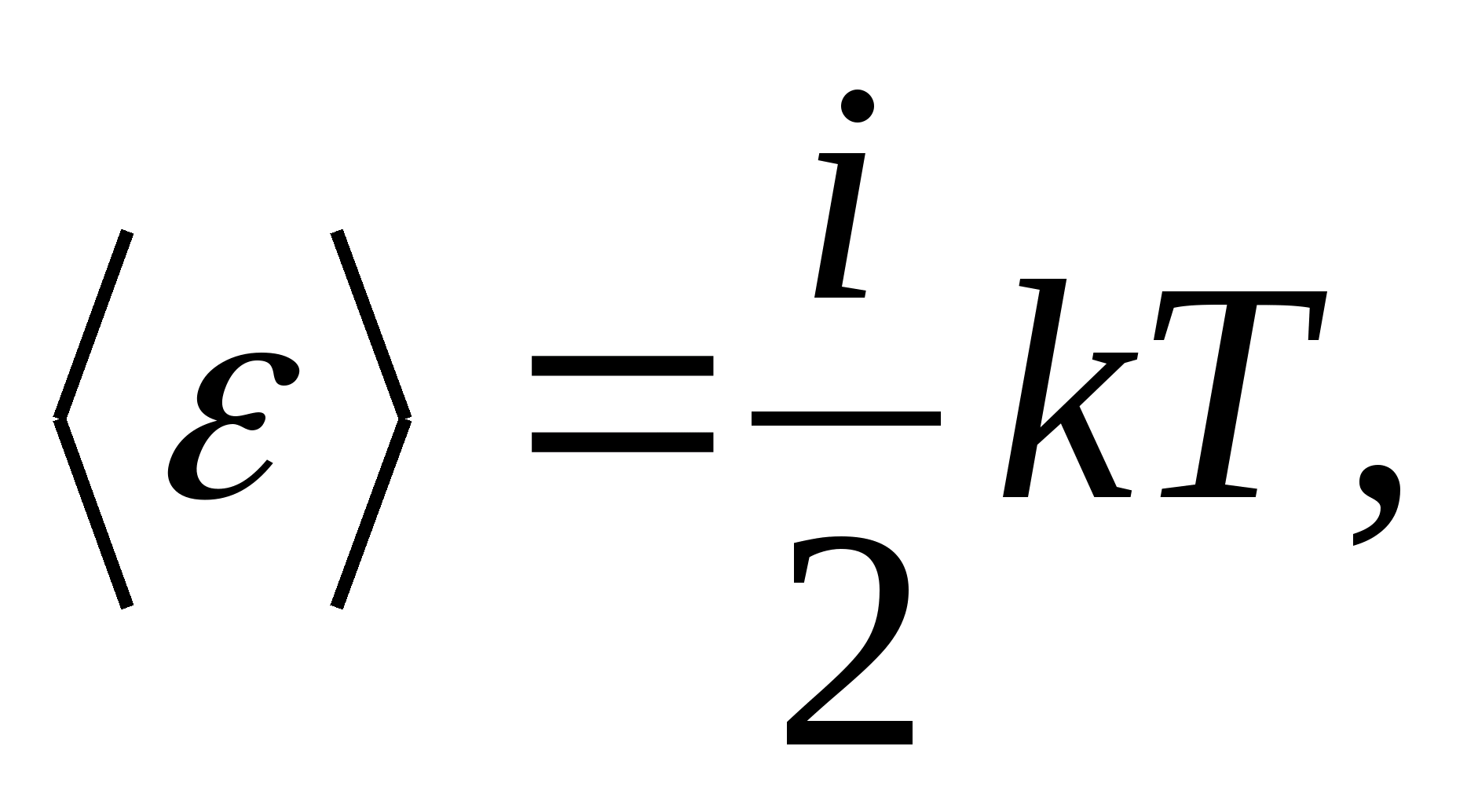
Onde eué a soma do número de translacional, o número de rotacional e duas vezes o número de graus de liberdade vibracionais da molécula:
![]()
Por exemplo, a energia cinética média de moléculas monoatômicas de gás ideal ( 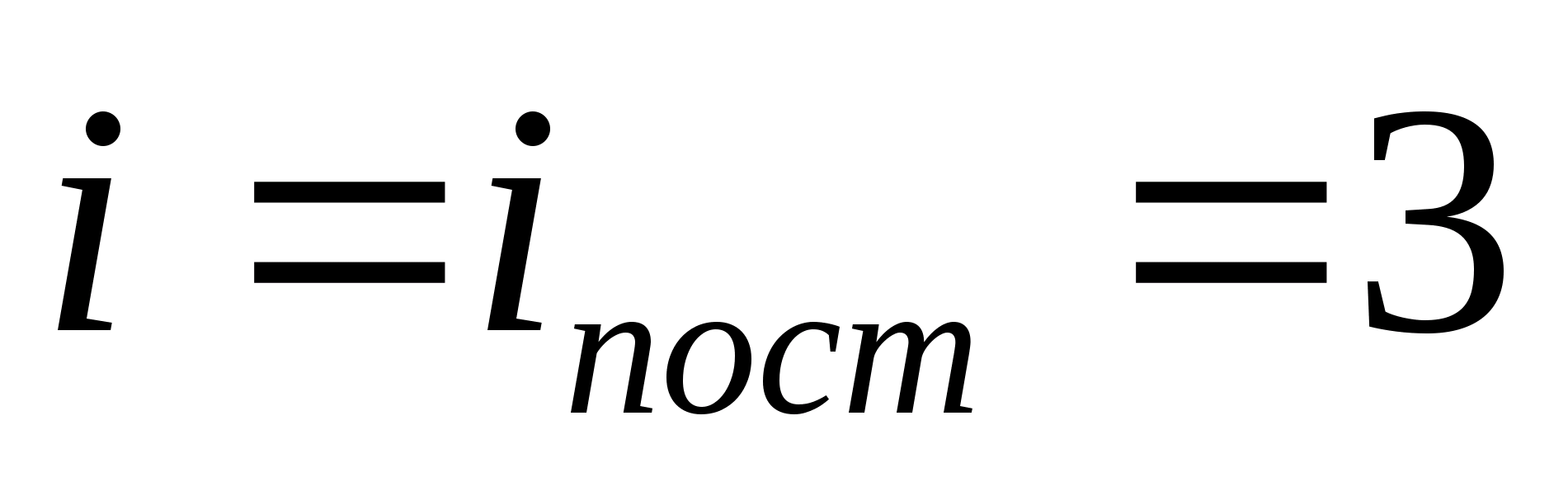 ) é igual a
) é igual a
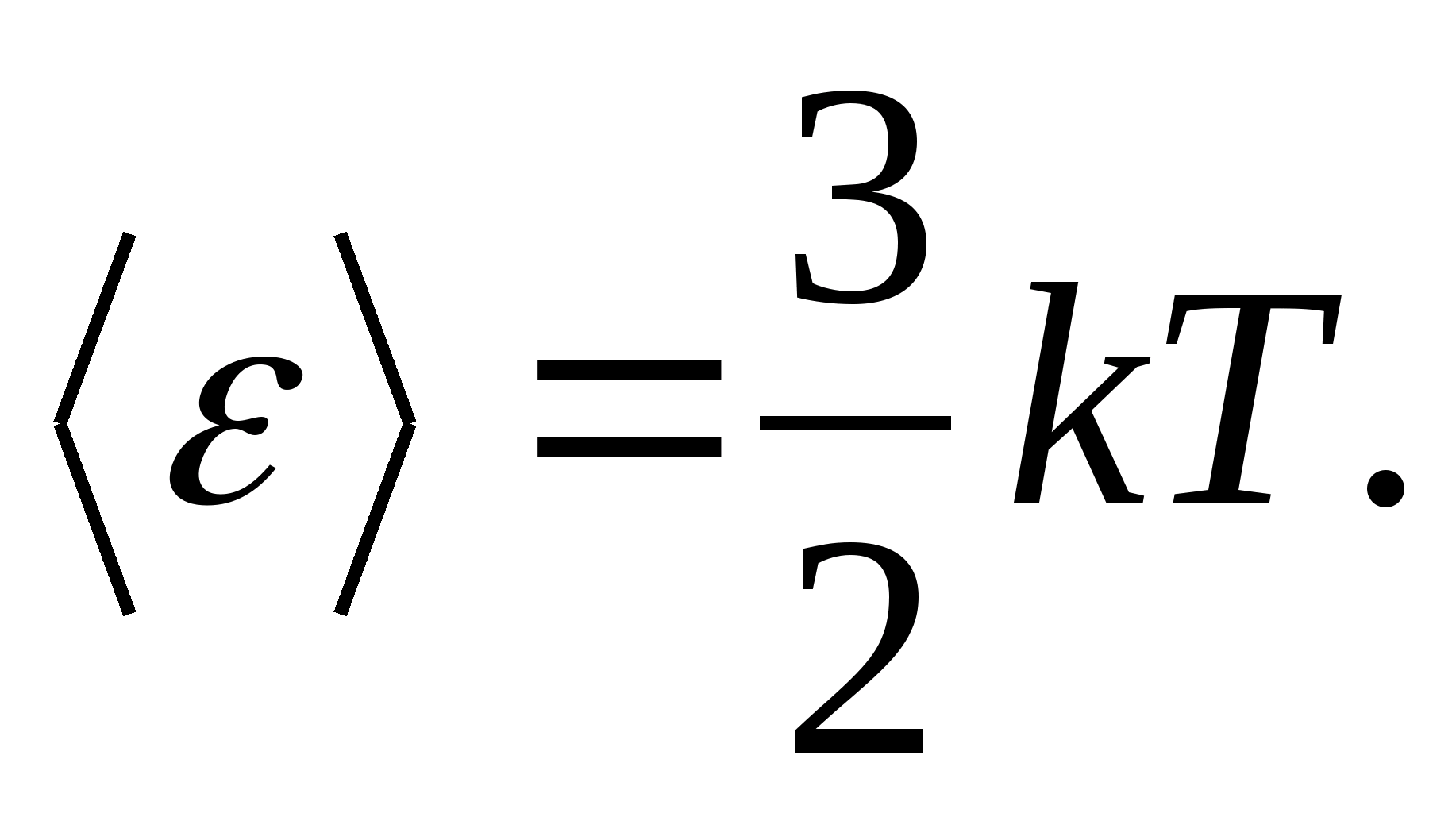
Como modelos de um corpo sólido, considere uma rede cristalina corretamente construída, em cujos nós as partículas (átomos, íons, moléculas) são tomadas como pontos materiais, oscilam em torno de suas posições de equilíbrio - nós de rede - em três direções mutuamente perpendiculares. Assim, a cada partícula que compõe a rede cristalina são atribuídos três graus de liberdade vibracional, cada um dos quais, de acordo com a lei da distribuição uniforme de energia em graus de liberdade, tem a energia kT.
Então o valor médio da energia total da partícula durante o movimento oscilatório na rede cristalina
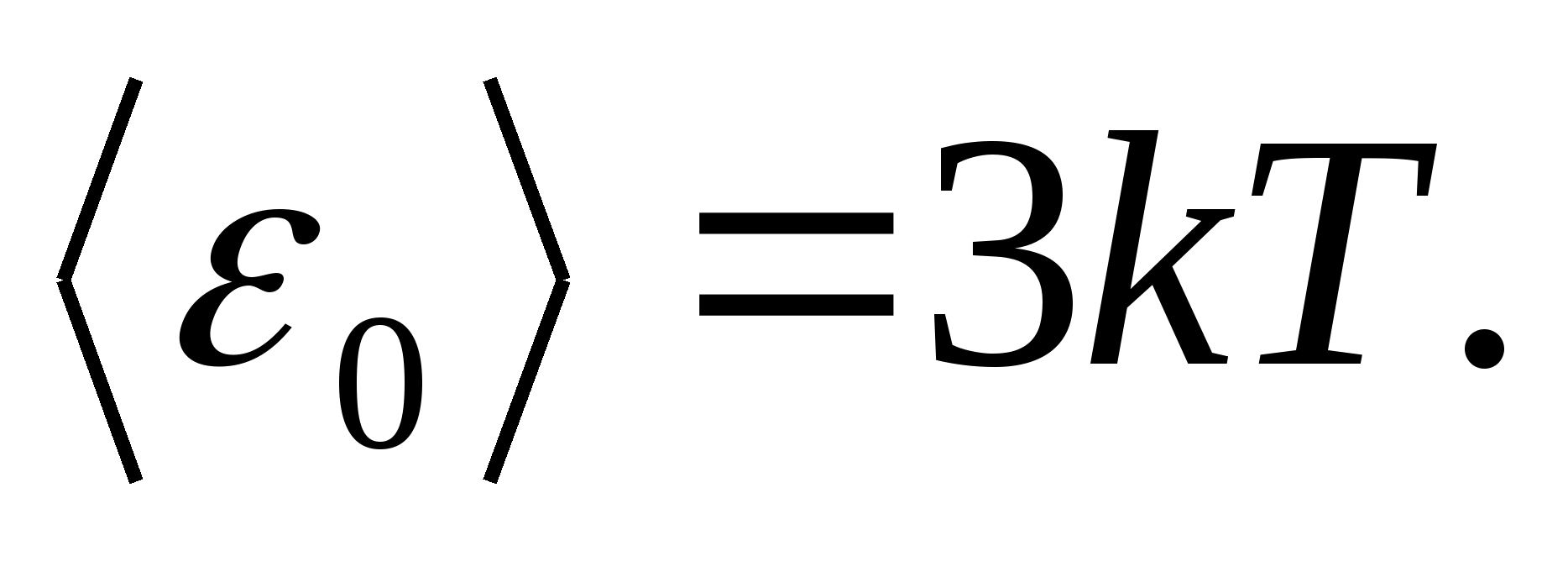
A energia interna total de um mol de um corpo sólido é obtida pela multiplicação da energia média de uma partícula pelo número de partículas de vibração independente contidas em um mol, ou seja, para a constante de Avogadro N UMA :
Onde R=N UMA ké a constante de gás universal (molar), R= 8,31 J/(molK).
Para sólidos, devido ao pequeno coeficiente de expansão térmica, as capacidades caloríficas a pressão constante e volume constante praticamente não diferem. Portanto, levando em conta (8.1), a capacidade calorífica molar de um sólido
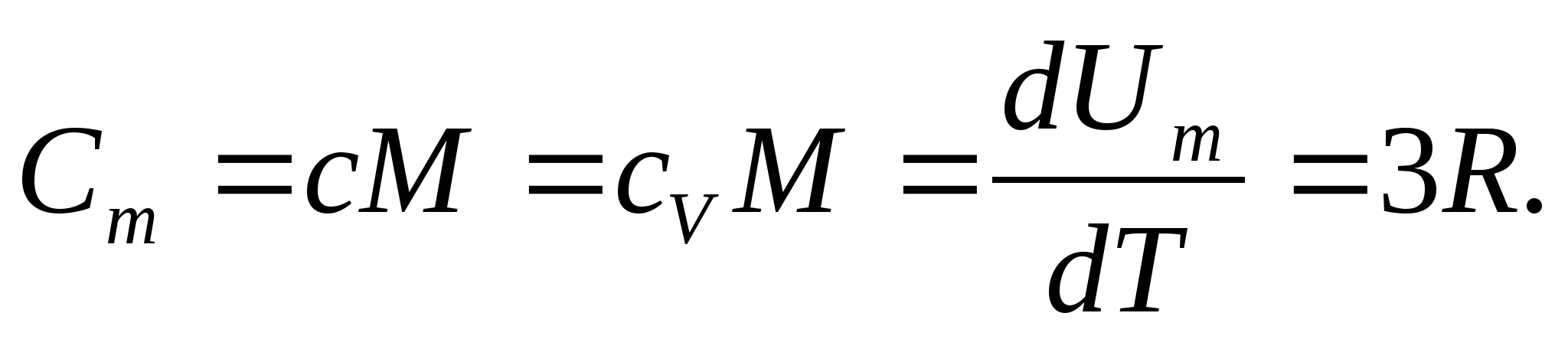 (8.2)
(8.2)
Substituindo o valor numérico da constante molar do gás, obtemos:
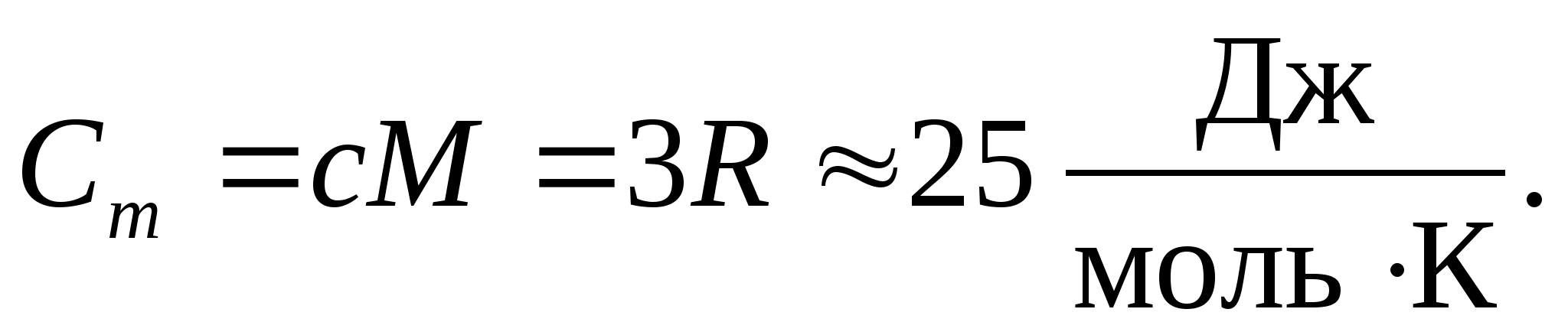
Essa igualdade é bastante aproximada para muitas substâncias à temperatura ambiente e é chamada de Direito Dulong e Petit : capacidade de calor molar de todos os cristais quimicamente simples sólidos aproximadamente igual a 25 J/(mol PARA). À medida que a temperatura diminui, as capacidades caloríficas de todos os sólidos diminuem, aproximando-se de zero em T0. Perto do zero absoluto, a capacidade calorífica molar de todos os corpos é proporcional a T3, e somente em uma temperatura suficientemente alta característica de cada substância a igualdade (8.2) começa a valer. Essas características das capacidades caloríficas dos sólidos em baixas temperaturas podem ser explicadas usando a teoria quântica da capacidade calorífica criada por Einstein e Debye.
Para determinar experimentalmente a capacidade calorífica, o corpo em estudo é colocado em um calorímetro, que é aquecido por uma corrente elétrica. Se a temperatura do calorímetro com a amostra de teste for aumentada muito lentamente desde o T 0 a T, então a energia da corrente elétrica será usada para aquecer a amostra e o calorímetro:
Onde EU e você− corrente e tensão do aquecedor; − tempo de aquecimento; m 0 e m são as massas do calorímetro e da amostra de teste, Com 0 e Com− capacidades caloríficas específicas do calorímetro e da amostra de teste, Q− perda de calor para o isolamento térmico do calorímetro e para o espaço envolvente.
Para excluir da equação (8.3) a quantidade de calor gasto no aquecimento do calorímetro e a perda de calor para o espaço circundante, é necessário, na mesma potência do aquecedor, aquecer o calorímetro vazio (sem amostra) a partir da temperatura inicial T 0 para a mesma diferença de temperatura T. A perda de calor em ambos os casos será praticamente a mesma e muito pequena, se a temperatura do invólucro protetor do calorímetro em ambos os casos for constante e igual à temperatura ambiente:
As equações (8.3) e (8.4) implicam
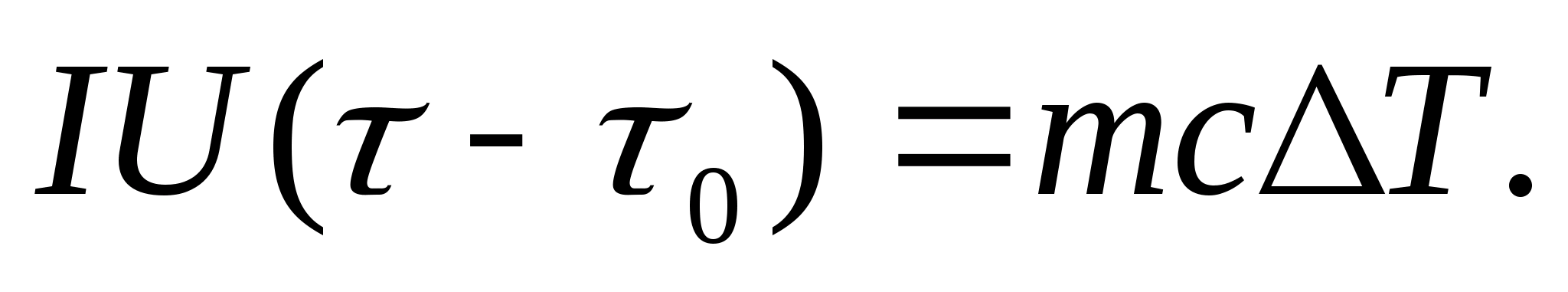 (8.5)
(8.5)
A equação (8.5) pode ser usada para determinar experimentalmente a capacidade calorífica específica do material da amostra de teste. Ao alterar a temperatura do calorímetro, é necessário traçar a dependência da diferença no tempo de aquecimento na mudança de temperatura da amostra de teste: (
−
0)=f(T), de acordo com o coeficiente angular do qual 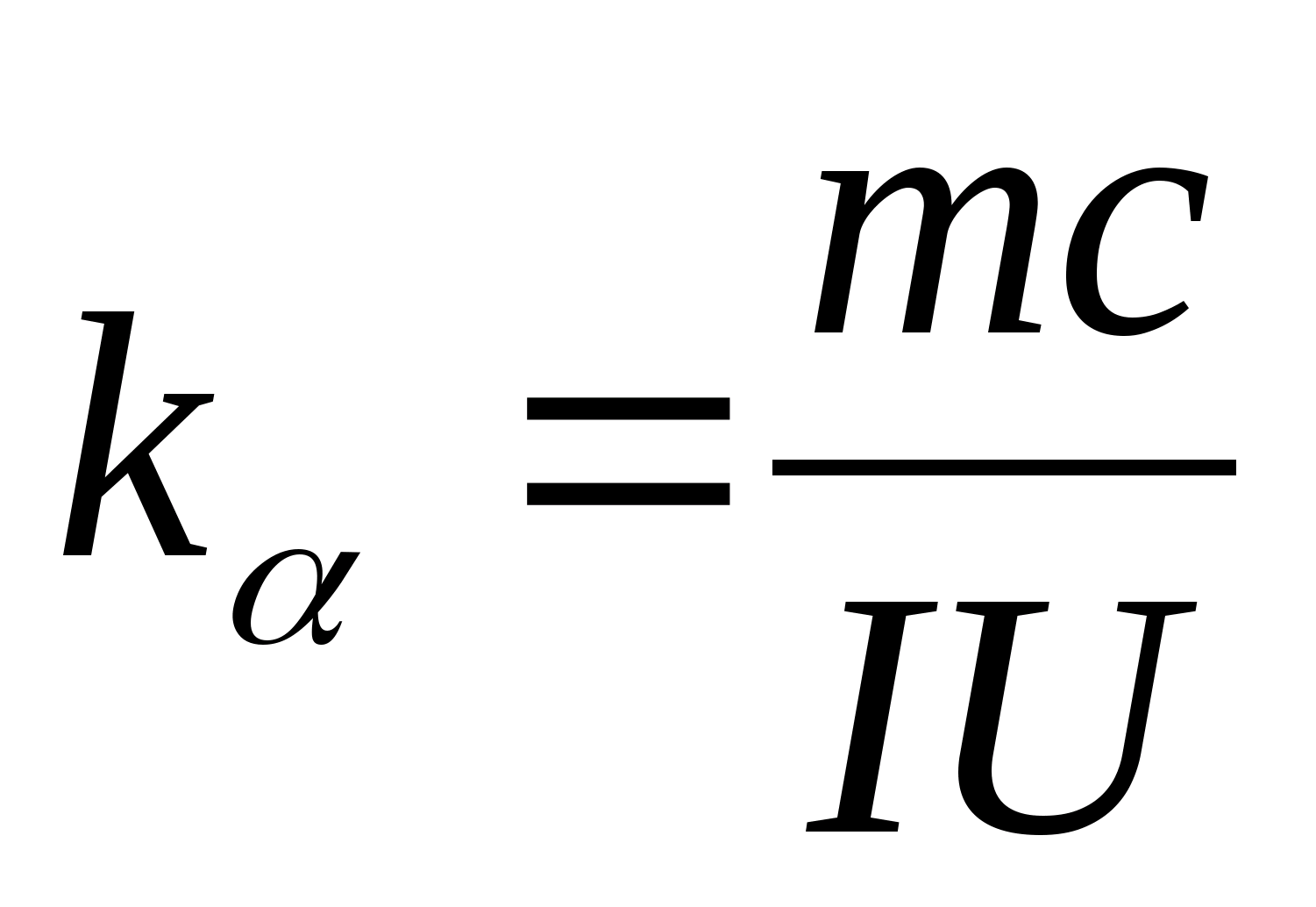 a capacidade de calor específico da amostra pode ser determinada.
a capacidade de calor específico da amostra pode ser determinada.
Descrição da configuração do laboratório
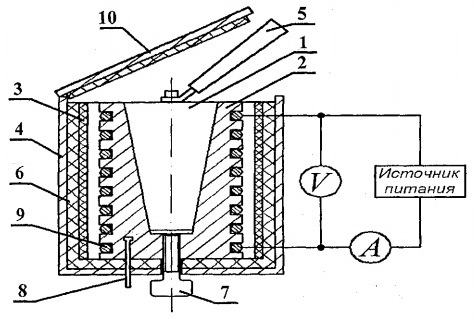
Para determinar a capacidade calorífica dos sólidos, a configuração experimental FPT1-8 é projetada, cuja visão geral é mostrada na Fig. 8.1. A instalação consiste em três partes principais: unidade instrumental 1, unidade de elemento operacional 2 e rack 3.
No painel frontal da central 1 encontram-se: o comutador “NETWORK”, que liga a central à rede de alimentação; interruptor "HEATING", que liga o aquecedor; o regulador “HEATING”, com o qual a potência do aquecedor é regulada; voltímetro e amperímetro, que medem a tensão e a corrente no circuito do aquecedor; cronômetro, que mede o tempo de aquecimento do calorímetro. O cronômetro é ativado quando a unidade de instrumento é ligada.
O bloco do elemento de trabalho 2 é fechado na frente com uma tela removível da org. vidro. Ao realizar o trabalho, a tela é pendurada na parede traseira do bloco do elemento de trabalho. No bloco de painel do elemento de trabalho está um termômetro digital 6 para medição de temperatura. Na parte inferior, nos ninhos, há 5 amostras de teste feitas de diversos materiais e uma alça para colocar as amostras no aquecedor.
O aquecedor 4 consiste em um invólucro de metal, material isolante de calor e um calorímetro.

As amostras são aquecidas em um calorímetro, cujo esquema é mostrado na Fig. 8.2.
O calorímetro é uma caixa de latão 2 com um orifício cônico, onde a amostra de teste 1 é inserida. Na superfície externa da caixa, uma bobina de aquecimento 9 é colocada em ranhuras especiais. No exterior, a caixa do calorímetro é isolada termicamente com camadas de amianto 3 e fibra de vidro 6 e fechado com um invólucro de alumínio 4. O calorímetro é fechado com uma tampa de isolamento térmico 10. Após o término do experimento, a amostra pode ser empurrada para fora do orifício cônico do corpo do calorímetro usando o parafuso 7. Para retirar a amostra aquecida do calorímetro e instalar a amostra no aquecedor, utiliza-se a alça 5, localizada em um soquete especial próximo às amostras em estudo.
A temperatura do calorímetro é medida por um termômetro digital, cujo sensor de temperatura 8 está localizado no alojamento 2 do calorímetro.
Segurança
Ao realizar o trabalho, são observados os requisitos gerais de segurança no laboratório de mecânica.
Ordem de serviço
ATENÇÃO! O calorímetro leva muito tempo para esfriar, então depois de medir todos os valores de tempo 0 aquecimento de um calorímetro vazio, desligue imediatamente o aquecimento (ver ponto 4 abaixo). A temperatura máxima de aquecimento para esta unidade é +44С.
1. Remova a tampa transparente da unidade do elemento de trabalho da instalação e pendure-a nos parafusos do painel traseiro. Coloque o botão de controle HEAT no mínimo. Ligue a instalação com a chave de alternância "NETWORK".
2. Feche bem a tampa do calorímetro vazio. Ligue o interruptor de alternância "HEAT". Usando o regulador HEAT, ajuste a tensão para 10-20 V (quanto maior a tensão, mais rápido o aquecimento). Escreva na tabela. 8.1 valores de tensão selecionados você e atual EU.
3. A partir da temperatura do calorímetro t 0 especificado pelo professor, após um intervalo de 1С entrar na tabela. 8.1 valores de tempo 0 correspondente a cada temperatura atingida t.
4. Desligue a chave seletora "HEAT", abra a tampa e resfrie o calorímetro até a temperatura inicial t 0. Para resfriar rapidamente o calorímetro, você pode abaixar uma das amostras no calorímetro, exceto a indicada pelo professor (ao colocar a amostra no calorímetro, gire o parafuso na parte inferior do calorímetro para a esquerda). A temperatura começará a cair. Quando a taxa de resfriamento diminuir, retire a amostra aquecida e insira a próxima (fria), exceto a indicada pelo professor. Para remover a amostra, gire o parafuso na parte inferior do calorímetro para a direita (sentido horário) e puxe a amostra para fora com a alça.
Tabela 8.1
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =ComM, J/(molK) |
||||||||
5. Girando o parafuso para a esquerda, coloque uma das amostras de teste, colhidas conforme as instruções do professor, no calorímetro. Feche bem a tampa do calorímetro e espere 2-3 minutos para que as temperaturas do calorímetro e da amostra se equalizem.
6. Ligue a chave seletora "HEAT" e defina a mesma tensão no circuito ao aquecer o calorímetro vazio.
7. Partindo da mesma temperatura inicial do calorímetro t 0, após um intervalo de 1С entrar na tabela. 8.1 valores de tempo correspondente a cada temperatura atingida t.
8. Coloque o regulador “HEATING” na posição extrema esquerda (no mínimo), desligue o interruptor “HEATING”, abra a tampa do calorímetro. Para remover a amostra do calorímetro, gire o parafuso para a direita e remova a amostra aquecida usando a alça.
9. Desligue a unidade com a chave seletora "NETWORK".
10. Traduza todos os valores das quantidades 0 e em valores em segundos (sem minutos) e insira-os na tabela. 8.1. Para cada linha da tabela. 8.1 calcule os valores de = − 0 e T= t− t 0 .
11. Faça um cálculo estimado da capacidade calorífica específica da amostra usando a fórmula 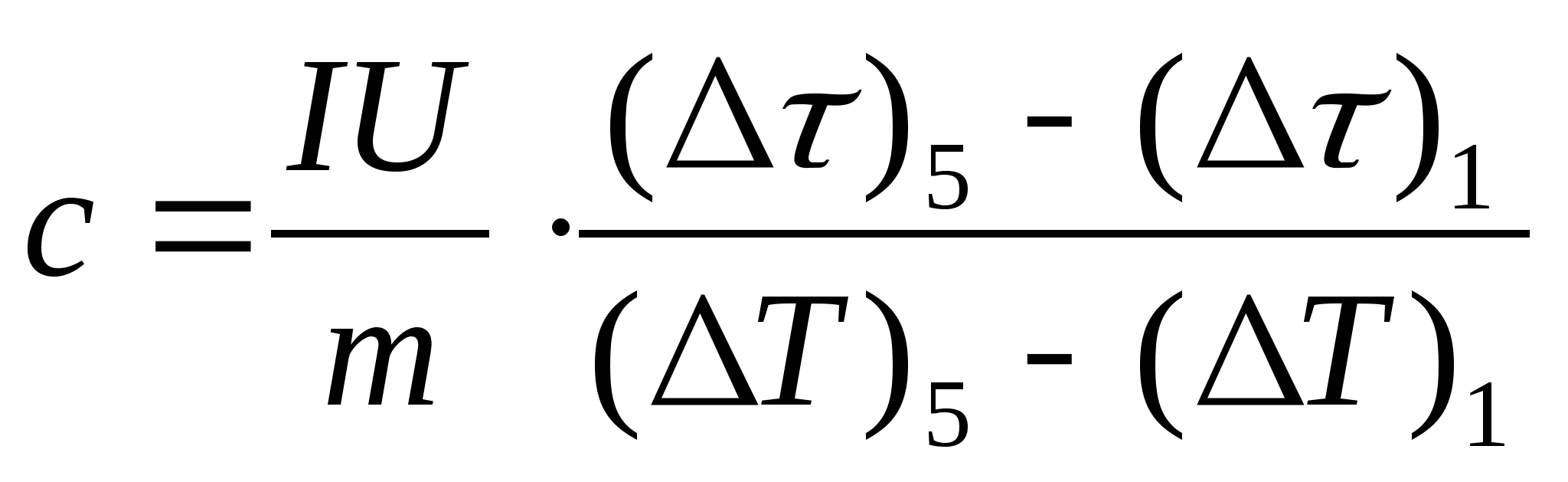 , onde a massa da amostra m=139,5 g (latão) ou m=129,7 g (aço) ou
m=46,05 g (duralumínio). Vá ao professor para verificação.
, onde a massa da amostra m=139,5 g (latão) ou m=129,7 g (aço) ou
m=46,05 g (duralumínio). Vá ao professor para verificação.
Processando resultados de medição
1. Plotagem
=f(T) a dependência da diferença no tempo de aquecimento do calorímetro com a amostra e o calorímetro vazio na mudança de temperatura do calorímetro, selecione dois pontos quaisquer no gráfico e determine a inclinação da linha reta usando a fórmula 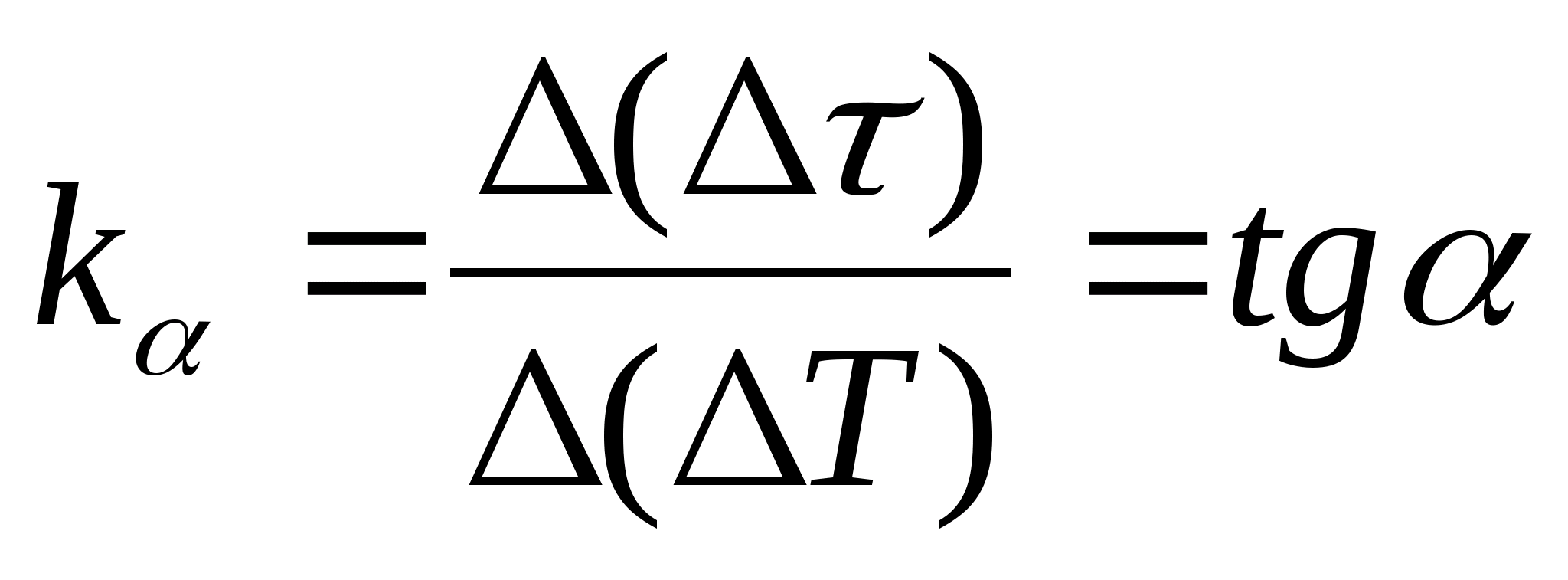 , Onde
− o ângulo de inclinação do gráfico em relação ao eixo T
(se as unidades de
e T são mostrados em ambos os eixos como segmentos do mesmo comprimento).
, Onde
− o ângulo de inclinação do gráfico em relação ao eixo T
(se as unidades de
e T são mostrados em ambos os eixos como segmentos do mesmo comprimento).
2. Usando o valor da inclinação k
, determine a capacidade calorífica específica da amostra usando a fórmula 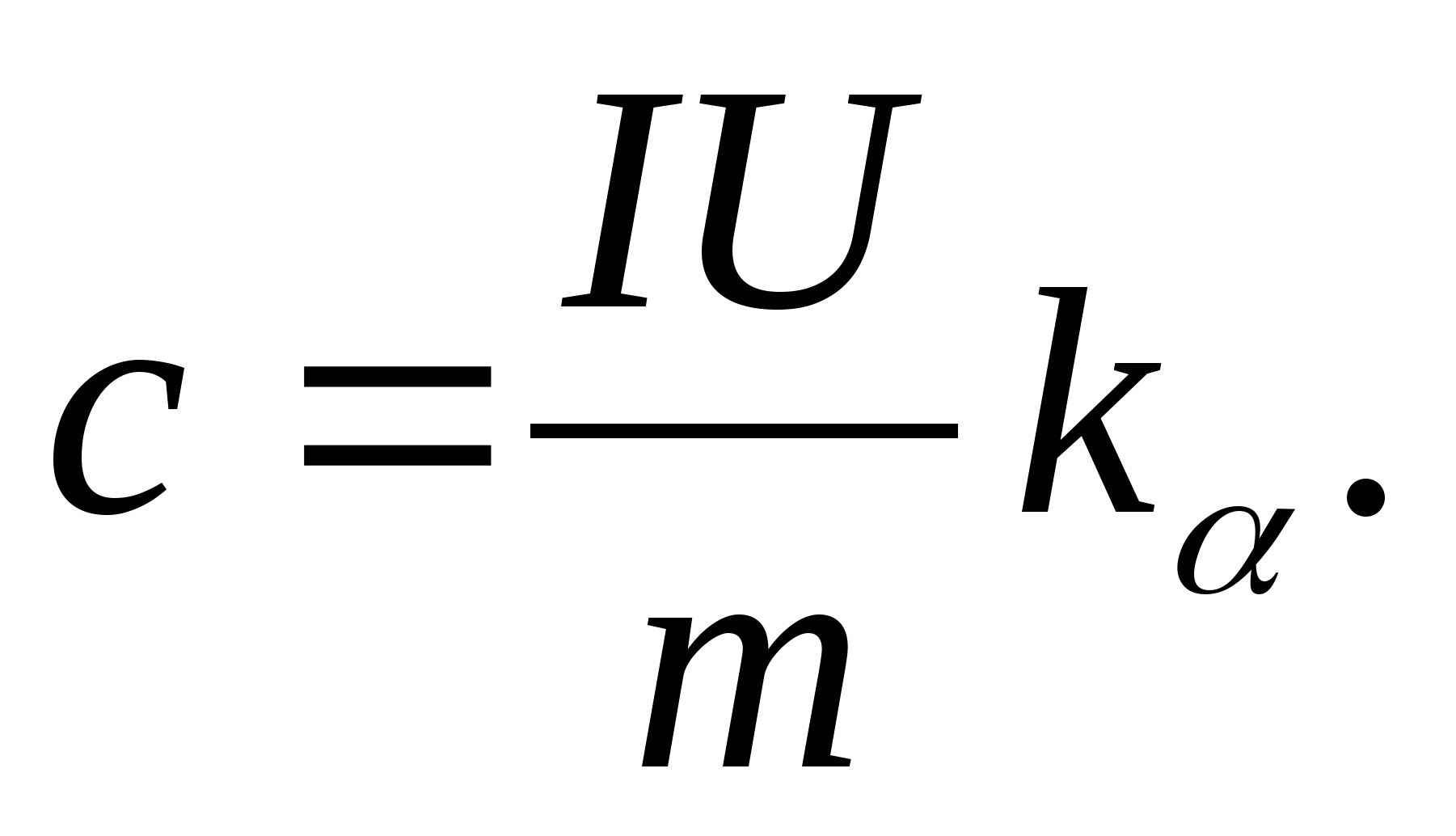
3. Usando os dados da tabela 8.2 (ou da tabela periódica), determine a capacidade calorífica molar da amostra usando a fórmula C m =ComM.
Tabela 8.2
|
Material de amostra |
Massa atômica, kg/mol |
|
Como modelo de um corpo sólido, consideremos uma rede cristalina corretamente construída, em cujos nós as partículas (átomos, íons, moléculas), tomadas como pontos materiais, oscilam em torno de suas posições de equilíbrio - nós da rede - em três direções mutuamente perpendiculares. . Assim, a cada partícula que constitui a rede cristalina são atribuídos três graus de liberdade vibracional, cada um dos quais, de acordo com a lei da equipartição da energia sobre os graus de liberdade (ver § 50), tem a energia kT.
Energia interna de um mol de um corpo sólido
Um m \u003d 3N A kT \u003d 3RT,
onde NA é a constante de Avogadro; N UMA k= R (R é a constante molar do gás).
Capacidade térmica molar de um sólido
ou seja, capacidade de calor molar (atômica) corpos quimicamente simples no estado cristalino é o mesmo (igual a 3 R) e não depende da temperatura. Esta lei foi obtida empiricamente pelos cientistas franceses P. Dulong (1785-1838) e L. Petit (1791-1820) e é títuloDireito Dulong e Petit.
Se o sólido é um composto químico (por exemplo, NaCl), então o número de partículas no mol não é igual à constante de Avogadro, mas é igual a nN UMA , Onde n - número de átomos em uma molécula (para NaCl, o número de partículas em um mol é 2 N e, assim, um mol de NaCl contém átomos de NA Na e átomos de NA Cl). Portanto, a capacidade calorífica molar compostos químicos sólidos
C V \u003d 3R25n J / (mol K),
ou seja, igual à soma das capacidades caloríficas atômicas dos elementos que compõem este composto.
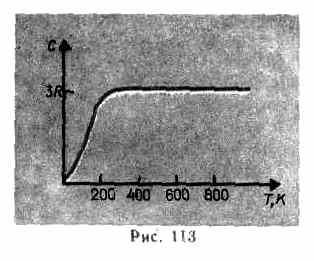
Como mostram os dados experimentais (Tabela 4), para muitas substâncias a lei de Dulong e Petit é satisfeita com uma aproximação bastante boa, embora algumas substâncias (C, Be, B) tenham desvios significativos das capacidades caloríficas calculadas. Além disso, como no caso dos gases (ver § 53), experimentos para medir a capacidade calorífica de sólidos a baixas temperaturas mostraram que ela depende da temperatura (Fig. 113). Perto de zero Kelvin, a capacidade calorífica dos corpos é proporcional a T 3 , e somente em temperaturas suficientemente altas, características de cada substância, a condição (73.1) é satisfeita. O diamante, por exemplo, tem capacidade calorífica de 3 R em 1800K! No entanto, para a maioria dos sólidos, a temperatura ambiente já é alta o suficiente.
A discrepância entre os valores experimentais e teóricos das capacidades de calor calculadas em
a base da teoria clássica, explicada, com base na teoria quântica das capacidades de calor, A. Einstein e P. Debye (1884-1966).
§ 74. Evaporação, sublimação, fusão e cristalização. Corpos amorfos
Tanto em líquidos quanto em sólidos, há sempre um certo número de moléculas cuja energia é suficiente para vencer a atração por outras moléculas e que são capazes de romper a superfície de um líquido ou sólido e passar para o espaço ao seu redor. Este processo para o líquido é chamado evaporação(ou vaporização), para sólidos - sublimação(ou sublimação).
A evaporação de líquidos ocorre em qualquer temperatura, mas sua intensidade aumenta com o aumento da temperatura. Junto com o processo de evaporação, ocorre um processo de compensação condensação vapor para líquido. Se o número de moléculas que saem do líquido por unidade de tempo através de uma superfície unitária é igual ao número de moléculas que passam do vapor para o líquido, então equilíbrio dinâmico entre os processos de evaporação e condensação. Um vapor em equilíbrio com seu líquido é chamado rico(ver também § 62).
Para a maioria dos sólidos, o processo de sublimação em temperaturas normais é desprezível e a pressão de vapor sobre a superfície do sólido é baixa; aumenta com o aumento da temperatura. Sublima intensamente substâncias como naftaleno, cânfora, que é detectada por um cheiro forte e característico. A sublimação ocorre de forma especialmente intensa no vácuo - isso é usado para fazer espelhos. Um exemplo bem conhecido de sublimação é a transformação do gelo em vapor - a roupa molhada seca no frio.
Se um corpo sólido é aquecido, então ele energia interna(a soma da energia das vibrações das partículas nos sítios da rede e a energia de interação dessas partículas) aumenta. À medida que a temperatura aumenta, a amplitude das oscilações das partículas
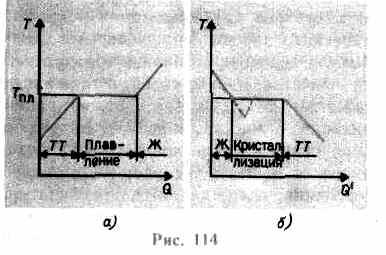
aumenta até que a rede cristalina desmorone - o sólido derrete. Na fig. 114 uma uma dependência aproximada é mostrada T(Q), Onde Q- a quantidade de calor recebida pelo corpo durante a fusão. Como a mensagem para o sólido corpo quente sua temperatura aumenta, e no ponto de fusão T pl inicia a transição do corpo do estado sólido para o estado líquido. Temperatura T pl permanece constante até que todo o cristal seja derretido, e só então a temperatura do líquido começa a subir novamente.
Aquecer um sólido até T pl ainda não a converte em estado líquido, pois a energia das partículas da substância deve ser suficiente para destruir a rede cristalina. No processo de fusão, o calor transmitido à substância é usado para realizar o trabalho de destruição da rede cristalina e, portanto, T pl = const até que todo o cristal seja fundido. Então o calor fornecido irá novamente aumentar a energia das partículas do líquido e sua temperatura começará a subir. A quantidade de calor necessária para derreter 1 kg de uma substância é chamada de calor específico de fusão.
Se o líquido é resfriado, o processo prossegue na direção oposta (Fig. 114, b; Q" - a quantidade de calor emitida pelo corpo durante a cristalização): primeiro, a temperatura do líquido diminui e, em seguida, a uma temperatura constante igual a T pl, começa cristalização, após sua conclusão, a temperatura do cristal começa a diminuir. Para a cristalização de uma substância, a presença dos chamados centros de cristalização - núcleos cristalinos, que podem ser não apenas cristais da substância formada, mas também impurezas, além de poeira, fuligem, etc. A ausência de centros de cristalização em um líquido puro dificulta a formação de cristais microscópicos, e a substância, permanecendo no estado líquido, resfria a uma temperatura inferior à temperatura de cristalização, formando assim líquido super-resfriado(em 114, b corresponde à curva tracejada). Com um forte super-resfriamento, a formação espontânea de centros de cristalização começa e a substância cristaliza rapidamente.
Normalmente, o super-resfriamento do fundido ocorre de frações a dezenas de graus, mas para várias substâncias pode atingir centenas de graus. Devido à alta viscosidade, líquidos altamente super-resfriados perdem sua fluidez, mantendo sua forma, como os sólidos. Esses corpos são chamados sólidos amorfos; estes incluem resinas, cera, cera de vedação, vidro. Corpos amorfos, sendo assim líquidos super-resfriados, isotrópico, ou seja, suas propriedades são as mesmas em todas as direções; para eles, assim como para líquidos, é característico ordem de curto alcance no arranjo de partículas; neles, em contraste com os líquidos, a mobilidade das partículas é bastante pequena. Uma característica dos corpos amorfos é que eles não possuem um ponto de fusão específico, ou seja, é impossível indicar uma temperatura específica acima da qual um estado líquido pode ser determinado e abaixo de um estado sólido. Por experiência, sabe-se que em corpos amorfos o processo de cristalização pode ser observado ao longo do tempo, por exemplo, cristais aparecem em vidro; ela, perdendo a transparência, começa a ficar turva e se transformar em um corpo policristalino.
Recentemente, o uso generalizado em economia nacional pegou polímeros- corpos amorfos orgânicos, cujas moléculas consistem em um grande número de cadeias moleculares longas idênticas conectadas por ligações químicas (de valência). Os polímeros incluem substâncias orgânicas naturais (amido, proteína, borracha, fibra, etc.) e artificiais (plástico, borracha, poliestireno, lavsan, nylon, etc.). Os polímeros são força e elasticidade inerentes; alguns polímeros resistem ao alongamento de 5 a 10 vezes seu comprimento original. Isso é explicado pelo fato de que longas cadeias moleculares podem, sob deformação, dobrar-se em bobinas densas ou esticar-se em linhas retas. A elasticidade dos polímeros se manifesta apenas em uma certa faixa de temperatura, abaixo da qual eles se tornam duros e quebradiços, e acima - plástico. Embora muitos materiais poliméricos sintéticos tenham sido criados (fibras artificiais, substitutos de couro, materiais de construção, substitutos de metais, etc.), a teoria dos polímeros ainda não foi totalmente desenvolvida. Seu desenvolvimento é determinado pelas exigências da tecnologia moderna, que exige a síntese de polímeros com propriedades pré-determinadas.
A capacidade calorífica específica de uma substância é entendida como o valor
, (1)
onde é a quantidade de calor transmitida ao corpo.
é a variação de temperatura que ocorre em
como resultado da transferência de calor para o corpo,
m é a massa do corpo aquecido.
A experiência geralmente determina a média calor específico substância c, numericamente igual à quantidade de calor que deve ser transmitida a uma unidade de massa dessa substância para aumentar sua temperatura por:
(2),
onde é a diferença entre as temperaturas final e inicial do corpo em estudo.
Vários métodos calorimétricos são usados para determinar experimentalmente a capacidade calorífica. A variedade desses métodos se deve ao fato de que a medição precisa da quantidade de calor transmitida ao corpo requer a eliminação de perdas de calor que não são levadas em consideração no aquecimento do corpo em estudo.
Normalmente, nos chamados calorímetros com casca isotérmica, é introduzida uma correção calculada ou determinada experimentalmente para a radiação, ou seja, a quantidade de calor que o calorímetro recebe ou emite ao meio externo por radiação durante o experimento.
No entanto, é possível reduzir significativamente as perdas de calor introduzindo um bom isolamento térmico ou reduzindo a duração do experimento, o que é alcançado por uma alta taxa de aquecimento da amostra ~ (método de pulso para medir a capacidade de calor), na qual as perdas de calor serão ser pequena em comparação com a quantidade total de calor fornecida.
Um dos métodos mais precisos para determinar a capacidade calorífica é o método do calorímetro adiabático. As dificuldades associadas à necessidade de levar em conta as perdas de calor em calorímetros deste tipo são eliminadas pelo fato de as medições serem feitas em condições de equilíbrio térmico, ou seja, em condições de temperaturas iguais da amostra de teste e do bloco que envolve a amostra. As vantagens deste método, juntamente com a alta precisão, também incluem a possibilidade de determinar a capacidade calorífica dos sólidos em uma ampla faixa de temperatura, o que é especialmente importante se as substâncias sofrerem transformações de fase.
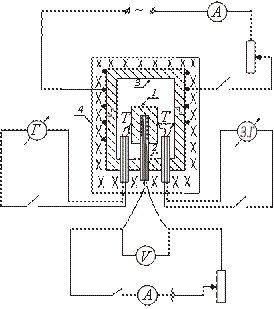
O dispositivo de um dos tipos de calorímetro adiabático é mostrado esquematicamente na figura. A amostra de teste 1 é colocada no bloco de cobre 3 e junto com ela é aquecida no forno 4. O aquecedor 2 é introduzido dentro da amostra, o que permite um aquecimento adicional da amostra.
Após ligar o forno 4, no qual é colocado o bloco com a amostra, a temperatura da amostra começa a subir, permanecendo abaixo da temperatura do bloco. Para estabelecer a igualdade entre as temperaturas da amostra e do bloco, ligue o aquecedor colocado dentro da amostra. Quando a temperatura da amostra está ligeiramente acima da temperatura do bloco, o aquecedor interno é desligado.
Posteriormente, este aquecedor é ligado e desligado periodicamente, de forma que a diferença de temperatura entre a amostra e o bloco mude de sinal o tempo todo.
No momento em que é igual a zero (quando o aquecedor interno está ligado), não há troca de calor entre a amostra e o bloco, e todo o calor liberado pelo aquecedor interno é gasto apenas no aquecimento da amostra; calor específico neste caso pode ser determinado pela fórmula (2).
A quantidade de calor liberada pelo aquecedor interno é determinada pela fórmula:
onde I é a corrente do aquecedor interno;
V é a queda de tensão sobre ele;
- o intervalo de tempo durante o qual a temperatura aumentou em .
Então
(4)
onde é o tempo durante o qual a temperatura da amostra mudou em .
Na forma diferencial, a fórmula (4) tem a forma
(5)
A temperatura da amostra é medida com um termopar T. A diferença de temperatura entre o bloco e a amostra é medida com um termopar diferencial. Para determinar a temperatura da amostra, é utilizada uma curva de calibração do termopar T. A diferença de temperatura entre o bloco e a amostra é determinada em divisões da escala do galvanômetro (já que é necessário apenas fixar o momento em que a diferença de temperatura entre o bloco e o sinal de mudança de amostra).
Conclusão do trabalho.
A amostra é colocada em um aquecedor colocado dentro de um bloco de cobre. As junções do termopar T e são conectadas à amostra e ao bloco. O forno é fechado com uma tampa. O enrolamento elétrico do forno, no qual o bloco é colocado, é ligado. O aquecedor colocado dentro da amostra é ligado e desligado periodicamente, e os valores de I e V são registrados no circuito do aquecedor interno.
Antes de iniciar as medições, é necessário verificar a posição zero do galvanômetro de espelho. Para fazer isso, desconectando o termopar do galvanômetro, eles esperam que o coelho pare de flutuar ao longo da escala. Se depois disso a imagem do fio não coincidir com zero, então, movendo a escala, essa coincidência é alcançada.
As curvas de dependência de T e no tempo são traçadas.
A partir da inclinação da curva T(t) no ponto onde ela muda de sinal (isto é, quando o equilíbrio térmico é estabelecido), o calor específico é calculado usando a fórmula (5). Esta capacidade calorífica refere-se à temperatura a ser lida na curva T(t) no momento em que a diferença de temperatura entre o bloco e a amostra muda de sinal.
