Գազային խառնուրդներ. Գազերի ջերմային հզորությունը: Վառելիքի, գազի խառնուրդներ և ջերմային հզորություն
1.3. Իդեալական գազի վիճակի հավասարումը
Իրական նյութերի վիճակի (1.1) հավասարումների ձևը բավականին բարդ է։
Այս առումով թերմոդինամիկայի մեջ օգտագործվում են աշխատանքային հեղուկների պարզեցված ֆիզիկական մոդելներ։
Գազային վիճակում աշխատող հեղուկների համար ամենապարզ և պատմականորեն առաջին մոդելն է իդեալական գազ. Իդեալական գազը հասկացվում է որպես գազ, որի մեջ բացակայում են միջմոլեկուլային փոխազդեցության ուժերը (ներգրավում և վանում), իսկ մոլեկուլներն իրենք են համարվում. նյութական միավորներ. Իդեալական գազը ենթարկվում է Clayperon հավասարումը– Մենդելեևը
Որտեղ մ- գազի զանգվածը համակարգում; μ – գազի մոլային զանգված; Ռμ = 8314 J/(kmol K) ունիվերսալ գազի հաստատուն է, որը կախված չէ գազի տեսակից կամ դրա գոյության պայմաններից։ Համատեղելով վիճակի (1.2) հավասարումը ստացվում է Բոյլ-Մարիոտի օրենքներըԵվ Գեյ Լուսակհաշվի առնելով Ավոգադրոյի օրենքը.
Մոլային զանգված μ = մ/n, կգ/մոլ, մեկ մոլի չափով վերցված նյութի զանգվածն է։ 1 խլուրդնյութի քանակի միավոր է, որը պարունակում է նույն թվով մասնիկներ, որքան 12 գրամ ածխածինը։ Նյութի քանակությունը– n = N/N Ա, խլուրդ, որտեղ Ն- մասնիկների քանակը (ատոմներ, մոլեկուլներ), Ն Ա ≈ 6,02·10 23 – ատոմների թիվը 12 գրամ ածխածնի մեջ ( Ավոգադրոյի համարը) Թվային մ = Мr·10 -3, որտեղ Mr-ը նյութի հարաբերական մոլեկուլային զանգվածն է ( սեղան Մենդելեևը) (օրինակ՝ =2 կգ/կմոլ):
Հատուկ քանակությամբ (այսինքն՝ 1 կգ գազի համար) հավասարումը (1.2) կունենա ձև.
Որտեղ Ռ– հատուկ գազի հաստատուն, J/(kg K).
Եկեք բացատրենք կոնկրետ գազի հաստատունի ֆիզիկական նշանակությունը Ռ. Առաջին վիճակի համար (1.2) հավասարումը կգրվի , իսկ երկրորդ վիճակի համար՝ նույն ճնշման տակ – . Եկեք հանենք առաջինը երկրորդ հավասարումից և գտնենք, որ, այսինքն. Գազի հատուկ հաստատունը 1 կգ գազի կատարած աշխատանքն է, երբ այն տաքացվում է 1 աստիճանով մշտական ճնշման տակ։
Փորձարարական տվյալները ցույց են տալիս, որ իրական գազը ավելի մոտ է իդեալական գազին, այնքան ցածր է նրա խտությունը: Այլ կերպ ասած, ճնշման բարձրացման կամ ջերմաստիճանի նվազման հետևանքով առաջացած գազի տվյալ քանակի ծավալի նվազման դեպքում ցանկացած գազ ավելի ու ավելի մեծ շեղումներ կտա իդեալական գազի հատկություններից: Այսպիսով, «իդեալական գազ» հասկացությունը ներառում է բոլոր իրական գազերը բարձր ջերմաստիճաններում և ցածր ճնշումներում:
1.4. Խառնուրդներ իդեալական գազեր
Գործնականում աշխատանքային հեղուկը հաճախ միատարր գազերի խառնուրդ է (օրինակ՝ օդ), որոնցից յուրաքանչյուրը կարելի է իդեալական համարել և որոնք չեն փոխազդում միմյանց հետ։ քիմիական ռեակցիաներ.
Նման խառնուրդը նույնպես իդեալական գազ է և ենթարկվում է խառնուրդի վիճակի (1.2) հավասարմանը
Որտեղ R=R μ / μ - խառնուրդի գազի հաստատուն; մ – խառնուրդի միջին (թվացյալ) մոլային զանգվածը(պայմանական արժեք, որը վերաբերում է համասեռ ներկայացված գազին, որտեղ մոլեկուլների թիվը և ընդհանուր զանգվածը հավասար են մոլեկուլների թվին և խառնուրդի զանգվածին):
Խառնուրդի զանգվածը հավասար է բոլոր բաղկացուցիչ բաղադրիչների զանգվածին
Գազային խառնուրդի վարքագիծը որոշող հիմնական օրենքը Դալթոնի օրենքը:
Յուրաքանչյուր առանձին գազ գազային խառնուրդում իրեն պահում է այնպես, կարծես միայն այն, խառնուրդի ջերմաստիճանում, զբաղեցնում է խառնուրդի ամբողջ ծավալը,
Գազային խառնուրդի մեջ ներառված յուրաքանչյուր առանձին գազ ունի նույն ճնշումը, որը կունենար, եթե միայնակ զբաղեցներ գազային խառնուրդի ամբողջ ծավալը:
Այստեղից էլ արժեքը Ռ(խառնուրդի բացարձակ ճնշում) սահմանվում է որպես
Որտեղ Ռ ես – մասնակի ճնշում եսրդ բաղադրիչը, այսինքն. ճնշում, որը կունենար ես- բաղադրիչ, եթե այն միայնակ զբաղեցրեց խառնուրդի ամբողջ ծավալը նույն ջերմաստիճանում ():
Խառնուրդի բաղադրությունը նշվում է խառնուրդը կազմող բաղադրիչների զանգվածային կամ մոլային ֆրակցիաներով, ինչպես նաև ըստ ծավալային ֆրակցիաների (կոնցենտրացիաների):
Զանգվածային բաժինկոչվում է յուրաքանչյուր գազի զանգվածի հարաբերություն խառնուրդի ընդհանուր զանգվածին.
(1.3) հավասարումից հետևում է, որ .
Ծավալային բաժինկոչվում է հարաբերություն մասնակի ծավալը(այն ծավալը, որը կզբաղեցներ գազը, եթե նրա ճնշումը և ջերմաստիճանը հավասար լինեին գազային խառնուրդի ճնշմանն ու ջերմաստիճանին, այսինքն.) գազային խառնուրդի ընդհանուր ծավալին. Մասնակի ճնշման և ծավալի և հաստատուն ջերմաստիճանի սահմանումներից հետևում է.
![]() (1.5)
(1.5)
Ամփոփելով վերջին հավասարությունը խառնուրդի բոլոր բաղադրիչների նկատմամբ՝ մենք ստանում ենք, այսինքն. խառնուրդը կազմող գազերի մասնակի ծավալների գումարը հավասար է գազերի խառնուրդի ծավալին։
Ծավալային կոտորակների գումարը հավասար է մեկի՝ .
Խլուրդային բաժինբաղադրիչը յուրաքանչյուր գազի նյութի քանակի հարաբերակցությունն է n ես գազային խառնուրդում նյութի քանակին n. հարաբերություններից ու ու Ավոգադրոյի օրենքը(միևնույն ջերմաստիճաններում և ճնշումներում տեղակայված տարբեր իդեալական գազերի հավասար ծավալներում կա հավասար թվով մոլեկուլներ, այսինքն.) հետևում է.
դրանք. խառնուրդը մոլային ֆրակցիաներում նշելը համարժեք է դրա ծավալային ֆրակցիաները նշելուն:
Զանգվածային և ծավալային կոտորակները կապված են հարաբերություններով.
![]() .
.
Եթե խառնուրդը նշված է զանգվածային կոտորակներով է ես, ապա խառնուրդի գազի հաստատունը և խառնուրդի մոլային զանգվածը հաշվարկվում են հետևյալ կերպ.
![]()
![]()
Եթե խառնուրդը նշված է ծավալային ֆրակցիաներով r ես, ապա խառնուրդի մոլային զանգվածը և խառնուրդի գազային հաստատունը հաշվարկելու բանաձևերը հետևյալն են.
![]() (1.6)
(1.6)
Գազերի մասնակի ճնշումները և ծավալները որոշվում են Բոյլի օրենքը–Մարիոթ(գազի մշտական ջերմաստիճանում գազի ճնշման և դրա ծավալի արտադրյալը հաստատուն արժեք է, այսինքն).
![]() .
.
Վերահսկիչ հարցեր
Միավորների միջազգային համակարգը (SI) և դրա հիմնական միավորները:
Հիմնական թերմոդինամիկական պարամետրերը և դրանց չափերը:
Ի՞նչ է նշանակում թերմոդինամիկական համակարգի հավասարակշռության վիճակ:
Հավասարակշռության և ոչ հավասարակշռության հայեցակարգը.
Ո՞րն է համակարգի վիճակի հավասարումը:
Համակարգի վիճակի երկրաչափական մեկնաբանություն, թերմոդինամիկական գործընթաց։
Ի՞նչ է իդեալական գազը: Ո՞րն է տարբերությունը իդեալական գազի և իրական գազի միջև:
Ինչ է գազի հաստատունը: Դրա ֆիզիկական նշանակությունը, չափը և որոշման մեթոդները:
2. Ջերմային հզորություն
Ջերմության փոխանցումը աշխատող հեղուկին ցանկացած գործընթացում առաջացնում է նրա վիճակի փոփոխություն և ընդհանուր դեպքում ուղեկցվում է ջերմաստիճանի փոփոխությամբ։ Ջերմաստիճանի փոփոխությունը, ինչպես աշխատանքային հեղուկի վիճակի ցանկացած այլ պարամետր, կախված չէ գործընթացի տեսակից, այլ կախված է դրա սկզբնական ( 1 ) և վերջնական ( 2 ) պետություններ, այսինքն. (տարրական գործընթացի համար պարամետրի փոփոխությունը փոխարինվում է դրա դիֆերենցիալով):
Ջերմային քանակի հարաբերակցություն δ Քհաղորդվում է մարմնին մարմնի ջերմաստիճանի փոփոխությանը dTտարրական թերմոդինամիկական գործընթացում կոչվում է իրական ջերմային հզորությունմարմիններն այս գործընթացում.
Ստորագրությունն այստեղ ցույց է տալիս այն փաստը, որ ջերմային հզորությունը, ինչպես ջերմությունը, կախված է գործընթացի բնույթից: Բացի այդ, ջերմային հզորությունը կախված է մարմնի քանակից և նրա թերմոդինամիկ վիճակից: Հարկ է նաև նշել, որ այս գործընթացում մարմնի քիմիական բաղադրությունը չի փոխվում, չի լինում նյութի անցում ագրեգացիայի մի վիճակից մյուսին, չի լինում բաղադրիչների տարրալուծում և այլն։
Կախված նյութի քանակի ընտրված միավորից՝ առանձնանում են զանգվածը, ծավալը և մոլային հատուկ ջերմային հզորությունները.
Զանգվածային ջերմային հզորության հայեցակարգը առավել հաճախ օգտագործվում է գործնականում:
2.1. Իրական և միջին ջերմային հզորություններ
Իրական նյութի ջերմունակությունը հաստատուն արժեք չէ։ Այն փոխվում է ջերմաստիճանի հետ, և այդ կախվածությունը կարող է շատ զգալի լինել (նկ. 2.1):
Գործընթացի ջերմության հատուկ քանակությունը հաշվարկվում է բանաձևով
Այս արժեքը որոշելու համար օգտագործվում են հետևյալ մեթոդները.
Ըստ փորձարարական արդյունքների՝ ջերմային հզորության կախվածությունը ջերմաստիճանից ներկայացված է մոտավոր բազմանդամի տեսքով.
որտեղ են մոտարկման գործակիցները. Այս գործակիցները տրված են տեղեկատու գրականության մեջ: Հետո
ջերմաստիճանի տիրույթում գործնական հաշվարկներում տ 1 , տ 2 ջերմային հզորությունը համարվում է հաստատուն արժեք, որը հավասար է
որը կոչվում է միջին ջերմային հզորությունայս միջակայքում, ի տարբերություն (2.1) ներկայացված իրական ջերմային հզորության: Հղման տվյալները ապահովում են միջին ջերմային հզորություններ 0-ից մինչև ֆիքսված ջերմաստիճան տ, ստացված փորձարարական, այսինքն.
Միջին ջերմային հզորությունը ջերմաստիճանի միջակայքում տ 1 , տԱյս հղման տվյալներից 2-ը կարելի է հաշվարկել բանաձևով
Հետո կոնկրետ գումարգործընթացի ջերմությունը կորոշվի որպես
2.2. Իզոխորիկ և իզոբարային ջերմային հզորություններ
Թերմոդինամիկայի մեջ դրանք մեծ նշանակություն ունեն
իզոխորիկջերմային հզորություն
հավասար է հաստատուն ծավալով գործընթացում ջերմության քանակի հարաբերակցությանը մարմնի ջերմաստիճանի փոփոխությանը,
իզոբարիկջերմային հզորություն
հավասար է մշտական ճնշման գործընթացում ջերմության քանակի հարաբերակցությանը մարմնի ջերմաստիճանի փոփոխությանը:
Ջերմատեխնիկական հաշվարկներում օգտագործվում են աղյուսակներ, որոնք ներկայացնում են տարբեր նյութերի հատուկ իզոբարային և իզոխորային ջերմային հզորությունների փորձարարական ստացված թվային արժեքները՝ կախված ջերմաստիճանից:
2.3. Գազային խառնուրդների ջերմային հզորությունը
Հաշվարկելիս հաճախ պետք է գործ ունենալ գազերի խառնուրդների հետ, իսկ աղյուսակները ջերմային հզորություններ են տալիս միայն առանձին գազերի համար։
Եթե գազերի խառնուրդը նշված է զանգվածային կոտորակներով է ես, ապա խառնուրդի հատուկ զանգվածային ջերմային հզորությունները որոշվում են բանաձեւերով
![]()
Եթե գազերի խառնուրդը նշված է ծավալային կոտորակներով r ես, ապա խառնուրդի հատուկ ծավալային ջերմային հզորությունները որոշվում են բանաձեւերով
![]()
Վերահսկիչ հարցեր
Գրեք հատուկ ջերմային հզորության չափման միավորները:
Ինչպե՞ս է ներդրվում միջին ջերմային հզորության հայեցակարգը:
3. Էներգիայի պահպանման և փոխակերպման օրենքը
Էներգիայի հասկացությունը կապված է նյութի շարժման հետ։
Էներգիան կարող է ունենալ տարբեր ձևեր՝ մեխանիկական աշխատանք, ջերմություն, քիմիական էներգիա, էլեկտրական և մագնիսական էներգիա։
Թերմոդինամիկ գործընթացում շրջակա միջավայրի և փակ թերմոդինամիկական համակարգի փոխազդեցությունը տեղի է ունենում էներգիայի փոխանակման միջոցով ջերմության և մեխանիկական աշխատանքի տեսքով:
3.1. Ներքին էներգիա
Ցանկացած միջավայր որոշակի ռեզերվ ունի ներքին էներգիաU(J), որը տեխնիկական թերմոդինամիկայի մեջ ներկայացված է որպես միջավայրի մոլեկուլների և ատոմների կինետիկ և պոտենցիալ էներգիաների գումար։ Այս մասնիկների կինետիկ էներգիան որոշվում է դրանց արագությամբ և զանգվածով, պոտենցիալ էներգիան որոշվում է նրանց միջև փոխազդեցության ուժերով, որոնք կախված են նրանց հարաբերական դիրքից։ Համակարգի ներքին էներգիան ինքնին համակարգում պարունակվող էներգիան է: Սա նշանակում է, որ ներքին էներգիան կարող է բնութագրել մարմնի վիճակը քանակների հետ մեկտեղ Ռ, Վ, Տ.
Ներքին էներգիան ունի ավելացման հատկություն, այսինքն. Բարդ համակարգի ներքին էներգիան հավասար է նրա բաղկացուցիչ մասերի ներքին էներգիաների գումարին.
1 կգ նյութի ներքին էներգիան կոչվում է հատուկ ներքին էներգիա u= U/ մ (Ջ/կգ):
Թերմոդինամիկայի տեխնիկական կիրառությունների մեծ մասի համար կարևորը բացարձակ արժեքը չէ: U, և այս քանակի փոփոխությունը։ Հետևաբար, միատարր համակարգի ներքին էներգիայի քանակական որոշումը հաճախ որոշվում է որոշ պայմանականորեն ընտրված ստանդարտ վիճակի հետ կապված:
3.2. Էներգիայի պահպանման օրենքը թերմոդինամիկայի մեջ
Թերմոդինամիկական գործընթաց իրականացնելիս փակ համակարգը փոխազդում է արտաքին միջավայրի (արտաքին մարմինների և դաշտերի) հետ, այսինքն. էներգիա է փոխանակում. Տեխնիկական թերմոդինամիկայի մեջ դիտարկվում է էներգիայի փոխանցման երկու տեսակ՝ ջերմություն փոխանցելով և մեխանիկական աշխատանք կատարելով։
Ջերմության փոխանցումը տեղի է ունենում տարբեր ջերմաստիճաններ ունեցող և շփման մեջ գտնվող մարմինների միջև կամ հեռավորության վրա գտնվող տարբեր ջերմաստիճան ունեցող մարմինների միջև էլեկտրամագնիսական ալիքների միջոցով: ջերմային ճառագայթում) Հեռարձակում ջերմությունտեղի է ունենում մոլեկուլային (միկրոֆիզիկական) մակարդակում՝ առանց մարմինների տեսանելի շարժման։
Աշխատանքի տեսքով էներգիայի փոխանցումը տեղի է ունենում ամբողջ մարմնի կամ դրա մի մասի տեղաշարժով տարածության մեջ: Այս մեթոդով մարմինը կամ շարժվում է ուժային դաշտում, կամ փոխում է իր ծավալը արտաքին ճնշման ազդեցության տակ։ Աշխատանքէներգիայի փոխանցման մակրոֆիզիկական ձև է:
Հարկ է նշել, որ ջերմությունը և աշխատանքը, ի տարբերություն մարմնի էներգիայի, նրա վիճակի գործառույթ չեն, այլ կախված են գործընթացի տեսակից և որոշում են այս գործընթացը, այսինքն. գործընթացի գործառույթներն են:
Բազմաթիվ փորձեր և դիտարկումներ հանգեցրին բնության հիմնարար օրենքի՝ էներգիայի պահպանման օրենքի բացահայտմանը. բնության մեջ էներգիան ոչնչից չի առաջանում և չի անհետանում,կամ էներգիայի քանակը հաստատուն է, այն փոխվում է միայն մի ձևից մյուսը,կամ
Որտեղ Ք- գործընթացում ներգրավված ջերմություն; Լ- կատարված աշխատանք; Դ Ե- համակարգի էներգիայի փոփոխություն. Այստեղ և հետագայում մենք համաձայնում ենք հաշվարկել.
աշխատանք դրական, եթե այս աշխատանքը կատարվում է աշխատանքային հեղուկով, և բացասական, եթե աշխատանք է կատարվում համակարգի աշխատանքային հեղուկի վրա.
մարմնին մատակարարվող ջերմություն - դրական, իսկ հատկացվածը՝ բացասական,
Բացի այդ, վերջնական գործընթացում ցանկացած վիճակի պարամետրի փոփոխությունը կնշանակվի Δ (դելտա) նշանով, իսկ տարրական գործընթացում՝ դ(համապատասխան պարամետրի դիֆերենցիալ): Ցանկացած վերջավոր թերմոդինամիկական գործընթացի դեպքում վիճակի պարամետրի փոփոխությունը (ճնշում, ջերմաստիճան, ներքին էներգիա, էնթալպիա, էնտրոպիա և այլն) կախված չէ պրոցեսի տեսակից, այլ որոշվում է նախնական և վերջնական վիճակով։
Ընդհանուր առմամբ, թերմոդինամիկական համակարգն ունի ներքին էներգիա U, կինետիկ էներգիա (թերմոդինամիկայի մեջ համակարգը դիտվում է որպես արագությամբ շարժվող ամբողջություն w) – մվտ 2/2, պոտենցիալ – մգզ (զ- բարձրությունը, որի վրա գտնվում է համակարգը): Ընթացքի ընթացքում ընդհանուր էներգիայի փոփոխություն 1 –2 կարող է ներկայացվել որպես.
Այս գործընթացում կատարված աշխատանքը բաղկացած է աշխատանքից Լմասին, կապված համակարգի աշխատանքային հեղուկի ծավալի փոփոխության հետ (դեֆորմացիոն աշխատանք), աշխատ Լ dv համակարգը տարածության մեջ տեղափոխելու մասին, տեխնիկական աշխատանքԴրանք (համակարգը տարբեր տեխնիկական սարքերով տեղափոխելիս, օրինակ՝ շարժիչում, գոլորշու կաթսայում, կոմպրեսորում և այլն), աշխատում են շփման ուժերի դեմ։ Լ tr:
L = L rev + L dv + L tech + L tr.
Գործընթացում ներգրավված ջերմությունը ջերմության գումարն է Քարտաքին, ներգրավված արտաքին միջավայրի հետ փոխանակման և շփման ջերմության հետ Ք tr:
Ք = Քարտաքին + Ք tr.
Հաշվի առնելով դա Ք tr = Լ tr (բազմաթիվ փորձեր ցույց են տվել, որ շփման հաղթահարման վրա ծախսվող հոսքի աշխատանքն ամբողջությամբ վերածվում է հոսքի միջոցով ընկալվող ջերմության), էներգիայի պահպանման օրենքը թերմոդինամիկայի մեջ 1 կգ աշխատող միատարր նյութի համար (այսինքն՝ որոշակի զանգվածային քանակությամբ) տարրական գործընթացում կարելի է գրել.
![]() , (3.1)
, (3.1)
(արտաքին ինդեքսը բաց է թողնվել որպես ավելորդ):
Հարկ է ընդգծել, որ (3.1)-ի աջ կողմում դիֆերենցիալ նշանի տակ դրված են վիճակային ֆունկցիաներ, իսկ մնացածը մեծություններ են, որոնք կախված են թերմոդինամիկական գործընթացի բնույթից։ Քանի որ աշխատանքը և ջերմությունը գործընթացի գործառույթներ են, և ոչ թե վիճակի գործառույթներ, δ նշանը միայն ցույց է տալիս այն փաստը, որ տարրական գործընթացում դրան հաջորդող մեծությունները կամայական անվերջ փոքր են, և ոչ թե որևէ կոնկրետ ֆունկցիայի ավելացում: Այսպիսով, դ քև դ լ– տարրական (այսինքն՝ համակարգի վիճակի անվերջ փոքր փոփոխությունների համապատասխան) ջերմության և աշխատանքի քանակները։
Եթե թերմոդինամիկական համակարգը չի փոխում իր դիրքը տարածության մեջ, և աշխատանքի միակ տեսակն այն աշխատանքն է, որը կապված է համակարգի ծավալի փոփոխության հետ, ապա (3.1) հավասարումը ստանում է ավելի պարզ ձև.
Աշխատանք դ լմասին կատարվում է կամ արտաքին ճնշման ուժերի դեմ, և այնուհետև աշխատանքային հեղուկի ծավալը մեծանում է, կամ, ընդհակառակը, արտաքին միջավայրը գործում է մարմնի վրա՝ սեղմելով այն։ Հավասարակշռության գործընթացների համար, երբ միջավայրի ճնշումը հավասար է աշխատանքային հեղուկի ճնշմանը, այս աշխատանքը հաշվարկվում է որպես. Ռdv, Որտեղ v- աշխատանքային նյութի հատուկ ծավալը.
Հավասարումը
կանչեց Թերմոդինամիկայի առաջին օրենքը. հանգստի վիճակում փակ թերմոդինամիկական համակարգին մատակարարվող ջերմությունը ծախսվում է համակարգի ներքին էներգիան փոխելու և համակարգի ծավալը փոխելու աշխատանքներ կատարելու համար։. Հաշվեկշռային հարաբերությունը (3.2) կոչվում է նաև դասախոսություններ Ըստտեսական գրական քննադատություն։ 1. Բարոկկո՝ ...
Լ. Ա. Էլիզեևա © Գիտության դաշնային պետական բյուջետային հաստատություն ՌԱՍ-ի Սիբիրյան մասնաճյուղի պետական հանրային գիտատեխնիկական գրադարան (GPNTB RAS-ի հետ), 2013 թ.
ՑուցիչՊատահական զբոսանքներ / A. N. Բորոդին, I. A. Ibragimov; տակ... 241. Դորոգոկուպեց Պ.Ի. Թերմոդինամիկամիներալներ և հանքային հավասարակշռություն... կատալոգներ՝ վերացական դասախոսություններ Ըստդասընթաց «Տեղեկանք... պետ տեխնիկականհամալսարան. Սերիա, Տեխնիկականգիտություններ. -...
Ն.Վ.Բասովա [և ուրիշներ]; խմբ. Ն.Վ.Բասովա. Ռոստով n/a: Phoenix, 2008 թ
ԴասագիրքԴասընթաց) Գրավոր D.T. նշումներ դասախոսություններ Ըստբարձրագույն մաթեմատիկա [Text]: ... Տեխնիկական թերմոդինամիկա Rudobashta, S.P. Ջերմային ճարտարագիտություն [Տեքստ]: Դասագիրք ուսանողների համար: սովորող համալսարանները Ըստ... 2008. - 204 էջ. 10 Բորոդին, I. F. Տեխնոլոգիական գործընթացների ավտոմատացում...
Գանձապետարանի 2008 թվականից մինչև 2013 թվականի հունիսի 1-ը ընկած ժամանակահատվածի գիտական աշխատանքների ցանկը (1)
Փաստաթուղթ... «Ռենտգեն հետազոտության մեթոդներ». Դասախոսություններ Ըստկլինիկական ուռուցքաբանություն. Ալմաթի... երկրորդ օրենք թերմոդինամիկա» 2-Միջազգային... եւ փորձագիտական վերանայում տեխնիկականառողջապահական կազմակերպությունների վերազինում... Ռուսաստանի բժշկական գիտությունների ակադեմիայի ակադեմիկոս Յու.Ի. Բորոդին, Բիշքեկ, 2009, Պ. ...
Ինժեներական պրակտիկայում մենք հաճախ գործ ունենք ոչ թե միատարր գազերի, այլ քիմիապես անկապ գազերի խառնուրդների հետ։ Գազային խառնուրդների օրինակներ են՝ մթնոլորտային օդը, բնական գազը, վառելիքի այրման գազային արտադրանքները և այլն։
Գազային խառնուրդների նկատմամբ կիրառվում են հետևյալ դրույթները.
1. Խառնուրդի մեջ ներառված յուրաքանչյուր գազ ունի ջերմաստիճան հավասար է ջերմաստիճանինխառնուրդներ.
2. Խառնուրդի մեջ ընդգրկված գազերից որևէ մեկը տարածվում է խառնուրդի ամբողջ ծավալով և, հետևաբար, յուրաքանչյուր գազի ծավալը հավասար է ամբողջ խառնուրդի ծավալին:
3. Խառնուրդի մեջ ընդգրկված գազերից յուրաքանչյուրը ենթարկվում է վիճակի իր հավասարմանը։
4. Խառնուրդն ամբողջությամբ նման է նոր գազի և ենթարկվում է նրա վիճակի հավասարմանը:
Գազային խառնուրդների ուսումնասիրությունը հիմնված է Դալթոնի օրենքի վրա, ըստ որի, հաստատուն ջերմաստիճանում խառնուրդի ճնշումը հավասար է խառնուրդի մեջ ներառված գազերի մասնակի ճնշումների գումարին.
որտեղ p սմ-ը խառնուրդի ճնշումն է.
p i - խառնուրդի մեջ ներառված i-րդ գազի մասնակի ճնշումը.
n-ը խառնուրդի մեջ ներառված գազերի թիվն է:
Մասնակի է այն ճնշումը, որը կգործադրի խառնուրդ մտնող գազը, եթե այն միայնակ զբաղեցնի խառնուրդի ամբողջ ծավալը նույն ջերմաստիճանում:
Գազային խառնուրդների հստակեցման մեթոդներ
Գազային խառնուրդի բաղադրությունը կարելի է ճշտել ըստ զանգվածի, ծավալի և մոլային ֆրակցիաների:
Զանգվածային կոտորակներ. Խառնուրդի մեջ ընդգրկված ցանկացած գազի զանգվածային բաժինը այս գազի զանգվածի և խառնուրդի զանգվածի հարաբերակցությունն է:
m 1 = M 1 / M սմ; m 2 = M 2 / M սմ; ..........; m n = M n / M սմ,
որտեղ m 1, m 2, ..., m n գազերի զանգվածային բաժիններն են.
M 1, M 2, ..., M n - առանձին գազերի զանգվածներ;
M սմ-ը խառնուրդի զանգվածն է։
Դժվար չէ դա տեսնել  Եվ
Եվ  (100%).
(100%).
Ծավալային կոտորակներ.Խառնուրդի մեջ ընդգրկված ցանկացած գազի ծավալային բաժինը այս գազի կրճատված (մասնակի) ծավալի հարաբերակցությունն է խառնուրդի ծավալին:
r 1 = V 1 / V սմ; r 2 = V 2 / V սմ; ........., r n = V n / V սմ;
որտեղ V 1, V 2, ..., V n - գազերի կրճատված ծավալներ;
V սմ - խառնուրդի ծավալը;
r 1, r 2, ..., r n - գազերի ծավալային բաժիններ:
Տրված ծավալը գազի ծավալն է խառնուրդի պայմաններում (խառնուրդի ջերմաստիճանում և ճնշման դեպքում)։
Կրճատված ծավալը կարելի է ներկայացնել հետևյալ կերպ. եթե խառնուրդը պարունակող անոթից հանվում են բոլոր գազերը, բացի մեկից, իսկ մնացած գազը սեղմվում է խառնուրդի ճնշման տակ՝ պահպանելով ջերմաստիճանը, ապա դրա ծավալը կնվազի կամ մասնակի:
Կարելի է ապացուցել, որ խառնուրդի ծավալը հավասար կլինի գազերի տրված ծավալների գումարին։
 (100%).
(100%).
Խլուրդային ֆրակցիաներ.Խառնուրդի մեջ ընդգրկված ցանկացած գազի մոլային բաժինը այս գազի կիլոմոլների քանակի և խառնուրդի կիլոմոլների քանակի հարաբերակցությունն է:
r 1 = n 1 / n սմ; r 2 = n 2 / n սմ; ........., r n = n n / n սմ,
որտեղ r 1, r 2, ..., r n գազերի մոլային բաժիններն են.
n սմ-ը խառնուրդի կիլոմոլների թիվն է.
n 1, n 2, ..., n n - գազերի կիլոմոլների քանակը:
Խլուրդային ֆրակցիաներում խառնուրդ նշելը նույնական է ծավալային ֆրակցիաներում խառնուրդ նշելուն, այսինքն. մոլային և ծավալային ֆրակցիաներն ունեն նույն թվային արժեքները խառնուրդի մեջ ներառված յուրաքանչյուր գազի համար:
Գազի մշտական և խառնուրդի ակնհայտ (միջին) մոլեկուլային քաշը:Զանգվածային կոտորակներով նշված գազային հաստատուն խառնուրդը հաշվարկելու համար մենք գրում ենք վիճակի հավասարումները.
խառնուրդի համար
p սմ × V սմ = M սմ R սմ T; (1.9)
գազերի համար
 .
(1.10)
.
(1.10)
Եկեք ամփոփենք հավասարումների ձախ և աջ կողմերը (1.10)
(p 1 + p 2 + .... + p n) V սմ = (M 1 R 1 + M 2 R 2 + ..... + M n R n) Տ.
Որովհետեւ  ,
,
ապա p սմ V սմ = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
(1.9) և (1.11) հավասարումներից հետևում է, որ
M սմ R սմ T = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm = M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n =
M 1 R 1 + m 2 R 2 + ...... + m n R n
կամ  ,
(1.12)
,
(1.12)
որտեղ R սմ-ը խառնուրդի գազի հաստատունն է:
Քանի որ i-րդ գազի գազի հաստատունը
R i = 8314 / մ i,
ապա հավասարումը (1.12) կվերաշարադրվի հետևյալ կերպ.
 .
(1.13)
.
(1.13)
Գազային խառնուրդի պարամետրերը որոշելիս հարմար է օգտագործել որոշակի պայմանական արժեք, որը կոչվում է գազային խառնուրդի ակնհայտ (միջին) մոլեկուլային քաշ: Խառնուրդի ակնհայտ մոլեկուլային քաշի հայեցակարգը թույլ է տալիս պայմանականորեն դիտարկել խառնուրդը որպես միատարր գազ, ինչը զգալիորեն հեշտացնում է հաշվարկները։
Անհատական գազի համար վավեր է հետևյալ արտահայտությունը.
Ըստ անալոգիայի, խառնուրդի համար մենք կարող ենք գրել
մ սմ R սմ = 8314, (1.14)
որտեղ m սմ-ը խառնուրդի ակնհայտ մոլեկուլային քաշն է:
(1.14) հավասարումից, օգտագործելով (1.12) և (1.13) արտահայտությունները, մենք ստանում ենք.
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Այս կերպ պատճառաբանելով՝ կարելի է ստանալ Rcm և mcm ծավալային կոտորակների միջոցով հաշվարկելու բանաձևեր, զանգվածային բաժինները ծավալային կոտորակների և, ընդհակառակը, ծավալային բաժինները զանգվածային կոտորակների վերածելու բանաձևեր, խառնուրդի հատուկ ծավալը հաշվարկելու բանաձևեր u սմ և խառնուրդի խտությունը r սմ զանգվածային և ծավալային կոտորակների միջոցով և, վերջապես, խառնուրդում ընդգրկված գազերի մասնակի ճնշումների հաշվարկման բանաձևերը ծավալային և զանգվածային բաժինների միջոցով: Այս բանաձևերը ներկայացնում ենք աղյուսակում՝ առանց ածանցյալի:
Գազային խառնուրդների հաշվարկման բանաձևեր
|
Խառնուրդի կազմի կարգավորում |
Տեղափոխում մի կազմից մյուսը |
Խառնուրդի խտությունը և հատուկ ծավալը |
Խառնուրդի ակնհայտ մոլեկուլային քաշը |
Խառնուրդի գազային հաստատուն |
Մասնակի ճնշում |
|
Զանգվածային կոտորակներ |
|
|
|
|
|
|
Ծավալային կոտորակներ |
|
|
|
|
|
Գազերի ջերմային հզորությունը
Մարմնի ջերմունակությունը ջերմության քանակությունն է, որն անհրաժեշտ է մարմինը 1 Կ-ով տաքացնելու կամ հովացնելու համար: Նյութի միավոր քանակի ջերմունակությունը կոչվում է հատուկ ջերմային հզորություն:
Այսպիսով, նյութի հատուկ ջերմային հզորությունը ջերմության քանակն է, որը պետք է ավելացվի կամ հանվի նյութի միավորից, որպեսզի տվյալ գործընթացում նրա ջերմաստիճանը փոխվի 1 Կ-ով:
Քանի որ ապագայում կդիտարկվեն միայն հատուկ ջերմային հզորությունները, մենք պարզապես կկոչենք հատուկ ջերմային հզորություն ջերմային հզորություն:
Գազի քանակը կարելի է ճշտել ըստ զանգվածի, ծավալի և կիլոմոլների քանակի։ Հարկ է նշել, որ գազի ծավալը նշելիս այդ ծավալը բերվում է նորմալ պայմանների և չափվում նորմալ խորանարդ մետրով (նմ 3):
Կախված գազի քանակի որոշման եղանակից՝ առանձնանում են հետևյալ ջերմային հզորությունները.
с - զանգվածային ջերմային հզորություն, J/ (kg×K);
с¢ - ծավալային ջերմային հզորություն, J/ (nm 3 ×K);
c m-ը մոլային ջերմային հզորությունն է, J/(kmol ×K):
Անվանված ջերմային հզորությունների միջև գոյություն ունեն հետևյալ կախվածությունները.
c = c m / m; c m = c × m;
c¢ = c m / 22.4; m = с¢ × 22,4,
այստեղից  ; c¢ = c × r n,
; c¢ = c × r n,
որտեղ u n և r n-ը հատուկ ծավալն ու խտությունն են նորմալ պայմաններում:
Իզոխորիկ և իզոբարային ջերմային հզորություններ
Աշխատանքային հեղուկին փոխանցվող ջերմության քանակը կախված է թերմոդինամիկական գործընթացի բնութագրերից: Կախված թերմոդինամիկ գործընթացից գործնական նշանակություն ունեն ջերմային հզորության երկու տեսակ՝ իզոխորիկ և իզոբարային։
Ջերմային հզորությունը u = const-ում իզոխորիկ է:
c u - զանգվածային իզոխորիկ ջերմային հզորություն,
գ¢ u- ծավալային իզոխորիկ ջերմային հզորություն,
սմ u- մոլային իզոխորիկ ջերմային հզորություն:
Ջերմային հզորությունը p = const-ում իզոբար է:
c р - զանգվածային իզոբար ջերմային հզորություն,
c¢ р - ծավալային իզոբար ջերմային հզորություն,
c m р - մոլային իզոբարային ջերմային հզորություն:
p=const-ում իրականացվող պրոցեսի նույն ջերմաստիճանի փոփոխությամբ ավելի շատ ջերմություն է սպառվում, քան u=const-ի գործընթացում: Սա բացատրվում է նրանով, որ u=const-ում մարմնին հաղորդվող ջերմությունը ծախսվում է միայն նրա ներքին էներգիան փոխելու վրա, մինչդեռ p=const-ում ջերմությունը ծախսվում է ինչպես ներքին էներգիան ավելացնելու, այնպես էլ ընդլայնման աշխատանք կատարելու վրա։ Զանգվածային իզոբարային և զանգվածային իզոխորային ջերմային հզորությունների տարբերությունը ըստ Մայերի հավասարման
գ ռ - գ u=Ռ. (1.17)
Եթե (1.17) հավասարման ձախ և աջ կողմերը բազմապատկվեն m կիլոմոլային զանգվածով, մենք ստանում ենք.
c m r - c m u= 8314 J/(kmol×K) (1.18)
Թերմոդինամիկայի և դրա կիրառության մեջ մեծ նշանակություն ունի իզոբար և իզոխորային ջերմային հզորությունների հարաբերակցությունը.
 ,
(1.19)
,
(1.19)
որտեղ k-ն ադիաբատիկ ցուցիչն է:
Հաշվարկները ցույց են տալիս, որ միատոմ գազերի դեպքում այն մոտավորապես կարող է ընդունվել մինչև » 1,67, երկատոմային գազերի համար՝ » 1,4, եռատոմային գազերի համար՝ » 1,29:
Հեշտ է հասկանալ, որ իմաստը Դեպիկախված է ջերմաստիճանից. Իսկապես, (1.17) և (1.19) հավասարումներից հետևում է, որ
 ,
(1.20)
,
(1.20)
և (1.18) և (1.19) հավասարումներից
 .
(1.21)
.
(1.21)
Քանի որ ջերմային հզորությունը մեծանում է գազի ջերմաստիճանի բարձրացման հետ, k-ի արժեքը նվազում է՝ մոտենալով միասնությանը, բայց միշտ մնում է դրանից ավելի մեծ։
Իմանալով k-ի արժեքը՝ կարող ենք որոշել համապատասխան ջերմային հզորության արժեքը։ Այսպիսով, օրինակ, (1.20) հավասարումից ունենք
 ,
(1.22)
,
(1.22)
և որովհետև c p = k × c u, ապա մենք ստանում ենք
 .
(1.23)
.
(1.23)
Նմանապես, մոլային ջերմային հզորությունների համար (1.21) մենք ստանում ենք
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Միջին և իրական ջերմային հզորություն
Գազերի ջերմունակությունը կախված է ջերմաստիճանից և որոշ չափով ճնշումից։ Ջերմային հզորության կախվածությունը ճնշումից փոքր է և անտեսված է շատ հաշվարկներում: Ջերմային հզորության կախվածությունը ջերմաստիճանից զգալի է և պետք է հաշվի առնել: Այս կախվածությունը բավականին ճշգրիտ արտահայտված է հավասարմամբ
c = a + Վ t + et 2, (1.26)
որտեղ ա, Վիսկ e-ն արժեքներ են, որոնք հաստատուն են տվյալ գազի համար:
Հաճախ ջերմային ճարտարագիտության հաշվարկներում ոչ գծային կախվածությունը (1.26) փոխարինվում է գծայինով.
c = a + Վտ. (1.27)
|
Եթե ջերմային հզորության կախվածությունը ջերմաստիճանից գրաֆիկորեն գծենք ըստ (1.26) հավասարման, ապա դա կլինի կորագիծ կախվածություն (նկ. 1.4): Ինչպես ցույց է տրված նկարում, յուրաքանչյուր ջերմաստիճանի արժեք ունի իր ջերմային հզորության արժեքը, որը սովորաբար կոչվում է իրական ջերմային հզորություն: Մաթեմատիկորեն իրական ջերմային հզորության արտահայտությունը կգրվի հետևյալ կերպ.
|
|
|
|
Հետևաբար, իրական ջերմային հզորությունը dq ջերմության անվերջ փոքր քանակի հարաբերակցությունն է dt ջերմաստիճանի անվերջ փոքր փոփոխությանը: Այլ կերպ ասած, իրական ջերմային հզորությունը գազի ջերմային հզորությունն է տվյալ ջերմաստիճանում: Նկ. 1.4, t 1 ջերմաստիճանում իրական ջերմային հզորությունը նշվում է t1-ով և պատկերված է 1-4 հատվածով, t 2 ջերմաստիճանում `t2-ով և պատկերված է 2-3 հատվածով: (1.28) հավասարումից ստանում ենք dq = cdt. (1.29) Գործնական հաշվարկներում նրանք միշտ որոշում են վերջնական փոփոխության պատճառով ջերմության քանակը |
ջերմաստիճանը. Ակնհայտ է, որ ջերմության q քանակությունը, որը տրվում է նյութի միավորի քանակին, երբ այն տաքացվում է t 1-ից մինչև t 2, կարելի է գտնել (1.29) t 1-ից t 2 ինտեգրելով:
 .
(1.30)
.
(1.30)
Գրաֆիկորեն ինտեգրալը (1.30) արտահայտվում է 4-1-2-3 տարածքով։ Եթե իրական ջերմային հզորության արժեքը փոխարինենք արտահայտությամբ (1.30) ըստ գծային կախվածության (1.27), ապա կստանանք.
 (1.31)
(1.31)
Որտեղ  - միջին ջերմային հզորությունը t 1-ից t 2 ջերմաստիճանի միջակայքում:
- միջին ջերմային հզորությունը t 1-ից t 2 ջերմաստիճանի միջակայքում:
 ,
(1.32)
,
(1.32)
Հետևաբար, միջին ջերմային հզորությունը ջերմության q վերջնական քանակի հարաբերակցությունն է վերջնական ջերմաստիճանի փոփոխությանը t 2 - t 1:
 .
(1.33)
.
(1.33)
Եթե 4-3-ի հիման վրա (նկ. 1.4) կառուցենք 4-1¢-2¢-3 ուղղանկյուն, որն իր չափերով հավասար է 4-1-2-3 նկարին, ապա այս ուղղանկյան բարձրությունը հավասար կլինի: միջին ջերմային հզորությանը, որտեղ  գտնվում է t 1 - t 2 ջերմաստիճանի միջակայքում:
գտնվում է t 1 - t 2 ջերմաստիճանի միջակայքում:
Սովորաբար, միջին ջերմային հզորությունների արժեքները տրված են նյութերի ջերմադինամիկական հատկությունների աղյուսակներում: Այնուամենայնիվ, այս աղյուսակների ծավալը նվազեցնելու համար դրանք տրամադրում են միջին ջերմային հզորությունների արժեքները, որոնք որոշվում են ջերմաստիճանի միջակայքում 0 o C-ից մինչև t o C:
Եթե անհրաժեշտ է հաշվարկել միջին ջերմային հզորության արժեքը տվյալ ջերմաստիճանային միջակայքում t 1 - t 2, ապա դա կարելի է անել հետևյալ կերպ.
C = f(t) կորի տակ գտնվող 0a14 տարածքը (նկ. 1.4) համապատասխանում է q 1 ջերմության քանակին, որն անհրաժեշտ է գազի ջերմաստիճանը 0 o C-ից t 1 o C բարձրացնելու համար:

Նմանապես, 0a23 տարածքը համապատասխանում է q 2-ին, քանի որ ջերմաստիճանը բարձրանում է 0 o C-ից մինչև t 2 o C:

Այսպիսով, q = q 2 - q 1 (տարածքը 4123) կարող է ներկայացվել որպես
![]() (1.34)
(1.34)
Փոխարինելով q-ի արժեքը ըստ (1.34) արտահայտության (1.33), մենք ստանում ենք միջին ջերմային հզորության բանաձևը ցանկացած ջերմաստիճանի միջակայքում.
 .
(1.35)
.
(1.35)
Այսպիսով, միջին ջերմային հզորությունը կարելի է հաշվարկել աղյուսակային միջին ջերմային հզորություններից՝ օգտագործելով (1.35) հավասարումը: Ավելին, մենք ստանում ենք ոչ գծային կախվածություն c = f(t): Կարող եք նաև գտնել միջին ջերմային հզորությունը՝ օգտագործելով (1.32) հավասարումը, օգտագործելով գծային հարաբերություն: Արժեքներ ա և Վ(1.32) տարբեր գազերի համար տրված են գրականության մեջ:
Աշխատանքային հեղուկից մատակարարվող կամ հեռացվող ջերմության քանակը կարելի է հաշվարկել՝ օգտագործելով հետևյալ հավասարումները.
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
Որտեղ 

 - համապատասխանաբար միջին զանգվածային, ծավալային և մոլային ջերմային հզորություններ. M-ը գազի զանգված է; n-ը գազի կիլոմոլների թիվն է. V n - նորմալ պայմաններում գազի ծավալը:
- համապատասխանաբար միջին զանգվածային, ծավալային և մոլային ջերմային հզորություններ. M-ը գազի զանգված է; n-ը գազի կիլոմոլների թիվն է. V n - նորմալ պայմաններում գազի ծավալը:
Գազի ծավալը Vn կարելի է գտնել հետևյալ կերպ. Գրելով վիճակի հավասարումը տվյալ պայմանների համար՝ pV = MRT և նորմալ պայմանների համար՝ p n V n = MRT n, մենք երկրորդ հավասարումը կապում ենք առաջինի հետ.
 ,
,
այստեղից  .
(1.39)
.
(1.39)
Գազային խառնուրդների ջերմային հզորությունը
Գազային խառնուրդի ջերմային հզորությունը կարող է հաշվարկվել, եթե տրված է խառնուրդի բաղադրությունը և հայտնի են խառնուրդում ներառված բաղադրիչների ջերմային հզորությունները։
M սմ զանգվածի խառնուրդը 1K-ով տաքացնելու համար յուրաքանչյուր բաղադրիչի ջերմաստիճանը նույնպես պետք է ավելացվի 1K-ով։ Այս դեպքում խառնուրդի i-րդ բաղադրիչը M i զանգվածով տաքացնելու համար պահանջվում է ջերմության քանակություն, որը հավասար է c i M i-ին: Ամբողջ խառնուրդի համար ջերմության քանակը  ,
,
որտեղ c i և c սմ են i-րդ բաղադրիչի և խառնուրդի զանգվածային ջերմային հզորությունները:
Վերջին արտահայտությունը M սմ-ով բաժանելով՝ ստանում ենք խառնուրդի զանգվածային ջերմային հզորության հաշվարկման բանաձևը.
 ,
(1.40)
,
(1.40)
որտեղ m i-ը i-րդ բաղադրիչի զանգվածային բաժինն է:
Նմանապես պատճառաբանելով՝ մենք գտնում ենք խառնուրդի ծավալը c¢ սմ և մոլային c m սմ ջերմունակությունը.
 (1.41)
(1.41)
որտեղ c¢ i-ը i-րդ բաղադրիչի ծավալային ջերմունակությունն է, r i-ը i-րդ բաղադրիչի ծավալային բաժինն է,
 ,
(1.42)
,
(1.42)
որտեղ c m i-ը i-րդ բաղադրիչի մոլային ջերմային հզորությունն է,
r i-ն i-րդ բաղադրիչի մոլային (ծավալային) բաժինն է:
Ջերմային շարժիչներում (մեքենաներում) աշխատանքային հեղուկը տարբեր գազերի խառնուրդ է։ Եթե խառնուրդի բաղադրիչները միմյանց հետ քիմիական ռեակցիաների մեջ չեն մտնում, և յուրաքանչյուր բաղադրիչ ենթարկվում է Կլայպերոնի վիճակի հավասարմանը, ապա այդպիսի խառնուրդը համարվում է իդեալական գազ։
Խառնուրդը հաշվարկելու համար անհրաժեշտ է որոշել μ սմ - միջին մոլային զանգվածը և Rc m - խառնուրդի հատուկ գազային հաստատունը: Դրանք որոշելու համար անհրաժեշտ է իմանալ խառնուրդի բաղադրությունը, այսինքն՝ որ բաղադրիչները և ինչ քանակությամբ են կազմում այս խառնուրդը, ինչ պարամետրեր ունի խառնուրդի մեջ ներառված յուրաքանչյուր բաղադրիչ։
Խառնուրդի յուրաքանչյուր բաղադրիչ իրեն պահում է այնպես, կարծես խառնուրդում այլ գազեր չկան, զբաղեցնում է ողջ հասանելի ծավալը, որում գտնվում է խառնուրդը, հետևում է վիճակի իր հավասարմանը և գործադրում է իր այսպես կոչված մասնակի ճնշումը պատերի վրա, մինչդեռ ջերմաստիճանը խառնուրդի բոլոր բաղադրիչների խառնուրդի ջերմաստիճանը նույնն է և հավասար:
Համաձայն Դալթոնի օրենքի՝ P խառնուրդի ճնշումը հավասար է խառնուրդի մեջ ներառված առանձին բաղադրիչների մասնակի ճնշումների գումարին.
որտեղ n-ը խառնուրդի բաղադրիչների քանակն է:
Համաձայն Ամագի օրենքի՝ V խառնուրդի ծավալը հավասար է խառնուրդի մեջ ներառված առանձին բաղադրիչների մասնակի ծավալների գումարին խառնուրդի ջերմաստիճանում և ճնշման դեպքում.
 , (1.21)
, (1.21)
որտեղ է մասնակի ծավալը, m3; V - խառնուրդի ծավալը, մ 3
Խառնուրդի բաղադրությունը նշվում է ծավալային (մոլային) կամ զանգվածային ֆրակցիաներով։
i-րդ բաղադրիչի ծավալային բաժինբաղադրիչի մասնակի ծավալի հարաբերությունն է խառնուրդի ծավալին, այսինքն, ապա խառնուրդի բաղադրիչների ծավալային ֆրակցիաների գումարը հավասար է 1-ի, այսինքն. Եթե արժեքը նշված է %-ով, ապա դրանց գումարը = 100%:
i-րդ բաղադրիչի մոլային բաժինը n i N i բաղադրիչի կիլոմոլների քանակի հարաբերությունն է N խառնուրդի կիլոմոլների թվին, այսինքն. ![]() , , այսինքն՝ յուրաքանչյուր բաղադրիչի և ամբողջ խառնուրդի կիլոմոլների թիվը հավասար է բաղադրիչի մեկ կիլոմոլի զբաղեցրած ծավալի և ամբողջ խառնուրդի հարաբերակցությանը։
, , այսինքն՝ յուրաքանչյուր բաղադրիչի և ամբողջ խառնուրդի կիլոմոլների թիվը հավասար է բաղադրիչի մեկ կիլոմոլի զբաղեցրած ծավալի և ամբողջ խառնուրդի հարաբերակցությանը։
Հաշվի առնելով, որ միևնույն պայմաններում իդեալական գազն ունի նույն կիլոմոլի ծավալը, ապա փոխարինումից հետո մենք ստանում ենք հետևյալը.
i-րդ բաղադրիչի զանգվածային բաժինը- սա բաղադրիչի զանգվածի հարաբերակցությունն է խառնուրդի զանգվածին. , հետևում է, որ խառնուրդի զանգվածը հավասար է բաղադրիչների զանգվածների գումարին, ինչպես նաև բաղադրիչների զանգվածային բաժինների գումարին. հավասար է 1-ի (կամ 100%)։
Ծավալային կոտորակների փոխարկումը զանգվածային կոտորակների և հակառակը կատարվում է հետևյալ հարաբերակցությունների հիման վրա.
![]() ,
,
որտեղ ρ = μ/22,4, կգ/մ 3:
Հետևում է, որ i-րդ բաղադրիչի զանգվածային բաժինը կորոշվի հարաբերությունից.
 ,
,
որտեղ է խառնուրդի խտությունը, կգ/մ 3, և i-րդ բաղադրիչի ծավալային բաժինն է:
Հետագայում այն կարող է որոշվել ծավալային ֆրակցիաների միջոցով։
 .
.
Խտությունխառնուրդ ծավալային ֆրակցիաների համար որոշվում է հարաբերությունից
 , որտեղ
, որտեղ  , (1.22)
, (1.22)
 .
.
Մասնակի ճնշումը որոշվում է բանաձևերով.
![]() կամ
կամ  (1.23)
(1.23)
Բաղադրիչների և ամբողջ խառնուրդի վիճակի հավասարումները ունեն հետևյալ ձևը.
![]() ;
;
![]() ,
,
որտեղից հետո մենք ստանում ենք փոխակերպումներ զանգվածայինբաժնետոմսեր
 ,
,  . (1.24)
. (1.24)
Խառնուրդի խտությունը և հատուկ ծավալը համար զանգվածայինբաժնետոմսեր:
;  . (1.25)
. (1.25)
Մասնակի ճնշումները հաշվարկելու համար օգտագործվում է բանաձևը.
 . (1.26)
. (1.26)
Զանգվածային կոտորակների վերածումը ծավալային կոտորակների իրականացվում է բանաձևով.
 .
.
Գազերի խառնուրդի ջերմունակությունը որոշելիս մենք ելնում ենք այն դիրքից, որ գազային խառնուրդը տաքացնելու (հովացնելու) համար անհրաժեշտ է տաքացնել (հովացնել) խառնուրդի յուրաքանչյուր բաղադրիչ.
որտեղ Q i =M i c i ∆t-ը խառնուրդի i-րդ բաղադրիչի ջերմաստիճանը փոխելու համար ծախսվող ջերմությունն է, c i՝ խառնուրդի i-րդ բաղադրիչի զանգվածային ջերմունակությունը:
Խառնուրդի ջերմային հզորությունը որոշվում է հարաբերությունից (եթե խառնուրդը նշված է զանգվածային կոտորակներով)
 , նմանատիպ
, նմանատիպ  . (1.28)
. (1.28)
Որոշվում են ծավալային կոտորակներով տրված խառնուրդի մոլային և ծավալային ջերմային հզորությունները
 ;
;  ;
;
 ;
; 
Օրինակ 1.5Չոր օդը զանգվածով բաղկացած է g O2 = 23,3% թթվածնից և g N 2 = 76,6% ազոտից։ Որոշել օդի բաղադրությունն ըստ ծավալի (r O2 և r N 2) և խառնուրդի գազի հաստատունը:
Լուծում.
1. Աղյուսակ 1-ից գտնում ենք կգ/կմոլ և կգ/կմոլ
2. Որոշե՛ք թթվածնի և ազոտի ծավալային բաժինները.
1. Օդի (խառնուրդի) գազի հաստատունը որոշվում է բանաձևով.
 , Ջ/կգ Կ
, Ջ/կգ Կ
Օրինակ 1.6. Որոշե՛ք M=2 կգ կշռող գազային խառնուրդը P=const-ում տաքացնելու համար պահանջվող ջերմության քանակը, որը բաղկացած է % կշռից՝ , , , , երբ ջերմաստիճանը t 1 =900 o C-ից փոխվում է t 2 =1200 o C։
Լուծում:
1. Որոշեք գազային խառնուրդը կազմող բաղադրիչների միջին զանգվածային ջերմային հզորությունը P = const և t 1 = 900 o C (P2-ից):
1,0258 կՋ/կգ Կ; =1,1045 կՋ/կգ Կ;
1,1078 կՋ/կգ Կ; =2,1097 կՋ/կգ Կ;
2. Որոշեք գազային խառնուրդը կազմող բաղադրիչների միջին զանգվածային ջերմային հզորությունը P = const և t 1 = 1200 o C (P2-ից):
1,0509 կՋ/կգ Կ; =1,153 կՋ/կգ Կ;
1,1359 կՋ/կգ Կ; =2,2106 կՋ/կգ Կ;
3. Որոշեք խառնուրդի միջին զանգվածային ջերմունակությունը ջերմաստիճանի միջակայքի համար՝ t 2 =1200 o C և t 1 =900 o C:
4. Ջերմության քանակությունը 2 կգ խառնուրդ տաքացնելու համար P=const:
Թերմոդինամիկայի առաջին օրենքըքանակական կապ է հաստատում համակարգի ներքին էներգիայի փոփոխության և աշխատանքային հեղուկին ջերմություն մատակարարելու արդյունքում արտաքին միջավայրի ճնշման ուժերի դեմ կատարված մեխանիկական աշխատանքի միջև.
Փակ թերմոդինամիկական համակարգի համար առաջին օրենքի հավասարումն ունի ձև
Աշխատանքային հեղուկին (կամ համակարգին) փոխանցվող ջերմությունն օգտագործվում է նրա ներքին էներգիան (dU) բարձրացնելու համար՝ մարմնի ջերմաստիճանի բարձրացման և արտաքին աշխատանք (dL) կատարելու համար՝ աշխատանքային հեղուկի ընդլայնման և ավելացման պատճառով։ իր ծավալով։
Առաջին օրենքը կարելի է գրել dH=dq+VdP=dq-dL 0,
որտեղ dL 0 =VdP – ճնշման փոփոխության տարրական աշխատանքը կոչվում է օգտակար արտաքին (տեխնիկական) աշխատանք:
dU-ն աշխատանքային հեղուկի (համակարգի) ներքին էներգիայի փոփոխությունն է, որը ներառում է մոլեկուլների ջերմային շարժման էներգիան (թարգմանական, պտտվող և թրթռումային) և մոլեկուլների փոխազդեցության պոտենցիալ էներգիան։
Քանի որ համակարգի անցումը մի վիճակից մյուսին տեղի է ունենում ջերմության մատակարարման արդյունքում, հետևաբար աշխատանքային հեղուկը տաքանում է և նրա ջերմաստիճանը բարձրանում է դՏ-ով, իսկ ծավալը՝ դՎ-ով։
Մարմնի ջերմաստիճանի բարձրացումը հանգեցնում է նրա մասնիկների կինետիկ էներգիայի ավելացմանը, իսկ մարմնի ծավալի ավելացումը հանգեցնում է մասնիկների պոտենցիալ էներգիայի փոփոխության։ Արդյունքում մարմնի ներքին էներգիան ավելանում է dU-ով, հետևաբար U ներքին էներգիան մարմնի վիճակի ֆունկցիա է և կարող է ներկայացվել որպես երկու անկախ պարամետրերի ֆունկցիա U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T): Թերմոդինամիկ գործընթացում ներքին էներգիայի փոփոխությունը որոշվում է միայն նախնական (U 1) և վերջնական (U 2) վիճակներով, այսինքն.
Դիֆերենցիալ տեսքով կգրվի ներքին էներգիայի փոփոխությունը
ա) որպես հատուկ ծավալի և ջերմաստիճանի ֆունկցիա

բ) որպես ջերմաստիճանի ֆունկցիա, քանի որ , Դա
Գործնական հաշվարկների համար, որոնցում անհրաժեշտ է հաշվի առնել C v-ի փոփոխությունը ջերմաստիճանից, կան հատուկ ներքին էներգիայի (հաճախ մոլային) էմպիրիկ բանաձևեր և աղյուսակներ։ Իդեալական գազերի համար U m խառնուրդի մոլային ներքին էներգիան որոշվում է բանաձևով
 , Ջ/կմոլ
, Ջ/կմոլ
Զանգվածային կոտորակներով տրված խառնուրդի համար. Այսպիսով ներքին էներգիաԿա համակարգի հատկությունը և բնութագրում է համակարգի վիճակը.
Էնթալպիա– Ջերմային վիճակի ֆունկցիան ներկայացրել է Կամերլինգ Օննեսը (հաղթող Նոբելյան մրցանակ, 1913), որը U համակարգի ներքին էներգիայի գումարն է և P համակարգի ճնշման և նրա V ծավալի արտադրյալը։
Քանի որ դրանում ներառված մեծությունները պետության ֆունկցիաներ են, հետևաբար H-ն նույնպես պետության ֆունկցիա է, այսինքն՝ H = f 1 (P,V); H=f 2 (V,T); H=f 3 (P,T):
Ցանկացած թերմոդինամիկական գործընթացում էնթալպի dH-ի փոփոխությունը որոշվում է նախնական H 1 և վերջնական H 2 վիճակներով և կախված չէ գործընթացի բնույթից: Եթե համակարգը պարունակում է 1 կգ նյութ, ապա օգտագործվում է սպեցիֆիկ էթալպիա՝ Ջ/կգ։
Իդեալական գազի համար դիֆերենցիալ հավասարումն ունի ձև
Համապատասխանաբար, կոնկրետ էթալպիան որոշվում է բանաձևով
Թերմոդինամիկայի առաջին օրենքի հավասարումը dq=dU+Pdυ է, երբ աշխատանքի միակ տեսակը ընդլայնման Pdυ=d(Pυ)-υdP աշխատանքն է, ապա dq=d(U+Pυ)-υdP, որտեղից.
Գործնական աշխատանք№ 2
Թեմա՝ Ջերմունակություն, էթալպիա, իդեալական գազերի խառնուրդներ, ներքին էներգիա, աշխատանք, թերմոդինամիկական պրոցեսներ։
Աշխատանքի նպատակը՝ տեսական ուսուցման ընթացքում ձեռք բերված գիտելիքների համախմբում, ջերմային ճարտարագիտական հաշվարկներ կատարելու հմտությունների ձեռքբերում։
Ի.Հիմնական սահմանումներ, բանաձևեր և հավասարումներ
1. Իդեալական գազերի խառնուրդներ
Գազային խառնուրդը մի քանի գազերի մեխանիկական խառնուրդ է, որոնք քիմիապես չեն փոխազդում միմյանց հետ։ Խառնուրդի մեջ ներառված գազերից յուրաքանչյուրը կոչվում է գազի բաղադրիչ. իրեն պահում է այնպես, կարծես խառնուրդում այլ գազեր չլինեն, այսինքն. հավասարաչափ բաշխված խառնուրդի ողջ ծավալով: Այն ճնշումը, որ խառնուրդի յուրաքանչյուր գազ գործադրում է անոթի պատերին, կոչվում է մասնակի։ Իդեալական գազերի խառնուրդների հիմնական օրենքը Դալթոնի օրենքն է, ըստ որի խառնուրդի ճնշումը հավասար է խառնուրդը կազմող գազերի մասնակի ճնշման գումարին.
2. Ներքին էներգիա
Մարմնի ներքին էներգիան մարմինը կազմող միկրոմասնիկների շարժման կինետիկ էներգիայի և դրանց պոտենցիալ էներգիայի ամբողջությունն է։ փոխազդեցությունը սահմանված է: փոխադարձ ներգրավման կամ վանման ուժեր. Ներքին էներգիայի բացարձակ արժեքը հնարավոր չէ որոշել, հետևաբար թերմոդինամիկական հաշվարկներում հաշվարկվում է ոչ թե ներքին էներգիայի բացարձակ արժեքը, այլ դրա փոփոխությունը, այսինքն.
![]() կամ
կամ ![]()
որտեղ U 1 և U 2 - աշխատանքային հեղուկի (գազի) սկզբնական և վերջնական վիճակի ներքին էներգիան.
u 1 և և 2 - ծեծում: աշխատանքային հեղուկի սկզբնական և վերջնական վիճակի ներքին էներգիան.
Սրանից հետևում է, որ ներքին էներգիայի փոփոխությունը կախված չէ գործընթացի բնույթից և ուղուց, այլ որոշվում է փոփոխության գործընթացի սկզբում և վերջում աշխատող հեղուկի վիճակով։
Իդեալական գազի առանձնահատկությունը նրանում մոլեկուլային փոխազդեցության ուժերի բացակայությունն է, հետևաբար ներքին պոտենցիալ էներգիայի բացակայությունը, այսինքն. U n =0 և u„ = 0. Հետևաբար, իդեալական գազի ներքին էներգիան.
U=U k =f(T) unu u=u k =f(T):
Հ.Գազի աշխատանք.
Թերմոդինամիկայի մեջ՝ աշխատող հեղուկի վիճակի ցանկացած փոփոխություն՝ հետ էներգիայի փոխանակման արդյունքում միջավայրըկոչվում է գործընթաց: Այս դեպքում աշխատանքային հեղուկի հիմնական պարամետրերը փոխվում են.
Ջերմության փոխակերպումը մեխանիկական աշխատանքի կապված է աշխատանքային հեղուկի վիճակի փոփոխման գործընթացի հետ։ Գազի վիճակի փոփոխման գործընթացները կարող են լինել ընդլայնման և սեղմման գործընթացներ: Մ (կգ) գազի կամայական զանգվածի համար աշխատանքը հավասար է.
L = М l = Мр (v 2 - v 1) = , Ջ
որտեղ l = p (v 2 -v 1) J/kg - 1 կգ գազի աշխատանք կամ կոնկրետ աշխատանք։
4. Գազի էնթալպիա,
Էնթալպիան աշխատանքային հեղուկի (գազի) շրջակա միջավայրի հետ կապի պոտենցիալ էներգիան բնութագրող պարամետր է։ Էնթալպիա և հատուկ էնթալպիա.
I = U + pV, J և i i = u + pv, J / կգ:
5. Ջերմային հզորություն.
Հատուկ ջերմային հզորությունը ջերմության այն քանակությունն է, որը պետք է մատակարարվի 1 կգ գազին, որպեսզի այն տաքացվի 1°C-ով տվյալ ջերմաստիճանի միջակայքում:
Հատուկ ջերմային հզորությունը կարող է լինել զանգվածային, ծավալային և կիլոմոլային: Կապ կա C զանգվածի, C ծավալի և կիլոմոլար C ջերմային հզորությունների միջև.
 ;
; 
որտեղ Vo 22,4 մ 3 /կմոլ - ծեծում է. նորմալ պայմաններում գազի ծավալը.
Զանգվածային ծեծ գազային խառնուրդի ջերմային հզորությունը.

Ծավալային հատուկ ջերմությունգազի խառնուրդ.

Գազային խառնուրդի կիլոմոլ հատուկ ջերմային հզորությունը.

6.Ջերմության քանակի որոշման հավասարումը
Աշխատանքային հեղուկի (գազի) կողմից արտանետվող կամ ստացվող ջերմության քանակը կարող է որոշվել հետևյալ հավասարմամբ.
Q = M C m (t 2 -t 1), J կամ Q = VC (t-t), J, որտեղ M և V գազի քաշը կամ ծավալը, կգ կամ մ 3;
t u t - գազի ջերմաստիճանը գործընթացի վերջում և սկզբում ° C;
C և C - զանգվածային և ծավալային միջին հարված: գազի ջերմային հզորությունը
At t cp = J/kgK կամ J/m 3 K
7. Թերմոդինամիկայի առաջին օրենքը
Այս օրենքը հաշվի է առնում ջերմության և մեխանիկական աշխատանքի փոխակերպումը: Համաձայն այս օրենքի՝ ջերմությունը վերածվում է մեխանիկական աշխատանքի և հակառակը, մեխանիկական աշխատանքը ջերմության՝ խիստ համարժեք քանակությամբ։ Ջերմության և աշխատանքի համարժեքության հավասարումը ունի ձև.
Հաշվի առնելով ջերմության և աշխատանքի համարժեքության սկզբունքը՝ գազի կամայական զանգվածի ջերմային հաշվեկշռի հավասարումը.
Q = U + L և q =u+l= u –u +l
Խնդրի լուծումII
Առաջադրանք թիվ 1 (թիվ 1)
Մթնոլորտային չոր օդն ունի հետևյալ մոտավոր զանգվածային բաղադրությունը՝ g 02 =23,2%, g N 2 =76,8%.
Որոշեք օդի ծավալային բաղադրությունը, նրա գազի հաստատունը, ակնհայտ մոլեկուլային քաշը, թթվածնի և ազոտի մասնակի ճնշումը, եթե օդը ըստ բարոմետրի P = 101325 Պա է։
Ես որոշում եմ օդի ծավալային կազմը.
 ;
; ;
;
որտեղ r-ը զանգվածային բաժինն է.
մ - հարաբերական մոլեկուլային քաշը;
g – ծավալային բաժին:
մ օդ =m O2 r O2 +m N2 r N2 = 32·0,209 + 28·0,7908=6,688+22,14=28,83;

 ;
;
որտեղ R 0-ը գազի հաստատունն է:
Ես որոշում եմ տարբեր գազերի մասնակի ճնշումները.
P O 2 =P սմ · r O2 =101325 · 0.209 = 21176.9 (Pa);
P N 2 = P սմ · r N 2 = 101325 · 0.7908 = 80127.81 (Pa);
որտեղ P O 2, P N 2 - մասնակի ճնշում;
P սմ - խառնուրդի ճնշում:
Առաջադրանք թիվ 2 (թիվ 2)
Անոթը բաժանված է 2 մասի, որոնց ծավալներն են V 1 = 1,5 մ 3 և V 2 = 1,0 մ 3։ V 1 ծավալի առաջին մասը պարունակում է CO 2 P 1 = 0,5 ՄՊա և t 1 = 30 ° C; V 2 ծավալով երկրորդ մասը պարունակում է O 2 P 2 =0,2 ՄՊա և t 2 =57 ° C: Որոշեք CO 2-ի և O 2-ի զանգվածային և ծավալային բաժինները, խառնուրդի ակնհայտ մոլեկուլային քաշը և դրա գազի հաստատունը միջնորմը հեռացնելուց և խառնման գործընթացն ավարտելուց հետո:
Ես որոշում եմ գազի առանձին հաստատունները.
Դա անելու համար որոշում եմ հարաբերական մոլեկուլային քաշը՝ m(CO 2) =32+12=44; m(O 2)=32;

 ;
;
![]()
 ;
;
Կլայպերոնի բնորոշ հավասարման համաձայն՝ ես որոշում եմ գազերի զանգվածները.
 (կգ);
(կգ);
 (կգ);
(կգ);
Ես որոշում եմ զանգվածային կոտորակները.


Ես որոշում եմ ծավալային կոտորակները.


Որոշեք օդի ակնհայտ մոլեկուլային զանգվածը.
մ օդ =m O2 r O 2 +m CO2 r CO2 = 32·0,21 + 44·0,79=6,72+34,74=41,48;
Ես որոշում եմ օդի անհատական գազի հաստատունը (R).

 ;
;
Խնդիր թիվ 3 (թիվ 6)
300 լիտր ծավալ ունեցող անոթում կա թթվածին P 1 = 0,2 ՄՊա և t 1 = 20 0 C ճնշման տակ: Որքա՞ն ջերմություն պետք է մատակարարվի, որպեսզի թթվածնի ջերմաստիճանը բարձրանա մինչև t 2 = 300 0: C? Ի՞նչ ճնշում կստեղծվի նավի մեջ: Հաշվարկի համար վերցրեք թթվածնի միջին ծավալային հատուկ ջերմությունը նորմալ պայմաններում: C 02 = 0,935 
Օգտագործելով Չարլզի օրենքը, ես որոշում եմ գործընթացի վերջնական ճնշումը.
;  (Pa);
(Pa);
որտեղ P, T-ը գազի պարամետրերն են:
Ես որոշում եմ թթվածնի անհատական գազի հաստատունը (R).

 ;
;
Քանի որ պրոցեսը իզոխորիկ է, ես որոշում եմ ջերմության այն քանակությունը, որը պետք է մատակարարվի՝ օգտագործելով համապատասխան բանաձևը. գազ
 (կգ); Q v =M·С cv ·(T 2 -T 1)=1,27·935·280=332486 (J):
(կգ); Q v =M·С cv ·(T 2 -T 1)=1,27·935·280=332486 (J):
Խնդիր թիվ 4 (թիվ 7)
Որքա՞ն ջերմություն պետք է ծախսվի մշտական ավելցուկային ճնշման դեպքում 2մ 3 օդ տաքացնելու համար Pg. =0,2 ՄՊա 100 0 C ջերմաստիճանից մինչև 500 0 C ջերմաստիճան: Ի՞նչ աշխատանք կկատարվի օդով: Հաշվարկների համար վերցրեք՝ մթնոլորտային ճնշում R at. =0,1 ՄՊա, օդի միջին զանգվածային իզոբար ջերմային հզորությունը C pm =1,022  ; հաշվարկել գազի հաստատունը՝ նկատի ունենալով, որ օդի ակնհայտ մոլեկուլային զանգվածը M օդ է։ =29.
; հաշվարկել գազի հաստատունը՝ նկատի ունենալով, որ օդի ակնհայտ մոլեկուլային զանգվածը M օդ է։ =29.
Ես որոշում եմ օդի անհատական գազի հաստատունը.

 ;
;
Բացարձակ ճնշումը հավասար է ավելցուկային և մթնոլորտային ճնշման գումարին P = P g: + R ժամը. =0,1+0,2=0,3 ՄՊա
 (կգ);
(կգ);
Քանի որ գործընթացը isobaric է, ես որոշում եմ Q և L՝ օգտագործելով համապատասխան բանաձևերը.
Համաձայն Գեյ-Լուսակի օրենքի՝ ես որոշում եմ վերջնական ծավալը.
 մ 3;
մ 3;
Q=M·C pm ·(T 2 -T 1)= 5.56·1022·400=2272928 (J);
L=P·(V 2 -V 1)=300000·2.15=645000 (J):
Խնդիր թիվ 5 (թիվ 8)
Մխոցը պարունակում է օդ P = 0,5 ՄՊա ճնշման և t 1 = 400 0 C ջերմաստիճանի դեպքում: Ջերմությունը հեռացվում է օդից P = const-ում, որպեսզի գործընթացի վերջում հաստատվի t 2 = 0 0 C ջերմաստիճան: Օդ պարունակող գլանի ծավալը V 1 =400լ.
Որոշեք հեռացված ջերմության քանակը, վերջնական ծավալը, ներքին էներգիայի փոփոխությունը և սեղմման կատարյալ աշխատանքը C pm =1,028  .
.
Քանի որ գործընթացը իզոբար է, ես որոշում եմ վերջնական ծավալը՝ օգտագործելով Գեյ-Լյուսակի օրենքը.
 մ 3;
մ 3;
Կլայպերոնի բնորոշ հավասարման համաձայն՝ ես որոշում եմ գազի զանգվածը.
Նախորդ խնդիրից R=286.7 
 (կգ);
(կգ);
Ես որոշում եմ արտանետվող ջերմության քանակը.
Q=M·C pm ·(T 2 -T 1)=1.03·1028·(273-673)=-423536 (J);
Ես որոշում եմ ծախսված աշխատանքի ծավալը.
L=P·(V 2 -V 1)= 500000·(0.16-0.4)=-120000 (J);
Այն հավասարումից, որով որոշվում է ընդհանուր գումարը, ես որոշում եմ ներքին էներգիայի քանակի փոփոխությունը.
![]() ; (J)
; (J)
Խնդիր թիվ 6 (թիվ 9)
V 1 = 0,02 մ3 ծավալ ունեցող օդը P 1 = 1,1 ՄՊա և t 1 = 25 վ ճնշման դեպքում ընդլայնվում է շարժական մխոցով մխոցում մինչև P 2 = 0,11 ՄՊա ճնշում: Գտեք վերջնական ծավալը V 2 , վերջնական ջերմաստիճան t 2 , օդի կատարած աշխատանքը և ջերմության մուտքագրումը, եթե մխոցում ընդլայնում է տեղի ունենում.
ա) իզոթերմային
բ) ադիաբատիկ k=1.4 ադիաբատիկ ինդեքսով
գ) պոլիտրոպիկ n=1.3 պոլիտրոպիկ ինդեքսով
Իզոթերմային գործընթաց.
P 1 / P 2 = V 2 / V 1
V 2 =0.02·1.1/0.11=0.2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1.1 10 6 0.02 Ln(0.2/0.02)=22000 J
Ադիաբատիկ գործընթաց.
V 1 / V 2 = (P 2 / P 1) 1 / k
V 2 =V 1 /(P 2 /P 1) 1/k =0.02/(0.11/1.1) 1/1.4 =0.1036M 3
T 2 / T 1 = (P 2 / P 1) k-1 / k
T 2 =(P 2 /P 1) k-1/k T 1 =(0.11/1.1) 1.4-1/1.4 298=20.32k
С v =727,4 Ջ/կգ k
L=1/k-1(P 1 V 1 -P 2 V 2) =(1/1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275·10 6 J.
Պոլիտրոպիկ գործընթաց.
V 1 / V 2 = (P 2 / P 1) 1 / n
V 2 =V 1 /(P 2 /P 1) 1/n =0.02/(0.11/1.1) 1/1.3 =0.118M 3
T 2 / T 1 = (P 2 / P 1) n-1 / n
T 2 =(P 2 /P 1) n-1/n T 1 =(0.11/1.1) 1.3-1/1.3 298=175k
L= 1/n-1(P 1 V 1 -P 2 V 2)= (1/(1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118)=30000Ջ
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500Ջ
Գրականություն:
1. «Էներգիա», Մոսկվա, 1975 թ.
2. Լիտվին Ա.Մ. «Ջերմային տեխնիկայի տեսական հիմունքներ», «Էներգիա» հրատարակչություն, Մոսկվա, 1969 թ.
3. Տուգունով Պ.Ի., Սամսոնով Ա.Ա., «Ջերմային տեխնիկայի, ջերմային շարժիչների և գոլորշու էներգիայի կառավարման հիմունքներ», «Նեդրա» հրատարակչություն, Մոսկվա, 1970 թ.
4. Կրուտով Վ.Ի., «Ջերմային ճարտարագիտություն», «Մեքենաշինություն» հրատարակչություն, Մոսկվա, 1986 թ.
Գազային խառնուրդներ. Գազերի ջերմային հզորությունը
Գազային խառնուրդները հասկացվում են որպես մի քանի գազերի մեխանիկական խառնուրդ, որոնք քիմիապես չեն փոխազդում միմյանց հետ: Իդեալական գազերի խառնուրդը ենթարկվում է բոլոր օրենքներին իդեալական գազեր. Գազային խառնուրդի բաղադրությունը որոշվում է խառնուրդում ընդգրկված գազերից յուրաքանչյուրի քանակով և կարող է որոշվել զանգվածային կամ ծավալային բաժիններով.
որտեղ է րդ բաղադրիչի զանգվածը, րդ բաղադրիչի ծավալն է, և և են ամբողջ խառնուրդի զանգվածն ու ծավալը, համապատասխանաբար:
Ակնհայտ է, որ
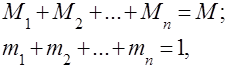
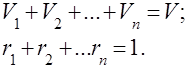
Գազային խառնուրդների հետ գործնական խնդիրներ լուծելու հարմարության համար ներդրվել է գազային խառնուրդի տեսանելի մոլեկուլային զանգվածի հայեցակարգը, որը խառնուրդի առանձին բաղադրիչների փաստացի մոլեկուլային զանգվածների միջին զանգվածն է։
Գազերի խառնուրդի վիճակի հավասարումն ունի հետևյալ ձևը.
Համընդհանուր գազի հաստատունի հայեցակարգը վերաբերում է գազերի խառնուրդներին
Գազային խառնուրդի ճնշման և խառնուրդի մեջ ներառված առանձին բաղադրիչների մասնակի ճնշման միջև կապը հաստատվում է Դալթոնի օրենքով.
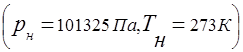
1 գազն ունի տարբեր զանգված՝ կախված ճնշումից և ջերմաստիճանից։ Այս առումով, ծավալային ջերմային հզորությունը միշտ կապված է նորմալ պայմաններում 1-ում պարունակվող գազի զանգվածի հետ։ Այս դեպքում տարբեր գազերի 1 կմոլ ծավալը հավասար է 22,4/կմոլի, իսկ գազի համընդհանուր հաստատունը՝ . Կախված գազին ջերմություն մատակարարելու եղանակից՝ առանձնանում են իզոբար և իզոխորային ջերմային հզորություններ։ Այս մեծությունների հարաբերակցությունը կոչվում է ադիաբատիկ ցուցիչ
Ջերմային հզորությունները և կապված են նաև Մայերի հետ
Ջերմության քանակությունը, որը պետք է ծախսվի 1 կգ գազի տաքացման գործընթացում մինչև ջերմաստիճանի միջակայքում, որոշվում է բանաձևով.
որտեղ և են միջին ջերմային հզորությունները համապատասխանաբար 0°- և 0°-ի սահմաններում:
Եթե գործընթացը ներառում է (կգ) կամ () գազ, ապա
Գազային խառնուրդի ջերմային հզորությունը պետք է որոշվի բանաձևերով.
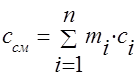
զանգված - ;
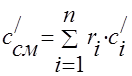
ծավալային - ;
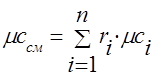
մոլային - .
Կաթսայատան ագրեգատում վառելիքի այրման արտադրանք հանդիսացող գազերի ջերմությունն օգտագործելու համար կաթսայատան ագրեգատի գազի խողովակներում տեղադրվում են վառելիքի այրման համար անհրաժեշտ օդի օդատաքացուցիչներ (նկ. 1): Կաթսայից դուրս եկող գազերը ջերմաստիճանում մտնում են օդատաքացուցիչ և սառչում են՝ ջերմություն տալով օդին, դեպի։ Կաթսայատան ագրեգատի ծխատար խողովակում, ծխի արտանետիչի աշխատանքի ազդեցության տակ, մթնոլորտային ճնշումից մի փոքր ցածր ճնշում է հաստատվում: Օդատաքացուցիչի օդը տաքացվում է ջերմաստիճանից մինչև ջերմաստիճան:
Ծխատար գազեր
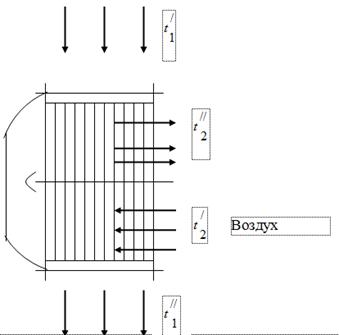
Կաթսայատան միավորը փորձարկելիս ստացվել են հետևյալ տվյալները.
Գազի ջերմաստիճանը օդատաքացուցիչի մուտքի մոտ = 450 °C:
Գազի ջերմաստիճանը օդատաքացուցիչի ելքի մոտ = 150°C:
Օդի ջերմաստիճանը օդափոխիչի մուտքի մոտ = 26 ° C:
Օդի ջերմաստիճանը օդափոխիչի ելքի մոտ = 260 ° C:
Ծխատար գազերի ծավալային կազմը - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Գազի ժամային հոսքի արագությունը 50 ·/ժ է:
Գազի խողովակում վակուումը 15 մմ ջուր է: Արվեստ.
Բարոմետրիկ ճնշում 760 մմ Hg: Արվեստ.
Սահմանել.
ծխատար գազերի ակնհայտ մոլեկուլային քաշը;
ծխատար գազերի գազի հաստատուն;
ծխատար գազերի բաղադրության մեջ ընդգրկված առանձին բաղադրիչների զանգվածային (զանգվածային) ֆրակցիաներ.
Բաղադրիչների մասնակի ճնշումը.
օդի ժամային հոսք:
Ենթադրենք, որ գազի արտանետվող ողջ ջերմությունը կլանում է օդը:
Ջերմային հզորության կախվածությունը ջերմաստիճանից ենթադրվում է կորագիծ:
1. Ծխատար գազերի տեսանելի մոլեկուլային քաշը
0,115·44 + 0,065·18 + 0,172·32 + 0,648·28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Ծխատար գազերի գազի հաստատուն
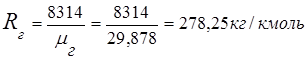
3. Զանգվածային կոտորակներգազի բաղադրիչներ
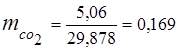
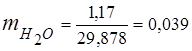
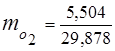
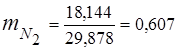
4. Բաղադրիչների մասնակի ճնշումներ
Մենք հաշվարկի արդյունքները մուտքագրում ենք աղյուսակում
|
Ընտրանքներ |
Գազային խառնուրդ |
|||
|
|
||||
|
|
||||
|
|
5. Օդի ժամային հոսք
Օդի հոսքը որոշվում է օդափոխիչի ջերմային հավասարակշռության հավասարումից
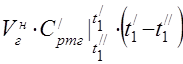
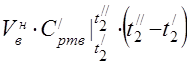
միջին մոլային ջերմային հզորությունը 450 °C-ում
Բաղադրիչների միջին տեսակարար ջերմությունը 0…450°C միջակայքում գտնվող ջերմաստիճաններում:













 .
(1.28)
.
(1.28)