Méthode de détermination de la capacité calorifique d'un corps solide
Qu'est-ce que la CAPACITÉ THERMIQUE
Lorsque de la chaleur est fournie, la température du système augmente. Dans le cas d'un changement de température infiniment petit, la proportionnalité est valable
dT=δQ , ou dT=constδQ
Il est plus commode d'écrire cette relation sous la forme : δQ=СdT ou
La valeur C est appelée la véritable capacité calorifique du système.
La capacité calorifique est le rapport entre la quantité de chaleur fournie au système et le changement de température qui se produit.
En plus du vrai, il existe également une capacité calorifique moyenne:
Capacité thermique
Si la capacité calorifique est attribuée à une unité de masse (mole) d'une substance, elle devient alors indépendante de la masse de l'ensemble du système et acquiert les propriétés d'un paramètre intensif. Si la capacité thermique se réfère à une unité de masse d'une substance, elle est dite spécifique, et à 1 mole - capacité thermique avec la dimension de J / (mol * k)
Nous ne considérerons que les capacités calorifiques molaires, puisque pour eux, toutes les régularités sont beaucoup plus simples que pour la capacité calorifique spécifique.
La capacité calorifique dépend des conditions dans lesquelles s'effectue le transfert de chaleur vers le système. Si le système est enfermé dans un volume constant, alors une augmentation de température de dT se produira sous l'action d'une chaleur égale à CvdT, où Cv est la capacité calorifique à volume constant. En cas de pression constante lors de la détente du système, pour augmenter la température de dT, il faudra de la chaleur CpdT, où Cp est la capacité calorifique à pression constante.
Compte tenu des conditions de transfert de chaleur, lorsqu'une ou plusieurs variables sont maintenues constantes, tandis que d'autres changent, la capacité calorifique peut être exprimée à l'aide de dérivées partielles : ![]() . Puisque δQ v = dU,
. Puisque δQ v = dU,
δQ p =dH, on peut écrire :
![]() (1)
(1)
Cv est la capacité thermique isochore des gaz, Cp est la capacité thermique isobare des gaz.
Les différences entre les capacités calorifiques isochoriques et isobares sont dues à la différence d'énergie interne et d'enthalpie. Les changements d'enthalpie et d'énergie interne diffèrent par la quantité de travail effectué par le système.
δW=∆nRT, ∆H-∆U=∆nRT
Par conséquent, les capacités calorifiques à volume constant Cv et pression constante Cp diffèrent également par la quantité de travail : Cp - Cv = δW
A partir des expressions (1), on peut écrire :
En substituant ces égalités dans l'équation ∆H- ∆U=∆nRT
et en tenant compte que ∆n= 1, on trouvera la relation entre les capacités calorifiques molaires des gaz :
Cp– Cv= R ou Cp= Cv+ R
Comme on peut le voir, ils diffèrent par la valeur de la constante des gaz.
De la condition Cp= Cv+ R il résulte que Cp˃Cv, c'est-à-dire dans un processus isobare, quand P=const, pour augmenter la température du système, il faut grande quantité chaleur que dans un processus isochore.
La capacité calorifique molaire des gaz a des valeurs de l'ordre de R, donc la différence entre Cp et Cv est très importante. Ainsi, pour le dioxyde de carbone CO 2 à 25 0 C Cp = 37, 14 et Cv = 28,83 J / (mol * K)
La différence Cp - Cv est le travail de l'expansion isobare d'une mole gaz parfait lorsque la température augmente d'un degré. Les liquides et les solides du corps se caractérisent par une légère augmentation de volume lorsqu'ils sont chauffés. Par conséquent, pour les corps condensés, nous pouvons supposer que Ср ≈ Сv.
ÉQUATION DE KIRCHOFF. DÉPENDANCE DES EFFETS THERMIQUES SUR LA TEMPÉRATURE.
Les calculs d'effets thermiques précédemment envisagés basés sur la loi de Hess pour la chaleur de formation et de combustion sont limités par des conditions standard. Pour des raisons pratiques, il est nécessaire de calculer les effets thermiques pour des conditions spécifiques autres que les conditions standard.
Partez des effets thermiques connus dans des conditions standard, c'est-à-dire à une température de 25 0 C (298,15 K) et une pression de 1 atm. (1.013 * 10 5 Pa), il est possible de calculer les effets thermiques à n'importe quelle température qui nous intéresse en utilisant La loi de Kirchhoff. Les processus dans des conditions industrielles se caractérisent par une variation de température importante, dont la plage est déterminée non seulement par les conditions de la technologie, mais également par la saison.Cette plage peut atteindre des centaines de degrés - il est naturel que les effets thermiques soient très différents et dépendent de la température.
Considérons la loi de Kirchhoff sous forme différentielle. Pour ce faire, nous écrivons les changements d'enthalpie dans l'énergie isobare et interne dans les processus isochores.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
Différenciez ces équations par rapport à la température et obtenez :
Équations de Kirchhoff :

Et - coefficients de température de l'effet thermique des processus isobares et isochoriques, respectivement; et - modification de la capacité calorifique du système à la suite de processus isobares et isochoriques, respectivement.
Sur la base de l'équation de Kirchhoff, la loi de Kirchhoff est formulée sous forme différentielle : le coefficient de température de l'effet thermique du processus est égal à la variation de la capacité calorifique du système résultant de ce processus.
Ainsi, la loi de Kirchhoff sous forme différentielle permet de déterminer uniquement la variation de l'effet thermique avec la température, et non l'amplitude de l'effet thermique lui-même.
Analysons l'équation de Kirchhoff
Pour la réaction : aA + bB = dD + rR dans un processus isobare (р=const), selon la loi de Kirchhoff, la variation de capacité calorifique dans le système aura la forme :
Une expression similaire peut être obtenue pour un processus isochore :
Puisque la loi de Kirchhoff vous permet de déterminer les changements de l'effet thermique du processus avec un changement de température, nous construisons un graphique :
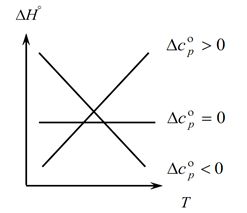
1. Considérons le premier cas, quand ∆Ср(∆Сv)˃0, car ∆Ср=∑С con. -∑С initial, il s'ensuit donc que la somme des capacités calorifiques des produits de réaction est supérieure à la somme des capacités calorifiques des substances de départ : ∑С con. ˃∑Depuis le début Dans ce cas, on obtient la courbe 1 sur le graphique, ce qui signifie que lorsque la température augmente, la variation de l'effet thermique du procédé augmente également (T et ∆H) ;
2. Le deuxième cas, quand ∆Ср(∆Сv)˂0. Comme pour la première loi, nous avons ∑С con. ˂∑Dès le début (la somme des capacités calorifiques des produits finaux est inférieure à la somme des capacités calorifiques des substances initiales). Ensuite, nous obtenons une courbe sur le graphique, ce qui signifie qu'avec une augmentation de la température, la variation de l'effet thermique du processus diminue (Т→∆H↓)
3. Et le troisième cas, lorsque la variation des capacités calorifiques du système est égale à zéro ∆Ср(∆Сv)=0. Alors la somme des capacités calorifiques des produits finaux des réactions est égale à la somme des capacités calorifiques des matières premières ∑С con. \u003d ∑ Depuis le début. Dans ce cas, l'effet thermique de la réaction n'est pas fonction de la température (∆H ≠ f(T)) et on obtient une droite sur le graphique.
CALCUL DES EFFETS THERMIQUES POUR UNE DONNEE
TEMPÉRATURE. INTÉGRATION DE L'ÉQUATION DE KIRCHHOFF
Pour trouver la valeur de l'effet thermique en fonction de la température, il faut intégrer les équations

De T à T 0 (où T est la température requise, T 0 est la température standard), de ∆H à ∆H 0 ou de ∆U à ∆U 0 (où ∆H et ∆U sont l'enthalpie et l'énergie interne sous conditions différentes de la norme). L'intégration est effectuée pour deux cas :
Pour ne pas matière organique: Pour les substances organiques :
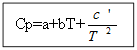
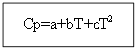
Exemple : pour H 2 (g) - substance inorganique
| Ср=f(T) | J | |||
| un | b*10 3 | c'*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27,28 + 3,26 * 10 -3 T +.
un) Intégration approximative:
pour processus isobare
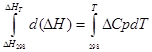
∆H T - ∆H 298 =∆Cp*(T-298)
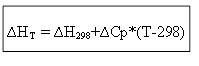
pour le processus isochore :
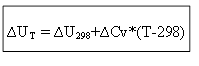
Ainsi, pour déterminer l'effet thermique ∆H ou l'énergie interne ∆U à toute température T, il est nécessaire de connaître la chaleur du processus dans des conditions standard ∆H 0 (∆U 0) et la variation des capacités calorifiques ∆Ср, ∆ CV.
Exemple. Calculez l'effet thermique ∆H du processus d'obtention du benzène à partir de l'acétylène :
3C2H2 (g) → C6H6 (g) à 75°C (348K).
1. On trouve dans les tableaux les capacités calorifiques isobares molaires moyennes du benzène et de l'acétylène :
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. On trouve la variation de la capacité calorifique du procédé :
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) initial \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81,67 - 3 * 43,93 \u003d - 50,12 J / (mol * K) .
3. D'après les données du tableau, on retrouve l'effet thermique dans des conditions standards :
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Trouvez l'effet thermique à une température donnée :
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
b) Intégration exacte:
Considérons le deuxième cas, plus compliqué, lorsque le changement de capacité calorifique dépend de la température, c'est-à-dire Ср=f(T), Cv=f(T).
Passons à l'équation de réaction sous forme générale
dD + rR = qQ + pP
| un | b*10 3 | c'*10 -5 | C*10 6 | |
| ré | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c'= q*c'(Q) + p*c'(P) - ;
![]()
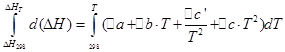
Nous effectuerons les mêmes opérations pour le processus isochore :
CHALEUR DE DISSOLUTION
La variation d'enthalpie lors de la transition d'une substance solide, liquide ou gazeuse dans une solution est appelée thermique ou enthalpie de dissolution.
La chaleur de dissolution comprend généralement la chaleur de destruction du réseau cristallin (par solides), ionisation et solvatation.
Pour rompre la liaison entre les ions d'un sel cristallin, il faut de l'énergie, c'est-à-dire tandis que la chaleur est absorbée. En même temps, l'hydratation des ions se produit dans la solution aqueuse ; une liaison se forme entre les ions et les molécules de H 2 O. Le signe de la chaleur de dissolution est déterminé par le processus énergétiquement plus prononcé.
LiBr : ∆H dist = - 49,02 kJ / mol - la chaleur est dégagée
KCl : ∆H dist = 7,23 kJ/mol - la chaleur est absorbée
Distinguer : la chaleur intégrale de dissolution est la chaleur qui est libérée ou absorbée lorsqu'une mole d'une substance donnée est dissoute pour former une solution d'une concentration donnée. La chaleur intégrale de dissolution varie en fonction de la quantité de substance dissoute.
Distinguer: chaleur différentielle de dissolution - c'est la chaleur qui accompagne la dissolution de 1 mole d'une substance donnée à l'infini grand volume solution de cette substance. Les chaleurs intégrales sont largement utilisées pour calculer les chaleurs de formation et les chaleurs d'autres réactions selon la loi de Hess. Les chaleurs différentielles de dissolution caractérisent les propriétés thermodynamiques des solutions et le processus de leur formation.
LABO #8
DÉTERMINATION DE LA CAPACITÉ THERMIQUE DES CORPS SOLIDES
Instruments et accessoires : montage expérimental FPT1-8.
Objectif: détermination de la capacité calorifique d'échantillons métalliques par la méthode calorimétrique par chauffage électrique.
Brève théorie
Capacité thermique spécifique d'une substance - une valeur égale à la quantité de chaleur nécessaire pour chauffer 1 kg d'une substance de 1 K :
Capacité calorifique molaire - une valeur égale à la quantité de chaleur nécessaire pour chauffer 1 mol d'une substance par 1 K :
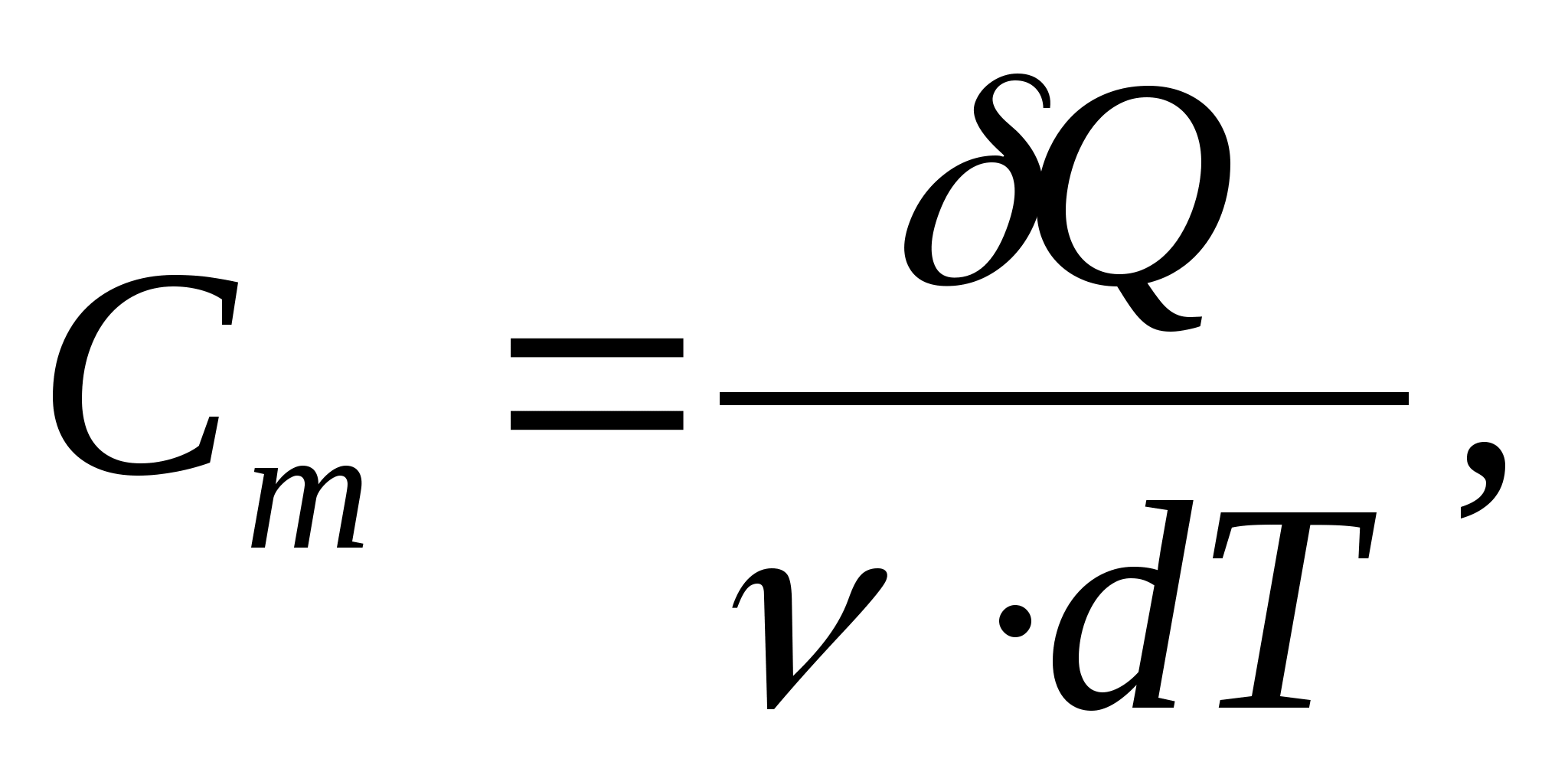
où 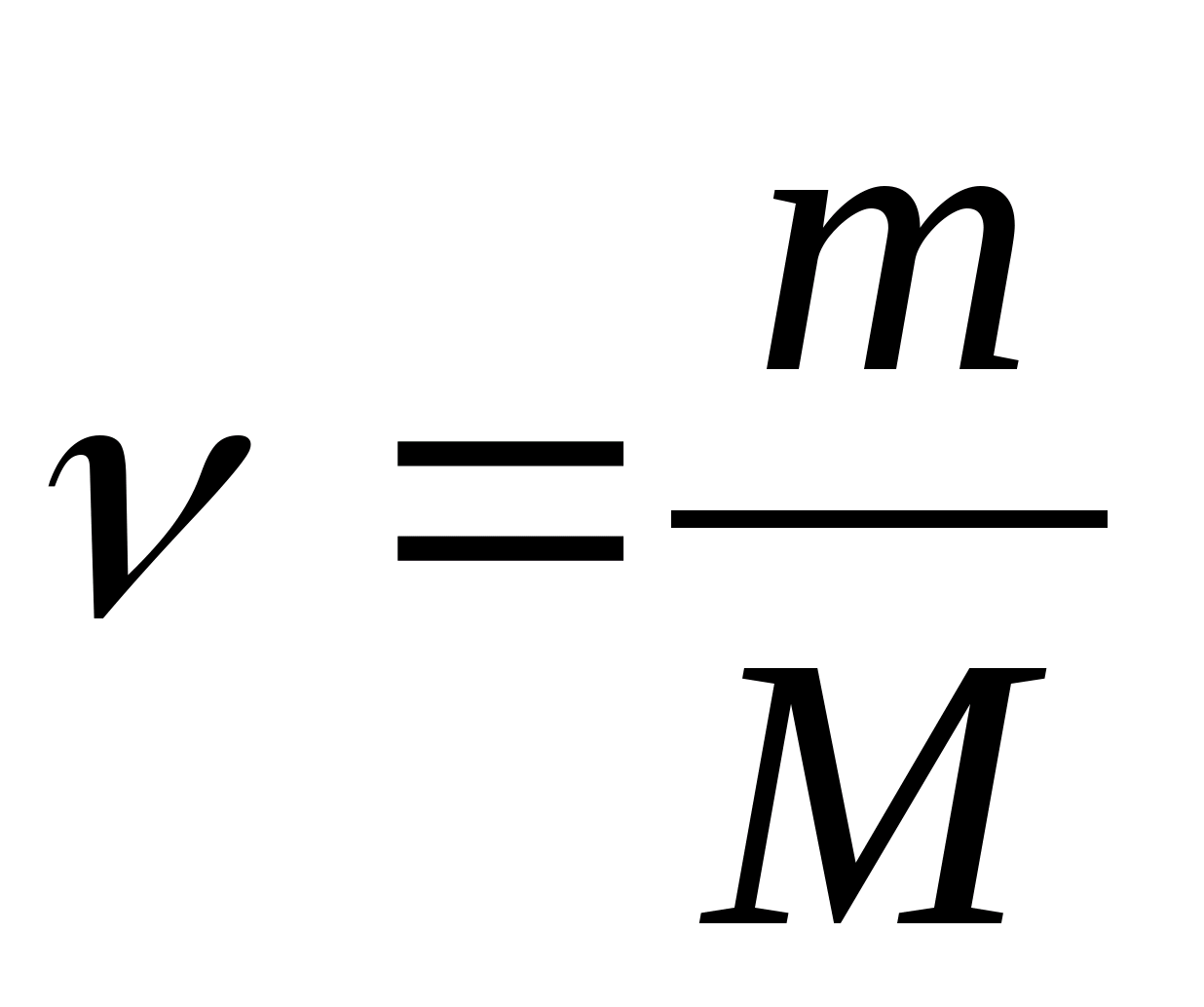 − quantité de substance.
− quantité de substance.
Chaleur spécifique c associé à la molaire C m rapport

où M est la masse molaire de la substance.
Distinguer capacité calorifique à volume constant et pression constante, si, au cours du processus de chauffage d'une substance, son volume ou sa pression est maintenu constant.
Le plus petit nombre de variables indépendantes (coordonnées) qui déterminent complètement la position du système dans l'espace est appelé nombre de degrés de liberté .
Selon la loi de Boltzmann sur la distribution uniforme de l'énergie sur les degrés de liberté des molécules, chaque degré de liberté de translation et de rotation a une énergie cinétique moyenne égale à
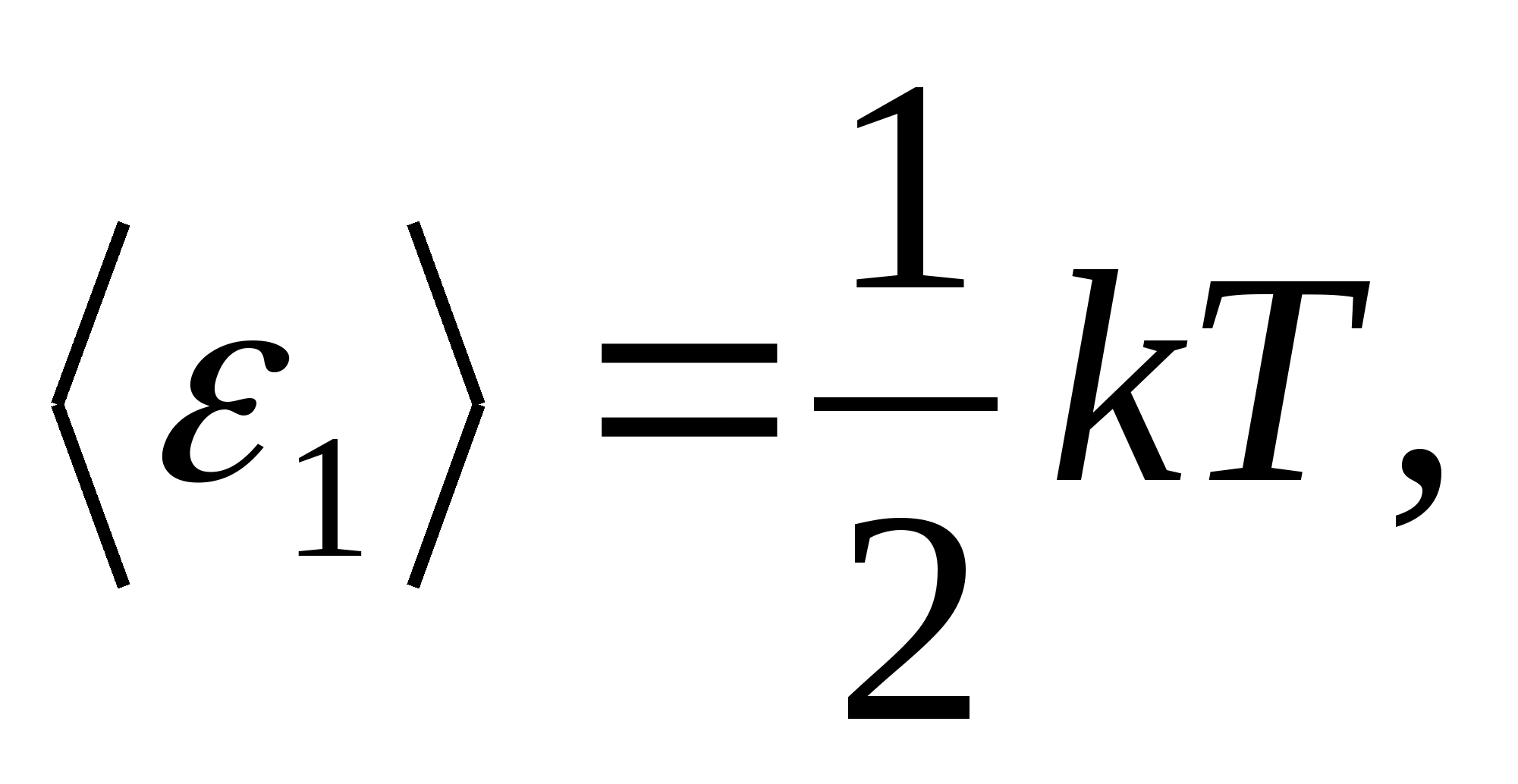
(où k est la constante de Boltzmann), et pour chaque degré de liberté vibratoire, en moyenne, l'énergie égale à
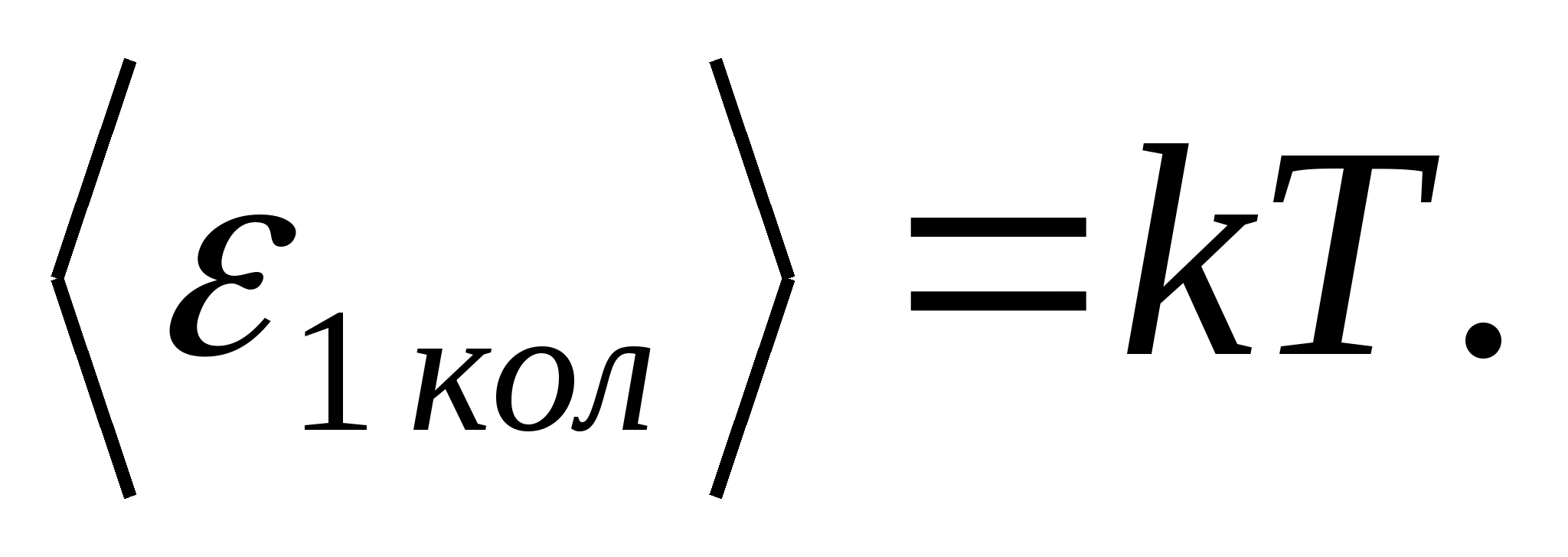
Ainsi, l'énergie moyenne d'une molécule
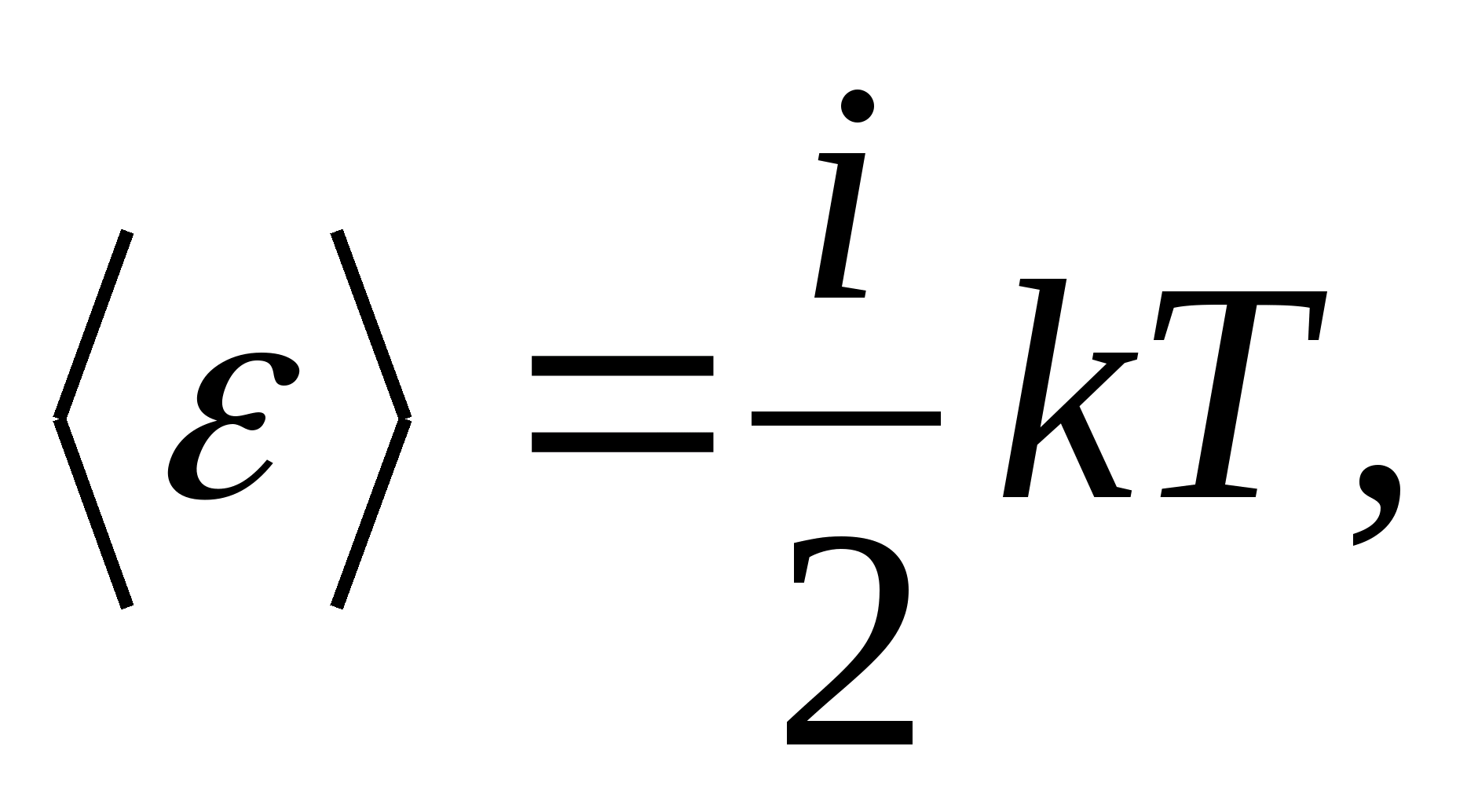
où je est la somme du nombre de translations, du nombre de rotations et du double du nombre de degrés de liberté vibrationnels de la molécule :
![]()
Par exemple, l'énergie cinétique moyenne des molécules de gaz parfait monoatomique ( 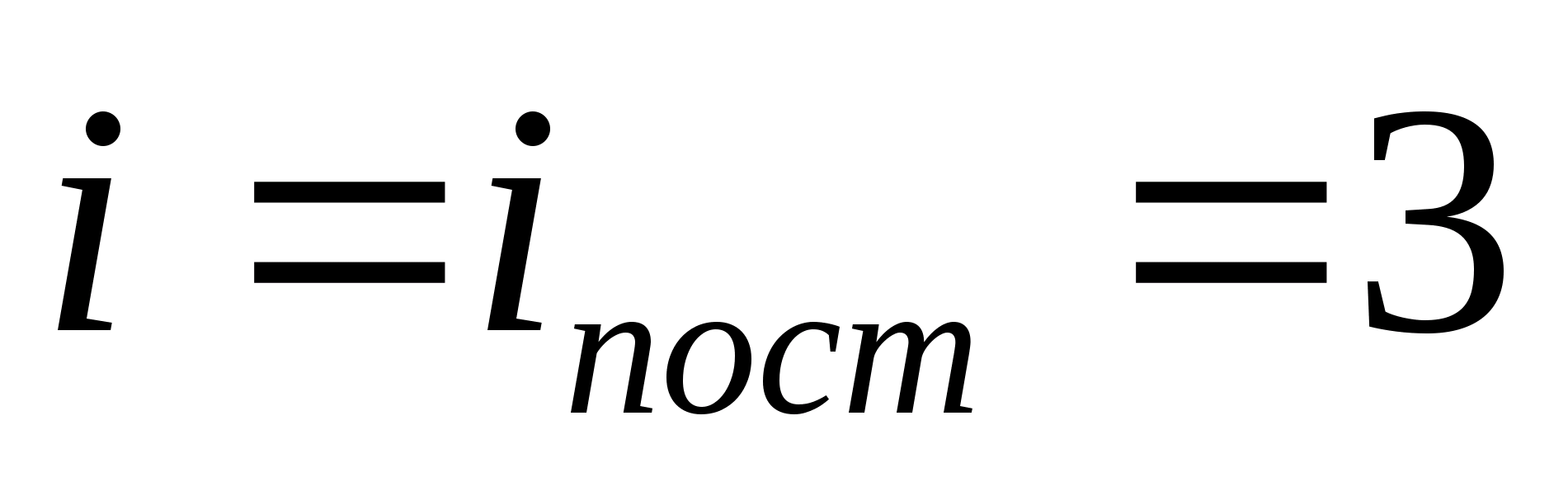 ) est égal à
) est égal à
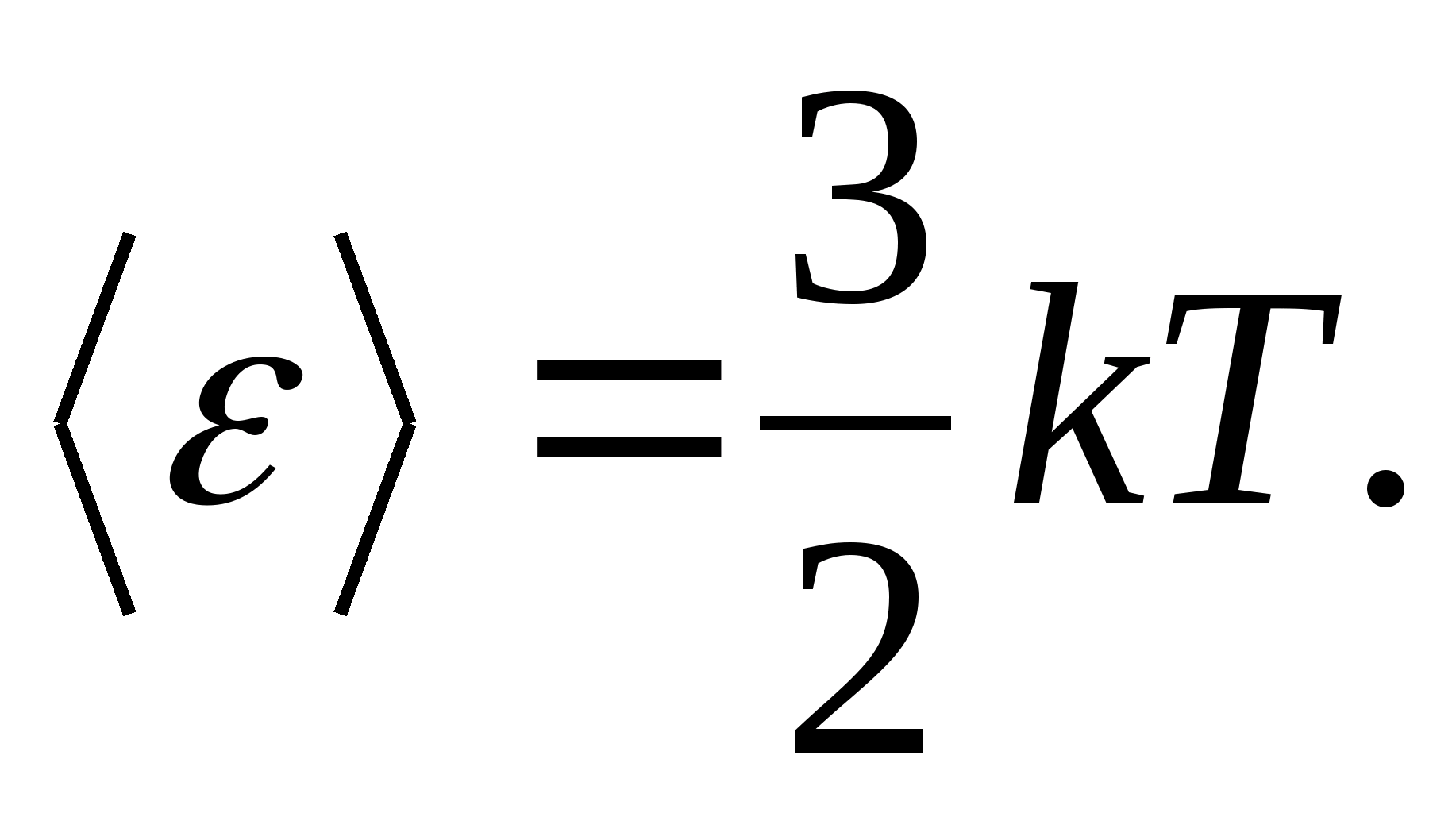
Comme des modèles d'un corps solide, considérons un réseau cristallin correctement construit, dans les nœuds duquel les particules (atomes, ions, molécules) sont prises comme points matériels, oscillent autour de leurs positions d'équilibre - nœuds de réseau - dans trois directions mutuellement perpendiculaires. Ainsi, chaque particule constituant le réseau cristallin se voit attribuer trois degrés de liberté vibrationnels, dont chacun, selon la loi sur la répartition uniforme de l'énergie sur les degrés de liberté, a pour énergie kT.
Ensuite, la valeur moyenne de l'énergie totale de la particule lors d'un mouvement oscillatoire dans le réseau cristallin
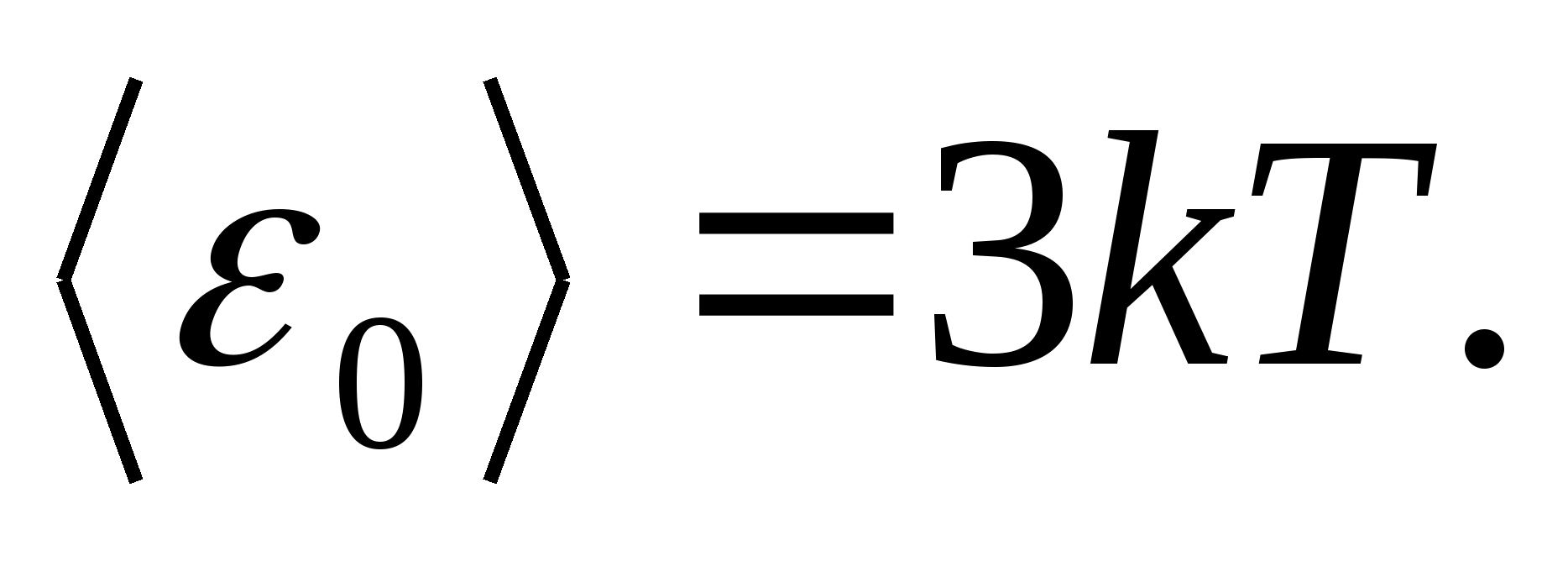
L'énergie interne totale d'une mole d'un corps solide est obtenue en multipliant l'énergie moyenne d'une particule par le nombre de particules vibrant indépendamment contenues dans une mole, c'est-à-dire à la constante d'Avogadro N UN :
où R=N UN k est la constante universelle (molaire) des gaz, R= 8,31 J/(molK).
Pour les solides, en raison du faible coefficient de dilatation thermique, les capacités calorifiques à pression constante et à volume constant ne diffèrent pratiquement pas. Par conséquent, compte tenu de (8.1), la capacité calorifique molaire d'un solide
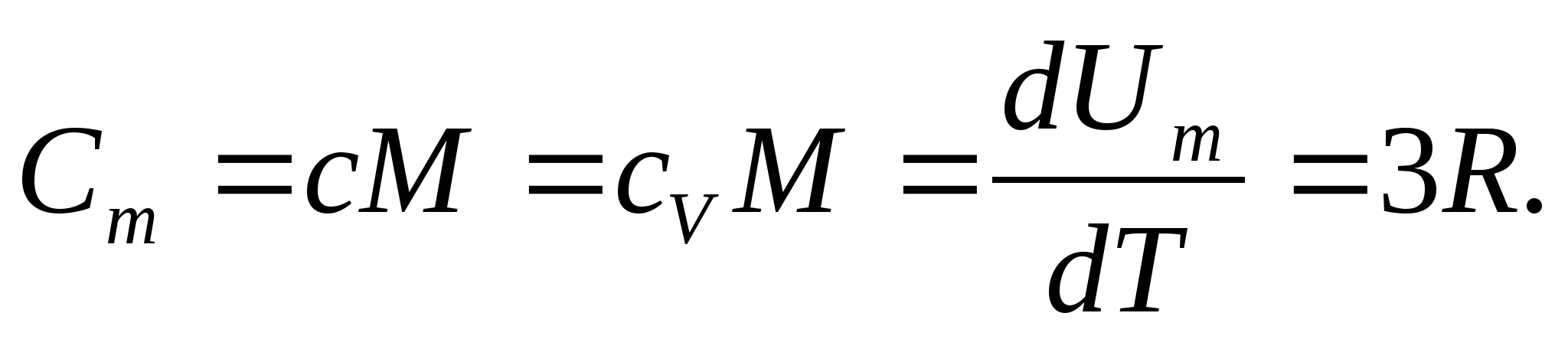 (8.2)
(8.2)
En substituant la valeur numérique de la constante molaire des gaz, on obtient :
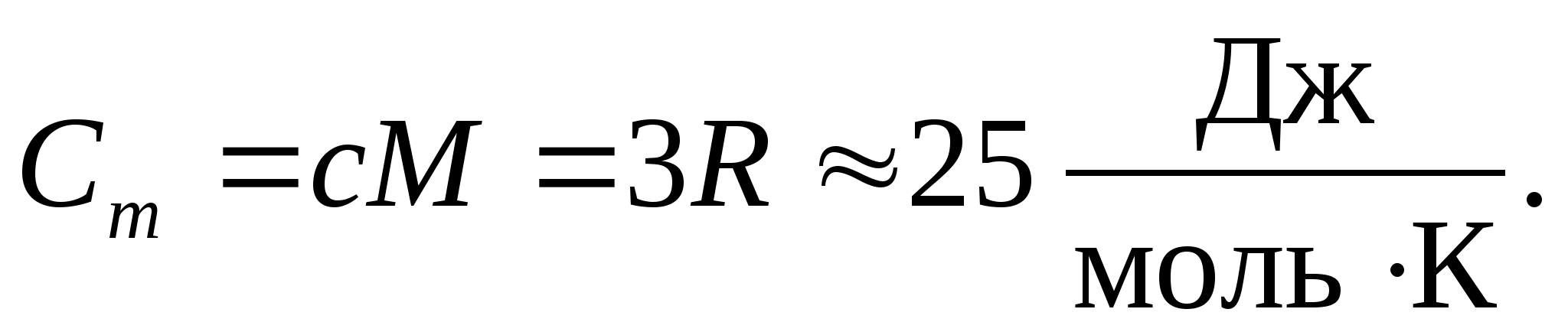
Cette égalité tient à une assez bonne approximation pour de nombreuses substances à température ambiante et est appelée Loi Dulong et Petit : capacité calorifique molaire de tous les cristallins chimiquement simples solides environ égal à 25 J/(mol À). Lorsque la température diminue, les capacités calorifiques de tous les solides diminuent, se rapprochant de zéro à J0. Près du zéro absolu, la capacité calorifique molaire de tous les corps est proportionnelle à T 3, et ce n'est qu'à une température suffisamment élevée caractéristique de chaque substance que l'égalité (8.2) commence à se vérifier. Ces caractéristiques des capacités thermiques des solides à basse température peuvent être expliquées à l'aide de la théorie quantique de la capacité thermique créée par Einstein et Debye.
Pour déterminer expérimentalement la capacité calorifique, le corps étudié est placé dans un calorimètre chauffé par un courant électrique. Si la température du calorimètre avec l'échantillon d'essai est augmentée très lentement à partir de la valeur initiale J 0 à J, alors l'énergie du courant électrique sera utilisée pour chauffer l'échantillon et le calorimètre :
où je et tu− courant et tension du réchauffeur ; − temps de chauffe ; m 0 et m sont les masses du calorimètre et de la prise d'essai, Avec 0 et Avec− capacités calorifiques spécifiques du calorimètre et de la prise d'essai, Q− perte de chaleur vers l'isolation thermique du calorimètre et vers l'espace environnant.
Pour exclure de l'équation (8.3) la quantité de chaleur dépensée pour chauffer le calorimètre et la perte de chaleur vers l'espace environnant, il est nécessaire, à la même puissance de chauffage, de chauffer le calorimètre vide (sans échantillon) à partir de la température initiale J 0 pour le même écart de température J. La perte de chaleur dans les deux cas sera presque la même et très faible, si la température de l'enveloppe de protection du calorimètre dans les deux cas est constante et égale à la température ambiante :
Les équations (8.3) et (8.4) impliquent
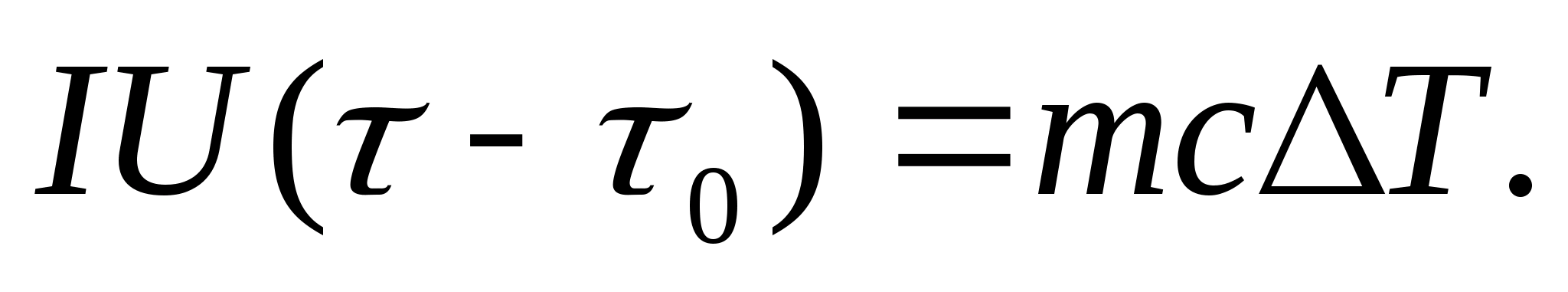 (8.5)
(8.5)
L'équation (8.5) peut être utilisée pour déterminer expérimentalement la capacité calorifique spécifique du matériau de l'échantillon d'essai. En changeant la température du calorimètre, il est nécessaire de tracer la dépendance de la différence de temps de chauffage sur le changement de température de l'échantillon à tester: (
−
0)=F(J), selon le coefficient angulaire dont 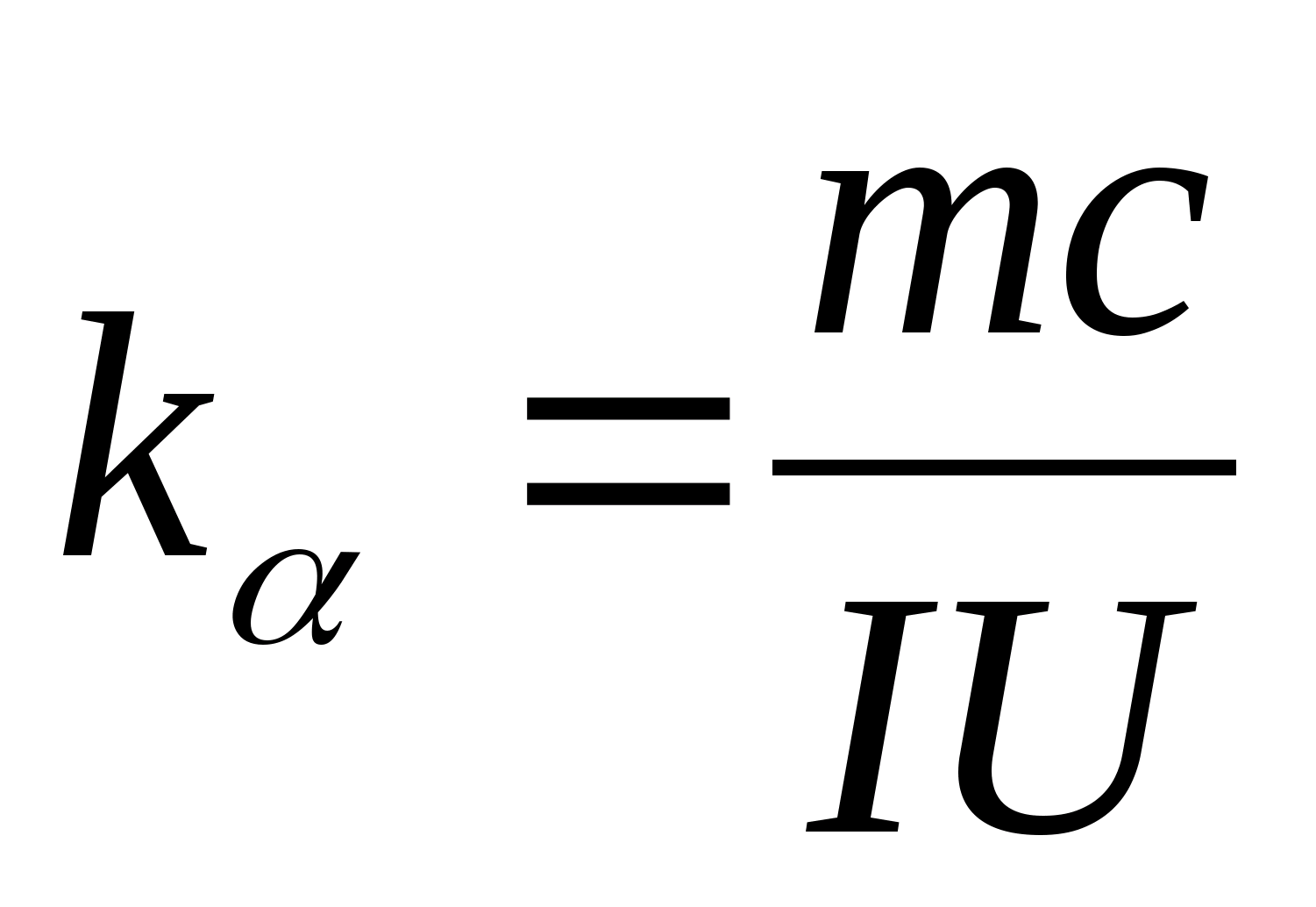 la capacité thermique spécifique de l'échantillon peut être déterminée.
la capacité thermique spécifique de l'échantillon peut être déterminée.
Description de l'installation du laboratoire
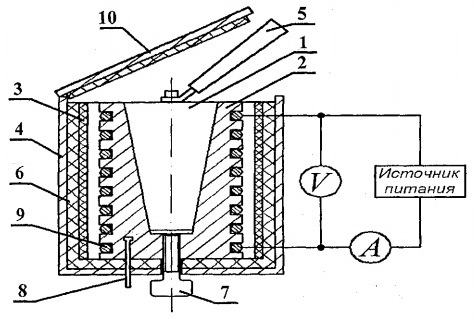
Pour déterminer la capacité calorifique des solides, le montage expérimental FPT1-8 est conçu, dont la vue générale est illustrée à la Fig. 8.1. L'installation se compose de trois parties principales : l'unité instrumentale 1, l'unité d'éléments de commande 2 et le rack 3.
Sur le panneau avant de l'unité de contrôle 1 se trouvent : l'interrupteur à bascule « RÉSEAU », qui connecte l'unité au réseau de tension d'alimentation ; interrupteur à bascule "HEATING", qui allume le chauffage ; le régulateur «CHAUFFAGE», à l'aide duquel la puissance de chauffage est régulée; voltmètre et ampèremètre, qui mesurent la tension et le courant dans le circuit de chauffage ; chronomètre, qui mesure le temps de chauffage du calorimètre. Le chronomètre est activé lorsque l'unité d'instrument est sous tension.
Le bloc de l'élément de travail 2 est fermé à l'avant avec un écran amovible de org. verre. Lors de l'exécution du travail, l'écran est accroché au mur arrière du bloc de l'élément de travail. Sur le bloc de panneau de l'élément de travail se trouve un thermomètre numérique 6 pour mesurer la température. Au fond, dans les nids, il y a 5 échantillons d'essai faits de divers matériaux et une poignée pour placer les échantillons dans le réchauffeur.
Le réchauffeur 4 est constitué d'une enveloppe métallique, d'un matériau calorifuge et d'un calorimètre.

Les échantillons sont chauffés dans un calorimètre dont le schéma est illustré à la Fig. 8.2.
Le calorimètre est un boîtier en laiton 2 avec un trou conique, dans lequel est inséré l'échantillon d'essai 1. Sur la surface extérieure du boîtier, un serpentin chauffant 9 est placé dans des rainures spéciales. À l'extérieur, le boîtier du calorimètre est isolé thermiquement avec des couches d'amiante 3 et fibre de verre 6 et fermé par un boîtier en aluminium 4. Le calorimètre est fermé par un couvercle calorifuge 10. Après la fin de l'expérience, l'échantillon peut être poussé hors du trou conique du corps du calorimètre à l'aide de vis 7. Pour retirer l'échantillon chauffé du calorimètre et installer l'échantillon dans le réchauffeur, on utilise la poignée 5, située dans une douille spéciale à côté des échantillons à étudier.
La température du calorimètre est mesurée par un thermomètre numérique dont le capteur de température 8 est situé dans le boîtier 2 du calorimètre.
Sécurité
Lors de l'exécution des travaux, les exigences générales de sécurité du laboratoire de mécanique sont respectées.
Demande de service
ATTENTION! Le calorimètre met beaucoup de temps à refroidir, donc après avoir mesuré toutes les valeurs de temps 0 chauffage d'un calorimètre vide, couper immédiatement le chauffage (voir point 4 ci-dessous). La température de chauffage maximale pour cet appareil est de +44С.
1. Retirez le couvercle transparent de l'unité d'élément de travail de l'installation et accrochez-le sur les vis du panneau arrière. Réglez le bouton de commande HEAT au minimum. Activez l'installation avec le commutateur à bascule "RÉSEAU".
2. Fermez hermétiquement le couvercle du calorimètre vide. Allumez l'interrupteur à bascule "HEAT". À l'aide du régulateur HEAT, réglez la tension sur 10-20 V (plus la tension est élevée, plus le chauffage est rapide). Écrivez dans le tableau. 8.1 valeurs de tension sélectionnées tu et actuel je.
3. A partir de la température du calorimètre t 0 spécifié par l'enseignant, après un intervalle de 1С entrer dans le tableau. 8.1 valeurs temporelles 0 correspondant à chaque température atteinte t.
4. Éteignez l'interrupteur à bascule "HEAT", ouvrez le couvercle et refroidissez le calorimètre à la température initiale t 0 . Pour refroidir rapidement le calorimètre, vous pouvez descendre l'un des échantillons dans le calorimètre, sauf celui indiqué par le professeur (lors de l'installation de l'échantillon dans le calorimètre, tournez la vis en bas du calorimètre vers la gauche). La température va commencer à baisser. Lorsque la vitesse de refroidissement diminue, retirez l'échantillon chauffé et insérez le suivant (froid), à l'exception de celui indiqué par l'enseignant. Pour retirer l'échantillon, tournez la vis au bas du calorimètre vers la droite (dans le sens des aiguilles d'une montre), puis retirez l'échantillon avec la poignée.
Tableau 8.1
|
J= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =AvecM, J/(molK) |
||||||||
5. En tournant la vis vers la gauche, placez l'un des échantillons de test, prélevé selon les instructions de l'enseignant, dans le calorimètre. Fermez hermétiquement le couvercle du calorimètre et attendez 2 à 3 minutes que le calorimètre et les températures de l'échantillon s'égalisent.
6. Allumez l'interrupteur à bascule "HEAT" et réglez la même tension dans le circuit que lors du chauffage du calorimètre vide.
7. Partant de la même température initiale du calorimètre t 0, après un intervalle de 1С entrer dans le tableau. 8.1 valeurs temporelles correspondant à chaque température atteinte t.
8. Réglez le régulateur "CHAUFFAGE" à l'extrême gauche (au minimum), éteignez l'interrupteur à bascule "CHAUFFAGE", ouvrez le couvercle du calorimètre. Pour retirer l'échantillon du calorimètre, tourner la vis vers la droite, puis retirer l'échantillon chauffé à l'aide de la poignée.
9. Éteignez l'appareil avec l'interrupteur à bascule "NETWORK".
10. Traduire toutes les valeurs des quantités 0 et en valeurs en secondes (sans minutes) et entrez-les dans le tableau. 8.1. Pour chaque ligne du tableau. 8.1 calculer les valeurs de = − 0 et J= t− t 0 .
11. Effectuez un calcul estimé de la capacité thermique spécifique de l'échantillon à l'aide de la formule 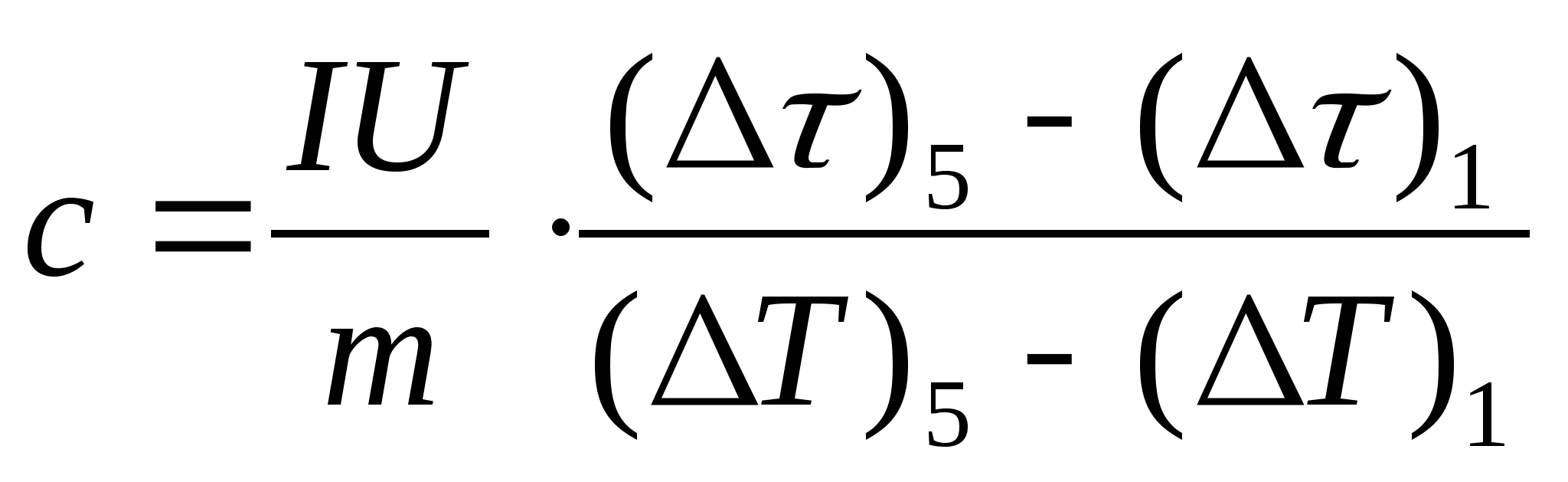 , où la masse de l'échantillon m=139,5 g (laiton) ou m=129,7 g (acier) ou
m= 46,05 g (duralumin). Venez voir le professeur pour vérification.
, où la masse de l'échantillon m=139,5 g (laiton) ou m=129,7 g (acier) ou
m= 46,05 g (duralumin). Venez voir le professeur pour vérification.
Traitement des résultats de mesure
1. Tracé
=f(J) la dépendance de la différence de temps de chauffage du calorimètre avec l'échantillon et le calorimètre vide sur le changement de température du calorimètre, sélectionnez deux points quelconques sur le graphique et déterminez la pente de la droite à l'aide de la formule 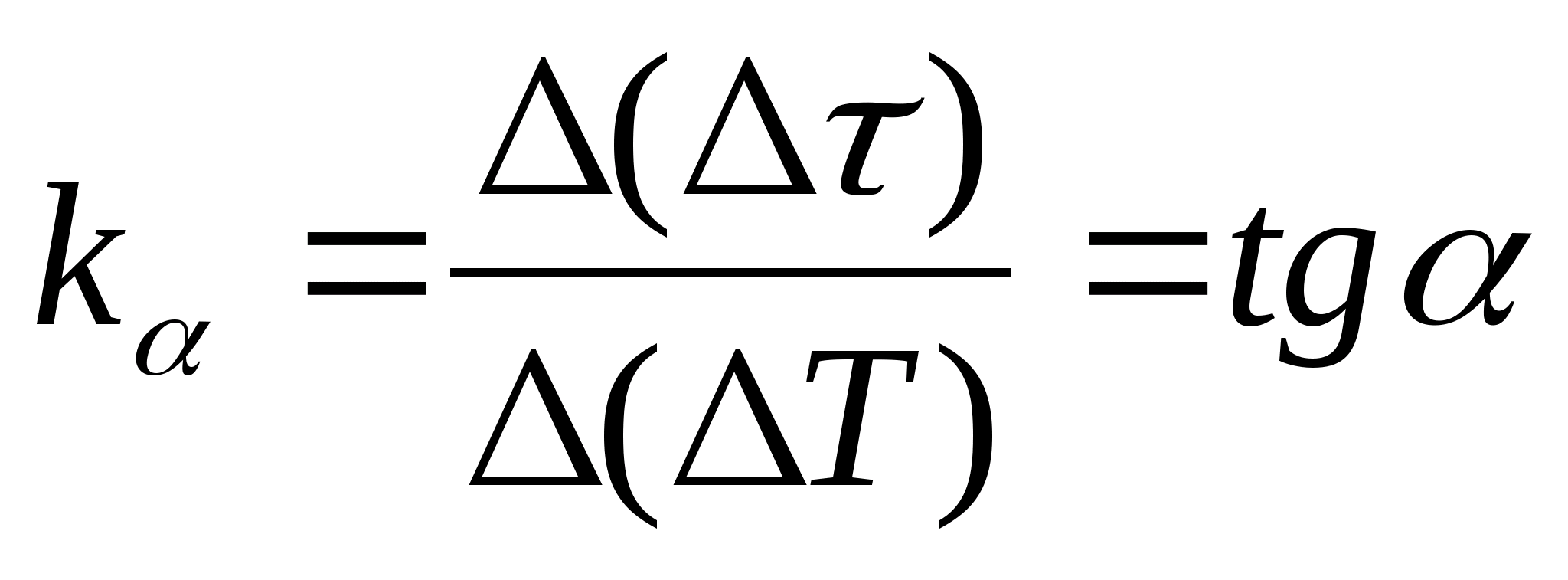 , où
− l'angle d'inclinaison du graphique par rapport à l'axe J
(si les unités de
et J sont représentés sur les deux axes sous forme de segments de même longueur).
, où
− l'angle d'inclinaison du graphique par rapport à l'axe J
(si les unités de
et J sont représentés sur les deux axes sous forme de segments de même longueur).
2. Utilisation de la valeur de la pente k
, déterminer la capacité calorifique spécifique de l'échantillon à l'aide de la formule 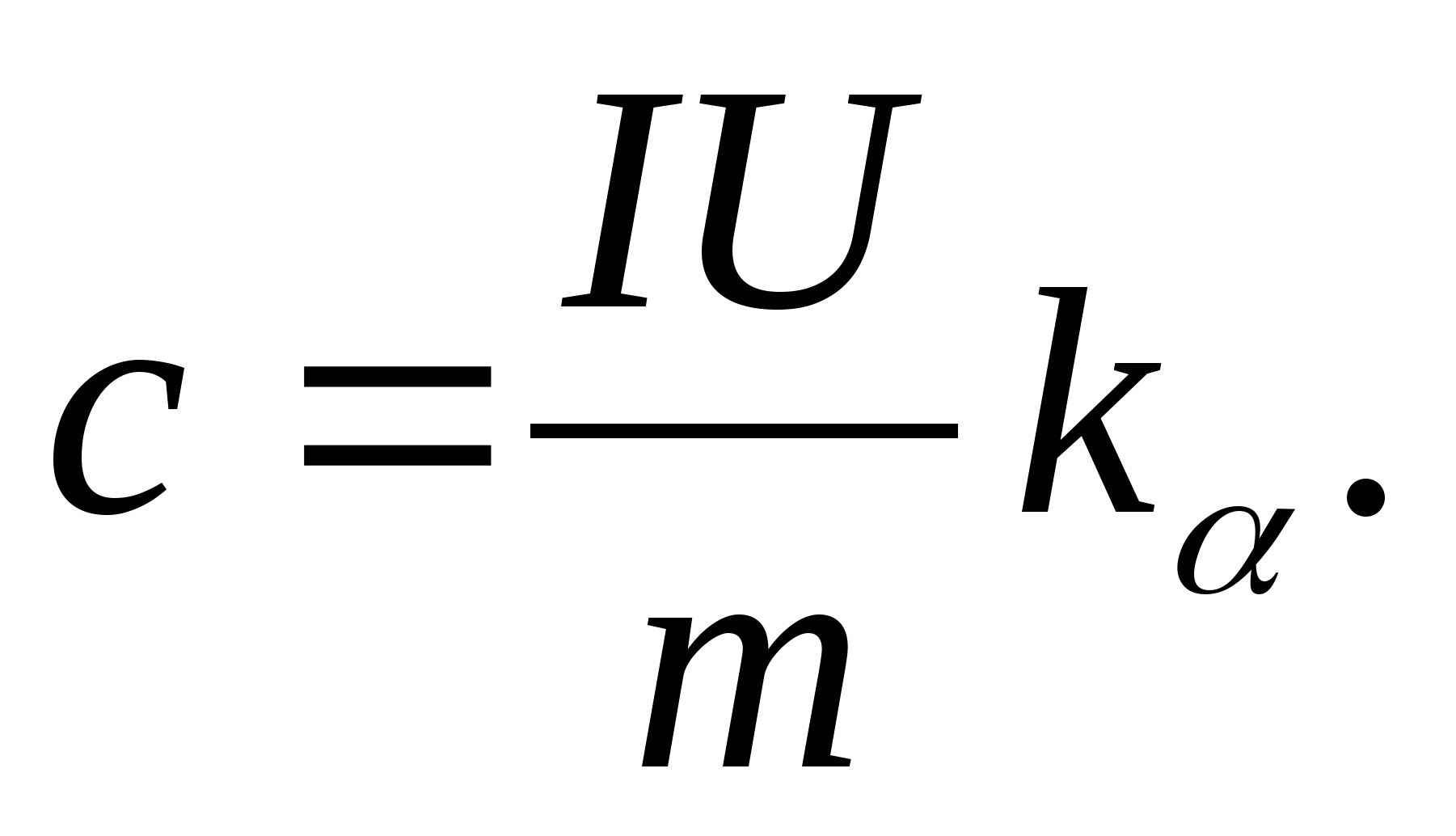
3. À l'aide des données du tableau 8.2 (ou du tableau périodique), déterminez la capacité calorifique molaire de l'échantillon à l'aide de la formule C m =AvecM.
Tableau 8.2
|
Échantillon de matériel |
Masse atomique, kg/mol |
|
Comme modèle d'un corps solide, considérons un réseau cristallin correctement construit, dans les nœuds duquel les particules (atomes, ions, molécules), prises comme points matériels, oscillent autour de leurs positions d'équilibre - nœuds du réseau - dans trois directions mutuellement perpendiculaires . Ainsi, à chaque particule constituant le réseau cristallin se voient attribuer trois degrés de liberté vibrationnels dont chacun, selon la loi d'équipartition de l'énergie sur les degrés de liberté (voir § 50), a pour énergie kT.
Énergie interne d'une taupe d'un corps solide
U m \u003d 3N A kT \u003d 3RT,
où N A est la constante d'Avogadro; N UN k= R (R est la constante molaire des gaz).
Capacité calorifique molaire d'un solide
c'est-à-dire la capacité thermique molaire (atomique) corps chimiquement simplesà l'état cristallin est le même (égal à 3 R) et ne dépend pas de la température. Cette loi a été empiriquement obtenue par les scientifiques français P. Dulong (1785-1838) et L. Petit (1791-1820) et est TitreLoi Dulong et Petit.
Si le solide est un composé chimique (par exemple, NaCl), alors le nombre de particules dans la mole n'est pas égal à la constante d'Avogadro, mais est égal à nN UN , où n - nombre d'atomes dans une molécule (pour NaCl, le nombre de particules dans une mole est de 2 N et, ainsi, une mole de NaCl contient des atomes de N A Na et des atomes de N A Cl). Donc la capacité calorifique molaire composés chimiques solides
C V \u003d 3R25n J / (mol K),
c'est-à-dire égale à la somme des capacités calorifiques atomiques des éléments qui composent ce composé.
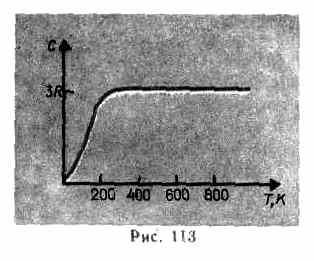
Comme le montrent les données expérimentales (tableau 4), pour de nombreuses substances, la loi de Dulong et Petit se satisfait d'une assez bonne approximation, bien que certaines substances (C, Be, B) présentent des écarts importants par rapport aux capacités calorifiques calculées. De plus, comme pour les gaz (voir § 53), des expériences de mesure de la capacité calorifique des solides à basse température ont montré qu'elle dépendait de la température (fig. 113). Près de zéro Kelvin, la capacité calorifique des corps est proportionnelle à T 3 , et ce n'est qu'à des températures suffisamment élevées, caractéristiques de chaque substance, que la condition (73.1) est satisfaite. Le diamant, par exemple, a une capacité calorifique de 3 R à 1800K ! Cependant, pour la plupart des solides, la température ambiante est déjà suffisamment élevée.
L'écart entre les valeurs expérimentales et théoriques des capacités calorifiques calculées sur
la base de la théorie classique, expliquée, basée sur la théorie quantique des capacités thermiques, A. Einstein et P. Debye (1884-1966).
§ 74. Évaporation, sublimation, fusion et cristallisation. Corps amorphes
Dans les liquides comme dans les solides, il existe toujours un certain nombre de molécules dont l'énergie est suffisante pour vaincre l'attraction d'autres molécules et qui sont capables de se détacher de la surface d'un liquide ou d'un solide et de passer dans l'espace qui les entoure. Ce processus pour le liquide est appelé évaporation(ou vaporisation), pour solides -sublimation(ou sublimation).
L'évaporation des liquides se produit à n'importe quelle température, mais son intensité augmente avec l'augmentation de la température. Parallèlement au processus d'évaporation, un processus de compensation a lieu condensation vapeur en liquide. Si le nombre de molécules quittant le liquide par unité de temps à travers une unité de surface est égal au nombre de molécules passant de la vapeur au liquide, alors équilibre dynamique entre les processus d'évaporation et de condensation. Une vapeur en équilibre avec son liquide est appelée riche(voir aussi § 62).
Pour la plupart des solides, le processus de sublimation aux températures ordinaires est négligeable et la pression de vapeur à la surface du solide est faible ; elle augmente avec l'augmentation de la température. Sublimez intensément des substances telles que le naphtalène, le camphre, qui se détectent par une odeur forte et caractéristique. La sublimation se produit de manière particulièrement intensive dans le vide - elle est utilisée pour fabriquer des miroirs. Un exemple bien connu de sublimation est la transformation de la glace en vapeur - le linge humide sèche dans le froid.
Si un corps solide est chauffé, alors il énergie interne(la somme de l'énergie des vibrations des particules aux sites du réseau et de l'énergie d'interaction de ces particules) augmente. Lorsque la température augmente, l'amplitude des oscillations des particules
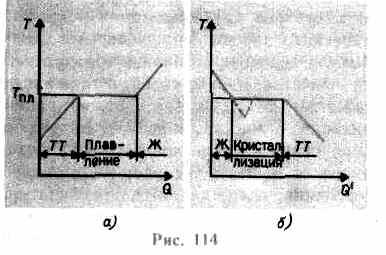
augmente jusqu'à ce que le réseau cristallin s'effondre - le solide fond. Sur la fig. 114 un une dépendance approximative est indiquée J(Q), où Q- la quantité de chaleur reçue par le corps lors de la fonte. Comme le message au solide chaleur corps sa température augmente, et au point de fusion J pl commence la transition du corps d'un état solide à un état liquide. Température J PL reste constant jusqu'à ce que tout le cristal soit fondu, et alors seulement la température du liquide recommence à augmenter.
Chauffer un solide jusqu'à J PL ne le convertit pas encore à l'état liquide, puisque l'énergie des particules de la substance doit être suffisante pour détruire le réseau cristallin. Dans le processus de fusion, la chaleur transmise à la substance est utilisée pour effectuer un travail sur la destruction du réseau cristallin, et donc T pl = const jusqu'à ce que tout le cristal soit fondu. Puis la chaleur fournie ira à nouveau augmenter l'énergie des particules du liquide et sa température commencera à monter. La quantité de chaleur nécessaire pour faire fondre 1 kg d'une substance est appelée chaleur spécifique de fusion.
Si le liquide est refroidi, le processus se déroule dans le sens opposé (Fig. 114, b; Q" - la quantité de chaleur dégagée par le corps lors de la cristallisation) : d'abord, la température du liquide diminue, puis à température constante égale à T pl, commence cristallisation, après son achèvement, la température du cristal commence à diminuer. Pour la cristallisation d'une substance, la présence de ce qu'on appelle centres de cristallisation - noyaux cristallins, qui peuvent être non seulement des cristaux de la substance formée, mais aussi des impuretés, ainsi que de la poussière, de la suie, etc. L'absence de centres de cristallisation dans un liquide pur rend difficile la formation de cristaux microscopiques, et la substance, restant à l'état liquide, se refroidit à une température inférieure à la température de cristallisation, formant ainsi liquide surfondu(sur 114, b il correspond à la courbe en pointillés). Avec une forte surfusion, la formation spontanée de centres de cristallisation commence et la substance cristallise assez rapidement.
Habituellement, la surfusion de la masse fondue se produit de fractions à des dizaines de degrés, mais pour un certain nombre de substances, elle peut atteindre des centaines de degrés. En raison de la viscosité élevée, les liquides fortement surfondus perdent leur fluidité, conservant leur forme, comme les solides. Ces corps sont appelés solides amorphes; ceux-ci incluent les résines, la cire, la cire à cacheter, le verre. Les corps amorphes, étant ainsi des liquides surfondus, isotrope, c'est-à-dire que leurs propriétés sont les mêmes dans toutes les directions; pour eux, ainsi que pour les liquides, il est caractéristique commande à court terme dans l'arrangement des particules; en eux, contrairement aux liquides, la mobilité des particules est plutôt faible. Une caractéristique des corps amorphes est qu'ils n'ont pas de point de fusion spécifique, c'est-à-dire qu'il est impossible d'indiquer une température spécifique au-dessus de laquelle un état liquide pourrait être déterminé, et en dessous d'un état solide. Par expérience, on sait que dans les corps amorphes, le processus de cristallisation peut être observé au fil du temps, par exemple, des cristaux apparaissent dans le verre ; celui-ci, perdant sa transparence, commence à se troubler et à se transformer en un corps polycristallin.
Récemment, l'utilisation répandue dans économie nationale a obtenu polymères- des corps amorphes organiques dont les molécules sont constituées d'un grand nombre de longues chaînes moléculaires identiques reliées par des liaisons chimiques (valence). Les polymères comprennent à la fois des substances organiques naturelles (amidon, protéines, caoutchouc, fibres, etc.) et artificielles (plastique, caoutchouc, polystyrène, lavsan, nylon, etc.). Les polymères sont une force et une élasticité inhérentes; certains polymères résistent à un étirement de 5 à 10 fois leur longueur d'origine. Ceci s'explique par le fait que de longues chaînes moléculaires peuvent, sous déformation, soit se replier en boules denses, soit s'étirer en lignes droites. L'élasticité des polymères ne se manifeste que dans une certaine plage de températures, en dessous de laquelle ils deviennent durs et cassants, et au-dessus - plastique. Bien que de nombreux matériaux polymères synthétiques aient été créés (fibres artificielles, substituts du cuir, matériaux de construction, substituts du métal, etc.), la théorie des polymères n'est pas encore complètement développée. Son développement est déterminé par les exigences de la technologie moderne, qui nécessite la synthèse de polymères aux propriétés prédéterminées.
La capacité calorifique spécifique d'une substance s'entend comme la valeur
, (1)
où est la quantité de chaleur transmise au corps.
est le changement de température qui se produit dans
en raison du transfert de chaleur au corps,
m est la masse du corps chauffé.
L'expérience détermine généralement la moyenne chaleur spécifique substance c, numériquement égale à la quantité de chaleur qui doit être conférée à une unité de masse de cette substance pour élever sa température de :
(2),
où est la différence entre les températures finale et initiale du corps étudié.
Diverses méthodes calorimétriques sont utilisées pour déterminer expérimentalement la capacité calorifique. La variété de ces méthodes est due au fait que la mesure précise de la quantité de chaleur transmise au corps nécessite l'élimination des pertes de chaleur qui ne sont pas prises en compte lors du chauffage du corps étudié.
Habituellement, dans les soi-disant calorimètres à coque isotherme, une correction calculée ou déterminée expérimentalement pour le rayonnement est introduite, c'est-à-dire la quantité de chaleur que le calorimètre reçoit ou dégage dans l'environnement extérieur par rayonnement au cours de l'expérience.
Cependant, il est possible de réduire considérablement les pertes de chaleur en introduisant une bonne isolation thermique ou en réduisant la durée de l'expérience, ce qui est obtenu par une vitesse de chauffage élevée de l'échantillon ~ (méthode pulsée pour mesurer la capacité thermique), à laquelle les pertes de chaleur seront être faible par rapport à la quantité totale de chaleur fournie.
L'une des méthodes les plus précises pour déterminer la capacité calorifique est la méthode du calorimètre adiabatique. Les difficultés liées à la nécessité de prendre en compte les pertes de chaleur dans les calorimètres de ce type sont éliminées par le fait que les mesures sont effectuées dans des conditions d'équilibre thermique, c'est-à-dire dans des conditions de températures égales de l'échantillon à l'étude et du bloc entourant l'échantillon. . Les avantages de cette méthode, ainsi qu'une grande précision, incluent également la possibilité de déterminer la capacité calorifique des solides dans une large plage de températures, ce qui est particulièrement important si les substances subissent des transformations de phase.
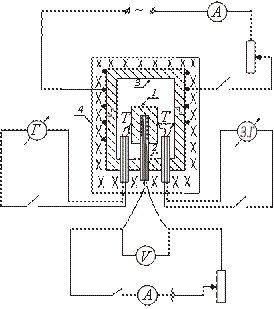
Le dispositif de l'un des types de calorimètre adiabatique est représenté schématiquement sur la figure. L'échantillon d'essai 1 est placé dans le bloc de cuivre 3 et avec lui est chauffé dans le four 4. L'élément chauffant 2 est introduit à l'intérieur de l'échantillon, ce qui permet un chauffage supplémentaire de l'échantillon.
Après avoir allumé le four 4, dans lequel le bloc avec l'échantillon est placé, la température de l'échantillon commence à augmenter, restant en dessous de la température du bloc. Pour établir l'égalité entre les températures de l'échantillon et du bloc, allumez le réchauffeur placé à l'intérieur de l'échantillon. Lorsque la température de l'échantillon est légèrement supérieure à la température du bloc, le chauffage interne est désactivé.
Par la suite, ce réchauffeur est allumé et éteint périodiquement, de sorte que la différence de température entre l'échantillon et le bloc change de signe tout le temps.
Au moment où il est égal à zéro (lorsque le chauffage interne est allumé), il n'y a pas d'échange de chaleur entre l'échantillon et le bloc, et toute la quantité de chaleur dégagée par le chauffage interne est dépensée uniquement pour chauffer l'échantillon ; la chaleur spécifique dans ce cas peut être déterminée par la formule (2).
La quantité de chaleur dégagée par le réchauffeur interne est déterminée par la formule :
où I est le courant du réchauffeur interne ;
V est la chute de tension à ses bornes ;
- l'intervalle de temps pendant lequel la température a augmenté de .
Alors
(4)
où est le temps pendant lequel la température de l'échantillon a changé de .
Sous forme différentielle, la formule (4) a la forme
(5)
La température de l'échantillon est mesurée avec un thermocouple T. La différence de température entre le bloc et l'échantillon est mesurée avec un thermocouple différentiel. Pour déterminer la température de l'échantillon, on utilise une courbe d'étalonnage du thermocouple T. La différence de température entre le bloc et l'échantillon est déterminée en divisions de l'échelle du galvanomètre (puisqu'il suffit de fixer le moment où la différence de température entre le bloc et le l'échantillon change de signe).
Achèvement des travaux.
L'échantillon est placé sur un réchauffeur placé à l'intérieur d'un bloc de cuivre. Les jonctions thermocouple T et sont reliées à l'échantillon et au bloc. Le four est fermé par un couvercle. L'enroulement électrique du four, dans lequel le bloc est placé, est allumé. Le réchauffeur placé à l'intérieur de l'échantillon est périodiquement allumé et éteint, et les valeurs de I et V sont enregistrées dans le circuit du réchauffeur interne.
Avant de commencer les mesures, il est nécessaire de vérifier la position zéro du galvanomètre à miroir. Pour ce faire, en déconnectant le thermocouple du galvanomètre, ils s'attendent à ce que le lapin cesse de fluctuer le long de l'échelle. Si après cela l'image du fil ne coïncide pas avec zéro, alors en déplaçant l'échelle cette coïncidence est obtenue.
Des courbes de dépendance de T et du temps sont tracées.
A partir de la pente de la courbe T(t) au point où elle change de signe (c'est-à-dire lorsque l'équilibre thermique est établi), la chaleur spécifique est calculée à l'aide de la formule (5). Cette capacité calorifique se rapporte à la température à lire sur la courbe T(t) au moment où la différence de température entre le bloc et l'échantillon change de signe.
