في أي وحدات يتم قياس السعة الحرارية؟ السعة الحرارية للغازات. أنواع السعات الحرارية
السعة الحرارية للجسم هي كمية الحرارة التي يجب نقلها إلى جسم معين من أجل رفع درجة حرارته بمقدار درجة واحدة. عند تبريد الجسم بدرجة واحدة ، يُطلق نفس القدر من الحرارة. السعة الحرارية تتناسب مع كتلة الجسم. تسمى السعة الحرارية لوحدة كتلة الجسم محددة ، ويسمى ناتج الحرارة النوعية بالكتلة الذرية أو الجزيئية الذري أو المولي ، على التوالي.
القدرات الحرارية مواد مختلفةتختلف اختلافا كبيرا عن بعضها البعض. لذا، حرارة نوعيةالماء عند 20 درجة مئوية هو 4200 جول / كجم كلفن ، خشب صنوبر - 1700 ، هواء - 1010. بالنسبة للمعادن ، يكون أقل: الألومنيوم - 880 جول / كجم كلفن ، حديد - 460 ، نحاس - 385 ، رصاص - 130. حرارة محددة يزيد بشكل طفيف مع درجة الحرارة (عند 90 درجة مئوية ، تبلغ السعة الحرارية للماء 4220 جول / كجم كلفن) وتتنوع بشكل كبير أثناء تحولات الطور: السعة الحرارية للجليد عند 0 درجة مئوية أقل مرتين من سعة الماء ؛ تبلغ السعة الحرارية لبخار الماء عند 100 درجة مئوية حوالي 1500 جول / كجم كلفن.
تعتمد السعة الحرارية على الظروف التي تتغير فيها درجة حرارة الجسم. إذا لم تتغير أبعاد الجسم ، فإن كل الحرارة تذهب لتغيير الطاقة الداخلية. نحن هنا نتحدث عن السعة الحرارية بحجم ثابت. عند الضغط الخارجي الثابت ، بسبب التمدد الحراري ، يتم تنفيذ العمل الميكانيكي ضد القوى الخارجية ، ويتطلب التسخين إلى درجة حرارة معينة مزيدًا من الحرارة. لذلك ، فإن السعة الحرارية عند الضغط المستمر تكون دائمًا أكبر من. إلى عن على غازات مثالية(انظر الشكل) ، حيث R هو ثابت الغاز ، يساوي 8.32 J / mol K.
يقاس عادة. الطريقة الكلاسيكيةقياسات السعة الحرارية هي كما يلي: يتم تسخين الجسم المراد قياس سعته الحرارية إلى درجة حرارة معينة ويوضع في مسعر بدرجة حرارة أولية ، مملوء بالماء أو سائل آخر بسعة حرارية معروفة و - السعة الحرارية لـ المسعر والسائل).
من خلال قياس درجة الحرارة في المسعر بعد تحقيق التوازن الحراري ، يمكن حساب السعة الحرارية للجسم باستخدام الصيغة:
![]()
أين و هي كتل الجسم و السوائل و المسعرات.
النظرية الأكثر تطورًا هي السعة الحرارية للغازات. في درجات الحرارة العادية ، يؤدي التسخين بشكل أساسي إلى تغيير في طاقة الحركة الانتقالية والدورانية لجزيئات الغاز. بالنسبة للسعة الحرارية المولية للغازات الأحادية ، تعطي النظرية ، ثنائي الذرة ومتعدد الذرات - و. في درجات حرارة منخفضة للغاية ، تكون السعة الحرارية أقل إلى حد ما بسبب التأثيرات الكمية (انظر الشكل. ميكانيكا الكم). في درجات حرارة عاليةتضاف طاقة الاهتزازات ، وتزداد السعة الحرارية للغازات المتعددة الذرات مع زيادة درجة الحرارة.
السعة الحرارية الذرية للبلورات ، وفقًا للنظرية الكلاسيكية ، تساوي ، وهو ما يتوافق مع قانون Dulong و Petit التجريبي (الذي أنشأه العالمان الفرنسيان P. Dulong و A. Petit في عام 1819). نظرية الكمتؤدي السعة الحرارية إلى نفس النتيجة في درجات الحرارة المرتفعة ، ولكنها تتوقع انخفاضًا في السعة الحرارية مع انخفاض درجة الحرارة. بالقرب من الصفر المطلق ، تميل السعة الحرارية لجميع الأجسام إلى الصفر (القانون الثالث للديناميكا الحرارية).
السعة الحرارية للجسم- هذا هو الكمية المادية، التي تحددها نسبة كمية الحرارة التي يمتصها الجسم عند تسخينه ، إلى التغير في درجة حرارته:
المعنى المادي للسعة الحرارية للجسم: السعة الحرارية للجسم تساوي كمية الحرارة التي يمتصها الجسم عند تسخينه أو إطلاقه عند تبريده بمقدار 1 كلفن.
نظرًا لأن السعات الحرارية متغيرة ، فإنها تميز بين السعات الحرارية المتوسطة والحقيقية. تحت متوسط السعة الحرارية ، فهم نسبة كمية الحرارة ف ، تلخيصًا لوحدة كمية مادة (غاز) ، للتغير في درجة حرارتها من ر 1 قبل ر 2 شريطة أن يكون الاختلاف في درجة الحرارة ر 2 - ت 1 هي قيمة محدودة. يُشار إلى متوسط سعة الكتلة والحجم والسعة الحرارية المولية ، على التوالي ، بالرمز ج م ، ج م ' و م . من تعريف متوسط السعة الحرارية ، يترتب على ذلك أنه إذا ارتفعت درجة حرارة الغاز منها ر 1 قبل ر 2 ثم متوسط السعة الحرارية [kJ / (kg * K)]
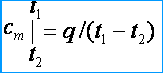
في ظل السعة الحرارية الحقيقية ، فهم السعة الحرارية للغاز ، والتي تقابل تغيرًا متناهي الصغر في درجة حرارة الغاز ، بما يتوافق مع تغير متناهي الصغر في درجة الحرارة د ، بمعنى آخر.
ج = دق / دت ،
أين دق = cdt.
حرارة نوعيةهي قدرة المواد المختلفة على امتصاص الحرارة عند تسخينها. يتم تحديد السعة الحرارية النوعية لمادة ما بنسبة كمية الحرارة التي تتلقاها عند تسخينها إلى كتلة المادة والتغير في درجة حرارتها ، إذا: ![]()
العلاقة التي تعبر عن العلاقة بين السعات الحرارية المولية Cp و CV لها الشكل (صيغة Mayer): Cp = CV + R. أو المزيد من السعة الحرارية الموسعة غاز مثاليإذا انتقلت كمية معينة من الحرارة إلى الجسم نتيجة لانتقال الحرارة ، فإن الطاقة الداخلية للجسم وتغير درجة حرارته. كمية الحرارة Q المطلوبة لتسخين 1 كجم من مادة بمقدار 1 كلفن تسمى الحرارة النوعية للمادة ج. ج = س / (متر مكعب). في كثير من الحالات ، من الملائم استخدام السعة الحرارية المولية C: C = Mc ، حيث M هي الكتلة المولية للمادة. السعة الحرارية المحددة بهذه الطريقة ليست خاصية لا لبس فيها لمادة. وفقًا للقانون الأول للديناميكا الحرارية ، فإن التغيير في الطاقة الداخلية للجسم لا يعتمد فقط على كمية الحرارة المتلقاة ، ولكن أيضًا على العمل الذي يقوم به الجسم. اعتمادًا على الظروف التي أجريت فيها عملية نقل الحرارة ، يمكن للجسم أداء أعمال مختلفة. لذلك ، يمكن أن تتسبب نفس كمية الحرارة المنقولة إلى الجسم في تغيرات مختلفة في طاقته الداخلية ، وبالتالي في درجة الحرارة. هذا الغموض في تحديد السعة الحرارية نموذجي فقط لمادة غازية. عندما يتم تسخين الأجسام السائلة والصلبة ، لا يتغير حجمها عمليًا ، ويتبين أن عمل التمدد يساوي صفرًا. لذلك ، فإن كامل كمية الحرارة التي يتلقاها الجسم تذهب لتغيير طاقته الداخلية. على عكس السوائل و المواد الصلبة، يمكن للغاز في عملية نقل الحرارة أن يغير حجمه بشكل كبير ويقوم بعمله. لذلك ، تعتمد السعة الحرارية للمادة الغازية على طبيعة العملية الديناميكية الحرارية. عادة ، يتم أخذ قيمتين من السعة الحرارية للغازات في الاعتبار: CV هو السعة الحرارية المولية في عملية متساوية الصدور (V = const) و Cp هي السعة الحرارية المولية في عملية متساوية الضغط (p = const). في العملية عند حجم ثابت ، لا يعمل الغاز: A = 0. من القانون الأول للديناميكا الحرارية لمول واحد من الغاز يتبع QV = CVΔT = ΔU. التغير ΔU للطاقة الداخلية للغاز يتناسب طرديًا مع التغير ΔT في درجة حرارته. بالنسبة لعملية تحت ضغط ثابت ، يعطي القانون الأول للديناميكا الحرارية: Qp = ΔU + p (V2 - V1) = CVΔT + pΔV ، حيث ΔV هو التغير في حجم 1 مول من غاز مثالي عندما تتغير درجة حرارته بمقدار ΔT. يتبع من هذا: يمكن إيجاد النسبة ΔV / T من معادلة حالة الغاز المثالي المكتوب لـ 1 مول: pV = RT ، حيث R هو ثابت الغاز العام. عند p = const وهكذا ، فإن العلاقة التي تعبر عن العلاقة بين السعات الحرارية المولية Cp و CV لها الشكل (صيغة Mayer): Cp = CV + R.
ثابت الغاز يساوي عدديًا عمل تمدد 1 مول من غاز مثالي تحت ضغط ثابت عند تسخينه بمقدار 1 K. R = pV / T = 1.01 10 5 22.4 10-3 / 273 [Pa · m 3 / mol] / K = 8.31 (44) Dzh / (مول · K)
ثابت الغاز العام هو ثابت فيزيائي عالمي أساسي R ، يساوي حاصل ضرب ثابت بولتزمان k وثابت أفوجادرو
المعنى المادي: ثابت الغاز i يساوي عدديًا عمل تمدد مول واحد من غاز مثالي في عملية متساوية الضغط مع زيادة درجة الحرارة بمقدار 1 كلفن
ثابت الغاز في نظام CGS هو:
ثابت الغاز المحدد هو:
الأس الأديباتي(اتصلت في بعض الأحيان معامل في الرياضيات او درجةبواسون) - نسبة السعة الحرارية عند ضغط ثابت () إلى السعة الحرارية عند حجم ثابت (). في بعض الأحيان يطلق عليه أيضًا عامل متماثل ملحقات. يشار إليها بالحرف اليوناني (جاما) أو (كابا). يستخدم رمز الحرف بشكل أساسي في تخصصات الهندسة الكيميائية. في الهندسة الحرارية ، يتم استخدام الحرف اللاتيني.
خليط من الغازات عبارة عن مجموعة من عدة غازات غير متشابهة لا تدخل في تفاعلات كيميائية مع بعضها في ظل الظروف قيد الدراسة.
مزيج الغازات هو نظام ديناميكي حراري متجانس (لا توجد فيه واجهات تفصل الأجزاء العيانية للنظام عن بعضها البعض ، وتختلف في خصائصها وتكوينها).
ضغط جزئي P i للغاز i في الخليط هو الضغط الذي سيكون هذا الغاز تحته إذا تمت إزالة جميع الغازات الأخرى من الخليط ، وبقي V و T كما هو.
قانون دالتون - ضغط خليط من الغازات التي لا تتفاعل كيميائيًا مع بعضها البعض يساوي مجموع الضغوط الجزئية لهذه الغازات.
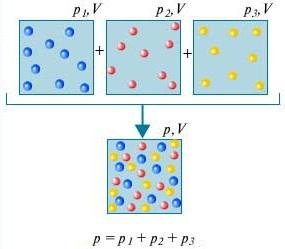
من أجل فهم ما هو قانون دالتون، ضع في اعتبارك هذا الهواء في الغرفة. إنه خليط من عدة غازات: نيتروجين (80٪) ، أكسجين (20٪). الضغط الجزئي لكل من هذه الغازات هو الضغط الذي سيتركه الغاز إذا احتل وحده الحجم بالكامل. على سبيل المثال ، إذا تم إزالة جميع الغازات باستثناء النيتروجين من الغرفة ، فإن ضغط ما تبقى سيكون الضغط الجزئي للنيتروجين. قانون دالتونينص على أن الضغط الكلي لجميع الغازات مجتمعة يساوي مجموع الضغوط الجزئية لكل غاز مأخوذ على حدة. (بالمعنى الدقيق للكلمة ، لا ينطبق القانون إلا على الغازات المثالية ، ولكن على تقدير تقريبي جيد بما فيه الكفاية ، فإنه يصف أيضًا الغازات الحقيقية).
القانون الأول للديناميكا الحرارية هو تعميم لقانون الحفاظ على الطاقة وتحويلها لنظام ديناميكي حراري. تمت صياغته على النحو التالي:
تغيير Δيو الطاقة الداخلية لنظام ديناميكي حراري غير معزول تساوي الفرق بين كمية الحرارةس إلى النظام والعملأ ، نظام مثالي فوق الهيئات الخارجية.
|
غالبًا ما تتم كتابة العلاقة التي تعبر عن القانون الأول للديناميكا الحرارية في شكل مختلف:
|
يتم استخدام كمية الحرارة التي يتلقاها النظام لتغيير طاقته الداخلية وأداء العمل على الهيئات الخارجية.
القانون الأول للديناميكا الحرارية هو تعميم للحقائق التجريبية. وفقًا لهذا القانون ، لا يمكن إنشاء الطاقة أو تدميرها ؛ يتم نقلها من نظام إلى آخر وتتحول من شكل إلى آخر. إحدى النتائج المهمة للقانون الأول للديناميكا الحرارية هي التأكيد على أنه من المستحيل إنشاء آلة قادرة على القيام بعمل مفيد دون استهلاك الطاقة من الخارج ودون أي تغييرات داخل الجهاز نفسه. تسمى هذه الآلة الافتراضية آلة الحركة الدائمة (الأبدية المتنقلة) من النوع الأول . المحاولات العديدة لإنشاء مثل هذه الآلة انتهت دائمًا بالفشل. يمكن لأي آلة القيام بعمل إيجابي أعلى الأجسام الخارجية فقط عن طريق الحصول على كمية معينة من الحرارة سمن الأجسام المحيطة أو انخفاض في Δ يوطاقتها الداخلية.
دعونا نطبق القانون الأول للديناميكا الحرارية على المعالجات المتساوية في الغازات.
مع توسع متساوي الضغط س> 0 - يمتص الغاز الحرارة ، ويقوم الغاز بعمل إيجابي. مع ضغط متساوي الضغط س < 0 – тепло отдается внешним телам. В этом случае أ < 0. Температура газа при изобарном сжатии уменьшается, تي 2 < تيواحد ؛ تنخفض الطاقة الداخلية ، Δ يو < 0.
في عملية متساوية الحرارةلا تتغير درجة حرارة الغاز ، وبالتالي ، الطاقة الداخلية للغاز ، Δ يو = 0.
في عملية متساوية (الخامس= const) الغاز لا يعمل ، أ= 0. لذلك ،
يعطي القانون الأول للديناميكا الحرارية لعملية متساوية الضغط:
|
يتم التعبير عن القانون الأول للديناميكا الحرارية لعملية متساوي الحرارة من خلال العلاقة
|
كمية الحرارة س، التي حصل عليها الغاز في عملية التمدد متساوي الحرارة ، يتحول إلى عمل على الأجسام الخارجية. تحت ضغط متساوي الحرارة ، يتم تحويل عمل القوى الخارجية الناتجة عن الغاز إلى حرارة ، والتي يتم نقلها إلى الأجسام المحيطة.
جنبا إلى جنب مع العمليات متساوية الضغط ، متساوي الضغط ، ومتساوي الحرارة ، غالبًا ما تأخذ الديناميكا الحرارية في الاعتبار العمليات التي تحدث في غياب التبادل الحراري مع الأجسام المحيطة. تسمى السفن ذات الجدران العازلة قذائف ثابتة الحرارة، وتسمى عمليات تمدد الغاز أو ضغطه في هذه الأوعية ثابت الحرارة.
في عملية ثابت الحرارةس= 0 ؛ لذلك يأخذ القانون الأول للديناميكا الحرارية الشكل
|
|
|
في معناه المادي ، القانون الأول للديناميكا الحرارية هو قانون حفظ (تغيير) الطاقة في الديناميكا الحرارية. إذا كان عمل القوى غير المحافظة ، وفقًا لقانون تغيير الطاقة في الميكانيكا ، مساويًا لزيادة الطاقة الميكانيكية للنظام (على وجه الخصوص ، فإن عمل قوى الاحتكاك التي لها علامة سالبة يساوي الانخفاض في الطاقة الميكانيكية للنظام) ، ثم وفقًا للقانون الأول للديناميكا الحرارية ، فإن زيادة الطاقة الداخلية للنظام الديناميكي الحراري تساوي مجموع عمل القوى الخارجية ، والكمال على النظام ، والطاقة المنقولة إلى النظام عن طريق نقل الحرارة. الطاقة الداخلية الكامنة(من اليونانية. المحتوى الحراري- تسخين) هو خاصية المادة، مما يشير إلى كمية الطاقة التي يمكن تحويلها إلى حرارة. الطاقة الداخلية الكامنةهي خاصية ديناميكية حرارية لمادة تشير إلى مستوى الطاقة المخزنة في هيكلها الجزيئي. هذا يعني أنه في حين أن المادة يمكن أن تحتوي على طاقة بناءً على درجة الحرارة والضغط ، إلا أنه لا يمكن تحويلها كلها إلى حرارة. يبقى جزء من الطاقة الداخلية دائمًا في المادة ويحافظ على هيكلها الجزيئي. لا يتوفر جزء من الطاقة الحركية لمادة ما عندما تقترب درجة حرارتها من درجة الحرارة المحيطة. بالتالي، الطاقة الداخلية الكامنةهي كمية الطاقة المتاحة للتحويل إلى حرارة عند درجة حرارة وضغط معينين. وحدات المحتوى الحراري هي BTU أو Joule للطاقة و Btu / lbm أو J / kg لطاقة معينة. 11 سؤال |

هدف:التحديد التجريبي للسعة الحرارية للمواد.
معدات:الموازين ، الوزن ، المسعرات ، الاسطوانة المعدنية ذات السعة الحرارية المعروفة ، الدورق ، السخان ، الخطاف.
نظرية موجزة:
جميع الأجسام وأنظمة الأجسام الماكروسكوبية ، بالإضافة إلى الطاقة الميكانيكية بسبب حركتها وتفاعلها ، لديها طاقة تعتمد على حالتها الداخلية. هذه الطاقة ، وهي طاقة الحركة والتفاعل بين جميع الجسيمات التي يتكون منها الجسم ، تسمى الطاقة الداخلية.
تشمل الطاقة الداخلية الطاقة الحركية للحركة الحرارية للجزيئات والذرات التي تشكل جسمًا معينًا ، والطاقة الحركية للإلكترونات التي تتحرك في الذرات حول النوى ، والطاقة الكامنة للتفاعلات بين الجزيئات والذرات والإلكترونات والنواة ، والنيوكليونات في النواة ، إلخ. لا يشمل مفهوم الطاقة الداخلية الطاقة الحركية والوضعية لجسم معين ككل.
يتم تحديد الطاقة الداخلية بشكل فريد من خلال مجموعة المعلمات التي تميز حالة النظام المعطى ، أي هي وظيفة ذات قيمة واحدة لحالة هذا النظام.
عادة ما يتم الإشارة إلى الطاقة الداخلية بالحرف U.
في الظواهر الحرارية التي تحدث في درجات حرارة بعيدة عن درجات حرارة انتقالات الطور ، يرتبط التغير في الطاقة الداخلية اليورانيوم المنضب بتغير في الطاقة الحركية والمحتملة للجزيئات ، بينما لا تتغير المكونات المتبقية للطاقة الداخلية. لذلك ، في مثل هذه العمليات ، يمكننا أن نفترض أن الطاقة الداخلية للجسم تساوي مجموع الطاقات الحركية للحركة الحرارية الفوضوية لجميع الجزيئات بالنسبة لمركز كتلة هذا الجسم والطاقات المحتملة للتفاعل بين الجميع مع بعضها البعض.
عندما تتغير حالة الجسم ، تتغير طاقته الداخلية. على سبيل المثال ، عندما ترتفع درجة حرارة الجسم ، تزداد طاقته الداخلية ، حيث يزداد متوسط الطاقة الحركية لحركة جزيئات هذا الجسم. مع انخفاض درجة الحرارة ، تقل الطاقة الداخلية للجسم.
يمكن أن تتغير الطاقة الداخلية للأجسام طرق مختلفة. على سبيل المثال ، تتغير الطاقة الداخلية عندما يتم تنفيذ العمل الميكانيكي بواسطة قوى خارجية على جسم معين أثناء تشوهه ، وأيضًا بدون القيام بأي عمل ، عندما يكون الجسم على اتصال بجسم آخر (أو وسط) لديه درجة حرارة أعلى أو أقل من الجسم المعطى.
تسمى عملية تغيير الطاقة الداخلية للجسم دون القيام بعمل ميكانيكي بنقل الحرارة أو نقل الحرارة. هناك ثلاثة أنواع من نقل الحرارة: الحمل الحراري والتوصيل والإشعاع.
أثناء التبادل الحراري ، لا يوجد تحويل للطاقة من نوع إلى آخر. تتكون عملية نقل الحرارة من حقيقة أن جزءًا من الطاقة الداخلية من جسم أكثر سخونة يتم نقله إلى جسم أقل حرارة (أو وسط).
لتوصيف عمليات نقل الحرارة ، يتم تقديم مفهوم كمية الحرارة ، والتي تسمى الكمية التي تعتبر مقياسًا كميًا للتغير في الطاقة الداخلية للجسم في عملية نقل الحرارة.
يجب أن نتذكر أن الجسم يمكنه فقط إعطاء أو استقبال الطاقة ، وأن كمية الحرارة Q هي فقط مكافئ عددي للطاقة التي يعطيها أو يتلقاها الجسم في عملية نقل الحرارة.
تعتمد كمية الحرارة على نوع العملية وليست دالة على حالة النظام.
كمية الحرارة المطلوبة لتسخين الجسم والتي تحدث بدون تحولات طورية (دون تغيير حالة تراكم المادة):
حيث c هي السعة الحرارية النوعية للجسم ، والتي تحددها نسبة كمية الحرارة المنقولة إلى كتلة الجسم m ، والتغير الناتج في درجة الحرارة DT ، m هي كتلة الجسم ، DT هو الفرق بين النهائي ودرجات الحرارة الأولية لجسم معين.
كمية الحرارة التي يجب نقلها إلى الجسم من أجل رفع درجة حرارته بمقدار كيلفن واحد تسمى السعة الحرارية لهذه المادة. عندما يبرد بمقدار كلفن واحد ، يُصدر الجسم نفس القدر من الحرارة. تتناسب السعة الحرارية للجسم مع كتلة الجسم وتعتمد على المادة التي يتكون منها. في نظام الوحدات الدولي للوحدات ، تُقاس السعة الحرارية بـ J / K.
لوصف الخصائص الحرارية لمادة ما ، يتم أخذ السعة الحرارية لوحدة كتلة هذه المادة. هذه الخاصية تسمى السعة الحرارية النوعية. إنه يساوي نسبة السعة الحرارية لجسم معين إلى كتلته. يتم قياس السعة الحرارية المحددة مع نظام SI بـ J / (كجم × كلفن).
تجريبيًا ، يتم تحديد الحرارة النوعية للجسم المعدني باستخدام مقياس حرارة وميزان حرارة. أبسط مسعر يتكون من زجاج معدني مصقول يوضع داخل زجاج آخر على سدادات (لغرض العزل الحراري). الزجاج الداخلي مملوء بالماء أو بسائل آخر له سعة حرارية محددة معروفة. يتم إنزال الجسم الذي يتم تسخينه إلى درجة حرارة معينة t إلى جهاز قياس السعرات الحرارية. اجعل درجة حرارة السائل في المسعر t 1 قبل أن ينخفض الجسم ، وبعد أن يثبت التوازن الحراري للسائل والجسم الذي ينزل فيه ، ستصبح درجة حرارتهما الإجمالية مساوية لـ q.
ويترتب على قانون حفظ الطاقة ما يلي:
س \ u003d س 1 + س 2 ،(2)
أين مقدار الحرارة س، معطى بجسم ساخن ، يساوي مجموع كمية الحرارة Q1 ،تم الحصول عليها عن طريق الماء ، و Q2 ،التي تلقاها المسعر.
بالنظر إلى (1) ، نعيد كتابة (2) على النحو التالي:
سم (t-q) \ u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1) ،(3)
أين ج 1و م 1- سعة حرارية محددة وكتلة الماء في المسعر ، ج 2و م 2- سعة حرارية محددة وكتلة المسعر. هذه المعادلة تسمى معادلة توازن الحرارة. ومنه نجد السعة الحرارية النوعية للجسم:
من الممكن التعامل مع حل هذه المشكلة بطريقة مختلفة ، لنفترض أن فقد الطاقة في إطار تجربة واحدة سيكون هو نفسه. الجسم معالسعة الحرارية النوعية المعروفة ، يتم تسخينها إلى درجة حرارة معينة ر، يتم خفضه إلى مسعر ، تتغير درجة حرارته. ثم تأخذ معادلة توازن الحرارة الشكل:
cm (t-q) = c 1 m 1 (q-t 1) + خسارة Q ،(5)
أين س الخسارةهي كمية الحرارة التي يتلقاها المسعر و بيئة، بالتالي:
Q خسارة ، = cm (t-q) - c 1 m 1 (q-t 1). (6)
إذا تم إنزال جسم بسعة حرارية محددة غير معروفة ، تم تسخينه إلى نفس درجة الحرارة ، إلى مقياس المسعر ، فستأخذ معادلة توازن الحرارة الشكل:
c x m x (t-q x) = c 1 m ¢ 1 (q - t ¢ 1) + Q الخسائر ،(7)
أين م ¢ 1هي كتلة الماء في المسعر ، و ر ¢ 1- درجة حرارة الماء في هذه التجربة. ثم:
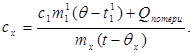 (8)
(8)
بالتعويض عن القيمة (6) في (8) نحصل على:
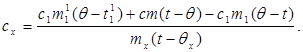 (9)
(9)
أين هي كمية الحرارة الأولية ؛ - تغير مبدئي في درجة الحرارة.
السعة الحرارية تساوي عدديًا كمية الحرارة التي يجب توفيرها للنظام من أجل زيادة درجة حرارته بمقدار درجة واحدة في ظل ظروف معينة. نظرًا لأن وحدة الحرارة في النظام الدولي للوحدات هي الجول ، ودرجة الحرارة هي الدرجة K ، فإن وحدة السعة الحرارية هي J / K.
اعتمادًا على الوحدة الكمية للجسم التي يتم توفير الحرارة لها في الديناميكا الحرارية ، يتم تمييز السعات الحرارية للكتلة والحجم والمول.
السعة الحرارية الجماعيةهي السعة الحرارية لكل وحدة كتلة من سائل العمل ،
أين وحجم وكثافة الجسم في ظل الظروف الفيزيائية العادية.
يتم قياس السعة الحرارية الحجمية بـ J / (m3 K).
السعة الحرارية المولية- السعة الحرارية ، المشار إليها بكمية سائل العمل (الغاز) في المولات ،
| , |
حيث m3 / mol هو الحجم المولي للغاز في الظروف العادية.
بالنظر إلى أن السعة الحرارية ليست ثابتة ، ولكنها تعتمد على درجة الحرارة والمعلمات الحرارية الأخرى ، يتم التمييز بين السعة الحرارية الحقيقية والمتوسطة. عادة ، تُفهم السعة الحرارية الحقيقية على أنها نسبة الكمية الأولية للحرارة التي يتم الإبلاغ عنها لنظام ديناميكي حراري في أي عملية إلى زيادة متناهية في الصغر في درجة حرارة هذا النظام بسبب الحرارة المنقولة. سننظر في السعة الحرارية الحقيقية للنظام الديناميكي الحراري عند درجة حرارة نظام تساوي ، و- صحيح السعة الحرارية محددةسائل العمل عند درجة حرارته تساوي. ثم يمكن تحديد متوسط السعة الحرارية النوعية لمائع العمل عندما تتغير درجة حرارته من إلى
تحديد الطاقة الداخلية للجسم.
الطاقة الداخليةالجسم (يشار إليه باسم هأو يو) هو مجموع طاقات التفاعلات الجزيئية والحركات الحرارية للجزيء. على وجه الخصوص ، الطاقة الداخلية للغاز المثالي تساوي مجموع الطاقات الحركية لجميع جزيئات الغاز في حركة حرارية مستمرة وعشوائية. من هذا يتبع قانون جول ، الذي أكدته تجارب عديدة.
تؤدي النظرية الحركية الجزيئية إلى التعبير التالي عن الطاقة الداخلية لمول واحد من غاز أحادي الذرة مثالي (الهيليوم ، النيون ، إلخ) ، الذي تؤدي جزيئاته حركة انتقالية فقط:
في هذا الطريق، الطاقة الداخلية يويتم تحديد الجسم بشكل فريد من خلال المعلمات العيانية التي تميز حالة الجسم. لا يعتمد على كيفية تحقيق الدولة المعينة. من المعتاد أن نقول إن الطاقة الداخلية هي وظيفة حالة.
في TD ، يتم استخدام التغيير في الطاقة الداخلية ، وليس قيمتها المطلقة.
ما هو العمل التوسعي. القانون الأول ل TD.
أعمال التمدد - العمل الميكانيكي الذي تقوم به المركبة ضد قوى الضغط الخارجي في عملية تمددها. عندما يتغير الحجم ، يعمل الغاز ، تتزامن علامة التغيير في V مع علامة العمل
القانون الأول لـ TD: تُستخدم الحرارة المنقولة إلى النظام لتحويل الطاقة الداخلية والقيام بالشغل.
من وجهة نظر قدرتها على تلقي (أو إعطاء) الطاقة في شكل حرارة ، فمن المعتاد أن تميز النظام الديناميكي الحراري بقدرته الحرارية.
السعة الحرارية للجسم (النظام) هي كمية فيزيائية تساوي عدديًا كمية الحرارة التي يجب نقلها إلى الجسم (النظام) من أجل تغيير درجة حرارته بمقدار كلفن واحد.
إذا أعطي الجسم كمية لا حصر لها من الحرارة س، مما تسبب في زيادة متناهية في الصغر في درجة الحرارة دتي ،ثم سعته الحرارية منبحكم التعريف يساوي
وحدة السعة الحرارية في النظام الدولي للوحدات هي الجول مقسومًا على كلفن ( ي/إلى).
التجارب والحسابات النظرية تظهر ذلك تعتمد السعة الحرارية للجسم على التركيب الكيميائي والكتلة والحالة الديناميكية الحرارية(على سبيل المثال ، في درجة الحرارة) ، وكذلك على نوع عملية تغيير حالة الجسم عند نقل الحرارة إليه.
السعة الحرارية النوعية هي السعة الحرارية لكل وحدة كتلة للمادة ،هذا هو ، لمادة متجانسة
![]() , (25.2)
, (25.2)
أين مع- السعة الحرارية محددة، مهي كتلة المادة.
وحدة SI للحرارة النوعية هي الجول مقسومًا على كيلفن كيلوغرام [( ي/(إلى . كلغ)].
السعة الحرارية المولية هي السعة الحرارية لمول واحد من مادة ما ،هذا هو
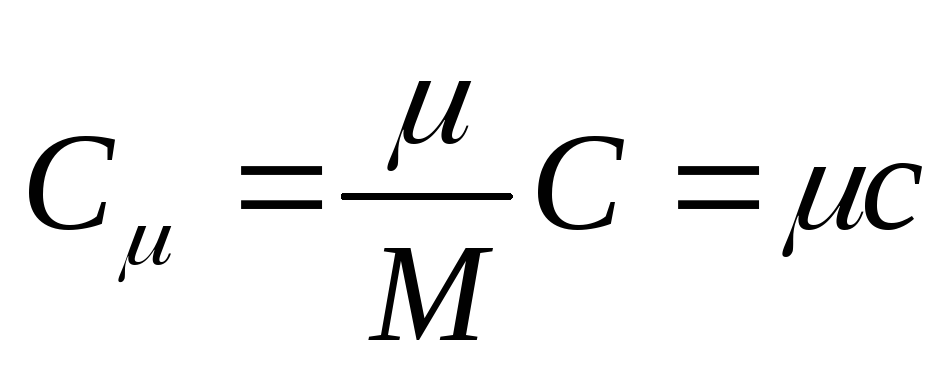 , (25.3)
, (25.3)
أين من - السعة الحرارية المولية. هي الكتلة المولية للمادة.
وحدة السعة الحرارية المولية في النظام الدولي للوحدات هي الجول مقسومًا على كلفن مول [ ي/(إلى . خلد)].
كمية الحرارة الأولية س, اللازمة لتغيير درجة حرارة الجسم دتي، يعرف ب
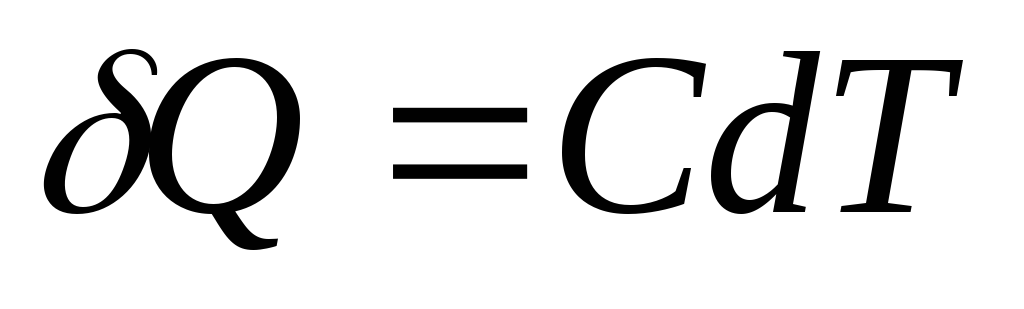 ,
,
ولجسم متجانس
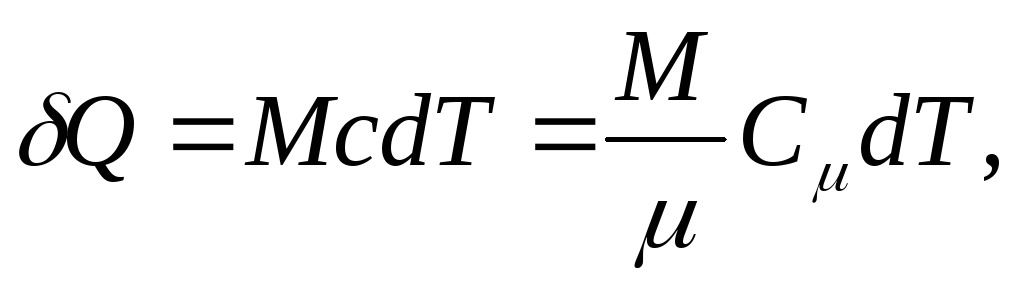 (25.4)
(25.4)
أين م/ - كمية المادة (عدد الشامات).
§26. القانون الأول للديناميكا الحرارية
القانون الأول (القانون الأول) للديناميكا الحرارية هو تعبير رياضي لقانون الحفاظ على الطاقة وتحويلها كما هو مطبق على الأنظمة الديناميكية الحرارية. تأسست نتيجة البحث التجريبي والنظري في مجال الفيزياء والكيمياء ، وكانت المرحلة الأخيرة منها اكتشاف معادلة الحرارة والعمل ، أي اكتشاف تحويل الحرارة إلى عمل والعمل فيه. يتم إجراء الحرارة دائمًا بنفس النسبة الكمية الثابتة بدقة.
في الفقرة 24 ، لوحظ أن الطاقة الداخلية لنظام ما يمكن تغييرها بطريقتين: من خلال العمل ونقل الحرارة. لذلك يمكننا أن نكتب:
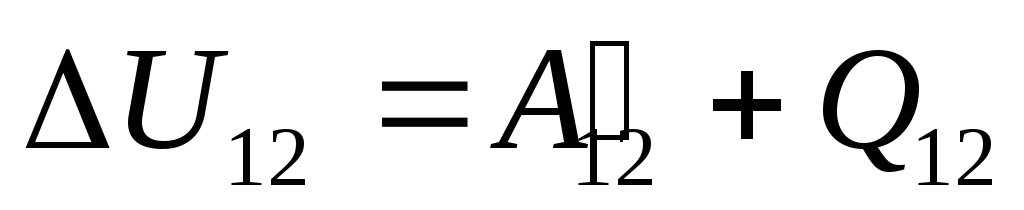 ,
(26.1)
,
(26.1)
أين
يو 12
-
التغيير في الطاقة الداخلية للنظام أثناء انتقاله من الحالة 1
في دولة 2
نتيجة العمل عليه 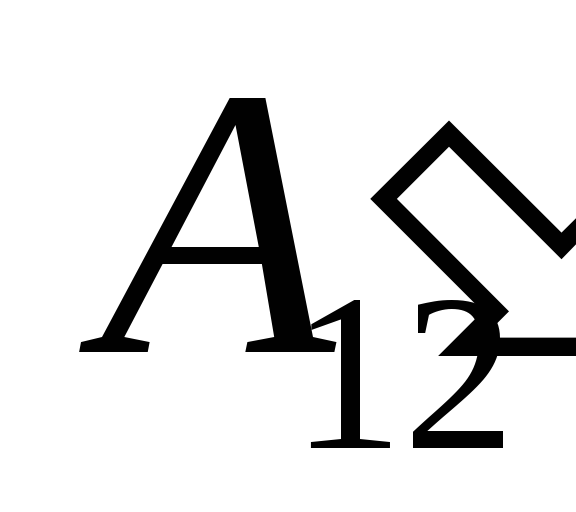 من الأجسام الخارجية وينقل إليها من الخارج كمية معينة من الحرارة
من الأجسام الخارجية وينقل إليها من الخارج كمية معينة من الحرارة  .
.
نحن نعلم هذا العمل 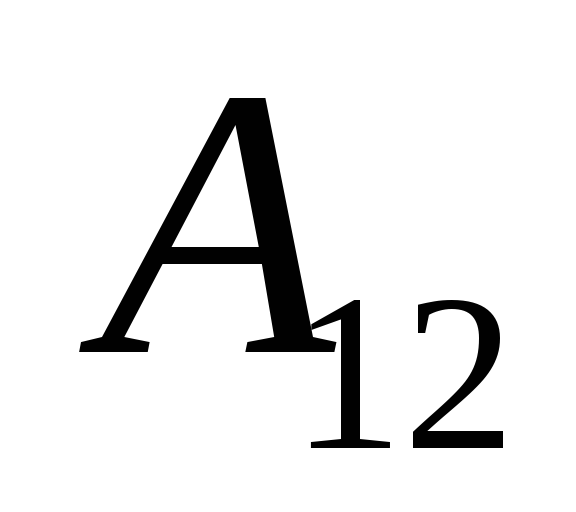 التي يؤديها النظام نفسه على الهيئات الخارجية متساوية عدديًا ومعاكسة في إشارة إلى العمل
التي يؤديها النظام نفسه على الهيئات الخارجية متساوية عدديًا ومعاكسة في إشارة إلى العمل  الهيئات الخارجية فوق النظام ، وهذا هو
الهيئات الخارجية فوق النظام ، وهذا هو
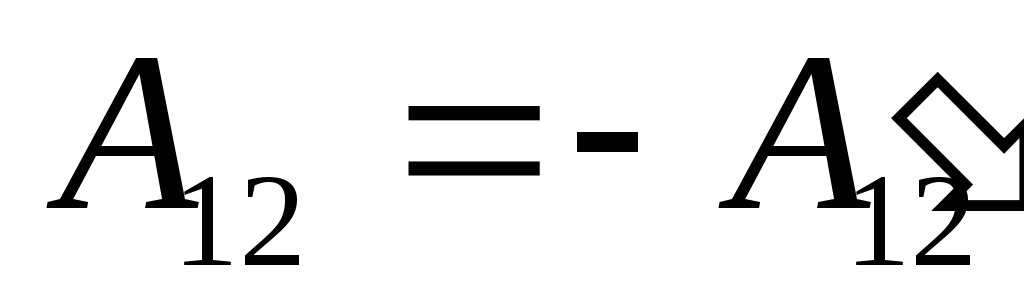 ,
(26.2)
,
(26.2)
لذلك يمكن إعادة كتابة التعبير (26.1) كـ
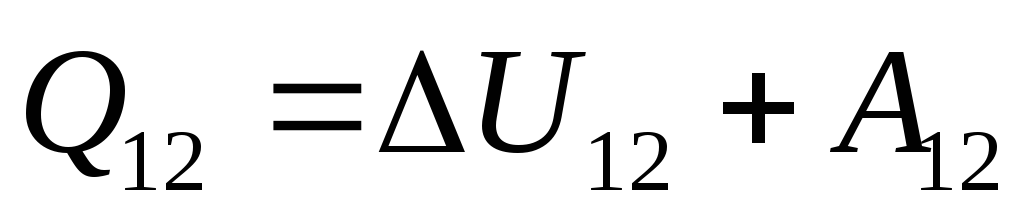 . (26.3)
. (26.3)
هذه المعادلة عبارة عن سجل رياضي للقانون الأول للديناميكا الحرارية: يتم إنفاق كمية الحرارة التي يتم توصيلها إلى النظام على تغيير طاقته الداخلية وعلى أداء العمل على الأجسام الخارجية بواسطة النظام.
مع التغيير اللامتناهي في حالة النظام ، تأخذ المعادلة (26.3) الشكل
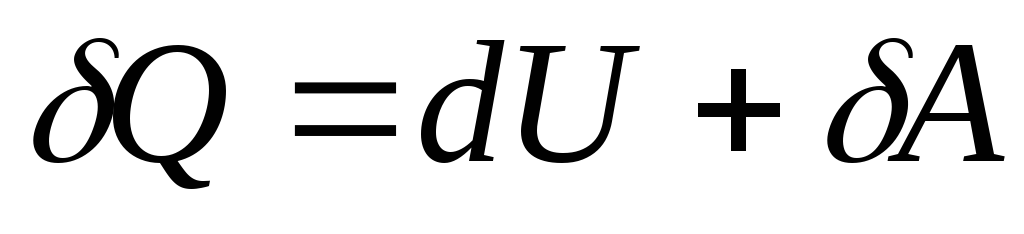 , (26.4)
, (26.4)
أين 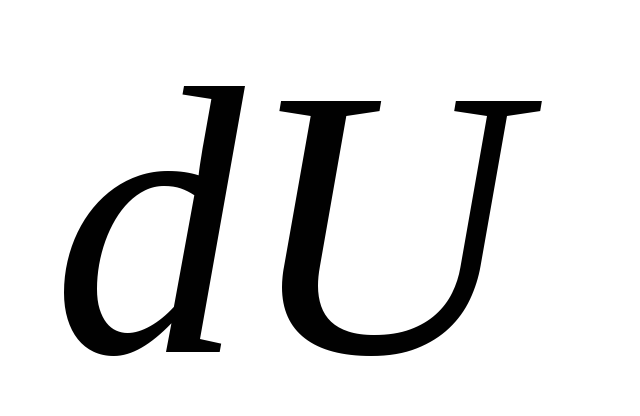 - تغيير متناهي الصغر في الطاقة الداخلية للنظام عندما يتم نقل كمية أولية من الحرارة إليه
سوأداء الأعمال الأولية من قبل النظام
لكنعلى الهيئات الخارجية.
- تغيير متناهي الصغر في الطاقة الداخلية للنظام عندما يتم نقل كمية أولية من الحرارة إليه
سوأداء الأعمال الأولية من قبل النظام
لكنعلى الهيئات الخارجية.
