Qattiq jismning issiqlik sig'imini aniqlash usuli
ISSIQLIK SIYoTI nima
Issiqlik ta'minlanganda, tizimning harorati ko'tariladi. Haroratning cheksiz kichik o'zgarishida mutanosiblik amal qiladi
dT=dQ yoki dT=constdQ
Bu munosabatni quyidagicha yozish qulayroq: dQ=SdT yoki
C qiymati tizimning haqiqiy issiqlik sig'imi deb ataladi.
Issiqlik sig'imi - tizimga berilgan issiqlik miqdorining harorat o'zgarishiga nisbati.
Haqiqatdan tashqari, o'rtacha issiqlik quvvati ham mavjud:
Issiqlik quvvati
Agar issiqlik sig'imi moddaning birlik massasiga (moliga) tegishli bo'lsa, u butun tizimning massasidan mustaqil bo'lib, intensiv parametr xususiyatlarini oladi. Agar issiqlik sig'imi moddaning birlik massasiga tegishli bo'lsa, u o'ziga xos deb ataladi va 1 mol uchun - J / (mol * k) o'lchamdagi issiqlik sig'imi.
Biz faqat molyar issiqlik sig'imlarini ko'rib chiqamiz, chunki ular uchun barcha qonuniyatlar o'ziga xos issiqlik quvvatiga qaraganda ancha sodda.
Issiqlik quvvati issiqlikning tizimga o'tishi sodir bo'lgan sharoitlarga bog'liq. Agar tizim doimiy hajmda o'ralgan bo'lsa, u holda haroratning dT ga oshishi CvdT ga teng issiqlik ta'sirida sodir bo'ladi, bu erda Cv - doimiy hajmdagi issiqlik sig'imi. Tizimning kengayishi paytida doimiy bosim bo'lgan hollarda, haroratni dT ga oshirish uchun CpdT issiqlik kerak bo'ladi, bu erda Cp - doimiy bosimdagi issiqlik sig'imi.
Issiqlikni uzatish shartlarini hisobga olgan holda, bir yoki bir nechta o'zgaruvchilar doimiy bo'lganda, boshqalari o'zgarganda, issiqlik sig'imi qisman hosilalar yordamida ifodalanishi mumkin: ![]() . dQ v = dU bo'lgani uchun,
. dQ v = dU bo'lgani uchun,
dQ p =dH, biz yozishimiz mumkin:
![]() (1)
(1)
Cv - gazlarning izoxorik issiqlik sig'imi, Cp - gazlarning izobar issiqlik sig'imi.
Izokorik va izobar issiqlik sig'imlari o'rtasidagi farq ichki energiya va entalpiya farqiga bog'liq. Entalpiya va ichki energiyadagi o'zgarishlar tizim tomonidan bajarilgan ish miqdori bilan farqlanadi.
dW=∆nRT, ∆H-∆U=∆nRT
Shuning uchun doimiy hajmdagi Cv va doimiy bosimdagi issiqlik sig'imlari Cp ish hajmi bilan ham farqlanadi: Cp - Cv = dW.
(1) iboralar asosida biz quyidagilarni yozishimiz mumkin:
Bu tengliklarni ∆H- ∆U=∆nRT tenglamasiga qo’yish
va ∆n= 1 ekanligini hisobga olsak, gazlarning molyar issiqlik sig'imlari o'rtasidagi bog'liqlikni topamiz:
Cp– Cv= R yoki Cp= Cv+ R
Ko'rinib turibdiki, ular gaz konstantasining qiymati bilan farqlanadi.
Cp= Cv+ R shartidan kelib chiqadiki, Cp˃Cv, ya’ni izobarik jarayonda P=const bo‘lganda, sistema haroratini oshirish kerak bo‘ladi. katta miqdor izoxorik jarayonga qaraganda issiqlik.
Gazlarning molyar issiqlik sig'imi R darajasidagi qiymatlarga ega, shuning uchun Cp va Cv o'rtasidagi farq juda katta. Shunday qilib, karbonat angidrid CO 2 uchun 25 0 C da Cp = 37, 14; va Cv = 28,83 J / (mol * K)
Farqi Cp - Cv bir molning izobarik kengayishining ishi ideal gaz harorat bir darajaga ko'tarilganda. Tananing suyuqlik va qattiq moddalari qizdirilganda hajmining biroz oshishi bilan tavsiflanadi. Shuning uchun kondensatsiyalangan jismlar uchun Sr ≈ Sv deb taxmin qilishimiz mumkin.
KIRXHOFF TENGLAMA. TERMAL TA'SIRLARNING HARORATGA BOG'LILIGI.
Shakllanish va yonish issiqligi uchun Hess qonuniga asoslangan issiqlik effektlarining ilgari ko'rib chiqilgan hisoblari standart shartlar bilan cheklangan. Amaliy maqsadlar uchun standart sharoitlardan tashqari, muayyan sharoitlar uchun termal effektlarni hisoblash kerak.
Standart sharoitlarda ma'lum bo'lgan termal effektlardan o'ting, ya'ni. 25 0 S (298,15 K) haroratda va 1 atm bosimda. (1.013 * 10 5 Pa), bizni qiziqtirgan har qanday haroratda termal effektlarni hisoblash mumkin. Kirchhoff qonuni. Sanoat sharoitidagi jarayonlar haroratning sezilarli o'zgarishi bilan tavsiflanadi, ularning diapazoni nafaqat texnologiya sharoitlari, balki mavsum bilan ham belgilanadi.Bu diapazon yuzlab darajaga yetishi mumkin - issiqlik effektlari tabiiydir. sezilarli darajada farq qiladi va haroratga bog'liq.
Kirxgof qonunini differentsial shaklda ko'rib chiqing. Buning uchun entalpiyaning izobarik va ichki energiyaning izoxorik jarayonlardagi o'zgarishlarini yozamiz.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
Ushbu tenglamalarni haroratga qarab farqlang va quyidagilarga ega bo'ling:
Kirchhoff tenglamalari:

Va - mos ravishda izobarik va izoxorik jarayonlarning issiqlik ta'sirining harorat koeffitsientlari; va - mos ravishda izobar va izoxorik jarayonlar natijasida tizimning issiqlik sig'imi o'zgarishi.
Kirchhoff tenglamasi asosida Kirchhoff qonuni differentsial shaklda tuzilgan: jarayonning issiqlik ta'sirining harorat koeffitsienti bu jarayon natijasida yuzaga keladigan tizimning issiqlik sig'imi o'zgarishiga teng.
Shunday qilib, differensial shakldagi Kirchhoff qonuni issiqlik effektining kattaligini emas, balki faqat harorat bilan issiqlik effektining o'zgarishini aniqlashga imkon beradi.
Kirxgof tenglamasini tahlil qilaylik
Reaksiya uchun: aA + bB = dD + rR izobar jarayonda (r=const), Kirxgof qonuniga ko'ra, tizimdagi issiqlik sig'imining o'zgarishi quyidagi ko'rinishga ega bo'ladi:
Xuddi shunday ifodani izoxorik jarayon uchun ham olish mumkin:
Kirchhoff qonuni haroratning o'zgarishi bilan jarayonning issiqlik effektidagi o'zgarishlarni aniqlashga imkon berganligi sababli, biz grafik tuzamiz:
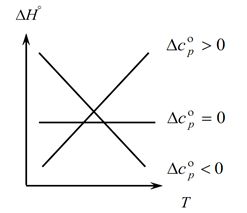
1. ∆Sr(∆Sv)˃0 bo'lgan birinchi holatni ko'rib chiqing, chunki ∆Sr=∑S con. -∑S boshlang'ich, bundan kelib chiqadiki, reaksiya mahsulotlarining issiqlik sig'imlari yig'indisi boshlang'ich moddalarning issiqlik sig'imlari yig'indisidan kattaroqdir: ∑S con. ˃∑Boshidan boshlab Bunda biz grafikda 1-egri chiziqni olamiz, ya'ni harorat oshishi bilan jarayonning issiqlik effektining o'zgarishi ham ortadi (T va ∆H);
2. Ikkinchi holat, ∆Sr(∆Sv)˂0 bo'lganda. Birinchi qonunga o'xshab, bizda ∑S con bor. ˂∑Ertadan boshlab (yakuniy mahsulotlarning issiqlik sig'imlarining yig'indisi dastlabki moddalarning issiqlik sig'imlari yig'indisidan kam). Keyin grafikda egri chiziqni olamiz, ya'ni harorat oshishi bilan jarayonning issiqlik effektining o'zgarishi kamayadi (T→∆H↓)
3. Va uchinchi holat, sistemaning issiqlik sig'imlarining o'zgarishi nolga teng bo'lganda ∆Sr(∆Sv)=0. U holda reaksiyalarning yakuniy mahsulotlarining issiqlik sig'imlari yig'indisi boshlang'ich materiallarning issiqlik sig'imlari yig'indisiga teng bo'ladi ∑S con. \u003d ∑ boshidan. Bunda reaksiyaning issiqlik effekti haroratga bog'liq emas (∆H ≠ f(T)) va biz grafikda to'g'ri chiziqni olamiz.
BERILGAN NARSA UCHUN TERMAK TA'SIRLARNI HISOBLASH
TEMPERATURA. KIRXHOFF TENGLAMASINING INTEGRASI
Haroratga bog'liq bo'lgan issiqlik effektining qiymatini topish uchun tenglamalarni integrallash kerak

T dan T 0 gacha (bu erda T - talab qilinadigan harorat, T 0 - standart harorat), ∆H dan ∆H 0 gacha yoki ∆U dan ∆U 0 gacha (bu erda ∆H va ∆U - entalpiya va ichki energiya. standartdan farq qiladigan shartlar). Integratsiya ikki holatda amalga oshiriladi:
Yo'q uchun organik moddalar: Organik moddalar uchun:
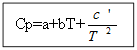
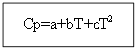
Misol: H 2 (g) uchun - noorganik modda
| Sr=f(T) | T | |||
| a | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27,28 + 3,26 * 10 -3 T +.
a) Taxminiy integratsiya:
izobar jarayon uchun
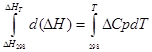
∆H T - ∆H 298 =∆Cp*(T-298)
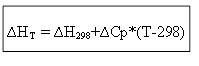
izoxorik jarayon uchun:
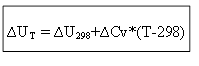
Shunday qilib, har qanday T haroratda issiqlik effekti ∆H yoki ichki energiya ∆U ni aniqlash uchun standart sharoitda ∆H 0 (∆U 0) jarayonning issiqligini va ∆Sr, ∆ issiqlik sig’imlarining o’zgarishini bilish kerak. Rezyume.
Misol. Asetilendan benzol olish jarayonining ∆H issiqlik effektini hisoblang:
3C 2 H 2 (g) → C 6 H 6 (g) 75 0 C da (348K).
1. Jadvallardan benzol va asetilenning o'rtacha molyar izobar issiqlik sig'imlarini topamiz:
Sr S6N6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. Jarayonning issiqlik sig'imi o'zgarishini topamiz:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) boshlang'ich \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81,67 - 3 * 43,93 \u003d - 50,12 J.
3. Jadval ma'lumotlariga ko'ra biz standart sharoitda issiqlik effektini topamiz:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Berilgan haroratdagi issiqlik effektini toping:
∆H = ∆H 0 + ∆Sr (T-T 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
b) Aniq integratsiya:
Keling, ikkinchi, yanada murakkab holatni ko'rib chiqaylik, qachonki issiqlik sig'imi o'zgarishi haroratga bog'liq, ya'ni. Sr=f(T), Cv=f(T).
Keling, umumiy shakldagi reaksiya tenglamasiga murojaat qilaylik
dD + rR = qQ + pP
| a | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
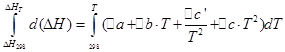
Biz izoxorik jarayon uchun xuddi shunday operatsiyalarni bajaramiz:
ERISH ISITISHI
Qattiq, suyuq yoki gazsimon moddaning eritmaga o'tishida entalpiyaning o'zgarishi deyiladi eritishning termal yoki entalpiyasi.
Eritma issiqligi odatda kristall panjarani yo'q qilish issiqligini o'z ichiga oladi (uchun qattiq moddalar), ionlanish va solvatsiya.
Kristalli tuzning ionlari orasidagi bog'lanishni buzish uchun energiya kerak, ya'ni. issiqlik yutilganda. Shu bilan birga, suvli eritmada ion hidratsiyasi sodir bo'ladi; H 2 O ning ionlari va molekulalari o'rtasida bog'lanish hosil bo'ladi. Eritma issiqligining belgisi energetik jihatdan aniqroq bo'lgan jarayon bilan belgilanadi.
LiBr: ∆H dist = - 49,02 kJ / mol - issiqlik chiqariladi
KCl: ∆H dist = 7,23 kJ/mol - issiqlik yutiladi
Ajrating: integral erish issiqligi - bu ma'lum konsentratsiyali eritma hosil qilish uchun ma'lum moddaning 1 molini eritganda ajralib chiqadigan yoki yutilgan issiqlik. Eritmaning integral issiqligi erigan moddaning miqdoriga qarab o'zgaradi.
Ajrating: differensial erish issiqligi - bu ma'lum bir moddaning 1 molining cheksiz ravishda erishi bilan birga keladigan issiqlik. katta hajm ushbu moddaning eritmasi. Integral issiqliklardan Gess qonuni bo'yicha hosil bo'lish issiqliklarini va boshqa reaksiyalarning issiqliklarini hisoblashda keng qo'llaniladi. Differensial erish issiqliklari eritmalarning termodinamik xossalarini va ularning hosil bo`lish jarayonini tavsiflaydi.
№8 laboratoriya
QATTIQ JISNALARNING ISSIQLIK SIYoTINI ANIQLASH
Asboblar va aksessuarlar: eksperimental o'rnatish FPT1-8.
Ishning maqsadi: metall namunalarining issiqlik sig'imini elektr isitish yordamida kalorimetrik usulda aniqlash.
Qisqacha nazariya
Moddaning o'ziga xos issiqlik sig'imi - 1 kg moddani 1 K ga qizdirish uchun zarur bo'lgan issiqlik miqdoriga teng qiymat:
Molar issiqlik sig'imi - 1 K ga 1 mol moddani isitish uchun zarur bo'lgan issiqlik miqdoriga teng qiymat:
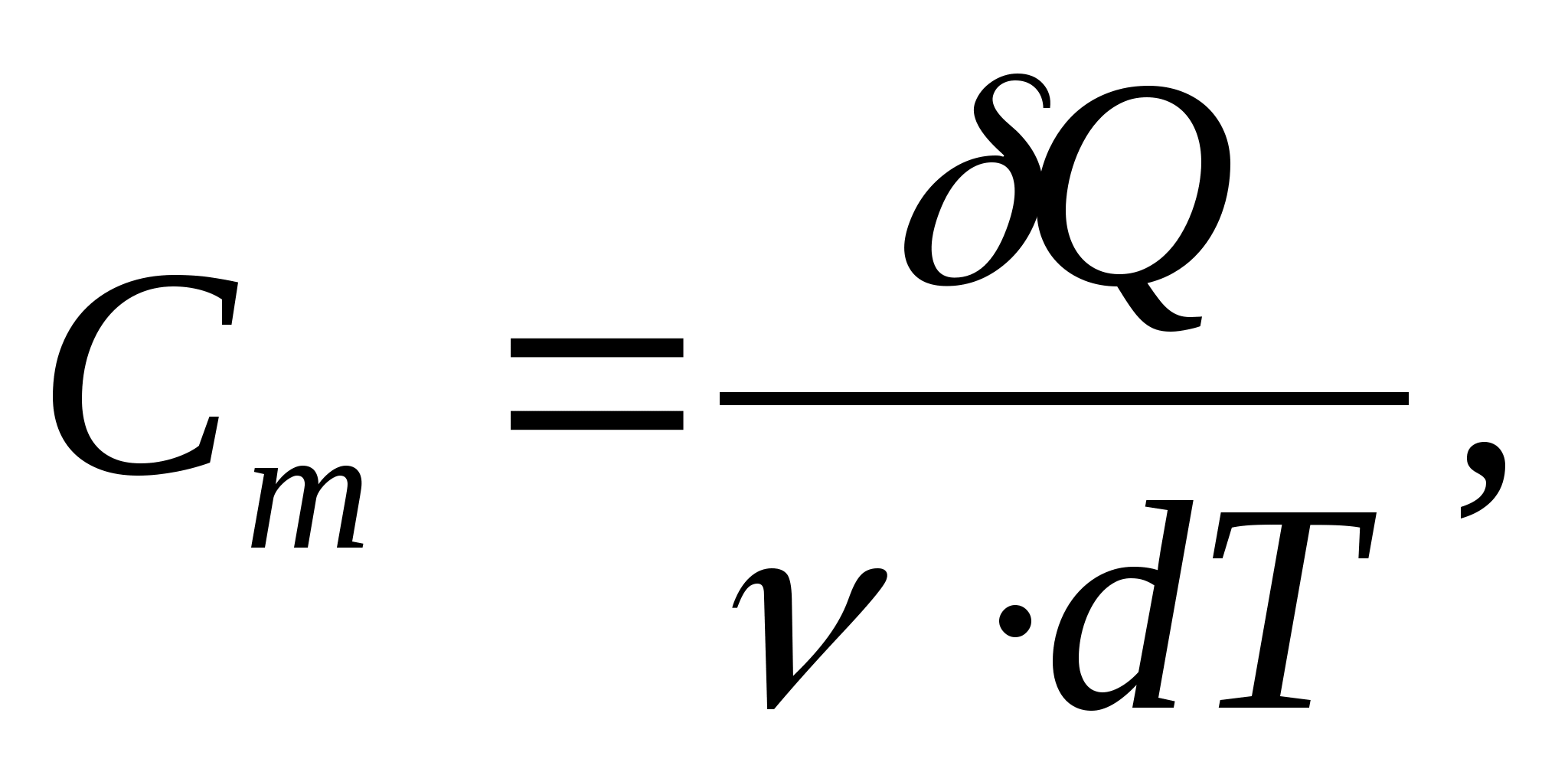
qayerda 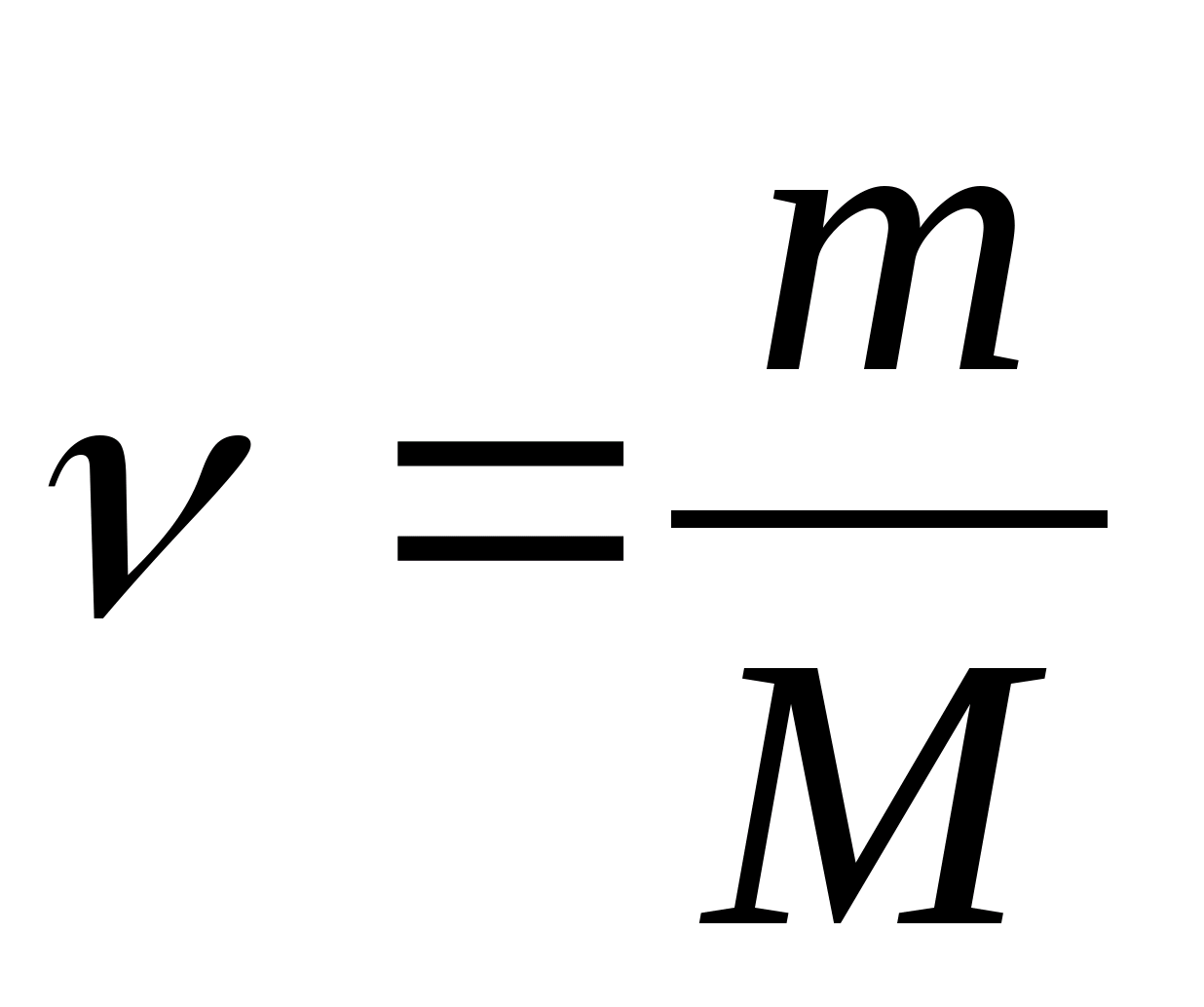 - moddaning miqdori.
- moddaning miqdori.
Maxsus issiqlik c molar bilan bog'liq C m nisbat

qayerda M- moddaning molyar massasi.
Farqlash doimiy hajmdagi issiqlik sig'imi va doimiy bosim, agar moddani isitish jarayonida uning hajmi yoki bosimi doimiy bo'lsa.
Tizimning fazodagi o'rnini to'liq aniqlaydigan eng kichik mustaqil o'zgaruvchilar (koordinatalar) deyiladi erkinlik darajalari soni .
Boltsmanning energiyaning molekulalarning erkinlik darajalari bo'yicha bir xil taqsimlanishi to'g'risidagi qonuniga ko'ra, har bir translatsiya va aylanish erkinlik darajasi o'rtacha kinetik energiyaga teng bo'ladi.
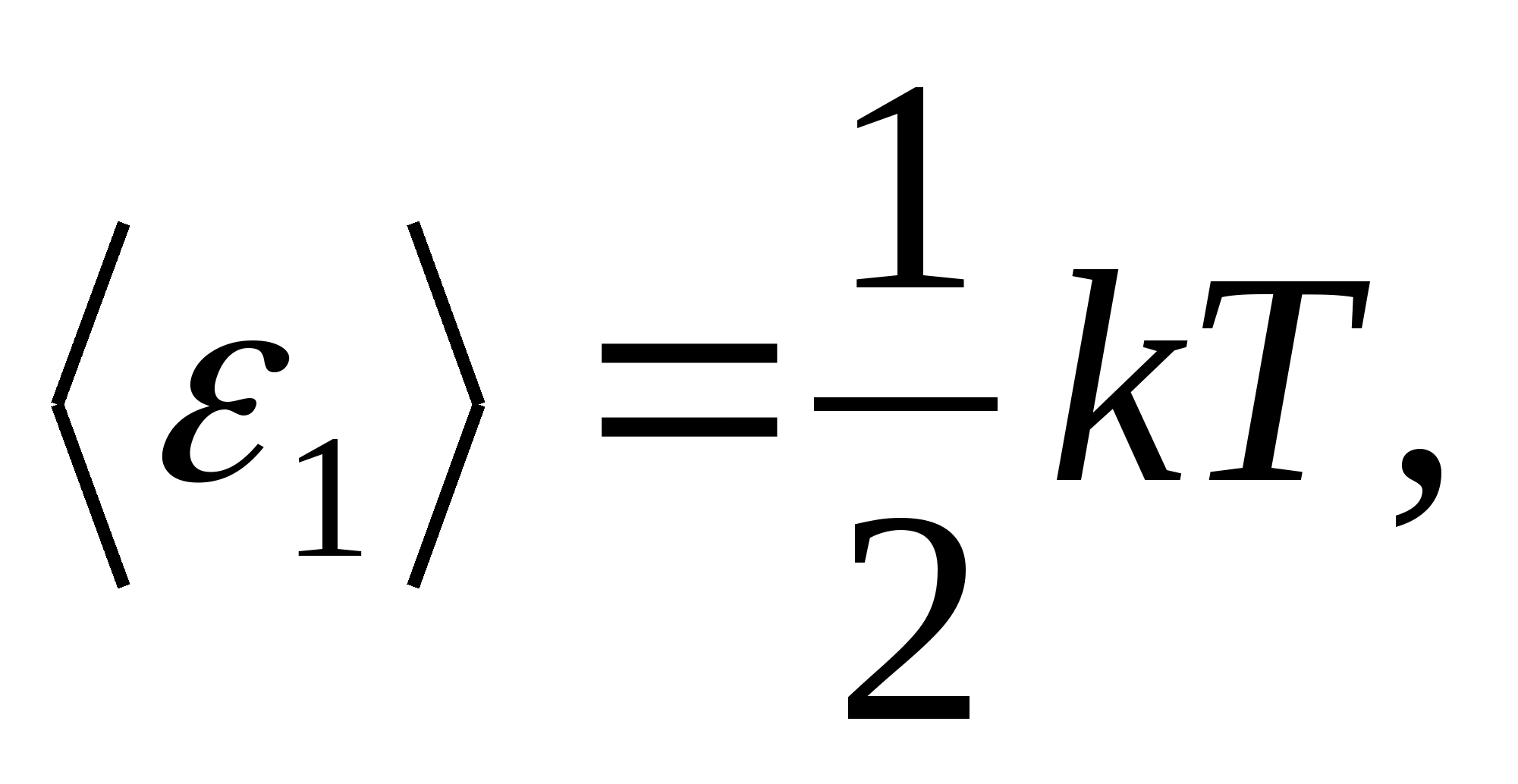
(qaerda k Boltsman doimiysi) va har bir tebranish erkinlik darajasi uchun o'rtacha energiya teng
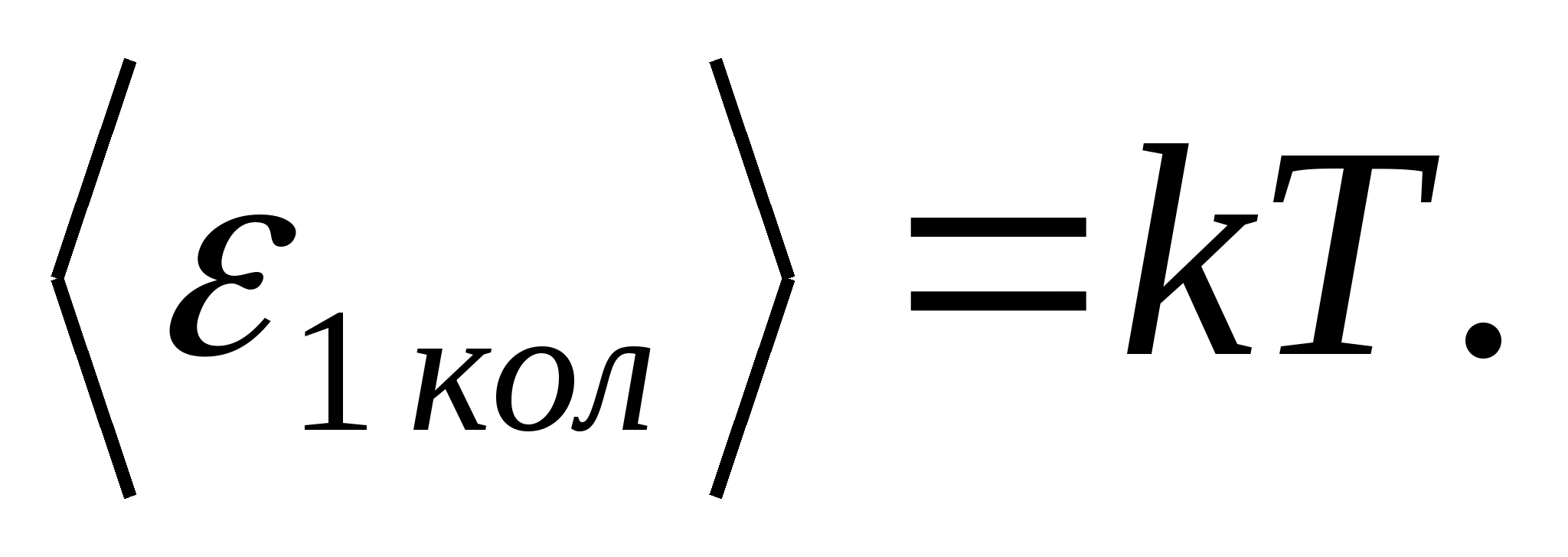
Shunday qilib, molekulaning o'rtacha energiyasi
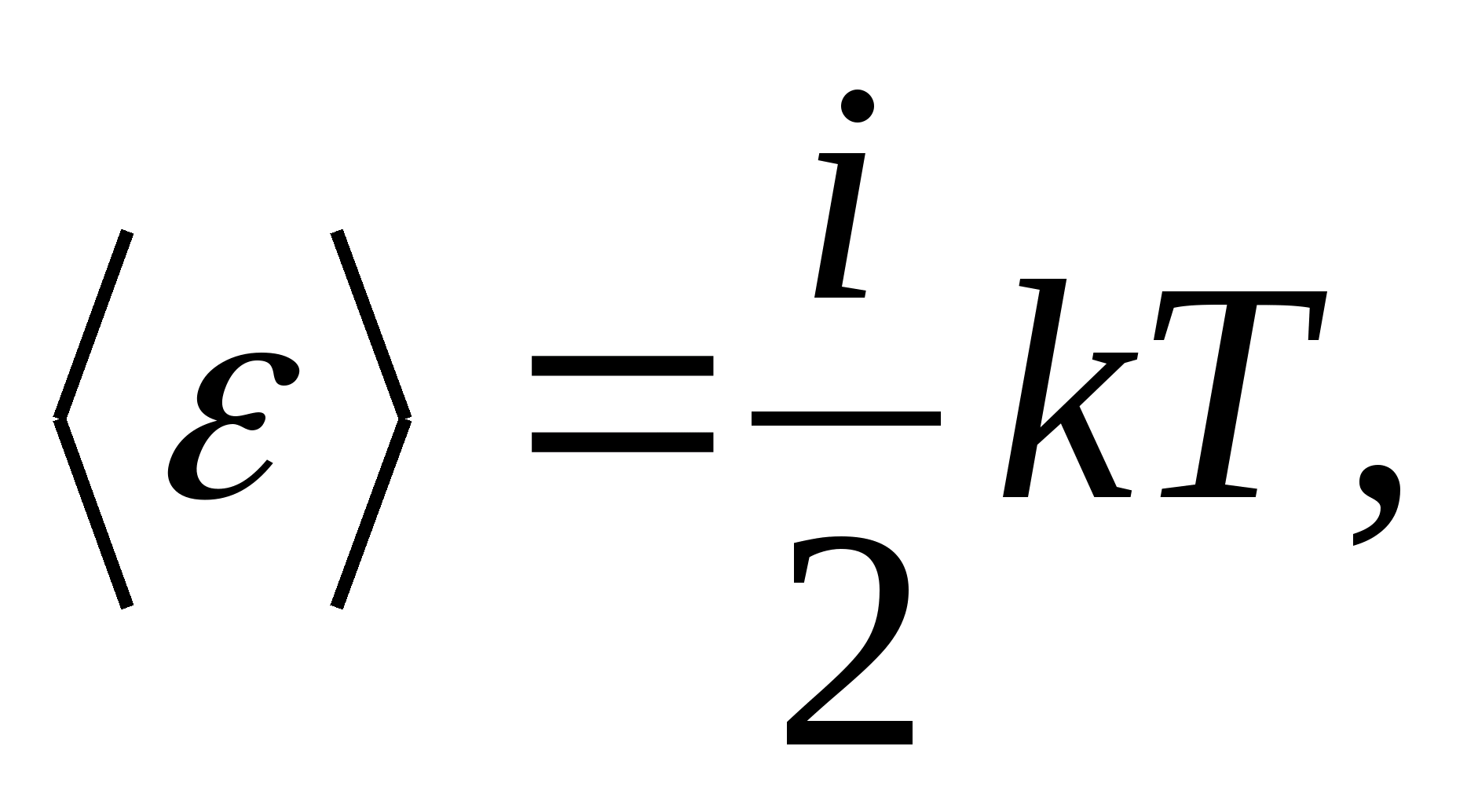
qayerda i molekulaning translatsiya soni, aylanish soni va ikki marta tebranish erkinlik darajalarining yig'indisi:
![]()
Masalan, monotomik ideal gaz molekulalarining o'rtacha kinetik energiyasi ( 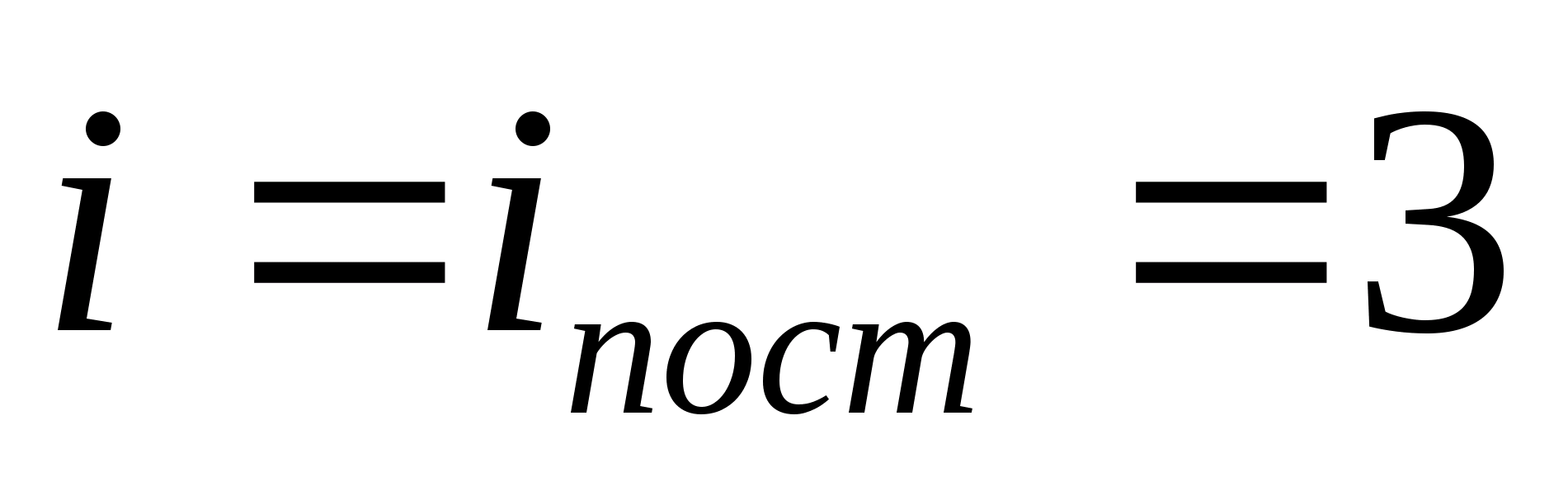 ) ga teng
) ga teng
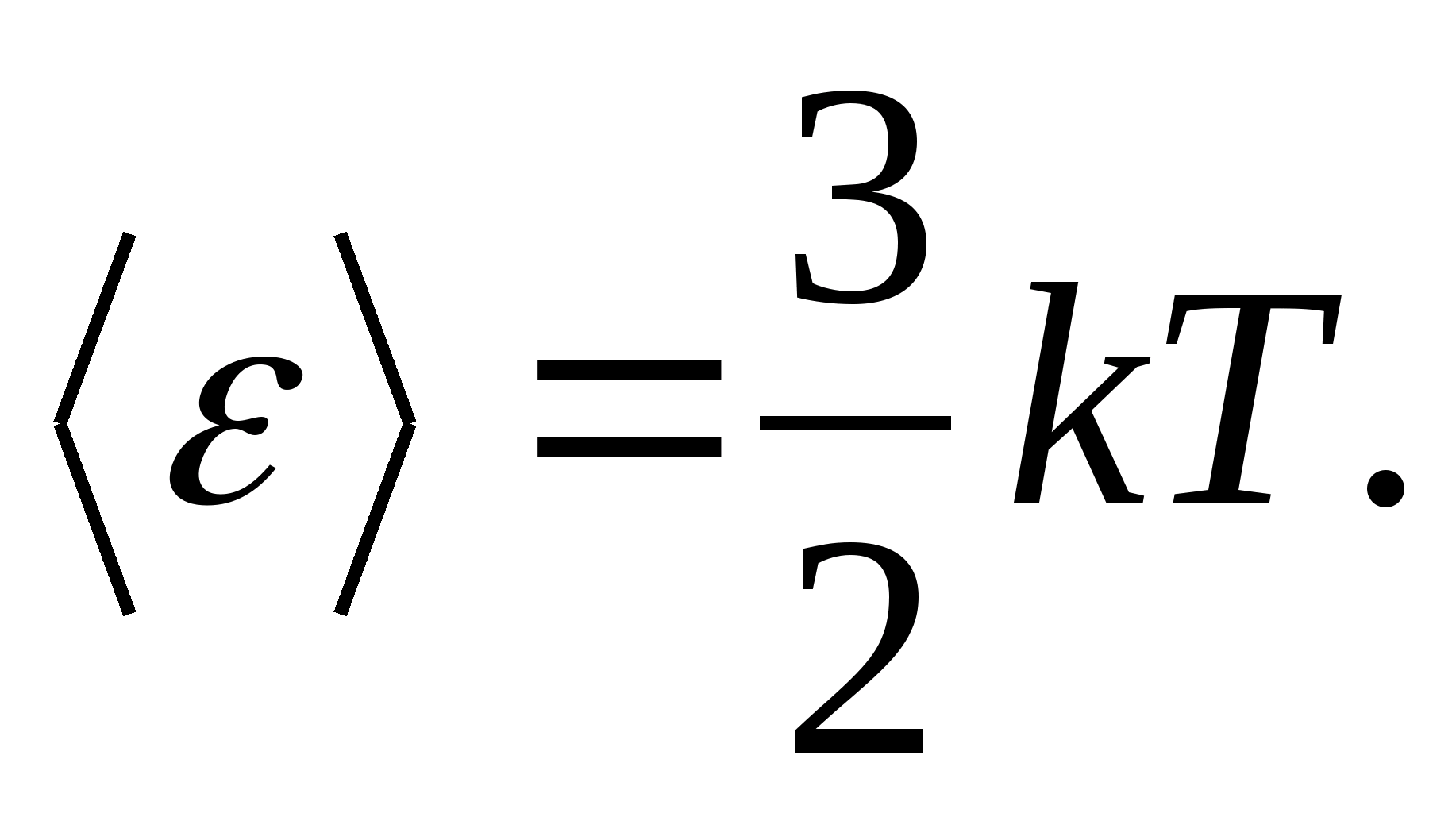
Sifatida modellar qattiq jismning tugunlarida zarrachalar (atomlar, ionlar, molekulalar) to'g'ri tuzilgan kristall panjarani ko'rib chiqing. moddiy nuqtalar, ularning muvozanat pozitsiyalari atrofida tebranadi - panjara tugunlari - uchta o'zaro perpendikulyar yo'nalishda. Shunday qilib, kristall panjarani tashkil etuvchi har bir zarrachaga uchta tebranish erkinlik darajasi beriladi, ularning har biri energiyaning erkinlik darajalari bo'yicha bir xil taqsimlanishi to'g'risidagi qonunga muvofiq, energiyaga ega. kT.
Keyin kristall panjarada tebranish harakati paytida zarrachaning umumiy energiyasining o'rtacha qiymati
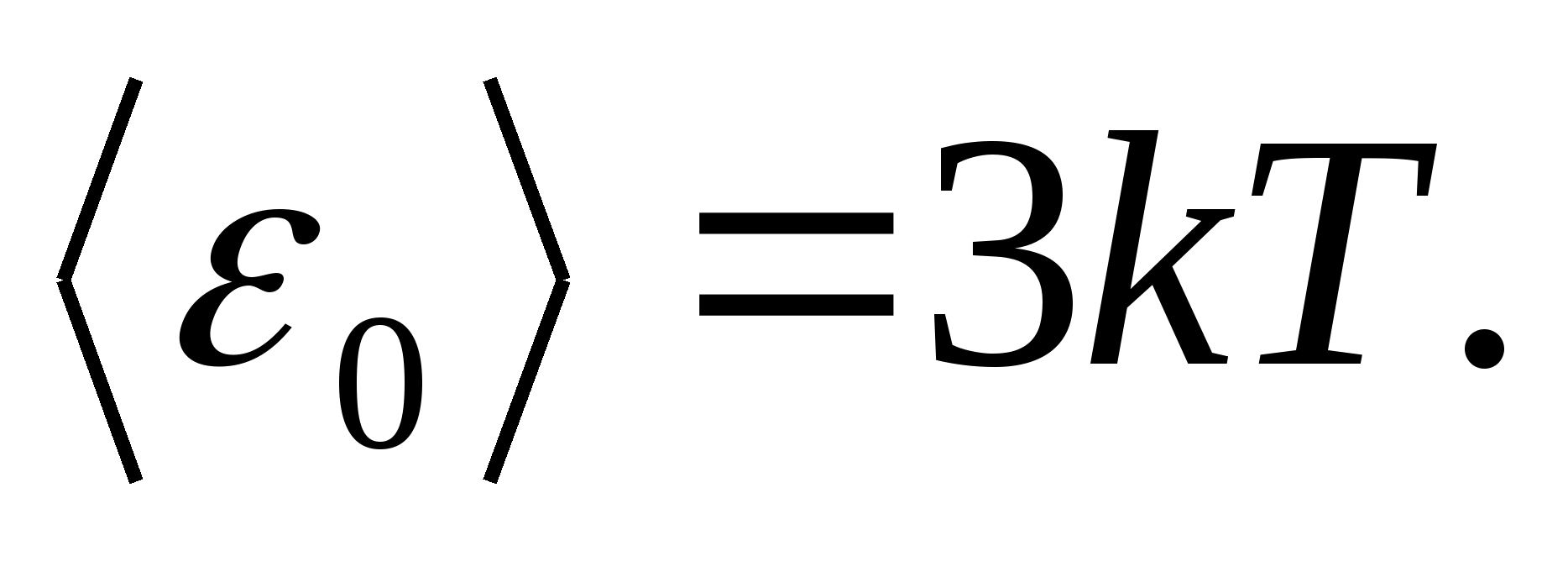
Bir mol qattiq jismning umumiy ichki energiyasi bitta zarrachaning o'rtacha energiyasini bir mol tarkibidagi mustaqil tebranish zarralari soniga ko'paytirish yo'li bilan olinadi, ya'ni. Avogadro doimiysiga N A :
qayerda R=N A k universal (molyar) gaz doimiysi, R= 8,31 J/(molK).
Qattiq jismlar uchun termal kengayishning kichik koeffitsienti tufayli doimiy bosim va doimiy hajmdagi issiqlik sig'imlari amalda farq qilmaydi. Shuning uchun (8.1) ni hisobga olgan holda, qattiq jismning molyar issiqlik sig'imi
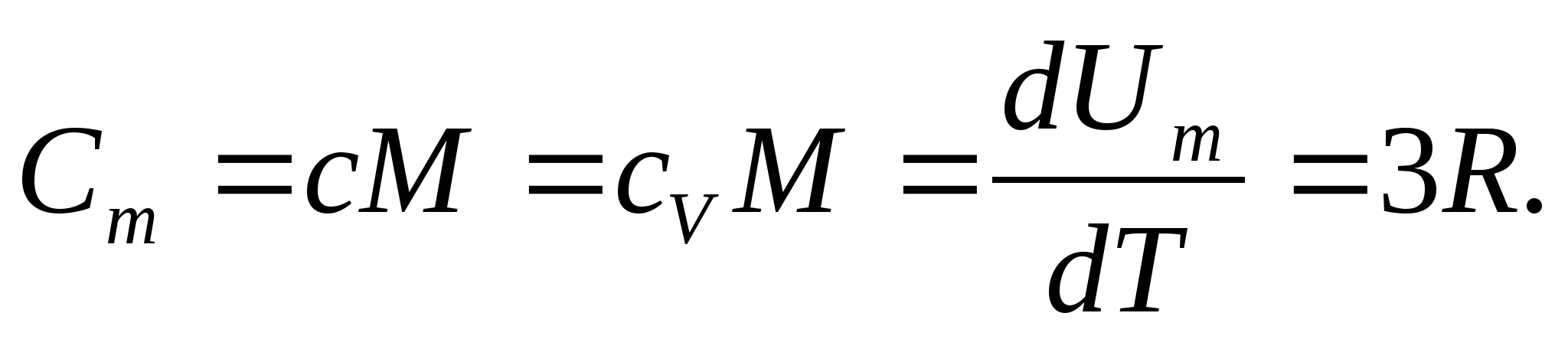 (8.2)
(8.2)
Molyar gaz konstantasining raqamli qiymatini almashtirib, biz quyidagilarni olamiz:
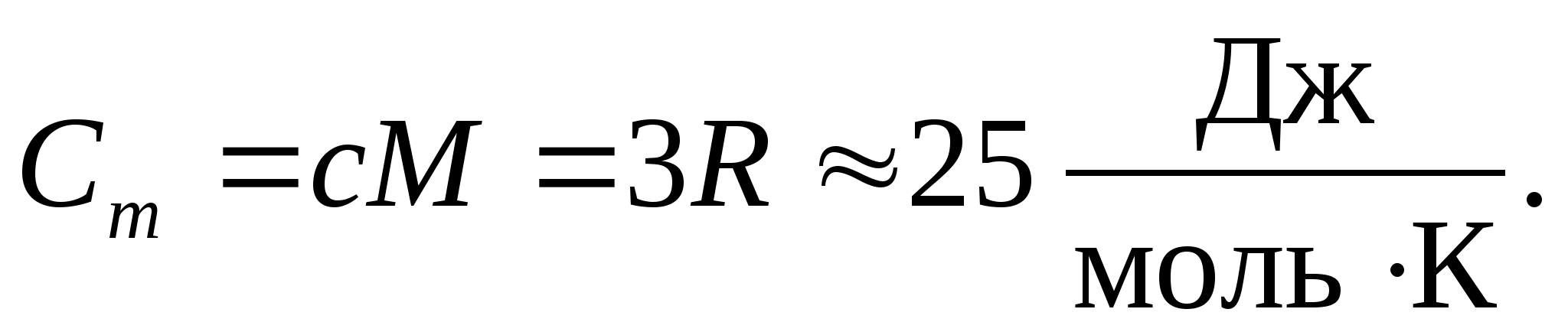
Bu tenglik xona haroratida ko'p moddalar uchun juda yaxshi yaqinlik qiladi va deyiladi Dulong va Petit qonuni : barcha kimyoviy oddiy kristallarning molyar issiqlik sig'imi qattiq moddalar taxminan 25 J/(mol TO). Haroratning pasayishi bilan barcha qattiq jismlarning issiqlik sig'imlari pasayadi va nolga yaqinlashadi T0. Mutlaq nolga yaqin, barcha jismlarning molyar issiqlik sig'imi T 3 ga proportsional bo'lib, faqat har bir moddaning etarlicha yuqori harorat xarakteristikasida tenglik (8.2) o'zini tuta boshlaydi. Past haroratlarda qattiq jismlarning issiqlik sig'imlarining bu xususiyatlarini Eynshteyn va Debay tomonidan yaratilgan issiqlik sig'imining kvant nazariyasi yordamida tushuntirish mumkin.
Issiqlik sig'imini eksperimental ravishda aniqlash uchun o'rganilayotgan jism elektr toki bilan isitiladigan kalorimetrga joylashtiriladi. Agar sinov namunasi bilan kalorimetrning harorati boshlang'ichdan juda sekin oshirilsa T 0 dan gacha T, keyin elektr tokining energiyasi namuna va kalorimetrni isitish uchun ishlatiladi:
qayerda I va U− isitgichning oqimi va kuchlanishi; − isitish vaqti; m 0 va m Kalorimetr va sinov namunasining massalari, Bilan 0 va Bilan− kalorimetr va sinov namunasining solishtirma issiqlik sig‘imlari, Q- kalorimetrning issiqlik izolatsiyasiga va uning atrofidagi bo'shliqqa issiqlik yo'qotilishi.
(8.3) tenglamadan kalorimetrni isitish uchun sarflangan issiqlik miqdorini va atrofdagi bo'shliqqa issiqlik yo'qotilishini chiqarib tashlash uchun, xuddi shu isitgich quvvatida, bo'sh kaloriyametrni (namunasiz) dastlabki haroratdan isitish kerak. T 0 bir xil harorat farqi uchun T. Har ikkala holatda ham issiqlik yo'qotilishi deyarli bir xil va juda kichik bo'ladi, agar kalorimetrning himoya qobig'ining harorati ikkala holatda ham doimiy va xona haroratiga teng bo'lsa:
(8.3) va (8.4) tenglamalar nazarda tutadi
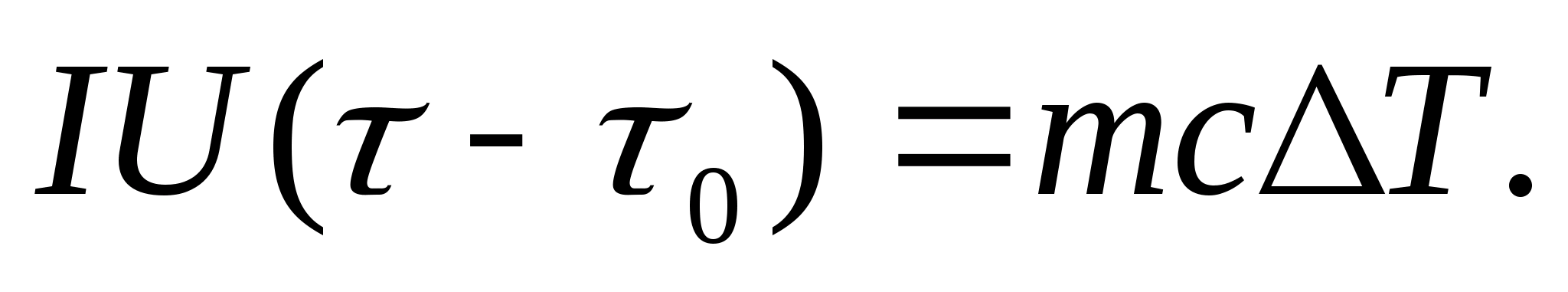 (8.5)
(8.5)
Tenglama (8.5) sinov namunasi materialining solishtirma issiqlik sig'imini eksperimental ravishda aniqlash uchun ishlatilishi mumkin. Kalorimetrning haroratini o'zgartirib, isitish vaqtidagi farqning sinov namunasi haroratining o'zgarishiga bog'liqligini chizish kerak: (
−
0)=f(T), qaysi burchak koeffitsientiga ko'ra 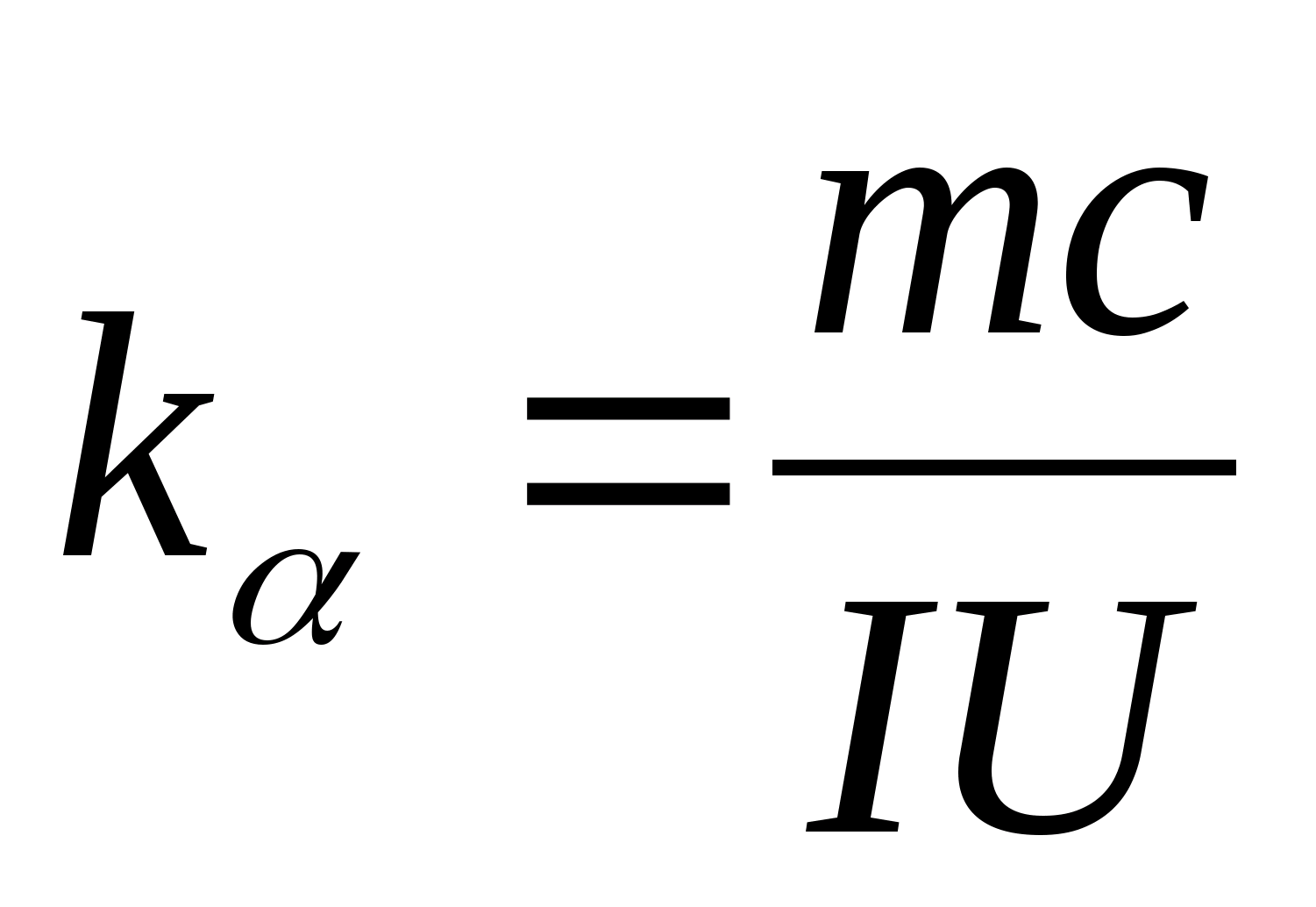 namunaning solishtirma issiqlik sig'imi aniqlanishi mumkin.
namunaning solishtirma issiqlik sig'imi aniqlanishi mumkin.
Laboratoriya jihozlarining tavsifi
Qattiq jismlarning issiqlik sig'imini aniqlash uchun FPT1-8 eksperimental qurilmasi ishlab chiqilgan bo'lib, uning umumiy ko'rinishi rasmda ko'rsatilgan. 8.1. O'rnatish uchta asosiy qismdan iborat: 1-instrumental blok, 2-ishchi element bloki va 3-rack.
1-boshqaruv blokining old panelida quyidagilar mavjud: jihozni kuchlanish tarmog'iga ulaydigan "TARMOQ" almashtirish tugmasi; isitgichni yoqadigan "HEATING" o'tish tugmasi; "ISTISH" regulyatori, uning yordamida isitgich quvvati tartibga solinadi; voltmetr va ampermetr, isitgich pallasida kuchlanish va oqimni o'lchaydi; Kalorimetrning isitish vaqtini o'lchaydigan sekundomer. Sekundomer asboblar bloki yoqilganda ishga tushadi.
Ishchi element 2 bloki old tomondan org dan olinadigan ekran bilan yopilgan. stakan. Ishni bajarishda ekran ishchi element blokining orqa devoriga osilgan. Ishchi elementning panel blokida haroratni o'lchash uchun raqamli termometr 6 mavjud. Pastki qismida, uyalarda turli materiallardan tayyorlangan 5 ta sinov namunasi va namunalarni isitgichga joylashtirish uchun tutqich mavjud.
Isitgich 4 metall korpus, issiqlik o'tkazmaydigan material va kalorimetrdan iborat.

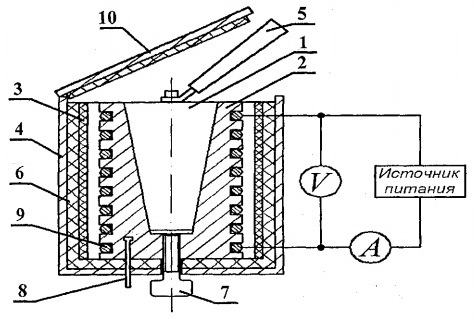
Namunalar kalorimetrda isitiladi, uning sxemasi shaklda ko'rsatilgan. 8.2.
Kalorimetr - bu konussimon teshikli latun quti 2 bo'lib, u yerga sinov namunasi 1 solinadi.Kosonning tashqi yuzasida maxsus oluklarga isitish batareyasi 9 joylashtiriladi.Tashqarida kalorimetr korpusi asbest qatlamlari bilan issiqlik izolatsiyasi bilan qoplangan. 3 va shisha tolali 6 va alyuminiy korpus bilan yopiladi 4. Kalorimetr issiqlik o'tkazmaydigan qopqoq bilan yopiladi 10. Tajriba tugagandan so'ng namunani kalorimetr korpusining konussimon teshigidan siqib chiqarish mumkin. vint 7. Kalorimetrdan qizdirilgan namunani olib tashlash va namunani isitgichga o'rnatish uchun o'rganilayotgan namunalar yonidagi maxsus rozetkada joylashgan tutqich 5 qo'llaniladi.
Kalorimetrning harorati raqamli termometr bilan o'lchanadi, uning harorat sensori 8 kalorimetrning korpusi 2da joylashgan.
Xavfsizlik
Ishlarni bajarishda mexanika laboratoriyasida umumiy xavfsizlik talablariga rioya qilinadi.
Ish tartibi
DIQQAT! Kalorimetrning sovishi uchun uzoq vaqt kerak bo'ladi, shuning uchun barcha vaqt qiymatlarini o'lchagandan so'ng 0 bo'sh kalorimetrni qizdiring, darhol isitishni o'chiring (quyida 4-bandga qarang). Ushbu qurilma uchun maksimal isitish harorati +44S.
1. O'rnatishning ishchi element birligining shaffof qopqog'ini olib tashlang va uni orqa panel vintlariga osib qo'ying. ISITISHni boshqarish tugmachasini minimal darajaga o'rnating. O'rnatishni "NETWORK" o'tish tugmasi bilan yoqing.
2. Bo'sh kaloriyametrning qopqog'ini mahkam yoping. "HEAT" o'tish tugmachasini yoqing. ISSIQLIK regulyatoridan foydalanib, kuchlanishni 10-20 V ga o'rnating (kuchlanish qanchalik baland bo'lsa, isitish tezroq bo'ladi). Jadvalga yozing. 8.1 tanlangan kuchlanish qiymatlari U va joriy I.
3. Kalorimetrning haroratidan boshlab t O'qituvchi tomonidan belgilangan 0, 1S oraliqdan keyin jadvalga kiriting. 8.1 vaqt qiymatlari 0 har bir erishilgan haroratga mos keladi t.
4. “HEAT” o‘tish tugmachasini o‘chiring, qopqog‘ini oching va kalorimetrni dastlabki haroratgacha sovuting. t 0 . Kalorimetrni tez sovutish uchun siz namunalardan birini kaloriyametrga tushirishingiz mumkin, o'qituvchi ko'rsatganidan tashqari (namunani kalorimetrga o'rnatishda kalorimetrning pastki qismidagi vintni chapga burang). Harorat pasayishni boshlaydi. Sovutish tezligi pasayganda, qizdirilgan namunani olib tashlang va o'qituvchi tomonidan ko'rsatilganidan tashqari keyingi (sovuq) namunani joylashtiring. Namunani olib tashlash uchun kalorimetrning pastki qismidagi vintni o'ngga (soat yo'nalishi bo'yicha) burang va keyin namunani dastagi bilan tortib oling.
8.1-jadval
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =BilanM, J/(molK) |
||||||||
5. Vintni chapga burab, o'qituvchining ko'rsatmasi bo'yicha olingan sinov namunalaridan birini kalorimetrga qo'ying. Kalorimetrning qopqog'ini mahkam yoping va kalorimetr va namuna harorati tenglashguncha 2-3 daqiqa kuting.
6. "HEAT" o'tish tugmachasini yoqing va bo'sh kalorimetrni qizdirganda bo'lgani kabi, kontaktlarning zanglashiga olib keladigan kuchlanishni o'rnating.
7. Xuddi shu boshlang'ich kalorimetr haroratidan boshlab t 0, 1S oraliqdan keyin jadvalga kiriting. 8.1 vaqt qiymatlari har bir erishilgan haroratga mos keladi t.
8. “ISTISH” regulyatorini o‘ta chap holatiga (minimalga) o‘rnating, “ISTISH” o‘tish tugmachasini o‘chiring, kalorimetrning qopqog‘ini oching. Kalorimetrdan namunani olib tashlash uchun vintni o'ngga burang, so'ngra tutqich yordamida qizdirilgan namunani olib tashlang.
9. Jihozni “TARMOQ” almashtirish tugmasi bilan o'chiring.
10. Miqdorlarning barcha qiymatlarini tarjima qiling 0 va soniyalardagi qiymatlarga (daqiqalarsiz) kiriting va ularni jadvalga kiriting. 8.1. Jadvalning har bir qatori uchun. 8.1 qiymatlarini hisoblang = − 0 va T= t− t 0 .
11. Formuladan foydalanib, namunaning solishtirma issiqlik sig'imining taxminiy hisobini tuzing 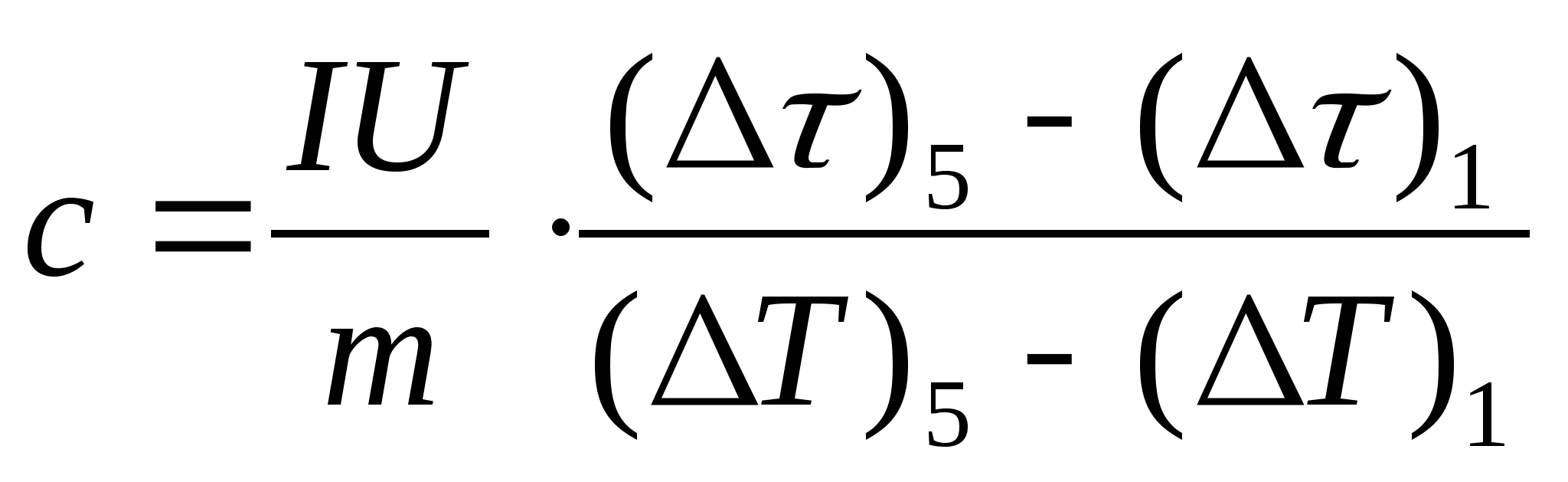 , bu erda namunaning massasi m=139,5 g (guruch) yoki m=129,7 g (po'lat) yoki
m=46,05 g (duralumin). Tekshirish uchun o'qituvchiga keling.
, bu erda namunaning massasi m=139,5 g (guruch) yoki m=129,7 g (po'lat) yoki
m=46,05 g (duralumin). Tekshirish uchun o'qituvchiga keling.
O'lchov natijalarini qayta ishlash
1. Syujet
=f(T) kalorimetrning namuna bilan qizdirish vaqti va bo'sh kalorimetrning kalorimetrning harorat o'zgarishiga bog'liqligi, grafikdagi istalgan ikkita nuqtani tanlang va formuladan foydalanib to'g'ri chiziqning qiyaligini aniqlang. 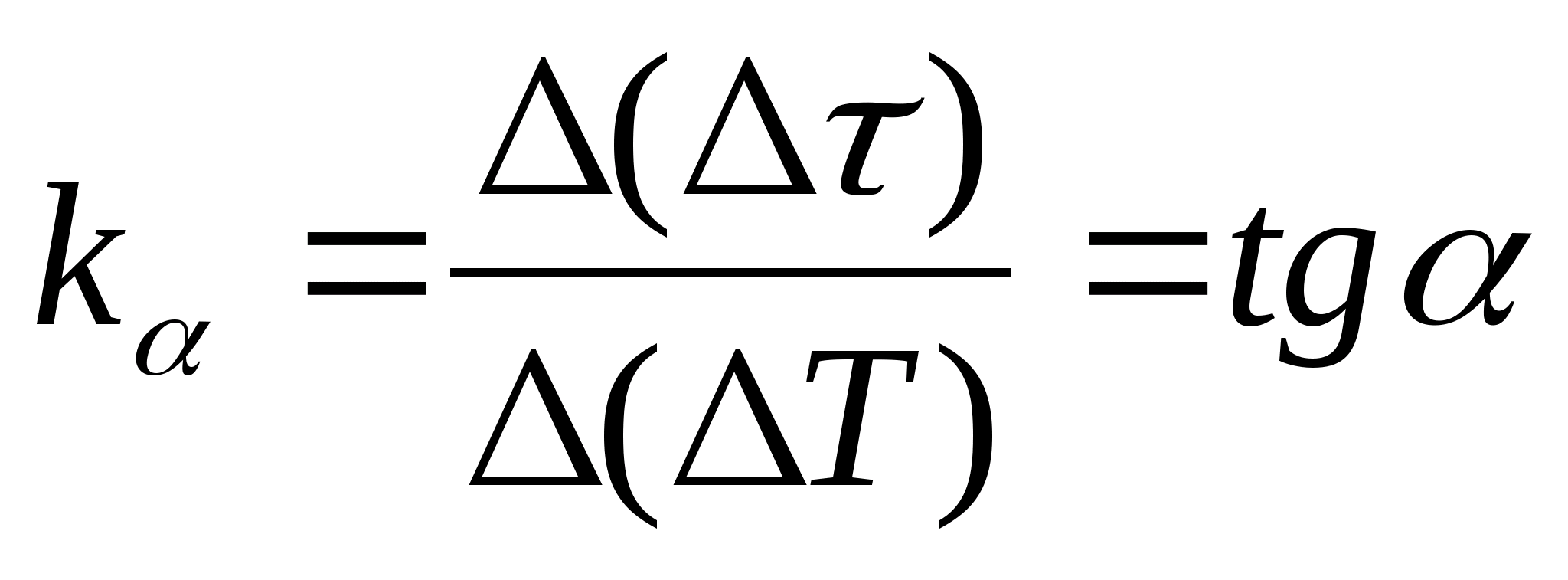 , qayerda
− grafaning o‘qga og‘ish burchagi T
(agar birliklari bo'lsa
va T ikkala o'qda bir xil uzunlikdagi segmentlar sifatida ko'rsatilgan).
, qayerda
− grafaning o‘qga og‘ish burchagi T
(agar birliklari bo'lsa
va T ikkala o'qda bir xil uzunlikdagi segmentlar sifatida ko'rsatilgan).
2. Nishabning qiymatidan foydalanish k
, formuladan foydalanib namunaning solishtirma issiqlik sig'imini aniqlang 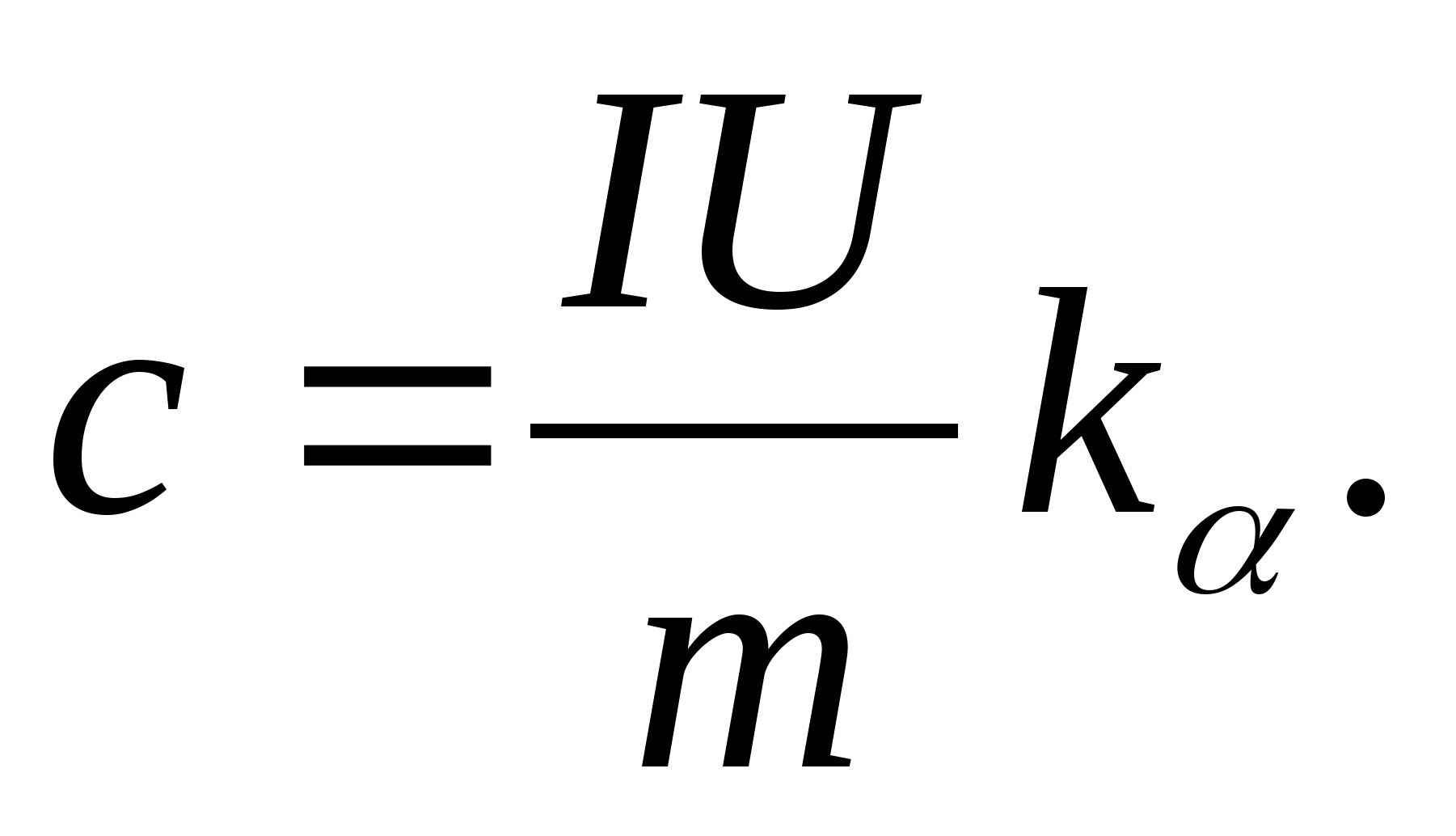
3. 8.2-jadvaldagi (yoki davriy jadval) ma’lumotlardan foydalanib, formuladan foydalanib namunaning molyar issiqlik sig‘imini aniqlang. C m =BilanM.
8.2-jadval
|
Namuna materiali |
Atom massasi, kg/mol |
|
Qattiq jismning modeli sifatida to'g'ri tuzilgan kristall panjarani ko'rib chiqaylik, uning tugunlarida moddiy nuqta sifatida olingan zarrachalar (atomlar, ionlar, molekulalar) o'zlarining muvozanat pozitsiyalari - panjara tugunlari atrofida uchta o'zaro perpendikulyar yo'nalishda tebranadi. . Shunday qilib, kristall panjarani tashkil etuvchi har bir zarrachaga uchta tebranish erkinlik darajasi beriladi, ularning har biri energiyani erkinlik darajalariga teng taqsimlash qonuniga muvofiq (50-bandga qarang) energiyaga ega. kT.
Qattiq jismning molining ichki energiyasi
U m \u003d 3N A kT \u003d 3RT,
bu yerda N A - Avogadro doimiysi; N A k= R (R molyar gaz konstantasi).
Qattiq jismning molyar issiqlik sig'imi
ya'ni molyar (atom) issiqlik sig'imi kimyoviy jihatdan oddiy jismlar kristall holatida bir xil (teng 3 R) va haroratga bog'liq emas. Bu qonun fransuz olimlari P.Dyulong (1785-1838) va L.Peti (1791-1820) tomonidan empirik tarzda olingan va sarlavhaDulong va Petit qonuni.
Agar qattiq modda kimyoviy birikma bo'lsa (masalan, NaCl), u holda moldagi zarrachalar soni Avogadro doimiysiga teng emas, balki tengdir. nN A , qayerda n - molekuladagi atomlar soni (NaCl uchun moldagi zarrachalar soni 2 ga teng) N va shuning uchun bir mol NaCl N A Na atomlarini va N A Cl atomlarini o'z ichiga oladi). Shunday qilib, molyar issiqlik sig'imi qattiq kimyoviy birikmalar
C V \u003d 3R25n J / (mol K),
ya'ni bu birikmani tashkil etuvchi elementlarning atom issiqlik sig'imlari yig'indisiga teng.
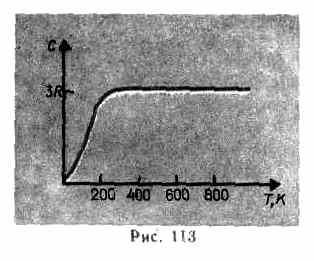
Eksperimental ma'lumotlardan ko'rinib turibdiki (4-jadval), ko'pgina moddalar uchun Dulong va Petit qonuni juda yaxshi yaqinlik bilan qoniqtiriladi, garchi ba'zi moddalar (C, Be, B) hisoblangan issiqlik sig'imlaridan sezilarli og'ishlarga ega. Bundan tashqari, gazlar misolida bo'lgani kabi (53-§ ga qarang), past haroratlarda qattiq jismlarning issiqlik sig'imini o'lchash bo'yicha tajribalar uning haroratga bog'liqligini ko'rsatdi (113-rasm). Kelvin nolga yaqin, jismlarning issiqlik sig'imi T 3 ga mutanosib bo'lib, faqat etarlicha yuqori haroratlarda, har bir moddaning xarakteristikasi (73.1) sharti qondiriladi. Masalan, olmosning issiqlik sig'imi 3 ga teng R 1800 K da! Biroq, ko'pchilik qattiq moddalar uchun xona harorati allaqachon etarlicha yuqori.
Hisoblangan issiqlik quvvatlarining eksperimental va nazariy qiymatlari o'rtasidagi tafovut
klassik nazariyaning asosi, issiqlik sig'imlarining kvant nazariyasiga asoslanib, A. Eynshteyn va P. Debay (1884-1966) tomonidan tushuntirildi.
§ 74. Bug'lanish, sublimatsiya, erish va kristallanish. Amorf jismlar
Suyuqlikda ham, qattiq jismda ham har doim ma'lum miqdordagi molekulalar mavjud bo'lib, ularning energiyasi boshqa molekulalarga tortishni engish uchun etarli bo'ladi va ular suyuqlik yoki qattiq jism yuzasidan ajralib chiqib, ularni o'rab turgan bo'shliqqa o'tishga qodir. Suyuqlik uchun bu jarayon deyiladi bug'lanish(yoki bug'lanish), qattiq moddalar uchun - sublimatsiya(yoki sublimatsiya).
Suyuqliklarning bug'lanishi har qanday haroratda sodir bo'ladi, lekin harorat oshishi bilan uning intensivligi ortadi. Bug'lanish jarayoni bilan birga kompensatsiya jarayoni sodir bo'ladi kondensatsiya bug'dan suyuqlikka aylanadi. Agar birlik sirt orqali suyuqlikni vaqt birligida tark etadigan molekulalar soni bug'dan suyuqlikka o'tadigan molekulalar soniga teng bo'lsa, u holda dinamik muvozanat bug'lanish va kondensatsiya jarayonlari o'rtasida. Suyuqligi bilan muvozanatda bo'lgan bug' deyiladi boy(shuningdek, §62 ga qarang).
Ko'pgina qattiq jismlar uchun oddiy haroratlarda sublimatsiya jarayoni ahamiyatsiz va qattiq jismning yuzasida bug' bosimi past; harorat oshishi bilan u kuchayadi. O'tkir, xarakterli hid bilan aniqlanadigan naftalin, kofur kabi moddalarni intensiv ravishda sublimatsiya qiladi. Sublimatsiya ayniqsa vakuumda intensiv ravishda sodir bo'ladi - bu nometall qilish uchun ishlatiladi. Sublimatsiyaning taniqli misoli muzning bug'ga aylanishidir - nam kirlar sovuqda quriydi.
Agar qattiq jism qizdirilsa, u holda ichki energiya(zarrachalarning panjara joylaridagi tebranish energiyasi va bu zarralarning o'zaro ta'sir qilish energiyasi yig'indisi) ortadi. Haroratning oshishi bilan zarracha tebranishlarining amplitudasi
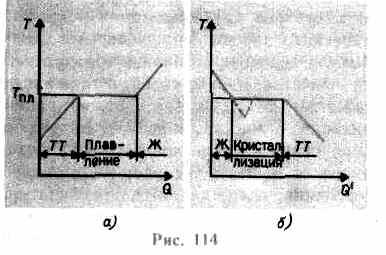
kristall panjarasi yiqilguncha ortadi - qattiq eriydi. Shaklda. 114 a taxminiy bog'liqlik ko'rsatilgan T(Q), qayerda Q- eritish jarayonida organizm tomonidan qabul qilingan issiqlik miqdori. Qattiq uchun xabar sifatida issiqlik tanasi uning harorati ko'tariladi, va erish nuqtasida T pl tananing qattiq holatdan suyuq holatga o'tishini boshlaydi. Harorat T pl butun kristall eritilgunga qadar doimiy bo'lib qoladi va shundan keyingina suyuqlikning harorati yana ko'tarila boshlaydi.
gacha qizdirish T pl hali uni suyuq holatga aylantirmaydi, chunki moddaning zarrachalarining energiyasi kristall panjarani yo'q qilish uchun etarli bo'lishi kerak. Erish jarayonida moddaga berilgan issiqlik kristall panjarani yo'q qilish bo'yicha ishlarni bajarish uchun ishlatiladi va shuning uchun butun kristal eriguncha T pl =const. Keyin berilgan issiqlik suyuqlik zarrachalarining energiyasini oshirish uchun yana ketadi va uning harorati ko'tarila boshlaydi. 1 kg moddani eritish uchun zarur bo'lgan issiqlik miqdori deyiladi o'ziga xos termoyadroviy issiqlik.
Agar suyuqlik sovutilsa, u holda jarayon teskari yo'nalishda davom etadi (114-rasm, b; Q" - kristallanish jarayonida tanadan ajralib chiqadigan issiqlik miqdori): avval suyuqlikning harorati pasayadi, so'ngra T pl ga teng doimiy haroratda boshlanadi. kristallanish, u tugagandan so'ng, kristallning harorati pasayishni boshlaydi. Bir moddaning kristallanishi uchun, deb atalmish mavjudligi kristallanish markazlari - kristall yadrolar, ular nafaqat hosil bo'lgan moddaning kristallari, balki aralashmalar, shuningdek, chang, kuyikish va boshqalar bo'lishi mumkin.Sof suyuqlikda kristallanish markazlarining yo'qligi mikroskopik kristallarning shakllanishini qiyinlashtiradi va modda, suyuq holatda qolib, kristallanish haroratidan pastroq haroratgacha soviydi va shu bilan hosil bo'ladi haddan tashqari sovutilgan suyuqlik(114, b da chiziqli egri chiziqqa mos keladi). Kuchli o'ta sovutish bilan kristallanish markazlarining o'z-o'zidan shakllanishi boshlanadi va modda juda tez kristallanadi.
Odatda, eritmaning supersovishi fraksiyalardan o'nlab darajagacha sodir bo'ladi, biroq bir qator moddalar uchun u yuzlab darajaga yetishi mumkin. Yuqori yopishqoqlik tufayli yuqori darajada sovutilgan suyuqliklar qattiq moddalar kabi o'z shakllarini saqlab, suyuqligini yo'qotadi. Bu jismlar deyiladi amorf qattiq moddalar; bularga qatronlar, mum, muhrlash mumi, shisha kiradi. Amorf jismlar, shuning uchun o'ta sovutilgan suyuqliklar, izotrop, ya'ni ularning xususiyatlari barcha yo'nalishlarda bir xil; ular uchun, shuningdek, suyuqliklar uchun xarakterlidir qisqa muddatli buyurtma zarrachalarning joylashishida; ularda suyuqliklardan farqli o'laroq, zarrachalarning harakatchanligi ancha kichik. Amorf jismlarning o'ziga xos xususiyati shundaki, ular o'ziga xos erish nuqtasiga ega emas, ya'ni undan yuqori suyuqlik holatini aniqlash mumkin bo'lgan va qattiq holatdan pastroq haroratni ko'rsatish mumkin emas. Tajribadan ma'lumki, amorf jismlarda kristallanish jarayoni vaqt o'tishi bilan kuzatilishi mumkin, masalan, shishada kristallar paydo bo'ladi; u shaffoflikni yo'qotib, loyqalana boshlaydi va polikristalli tanaga aylanadi.
So'nggi paytlarda keng tarqalgan milliy iqtisodiyot oldi polimerlar- molekulalari kimyoviy (valentlik) bog'lar bilan bog'langan ko'p sonli bir xil uzun molekulyar zanjirlardan iborat bo'lgan organik amorf jismlar. Polimerlarga tabiiy (kraxmal, oqsil, kauchuk, tola va boshqalar) va sun'iy (plastmassa, kauchuk, polistirol, lavsan, neylon va boshqalar) organik moddalar kiradi. Polimerlar o'ziga xos kuch va elastiklikdir; ba'zi polimerlar asl uzunligidan 5-10 baravar ko'p cho'zilishga bardosh beradi. Bu uzoq molekulyar zanjirlar deformatsiya ostida zich sharchalarga buklanib yoki to'g'ri chiziqlarga cho'zilishi mumkinligi bilan izohlanadi. Polimerlarning elastikligi faqat ma'lum bir harorat oralig'ida o'zini namoyon qiladi, undan pastda ular qattiq va mo'rt bo'ladi, yuqorida esa - plastik. Ko'pgina sintetik polimer materiallar (sun'iy tolalar, teri o'rnini bosuvchi moddalar, qurilish materiallari, metall o'rnini bosuvchi moddalar va boshqalar) yaratilgan bo'lsa-da, polimerlar nazariyasi hali to'liq rivojlanmagan. Uning rivojlanishi zamonaviy texnologiya talablari bilan belgilanadi, bu esa oldindan belgilangan xususiyatlarga ega polimerlarni sintez qilishni talab qiladi.
Moddaning o'ziga xos issiqlik sig'imi deganda qiymat tushuniladi
, (1)
tanaga berilgan issiqlik miqdori qayerda.
da sodir bo'ladigan haroratning o'zgarishi
issiqlikning tanaga o'tishi natijasida,
m - qizdirilgan tananing massasi.
Tajriba odatda o'rtachani aniqlaydi o'ziga xos issiqlik c moddasi, son jihatdan ushbu moddaning haroratini oshirish uchun uning birlik massasiga berilishi kerak bo'lgan issiqlik miqdoriga teng:
(2),
o'rganilayotgan tananing oxirgi va boshlang'ich harorati o'rtasidagi farq qayerda.
Issiqlik sig'imini eksperimental ravishda aniqlash uchun turli xil kalorimetrik usullar qo'llaniladi. Bu usullarning xilma-xilligi shundaki, organizmga berilgan issiqlik miqdorini aniq o'lchash uchun o'rganilayotgan jismni isitishda hisobga olinmaydigan issiqlik yo'qotishlarini bartaraf etish kerak.
Odatda, izotermik qobiqli deb ataladigan kalorimetrlarda radiatsiya uchun hisoblangan yoki eksperimental ravishda aniqlangan tuzatish kiritiladi, ya'ni tajriba davomida kalorimetrning nurlanish orqali tashqi muhitga oladigan yoki chiqaradigan issiqlik miqdori.
Shu bilan birga, yaxshi issiqlik izolatsiyasini joriy qilish yoki tajriba davomiyligini qisqartirish orqali issiqlik yo'qotishlarini sezilarli darajada kamaytirish mumkin, bu namunaning yuqori qizish tezligi ~ (issiqlik sig'imini o'lchash uchun impuls usuli), bunda issiqlik yo'qotishlari sodir bo'ladi. berilgan issiqlikning umumiy miqdoriga nisbatan kichik bo'lishi kerak.
Issiqlik sig'imini aniqlashning eng aniq usullaridan biri adiabatik kalorimetr usuli hisoblanadi. Ushbu turdagi kalorimetrlarda issiqlik yo'qotishlarini hisobga olish zarurati bilan bog'liq qiyinchiliklar o'lchovlar issiqlik muvozanati sharoitida, ya'ni o'rganilayotgan namuna va namunani o'rab turgan blokning teng haroratlari sharoitida amalga oshirilishi bilan bartaraf etiladi. . Ushbu usulning afzalliklari yuqori aniqlik bilan bir qatorda keng harorat oralig'ida qattiq jismlarning issiqlik sig'imini aniqlash imkoniyatini ham o'z ichiga oladi, bu moddalar fazaviy o'zgarishlarga duchor bo'lsa, ayniqsa muhimdir.
Adiyabatik kalorimetr turlaridan birining qurilmasi rasmda sxematik ko'rsatilgan. Sinov namunasi 1 mis blokga 3 joylashtiriladi va u bilan birga pechda 4 isitiladi. Namuna ichiga 2-isitgich kiritiladi, bu namunani qo'shimcha isitish imkonini beradi.
Namuna bilan blok qo'yilgan 4-o'choq yoqilgandan so'ng, namunaning harorati blokning haroratidan past bo'lib, ko'tarila boshlaydi. Namuna va blokning harorati o'rtasidagi tenglikni o'rnatish uchun namuna ichiga joylashtirilgan isitgichni yoqing. Namuna harorati blok haroratidan biroz yuqori bo'lsa, ichki isitgich o'chiriladi.
Keyinchalik, bu isitgich vaqti-vaqti bilan yoqiladi va o'chiriladi, shuning uchun namuna va blok o'rtasidagi harorat farqi doimo belgini o'zgartiradi.
Nolga teng bo'lgan vaqtda (ichki isitgich yoqilganda) namuna va blok o'rtasida issiqlik almashinuvi yo'q va ichki isitgich tomonidan chiqarilgan issiqlikning butun miqdori faqat namunani isitish uchun sarflanadi; bu holda solishtirma issiqlik formula (2) bo'yicha aniqlanishi mumkin.
Ichki isitgich tomonidan chiqarilgan issiqlik miqdori quyidagi formula bilan aniqlanadi:
bu erda I - ichki isitgichning oqimi;
V - undagi kuchlanishning pasayishi;
- harorat ga ko'tarilgan vaqt oralig'i.
Keyin
(4)
ga namunaning harorati o'zgargan vaqt qayerda.
Differensial shaklda formula (4) shaklga ega
(5)
Namuna harorati T termojuft bilan o'lchanadi.Blok va namuna o'rtasidagi harorat farqi differensial termojuft bilan o'lchanadi. Namuna haroratini aniqlash uchun termojuftni kalibrlash egri chizig'i T qo'llaniladi.Blok va namuna o'rtasidagi harorat farqi galvanometr shkalasi bo'linmalarida aniqlanadi (chunki faqat blok va blok o'rtasidagi harorat farqi paydo bo'lgan momentni belgilash kerak. namuna o'zgarishlar belgisi).
Ishni yakunlash.
Namuna mis blokning ichiga joylashtirilgan isitgichga qo'yiladi. Termojuft birlashmalari T va namunaga va blokga ulanadi. Pech qopqog'i bilan yopiladi. Blok joylashtirilgan pechning elektr o'rashi yoqiladi. Namuna ichiga joylashtirilgan isitgich vaqti-vaqti bilan yoqiladi va o'chiriladi va I va V qiymatlari ichki isitgichning pallasida qayd etiladi.
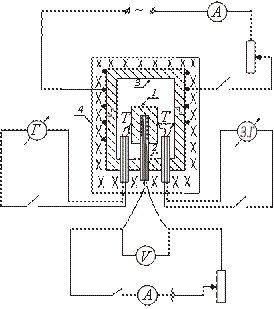
O'lchovlarni boshlashdan oldin, oyna galvanometrining nol holatini tekshirish kerak. Buning uchun termojuftni galvanometrdan uzib, quyonning shkala bo'ylab tebranishini to'xtatishini kutishadi. Agar bundan keyin ipning tasviri nolga to'g'ri kelmasa, u holda masshtabni siljitish orqali bu tasodifga erishiladi.
T va vaqtga bog'liqlik egri chizilgan.
T(t) egri chizig‘ining ishorasini o‘zgartiruvchi nuqtadagi qiyaligidan (ya’ni issiqlik muvozanati o‘rnatilganda) solishtirma issiqlik (5) formula yordamida hisoblanadi. Bu issiqlik sig'imi blok va namuna o'rtasidagi harorat farqi belgisini o'zgartirganda, T(t) egri chizig'idan o'qilishi kerak bo'lgan haroratni anglatadi.
