Issiqlik sig'imi qanday birliklarda o'lchanadi? Gazlarning issiqlik sig'imi. Issiqlik quvvatlarining turlari
Jismning issiqlik sig'imi - bu tananing haroratini bir darajaga ko'tarish uchun unga berilishi kerak bo'lgan issiqlik miqdori. Bir daraja sovutilganda, tana bir xil miqdorda issiqlik chiqaradi. Issiqlik sig'imi tananing massasiga proportsionaldir. Jismning birlik massasining issiqlik sig'imi o'ziga xos deb ataladi va o'ziga xos issiqlikning atom yoki molekulyar massaga ko'paytirilishi mos ravishda atom yoki molyar deb ataladi.
Issiqlik sig'imlari turli moddalar bir-biridan juda farq qiladi. Shunday qilib, o'ziga xos issiqlik 20 ° C da suv 4200 J / kg K, qarag'ay daraxti - 1700, havo - 1010. Metallar uchun u kamroq: alyuminiy - 880 J / kg K, temir - 460, mis - 385, qo'rg'oshin - 130. O'ziga xos issiqlik harorat bilan bir oz ortadi (90 ° C da, suvning issiqlik sig'imi 4220 J / kg K ni tashkil qiladi) va fazaviy o'zgarishlarda juda katta farq qiladi: 0 ° C da muzning issiqlik sig'imi suvnikidan 2 baravar kam; 100 ° C da suv bug'ining issiqlik sig'imi taxminan 1500 J / kg K ni tashkil qiladi.
Issiqlik sig'imi tananing harorati o'zgargan sharoitlarga bog'liq. Agar tananing o'lchamlari o'zgarmasa, unda barcha issiqlik ichki energiyani o'zgartirishga ketadi. Bu erda biz doimiy hajmdagi issiqlik sig'imi haqida gapiramiz. Doimiy tashqi bosimda, termal kengayish tufayli, mexanik ish tashqi kuchlarga qarshi amalga oshiriladi va ma'lum bir haroratgacha qizdirish ko'proq issiqlikni talab qiladi. Shuning uchun doimiy bosimdagi issiqlik sig'imi har doim dan katta bo'ladi. Uchun ideal gazlar(rasmga qarang), bu erda R - gaz doimiysi, 8,32 J / mol K ga teng.
Odatda o'lchanadi. Klassik usul issiqlik sig'imi o'lchovlari quyidagicha: issiqlik sig'imi o'lchanishi kerak bo'lgan jism ma'lum bir haroratgacha qizdiriladi va boshlang'ich harorati bo'lgan kalorimetrga joylashtiriladi, suv yoki issiqlik sig'imi ma'lum bo'lgan boshqa suyuqlik bilan to'ldiriladi va - issiqlik sig'imi. Kalorimetr va suyuqlik).
Issiqlik muvozanati o'rnatilgandan so'ng kalorimetrdagi haroratni o'lchash orqali tananing issiqlik sig'imi quyidagi formula yordamida hisoblanishi mumkin:
![]()
qayerda va - tananing massalari, suyuqlik va kalorimetr.
Eng rivojlangan nazariya gazlarning issiqlik sig'imidir. Oddiy haroratlarda isitish asosan gaz molekulalarining translatsiya va aylanish harakati energiyasining o'zgarishiga olib keladi. Monatomik gazlarning molyar issiqlik sig'imi uchun nazariya beradi , diatomik va ko'p atomli - va. Juda past haroratlarda issiqlik sig'imi kvant ta'siri tufayli biroz kamroq bo'ladi (2-rasmga qarang). Kvant mexanikasi). Da yuqori haroratlar tebranish energiyasi qo'shiladi va ko'p atomli gazlarning issiqlik sig'imi harorat oshishi bilan ortadi.
Kristallarning atom issiqlik sig'imi klassik nazariyaga ko'ra ga teng bo'lib, bu Dyulong va Petitning empirik qonuniga mos keladi (1819 yilda fransuz olimlari P. Dyulong va A. Petitlar tomonidan asos solingan). Kvant nazariyasi issiqlik sig'imi yuqori haroratlarda bir xil xulosaga olib keladi, lekin haroratning pasayishi bilan issiqlik quvvatining pasayishini taxmin qiladi. Mutlaq nolga yaqin, barcha jismlarning issiqlik sig'imi nolga intiladi (termodinamikaning uchinchi qonuni).
Tananing issiqlik sig'imi- bu jismoniy miqdor, qizdirilganda tana tomonidan so'rilgan issiqlik miqdori uning haroratining o'zgarishiga nisbati bilan aniqlanadi:
Jismning issiqlik sig'imi fizik ma'nosi: jismning issiqlik sig'imi 1K ga qizdirilganda so'rilgan yoki 1K ga sovutilganda chiqarilgan issiqlik miqdoriga teng.
Issiqlik sig'imlari o'zgaruvchan bo'lgani uchun ular o'rtacha va haqiqiy issiqlik sig'imlarini ajratadilar. O'rtacha issiqlik quvvati ostida issiqlik miqdori nisbati tushuniladi q , moddaning (gaz) miqdorining birligiga, uning haroratining o'zgarishiga yig'iladi t 1 oldin t 2 harorat farqi sharti bilan t 2 – t 1 chekli qiymatdir. O'rtacha massa, hajm va molyar issiqlik sig'imlari mos ravishda belgilanadi c m , c m ' va m . O'rtacha issiqlik sig'imi ta'rifidan kelib chiqadiki, agar gaz harorati dan ko'tarilsa t 1 oldin t 2 keyin uning o'rtacha issiqlik sig'imi [kJ / (kg * K)]
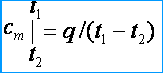
Haqiqiy issiqlik sig'imi deganda gaz haroratining cheksiz kichik o'zgarishiga mos keladigan, haroratning cheksiz kichik o'zgarishiga mos keladigan gazning issiqlik sig'imi tushuniladi. dt , ya'ni.
c = dq/dt,
qayerda dq=cdt.
Maxsus issiqlik turli moddalar qizdirilganda issiqlikni yutish qobiliyatidir. Moddaning solishtirma issiqlik sig'imi u qizdirilganda olingan issiqlik miqdorining moddaning massasiga va uning haroratining o'zgarishiga nisbati bilan belgilanadi, agar: ![]()
Cp va CV molyar issiqlik sig'imlari o'rtasidagi bog'liqlikni ifodalovchi munosabat quyidagi ko'rinishga ega (Mayer formulasi): Cp = CV + R. YOKI KO'PROQ KENGAYGAN issiqlik sig'imi ideal gaz Agar issiqlik almashinuvi natijasida tanaga ma'lum miqdorda issiqlik o'tkazilsa, u holda tananing ichki energiyasi va uning harorati o'zgaradi. 1 kg moddani 1 K ga qizdirish uchun zarur bo'lgan Q issiqlik miqdori c moddaning solishtirma issiqligi deyiladi. c = Q / (mDT). Ko'p hollarda molyar issiqlik sig'imi C dan foydalanish qulay: C = M c, bu erda M - moddaning molyar massasi. Shu tarzda aniqlangan issiqlik sig'imi moddaning aniq tavsifi emas. Termodinamikaning birinchi qonuniga ko'ra, tananing ichki energiyasining o'zgarishi nafaqat olingan issiqlik miqdoriga, balki tananing bajargan ishiga ham bog'liq. Issiqlik uzatish jarayoni amalga oshirilgan sharoitga qarab, tana turli ishlarni bajarishi mumkin edi. Shuning uchun tanaga bir xil miqdordagi issiqlik uzatilishi uning ichki energiyasida va shunga mos ravishda haroratda turli xil o'zgarishlarga olib kelishi mumkin. Issiqlik sig'imini aniqlashda bunday noaniqlik faqat gazsimon moddaga xosdir. Suyuq va qattiq jismlar qizdirilganda ularning hajmi deyarli o'zgarmaydi va kengayish ishi nolga teng bo'ladi. Shuning uchun, tana tomonidan qabul qilingan barcha issiqlik miqdori uning ichki energiyasini o'zgartirishga ketadi. Suyuqliklardan farqli o'laroq va qattiq moddalar, issiqlik uzatish jarayonida gaz hajmini sezilarli darajada o'zgartirishi va ishni bajarishi mumkin. Shuning uchun gazsimon moddaning issiqlik sig'imi termodinamik jarayonning tabiatiga bog'liq. Odatda, gazlarning issiqlik sig'imining ikkita qiymati hisobga olinadi: CV - izoxorik jarayondagi molyar issiqlik sig'imi (V = const) va Cp - izobarik jarayondagi molyar issiqlik sig'imi (p = const). Doimiy hajmdagi jarayonda gaz hech qanday ish qilmaydi: A = 0. 1 mol gaz uchun termodinamikaning birinchi qonunidan QV = CVDT = DU quyidagicha bo'ladi. Gazning ichki energiyasining DU o'zgarishi uning haroratining DT o'zgarishiga to'g'ridan-to'g'ri proportsionaldir. Doimiy bosimdagi jarayon uchun termodinamikaning birinchi qonuni quyidagilarni beradi: Qp = DU + p(V2 - V1) = CVDT + pDV, bu erda DV - ideal gazning harorati DT ga o'zgarganda 1 mol ideal gaz hajmining o'zgarishi. Bundan kelib chiqadi: DV / DT nisbatini 1 mol uchun yozilgan ideal gazning holat tenglamasidan topish mumkin: pV = RT, bu erda R universal gaz doimiysi. p = const da Shunday qilib, Cp va CV molyar issiqlik sig'imlari o'rtasidagi munosabatni ifodalovchi munosabat quyidagi ko'rinishga ega (Mayer formulasi): Cp = CV + R.
Gaz konstantasi son jihatdan 1 mol ideal gazning doimiy bosim ostida 1 K qizdirilganda kengayish ishiga teng. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8,31(44) Dj/ (mol K)
Universal gaz konstantasi universal, fundamental fizik doimiy R bo‘lib, Boltsman doimiysi k va Avogadro doimiysi ko‘paytmasiga teng.
Jismoniy ma'nosi: Gaz doimiy i haroratning 1 K ga oshishi bilan izobarik jarayonda bir mol ideal gazning kengayish ishiga son jihatdan teng.
CGS tizimida gaz konstantasi:
Maxsus gaz konstantasi:
Adiabatik ko'rsatkich(ba'zan chaqiriladi koeffitsientiPuasson) - doimiy bosimdagi issiqlik sig'imining () doimiy hajmdagi issiqlik sig'imiga nisbati (). Ba'zan u ham deyiladi omil izentropik kengaytmalar. Yunoncha harf (gamma) yoki (kappa) bilan belgilanadi. Harf belgisi asosan kimyo muhandisligi fanlarida qo'llaniladi. Issiqlik texnikasida lotin harfi ishlatiladi.
Gazlar aralashmasi ko'rib chiqilayotgan sharoitlarda bir-biri bilan kimyoviy reaksiyaga kirishmaydigan bir nechta o'xshash gazlar to'plamidir.
Gazlar aralashmasi bir hil termodinamik tizimdir (uning ichida tizimning xususiyatlari va tarkibi bilan farq qiluvchi makroskopik qismlarini bir-biridan ajratib turadigan interfeyslar mavjud emas).
Qisman bosim Aralashmadagi i-gazning P i, agar aralashmadan boshqa barcha gazlar chiqarilsa va V va T o'zgarmasa, bu gaz qanday bosim ostida bo'lar edi.
Dalton qonuni - Kimyoviy o'zaro ta'sir qilmaydigan gazlar aralashmasining bosimi bu gazlarning qisman bosimlari yig'indisiga teng.
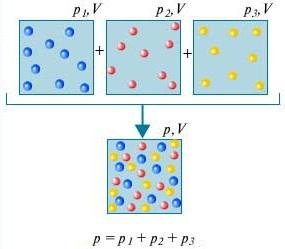
Nima ekanligini tushunish uchun Dalton qonuni, buning uchun xonadagi havoni hisobga oling. Bu bir nechta gazlarning aralashmasi: azot (80%), kislorod (20%). Ushbu gazlarning har birining qisman bosimi, agar u butun hajmni egallagan bo'lsa, gazning bosimiga teng. Misol uchun, agar xonadan azotdan tashqari barcha gazlar olib tashlangan bo'lsa, unda qolgan narsaning bosimi azotning qisman bosimi bo'ladi. Dalton qonuni birgalikda olingan barcha gazlarning umumiy bosimi alohida olingan har bir gazning qisman bosimlari yig'indisiga teng ekanligini ta'kidlaydi. (To'g'rirog'i, qonun faqat ideal gazlarga nisbatan qo'llaniladi, lekin juda yaxshi yaqinlashuv uchun u haqiqiy gazlarni ham tasvirlaydi.)
Termodinamikaning birinchi qonuni termodinamik tizim uchun energiyaning saqlanish va aylanish qonunini umumlashtirishdir. U quyidagicha tuzilgan:
D ni o'zgartirishU izolyatsiyalanmagan termodinamik tizimning ichki energiyasi issiqlik miqdori orasidagi farqga tengQ tizimga o'tkaziladi va ishlaydiA , tashqi jismlar ustidan mukammal tizim.
|
Termodinamikaning birinchi qonunini ifodalovchi munosabat ko'pincha boshqa shaklda yoziladi:
|
Tizim tomonidan qabul qilingan issiqlik miqdori uning ichki energiyasini o'zgartirish va tashqi jismlarda ishlarni bajarish uchun sarflanadi.
Termodinamikaning birinchi qonuni eksperimental faktlarni umumlashtirishdir. Ushbu qonunga ko'ra, energiyani yaratish yoki yo'q qilish mumkin emas; u bir tizimdan ikkinchi tizimga o'tadi va bir shakldan ikkinchisiga aylanadi. Termodinamikaning birinchi qonunining muhim natijasi shundaki, tashqaridan energiya iste'mol qilmasdan va mashinaning ichida hech qanday o'zgarishsiz foydali ishlarni bajarishga qodir mashina yaratish mumkin emas. Bunday faraziy mashina deyiladi birinchi turdagi doimiy harakat mashinasi (perpetuum mobile). . Bunday mashinani yaratish bo'yicha ko'plab urinishlar har doim muvaffaqiyatsiz tugadi. Har qanday mashina ijobiy ishni bajarishi mumkin A tashqi jismlar ustidan faqat ma'lum miqdorda issiqlik olish orqali Q atrofdagi jismlardan yoki D ning kamayishi U uning ichki energiyasi.
Keling, termodinamikaning birinchi qonunini gazlardagi izoproseslarga tatbiq qilaylik.
Izobarik kengayish bilan Q> 0 - issiqlik gaz tomonidan so'riladi va gaz ijobiy ish qiladi. Izobarik siqish bilan Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T bitta; ichki energiya kamayadi, D U < 0.
DA izotermik jarayon gaz harorati o'zgarmaydi, shuning uchun gazning ichki energiyasi o'zgarmaydi, D U = 0.
DA izoxorik jarayon (V= const) gaz ishlamaydi, A= 0. Shuning uchun,
Izobarik jarayon uchun termodinamikaning birinchi qonuni quyidagilarni beradi:
|
Izotermik jarayon uchun termodinamikaning birinchi qonuni munosabat bilan ifodalanadi
|
Issiqlik miqdori Q, izotermik kengayish jarayonida gaz tomonidan olingan, tashqi jismlar ustida ishlashga aylanadi. Izotermik siqilishda gazda hosil bo'lgan tashqi kuchlarning ishi issiqlikka aylanadi va u atrofdagi jismlarga o'tkaziladi.
Termodinamikada izoxorik, izobarik va izotermik jarayonlar bilan bir qatorda ko'pincha atrofdagi jismlar bilan issiqlik almashinuvi bo'lmaganda sodir bo'ladigan jarayonlarni ko'rib chiqadi. Izolyatsiya qiluvchi devorlarga ega bo'lgan idishlar deyiladi adiabatik qobiqlar, va bunday idishlarda gazning kengayishi yoki siqilish jarayonlari deyiladi adiabatik.
DA adiabatik jarayonQ= 0; shuning uchun termodinamikaning birinchi qonuni shakl oladi
|
|
|
O'zining fizik ma'nosida termodinamikaning birinchi qonuni termodinamikadagi energiyaning saqlanish (o'zgarishi) qonunidir. Agar mexanikadagi energiya o'zgarishi qonuniga ko'ra, konservativ bo'lmagan kuchlarning ishi tizimning mexanik energiyasining o'sishiga teng bo'lsa (xususan, manfiy belgiga ega bo'lgan ishqalanish kuchlarining ishi kamayishiga teng bo'ladi). tizimning mexanik energiyasi), keyin termodinamikaning birinchi qonuniga ko'ra, termodinamik tizimning ichki energiyasining o'sishi tashqi kuchlar ishining yig'indisiga teng bo'ladi , tizim ustida mukammal va energiyaga o'tkazilgan energiya. issiqlik uzatish orqali tizim. Entalpiya(yunon tilidan. entalpo- qizdirish) hisoblanadi materiyaning mulki, issiqlikka aylanishi mumkin bo'lgan energiya miqdorini ko'rsatadi. Entalpiya moddaning molekulyar tuzilishida saqlanadigan energiya darajasini ko'rsatadigan termodinamik xususiyatdir. Bu shuni anglatadiki, materiya harorat va bosimga asoslangan energiyaga ega bo'lishi mumkin, ammo ularning hammasi ham issiqlikka aylantirilmaydi. Ichki energiyaning bir qismi doimo moddada qoladi va uning molekulyar tuzilishini saqlaydi. Moddaning kinetik energiyasining bir qismi uning harorati atrof-muhit haroratiga yaqinlashganda mavjud emas. Binobarin, entalpiya ma'lum harorat va bosimda issiqlikka aylantirish uchun mavjud bo'lgan energiya miqdori. Entalpiya birliklari energiya uchun BTU yoki Joule va o'ziga xos energiya uchun Btu / lbm yoki J / kg. 11 savol |

Ishning maqsadi: Materiallarning issiqlik sig'imini eksperimental aniqlash.
Uskunalar: Tarozilar, vazn, kalorimetr, issiqlik sig'imi ma'lum bo'lgan metall silindr, stakan, isitgich, ilgak.
Qisqacha nazariya:
Barcha makroskopik jismlar va jismlarning sistemalari harakati va oʻzaro taʼsiri tufayli mexanik energiyadan tashqari, ularning ichki holatiga bogʻliq boʻlgan energiyaga ega. Jismni tashkil etuvchi barcha zarralar orasidagi harakat va o'zaro ta'sir energiyasi bo'lgan bu energiya ichki deyiladi.
Ichki energiyaga ma'lum jismni tashkil etuvchi molekulalar va atomlarning issiqlik harakatining kinetik energiyasi, yadrolar atrofida atomlarda harakatlanuvchi elektronlarning kinetik energiyasi, molekulalar, atomlar, elektronlar va yadrolar o'rtasidagi o'zaro ta'sirning potentsial energiyasi, yadrodagi nuklonlar kiradi. , va boshqalar. Ichki energiya tushunchasi butun jismning kinetik va potentsial energiyasini o'z ichiga olmaydi.
Ichki energiya berilgan tizimning holatini tavsiflovchi parametrlar to'plami bilan yagona aniqlanadi, ya'ni. bu tizim holatining yagona qiymatli funktsiyasidir.
Ichki energiya odatda U harfi bilan belgilanadi.
Fazali o'tish temperaturalaridan uzoqda bo'lgan haroratlarda sodir bo'ladigan issiqlik hodisalarida DU ichki energiyasining o'zgarishi molekulalarning kinetik va potentsial energiyasining o'zgarishi bilan bog'liq, ichki energiyaning qolgan tarkibiy qismlari esa o'zgarmaydi. Shuning uchun bunday jarayonlarda tananing ichki energiyasi barcha molekulalarning xaotik issiqlik harakatining kinetik energiyalari yig'indisiga teng deb taxmin qilishimiz mumkin, bu jismning massa markaziga va barcha o'zaro ta'sirning potentsial energiyalariga teng. molekulalar bir-biri bilan.
Tananing holati o'zgarganda uning ichki energiyasi o'zgaradi. Masalan, tananing harorati ko'tarilganda, uning ichki energiyasi ortadi, chunki bu jism molekulalari harakatining o'rtacha kinetik energiyasi ortadi. Haroratning pasayishi bilan tananing ichki energiyasi kamayadi.
Jismlarning ichki energiyasi o'zgarishi mumkin turli yo'llar bilan. Masalan, ma'lum bir jismning deformatsiyasi vaqtida mexanik ish tashqi kuchlar ta'sirida bajarilganda, shuningdek, ish bajarilmasdan turib, tananing harorati yuqori yoki pastroq bo'lgan boshqa jism (yoki muhit) bilan aloqa qilganda ichki energiya o'zgaradi. berilgan tana.
Mexanik ishlarni bajarmasdan tananing ichki energiyasini o'zgartirish jarayoni issiqlik uzatish yoki issiqlik uzatish deb ataladi. Issiqlik uzatishning uch turi mavjud: konveksiya, o'tkazuvchanlik va radiatsiya.
Issiqlik almashinuvi jarayonida energiya bir turdan ikkinchisiga o'tkazilmaydi. Issiqlik uzatish jarayoni issiqroq jismdan ichki energiyaning bir qismi kamroq issiq jismga (yoki muhitga) o'tkazilishidan iborat.
Issiqlik uzatish jarayonlarini tavsiflash uchun issiqlik miqdori tushunchasi kiritiladi, bu issiqlik uzatish jarayonida tananing ichki energiyasining o'zgarishining miqdoriy o'lchovi bo'lgan miqdor deb ataladi.
Shuni esda tutish kerakki, tana faqat energiya berishi yoki olishi mumkin va Q issiqlik miqdori issiqlik uzatish jarayonida tana tomonidan berilgan yoki olingan energiyaning faqat raqamli ekvivalentidir.
Issiqlik miqdori jarayonning turiga bog'liq va tizimning holatiga bog'liq emas.
Fazali o'zgarishlarsiz sodir bo'ladigan tanani isitish uchun zarur bo'lgan issiqlik miqdori (moddaning agregatsiya holatini o'zgartirmasdan):
Bu erda c - tananing m massasiga o'tkaziladigan issiqlik miqdori va natijada harorat o'zgarishi DT nisbati bilan aniqlanadigan tananing solishtirma issiqlik sig'imi, m - tana massasi, DT - yakuniy va o'rtasidagi farq. berilgan tananing boshlang'ich harorati.
Haroratni bir Kelvinga oshirish uchun tanaga berilishi kerak bo'lgan issiqlik miqdori bu moddaning issiqlik sig'imi deb ataladi. Bir Kelvin bilan sovutilganda, tana bir xil miqdorda issiqlik chiqaradi. Jismning issiqlik sig'imi tananing massasiga mutanosib bo'lib, u qaysi moddadan tashkil topganiga bog'liq. SI birliklar tizimida issiqlik sig'imi J/K da o'lchanadi.
Moddaning issiqlik xususiyatlarini tavsiflash uchun ushbu moddaning birlik massasining issiqlik sig'imi olinadi. Bu xususiyat o'ziga xos issiqlik sig'imi deb ataladi. Bu ma'lum bir jismning issiqlik sig'imi uning massasiga nisbatiga teng. SI tizimi bilan o'ziga xos issiqlik quvvati J / (kg × K) bilan o'lchanadi.
Metall jismning solishtirma issiqligi eksperimental ravishda kalorimetr va termometr yordamida aniqlanadi. Eng oddiy kalorimetr boshqa stakan ichiga tiqinlar (issiqlik izolyatsiyasi maqsadida) o'rnatilgan sayqallangan metall shishadan iborat. Ichki oyna suv yoki o'ziga xos issiqlik sig'imi ma'lum bo'lgan boshqa suyuqlik bilan to'ldirilgan. Muayyan haroratgacha qizdirilgan jism t kalorimetrga tushiriladi. Jismni tushirishdan oldin kaloriyametrdagi suyuqlikning harorati t 1 bo'lsin va suyuqlik va unga tushirilgan tananing issiqlik muvozanati o'rnatilgandan keyin ularning umumiy harorati q ga teng bo'ladi.
Energiyaning saqlanish qonunidan kelib chiqadiki:
Q \u003d Q 1 + Q 2,(2)
issiqlik miqdori qayerda Q, qizdirilgan jism tomonidan berilgan, issiqlik miqdori yig'indisiga teng Q1, suv bilan qabul qilingan va Q2, Kalorimetr tomonidan qabul qilinadi.
(1) ni hisobga olib, (2) ni quyidagi shaklda qayta yozamiz:
sm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
qayerda c 1 va m 1- kalorimetrdagi suvning solishtirma issiqlik sig'imi va massasi, c 2 va m2- kalorimetrning solishtirma issiqlik sig'imi va massasi. Bu tenglama issiqlik balansi tenglamasi deb ataladi. Undan biz tananing o'ziga xos issiqlik sig'imini topamiz:
Bu masalani yechishga boshqa yo‘l bilan yondashish mumkin, deylik, bitta tajriba doirasidagi energiya yo‘qotishlari bir xil bo‘ladi. Tana Bilan ma'lum o'ziga xos issiqlik sig'imi, ma'lum bir haroratgacha isitiladi t, harorati o'zgarib turadigan kalorimetrga tushiriladi. Keyin issiqlik balansi tenglamasi quyidagi shaklni oladi:
sm(t-q) = c 1 m 1 (q-t 1) + Q yo'qotish,(5)
qayerda Q yo'qotish- kalorimetr tomonidan qabul qilingan issiqlik miqdori va muhit, Natijada:
Q yo'qotish, = sm (t-q) - c 1 m 1 (q-t 1). (6)
Agar o'ziga xos issiqlik sig'imi noma'lum bo'lgan, bir xil haroratgacha qizdirilgan jism kaloriyametrga tushirilsa, issiqlik balansi tenglamasi quyidagi ko'rinishga ega bo'ladi:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q yo'qotishlar,(7)
qayerda m¢ 1- kalorimetrdagi suvning massasi, va t¢ 1- bu tajribada suv harorati. Keyin:
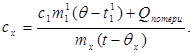 (8)
(8)
(6) qiymatini (8) ga almashtirsak, biz quyidagilarni olamiz:
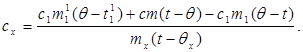 (9)
(9)
issiqlikning elementar miqdori qayerda; - haroratning elementar o'zgarishi.
Issiqlik sig'imi son jihatidan tizimning haroratini ma'lum sharoitlarda 1 darajaga oshirish uchun unga berilishi kerak bo'lgan issiqlik miqdoriga teng. SIda issiqlik birligi joul, harorat esa K daraja bo'lgani uchun issiqlik sig'im birligi J/K dir.
Termodinamikada issiqlik beriladigan tananing miqdoriy birligiga qarab, massa, hajm va molyar issiqlik sig'imlari farqlanadi.
Massa issiqlik sig'imi- ishchi suyuqlikning massa birligi uchun issiqlik sig'imi,
bu yerda va - normal jismoniy sharoitda tananing hajmi va zichligi.
Volumetrik issiqlik sig'imi J / (m3 K) da o'lchanadi.
Molar issiqlik sig'imi- issiqlik sig'imi, moldagi ishchi suyuqlik (gaz) miqdori;
| , |
bu yerda m3/mol gazning normal sharoitdagi molyar hajmi.
Issiqlik sig'imi doimiy emas, balki harorat va boshqa termal parametrlarga bog'liqligini hisobga olib, haqiqiy va o'rtacha issiqlik sig'imi o'rtasida farqlanadi. Odatda, haqiqiy issiqlik sig'imi deganda, har qanday jarayonda termodinamik tizimga xabar berilgan issiqlikning elementar miqdorining ushbu tizim haroratining berilgan issiqlik tufayli yuzaga keladigan cheksiz kichik o'sishiga nisbati tushuniladi. Biz termodinamik tizimning haqiqiy issiqlik sig'imini , va - rost ga teng tizim haroratida ko'rib chiqamiz o'ziga xos issiqlik sig'imi ga teng haroratda ishlaydigan suyuqlik. Keyin ishchi suyuqlikning harorati dan ga o'zgarganda uning o'rtacha solishtirma issiqlik sig'imi sifatida aniqlash mumkin
Tananing ichki energiyasini aniqlash.
Ichki energiya tanasi (deb yuritiladi E yoki U) molekulaning molekulyar oʻzaro taʼsirlari va issiqlik harakati energiyalarining yigʻindisidir. Xususan, ideal gazning ichki energiyasi uzluksiz va tasodifiy issiqlik harakatidagi barcha gaz zarralarining kinetik energiyalari yig'indisiga teng. Bundan ko'plab tajribalar bilan tasdiqlangan Joul qonuni kelib chiqadi.
Molekulyar kinetik nazariya molekulalari faqat tarjima harakatini bajaradigan bir mol ideal monoatomik gazning (geliy, neon va boshqalar) ichki energiyasini quyidagi ifodalashga olib keladi:
Shunday qilib, ichki energiya U tananing holatini tavsiflovchi makroskopik parametrlar bilan noyob tarzda aniqlanadi. Bu berilgan davlat qanday amalga oshirilganiga bog'liq emas. Ichki energiya davlat funktsiyasidir, deyish odatiy holdir.
TDda uning mutlaq qiymati emas, balki ichki energiyaning o'zgarishi qo'llaniladi.
Kengaytirish ishi nima. TD ning birinchi qonuni.
Kengayish ishi - avtomobilning kengayish jarayonida tashqi bosim kuchlariga qarshi bajariladigan mexanik ish. Hajmi o'zgarganda, gaz ishlaydi, V dagi o'zgarish belgisi ish belgisi bilan mos keladi
TD ning birinchi qonuni: tizimga berilgan issiqlik ichki energiyani aylantirish va ishni bajarish uchun ishlatiladi.
Issiqlik shaklida energiya olish (yoki berish) qobiliyati nuqtai nazaridan, termodinamik tizimni issiqlik sig'imi bilan tavsiflash odatiy holdir.
Jismning (tizimning) issiqlik sig'imi - bu uning haroratini bir Kelvinga o'zgartirish uchun tanaga (tizimga) berilishi kerak bo'lgan issiqlik miqdoriga son jihatdan teng bo'lgan jismoniy miqdor.
Agar tanaga cheksiz miqdorda issiqlik berilsa Q, bu haroratning cheksiz o'sishiga olib keldi dT, keyin uning issiqlik sig'imi FROM ta'rifiga ko'ra ga teng
SI issiqlik sig'imi birligi joulning kelvinga bo'linishidir ( J/Kimga).
Tajribalar va nazariy hisob-kitoblar shuni ko‘rsatadi jismning issiqlik sig'imi uning kimyoviy tarkibi, massasi va termodinamik holatiga bog'liq(masalan, harorat bo'yicha), shuningdek, unga issiqlik berilganda tananing holatini o'zgartirish jarayonining turi haqida.
Maxsus issiqlik sig'imi - bu moddaning birlik massasiga to'g'ri keladigan issiqlik sig'imi, ya'ni bir hil modda uchun
![]() , (25.2)
, (25.2)
qayerda Bilan- solishtirma issiqlik sig'imi; M moddaning massasi.
Maxsus issiqlikning SI birligi joulning kelvin-kilogrammga bo'linishidir [( J/(Kimga . kg)].
Molyar issiqlik sig'imi - bir mol moddaning issiqlik sig'imi, ya'ni
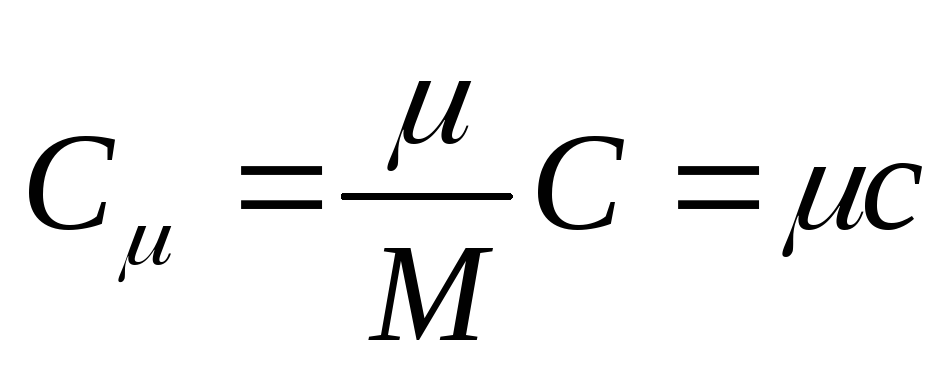 , (25.3)
, (25.3)
qayerda FROM -molyar issiqlik sig'imi; moddaning molyar massasi.
SIda molyar issiqlik sig'imi birligi joulning kelvin-molga bo'linishidir. J/(Kimga . mol)].
Issiqlikning elementar miqdori Q, tana haroratini o'zgartirish uchun kerak dT, sifatida belgilanadi
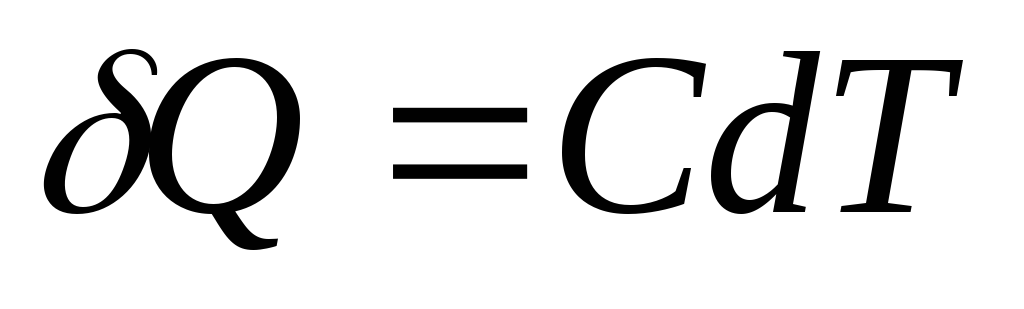 ,
,
va bir hil tana uchun
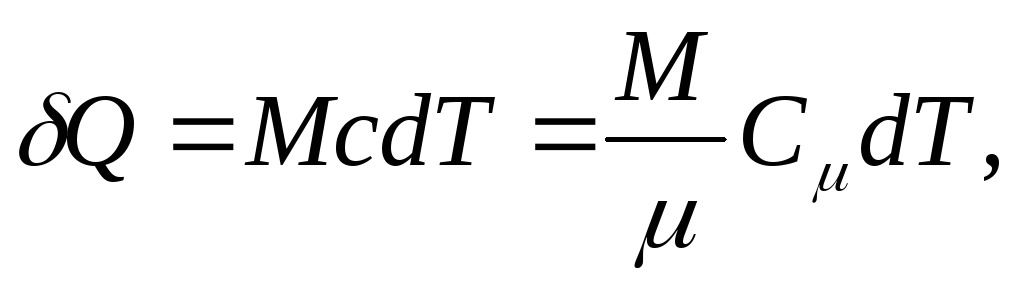 (25.4)
(25.4)
qayerda M/ - moddaning miqdori (mollar soni).
§26. Termodinamikaning birinchi qonuni
Termodinamikaning birinchi qonuni (birinchi qonuni) termodinamik tizimlarga nisbatan qoʻllaniladigan energiyaning saqlanish va oʻzgarish qonunining matematik ifodasidir. U fizika va kimyo sohasidagi eksperimental va nazariy tadqiqotlar natijasida tashkil etilgan bo'lib, uning yakuniy bosqichi issiqlik va ishning ekvivalentligini aniqlash, ya'ni issiqlikning ish va ishga aylanishini aniqlash edi. issiqlik har doim bir xil qat'iy doimiy miqdoriy nisbatda amalga oshiriladi.
24-§da tizimning ichki energiyasini ikki yo'l bilan o'zgartirish mumkinligi ta'kidlangan: ish bajarish va issiqlik uzatish. Shunday qilib, biz yozishimiz mumkin:
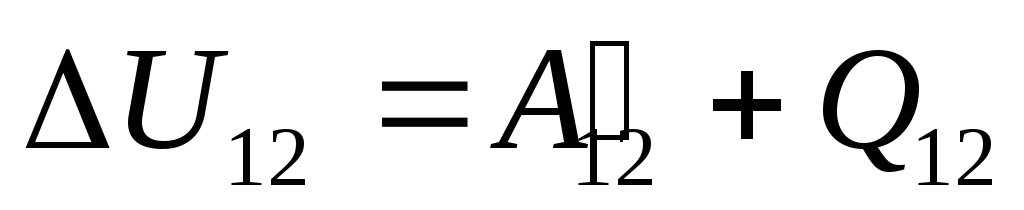 ,
(26.1)
,
(26.1)
qayerda
U 12
-
tizimning holatdan o'tish paytida uning ichki energiyasining o'zgarishi 1
holatga 2
ustidagi ishlar natijasida 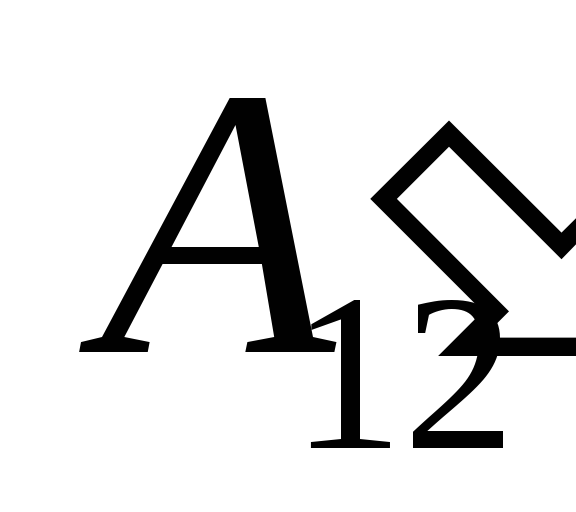 tashqi jismlardan va unga ma'lum miqdorda issiqlikni tashqaridan o'tkazish
tashqi jismlardan va unga ma'lum miqdorda issiqlikni tashqaridan o'tkazish  .
.
Biz bu ishni bilamiz 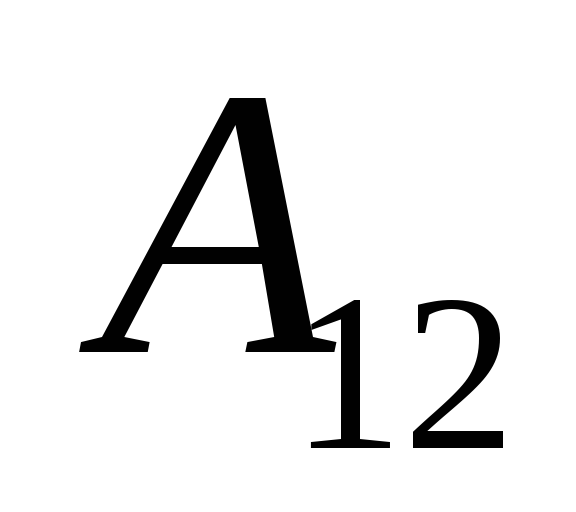 tizimning o'zi tomonidan tashqi jismlarda bajariladigan ish soni jihatidan teng va ish belgisiga qarama-qarshidir
tizimning o'zi tomonidan tashqi jismlarda bajariladigan ish soni jihatidan teng va ish belgisiga qarama-qarshidir  tizim ustidagi tashqi jismlar, ya'ni
tizim ustidagi tashqi jismlar, ya'ni
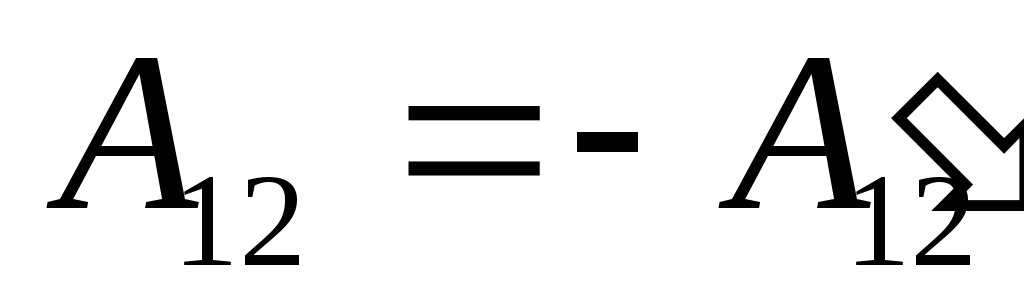 ,
(26.2)
,
(26.2)
shuning uchun (26.1) ifodani shunday yozish mumkin
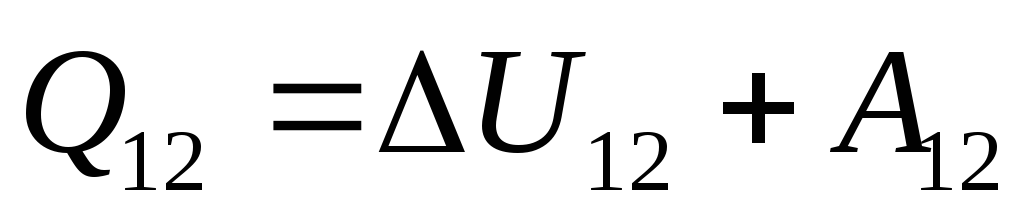 . (26.3)
. (26.3)
Ushbu tenglama termodinamikaning birinchi qonunining matematik yozuvidir: tizimga etkazilgan issiqlik miqdori uning ichki energiyasini o'zgartirishga va tizim tomonidan tashqi jismlar ustida ishlashga sarflanadi.
Tizim holatining cheksiz kichik o'zgarishi bilan (26.3) tenglama shaklni oladi
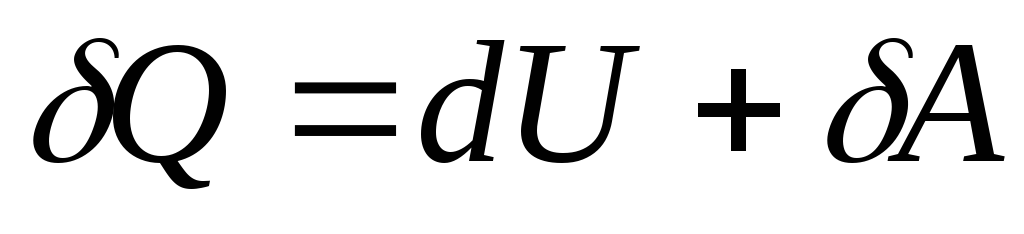 , (26.4)
, (26.4)
qayerda  - tizimga elementar issiqlik miqdori berilganda uning ichki energiyasining cheksiz kichik o'zgarishi
Q va tizim tomonidan elementar ishlarni bajarish
LEKIN tashqi jismlar ustida.
- tizimga elementar issiqlik miqdori berilganda uning ichki energiyasining cheksiz kichik o'zgarishi
Q va tizim tomonidan elementar ishlarni bajarish
LEKIN tashqi jismlar ustida.
