Метод визначення теплоємності твердого тіла
Що таке ТЕПЛОЄМНІСТЬ
При надходженні теплоти температура системи підвищується. У разі нескінченно малої зміни температури справедлива пропорційність
dT=δQ , або dT=constδQ
Це співвідношення зручніше написати у вигляді: Q=СdT або
Величина З називається справжньою теплоємністю системи.
Теплоємність - це відношення кількість теплоти, підведена до системи, до зміни температури, яка при цьому відбувається.
Крім істинної, розрізняють ще й середню теплоємність:
Теплоємність
Якщо теплоємність віднести до одиниці маси (молю) речовини, то вона стає незалежною від маси всієї системи і набуває властивостей інтенсивного параметра. Якщо теплоємність відноситься до одиниці маси речовини, вона називається питомою, а до 1 моль- мольною теплоємністю з розмірністю Дж/(моль*к)
Ми розглядатимемо лише мольні теплоємності, т.к. їм всі закономірності значно простіше, ніж питомої теплоємності.
Теплоємність залежить від умов, у яких здійснюється перехід теплоти до системи. Якщо система поміщена в постійний об'єм, то підвищення температури на dT відбудеться під дією теплоти, що дорівнює CvdT , де Cv - теплоємність при постійному обсязі. У разі сталості тиску при розширенні системи підвищення температури на dT потрібно теплоти CpdT, де Cp - теплоємність при постійному тиску.
З урахуванням умов переходу теплоти, коли одна або кілька змінних підтримуються постійними, інші зміняться, теплоємність можна висловити за допомогою приватних похідних: ![]() . Так як δQ v = dU,
. Так як δQ v = dU,
δQ p =dH, можна записати:
![]() (1)
(1)
Cv – ізохорна теплоємність газів, Cp – ізобарна теплоємність газів.
Відмінності між ізохорною та ізобарною теплоємностями обумовлені відмінністю внутрішньої енергії та ентальпії. Зміни ентальпії та внутрішньої енергії відрізняються на величину роботи, яка здійснюється системою.
δW=∆nRT, ∆H-∆U=∆nRT
Тому теплоємності при постійному обсязі Cv та постійному тиску Cp також відрізняються на величину роботи: Cp - Cv = δW
На підставі виразів (1) можна записати:
Підставивши ці рівності до рівняння ∆H- ∆U=∆nRT
та враховуючи, що ∆n= 1, знайдемо зв'язок мольних теплоємностей газів:
Cp - Cv = R або Cp = Cv + R
Як видно, вони різняться на величину газової постійної.
З умови Cp = Cv + R слід, що Cp˃Cv, тобто в ізобарному процесі, коли P = const, для підвищення температури системи потрібно більша кількістьтеплоти, ніж у ізохорному процесі.
Мольна теплоємність газів має значення порядку R, тому різниця між Cpі Cv дуже істотна. Так, для діоксиду вуглецю 2 при 25 0 С Ср = 37, 14; а Сv = 28,83 Дж/(моль * К)
Різниця Ср - Сvявляє собою роботу ізобарного розширення одного моля ідеального газупри збільшенні температура на один градус. Рідини та твердості тіла характеризуються незначним збільшенням об'єму при нагріванні. Тому для конденсованих тіл можна вважати, що Ср ≈ Сv.
РІВНЯННЯ КІРХГОФУ. ЗАЛЕЖНІСТЬ ТЕПЛОВИХ ЕФЕКТІВ ВІД ТЕМПЕРАТУРИ.
Розглянуті раніше розрахунки теплових ефектів на основі закону Гесса щодо теплоти освіти та згоряння обмежені стандартними умовами. Для практичних цілей необхідно розрахувати теплові ефекти для конкретних умов, відмінних від стандартних.
Перейти від відомих теплових ефектів за стандартних умов, тобто. при температурі 25 0 С(298,15К) та тиску 1 атм. (1,013*10 5 Па), до розрахунку теплових ефектів при будь-якій температурі, що нас цікавить, можна, використовуючи закон Кірхгофа. Процеси в промислових умовах характеризуються значним варіюванням температури, діапазон якої визначається не тільки умовами технологи, а й сезоном.
Розглянемо закон Кірхгофа у диференційній формі. Для цього запишемо зміни ентальпії в ізобарній та внутрішній енергії в ізохорному процесах.
∆H = H 2 -H 1; ∆U = U 2 -U 1 .
Продиференціюємо ці рівняння за температурою та отримаємо:
Рівняння Кірхгофа:

І - температурні коефіцієнти теплового ефекту ізобарного та ізохорного процесів відповідно; і - зміна теплоємності системи в результаті ізобарного та ізохорного процесів відповідно.
На підставу рівняння Кірхгофа формулюється закон Кірхгофа в диференційній формі: температурний коефіцієнт теплового ефекту процесу дорівнює зміні теплоємності системи, що відбувається в результаті цього процесу.
Таким чином, закон Кірхгофа у диференціальній формі дозволяє визначити лише зміну теплового ефекту зі зміною температури, а не величину самого теплового ефекту.
Проаналізуємо рівняння Кірхгоф
Для реакції: aA + bB = dD+ rR при ізобарному процесі (р=const) за законом Кірхгофа зміна теплоємності в системі матиме вигляд:
Аналогічний вираз можна отримати для ізохорного процесу:
Оскільки закон Кірхгофа дозволяє визначити зміни теплового ефекту процесу зі зміною температури, будуємо графік:
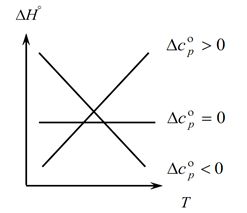
1. Розглянемо перший випадок, коли ∆Ср(∆Сv)˃0, т.к. ∆Ср=∑С кін. -∑С поч., звідси випливає, що сума теплоємностей продуктів реакцій більше суми теплоємностей вихідних речовин: ∑С кін. ˃∑З поч. В цьому випадку отримуємо криву 1 на графіці, яка означає, що при збільшенні температури зміна теплового ефекту процесу також збільшується (Т і H);
2. Другий випадок, коли ∆Ср(∆Сv)˂0. Аналогічно першому закону маємо ∑С кін. ˂∑З поч. (Сума теплоємностей кінцевих продуктів менше суми теплоємностей початкових речовин). Тоді на графіку отримуємо криву, яка означає, що при збільшенні температури зміна теплового ефекту процесу зменшується (Т→∆H↓)
3. І третій випадок, коли зміна теплоємностей системи дорівнює нулю ∆Ср(∆Сv)=0. Тоді сума теплоємностей кінцевих продуктів реакцій дорівнює сумі теплоємностей вихідних речовин ∑С кін. = З поч. У цьому випадку тепловий ефект реакції не є функцією від температури (H ≠ f(T)) і на графіці отримуємо пряму.
РОЗРАХУНОК ТЕПЛОВИХ ЕФЕКТІВ ПРИ ЗАВДАННІЙ
ТЕМПЕРАТУРІ. ІНТЕГРУВАННЯ РІВНЯННЯ КІРХГОФУ
Щоб знайти значення теплового ефекту в залежності від температури, необхідно проінтегрувати рівняння

Від Т до Т 0 (де Т - необхідна температура, Т 0 - стандартна температура), від ∆H до ∆H 0 або від ∆U до ∆U 0 (де ∆H і ∆U - ентальпія та внутрішня енергія в умовах, що відрізняються від стандартних). Інтегрування проводиться для двох випадків:
Для не органічних речовин: Для органічних речовин:
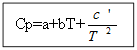
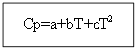
Приклад: для H 2 (г) - неорганічна речовина
| Ср = f (T) | Т | |||
| a | b*10 3 | c'*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Ср (Н 2 (г)) = 27,28 +3,26 * 10 -3 Т +.
а) Наближене інтегрування:
для ізобарного процесу
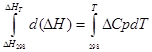
∆H T - ∆H 298 =∆Cp*(T-298)
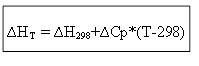
для ізохорного процесу:
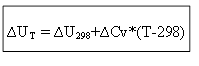
Таким чином, для визначення теплового ефекту ∆H або внутрішньої енергії ∆U за будь-якої температури Т необхідно знати теплоту процесу в стандартних умовах ∆H 0 (∆U 0) та зміну теплоємностей ∆Ср, ∆Cv.
приклад. Розрахуємо тепловий ефект ∆H процесу одержання бензолу з ацетилену:
3С 2 Н 2 (г)→С 6 Н 6 (г) при 75 0 С(348К).
1. Знаходимо по таблицях середнє мольне ізобарні теплоємності бензолу та ацетилену:
Ср С6Н6(г) = 81,67Дж/(моль*К);
Ср С2Н2(г) = 43,93Дж/(моль*К).
2.Знаходимо зміну теплоємності процесу:
∆Ср=∑(nСр) кін - ∑(nСр) поч = Ср С6Н6(г) - 3* Ср С2Н2(г) = 81,67 - 3*43,93 = - 50,12 Дж/(моль*К) .
3. За табличними даними знаходимо тепловий ефект у стандартних умовах:
∆H 0 = ∆H 0 обр С6Н6(г) - ∆H 0 обр С2Н2(г) = 82,93 – 3*226,73 = - 597,26 кДж/моль
4. Знаходимо тепловий ефект при заданій температурі:
∆H = ∆H 0 +∆Ср(Т-Т 0)= - 597,26*10 3 +(-50,12)*(348- 298) = -599766 Дж/моль
б) Точне інтегрування:
Розглянемо другий, складніший випадок, коли зміна теплоємності залежить від температури, тобто. Ср = f (T), Cv = f (T).
Звернемося до рівняння реакції у загальному вигляді
dD + rR = qQ + pP
| a | b*10 3 | c'*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) -;
∆b = q * b (Q) + p * b (P) -;
∆c'= q*c'(Q) + p*c'(P) - ;
![]()
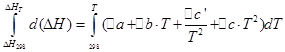
Ті самі операції проведемо для ізохорного процесу:
ТЕПЛОТА РОЗЧИНУ
Зміна ентальпії при переході твердої, рідкої або газоподібної речовини в розчин називають тепловою або ентальпією розчинення.
Теплота розчинення в загальному випадку включає теплоти руйнування кристалічної решітки (для твердих речовин), іонізація та сольватація.
Для розриву зв'язок між іонами кристалічної солі необхідна енергія, тобто. при цьому тепло поглинається. У той самий час водному розчині відбувається гідратація іонів, тобто. утворюється зв'язок між іонами та молекулами Н2О. Знак теплоти розчинення визначається тим процесом, який енергетично сильніше виражений.
LiBr: ∆H рост = - 49,02 кДж/моль – теплота виділяється
КСl: ∆H зрост = 7,23 кДж/моль – теплота поглинається
Розрізняють: інтегральну теплоту розчинення - це теплота, яка виділяється або поглинається при розчиненні 1 моля даної речовини з утворенням розчину даної концентрації. Інтегральна теплота розчинення змінюється в залежності від кількості речовини, що розчиняється.
Розрізняють: диференціальну теплоту розчинення - це та теплота, яка супроводжує розчинення 1 молячи даної речовини в нескінченно великому обсязірозчину цієї речовини. Інтегральні теплоти широко використовують у розрахунках теплот освіти і інших реакцій згідно із законом Гесса. Диференціальні теплоти розчинення характеризують термодинамічні властивості розчинів та процес їх утворення.
ЛАБОРАТОРНА РОБОТА № 8
ВИЗНАЧЕННЯ ТЕПЛОЄМКОСТІ ТВЕРДИХ ТІЛ
Прилади та приладдя:експериментальне встановлення ФПТ1-8.
Мета роботи:визначення теплоємності зразків металів калориметричним методом із використанням електричного нагріву.
Коротка теорія
Питома теплоємність речовини - величина, що дорівнює кількості теплоти, необхідної для нагрівання 1 кг речовини на 1 К:
Молярна теплоємність − величина, що дорівнює кількості теплоти, необхідної для нагрівання 1 моль речовини на 1 К:
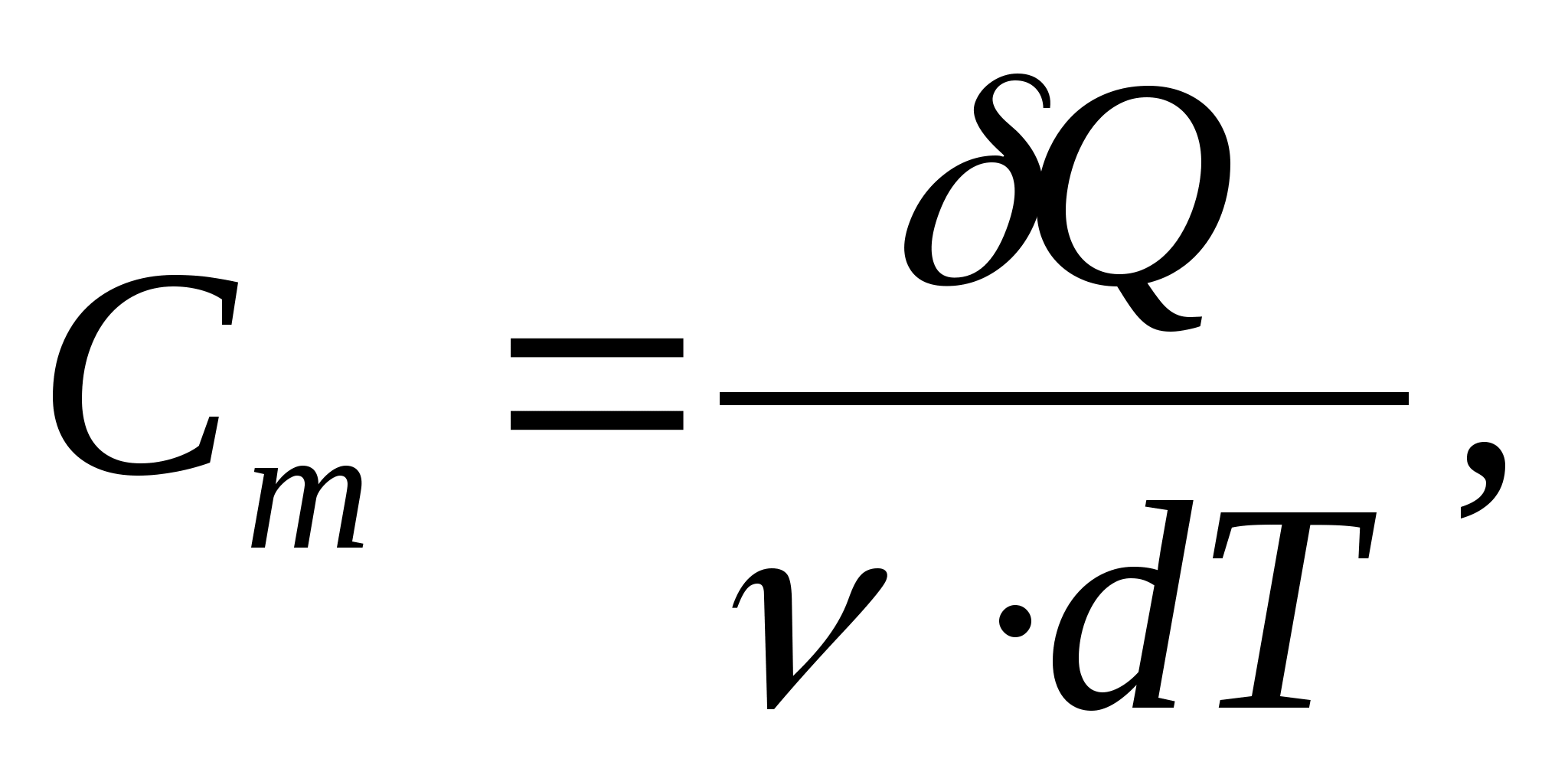
де 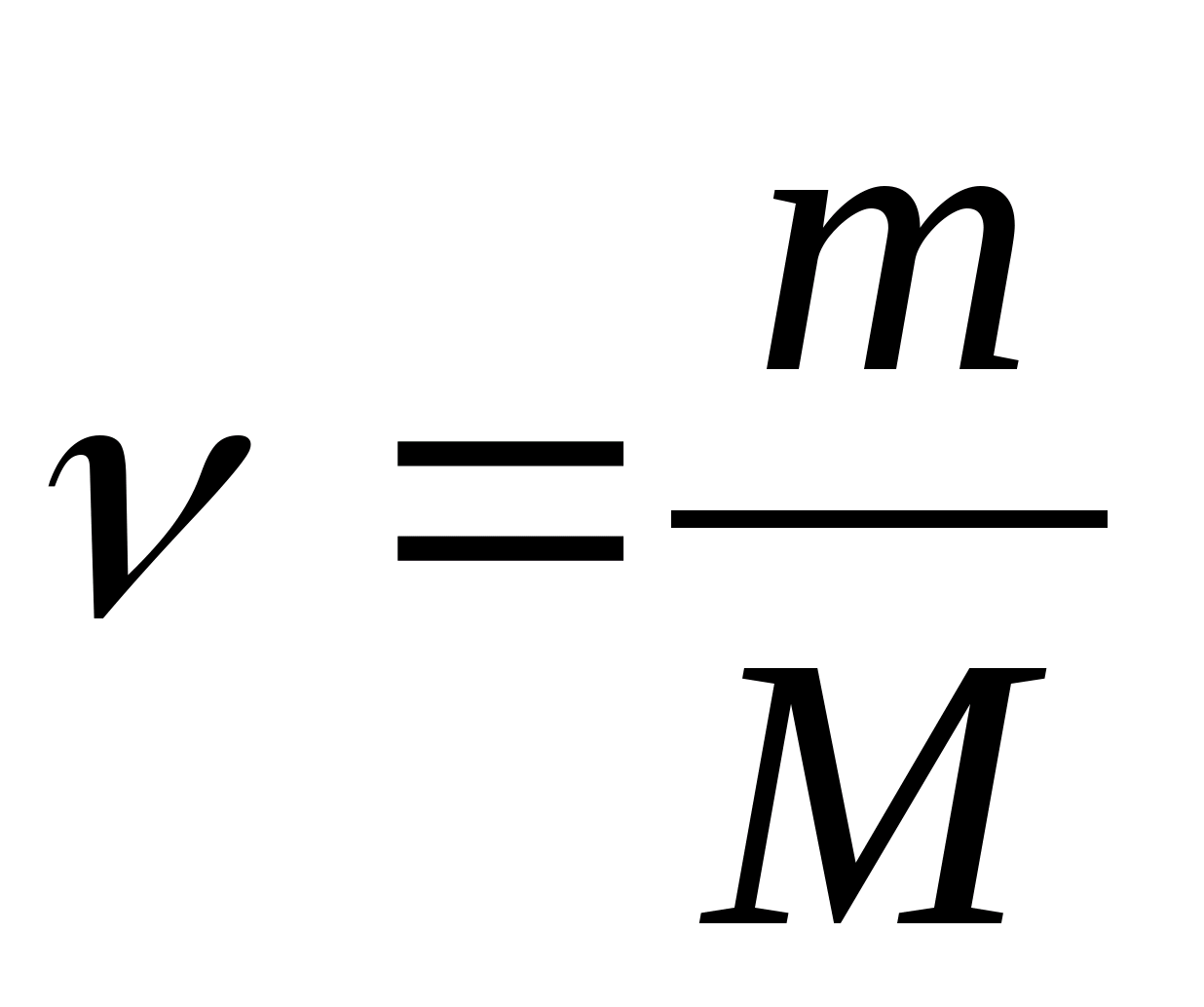 − кількість речовини.
− кількість речовини.
Питома теплоємність cпов'язана з молярною C mспіввідношенням

де M- Молярна маса речовини.
Розрізняють теплоємності при постійному обсязіі постійному тискуякщо в процесі нагрівання речовини його об'єм або тиск підтримується постійним.
Найменша кількість незалежних змінних (координат), що повністю визначають положення системи в просторі, називається числом ступенів свободи .
Відповідно до закону Больцмана про рівномірний розподіл енергії за ступенями свободи молекул на кожну поступальну та обертальну міру свободи припадає в середньому кінетична енергія, рівна
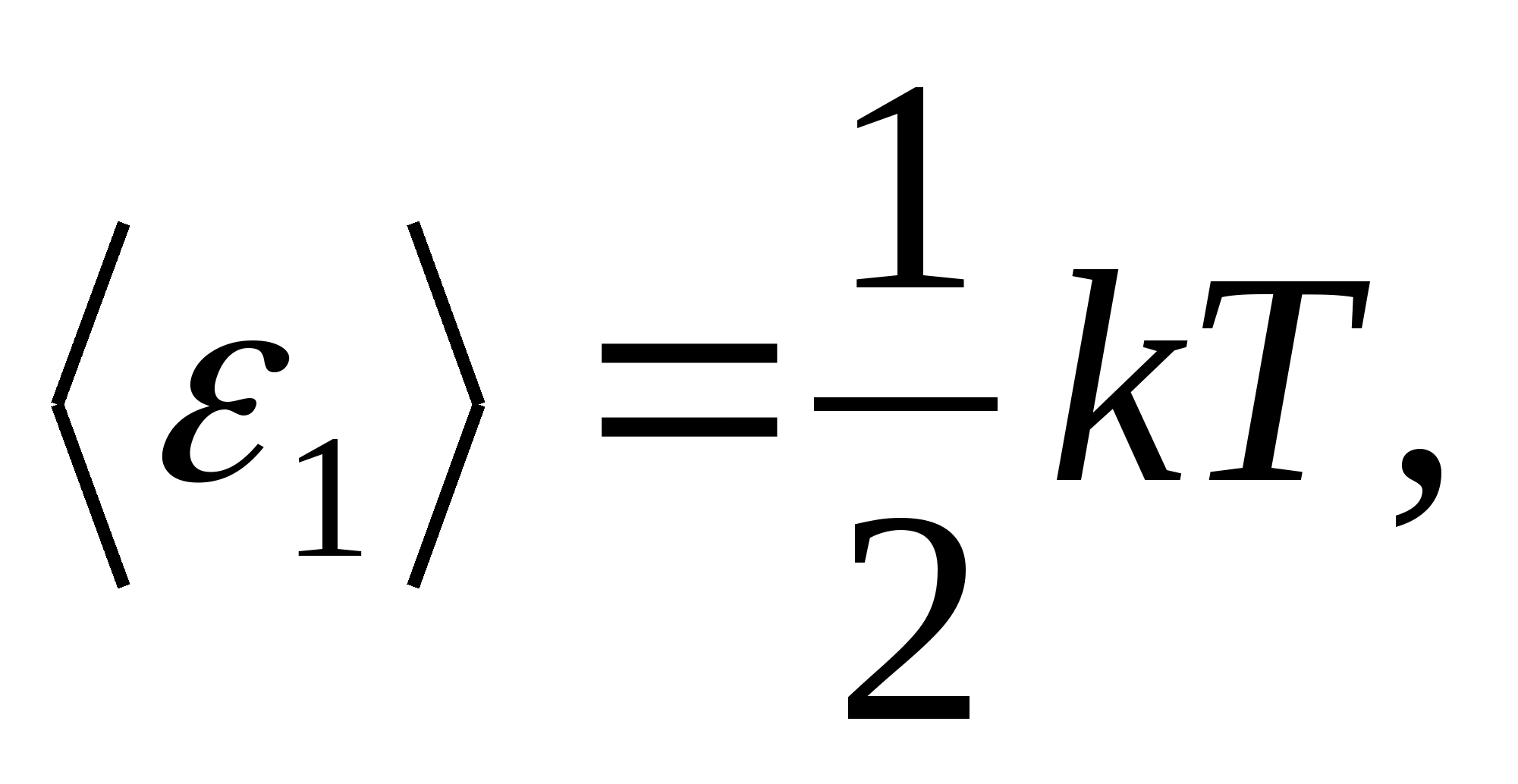
(де k− постійна Больцмана), а на кожний коливальний ступінь свободи – в середньому енергія, рівна
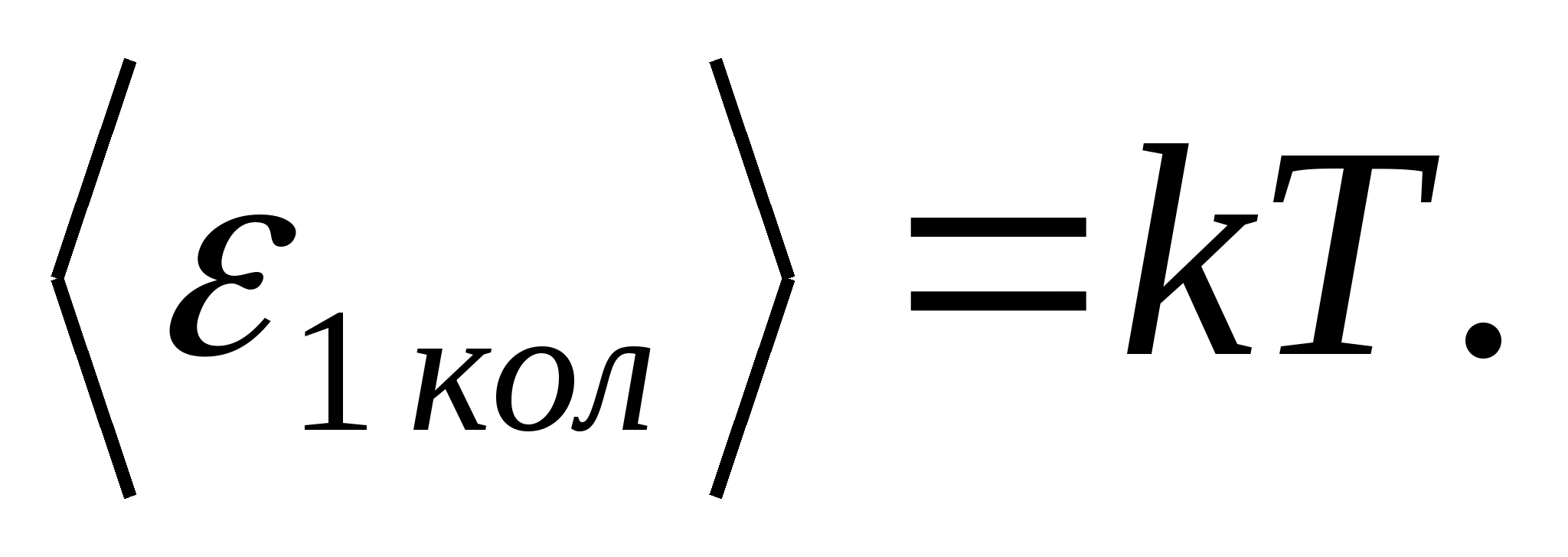
Таким чином, середня енергія молекули
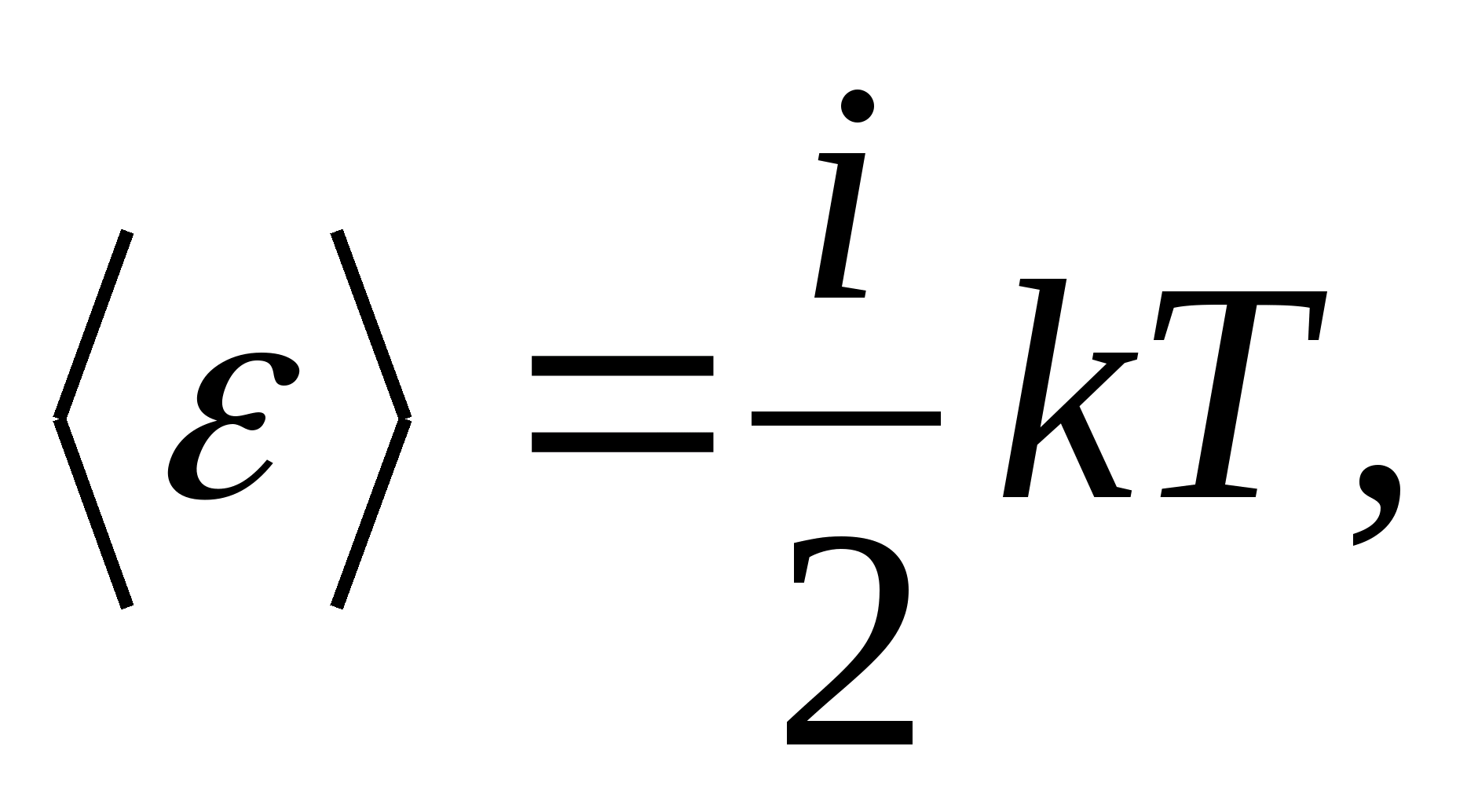
де i– сума числа поступальних, числа обертальних та подвоєного числа коливальних ступенів свободи молекули:
![]()
Наприклад, середня кінетична енергія одноатомних молекул ідеального газу ( 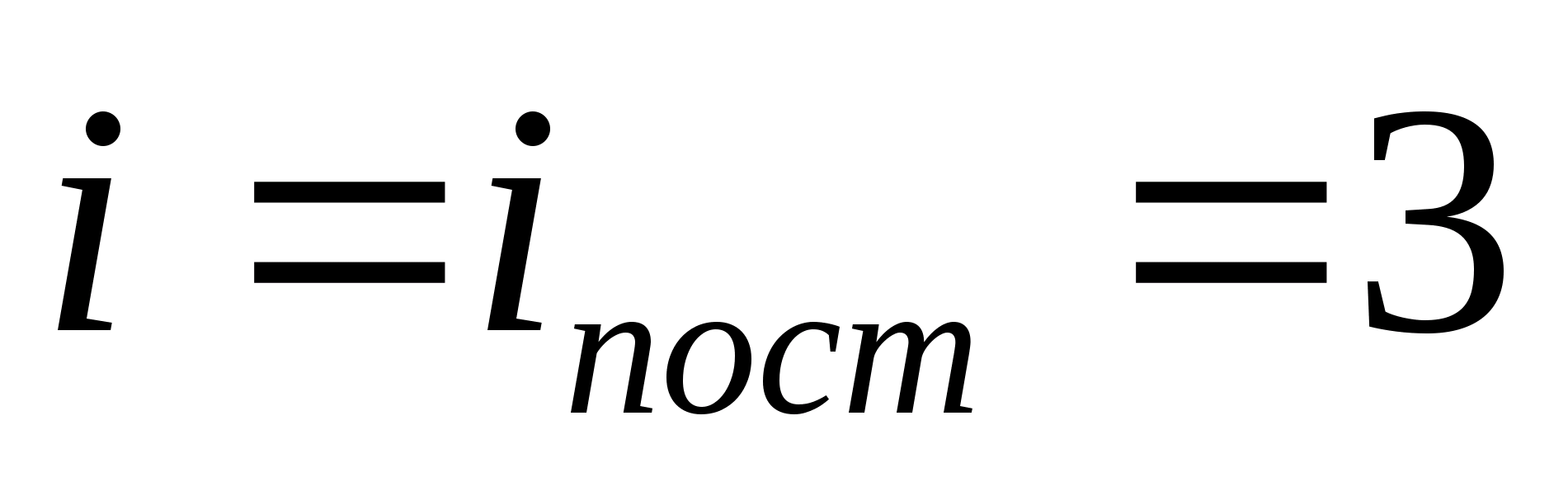 ) дорівнює
) дорівнює
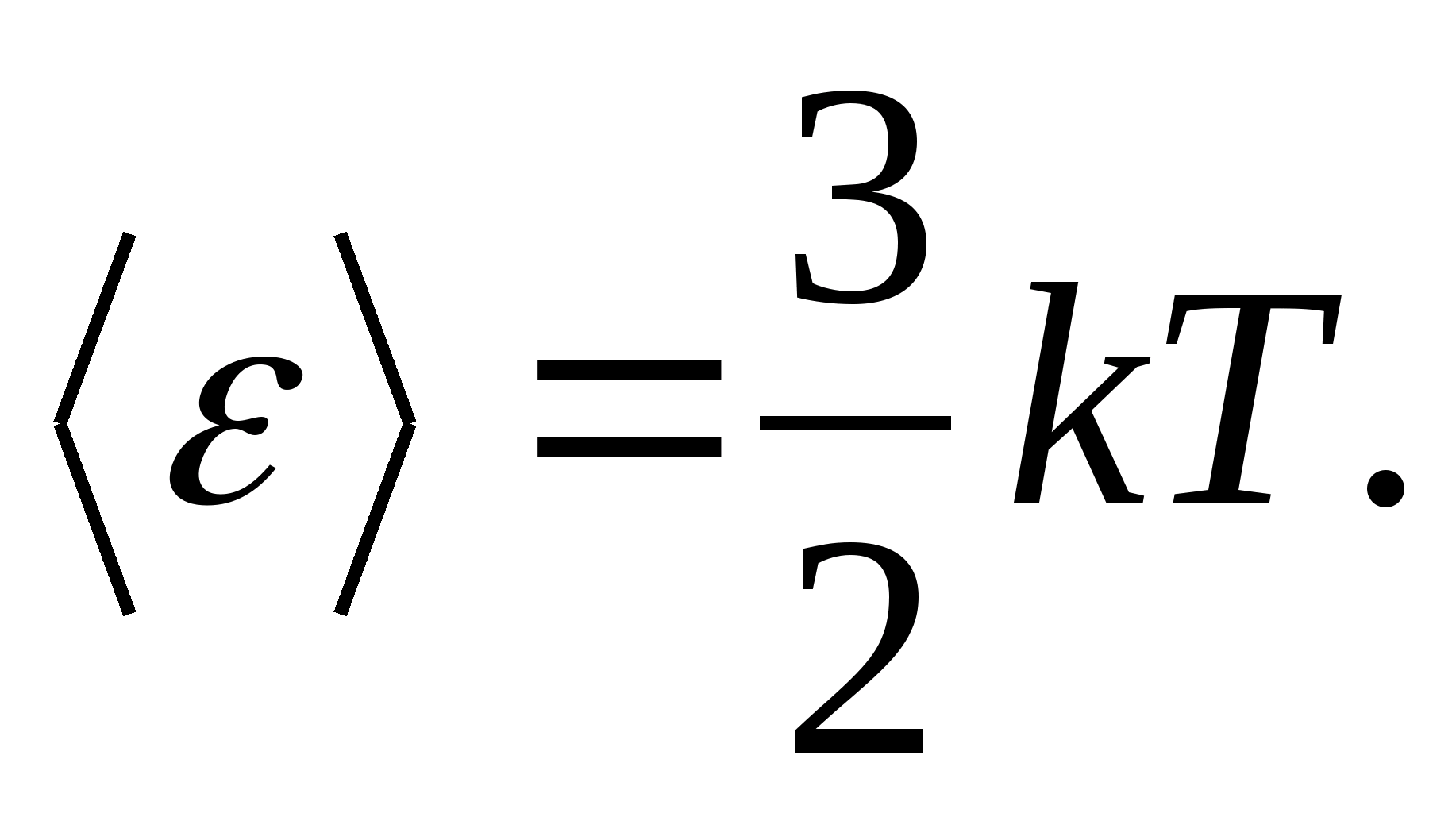
В якості моделітвердого тіла розглянемо правильно побудовану кристалічну решітку, у вузлах якої частинки (атоми, іони, молекули) приймаються за матеріальні точки, коливаються біля своїх положень рівноваги – вузлів решітки –у трьох взаємно перпендикулярних напрямках. Таким чином, кожній складовій кристалічні грати частинці приписується три коливальні ступені свободи, кожен з яких, згідно із законом про рівномірний розподіл енергії за ступенями свободи, має енергію. kT.
Тоді середнє значення повної енергії частки при коливальному русі в кристалічній решітці
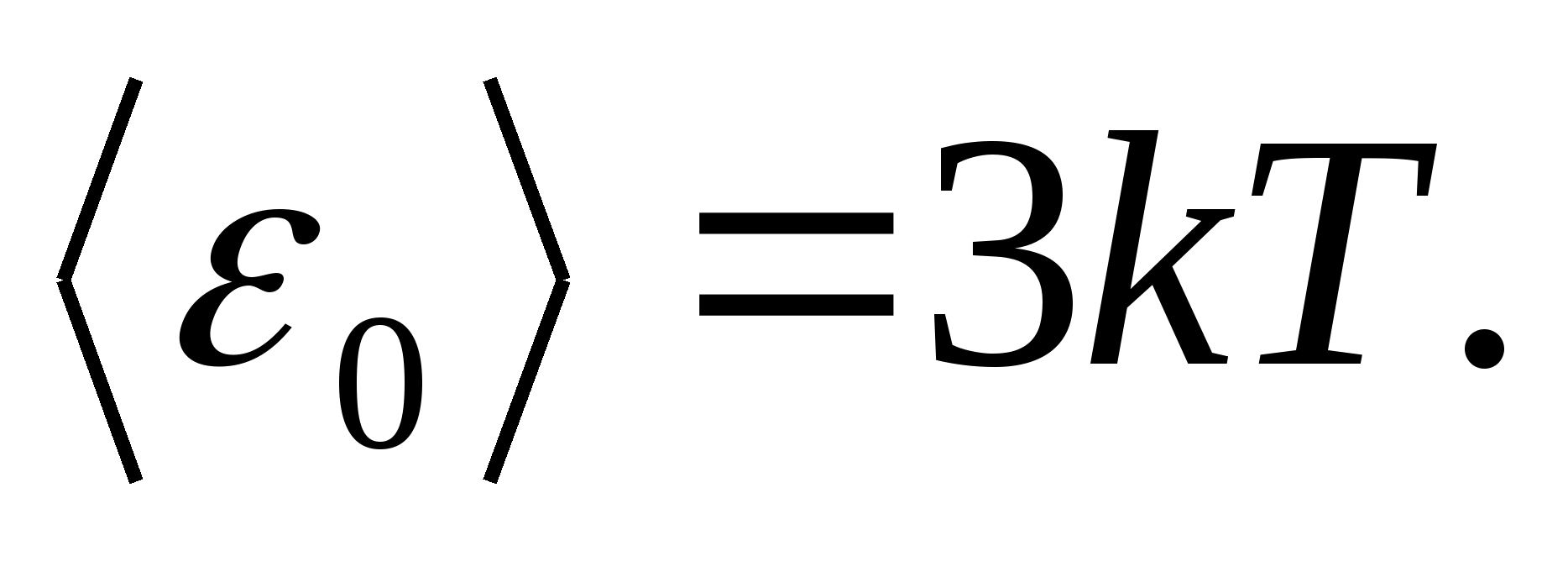
Повну внутрішню енергію одного моля твердого тіла отримаємо помноживши середню енергію однієї частинки на число незалежно коливаються частинок, що містяться в одному молі, тобто. на постійну Авогадро N A :
де R=N A k- Універсальна (молярна) газова постійна, R = 8,31 Дж/(мольК).
Для твердих тіл внаслідок малого коефіцієнта теплового розширення теплоємності при постійному тиску та постійному обсязі практично не відрізняються. Тому, враховуючи (8.1), молярна теплоємність твердого тіла
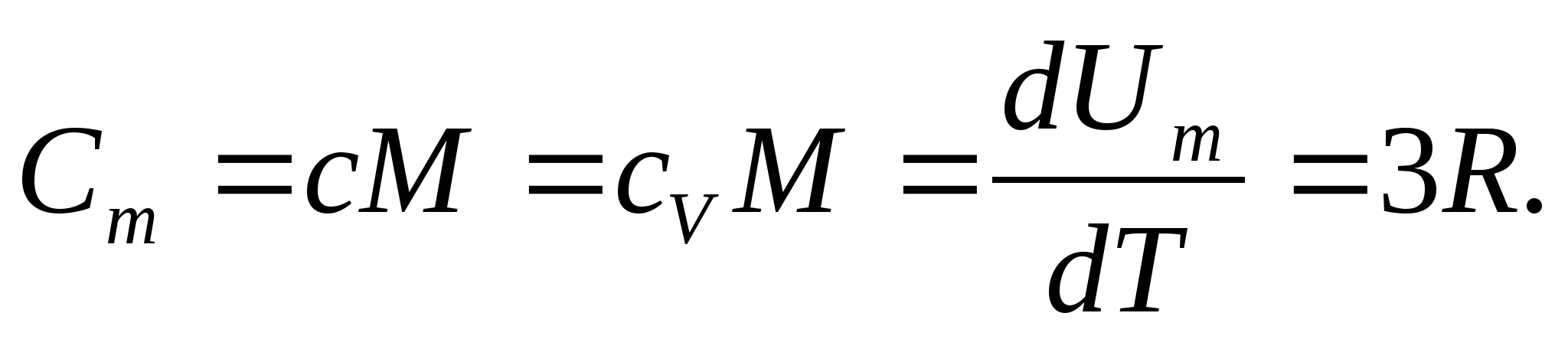 (8.2)
(8.2)
Підставляючи чисельне значення молярної газової постійної, отримаємо:
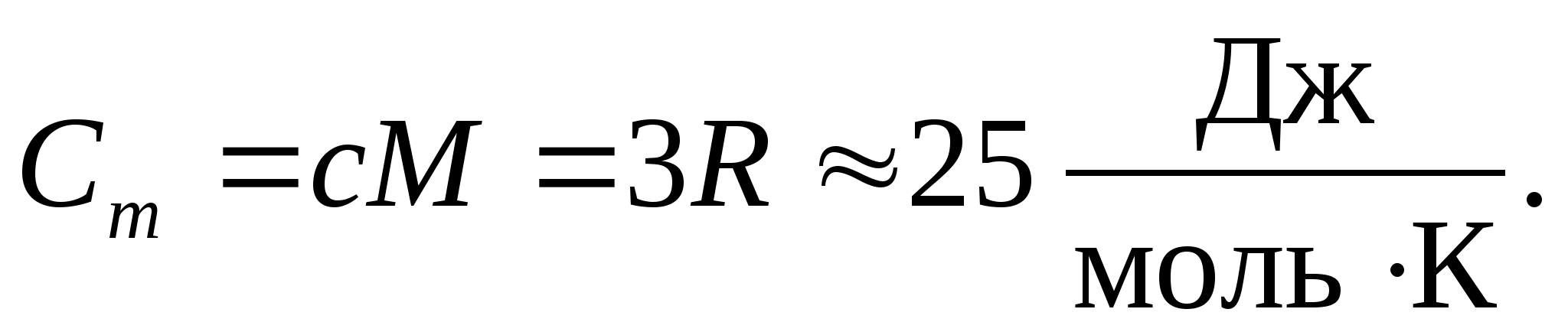
Ця рівність виконується з досить добрим наближенням для багатьох речовин при кімнатній температурі і називається законом Дюлонга та Пті : молярна теплоємність всіх хімічно простих кристалічних твердих тілприблизно дорівнює 25 Дж/(моль К). Зі зниженням температури теплоємності всіх твердих тіл зменшуються, наближаючись до нуля при Т0. Поблизу абсолютного нуля молярна теплоємність всіх тіл пропорційна Т 3 і лише за досить високої, характерної для кожної речовини температурі починає виконуватися рівність (8.2). Ці особливості теплоємностей твердих тіл за низьких температур можна пояснити за допомогою квантової теорії теплоємності, створеної Ейнштейном і Дебаєм.
Для експериментального визначення теплоємності досліджуване тіло міститься в калориметрі, який нагрівається електричним струмом. Якщо температуру калориметра з досліджуваним зразком дуже повільно збільшуватиме від початкової Т 0 на Т, то енергія електричного струму піде на нагрівання зразка та калориметра:
де Iі U− струм та напруга нагрівача; − час нагрівання; m 0 та m− маси калориметра та досліджуваного зразка, з 0 та з− питомі теплоємності калориметра та досліджуваного зразка, Q− втрати тепла в теплоізоляцію калориметра та в навколишній простір.
Для виключення з рівняння (8.3) кількості теплоти, витраченої на нагрівання калориметра, і втрати теплоти в навколишній простір, необхідно за тієї ж потужності нагрівача нагріти порожній калориметр (без зразка) від початкової температури Т 0 на ту саму різницю температур T. Втрати тепла в обох випадках будуть практично однаковими і дуже малими, якщо температура захисного кожуха калориметра в обох випадках постійна і дорівнює кімнатній:
З рівнянь (8.3) та (8.4) випливає
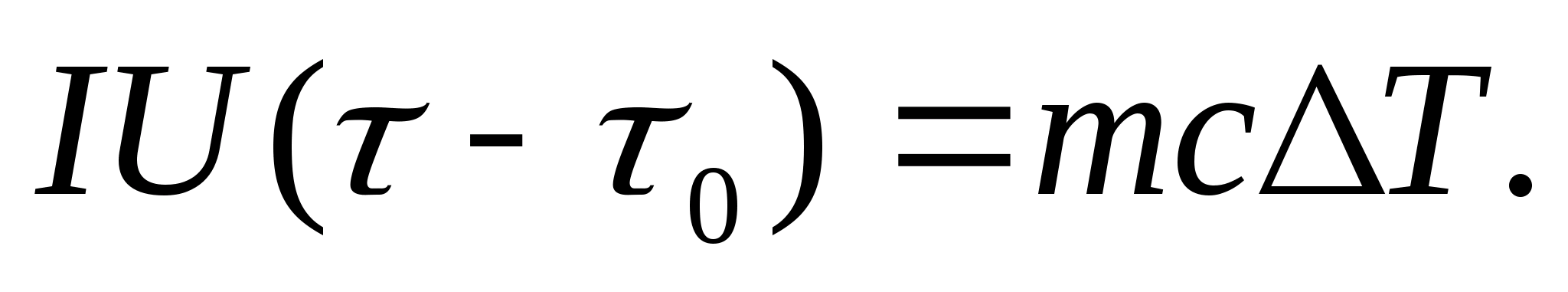 (8.5)
(8.5)
Рівняння (8.5) може бути використане для експериментального визначення питомої теплоємності матеріалу досліджуваного зразка. Змінюючи температуру калориметра, необхідно побудувати графік залежності різниці часу нагріву від зміни температури досліджуваного зразка: (
−
0)=f(T), за кутовим коефіцієнтом якого 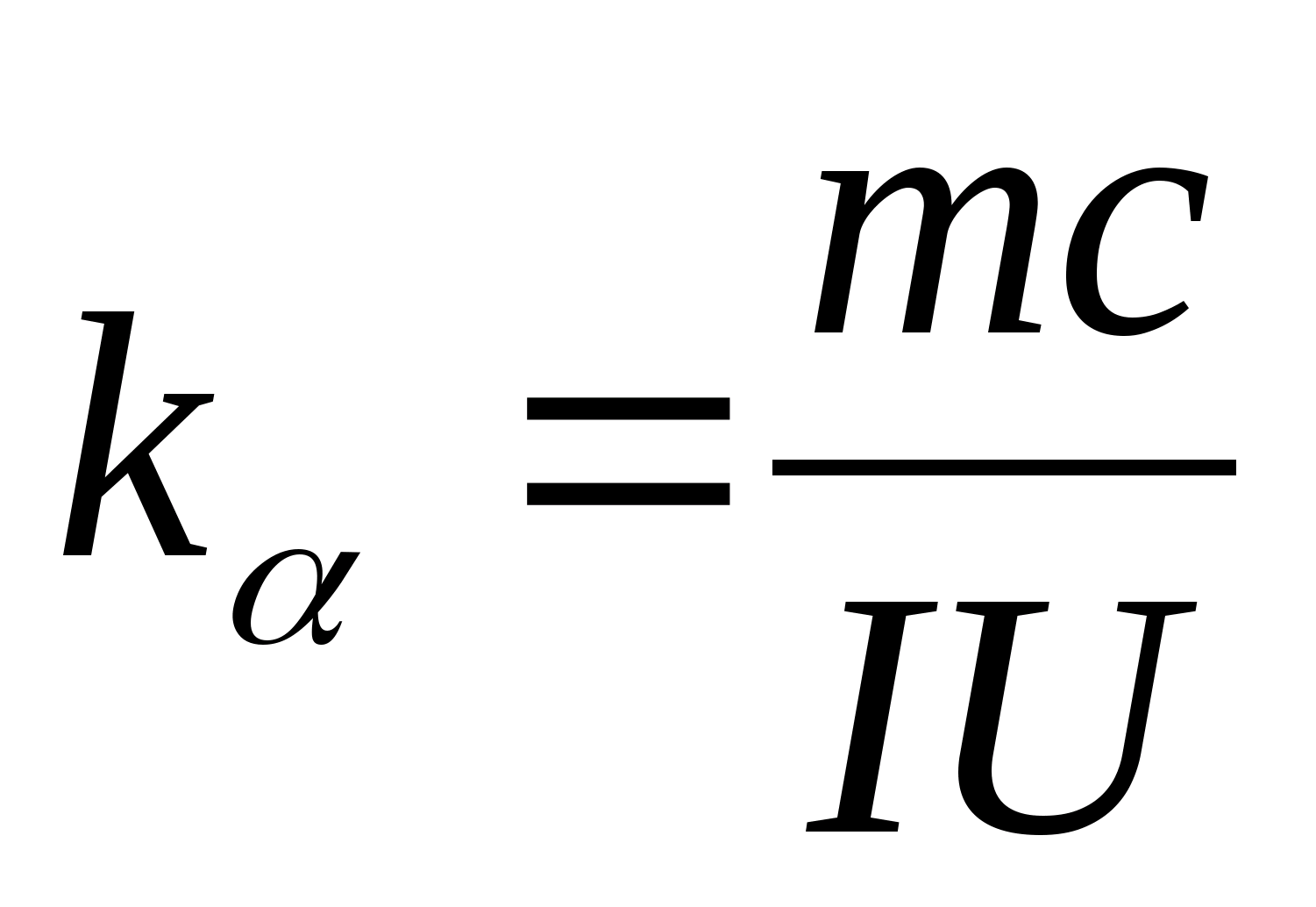 можна визначити питому теплоємність зразка.
можна визначити питому теплоємність зразка.
Опис лабораторної установки
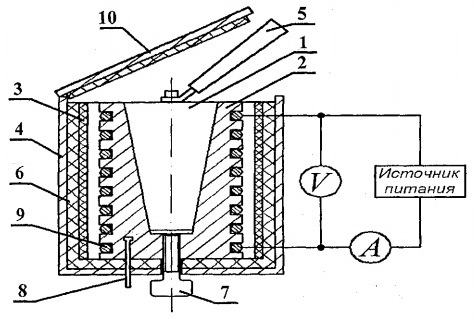
Для визначення теплоємності твердих тіл призначена експериментальна установка ФПТ1-8, загальний вигляд якої показано на рис. 8.1. Установка складається з трьох основних частин: приладового блоку 1, блоку робочого елемента 2 і стійки 3.
На передній панелі приладового блоку 1 розташовані: тумблер «МЕРЕЖА», який здійснює підключення установки до мережі напруги живлення; тумблер «НАГРІВ», який включає нагрівач; регулятор «НАГРІВ», за допомогою якого регулюється потужність нагрівача; вольтметр і амперметр за допомогою яких вимірюються напруга та струм у ланцюгу нагрівача; секундомір, за допомогою якого вимірюється час нагрівання калориметра. Секундомір приводиться в дію при включенні живлення приладового блоку.
Блок робочого елемента 2 закритий спереду знімним екраном з орг. скло. Під час роботи екран навішується на задню стінку блоку робочого елемента. На панелі блоку робочого елемента розташований цифровий термометр 6 вимірювання температури. Внизу в гніздах розміщені досліджувані зразки 5 різних матеріалів і рукоятка для установки зразків в нагрівач.
Нагрівач 4 складається з металевого кожуха, теплоізолюючого матеріалу та калориметра.

Зразки нагріваються у калориметрі, схема якого показана на рис. 8.2.
Калориметр являє собою латунний корпус 2 з конічним отвором, куди вставляється досліджуваний зразок 1. На зовнішній поверхні корпусу в спеціальних пазах розміщується нагрівальна спіраль 9. Зовні корпус калориметра теплоізольований шарами азбесту 3 і скловолокна 6 і закритий алюмінієвим шкіру. Після закінчення експерименту зразок можна виштовхнути з конічного отвору корпусу калориметра за допомогою гвинта 7. Для видалення нагрітого зразка з калориметра і установки зразка нагрівач використовується рукоятка 5, розташована в спеціальному гнізді поруч з досліджуваними зразками.
Температура калориметра вимірюється цифровим термометром датчик температури 8 якого знаходиться в корпусі 2 калориметра.
Техніка безпеки
При виконанні роботи дотримуються загальних вимог техніки безпеки у лабораторії механіки.
Порядок виконання роботи
УВАГА!Калориметр довго охолоджується, тому після виміру всіх значень часу 0 Нагрівання порожнього калориметра слід відразу ж відключити нагрівання (див. п. 4 нижче). Максимальна температура нагріву для цієї установки +44С.
1. Зніміть прозорий кожух блоку робочого елемента установки та підвісте його на гвинтах задньої панелі. Встановіть мінімум ручку регулятора «НАГРІВ». Увімкніть тумблером «МЕРЕЖА».
2. Порожній калориметр щільно закрийте кришкою. Увімкніть перемикач «НАГРІВ». За допомогою регулятора «НАГРІВ» встановіть напругу 10-20 В (що більше напруга, тим швидше нагрівання). Запишіть у табл. 8.1 вибрані значення напруги Uі струму I.
3. Починаючи з температури калориметра t 0 , зазначеної викладачем, через інтервал 1 С заносите в табл. 8.1 значення часу 0 , що відповідають кожній досягнутій температурі t.
4. Вимкніть тумблер «НАГРІВ», відкрийте кришку та охолодіть калориметр до початкової температури t 0 . Для швидкого охолодження калориметра можна опустити в калориметр один із зразків, крім вказаного викладачем (при встановленні зразка калориметр потрібно обертати гвинт в нижній частині калориметра вліво). Температура почне знижуватись. Коли темп охолодження знизиться, зразок, що нагрівся, вийняти і вкласти наступний (холодний), крім зазначеного викладачем. Для виймання зразка треба повернути праворуч (за годинниковою стрілкою) гвинт у нижній частині калориметра, після чого витягнути зразок рукояткою.
Таблиця 8.1
|
T= t− t 0 , |
= − 0 , |
Дж/(кгК) |
C m =зM, Дж/(мольК) |
||||||||
5. Повертаючи гвинт ліворуч, помістіть у калориметр один із досліджуваних зразків, взятий за вказівкою викладача. Щільно закрийте кришку калориметра і зачекайте 2-3 хвилини, щоб температури калориметра і зразка зрівнялися.
6. Увімкніть тумблер «НАГРІВ» і встановіть таку ж напругу в ланцюзі, як і при нагріванні порожнього калориметра.
7. Починаючи з тієї ж початкової температури калориметра t 0 через інтервал 1С заносите в табл. 8.1 значення часу , що відповідають кожній досягнутій температурі t.
8. Регулятор «НАГРІВ» встановіть у крайнє ліве положення (на мінімум), вимкніть тумблер «НАГРІВ», відкрийте кришку калориметра. Для видалення зразка з калориметра гвинт обертайте праворуч, після чого за допомогою ручки вийміть нагрітий зразок.
9. Вимкніть установку тумблером «МЕРЕЖА».
10. Переведіть усі значення величин 0 та значення в секундах (без хвилин) і занесіть їх у табл. 8.1. Для кожного рядка табл. 8.1 обчисліть значення = − 0 та T= t− t 0 .
11. Зробіть оцінний розрахунок питомої теплоємності зразка за формулою 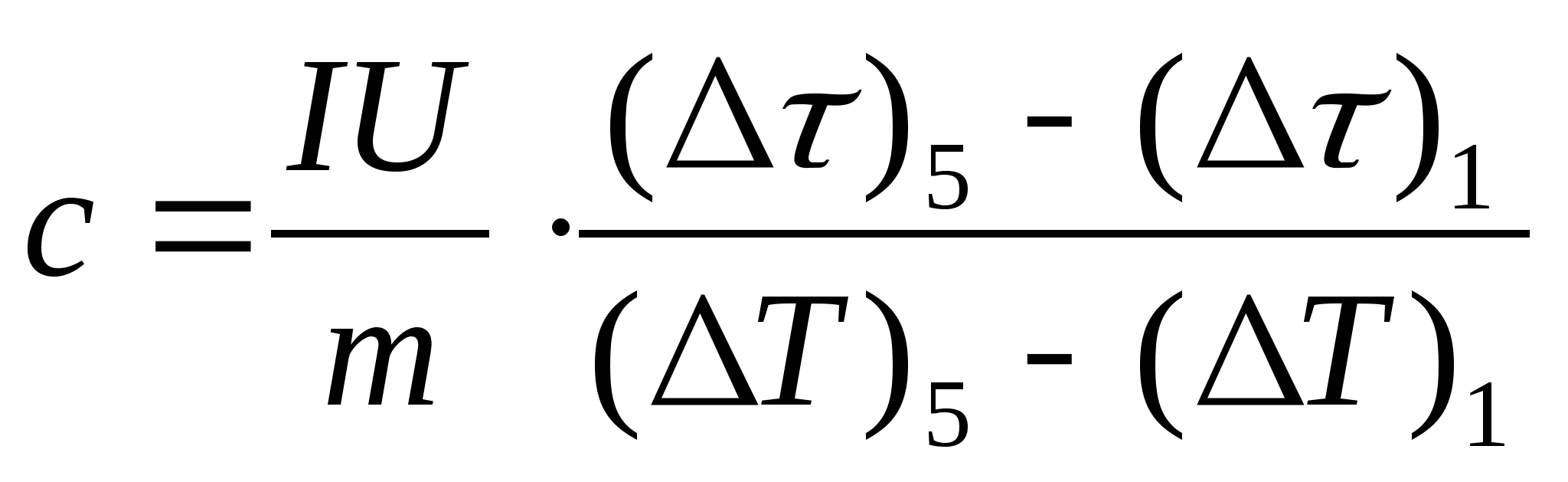 де маса зразка m=139,5 г (латунь) або m=129,7 г (сталь) або
m= 46,05 г (дюраль). Підійдіть до викладача на перевірку.
де маса зразка m=139,5 г (латунь) або m=129,7 г (сталь) або
m= 46,05 г (дюраль). Підійдіть до викладача на перевірку.
Обробка результатів виміру
1. Побудуйте графік
=f(T) залежності різниці часу нагрівання калориметра із зразком та порожнього калориметра від зміни температури калориметра, виберіть дві будь-які точки на графіку та визначте кутовий коефіцієнт прямий за формулою 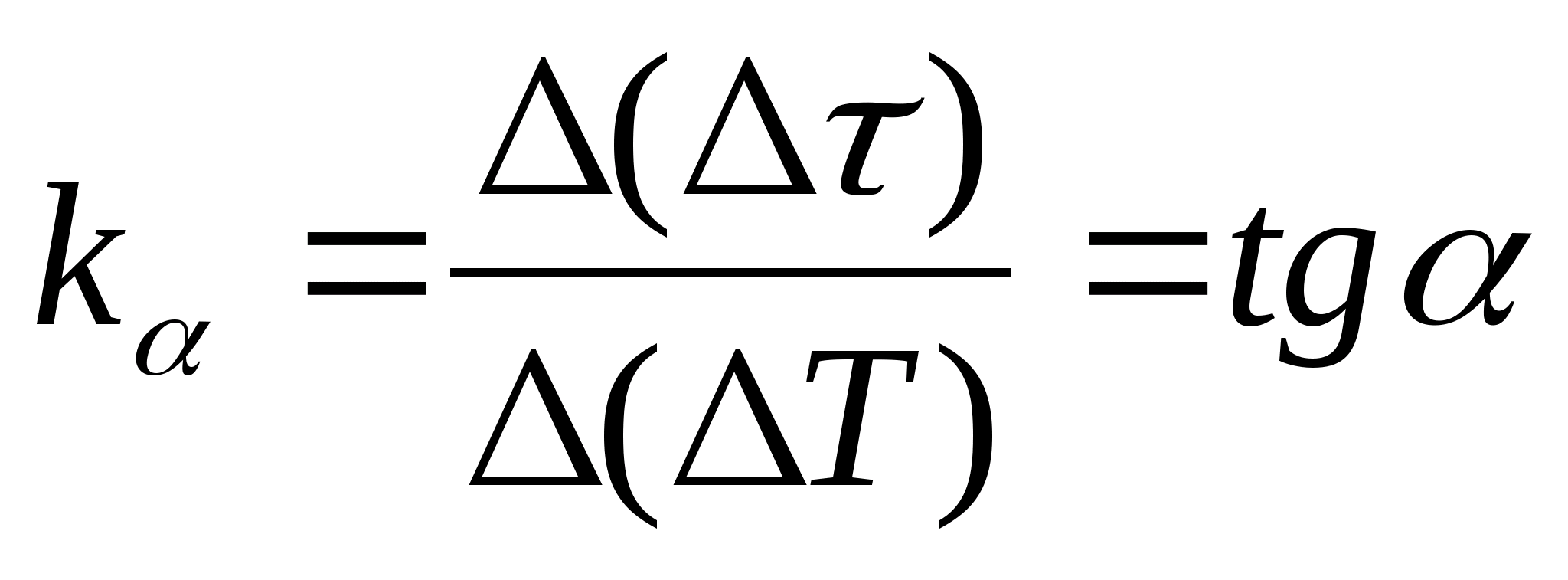 , де
− кут нахилу графіка до осі T
(якщо одиниці величин
та Tзображуються обох осях відрізками однакової довжини).
, де
− кут нахилу графіка до осі T
(якщо одиниці величин
та Tзображуються обох осях відрізками однакової довжини).
2. Використовуючи значення кутового коефіцієнта k
, визначте питому теплоємність зразка за формулою 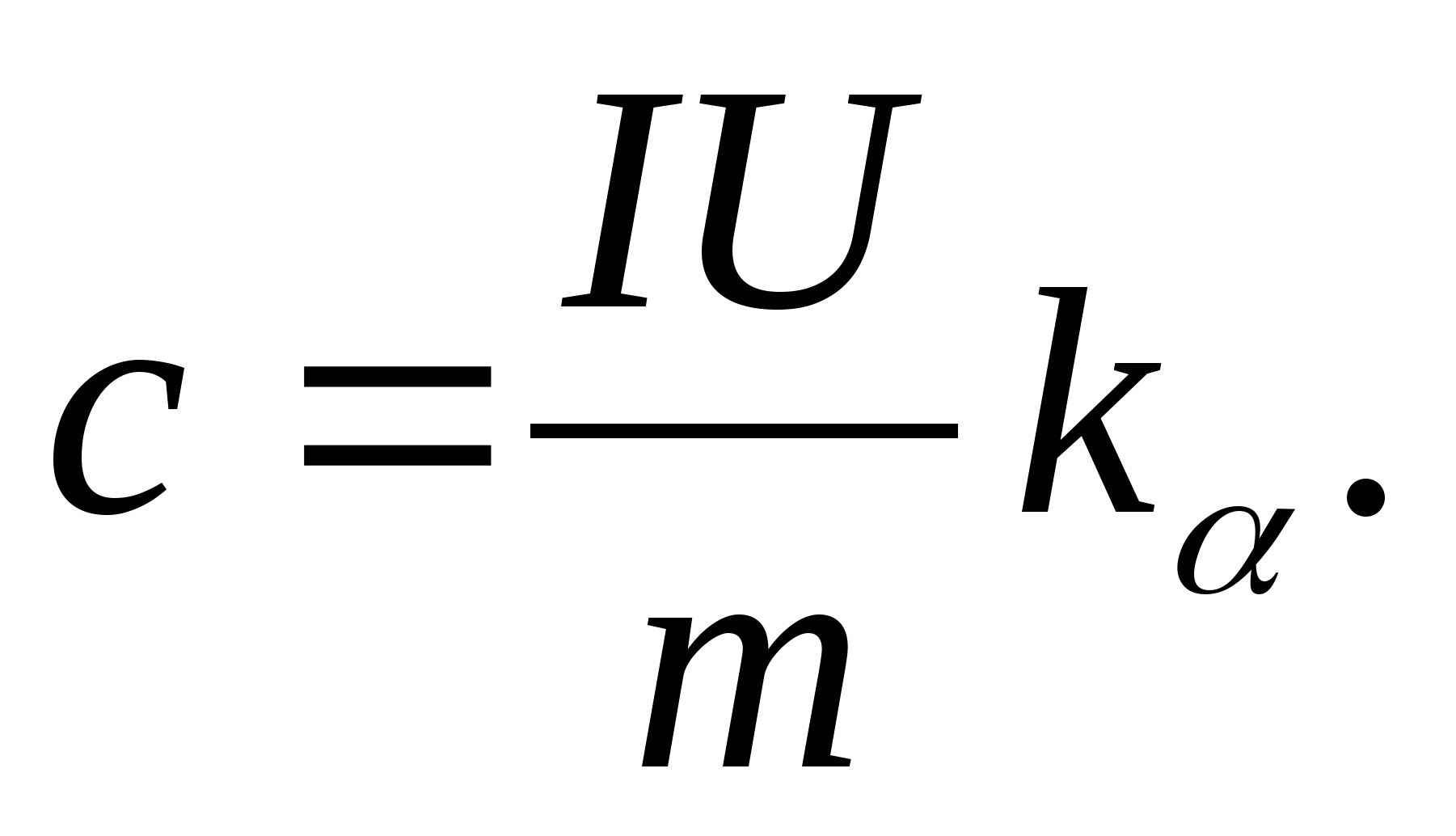
3. Використовуючи дані таблиці 8.2 (або таблицю Менделєєва) визначити молярну теплоємність зразка за формулою C m =зM.
Таблиця 8.2
|
Матеріал зразка |
Атомна маса, кг/моль |
|
Як модель твердого тіла розглянемо правильно побудовану кристалічну решітку, у вузлах якої частинки (атоми, іони, молекули), що приймаються за матеріальні точки, коливаються біля своїх положень рівноваги - вузлів ґрат - у трьох взаємно перпендикулярних напрямках. Таким чином, кожній складовій кристалічній решітці частинці приписується три коливальні ступені свободи, кожна з яких, згідно із законом рівнорозподілу енергії за ступенями свободи (див. § 50), має енергію kT.
Внутрішня енергія молячи твердого тіла
U m = 3N А kT = 3RT,
де N А - постійна Авогадро; N A k= R (R - молярна газова стала).
Молярна теплоємність твердого тіла
тобто молярна (атомна) теплоємність хімічно простих тілу кристалічному стані однакова (рівна 3 R) і залежить від температури. Цей закон був емпірично отриманий французькими вченими П. Дюлонгом (1785-1838) та Л. Пті (1791 -1820) і носить назвазакону Дюлонга та Пті.
Якщо тверде тіло є хімічною сполукою (наприклад, NaCl), то число частинок у молі не дорівнює постійній Авогадро, а дорівнює nN A , де n - Число атомів в молекулі (для NaCl число частинок в молі дорівнює 2 Nа, так, в одному молі NaCl міститься N атомів Na і N атомів Cl). Таким чином, молярна теплоємність твердих хімічних сполук
C V = 3R25n Дж/(моль К),
тобто дорівнює сумі атомних теплоємностей елементів, що становлять це з'єднання.
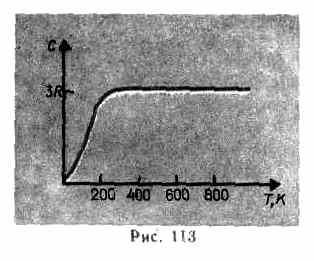
Як показують досвідчені дані (табл. 4), багатьом речовин закон Дюлонга і Пті виконується з досить добрим наближенням, хоча деякі речовини (С, Be, У) мають значні відхилення від обчислених теплоємностей. Крім того, як і у випадку газів (див. § 53), досліди з вимірювання теплоємності твердих тіл за низьких температур показали, що вона залежить від температури (рис. 113). Поблизу нуля Кельвіна теплоємність тіл пропорційна T 3 і тільки за досить високих температур, характерних для кожної речовини, виконується умова (73.1). Діамант, наприклад, має теплоємність, рівну 3 R при 1800 К! Однак для більшості твердих тіл кімнатна температура є досить високою.
Розбіжність досвідчених і теоретичних значень теплоємностей, обчислених на
На основі класичної теорії пояснили, виходячи з квантової теорії теплоємностей, А. Ейнштейн і П. Дебай (1884-1966).
§ 74. Випаровування, сублімація, плавлення та кристалізація. Аморфні тіла
Як у рідинах, так і в твердих тілах завжди є деяке число молекул, енергія яких достатня для подолання тяжіння до інших молекул і які здатні відірватися від поверхні рідини або твердого тіла і перейти в навколишній простір. Цей процес для рідини називається випаровуванням(або пароутворенням),для твердих тіл - сублімацією(або сублімацією).
Випаровування рідин йде за будь-якої температури, але його інтенсивність з підвищенням температури зростає. Поряд з процесом випаровування відбувається процес, що його компенсує. конденсаціїпара в рідині. Якщо число молекул, що залишають рідину за одиницю часу через одиницю поверхні, дорівнює кількості молекул, що переходять з пари в рідину, то настає динамічна рівновагаміж процесами випаровування та конденсації. Пара, що знаходиться в рівновазі зі своєю рідиною, називається насиченим(Див. також § 62).
Для більшості твердих тіл процес сублімації при звичайних температурах незначний і тиск пари над поверхнею твердого тіла мало; воно підвищується із підвищенням температури. Інтенсивно сублімують такі речовини, як нафталін, камфора, що виявляється по різкому, властивому їм запаху. Особливо інтенсивно сублімація відбувається у вакуумі – цим користуються для виготовлення дзеркал. Відомий приклад сублімації – перетворення льоду на пару – мокра білизна висихає на морозі.
Якщо тверде тіло нагрівати, його внутрішня енергія(Складається з енергії коливань частинок у вузлах решітки та енергії взаємодії цих частинок) зростає. При підвищенні температури амплітуда коливань частинок
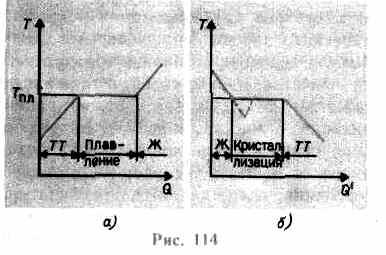
збільшується доти, поки кристалічні грати не зруйнується,- тверде тіло плавиться. На рис. 114, азображена зразкова залежність T(Q), де Q- кількість теплоти, отримане тілом під час плавлення. У міру повідомлення твердому тілу теплотийого температура підвищується, а при температурі плавлення Тпл починається перехід тіла з твердого стану в рідкий. Температура Тпл залишається постійною до того часу, поки весь кристал не розплавиться, і тоді температура рідини знову почне підвищуватися.
Нагрівання твердого тіла до Тпл ще не переводить його в рідкий стан, оскільки енергія частинок речовини має бути достатньою для руйнування кристалічних ґрат. У процесі плавлення теплота, що повідомляється речовині, йде на здійснення роботи з руйнування кристалічних ґрат, а тому T пл =const до розплавлення всього кристала. Потім тепло, що підводиться, знову піде на збільшення енергії частинок рідини і її температура почне підвищуватися. Кількість теплоти, необхідне для розплавлення 1 кг речовини, називається питомою теплотою плавлення.
Якщо рідина охолоджувати, процес протікає у зворотному напрямку (рис. 114, б; Q" - кількість теплоти, віддане тілом при кристалізації): спочатку температура рідини знижується, потім при постійній температурі, що дорівнює T пл, починається кристалізація,після її завершення температура кристала починає знижуватись. Для кристалізації речовини потрібна наявність так званих центрів кристалізації -кристалічних зародків, якими можуть бути не тільки кристалики речовини, що утворюється, але і домішки, а також пил, сажа і т. д. Відсутність центрів кристалізації в чистій рідині ускладнює утворення мікроскопічних кристаликів, і речовина, залишаючись в рідкому стані, охолоджується до температури, меншої температури кристалізації, при цьому утворюється переохолоджена рідина(На 114, б їй відповідає штрихова крива). При сильному переохолодженні починається спонтанне утворення центрів кристалізації і кристалізується речовина досить швидко.
Зазвичай переохолодження розплаву походить від часток до десятків градусів, але для низки речовин може досягати сотень градусів. Через велику в'язкість сильно переохолоджені рідини втрачають плинність, зберігаючи, як і тверді тіла, свою форму. Ці тіла отримали назву твердих аморфних тіл;до них відносяться смоли, віск, сургуч, скло. Аморфні тіла, будучи таким чином переохолодженими рідинами, ізотропні,тобто їх властивості у всіх напрямках однакові; для них, як і для рідин, характерний ближній порядоку розташуванні частинок; в них на відміну від рідин рухливість часток досить мала. Особливістю аморфних тіл є відсутність у них певної точки плавлення, тобто неможливо вказати певну температуру, вище за яку можна було б констатувати рідкий стан, а нижче - тверде. З досвіду відомо, що в аморфних тілах з часом може спостерігатися процес кристалізації, наприклад, у склі з'являються кристалики; воно, втрачаючи прозорість, починає каламутніти і перетворюватися на полікристалічне тіло.
Останнім часом стала вельми поширеною в народному господарствіотримали полімери- органічні аморфні тіла, молекули яких складаються з великої кількості однакових довгих молекулярних ланцюжків, з'єднаних хімічними зв'язками. До полімерів відносяться як природні (крохмаль, білок, каучук, клітковина та ін.), Так і штучні (пластмаса, гума, полістирол, лавсан, капрон та ін) органічні речовини. Полімерам притаманні міцність та еластичність; деякі полімери витримують розтягування, що в 5-10 разів перевищує їхню початкову довжину. Це тим, що довгі молекулярні ланцюжка можуть при деформації або згортатися в щільні клубки, або витягуватися в прямі лінії. Еластичність полімерів проявляється тільки в певному інтервалі температур, нижче за який вони стають твердими і крихкими, а вище - пластичними. Хоча синтетичних полімерних матеріалів створено дуже багато (штучні волокна, замінники шкіри, будівельні матеріали, замінники металів та ін.), але теорія полімерів досі повністю не розроблена. Її розвиток визначається запитами сучасної техніки, що вимагає синтезу полімерів із заздалегідь заданими властивостями.
Під питомою теплоємністю речовини мається на увазі величина
, (1)
де – кількість теплоти, повідомлена тілу.
- Зміна температури, що відбувається в
результаті передачі тілу теплоти,
m – маса тіла, що нагрівається.
На досвіді зазвичай визначається середня питома теплоємністьречовини c, чисельно рівна кількості теплоти , яку треба повідомити одиниці маси цієї речовини, щоб підняти її температуру на :
(2),
де - різниця кінцевої та початкової температур досліджуваного тіла.
Для експериментального визначення теплоємності використовують різні калориметричні методи. Різноманітність цих методів пов'язана з тим, що точне вимірювання кількості теплоти, що повідомляється тілу, вимагає усунення теплових втрат, що не враховуються при нагріванні досліджуваного тіла.
Зазвичай, у про калориметрах з ізотермічною оболонкою, вводиться розрахункова чи експериментально визначається поправка на радіацію, тобто кількість теплоти, яке калориметр під час досвіду отримує чи віддає зовнішнього середовища випромінюванням.
Однак, можна істотно зменшити теплові втрати введенням хорошої теплоізоляції або за рахунок скорочення тривалості досвіду, що досягається високою швидкістю нагріву зразка ~ (імпульсний метод вимірювання теплоємності), при якій теплові втрати будуть малі в порівнянні з загальною кількістю теплоти, що підводиться.
Одним із найбільш точних методів визначення теплоємності є метод адіабатичного калориметра. Труднощі, пов'язані з необхідністю обліку теплових втрат, у калориметрах цього усуваються тим, що виміри виробляються умовах теплового рівноваги, тобто умовах рівності температур досліджуваного зразка і оточуючого зразок блоку. До переваг цього методу, поряд з високою точністю, відноситься також можливість визначення теплоємності твердих тіл у широкому температурному інтервалі, що особливо важливо, якщо речовини мають фазові перетворення.
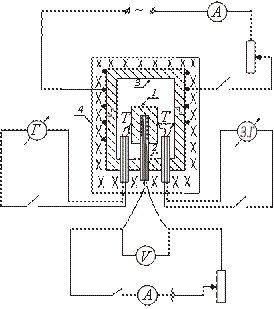
Пристрій одного з типів адіабатичного калориметра схематично показано малюнку. Досліджуваний зразок 1 поміщається в мідний блок 3 і разом з ним нагрівається в печі 4. Всередину зразка вводиться нагрівач 2, що дозволяє додатковий підігрів зразка.
Після включення печі 4, яку поміщений блок із зразком, температура зразка починає підвищуватися, залишаючись нижче температури блоку. Щоб встановити рівність температур зразка та блоку, включають нагрівач, вміщений всередині зразка. Коли температура зразка стане трохи вищою за температуру блоку, внутрішній нагрівач вимикається.
Надалі включення та вимкнення цього нагрівача відбувається періодично, так що різниця температур зразка та блоку постійно змінює знак.
У той момент, коли дорівнює нулю (при включеному внутрішньому нагрівачі), теплообмін між зразком і блоком відсутня, і вся кількість теплоти, що виділяється внутрішнім нагрівачем, витрачається тільки на нагрівання зразка; питома теплоємність у разі може бути визначена за формулою (2).
Кількість теплоти, що виділяється внутрішнім нагрівачем, визначається за формулою:
де I - Струм внутрішнього нагрівача;
V – падіння напруги у ньому;
- Проміжок часу, протягом якого температура збільшилася на .
Тоді
(4)
де - час, протягом якого температура зразка змінилася на .
У диференціальній формі формула (4) має вигляд
(5)
Температура зразка вимірюється термопарою Т. Різниця температур блоку та зразка вимірюється диференціальною термопарою. Для визначення температури зразка використовується крива градуювання термопари Т. Різниця температур блоку і зразка визначається в поділах шкали гальванометра (так як потрібно лише зафіксувати момент, коли різниця температур блоку і зразка змінює знак).
Виконання роботи.
Зразок одягнений на нагрівач, поміщений усередину мідного блоку. До зразка та блоку підведені спаї термопар T та . Пекти закривається кришкою. Включається електрична обмотка печі, до якої вміщено блок. Періодично вмикається і вимикається нагрівач, поміщений всередину зразка, причому записуються значення I і V ланцюга внутрішнього нагрівача.
Перед початком вимірювання необхідно перевірити положення нуля дзеркального гальванометра. Для цього, від'єднавши термопару від гальванометра, очікують припинення коливань зайчика вздовж шкали. Якщо після цього зображення нитки не збігається з нулем, пересуванням шкали домагаються цього збігу.
Будуються криві залежності T і часу.
За кутовим коефіцієнтом кривої T(t) у точці, де змінює знак (тобто коли встановлюється теплова рівновага), обчислюється питома теплоємність за формулою (5). Ця теплоємність відноситься до температури, яку потрібно відрахувати по кривій T(t) у момент, коли різниця температур блоку та зразка змінює знак.
