Kā noteikt ūdens īpatnējo siltumietilpību. Lielā naftas un gāzes enciklopēdija
INSTRUMENTI UN PIEDERUMI: kalorimetrs, termometrs, svari, testa korpusi, vārglāze (kalibrēts gramos), elektriskais sildītājs.
– eksperimentāli apstiprināt siltuma bilances vienādojuma pamatotību;
– aprēķināt cietvielu īpatnējās siltumietilpības;
– sakārtot mērījumu un aprēķinu rezultātus tabulas veidā;
– pierakstiet savus ieteikumus mērījumu un aprēķinu tehnikas pilnveidošanai šajā darbā.
ĪSS PIEREDZES TEORIJA
Viens no termodinamikas fizikālajiem pamatjēdzieniem ir siltumietilpība.
Ķermeņa siltumietilpība sauca fiziskais daudzums, skaitliski vienāds ar siltumu, kas ir jāpaziņo ķermenim, lai aplūkotajā termodinamiskajā procesā mainītu tā temperatūru par 1 K. No otras puses, ķermeņa siltumietilpība ir vienāda ar ķermeņa nodotā siltuma dQ attiecību pret ķermeņa temperatūras izmaiņām dT aplūkojamajā termodinamiskajā procesā:
Ķermeņa siltumietilpība ir atkarīga no tā ķīmiskais sastāvs, ķermeņa masu un tā termodinamisko stāvokli, kā arī, kā redzams no definīcijas, par ķermeņa stāvokļa maiņas procesa veidu, kurā nonāk siltums dQ.
Termiskās īpašības viendabīgus ķermeņus raksturo īpatnējās un molārās (molārās) siltumietilpības vērtības. Vielas īpatnējā siltumietilpība sauc par fizisko lielumu Ar, skaitliski vienāds ar siltumu, kas jāpiešķir vienam kilogramam vielas, lai aplūkojamajā termodinamiskajā procesā mainītu tās temperatūru par 1 K. Viendabīga ķermeņa siltumietilpību var definēt kā ķermeņa masas reizinājumu mīpatnējai siltuma jaudai Ar tās vielas:
![]() vai (2.2.).
vai (2.2.).
Tādējādi sakarībai starp dQ un dT viendabīgam ķermenim ir šāda forma:
molārā siltuma jauda fizikālo lielumu C sauc, kas skaitliski vienāds ar siltumu, kas jāpiešķir vienam molam vielas, lai aplūkojamajā termodinamiskajā procesā mainītu tās temperatūru par 1 K:
NO = JAUNKUNDZE = (2.4),
kur M ir vielas molārā masa; NO ir tā īpatnējā siltuma jauda tajā pašā procesā.
Izteiksmi (2.4) tagad var uzrakstīt šādā formā:
kur = n ir vielas daudzums.
Ķermeņa siltumietilpības mērvienība ir 1 J/K, īpašs karstums– 1 J/kg. K, molārais - 1 J / mol. UZ.
Ja karsēšana notiek apstākļos, kad tilpums paliek nemainīgs, tad sauc atbilstošo molāro siltumietilpību siltuma jauda nemainīgā tilpumā, vai izohoriskā siltumietilpība, un to apzīmē ar C v:
Ja spiediens karsēšanas laikā paliek nemainīgs, tad sauc siltuma jaudu siltuma jauda pastāvīgā spiedienā C p (to var saukt arī par izobārisko siltumietilpību):
Ņemiet vērā, ka cietām vielām tiešai mērīšanai ir pieejama tikai siltumietilpība nemainīgā spiedienā, nevis nemainīgā tilpumā, jo termiskās izplešanās dēļ nav iespējams nodrošināt ķermeņa tilpuma noturību. Taču, ņemot vērā tilpuma izmaiņu mazumu karsēšanas laikā, starpība starp siltuma jaudām C p un C v ir neliela.
Eksperimentāli ķermeņa siltumietilpību nosaka, izmantojot siltuma bilances vienādojumu. Ļaujiet ķermenim uzkarsēt līdz temperatūrai, kas ir augstāka par temperatūru vidi. Tad, atdziest, ķermenis izdala noteiktu siltuma daudzumu. Saskaņā ar enerģijas nezūdamības likumu slēgtā sistēmā siltuma daudzumam, ko saņem barotne, jābūt precīzi vienādam ar ķermeņa izdalītā siltuma daudzumu. Šajā darbā, atdziestot, testa ķermenis atdod siltumu ūdenim kalorimetrā un pašam kalorimetram.
Ļaujiet dotajam testa ķermenim ar masu m, uzkarsē līdz temperatūrai t0, tiek pazemināts kalorimetrā ar ūdeni, kura temperatūra t1. Siltuma pārneses rezultātā ūdens temperatūra un kalorimetrs paceļas līdz t2, a Ķermeņa temperatūra samazinās līdz t2. Siltuma daudzums, ko ķermenis izdala:
Q dep = cm(t0 - t2) (2.6),
kur c ir testa ķermeņa īpatnējā siltumietilpība,
t0- sākotnējā ķermeņa temperatūra,
t2- beigu ķermeņa temperatūra,
m- ķermeņa masa.
Siltuma daudzums, ko saņem kalorimetrs un ūdens, ir vienāds ar:
kur un ir kalorimetra masa un īpatnējais siltums,
Es - masa un specifiska ūdens siltuma jauda,
t1- sākotnējā ūdens temperatūra,
t2 ir ūdens galīgā temperatūra.
Saskaņā ar enerģijas nezūdamības likumu slēgtā sistēmā:
Q otd \u003d Q stāvs (2.8).
Pēc tam aizstājot formulas 2.6 un 2.7 vienādojumā 2.8 un izsakot vēlamo vērtību NO , mēs iegūstam:
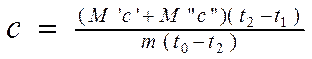 (2.9).
(2.9).
NOTEIKT ĪPAŠĀS SILTUMKApacitātes TRĪS CILINRISKIEM KORMEĻIEM NO DAŽĀDIEM METĀLIEM
1. Nosakiet ķermeņu masu vērtības - m i, kalorimetra masa – , ūdens īpatnējais siltums – , kalorimetra īpatnējais siltums – .
2. Ielejiet kalorimetrā nomērītu daudzumu auksta ūdens istabas temperatūrā (apmēram 150 g).
3. Izmēra aukstā ūdens sākotnējo temperatūru t 1 .
4. Uzkarsē ūdeni traukā līdz vārīšanās temperatūrai.
5. Vienu no testa ķermeņiem uz brīdi ievietojiet verdošā ūdenī. Ņem uzkarsētā ķermeņa temperatūru t 0 vienāds ar temperatūru verdošs ūdens normālos apstākļos - 100 ° C.
6. Ievietojiet apsildāmo ķermeni kalorimetrā ar ūdeni. Sagaidiet siltuma pārneses beigas un izmēra gala temperatūru kalorimetrā - t 2 .
8. Līdzīgi nosaka arī pārējo divu ķermeņu īpatnējās siltumietilpības.
9. Mērījumu un aprēķinu rezultātus ierakstīt 3. tabulā.
10. Pamatojoties uz īpatnējo siltumietilpību vērtībām, nosaka vielas, no kurām izgatavoti ķermeņi.
12. Izmērot ķermeņu lineāros izmērus, noteikt to blīvumu.
13. Aprēķiniet kļūdas un ierakstiet rezultātu saskaņā ar GOST.
14. Pierakstiet secinājumus par laboratorijas darbu.
3. tabula
| Nr p / lpp | M", kg | M", kg | m, kg | C", J/kg. K | C", J/kg. K | t 0, 0 C | t 1, 0 C | t 2, 0 C | C, J/kg. Uz |
2. lapa
Īpatnējā siltuma noteikšanas precizitāte saskaņā ar Sykes ir ļoti augsta. Tomēr šī metode ir saistīta ar lielākām eksperimentālām grūtībām nekā Smita metode, kā arī sniedz precīzus rezultātus tikai apkures līknēm, lai gan to var izmantot arī dzesēšanas līkņu iegūšanai. Smita metode atvieglo šauru temperatūras diapazonu izpēti, taču, iespējams, ir mazāk precīza.
Tāpēc, lai noteiktu vielas īpatnējo siltumietilpību sg, ir nepieciešams izmērīt darbu A, ko veic ārējie spēki, kas iedarbojas uz ķermeni, un izmērīt ķermeņa temperatūras izmaiņas, kas novērotas darba rezultātā prombūtnē. siltuma apmaiņu ar citiem ķermeņiem.
Biežāk izmantotā īpatnējās siltumietilpības noteikšanas metode; sauc par sajaukšanu. Kalorimetrs (Regno) sastāv no sarkana vara trauka, kas novietots uz koka kājām cita vara trauka dibenā, no kura to atdala gaisa slānis, kura siltumvadītspēja un siltumietilpība uz tilpuma vienību ir nenozīmīgs. Pirmais trauks ir piepildīts ar ūdeni.
Tagad apskatīsim metodes gāzes maisījuma īpatnējās siltumietilpības noteikšanai.
Īpatnējās siltumietilpības Su tieša (tieša) noteikšana un tās izmaiņu gaitas izpēte atkarībā no temperatūras un īpatnējā tilpuma ir viens no efektīvi līdzekļi vielu kritiskā stāvokļa izpēte. Tāpēc eksperimentālās siltumietilpības noteikšanas rada lielu teorētisko un praktisko interesi kritisko parādību izpētē.
Kāda ir šķīdumu īpatnējās siltumietilpības noteikšanas formula.
Veicot eksperimentus, lai noteiktu īpatnējo siltumu, sajaucot, ir nepieciešams uzsildīt testa paraugu - - līdz precīzi noteiktai temperatūrai. Šim nolūkam tiek izmantoti pārnēsājamie sildītāji, kas uz īsu brīdi tiek uzstādīti virs kalorimetra, kas nepieciešami ātrai karsētā parauga pārnešanai uz kalorimetru.
| Ierīces diagramma. |
Vienkāršākās absolūtās stacionārās metodes būtība īpatnējās siltumietilpības noteikšanai ir šāda: starp sildītāju un dzesētāju novieto pārbaudāmā materiāla paraugu ar biezumu h un šķērsgriezuma laukumu 5. Sildītājs var būt trauks ar karsts ūdens vai elektrisko sildelementu, lai tā jaudu varētu regulēt pēc vēlēšanās, mainot spriegumu. Dzesētājs ir dobs metāla korpuss, caur kuru tiek izvadīts auksts ūdens. Temperatūru uz parauga apsildāmajām un atdzesētajām virsmām (tj un attiecīgi / 2) mēra ar termopāriem.
Zemāk ir piemērs eksperimentālo datu apstrādei, nosakot smilšakmens parauga īpatnējo siltumietilpību. Dobu cilindru, kas pildīts ar pētāmā iežu parauga pulveri, uzsildīja līdz 40 C un atdzesēja klusā gaisa kamerā līdz 18–20 C temperatūrai.
Uz att. 3 - 6 parādītas nomogrammas šķidru atsevišķu ogļūdeņražu un eļļu maisījumu, kā arī metanola un etanola ūdens šķīdumu īpatnējās siltumietilpības noteikšanai.
Piemēram, izveidosim siltuma bilances vienādojumu, ko izmanto vielas īpatnējās siltumietilpības noteikšanā, izmantojot kalorimetru. Aptuveni var uzskatīt, ka šajā gadījumā siltuma apmaiņā piedalās trīs ķermeņi: kalorimetrs, šķidrums un ķermenis, kura vielas īpatnējais siltums tiek noteikts.
6.4. Siltuma pārnese starp ķermeņiem
6.4.1. Ķermeņa siltumietilpība, specifiska vielas siltumietilpība, vielas molārā siltumietilpība
Lai paaugstinātu ķermeņa temperatūru, tam ir jāsamazina noteikts siltuma daudzums.
Tiek saukts 1 kg dotās vielas uz 1 K īpašs karstums vielas un tiek aprēķināts pēc formulas
c sitieni = Q m Δ T ,
kur Q ir siltuma daudzums, kas nepieciešams noteiktas vielas masas uzsildīšanai; m ir vielas masa; ΔT ir vielas temperatūras izmaiņas karsēšanas laikā.
Starptautiskajā mērvienību sistēmā vielas īpatnējo siltumietilpību mēra džoulos, dalītos ar kilogramu-kelvinu (1 J/(kg ⋅ K)).
Siltuma daudzums, kas nepieciešams sildīšanai kāda matērijas masa, nosaka produkts
Q = c sitiens m ∆T .
Siltuma daudzumu, kas nepieciešams, lai paceltu doto ķermeni par 1 K, sauc ķermeņa siltumietilpība un tiek aprēķināts pēc formulas
C = QΔT,
kur Q ir siltuma daudzums, kas nepieciešams konkrēta ķermeņa uzsildīšanai; ΔT - ķermeņa temperatūras izmaiņas sildot.
Starptautiskajā mērvienību sistēmā ķermeņa siltumietilpību mēra džoulos, dalītos ar kelviniem (1 J/K).
Siltuma daudzumu, kas nepieciešams noteikta ķermeņa sildīšanai, nosaka produkts
Q=CΔT,
kur C ir ķermeņa siltumietilpība.
Ķermeņa siltumietilpība un tās vielas siltumietilpība, no kuras ķermenis sastāv, savstarpēji saistīti izteiksme
C \u003d mc sitieni,
kur C ir ķermeņa siltumietilpība; m - ķermeņa svars; c sitiens ir īpatnējā siltumietilpība vielai, no kuras izgatavots šis ķermenis.
Siltuma daudzumu, kas nepieciešams, lai paaugstinātu 1 mola dotās vielas temperatūru par 1 K, sauc vielas molārā siltumietilpība un tiek aprēķināts pēc formulas
c μ = Q ν Δ T ,
kur Q ir siltuma daudzums, kas nepieciešams, lai uzsildītu noteiktu vielas daudzumu; ν ir vielas daudzums; ΔT ir noteiktā vielas daudzuma temperatūras izmaiņas karsējot.
Starptautiskajā mērvienību sistēmā vielas molāro siltumietilpību mēra džoulos uz molkelvinu (1 J/(mol ⋅ K)).
Siltuma daudzums, kas nepieciešams sildīšanai kāds vielas daudzums, nosaka produkts
Q = c µ νΔT .
Vielas molārās un īpatnējās siltumietilpības savstarpēji saistīti izteiksme
c µ = Ms sitieni,
kur c µ ir vielas molārā siltumietilpība; M ir vielas molārā masa; c sp - vielas īpatnējā siltumietilpība.
14. piemērs Dzelzs un svina lodītēm ir vienāds diametrs. Cik reizes lielāka ir dzelzs lodītes siltumietilpība nekā svina lodei? Dzelzs un svina īpatnējā siltumietilpība ir 0,46 un 0,13 kJ / (kg ⋅ K), un blīvumi ir attiecīgi 7,80 un 11,5 g / cm 3.
Risinājums. Bumbiņu siltuma jaudas nosaka pēc šādām formulām:
- dzelzs bumba -
C 1 \u003d m 1 c beat1,
kur m 1 ir dzelzs lodītes masa; c ud1 - dzelzs īpatnējā siltumietilpība;
- svina bumba -
C 2 \u003d m 2 c beat2,
kur m 2 ir svina lodītes masa; c sp2 - svina īpatnējā siltumietilpība.
Vēlamā attiecība ir siltuma jaudas:
C 1 C 2 \u003d m 1 c sitiens 1 m 2 c sitiens 2,
ko nosaka dzelzs un svina lodīšu masu attiecība un dzelzs un svina īpatnējo siltumu attiecība.
Bumbiņu masu nosaka to izmērs un blīvums:
- dzelzs bumba -
m 1 \u003d ρ 1 V 1,
kur ρ 1 ir dzelzs blīvums; V 1 - dzelzs lodītes tilpums;
- svina bumba -
m 2 \u003d ρ 2 V 2,
kur ρ 2 - svina blīvums; V 2 - svina lodītes tilpums.
Bumbām ir vienāds diametrs, tāpēc to tilpums ir vienāds:
V 1 \u003d V 2 \u003d V \u003d π d 2 6,
kur d ir dzelzs un svina lodīšu diametrs.
Ņemot vērā pēdējo apstākli, masas attiecība ir vienāda ar:
m 1 m 2 = ρ 1 V 1 ρ 2 V 2 = ρ 1 ρ 2 .
Aizvietosim m 1 /m 2 dzelzs un svina lodīšu siltumietilpības attiecības formulā:
C 1 C 2 \u003d ρ 1 c sp 1 ρ 2 c sp 2.
Veiksim aprēķinu:
C 1 C 2 = 7,80 ⋅ 10 3 ⋅ 0,46 ⋅ 10 3 11,5 ⋅ 10 3 ⋅ 0,13 ⋅ 10 3 = 2,4.
Dzelzs lodītes siltumietilpība ir 2,4 reizes lielāka nekā svina lodei.
Piemērs 15. Sagatavojot maisījumu, bunkurā tika iebērta noteikta masa smilšu un četras reizes lielāka cementa masa. Cementa un smilšu īpatnējās siltumietilpības ir attiecīgi 810 un 960 J/(kg ⋅ K). Nosakiet maisījuma īpatnējo siltumietilpību.
Risinājums. Maisījuma īpatnējo siltumietilpību nosaka pēc formulas
c sitieni = Q m Δ T ,
kur Q ir siltuma daudzums, kas nepieciešams maisījuma temperatūras paaugstināšanai par ΔT; m ir maisījuma masa.
Siltuma daudzums, kas nepieciešams maisījuma sildīšanai, -
Q \u003d Q 1 + Q 2,
kur Q 1 - siltuma daudzums, kas nepieciešams, lai uzsildītu smiltis, kas ir maisījuma daļa, ar ΔT; Q 2 - siltuma daudzums, kas nepieciešams, lai sildītu cementu, kas ir maisījuma sastāvdaļa, ar ΔT.
Apkurei nepieciešamais siltuma daudzums:
- smiltis -
Q 1 \u003d c ud1 m 1 ∆T,
kur c ud1 - smilšu īpatnējā siltumietilpība; m 1 - smilšu masa;
- cements -
Q 2 \u003d c ud2 m 2 ∆T,
kur c ud2 - cementa īpatnējā siltumietilpība; m 2 ir cementa masa.
Siltuma daudzumu, kas nepieciešams, lai sildītu smilšu un cementa maisījumu, nosaka izteiksme
Q \u003d c sitiens 1 m 1 Δ T + c sitiens 2 m 2 Δ T \u003d (c sitiens 1 m 1 + c sitiens 2 m 2) Δ T.
Maisījuma masa ir smilšu un cementa masu summa:
m \u003d m 1 + m 2.
Aizvietosim iegūtās maisījuma siltuma daudzuma un masas izteiksmes maisījuma īpatnējās siltumietilpības formulā:
c sitieni \u003d (c pārspēj 1 m 1 + c pārspēj 2 m 2) Δ T (m 1 + m 2) Δ T \u003d c pārspēj 1 m 1 + c pārspēj 2 m 2 m 1 + m 2.
Mēs pārveidosim iegūto izteiksmi, ņemot vērā masas attiecību:
m 2 = 4m 1, t.i. c sitieni \u003d c sitieni 1 m 1 + 4 c sitieni 2 m 1 m 1 + 4 m 1 \u003d c sitieni 1 + 4 c sitieni 2 5.
Aprēķins dod vērtību:
c sitieni = 960 + 4 ⋅ 810 5 = 840 J/(kg ⋅ K).
Tāpēc maisījuma īpatnējā siltumietilpība ir 840 J/(kg ⋅ K).
