რა ერთეულებით იზომება სითბოს სიმძლავრე? გაზების თბოტევადობა. სითბოს სიმძლავრის სახეები
სხეულის სითბოს სიმძლავრე არის სითბოს რაოდენობა, რომელიც უნდა გადაეცეს მოცემულ სხეულს, რათა მისი ტემპერატურა ერთი გრადუსით გაიზარდოს. ერთი გრადუსით გაგრილებისას სხეული გამოსცემს იმავე რაოდენობის სითბოს. სითბოს ტევადობა სხეულის მასის პროპორციულია. სხეულის ერთეული მასის სითბურ ტევადობას სპეციფიკური ეწოდება, ხოლო ატომური ან მოლეკულური მასით სპეციფიკური სითბოს ნამრავლს შესაბამისად ატომური ან მოლური.
სითბოს სიმძლავრეები სხვადასხვა ნივთიერებებიძალიან განსხვავდება ერთმანეთისგან. Ისე, სპეციფიკური სითბოწყალი 20 ° C-ზე არის 4200 ჯ/კგ K, ფიჭვის ხე - 1700, ჰაერი - 1010. ლითონებისთვის ეს ნაკლებია: ალუმინი - 880 ჯ/კგ K, რკინა - 460, სპილენძი - 385, ტყვია - 130. სპეციფიკური სითბო ტემპერატურის მატებასთან ერთად ოდნავ იზრდება (90°C-ზე, წყლის თბოტევადობა 4220 ჯ/კგ კ) და მნიშვნელოვნად იცვლება ფაზური გარდაქმნების დროს: ყინულის თბოტევადობა 0°C-ზე 2-ჯერ ნაკლებია წყლისაზე; წყლის ორთქლის სითბოს სიმძლავრე 100°C-ზე არის დაახლოებით 1500 ჯ/კგ კ.
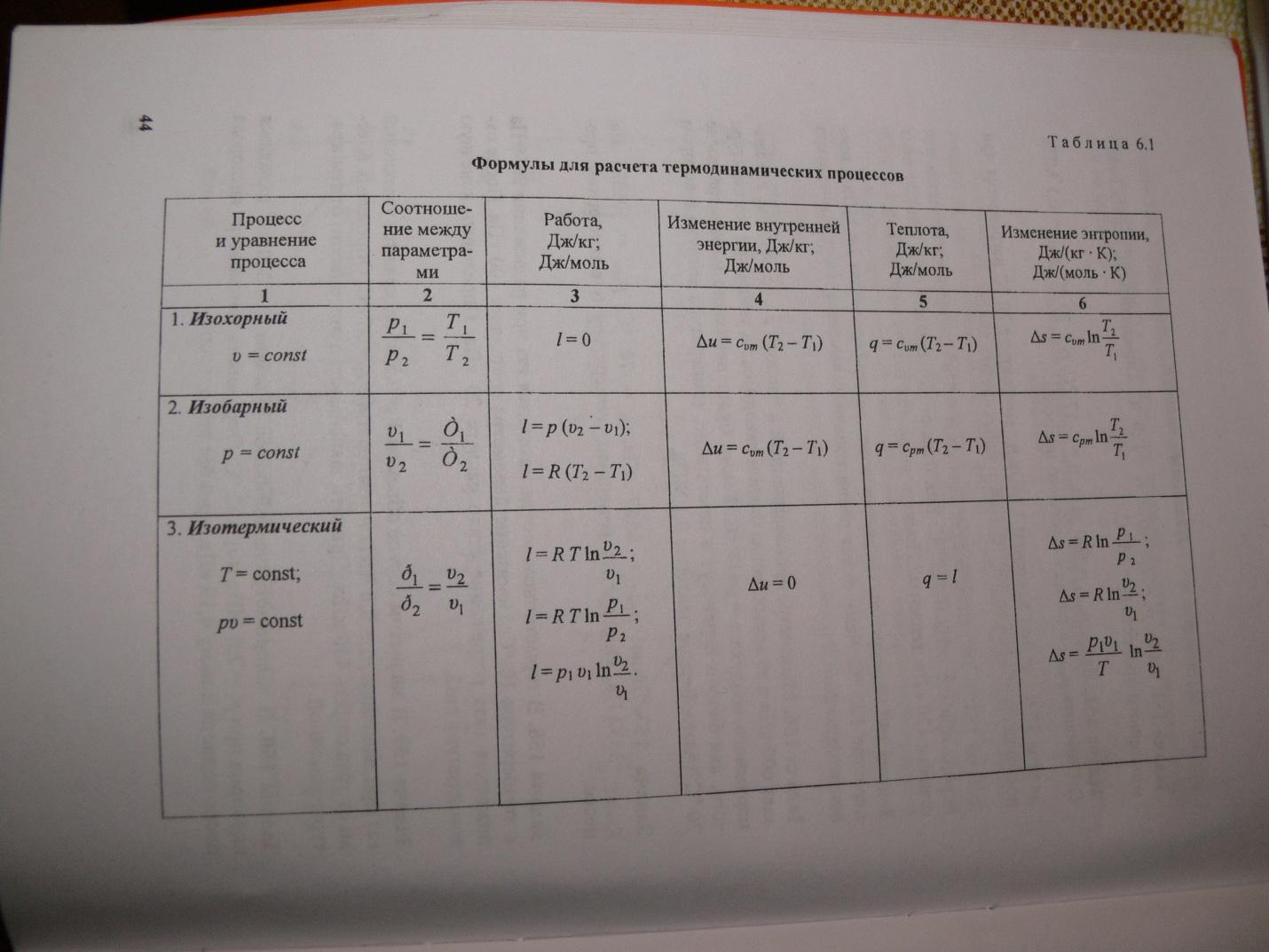
სითბოს სიმძლავრე დამოკიდებულია იმ პირობებზე, რომლებშიც იცვლება სხეულის ტემპერატურა. თუ სხეულის ზომები არ იცვლება, მაშინ მთელი სითბო მიდის შიდა ენერგიის შეცვლაზე. აქ ვსაუბრობთ სითბოს სიმძლავრეზე მუდმივ მოცულობაზე. მუდმივი გარე წნევის დროს, თერმული გაფართოების გამო, მექანიკური სამუშაოები ხორციელდება გარე ძალების წინააღმდეგ, ხოლო კონკრეტულ ტემპერატურაზე გათბობა მოითხოვს მეტ სითბოს. ამიტომ, მუდმივი წნევის დროს სითბოს სიმძლავრე ყოველთვის მეტია. ამისთვის იდეალური აირები(იხ. სურათი), სადაც R არის გაზის მუდმივი, ტოლია 8,32 ჯ/მოლ K.
ჩვეულებრივ იზომება. კლასიკური გზასითბოს სიმძლავრის გაზომვები შემდეგია: სხეული, რომლის სითბური სიმძლავრე უნდა გაიზომოს, თბება გარკვეულ ტემპერატურამდე და მოთავსებულია კალორიმეტრში საწყისი ტემპერატურით 0, ივსება წყლით ან სხვა სითხით ცნობილი სითბოს ტევადობით და - სითბოს ტევადობით. კალორიმეტრი და სითხე).
თერმული წონასწორობის დამყარების შემდეგ კალორიმეტრში ტემპერატურის გაზომვით, სხეულის სითბოს სიმძლავრე შეიძლება გამოითვალოს ფორმულის გამოყენებით:
![]()
სად და არის სხეულის მასები, სითხე და კალორიმეტრი.
ყველაზე განვითარებული თეორია არის აირების სითბოს სიმძლავრე. ჩვეულებრივ ტემპერატურაზე, გათბობა ძირითადად იწვევს გაზის მოლეკულების მთარგმნელობითი და ბრუნვის მოძრაობის ენერგიის ცვლილებას. მონატომური აირების მოლური სითბური სიმძლავრისთვის თეორია იძლევა , დიატომურ და პოლიატომურ - და . ძალიან დაბალ ტემპერატურაზე კვანტური ეფექტების გამო სითბოს სიმძლავრე გარკვეულწილად ნაკლებია (იხ. Კვანტური მექანიკა). ზე მაღალი ტემპერატურაემატება ვიბრაციული ენერგია და ტემპერატურის მატებასთან ერთად იზრდება პოლიატომური აირების სითბოს სიმძლავრე.
კრისტალების ატომური სითბური ტევადობა, კლასიკური თეორიის მიხედვით, უდრის , რაც შეესაბამება დულონგისა და პეტიტის ემპირიულ კანონს (დაადგინეს 1819 წელს ფრანგმა მეცნიერებმა პ. დულონგი და ა. პეტი). კვანტური თეორიასითბოს სიმძლავრე იწვევს იმავე დასკვნას მაღალ ტემპერატურაზე, მაგრამ პროგნოზირებს სითბოს სიმძლავრის შემცირებას ტემპერატურის შემცირებით. აბსოლუტურ ნულთან ახლოს, ყველა სხეულის სითბოს სიმძლავრე ნულისკენ მიისწრაფვის (თერმოდინამიკის მესამე კანონი).
სხეულის სითბოს მოცულობა- ეს ფიზიკური რაოდენობა, განისაზღვრება სხეულის მიერ გაცხელებისას შთანთქმული სითბოს რაოდენობის თანაფარდობით მისი ტემპერატურის ცვლილებასთან:
სხეულის სითბური სიმძლავრის ფიზიკური მნიშვნელობა: სხეულის სითბური ტევადობა ტოლია სხეულის მიერ გაცხელებისას შთანთქმის ან 1K-ით გაციებისას გამოთავისუფლებული სითბოს რაოდენობას.
ვინაიდან სითბოს სიმძლავრეები ცვალებადია, ისინი განასხვავებენ საშუალო და ნამდვილ სითბოს სიმძლავრეს. საშუალო სითბოს სიმძლავრის ქვეშ გვესმის სითბოს რაოდენობის თანაფარდობა ქ , შეჯამებულია ნივთიერების (აირის) რაოდენობის ერთეულამდე, მისი ტემპერატურის ცვლილებამდე ტ 1 ადრე ტ 2 იმ პირობით, რომ ტემპერატურის სხვაობა ტ 2 – ტ 1 არის სასრული მნიშვნელობა. საშუალო მასა, მოცულობა და მოლური სითბოს სიმძლავრეები, შესაბამისად, აღინიშნება გ მ , გ მ ' და მ . საშუალო სითბოს სიმძლავრის განსაზღვრებიდან გამომდინარეობს, რომ თუ აირის ტემპერატურა იზრდება ტ 1 ადრე ტ 2 მაშინ მისი საშუალო სითბოს სიმძლავრე [კჯ / (კგ * კ)]
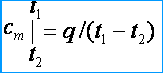
ჭეშმარიტი სითბოს სიმძლავრის ქვეშ გვესმის გაზის სითბოს სიმძლავრე, რომელიც შეესაბამება გაზის ტემპერატურის უსასრულოდ მცირე ცვლილებას, რომელიც შეესაბამება ტემპერატურის უსასრულოდ მცირე ცვლილებას. dt , ე.ი.
c = dq/dt,
სადაც dq=cdt.
სპეციფიკური სითბოარის სხვადასხვა ნივთიერების უნარი შთანთქას სითბოს გაცხელებისას. ნივთიერების სპეციფიკური თბოტევადობა განისაზღვრება მის მიერ გაცხელებისას მიღებული სითბოს რაოდენობის თანაფარდობით ნივთიერების მასასთან და მისი ტემპერატურის ცვლილებით, თუ: ![]()
ურთიერთობას, რომელიც გამოხატავს ურთიერთობას მოლარულ სითბოს სიმძლავრეებს შორის Cp და CV აქვს ფორმა (მაიერის ფორმულა): Cp = CV + R. ან უფრო გაფართოებული სითბოს სიმძლავრე იდეალური გაზითუ სითბოს გადაცემის შედეგად სითბოს გარკვეული რაოდენობა გადაეცემა სხეულს, მაშინ იცვლება სხეულის შინაგანი ენერგია და მისი ტემპერატურა. სითბოს Q რაოდენობას, რომელიც საჭიროა 1 კგ ნივთიერების 1 K-ით გასათბობად, c ნივთიერების სპეციფიკური სითბო ეწოდება. c = Q / (mΔT). ხშირ შემთხვევაში, მოსახერხებელია მოლური სითბოს სიმძლავრის გამოყენება C: C = M c, სადაც M არის ნივთიერების მოლური მასა. ამ გზით განსაზღვრული სითბოს სიმძლავრე არ არის ნივთიერების ცალსახა მახასიათებელი. თერმოდინამიკის პირველი კანონის მიხედვით, სხეულის შინაგანი ენერგიის ცვლილება დამოკიდებულია არა მხოლოდ მიღებული სითბოს რაოდენობაზე, არამედ სხეულის მიერ შესრულებულ სამუშაოზე. სითბოს გადაცემის პროცესის პირობებიდან გამომდინარე, სხეულს შეეძლო სხვადასხვა სამუშაოს შესრულება. ამრიგად, სხეულზე გადაცემული სითბოს ერთნაირი რაოდენობა შეიძლება გამოიწვიოს მისი შინაგანი ენერგიისა და, შესაბამისად, ტემპერატურის განსხვავებული ცვლილებები. ასეთი გაურკვევლობა თბოტევადობის განსაზღვრისას დამახასიათებელია მხოლოდ აირისებრი ნივთიერებისთვის. როდესაც თხევადი და მყარი სხეულები თბება, მათი მოცულობა პრაქტიკულად არ იცვლება და გაფართოების მუშაობა ნულის ტოლია. ამრიგად, სხეულის მიერ მიღებული სითბოს მთელი რაოდენობა მიდის მისი შინაგანი ენერგიის შეცვლაზე. სითხეებისგან განსხვავებით და მყარი, გაზს სითბოს გადაცემის პროცესში შეუძლია მნიშვნელოვნად შეცვალოს მისი მოცულობა და გააკეთოს მუშაობა. მაშასადამე, აირისებრი ნივთიერების თბოტევადობა დამოკიდებულია თერმოდინამიკური პროცესის ბუნებაზე. ჩვეულებრივ, განიხილება გაზების სითბოს სიმძლავრის ორი მნიშვნელობა: CV არის მოლური სითბოს სიმძლავრე იზოქორიულ პროცესში (V = const) და Cp არის მოლური სითბოს სიმძლავრე იზობარულ პროცესში (p = const). მუდმივი მოცულობის პროცესში გაზი არ მუშაობს: A = 0. თერმოდინამიკის პირველი კანონიდან 1 მოლ გაზზე მოდის QV = CVΔT = ΔU. გაზის შიდა ენერგიის ΔU ცვლილება პირდაპირპროპორციულია მისი ტემპერატურის ΔT ცვლილებისა. მუდმივი წნევის დროს პროცესისთვის თერმოდინამიკის პირველი კანონი იძლევა: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, სადაც ΔV არის იდეალური გაზის 1 მოლის მოცულობის ცვლილება, როდესაც მისი ტემპერატურა იცვლება ΔT-ით. აქედან გამომდინარეობს: თანაფარდობა ΔV / ΔT შეიძლება ვიპოვოთ იდეალური გაზის მდგომარეობის განტოლებიდან, რომელიც დაწერილია 1 მოლზე: pV = RT, სადაც R არის გაზის უნივერსალური მუდმივი. p = const-ზე ამგვარად, ურთიერთობას, რომელიც გამოხატავს ურთიერთობას მოლური სითბოს სიმძლავრეებს შორის Cp და CV, აქვს ფორმა (მაიერის ფორმულა): Cp = CV + R.
აირის მუდმივი რიცხობრივად უდრის 1 მოლი იდეალური აირის გაფართოების სამუშაოს მუდმივი წნევის ქვეშ 1 K-ით გაცხელებისას. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8.31(44) Dzh/ (მოლ K)
უნივერსალური აირის მუდმივა არის უნივერსალური, ფუნდამენტური ფიზიკური მუდმივა R, რომელიც ტოლია ბოლცმანის მუდმივის k და ავოგადროს მუდმივის ნამრავლის.
ფიზიკური მნიშვნელობა: გაზის მუდმივი i რიცხობრივად უდრის იდეალური აირის ერთი მოლის გაფართოების მუშაობას იზობარულ პროცესში ტემპერატურის 1 კ-ით ზრდით.
CGS სისტემაში გაზის მუდმივია:
სპეციფიკური გაზის მუდმივი არის:
ადიაბატური ექსპონენტი(ზოგჯერ ეძახიან კოეფიციენტიპუასონი) - სითბოს სიმძლავრის თანაფარდობა მუდმივ წნევაზე () სითბოს სიმძლავრის მუდმივ მოცულობაზე (). ზოგჯერ მას ასევე უწოდებენ ფაქტორი იზენტროპული გაფართოებები. აღინიშნება ბერძნული ასოთი (გამა) ან (კაპა). ასო სიმბოლო ძირითადად გამოიყენება ქიმიური ინჟინერიის დისციპლინებში. სითბოს ინჟინერიაში გამოიყენება ლათინური ასო.
გაზების ნარევი არის რამდენიმე განსხვავებული აირის ერთობლიობა, რომლებიც განსახილველ პირობებში არ შედის ქიმიურ რეაქციებში ერთმანეთთან.
აირების ნარევი არის ერთგვაროვანი თერმოდინამიკური სისტემა (რომელშიც არ არსებობს ინტერფეისები, რომლებიც გამოყოფს სისტემის მაკროსკოპულ ნაწილებს ერთმანეთისგან, განსხვავდება მათი თვისებებითა და შემადგენლობით).
ნაწილობრივი წნევა ნარევში i-ე აირის P i არის წნევა, რომლის ქვეშ იქნება ეს აირი, თუ ყველა სხვა აირი ამოღებულ იქნა ნარევიდან და V და T იგივე დარჩებოდა.
დალტონის კანონი - აირების ნარევის წნევა, რომელიც ქიმიურად არ ურთიერთქმედებს ერთმანეთთან, უდრის ამ გაზების ნაწილობრივი წნევის ჯამს.
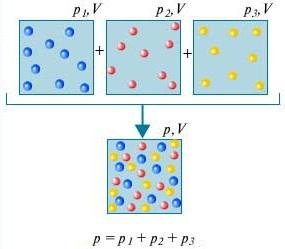
რათა გავიგოთ რა არის დალტონის კანონი, ამისათვის გაითვალისწინეთ ოთახში არსებული ჰაერი. ეს არის რამდენიმე აირის ნარევი: აზოტი (80%), ჟანგბადი (20%). თითოეული ამ აირის ნაწილობრივი წნევა არის წნევა, რომელიც ექნებოდა გაზს, თუ ის მარტო დაიკავებდა მთელ მოცულობას. მაგალითად, თუ აზოტის გარდა ყველა აირი ამოღებულია ოთახიდან, მაშინ დარჩენილის წნევა იქნება აზოტის ნაწილობრივი წნევა. დალტონის კანონიაცხადებს, რომ ყველა აირის მთლიანი წნევა ერთად აღებული უდრის თითოეული აირის ცალ-ცალკე აღებული პარციალური წნევის ჯამს. (მკაცრად რომ ვთქვათ, კანონი ვრცელდება მხოლოდ იდეალურ გაზებზე, მაგრამ საკმარისად კარგი მიახლოებით ის ასევე აღწერს რეალურ გაზებს.)
თერმოდინამიკის პირველი კანონი არის ენერგიის შენარჩუნებისა და გარდაქმნის კანონის განზოგადება თერმოდინამიკური სისტემისთვის. იგი ჩამოყალიბებულია შემდეგნაირად:
შეცვალეთ Δუ არაიზოლირებული თერმოდინამიკური სისტემის შიდა ენერგია უდრის სხვაობას სითბოს რაოდენობას შორისქ გადაეცემა სისტემას და მუშაობსა , სრულყოფილი სისტემა გარე სხეულებზე.
|
თერმოდინამიკის პირველი კანონის გამომხატველი მიმართება ხშირად იწერება განსხვავებული ფორმით:
|
სისტემის მიერ მიღებული სითბოს რაოდენობა გამოიყენება მისი შიდა ენერგიის შესაცვლელად და გარე სხეულებზე მუშაობის შესასრულებლად.
თერმოდინამიკის პირველი კანონი არის ექსპერიმენტული ფაქტების განზოგადება. ამ კანონის მიხედვით, ენერგია არ შეიძლება შეიქმნას ან განადგურება; ის ერთი სისტემიდან მეორეში გადადის და ერთი ფორმიდან მეორეში გარდაიქმნება. თერმოდინამიკის პირველი კანონის მნიშვნელოვანი შედეგია მტკიცება, რომ შეუძლებელია შეიქმნას მანქანა, რომელსაც შეუძლია სასარგებლო სამუშაოს შესრულება გარედან ენერგიის მოხმარების გარეშე და თავად მანქანაში ცვლილებების გარეშე. ასეთ ჰიპოთეტურ მანქანას ე.წ მარადიული მოძრაობის მანქანა (perpetuum mobile) პირველი სახის . ასეთი აპარატის შექმნის მრავალი მცდელობა უცვლელად მთავრდებოდა მარცხით. ნებისმიერ მანქანას შეუძლია დადებითი სამუშაოს შესრულება აგარე სხეულებზე მხოლოდ გარკვეული რაოდენობის სითბოს მიღებით ქმიმდებარე სხეულებიდან ან Δ-ის შემცირება უმისი შინაგანი ენერგია.
მოდით გამოვიყენოთ თერმოდინამიკის პირველი კანონი გაზების იზოპროცესებზე.
იზობარული გაფართოებით ქ> 0 - სითბოს შთანთქავს აირი და აირი ასრულებს დადებით მუშაობას. იზობარული შეკუმშვით ქ < 0 – тепло отдается внешним телам. В этом случае ა < 0. Температура газа при изобарном сжатии уменьшается, თ 2 < თერთი ; შინაგანი ენერგია მცირდება, Δ უ < 0.
AT იზოთერმული პროცესიგაზის ტემპერატურა არ იცვლება, შესაბამისად, გაზის შიდა ენერგია, Δ უ = 0.
AT იზოქორული პროცესი (ვ= const) გაზი არ მუშაობს, ა= 0. ამიტომ,
თერმოდინამიკის პირველი კანონი იზობარული პროცესისთვის იძლევა:
|
თერმოდინამიკის პირველი კანონი იზოთერმული პროცესისთვის გამოიხატება მიმართებით
|
სითბოს რაოდენობა ქიზოთერმული გაფართოების პროცესში მიღებული აირით, იქცევა სამუშაოდ გარე სხეულებზე. იზოთერმული შეკუმშვისას გაზზე წარმოქმნილი გარე ძალების მუშაობა გარდაიქმნება სითბოდ, რომელიც გადაეცემა მიმდებარე სხეულებს.
იზოქორიულ, იზობარულ და იზოთერმულ პროცესებთან ერთად, თერმოდინამიკა ხშირად განიხილავს პროცესებს, რომლებიც ხდება მიმდებარე სხეულებთან სითბოს გაცვლის არარსებობის შემთხვევაში. საიზოლაციო კედლების მქონე გემები ე.წ ადიაბატური ჭურვები, და ასეთ ჭურჭელში აირის გაფართოების ან შეკუმშვის პროცესებს ე.წ ადიაბატური.
AT ადიაბატური პროცესიქ= 0; ასე რომ, თერმოდინამიკის პირველი კანონი იღებს ფორმას
|
|
|
მისი ფიზიკური მნიშვნელობით, თერმოდინამიკის პირველი კანონი არის თერმოდინამიკაში ენერგიის შენარჩუნების (ცვლის) კანონი. თუ მექანიკაში ენერგიის ცვლილების კანონის მიხედვით, არაკონსერვატიული ძალების მუშაობა უდრის სისტემის მექანიკური ენერგიის ზრდას (კერძოდ, უარყოფითი ნიშნის მქონე ხახუნის ძალების მუშაობა უდრის შემცირებას სისტემის მექანიკური ენერგია), შემდეგ თერმოდინამიკის პირველი კანონის მიხედვით, თერმოდინამიკური სისტემის შინაგანი ენერგიის ზრდა უდრის გარე ძალების მუშაობის ჯამს, სრულყოფილი სისტემაზე და ენერგია გადაცემულია სისტემაზე. სისტემა სითბოს გადაცემით. ენთალპია(ბერძნულიდან. ენტალპო- გაცხელება) არის მატერიის თვისება, რაც მიუთითებს ენერგიის რაოდენობაზე, რომელიც შეიძლება გარდაიქმნას სითბოდ. ენთალპიაარის ნივთიერების თერმოდინამიკური თვისება, რომელიც მიუთითებს მის მოლეკულურ სტრუქტურაში შენახული ენერგიის დონეზე. ეს ნიშნავს, რომ მიუხედავად იმისა, რომ მატერიას შეიძლება ჰქონდეს ენერგია ტემპერატურაზე და წნევაზე დაფუძნებული, მისი მთელი სითბო ვერ გადაიქცევა. შინაგანი ენერგიის ნაწილი ყოველთვის რჩება ნივთიერებაში და ინარჩუნებს მის მოლეკულურ სტრუქტურას. ნივთიერების კინეტიკური ენერგიის ნაწილი მიუწვდომელია, როდესაც მისი ტემპერატურა გარემოს ტემპერატურას უახლოვდება. შესაბამისად, ენთალპიაარის ენერგიის რაოდენობა, რომელიც ხელმისაწვდომია სითბოში გადაქცევისთვის მოცემულ ტემპერატურასა და წნევაზე. ენთალპიის ერთეულები არის BTU ან ჯოული ენერგიისთვის და Btu/lbm ან J/kg კონკრეტული ენერგიისთვის. 11 კითხვა |

სამუშაოს მიზანი:მასალების თბოტევადობის ექსპერიმენტული განსაზღვრა.
აღჭურვილობა:სასწორი, წონა, კალორიმეტრი, ლითონის ცილინდრი ცნობილი თბოტევადობით, ჭიქა, გამათბობელი, კაუჭი.
მოკლე თეორია:
ყველა მაკროსკოპულ სხეულს და სხეულთა სისტემას, გარდა მექანიკური ენერგიისა, მათი მოძრაობისა და ურთიერთქმედების გამო, აქვს ენერგია, რომელიც დამოკიდებულია მათ შინაგან მდგომარეობაზე. ამ ენერგიას, რომელიც არის სხეულის შემადგენელი ყველა ნაწილაკების მოძრაობისა და ურთიერთქმედების ენერგია, შიდა ეწოდება.
შინაგანი ენერგია მოიცავს მოლეკულებისა და ატომების თერმული მოძრაობის კინეტიკურ ენერგიას, რომლებიც ქმნიან მოცემულ სხეულს, ელექტრონების კინეტიკურ ენერგიას, რომლებიც მოძრაობენ ბირთვების გარშემო ატომებში, მოლეკულებს, ატომებს, ელექტრონებსა და ბირთვებს შორის ურთიერთქმედების პოტენციურ ენერგიას, ნუკლეონებს ბირთვში. და ა.შ. შინაგანი ენერგიის ცნება არ მოიცავს მოცემული სხეულის კინეტიკურ და პოტენციურ ენერგიას მთლიანობაში.
შიდა ენერგია ცალსახად განისაზღვრება მოცემული სისტემის მდგომარეობის დამახასიათებელი პარამეტრების სიმრავლით, ე.ი. არის ამ სისტემის მდგომარეობის ერთმნიშვნელოვანი ფუნქცია.
შიდა ენერგია ჩვეულებრივ აღინიშნება ასო U-ით.
თერმულ ფენომენებში, რომლებიც ხდება ფაზური გადასვლების ტემპერატურებისგან შორს, შიდა ენერგიის ცვლილება DU დაკავშირებულია მოლეკულების კინეტიკური და პოტენციური ენერგიის ცვლილებასთან, ხოლო შიდა ენერგიის დარჩენილი კომპონენტები არ იცვლება. ამრიგად, ასეთ პროცესებში შეგვიძლია ვივარაუდოთ, რომ სხეულის შინაგანი ენერგია უდრის ყველა მოლეკულის ქაოტური თერმული მოძრაობის კინეტიკური ენერგიის ჯამს ამ სხეულის მასის ცენტრთან და ყველა ურთიერთქმედების პოტენციურ ენერგიასთან. მოლეკულები ერთმანეთთან.
როდესაც სხეულის მდგომარეობა იცვლება, მისი შინაგანი ენერგია იცვლება. მაგალითად, როდესაც სხეულის ტემპერატურა იზრდება, მისი შინაგანი ენერგია იზრდება, რადგან ამ სხეულის მოლეკულების მოძრაობის საშუალო კინეტიკური ენერგია იზრდება. ტემპერატურის კლებასთან ერთად მცირდება სხეულის შინაგანი ენერგია.
სხეულის შინაგანი ენერგია შეიძლება შეიცვალოს სხვადასხვა გზები. მაგალითად, შინაგანი ენერგია იცვლება, როდესაც მოცემულ სხეულზე გარე ძალები ასრულებენ მექანიკურ მუშაობას მისი დეფორმაციის დროს და ასევე სამუშაოს გარეშე, როდესაც სხეული კონტაქტშია სხვა სხეულთან (ან გარემოსთან), რომელსაც აქვს უფრო მაღალი ან დაბალი ტემპერატურა, ვიდრე მოცემული სხეული.
სხეულის შინაგანი ენერგიის შეცვლის პროცესს მექანიკური სამუშაოს შესრულების გარეშე სითბოს გადაცემა ან სითბოს გადაცემა ეწოდება. სითბოს გადაცემის სამი ტიპი არსებობს: კონვექცია, გამტარობა და გამოსხივება.
სითბოს გაცვლის დროს არ ხდება ენერგიის გადაქცევა ერთი ტიპიდან მეორეზე. სითბოს გადაცემის პროცესი შედგება იმაში, რომ უფრო ცხელი სხეულის შიდა ენერგიის ნაწილი გადადის ნაკლებად ცხელ სხეულზე (ან საშუალოზე).
სითბოს გადაცემის პროცესების დასახასიათებლად შემოღებულია სითბოს რაოდენობის ცნება, რომელსაც ეწოდება სიდიდე, რომელიც წარმოადგენს სხეულის შიდა ენერგიის ცვლილების რაოდენობრივ საზომს სითბოს გადაცემის პროცესში.
უნდა გვახსოვდეს, რომ სხეულს შეუძლია მხოლოდ ენერგიის მიცემა ან მიღება, ხოლო სითბოს Q რაოდენობა მხოლოდ სხეულის მიერ სითბოს გადაცემის პროცესში მიცემული ან მიღებული ენერგიის რიცხვითი ეკვივალენტია.
სითბოს რაოდენობა დამოკიდებულია პროცესის ტიპზე და არ არის სისტემის მდგომარეობის ფუნქცია.
სხეულის გასათბობად საჭირო სითბოს რაოდენობა, რომელიც ხდება ფაზური გარდაქმნების გარეშე (ნივთიერების აგრეგაციის მდგომარეობის შეცვლის გარეშე):
სადაც c არის სხეულის სპეციფიკური სითბური სიმძლავრე, რომელიც განისაზღვრება სხეულის m მასაზე გადაცემული სითბოს რაოდენობის თანაფარდობით და ტემპერატურის ცვლილების შედეგად DT, m არის სხეულის მასა, DT არის სხვაობა საბოლოოს შორის. და მოცემული სხეულის საწყისი ტემპერატურა.
სითბოს რაოდენობას, რომელიც უნდა გადაეცეს სხეულს მისი ტემპერატურის ერთი კელვინით ამაღლების მიზნით, ამ ნივთიერების სითბოს სიმძლავრე ეწოდება. როდესაც ერთი კელვინით გაცივდება, სხეული იმავე რაოდენობით სითბოს გამოსცემს. სხეულის სითბური ტევადობა სხეულის მასის პროპორციულია და დამოკიდებულია იმ ნივთიერებაზე, რომლისგანაც იგი შედგება. ერთეულების SI სისტემაში სითბოს სიმძლავრე იზომება J/K-ში.
ნივთიერების თერმული თვისებების დასახასიათებლად აღებულია ამ ნივთიერების ერთეული მასის თბოტევადობა. ამ მახასიათებელს ეწოდება სპეციფიკური სითბოს სიმძლავრე. ის უდრის მოცემული სხეულის სითბოს სიმძლავრის თანაფარდობას მის მასასთან. SI სისტემით სპეციფიკური სითბოს სიმძლავრე იზომება J / (კგ × K).
ექსპერიმენტულად, ლითონის სხეულის სპეციფიკური სითბო განისაზღვრება კალორიმეტრისა და თერმომეტრის გამოყენებით. უმარტივესი კალორიმეტრი შედგება გაპრიალებული ლითონის შუშისგან, რომელიც მოთავსებულია სხვა შუშის შიგნით საცობებზე (თბოიზოლაციის მიზნით). შიდა მინა ივსება წყლით ან სხვა სითხით ცნობილი სპეციფიკური სითბოს სიმძლავრის მქონე. გარკვეულ ტემპერატურაზე t გაცხელებული სხეული ქვეითდება კალორიმეტრში. სხეულის დაწევამდე სითხის ტემპერატურა კალორიმეტრში იყოს t 1, ხოლო სითხისა და მასში ჩაშვებული სხეულის თერმული წონასწორობის დამყარების შემდეგ მათი საერთო ტემპერატურა გახდება q-ის ტოლი.
ენერგიის შენარჩუნების კანონიდან გამომდინარეობს, რომ:
Q \u003d Q 1 + Q 2,(2)
სად არის სითბოს რაოდენობა ქგახურებული სხეულის მიერ მოცემული უდრის სითბოს რაოდენობის ჯამს Q1,მიღებული წყლით და Q2,მიღებული კალორიმეტრით.
(1) გათვალისწინებით, ჩვენ ვწერთ (2) შემდეგნაირად:
სმ (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
სადაც გ 1და მ 1- სითბოს სპეციფიკური სიმძლავრე და წყლის მასა კალორიმეტრში, გ 2და მ2- სპეციფიკური სითბოს მოცულობა და კალორიმეტრის მასა. ამ განტოლებას ეწოდება სითბოს ბალანსის განტოლება. მისგან ვპოულობთ სხეულის სპეციფიკურ სითბოს სიმძლავრეს:
შესაძლებელია ამ პრობლემის გადაწყვეტას სხვანაირად მივუდგეთ, დავუშვათ, რომ ერთი ექსპერიმენტის ფარგლებში ენერგიის დანაკარგები იგივე იქნება. სხეული თანცნობილი სპეციფიკური სითბოს სიმძლავრე, თბება გარკვეულ ტემპერატურამდე ტ, დაშვებულია კალორიმეტრში, რომლის ტემპერატურაც იცვლება. შემდეგ სითბოს ბალანსის განტოლება მიიღებს ფორმას:
სმ(t-q) = c 1 m 1 (q-t 1) + Q დაკარგვა,(5)
სადაც Q დაკარგვაარის კალორიმეტრის მიერ მიღებული სითბოს რაოდენობა და გარემო, შესაბამისად:
Q დაკარგვა, = სმ (t-q) - c 1 მ 1 (q-t 1). (6)
თუ სხეული, რომელსაც აქვს უცნობი სპეციფიკური სითბური სიმძლავრე, რომელიც გაცხელებულია იმავე ტემპერატურაზე, დაშვებულია კალორიმეტრში, მაშინ სითბოს ბალანსის განტოლება მიიღებს ფორმას:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q დანაკარგები,(7)
სადაც მ¢ 1არის წყლის მასა კალორიმეტრში და t¢ 1- წყლის ტემპერატურა ამ ექსპერიმენტში. შემდეგ:
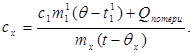 (8)
(8)
მნიშვნელობის (6) (8) ჩანაცვლებით მივიღებთ:
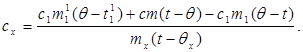 (9)
(9)
სად არის სითბოს ელემენტარული რაოდენობა; - ტემპერატურის ელემენტარული ცვლილება.
სითბოს სიმძლავრე რიცხობრივად უდრის სითბოს რაოდენობას, რომელიც უნდა მიეწოდოს სისტემას, რათა მოცემულ პირობებში მისი ტემპერატურა 1 გრადუსით გაიზარდოს. ვინაიდან SI-ში სითბოს ერთეული არის ჯოული, ხოლო ტემპერატურა არის K ხარისხი, სითბოს სიმძლავრის ერთეული არის J/K.
სხეულის რაოდენობრივი ერთეულიდან გამომდინარე, რომელსაც სითბო მიეწოდება თერმოდინამიკაში, განასხვავებენ მასას, მოცულობას და მოლურ სითბოს სიმძლავრეებს.
მასობრივი სითბოს მოცულობაარის სითბოს სიმძლავრე სამუშაო სითხის მასის ერთეულზე,
სადაც და არის სხეულის მოცულობა და სიმკვრივე ნორმალურ ფიზიკურ პირობებში.
მოცულობითი სითბოს სიმძლავრე იზომება J/(m3 K).
მოლური სითბოს ტევადობა- სითბოს სიმძლავრე, მოხსენიებული სამუშაო სითხის (გაზის) რაოდენობა მოლში,
| , |
სადაც m3/mol არის გაზის მოლური მოცულობა ნორმალურ პირობებში.
იმის გათვალისწინებით, რომ სითბოს სიმძლავრე არ არის მუდმივი, მაგრამ დამოკიდებულია ტემპერატურაზე და სხვა თერმული პარამეტრებზე, განასხვავებენ ნამდვილ და საშუალო სითბოს სიმძლავრეს. ჩვეულებრივ, ჭეშმარიტი სითბოს სიმძლავრე გაგებულია, როგორც სითბოს ელემენტარული რაოდენობის თანაფარდობა, რომელიც ეცნობა თერმოდინამიკურ სისტემას ნებისმიერ პროცესში, ამ სისტემის ტემპერატურის უსასრულო მატებასთან, რომელიც გამოწვეულია გადაცემული სითბოთი. ჩვენ განვიხილავთ თერმოდინამიკური სისტემის ნამდვილ სითბოს სიმძლავრეს სისტემურ ტემპერატურაზე ტოლი , და - სამუშაო სითხის ნამდვილი სპეციფიკური სითბო მის ტემპერატურაზე ტოლია . შემდეგ სამუშაო სითხის საშუალო სპეციფიკური სითბოს სიმძლავრე, როდესაც მისი ტემპერატურა იცვლება მდე, შეიძლება განისაზღვროს როგორც
სხეულის შინაგანი ენერგიის განსაზღვრა.
შინაგანი ენერგიასხეული (მოხსენიებული როგორც ეან უ) არის მოლეკულური ურთიერთქმედების და მოლეკულის თერმული მოძრაობების ენერგიის ჯამი. კერძოდ, იდეალური გაზის შიდა ენერგია უდრის უწყვეტ და შემთხვევით თერმულ მოძრაობაში მყოფი ყველა გაზის ნაწილაკების კინეტიკური ენერგიის ჯამს. აქედან გამომდინარეობს ჯოულის კანონი, რომელიც დადასტურებულია მრავალი ექსპერიმენტით.
მოლეკულური კინეტიკური თეორია მივყავართ შემდეგ გამოხატულებას იდეალური ერთატომური გაზის ერთი მოლის შიდა ენერგიისთვის (ჰელიუმი, ნეონი და ა.შ.), რომლის მოლეკულები ასრულებენ მხოლოდ მთარგმნელობით მოძრაობას:
ამრიგად, შინაგანი ენერგია უსხეული ცალსახად განისაზღვრება სხეულის მდგომარეობის დამახასიათებელი მაკროსკოპული პარამეტრებით. ეს არ არის დამოკიდებული იმაზე, თუ როგორ განხორციელდა მოცემული მდგომარეობა. ჩვეულებრივ უნდა ითქვას, რომ შინაგანი ენერგია არის სახელმწიფო ფუნქცია.
TD-ში გამოიყენება შიდა ენერგიის ცვლილება და არა მისი აბსოლუტური მნიშვნელობა.
რა არის გაფართოების სამუშაო. TD-ის პირველი კანონი.
გაფართოების სამუშაო - მექანიკური სამუშაო, რომელსაც ახორციელებს მანქანა გარე წნევის ძალების წინააღმდეგ მისი გაფართოების პროცესში. როდესაც მოცულობა იცვლება, გაზი მუშაობს, V-ის ცვლილების ნიშანი ემთხვევა სამუშაოს ნიშანს
TD-ის პირველი კანონი: სისტემაში გადაცემული სითბო გამოიყენება შიდა ენერგიის გადასაყვანად და სამუშაოს შესასრულებლად.
სითბოს სახით ენერგიის მიღების (ან გაცემის) უნარის თვალსაზრისით, ჩვეულებრივ, თერმოდინამიკური სისტემის დახასიათება მისი სითბოს სიმძლავრის მიხედვით.
სხეულის (სისტემის) თბოტევადობა არის ფიზიკური სიდიდე, რომელიც რიცხობრივად უდრის სითბოს რაოდენობას, რომელიც უნდა გადაეცეს სხეულს (სისტემას), რათა შეიცვალოს მისი ტემპერატურა ერთი კელვინით.
თუ სხეულს მიეცემა უსასრულო რაოდენობის სითბო ქ, რამაც გამოიწვია ტემპერატურის უსასრულოდ მცირე მატება დT,შემდეგ მისი სითბოს მოცულობა თანგანსაზღვრებით უდრის
SI სითბური სიმძლავრის ერთეული არის ჯული გაყოფილი კელვინზე ( ჯ/რომ).
ექსპერიმენტები და თეორიული გამოთვლები ამას აჩვენებს სხეულის სითბოს ტევადობა დამოკიდებულია მის ქიმიურ შემადგენლობაზე, მასაზე და თერმოდინამიკურ მდგომარეობაზე(მაგალითად, ტემპერატურაზე), ასევე სხეულის მდგომარეობის შეცვლის პროცესის ტიპზე, როდესაც მას სითბო გადაეცემა.
სპეციფიკური სითბოს სიმძლავრე არის სითბოს სიმძლავრე ნივთიერების მასის ერთეულზე,ანუ ერთგვაროვანი ნივთიერებისთვის
![]() , (25.2)
, (25.2)
სადაც თან- სპეციფიკური სითბოს სიმძლავრე, მარის ნივთიერების მასა.
სპეციფიკური სითბოს SI ერთეული არის ჯული გაყოფილი კელვინ-კილოგრამზე [( ჯ/(რომ . კგ)].
მოლური სითბოს სიმძლავრე არის ნივთიერების ერთი მოლის სითბოს მოცულობა,ანუ
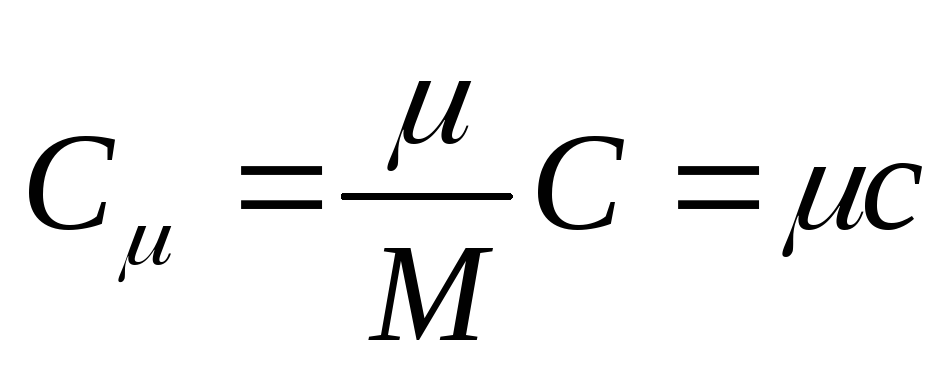 , (25.3)
, (25.3)
სადაც თან - მოლური სითბოს ტევადობა; არის ნივთიერების მოლური მასა.
მოლური სითბოს სიმძლავრის ერთეული SI-ში არის ჯული გაყოფილი კელვინ-მოლზე [ ჯ/(რომ . მოლი)].
სითბოს ელემენტარული რაოდენობა ქ, საჭიროა სხეულის ტემპერატურის შესაცვლელად დთ, განისაზღვრება როგორც
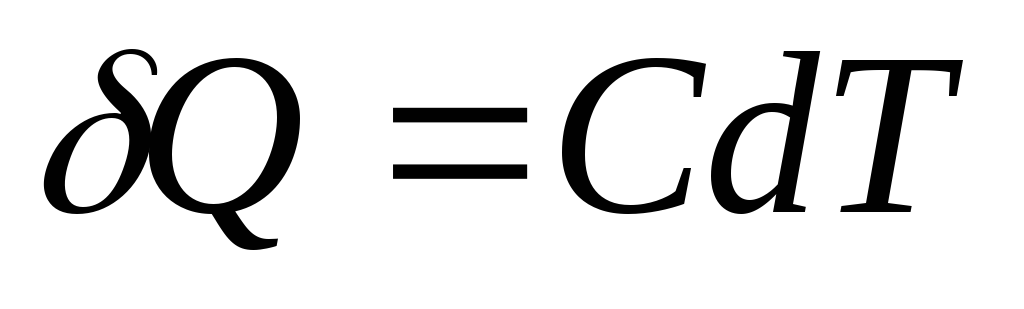 ,
,
და ერთგვაროვანი სხეულისთვის
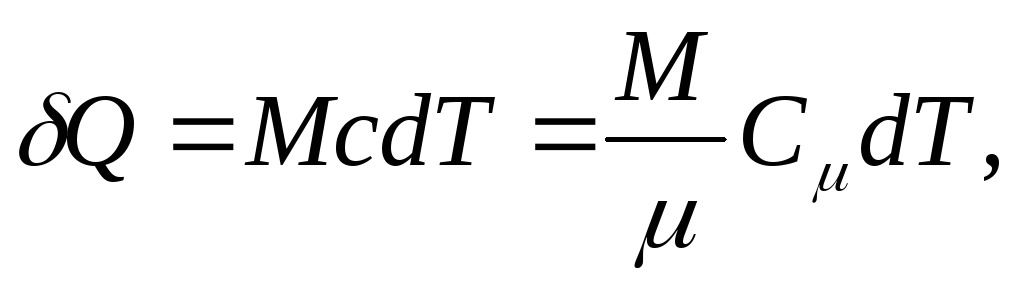 (25.4)
(25.4)
სადაც მ/ - ნივთიერების რაოდენობა (მოლების რაოდენობა).
§26. თერმოდინამიკის პირველი კანონი
თერმოდინამიკის პირველი კანონი (პირველი კანონი) არის ენერგიის შენარჩუნებისა და ტრანსფორმაციის კანონის მათემატიკური გამოხატულება, რომელიც გამოიყენება თერმოდინამიკურ სისტემებზე. იგი ჩამოყალიბდა ფიზიკისა და ქიმიის დარგში ექსპერიმენტული და თეორიული კვლევის შედეგად, რომლის საბოლოო ეტაპი იყო სითბოს და სამუშაოს ეკვივალენტობის აღმოჩენა, ანუ აღმოჩენა, რომ სითბოს გადაქცევა სამუშაოდ და სამუშაოდ. სითბო ყოველთვის ხორციელდება იმავე მკაცრად მუდმივი რაოდენობრივი თანაფარდობით.
§24-ში აღინიშნა, რომ სისტემის შიდა ენერგია შეიძლება შეიცვალოს ორი გზით: სამუშაოს შესრულებით და სითბოს გადაცემით. ამიტომ შეგვიძლია დავწეროთ:
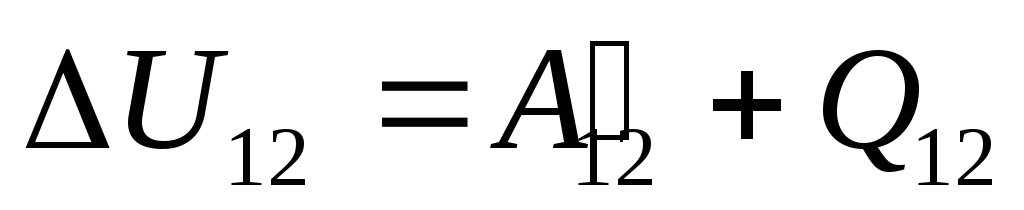 ,
(26.1)
,
(26.1)
სადაც
უ 12
-
სისტემის შინაგანი ენერგიის ცვლილება მდგომარეობიდან გადასვლისას 1
სახელმწიფოში 2
მასზე მუშაობის შედეგად 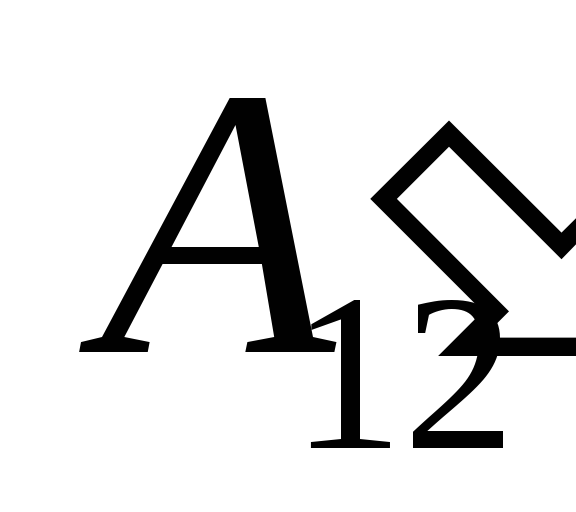 გარე სხეულებიდან და მას გარედან გარკვეული რაოდენობის სითბოს გადაცემა
გარე სხეულებიდან და მას გარედან გარკვეული რაოდენობის სითბოს გადაცემა  .
.
ჩვენ ვიცით ეს სამუშაო 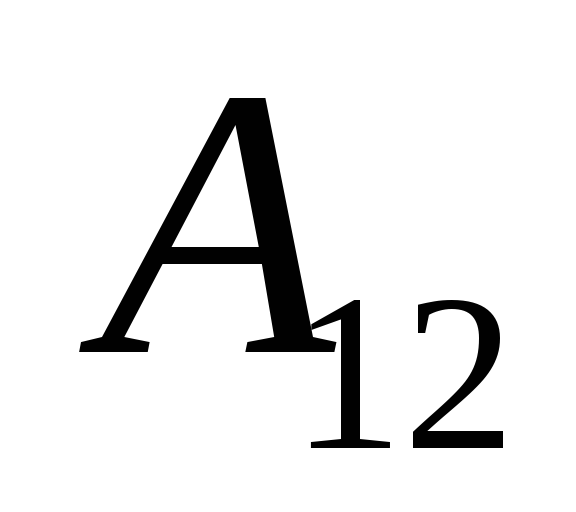 თავად სისტემის მიერ გარე სხეულებზე შესრულებული რიცხობრივად ტოლია და საპირისპირო ნიშნით სამუშაოს
თავად სისტემის მიერ გარე სხეულებზე შესრულებული რიცხობრივად ტოლია და საპირისპირო ნიშნით სამუშაოს  გარე სხეულები სისტემის ზემოთ, ანუ
გარე სხეულები სისტემის ზემოთ, ანუ
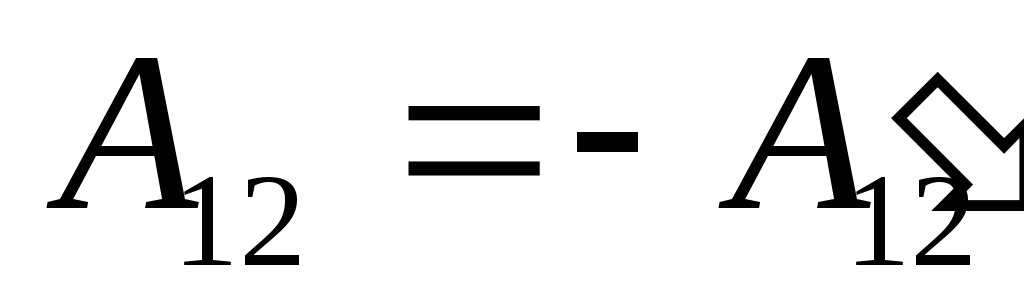 ,
(26.2)
,
(26.2)
ამიტომ გამონათქვამი (26.1) შეიძლება გადაიწეროს როგორც
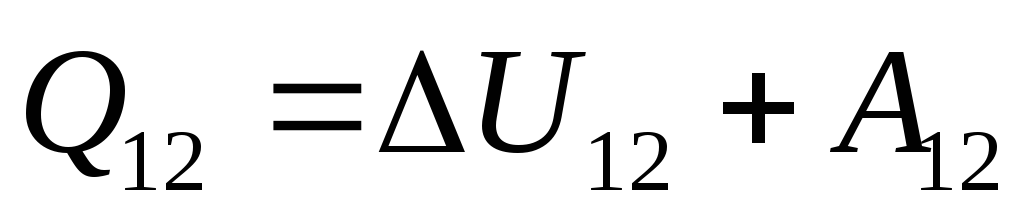 . (26.3)
. (26.3)
ეს განტოლება არის თერმოდინამიკის პირველი კანონის მათემატიკური ჩანაწერი: სისტემაში გადაცემული სითბოს რაოდენობა იხარჯება მისი შიდა ენერგიის შეცვლაზე და სისტემის მიერ გარე სხეულებზე სამუშაოს შესრულებაზე.
სისტემის მდგომარეობის უსასრულოდ მცირე ცვლილებით, განტოლება (26.3) იღებს ფორმას
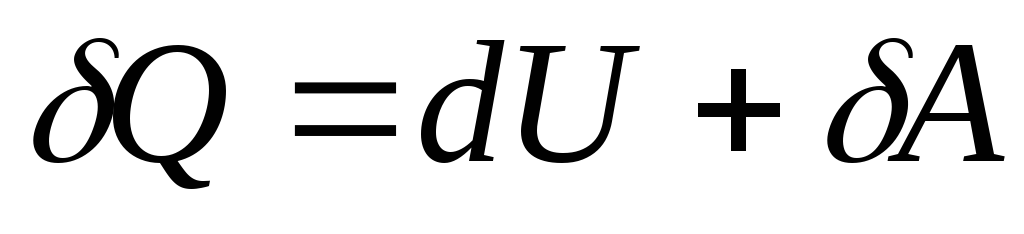 , (26.4)
, (26.4)
სადაც  - სისტემის შიდა ენერგიის უსასრულოდ მცირე ცვლილება, როდესაც მას სითბოს ელემენტარული რაოდენობა გადაეცემა.
ქდა სისტემის მიერ ელემენტარული სამუშაოს შესრულება
დაგარე სხეულებზე.
- სისტემის შიდა ენერგიის უსასრულოდ მცირე ცვლილება, როდესაც მას სითბოს ელემენტარული რაოდენობა გადაეცემა.
ქდა სისტემის მიერ ელემენტარული სამუშაოს შესრულება
დაგარე სხეულებზე.
