固体の熱容量を決定する方法
熱容量とは
熱が供給されると、システムの温度が上昇します。 無限に小さい温度変化の場合、比例関係は有効です
dT=δQ または dT=constδQ
この関係を次の形式で書くと便利です: δQ=СdT または
値 C は、システムの真の熱容量と呼ばれます。
熱容量は、発生する温度変化に対してシステムに供給される熱量の比率です。
真に加えて、平均熱容量もあります。
熱容量
熱容量が物質の単位質量(モル)に起因する場合、システム全体の質量とは無関係になり、集中的なパラメーターの特性を取得します。 熱容量が物質の単位質量を指す場合、それは特定と呼ばれ、1モル - J /(mol * k)の次元の熱容量
モル熱容量のみを考慮します。 それらの場合、すべての規則性は比熱容量の場合よりもはるかに単純です。
熱容量は、システムへの熱の伝達が行われる条件によって異なります。 システムが一定の体積で囲まれている場合、CvdTに等しい熱の作用でdTだけ温度が上昇します。ここで、Cvは一定の体積での熱容量です。 システムの膨張中に圧力が一定の場合、温度を dT だけ上昇させるには、熱 CpdT が必要になります。ここで、Cp は一定圧力での熱容量です。
熱伝達の条件が与えられ、1 つまたは複数の変数が一定に保たれ、他の変数が変化する場合、熱容量は偏導関数を使用して表すことができます。 ![]() . δQ v = dU であるため、
. δQ v = dU であるため、
δQ p =dH、次のように書くことができます。
![]() (1)
(1)
Cv はガスの等容熱容量、Cp はガスの等圧熱容量です。
等容熱容量と等圧熱容量の違いは、内部エネルギーとエンタルピーの違いによるものです。 エンタルピーと内部エネルギーの変化は、システムが行う仕事の量によって異なります。
δW=ΔnRT、ΔH-ΔU=ΔnRT
したがって、一定体積 Cv および一定圧力 Cp での熱容量も仕事量によって異なります。Cp - Cv = δW
式 (1) に基づいて、次のように記述できます。
これらの等式を式 ΔH- ΔU=ΔnRT に代入すると、
Δn= 1 を考慮に入れると、ガスのモル熱容量間の関係がわかります。
Cp– Cv= R または Cp= Cv+ R
ご覧のとおり、それらはガス定数の値によって異なります。
条件 Cp= Cv+ R から、Cp˃Cv、つまり等圧プロセスで P=const の場合、システムの温度を上げるには、次のことが必要です。 大量等容性プロセスよりも熱。
ガスのモル熱容量はRのオーダーの値を持つため、CpとCvの違いは非常に重要です。 したがって、25 ℃ の二酸化炭素 CO 2 の場合、Cp = 37, 14; Cv = 28.83 J / (mol * K)
Cp - Cv の差は、1 モルの等圧展開の仕事です。 理想気体気温が1度上がるとき。 体の液体と固体は、加熱すると体積がわずかに増加するのが特徴です。 したがって、凝縮体の場合、Ср ≈ Сv と仮定できます。
キルヒホッフ方程式。 温度に対する熱効果の依存性。
生成熱と燃焼のヘスの法則に基づく熱効果の以前に考慮された計算は、標準的な条件によって制限されます。 実際には、標準的な条件以外の特定の条件での熱効果を計算する必要があります。
標準的な条件下での既知の熱効果、つまり 25℃(298.15K)の温度および1気圧の圧力で。 (1.013 * 10 5 Pa) を使用して、関心のある任意の温度での熱効果を計算できます。 キルヒホッフの法則. 産業条件でのプロセスは、技術の条件だけでなく季節によっても決定される大きな温度変動によって特徴付けられます.この範囲は数百度に達する可能性があります-熱影響が発生するのは当然です.大きく異なり、温度に依存します。
キルヒホッフの法則を微分形式で考えてみましょう。 これを行うために、アイソバリックプロセスのエンタルピーと内部エネルギーの変化を書き留めます。
ΔH \u003d H 2 -H 1; ΔU \u003d U 2 -U 1.
これらの方程式を温度に関して微分し、次を取得します。
キルヒホッフ方程式:

そして - それぞれ等圧および等容プロセスの熱効果の温度係数; - それぞれ等圧プロセスと等容プロセスの結果としてのシステムの熱容量の変化。
キルヒホッフ方程式に基づいて、キルヒホッフの法則は微分形式で定式化されます。プロセスの熱効果の温度係数は、このプロセスの結果として発生するシステムの熱容量の変化に等しくなります。
したがって、微分形式のキルヒホッフの法則により、温度による熱効果の変化のみを決定でき、熱効果自体の大きさは決定できません。
キルヒホッフ方程式を分析してみましょう
反応の場合: aA + bB = dD + rR 等圧プロセス (р=const) で、キルヒホッフの法則によれば、システムの熱容量の変化は次の形式になります。
同様の式は、アイソコリック プロセスに対して取得できます。
キルヒホッフの法則により、温度の変化に伴うプロセスの熱効果の変化を判断できるため、グラフを作成します。
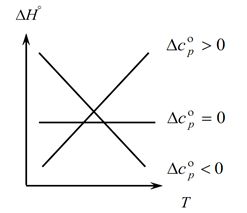
1. ∆Ср(∆Сv)˃0 の最初のケースを考えます。 ΔСр=∑С con. -ΣС 初期、したがって、反応生成物の熱容量の合計は出発物質の熱容量の合計よりも大きいことになります: ∑С con. ˃∑最初から この場合、グラフの曲線 1 が得られます。これは、温度が上昇すると、プロセスの熱効果の変化も増加することを意味します (T および ΔH)。
2. 2 番目のケース、ΔСр(ΔСv)˂0 の場合。 最初の法則と同様に、∑С con があります。 ˂∑初期から (最終製品の熱容量の合計は、初期物質の熱容量の合計よりも小さくなります)。 次に、グラフに曲線が表示されます。これは、温度が上昇すると、プロセスの熱効果の変化が減少することを意味します(Т→ΔH↓)
3. システムの熱容量の変化がゼロに等しい 3 番目のケース ΔСр(ΔСv)=0。 次に、反応の最終生成物の熱容量の合計は、出発物質の熱容量の合計∑С con に等しくなります。 \u003d ∑ 最初から。 この場合、反応の熱効果は温度の関数ではなく (ΔH ≠ f(T))、グラフ上に直線が得られます。
与えられた熱影響の計算
温度。 キルヒホッフ方程式の積分
温度の関数としての熱効果の値を見つけるには、方程式を積分する必要があります。

T から T 0 (T は必要な温度、T 0 は標準温度)、ΔH から ΔH 0 または ΔU から ΔU 0 (ΔH と ΔU は、以下のエンタルピーと内部エネルギー)標準とは異なる条件)。 統合は次の 2 つのケースで実行されます。
しないために 有機物:有機物について:
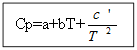
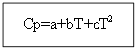
例:H 2 (g) - 無機物質の場合
| Ср=f(T) | T | |||
| a | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp(H 2(g))\u003d 27.28 + 3.26 * 10 -3 T +。
a) 近似積分:
等圧プロセス用
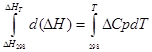
ΔH T - ΔH 298 =ΔCp*(T-298)
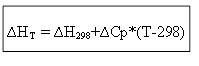
等容性プロセスの場合:
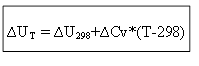
したがって、任意の温度 T での熱効果 ΔH または内部エネルギー ΔU を決定するには、標準条件下でのプロセスの熱 ΔH 0 (ΔU 0) と熱容量の変化 ΔСр、Δ を知る必要があります。履歴書。
例。 アセチレンからベンゼンを得るプロセスの熱効果 ΔH を計算します。
75℃(348K)で3C 2 H 2 (g)→C 6 H 6 (g)。
1.表から、ベンゼンとアセチレンの平均モル等圧熱容量を見つけます。
СрС6Н6(g)\u003d 81.67 J /(mol * K);
Cp C2H2(g)\u003d 43.93 J /(mol * K)。
2.プロセスの熱容量の変化を見つけます。
ΔCp \u003d ∑ (nCp) con - Σ (nCp) 初期 \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 J / (mol * K) .
3. 表形式のデータによると、標準条件下での熱効果がわかります。
ΔH 0 \u003d ΔH 0 arr C6H6 (g) - ΔH 0 arr C2H2 (g) \u003d 82.93 - 3 * 226.73 \u003d - 597.26 kJ / mol
4. 特定の温度での熱効果を見つけます。
ΔH = ΔH 0 + ΔСр (Т-Т 0) = - 597.26 * 10 3 + (-50.12) * (348- 298) = -599766 J / mol
b) 正確な統合:
熱容量の変化が温度に依存する、より複雑な 2 番目のケースを考えてみましょう。 Ср=f(T)、Cv=f(T)。
一般的な形式の反応方程式に目を向けましょう
dD + rR = qQ + pP
| a | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
Δa=q*a(Q) + p*a(P) - ;
Δb=q*b(Q) + p*b(P) - ;
Δc’= q*c’(Q) + p*c’(P) - ;
![]()
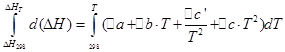
アイソコリック プロセスに対しても同じ操作を実行します。
溶解熱
固体、液体、または気体の物質が溶液に移行する際のエンタルピーの変化は、 溶解の熱またはエンタルピー.
溶解熱には一般に、結晶格子の破壊熱が含まれます( 固体)、イオン化および溶媒和。
結晶塩のイオン間の結合を切断するには、エネルギーが必要です。 熱を吸収しながら。 同時に、水溶液中でイオン水和が起こります。 イオンと H 2 O の分子の間に結合が形成されます。溶解熱の符号は、エネルギー的により顕著なプロセスによって決定されます。
LiBr: ΔH dist = - 49.02 kJ / mol - 熱が放出される
KCl: ΔH dist = 7.23 kJ/mol - 熱が吸収される
区別:積分溶解熱は、1モルの特定の物質が溶解して特定の濃度の溶液を形成するときに放出または吸収される熱です。 積分溶解熱は、溶解物質の量によって異なります。
区別:溶解の微分熱 - これは、与えられた物質の1モルの無限の溶解に伴う熱です 大ボリュームこの物質の溶液。 積分熱は、ヘスの法則に従って生成熱と他の反応熱を計算する際に広く使用されます。 溶解の示差熱は、溶液の熱力学的特性とその形成プロセスを特徴付けます。
ラボ #8
固体の熱容量の決定
楽器と付属品:実験装置 FPT1-8。
目的:電気加熱を使用した比色法による金属サンプルの熱容量の決定。
簡単な理論
物質の比熱容量 - 1 kg の物質を 1 K 加熱するのに必要な熱量に等しい値:
モル熱容量 - 1 K あたり 1 mol の物質を加熱するのに必要な熱量に等しい値:
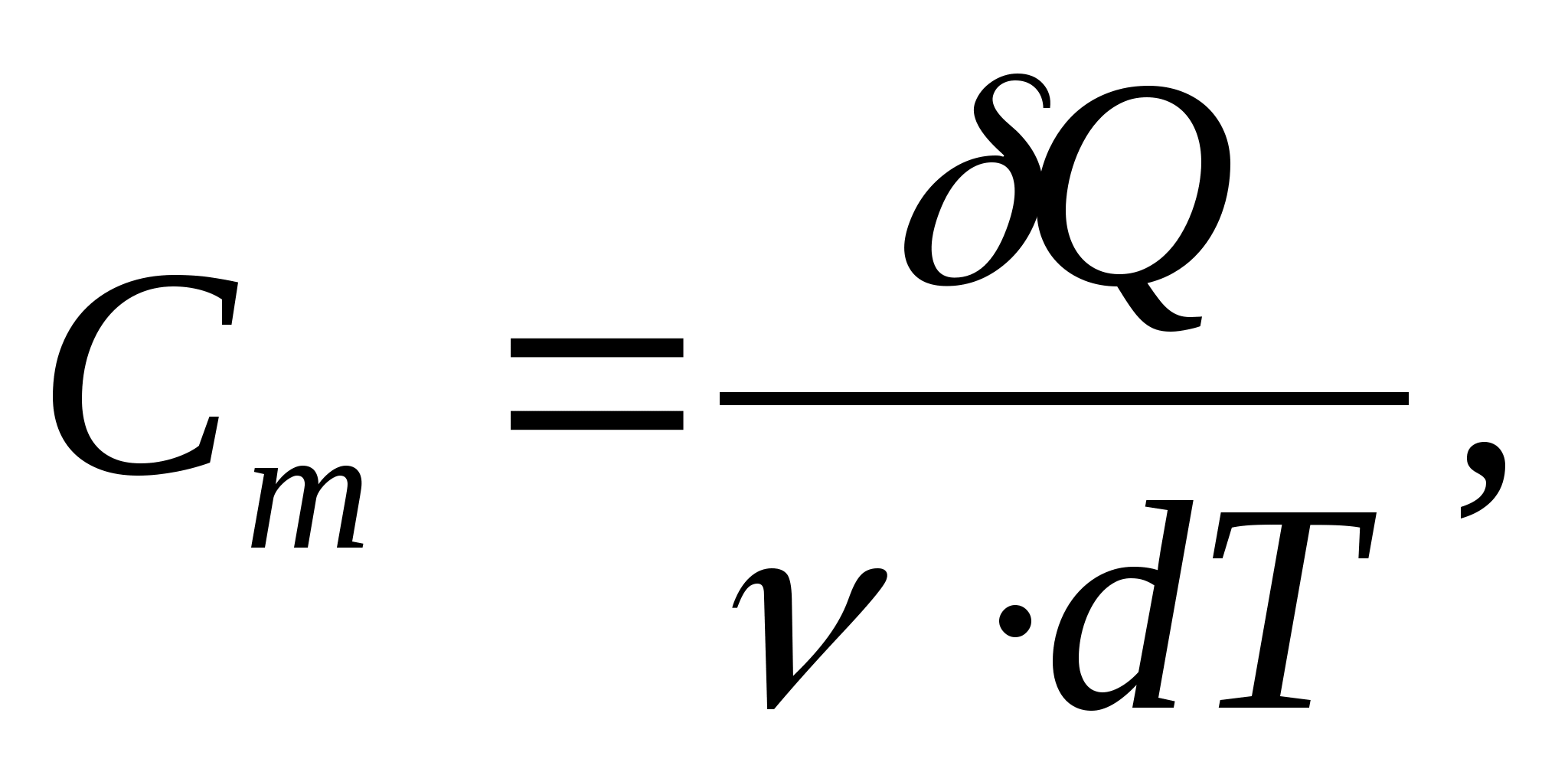
どこ 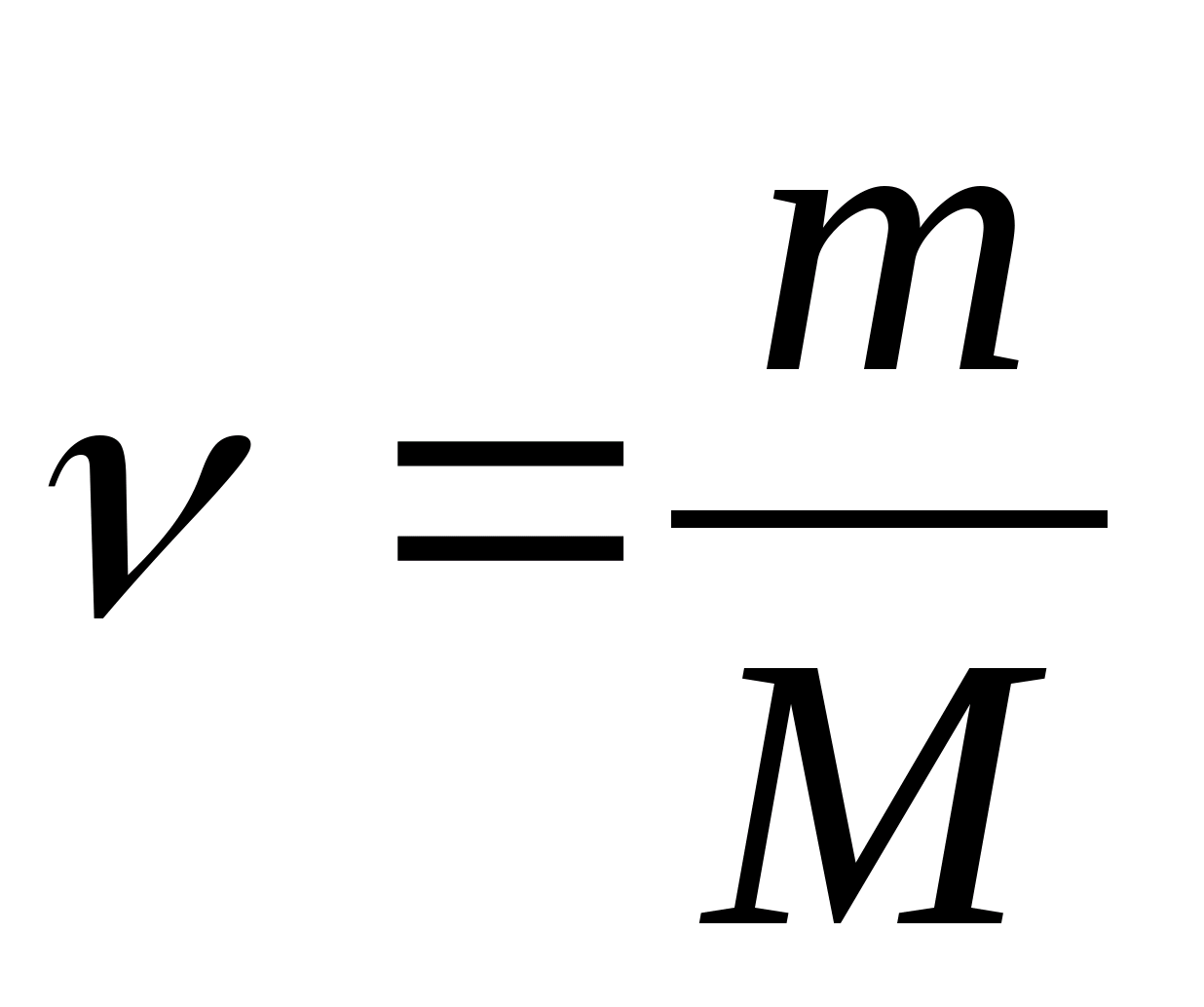 − 物質の量。
− 物質の量。
比熱 c大臼歯に関連する C メートル比

どこ M物質のモル質量です。
区別 一定体積での熱容量と 一定圧力、物質を加熱する過程で、その体積または圧力が一定に保たれている場合。
空間内のシステムの位置を完全に決定する最小数の独立変数 (座標) が呼び出されます。 自由度の数 .
分子の自由度全体にわたるエネルギーの一様分布に関するボルツマンの法則によれば、各並進および回転の自由度の平均運動エネルギーは次の値に等しくなります。
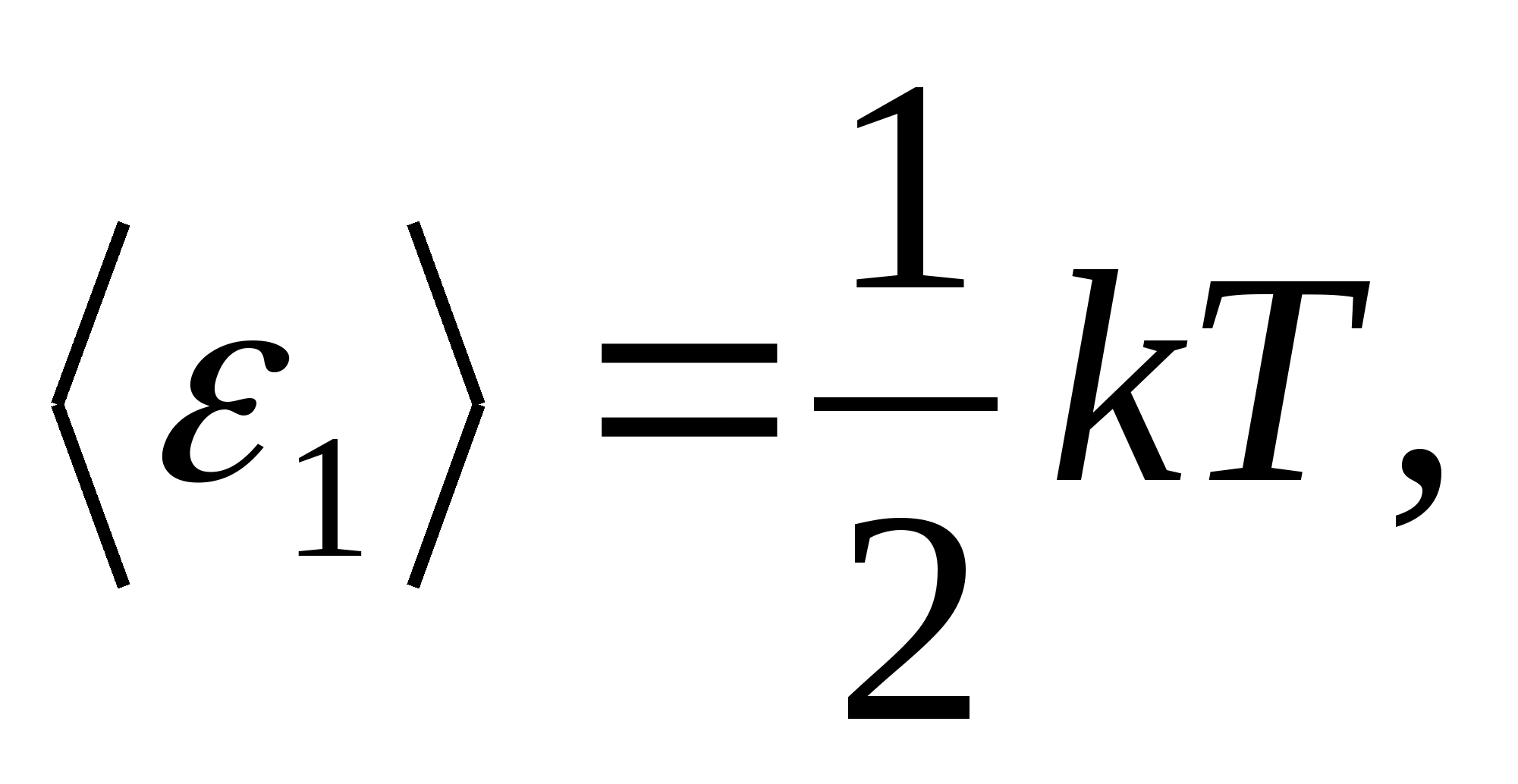
(どこ kはボルツマン定数)、振動の自由度ごとに、平均して次のエネルギーに等しい
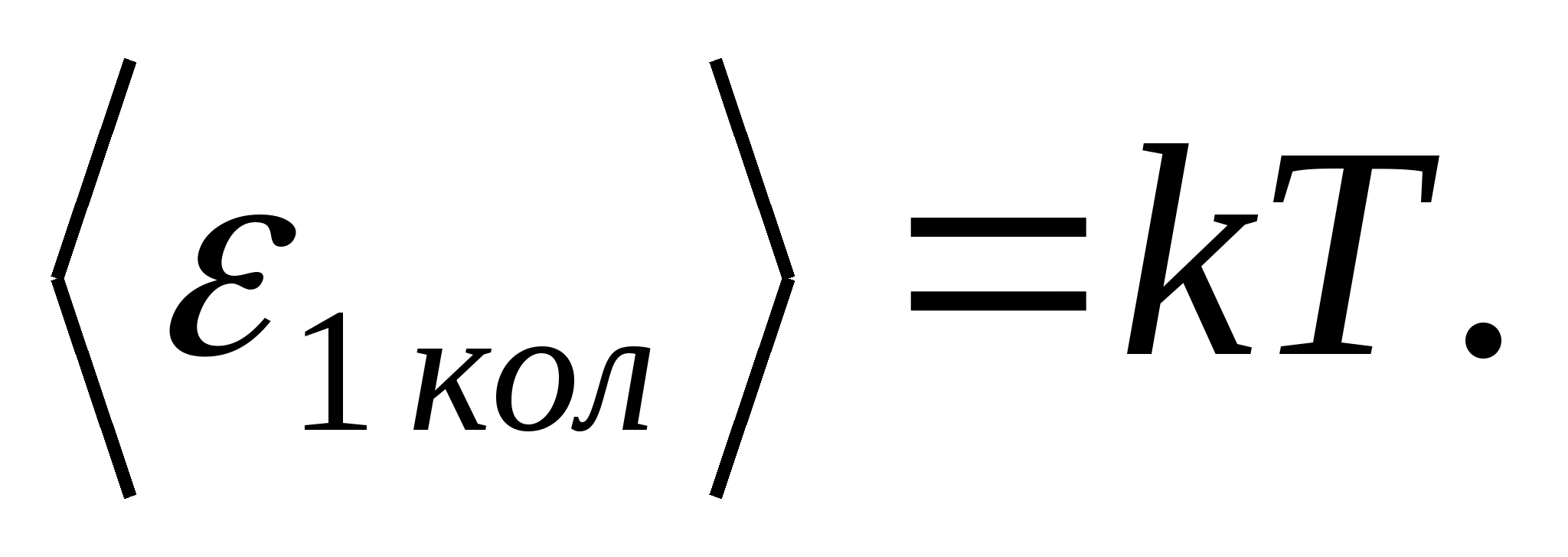
したがって、分子の平均エネルギー
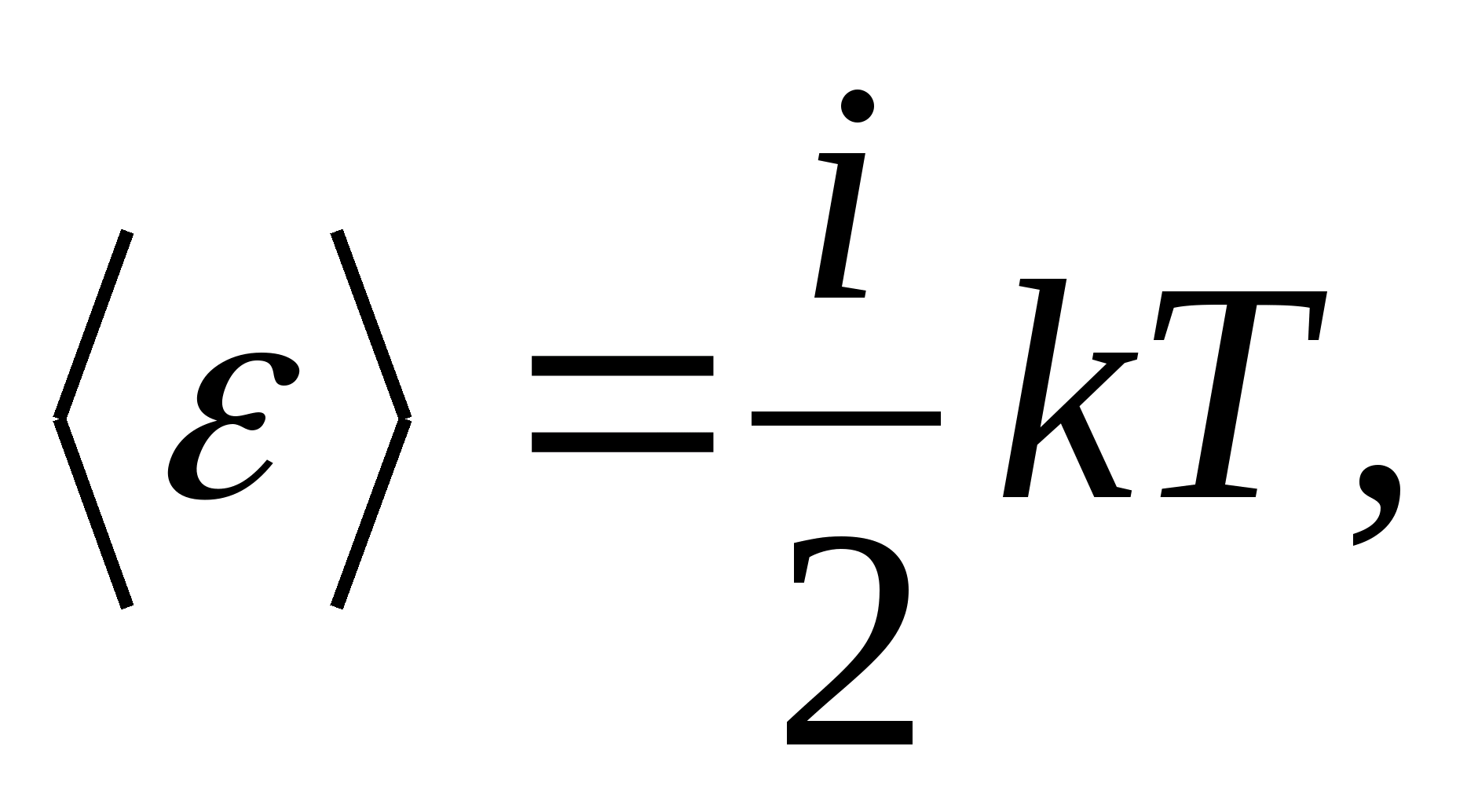
どこ 私分子の並進自由度、回転数、および振動自由度の 2 倍の数の合計です。
![]()
たとえば、単原子理想気体分子の平均運動エネルギー ( 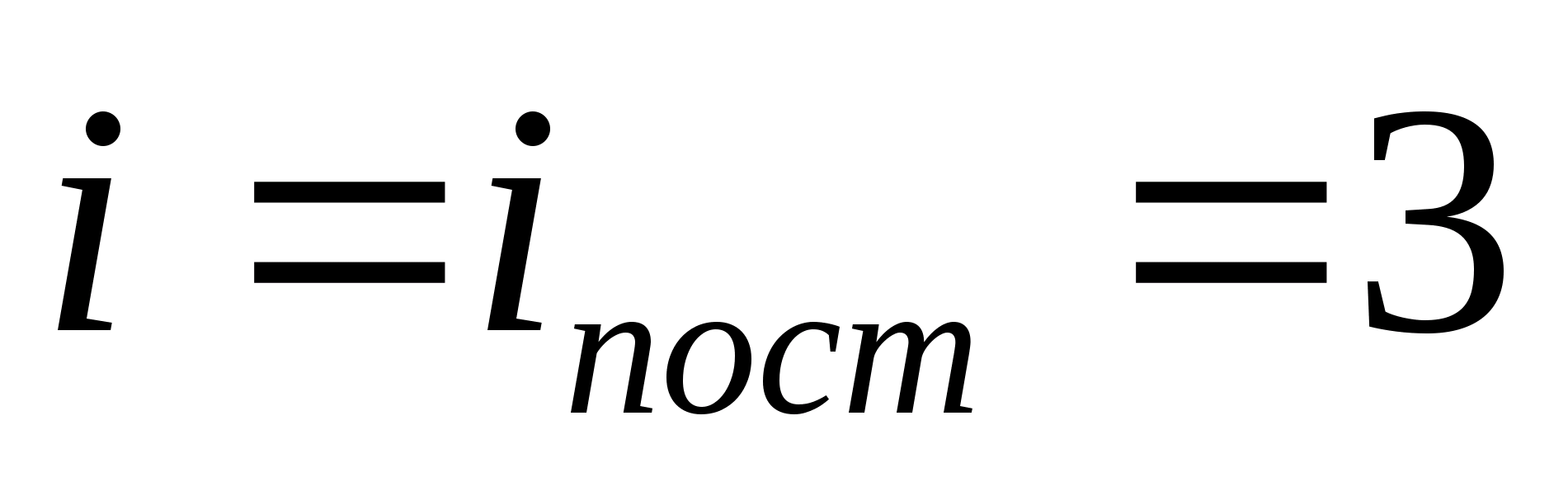 ) に等しい
) に等しい
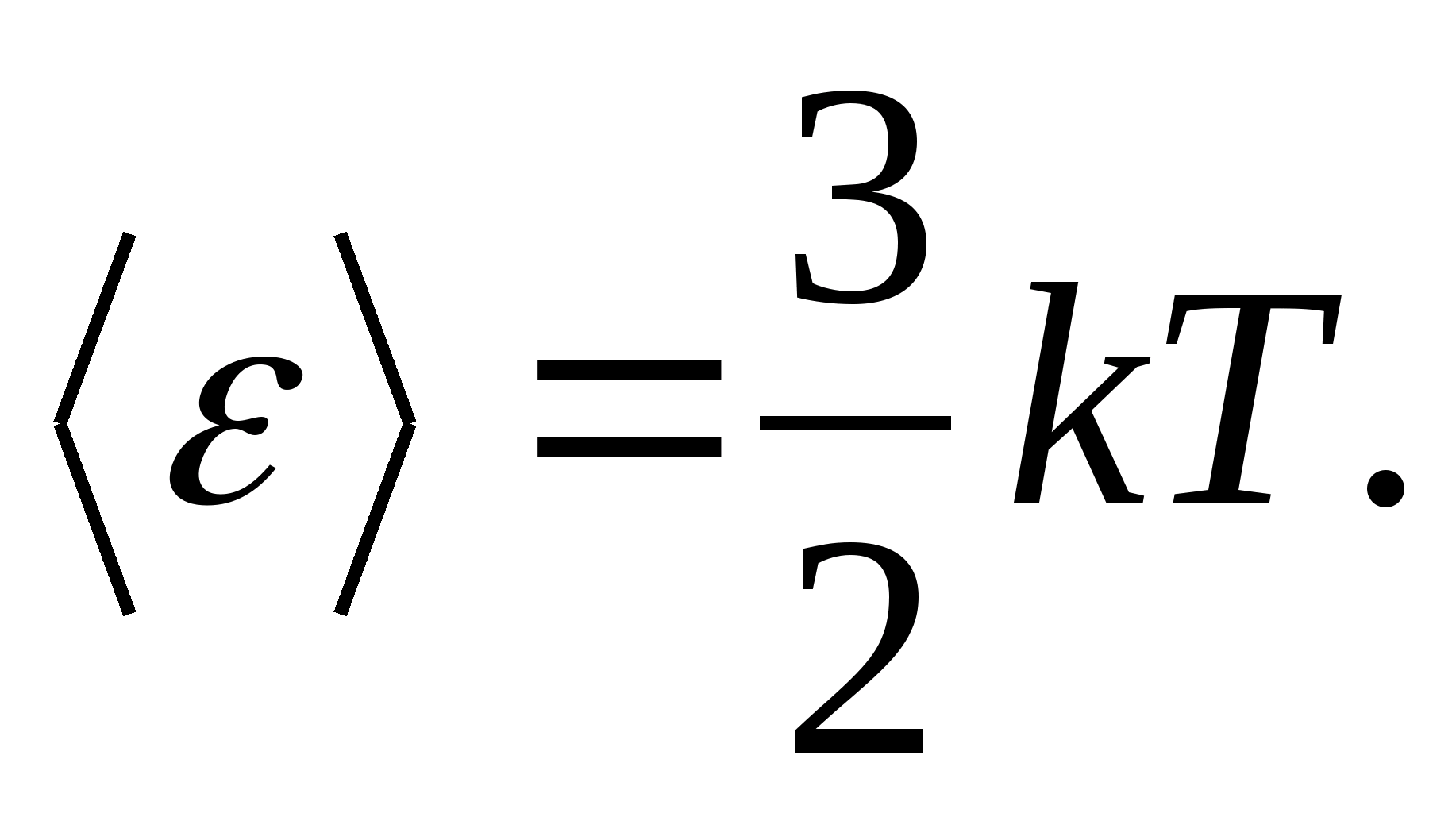
として モデル固体の、正しく構築された結晶格子を考えてみましょう。そのノードでは、粒子 (原子、イオン、分子) が 質点、それらの平衡位置の周りを振動します - ラティス ノード - 3 つの相互に垂直な方向に。 したがって、結晶格子を構成する各粒子には3つの振動自由度が割り当てられ、自由度に対するエネルギーの一様分布に関する法則に従って、それぞれの振動自由度は次のエネルギーを持ちます。 kT.
次に、結晶格子内の振動運動中の粒子の全エネルギーの平均値
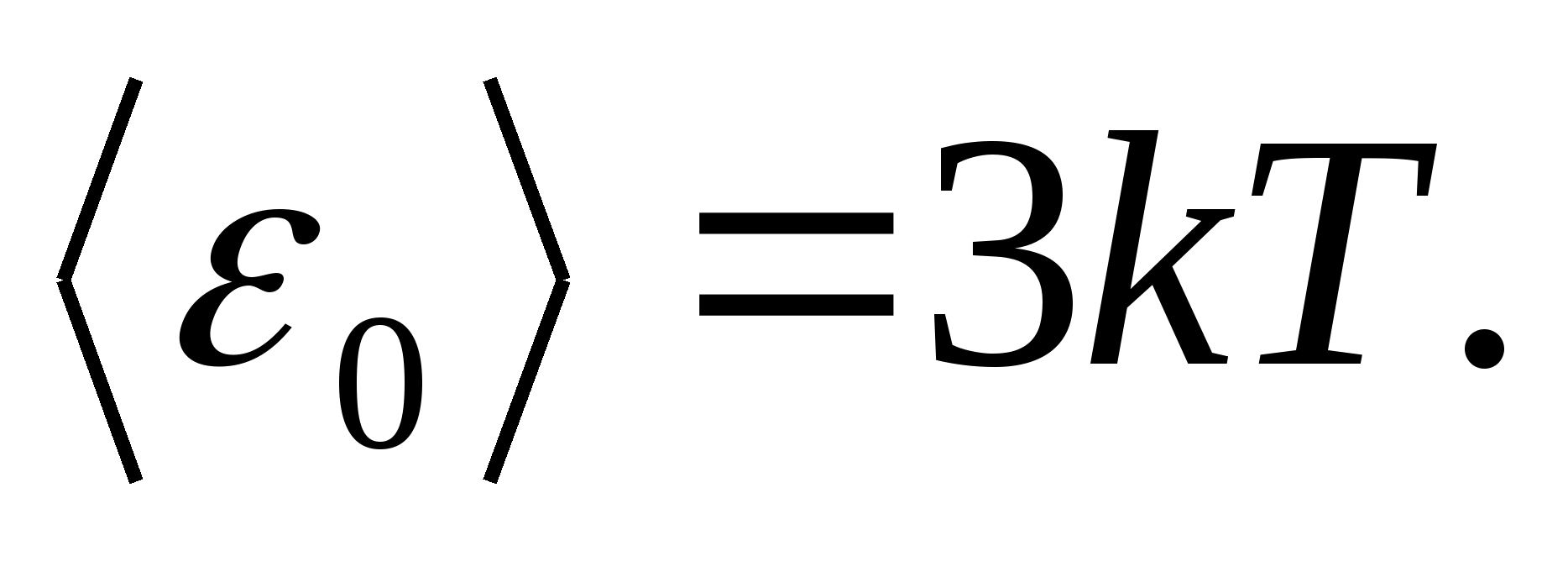
固体の 1 モルの全内部エネルギーは、1 粒子の平均エネルギーに 1 モルに含まれる独立して振動する粒子の数を掛けることによって得られます。 アボガドロ定数に N あ :
どこ R=N あ kは普遍的な (モル) 気体定数であり、 R= 8.31 J/(molK)。
固体の場合、熱膨張係数が小さいため、一定の圧力と一定の体積での熱容量は実質的に違いはありません。 したがって、(8.1) を考慮すると、固体のモル熱容量は
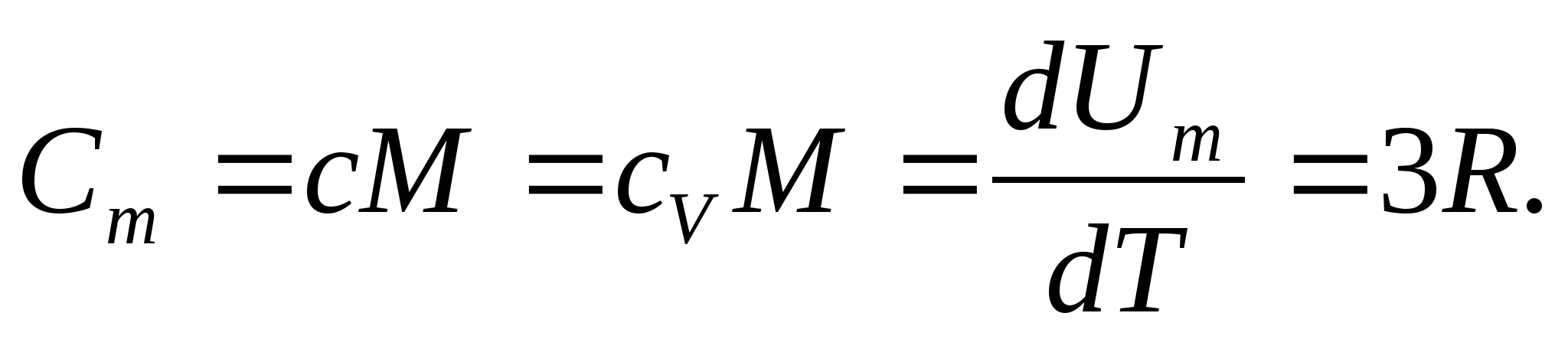 (8.2)
(8.2)
モルガス定数の数値を代入すると、次のようになります。
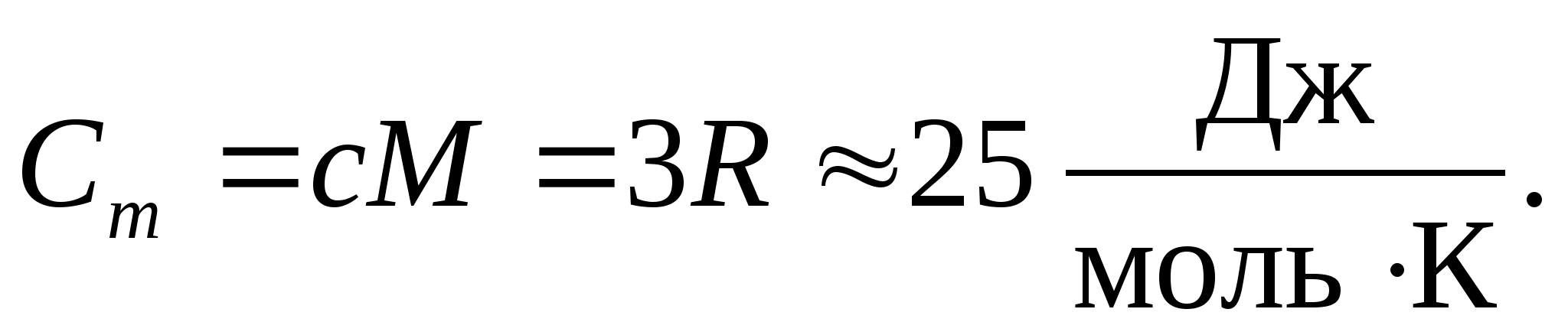
この等式は、室温で多くの物質に対してかなり良好な近似を保持し、次のように呼ばれます。 デュロンとプティの法則 : すべての化学的に単純な結晶のモル熱容量 固体 25 J/(mol にほぼ等しい に). 温度が下がると、すべての固体の熱容量が減少し、ゼロに近づきます。 T0. 絶対零度付近では、すべての物体のモル熱容量は T 3 に比例し、各物質に固有の十分に高い温度でのみ、等式 (8.2) が成立し始めます。 低温での固体の熱容量のこれらの特徴は、アインシュタインとデバイによって作成された熱容量の量子理論を使用して説明できます。
熱容量を実験的に決定するために、調査対象の物体を熱量計に入れ、電流で加熱します。 テストサンプルを入れた熱量計の温度が最初から非常にゆっくりと上昇した場合 T 0~ T、電流のエネルギーは、サンプルと熱量計を加熱するために使用されます。
どこ 私と う− ヒーターの電流と電圧 − 加熱時間 メートル 0 と メートル熱量計とテスト サンプルの質量、 と 0 と と− 熱量計と試験サンプルの比熱容量、 Q− 熱量計の断熱材および周囲空間への熱損失。
式 (8.3) から熱量計の加熱に費やされた熱量と周囲の空間への熱損失を除外するには、同じヒーター電力で空の熱量計 (サンプルなし) を初期温度から加熱する必要があります。 T同じ温度差で 0 T. 両方の場合の熱量計の保護ケーシングの温度が一定で室温に等しい場合、両方の場合の熱損失はほぼ同じで非常に小さくなります。
式 (8.3) と (8.4) は、
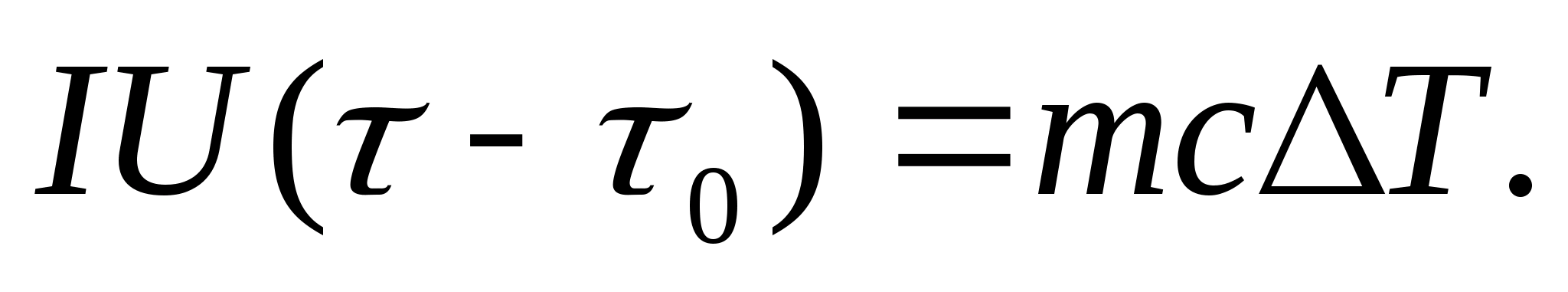 (8.5)
(8.5)
式 (8.5) を使用して、試験サンプルの材料の比熱容量を実験的に決定できます。 熱量計の温度を変化させることにより、加熱時間の差のテストサンプルの温度変化への依存性をプロットする必要があります:(
−
0)=へ(T)、その角係数によると 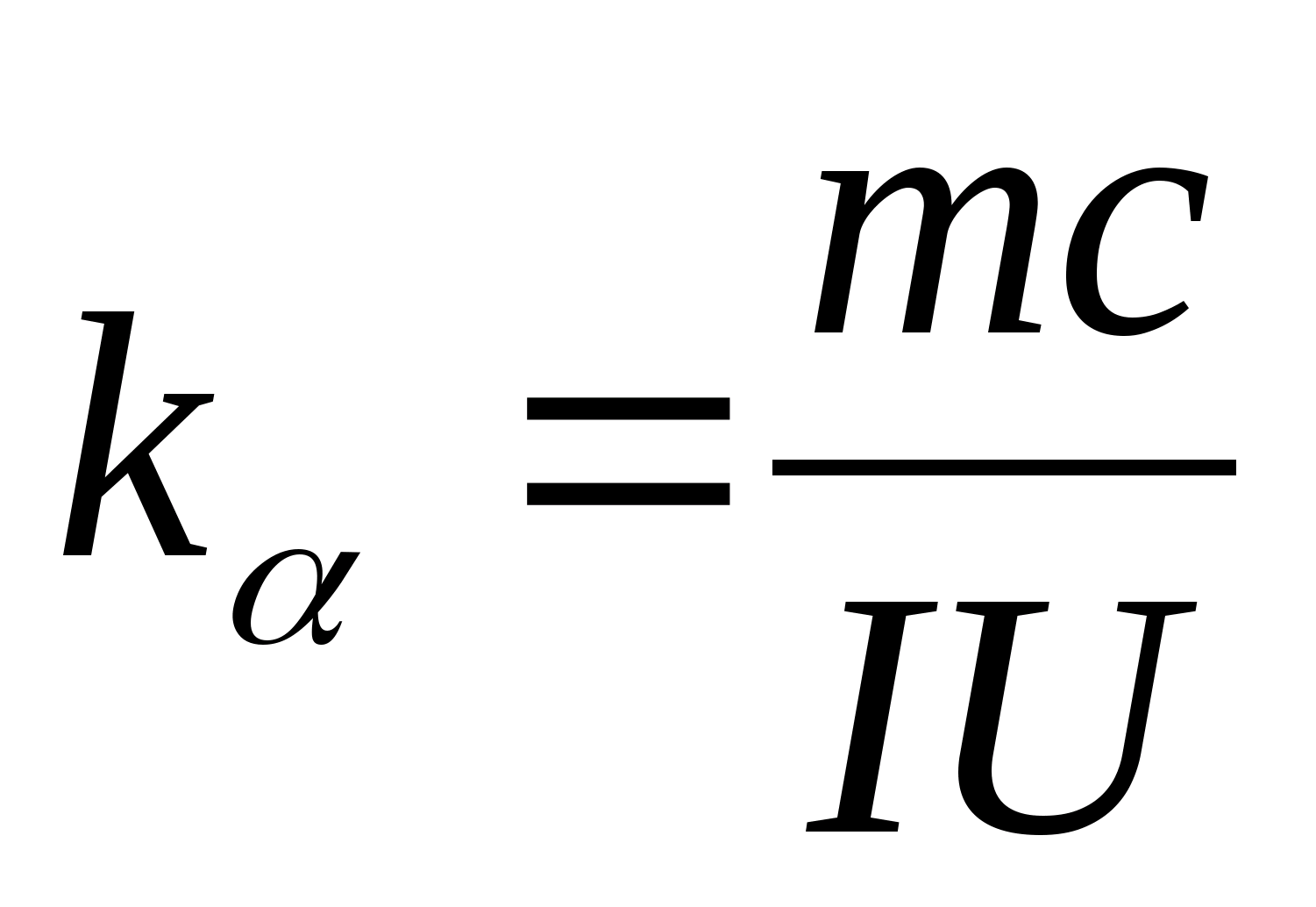 サンプルの比熱容量を決定できます。
サンプルの比熱容量を決定できます。
実験室のセットアップの説明
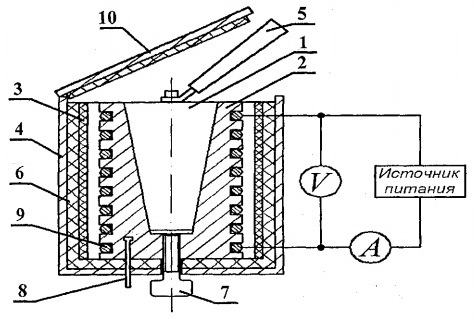
固体の熱容量を決定するために、FPT1-8 実験装置が設計されており、その全体図を図 1 に示します。 8.1. インストールは、計器ユニット 1、操作エレメント ユニット 2、およびラック 3 の 3 つの主要部分で構成されます。
コントロール ユニット 1 のフロント パネルには次のようなものがあります。 ヒーターをオンにするトグルスイッチ「HEATING」。 ヒーターの電力を調整する「HEATING」レギュレーター。 ヒーター回路の電圧と電流を測定する電圧計と電流計。 熱量計の加熱時間を測定するストップウォッチ。 計器ユニットの電源をオンにすると、ストップウォッチがアクティブになります。
作業要素2のブロックは、orgから取り外し可能なスクリーンで前面が閉じられています。 ガラス。 作業を行うとき、スクリーンは作業要素のブロックの後壁に掛けられます。 作業要素のパネルブロックには、温度を測定するためのデジタル温度計6があります。 下部のネストには、さまざまな材料で作られた 5 つのテスト サンプルと、ヒーターにサンプルを配置するためのハンドルがあります。
ヒーター 4 は、金属ケース、断熱材、熱量計で構成されています。

サンプルは熱量計で加熱され、そのスキームは図1に示されています。 8.2.
熱量計は、試験サンプル 1 が挿入される円錐形の穴を備えた真鍮のケース 2 です. ケースの外面には、加熱コイル 9 が特別な溝に配置されています. 外側では、熱量計のケースはアスベストの層で断熱されています熱量計は、断熱カバー 10 で閉じられます。実験の終了後、サンプルは熱量計本体の円錐形の穴から、ねじ 7. 熱量計から加熱されたサンプルを取り出し、サンプルをヒーターに取り付けるには、調査中のサンプルの隣にある特別なソケットにあるハンドル 5 を使用します。
熱量計の温度はデジタル温度計によって測定され、その温度センサー 8 は熱量計のハウジング 2 に配置されています。
安全性
作業を行うときは、機械工学実験室の一般的な安全要件が守られます。
作業命令
注意!熱量計は冷却に時間がかかるため、すべての時間値を測定した後、 0 空の熱量計の加熱、すぐに加熱をオフにします (以下のポイント 4 を参照)。 このユニットの最大加熱温度は+44°Cです。
1. 取付けの作業素子ユニットの透明カバーを取り外し、背面パネルのネジに掛けます。 HEAT コントロール ノブを最小に設定します。 「NETWORK」トグルスイッチでインストールをオンにします。
2. 空の熱量計の蓋をしっかり閉めます。 「HEAT」トグルスイッチをオンにします。 HEAT レギュレーターを使用して、電圧を 10 ~ 20 V に設定します (電圧が高いほど加熱が速くなります)。 表に書きます。 8.1 選択された電圧値 うそして現在 私.
3. 熱量計の温度から t教師によって指定された0、1Сの間隔の後、テーブルに入力します。 8.1 時間値 各到達温度に対応する0 t.
4.「HEAT」トグルスイッチをオフにし、蓋を開けて熱量計を初期温度まで冷却します t 0 . 熱量計をすばやく冷却するには、教師が指定したものを除いて、サンプルの 1 つを熱量計に下げることができます (サンプルを熱量計に取り付けるときは、熱量計の下部にあるネジを左に回します)。 気温が下がり始めます。 冷却速度が低下したら、加熱されたサンプルを取り外し、教師によって指定されたものを除いて、次の (冷たい) サンプルを挿入します。 サンプルを取り出すには、熱量計の下部にあるネジを右 (時計回り) に回し、ハンドルでサンプルを引き出します。
表 8.1
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C メートル =とM, J/(molK) |
||||||||
5. ねじを左に回し、教師の指示に従って採取した試験サンプルの 1 つを熱量計に入れます。 熱量計の蓋をしっかりと閉め、熱量計とサンプルの温度が等しくなるまで 2 ~ 3 分待ちます。
6.「HEAT」トグルスイッチをオンにし、空の熱量計を加熱するときと同じ電圧を回路に設定します。
7. 同じ熱量計の初期温度から開始 t 0、1Сの間隔の後、テーブルに入力します。 8.1 時間値 それぞれの到達温度に対応 t.
8. 「HEATING」レギュレーターを左端の位置 (最小) に設定し、「HEATING」トグル スイッチをオフにし、熱量計の蓋を開きます。 熱量計からサンプルを取り出すには、ネジを右に回し、ハンドルを使用して加熱されたサンプルを取り出します。
9. 「NETWORK」トグルスイッチでユニットの電源を切ります。
10. 数量のすべての値を翻訳します 0 と 秒単位(分なし)の値に変換し、それらを表に入力します。 8.1. テーブルの各行。 8.1 の値を計算する = − 0と T= t− t 0 .
11. 次の式を使用して、サンプルの比熱容量を概算します。 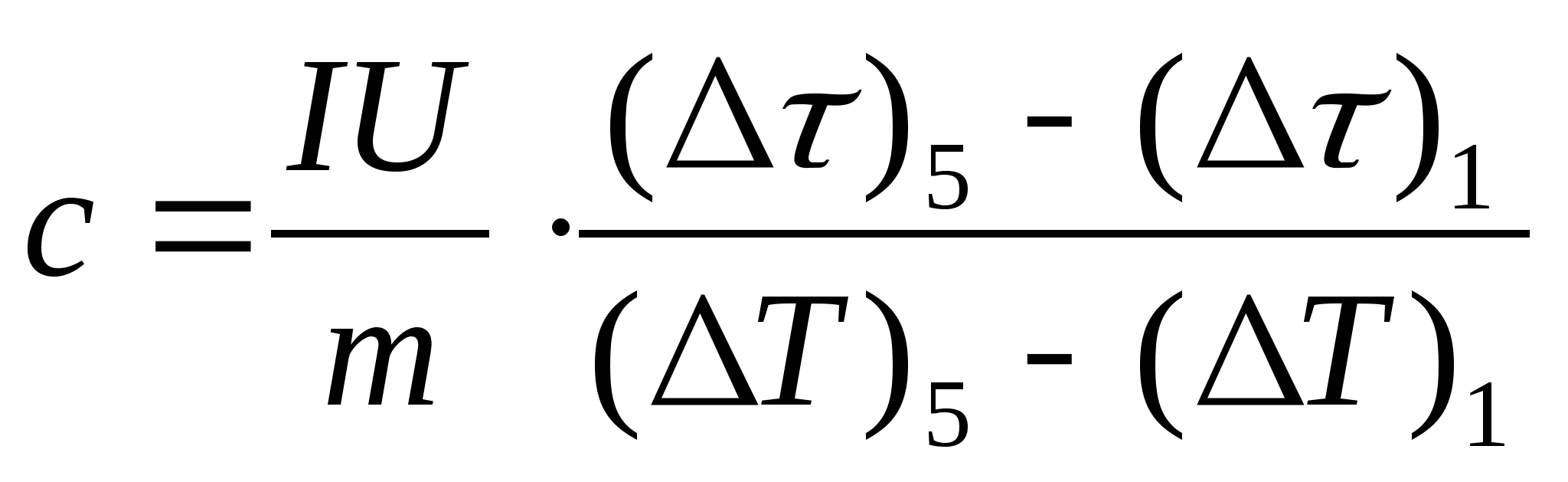 、サンプルの質量 メートル=139.5g(真鍮)または メートル=129.7 g (スチール) または
メートル=46.05g(ジュラルミン)。 確認のために先生に来てください。
、サンプルの質量 メートル=139.5g(真鍮)または メートル=129.7 g (スチール) または
メートル=46.05g(ジュラルミン)。 確認のために先生に来てください。
測定結果の処理
1. プロット
=f(T)熱量計の温度変化に対する、サンプルと空の熱量計を使用した熱量計の加熱時間の差の依存性、グラフ上の任意の2点を選択し、式を使用して直線の傾きを決定します 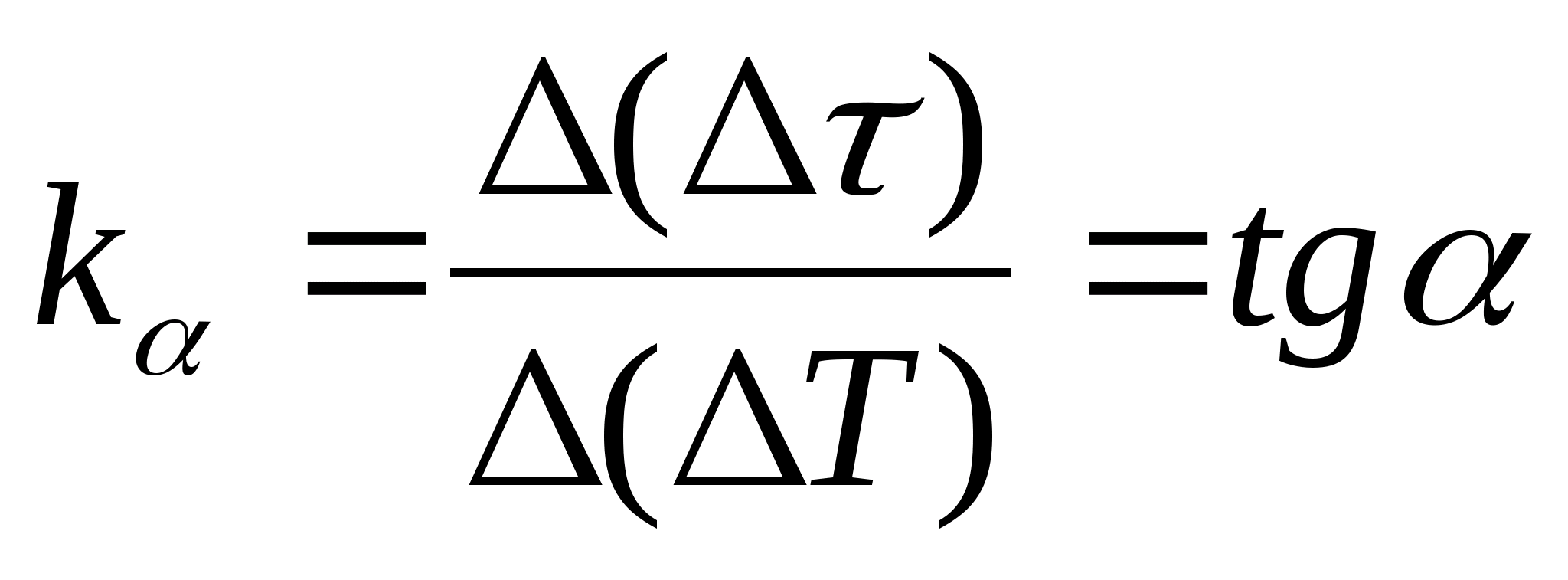 、 どこ
− 軸 に対するグラフの傾斜角度 T
(の単位の場合
と T両方の軸に同じ長さのセグメントとして表示されます)。
、 どこ
− 軸 に対するグラフの傾斜角度 T
(の単位の場合
と T両方の軸に同じ長さのセグメントとして表示されます)。
2. 傾きの値を使用する k
、式を使用してサンプルの比熱容量を決定します 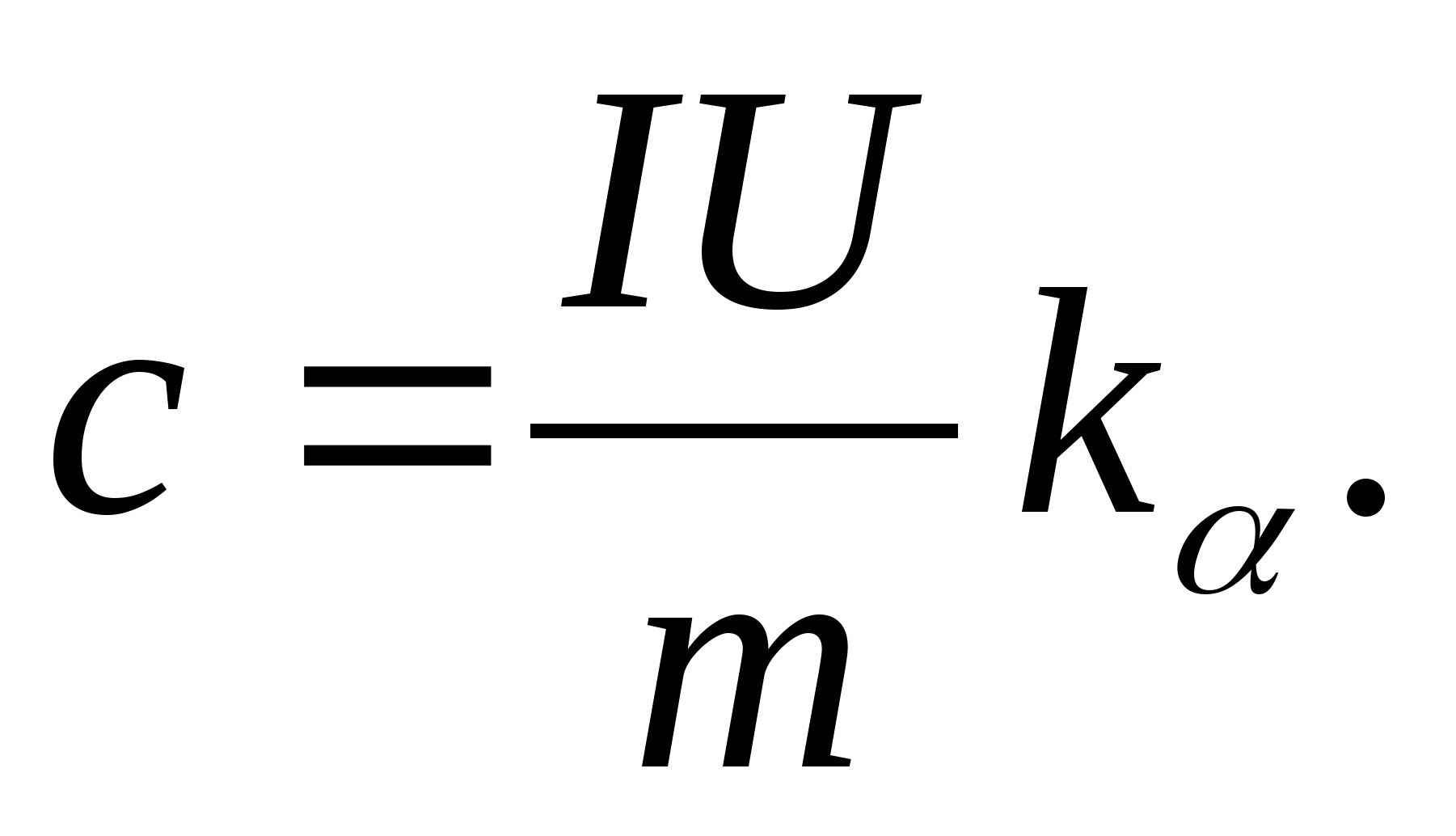
3. 表 8.2 (または周期表) のデータを使用して、式を使用してサンプルのモル熱容量を決定します。 C メートル =とM.
表 8.2
|
サンプル材料 |
原子量、kg/mol |
|
固体のモデルとして、正しく構成された結晶格子を考えてみましょう。その節では、粒子 (原子、イオン、分子) が物質点として取り込まれ、それらの平衡位置 (格子節) の周りで相互に垂直な 3 つの方向に振動します。 . したがって、結晶格子を構成する各粒子には3つの振動自由度が割り当てられ、自由度に対するエネルギーの等分配の法則(§50を参照)に従って、それぞれの振動自由度はエネルギーを持っています kT.
固体のモルの内部エネルギー
U m \u003d 3N A kT \u003d 3RT、
ここで、N A はアボガドロ定数です。 Nあ k= R (R はモル気体定数です)。
固体のモル熱容量
すなわち、モル(原子)熱容量 化学的に単純な物体結晶状態では同じです(に等しい 3 R) そして温度に依存しません。 この法則は、フランスの科学者 P. Dulong (1785-1838) と L. Petit (1791-1820) によって経験的に得られたものであり、 題名デュロンとプチの法則。
固体が化合物 (たとえば、NaCl) である場合、1 モル中の粒子の数はアボガドロ定数に等しくありませんが、次の値に等しくなります。 nNあ , どこ n - 分子中の原子の数 (NaCl の場合、1 モル中の粒子の数は 2 Nしたがって、1 モルの NaCl には N A Na 原子と N A Cl 原子が含まれます)。 したがって、モル熱容量 固体化合物
C V \u003d 3R25n J /(mol K)、
すなわち、この化合物を構成する元素の原子熱容量の合計に等しい。
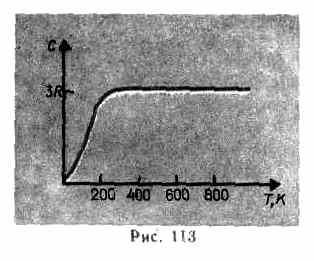
実験データが示すように (表 4)、多くの物質について、デュロンとプティの法則はかなり良好な近似で満たされていますが、一部の物質 (C、Be、B) は計算された熱容量から大きく外れています。 さらに、気体の場合と同様に(§53を参照)、低温での固体の熱容量を測定する実験により、温度に依存することが示されました(図113)。 ゼロケルビン付近では、物体の熱容量は T 3 に比例し、各物質の特性である十分に高い温度でのみ、条件 (73.1) が満たされます。 たとえば、ダイヤモンドの熱容量は 3 です。 R 1800Kで! ただし、ほとんどの固体では、室温はすでに十分に高くなっています。
計算された熱容量の実験値と理論値の不一致
熱容量の量子論、A.アインシュタインとP.デバイ(1884-1966)に基づいて説明された古典理論の基礎。
§ 74. 蒸発、昇華、融解、結晶化。 アモルファス体
液体と固体の両方で、他の分子への引力を克服するのに十分なエネルギーを持ち、液体または固体の表面から離れて周囲の空間に入ることができる特定の数の分子が常に存在します。 液体のためのこのプロセスは呼ばれます 蒸発(また 気化)、固体用 - 昇華(また 昇華)。
液体の蒸発はどの温度でも発生しますが、その強度は温度の上昇とともに増加します。 蒸発プロセスとともに、補償プロセスが行われます 結露蒸気から液体へ。 単位時間あたりに単位表面を通過して液体から出る分子の数が、蒸気から液体に移行する分子の数に等しい場合、 ダイナミックバランス蒸発と凝縮プロセスの間。 その液体と平衡状態にある蒸気は呼ばれます リッチ(§62も参照)。
ほとんどの固体では、常温での昇華プロセスは無視でき、固体表面の蒸気圧は低くなります。 温度の上昇とともに増加します。 ナフタレン、樟脳などの物質を集中的に昇華させ、鋭い特徴的な臭いで検出されます。 昇華は、真空中で特に集中的に発生します。これは、鏡を作るために使用されます。 昇華のよく知られている例は、氷が蒸気に変わることです。湿った洗濯物は寒さで乾きます。
固体を加熱すると、 内部エネルギー(格子サイトでの粒子の振動エネルギーとこれらの粒子の相互作用エネルギーの合計) が増加します。 温度が上昇すると、粒子振動の振幅が
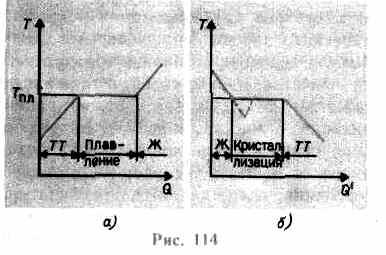
結晶格子が崩壊するまで増加します - 固体が溶けます。 図上。 114 aおおよその依存性が示されています T(Q), どこ Q- 融解中に体が受ける熱量。 立体へのメッセージとして ぬくもりボディその温度が上昇し、融点で T pl は、固体から液体状態への体の移行を開始します。 温度 T pl 結晶全体が溶けるまで一定のままであり、その後、液体の温度が再び上昇し始めます。
まで固体を加熱する T pl 物質の粒子のエネルギーは結晶格子を破壊するのに十分でなければならないため、まだ液体状態に変換されていません。 融解の過程で、物質に与えられた熱は、結晶格子の破壊に関する作業を実行するために使用されるため、結晶全体が融解するまで T pl =一定です。 その後、供給された熱は再び液体の粒子のエネルギーを増加させ、その温度が上昇し始めます。 1kgの物質を溶かすのに必要な熱量を 比融解熱。
液体が冷却されると、プロセスは反対方向に進みます(図114、b; Q" - 結晶化中に体から放出される熱量): 最初に、液体の温度が低下し、次に T pl に等しい一定の温度で開始します。 結晶、その完了後、結晶の温度が下がり始めます。 物質の結晶化には、いわゆる 結晶化センター -形成された物質の結晶だけでなく、不純物、ほこり、すすなども含まれる可能性がある結晶核。液体状態のまま、結晶化温度よりも低い温度に冷却され、形成されます。 過冷却液体(114 では、b は破線の曲線に対応します)。 強い過冷却により、結晶化中心の自発的な形成が始まり、物質はかなり急速に結晶化します。
通常、溶融物の過冷却は数分の1から数十度で発生しますが、多くの物質では数百度に達することがあります。 高過冷却液体は粘性が高いため、流動性を失い、固体のように形状を保持します。 これらの体は呼ばれます 非晶質固体;これらには、樹脂、ワックス、シーリングワックス、ガラスが含まれます。 このように過冷却液体である非晶質体は、 等方性、つまり、それらのプロパティはすべての方向で同じです。 それらにとっても、液体にとっても、それは特徴的です 短距離秩序粒子の配置で; それらでは、液体とは対照的に、粒子の移動性はかなり小さいです。 非晶質体の特徴は、特定の融点を持たないことです。つまり、液体状態を確認できる特定の温度を示すことはできず、固体状態を下回る特定の温度を示すことはできません。 経験から、アモルファス体では結晶化のプロセスが経時的に観察されることが知られています。たとえば、結晶はガラスに現れます。 透明性を失い、白濁し始め、多結晶体に変わります。
最近では、 国民経済得た ポリマー- 有機アモルファス体。その分子は、化学(原子価)結合によって接続された多数の同一の長い分子鎖で構成されています。 ポリマーには、天然(デンプン、タンパク質、ゴム、繊維など)と人工(プラスチック、ゴム、ポリスチレン、ラフサン、ナイロンなど)の両方の有機物質が含まれます。 ポリマーには固有の強度と弾力性があります。 一部のポリマーは、元の長さの 5 ~ 10 倍の伸びに耐えます。 これは、長い分子鎖が変形すると、折りたたまれて高密度のボールになるか、直線に伸びるという事実によって説明されます。 ポリマーの弾性は、特定の温度範囲でのみ現れ、それ以下では硬くて脆くなり、それ以上ではプラスチックになります。 多くの合成ポリマー材料が作成されていますが (人工繊維、皮革代替品、建築材料、金属代替品など)、ポリマーの理論はまだ完全には開発されていません。 その開発は、所定の特性を持つポリマーの合成を必要とする現代の技術の要求によって決定されます。
物質の比熱容量は値として理解されます
, (1)
体に与えられる熱の量はどこにありますか。
で発生する温度変化です。
体への熱の伝達の結果として、
m は加熱された物体の質量です。
経験は通常、平均を決定します 比熱物質 c は、温度を上げるためにこの物質の単位質量に与えなければならない熱量に数値的に等しくなります。
(2),
ここで、研究対象の物体の最終温度と初期温度の差です。
熱容量を実験的に決定するために、さまざまな熱量測定法が使用されます。 これらの方法の多様性は、身体に与えられる熱量を正確に測定するには、研究中の身体を加熱するときに考慮されていない熱損失を排除する必要があるという事実によるものです。
通常、等温シェルを備えたいわゆる熱量計では、計算された、または実験的に決定された放射の補正、つまり、実験中に熱量計が放射によって外部環境に放出する熱量が導入されます。
ただし、優れた断熱材を導入するか、実験の期間を短縮することにより、熱損失を大幅に減らすことができます。これは、サンプルの高い加熱速度によって達成されます ~ (熱容量を測定するためのパルス法)供給される熱の総量に比べて小さい。
熱容量を決定するための最も正確な方法の 1 つは、断熱熱量計法です。 このタイプの熱量計での熱損失を考慮する必要性に伴う困難は、測定が熱平衡の条件下で行われるという事実、つまり、研究中のサンプルとサンプルを囲むブロックの温度が等しい条件下で行われるという事実によって解消されます。 . この方法の利点は、高精度とともに、広い温度範囲で固体の熱容量を決定できる可能性も含まれます。これは、物質が相転移を起こす場合に特に重要です。
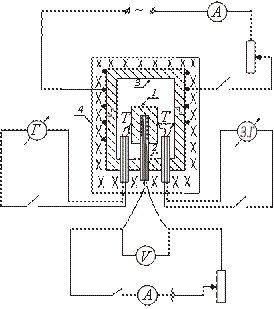
断熱熱量計のタイプの1つのデバイスが図に概略的に示されています。 テストサンプル 1 は銅ブロック 3 に配置され、それとともに炉 4 で加熱されます。ヒーター 2 がサンプルの内部に導入され、サンプルの追加の加熱が可能になります。
サンプルを含むブロックが配置されている炉4の電源を入れた後、サンプルの温度が上昇し始め、ブロックの温度を下回ったままになります。 サンプルとブロックの温度が等しくなるようにするには、サンプル内に配置されたヒーターをオンにします。 サンプル温度がブロック温度をわずかに上回ると、内部ヒーターがオフになります。
その後、このヒーターを定期的にオン/オフすることで、サンプルとブロックの温度差が常に符号を変えます。
ゼロに等しい瞬間(内部ヒーターがオンのとき)、サンプルとブロックの間で熱交換はなく、内部ヒーターによって放出された熱の全量はサンプルの加熱にのみ費やされます。 この場合の比熱は式(2)で求めることができます。
内部ヒーターによって放出される熱量は、次の式で決まります。
ここで、I は内部ヒーターの電流です。
V は電圧降下です。
- 温度が上昇する時間間隔。
それで
(4)
ここで、 はサンプルの温度が だけ変化した時間です。
微分形式では、式 (4) は次の形式を持ちます。
(5)
サンプルの温度は T 熱電対で測定され、ブロックとサンプルの温度差は差動熱電対で測定されます。 サンプル温度を決定するために、熱電対校正曲線 T が使用されます. ブロックとサンプルの間の温度差は、検流計スケールの分割で決定されます (ブロックとサンプルの間の温度差が発生する瞬間を固定するだけでよいため)サンプルは記号を変更します)。
作品の完成。
サンプルは、銅ブロック内に配置されたヒーターに置かれます。 熱電対接合部 T と は、サンプルとブロックに接続されています。 オーブンはふたで閉じられます。 ブロックが置かれている炉の電気巻線がオンになっています。 試料内部に設置したヒーターを周期的にON/OFFし、内部ヒーターの回路にIとVの値を記録します。
測定を開始する前に、ミラー検流計のゼロ位置を確認する必要があります。 これを行うには、検流計から熱電対を切り離すことで、うさぎが体重計に沿って変動しなくなることを期待しています。 この後、糸の画像がゼロと一致しない場合は、スケールを移動することでこの一致が達成されます。
T とオン時間の依存曲線がプロットされます。
曲線 T(t) の符号が変化するポイント (つまり、熱平衡が確立されるポイント) での傾きから、式 (5) を使用して比熱が計算されます。 この熱容量は、ブロックとサンプルの間の温度差が符号を変える瞬間に曲線 T(t) から読み取られる温度を指します。
