熱容量はどの単位で測定されますか? ガスの熱容量。 熱容量の種類
物体の熱容量は、物体の温度を 1 度上昇させるために物体に与えなければならない熱量です。 1度冷やすと、体は同じ量の熱を放出します。 熱容量は本体の質量に比例します。 物体の単位質量の熱容量は比熱と呼ばれ、原子または分子質量による比熱の積は、それぞれ原子またはモルと呼ばれます。
熱容量 さまざまな物質互いに大きく異なります。 そう、 比熱 20°Cの水は4200 J / kg K、松の木 - 1700、空気 - 1010です。金属の場合はそれ以下です:アルミニウム - 880 J / kg K、鉄 - 460、銅 - 385、鉛 - 130。温度とともにわずかに増加し (90°C での水の熱容量は 4220 J/kg K)、相転移中に大きく変化します。0°C での氷の熱容量は、水の熱容量の 2 分の 1 です。 100°C での水蒸気の熱容量は約 1500 J/kg K です。
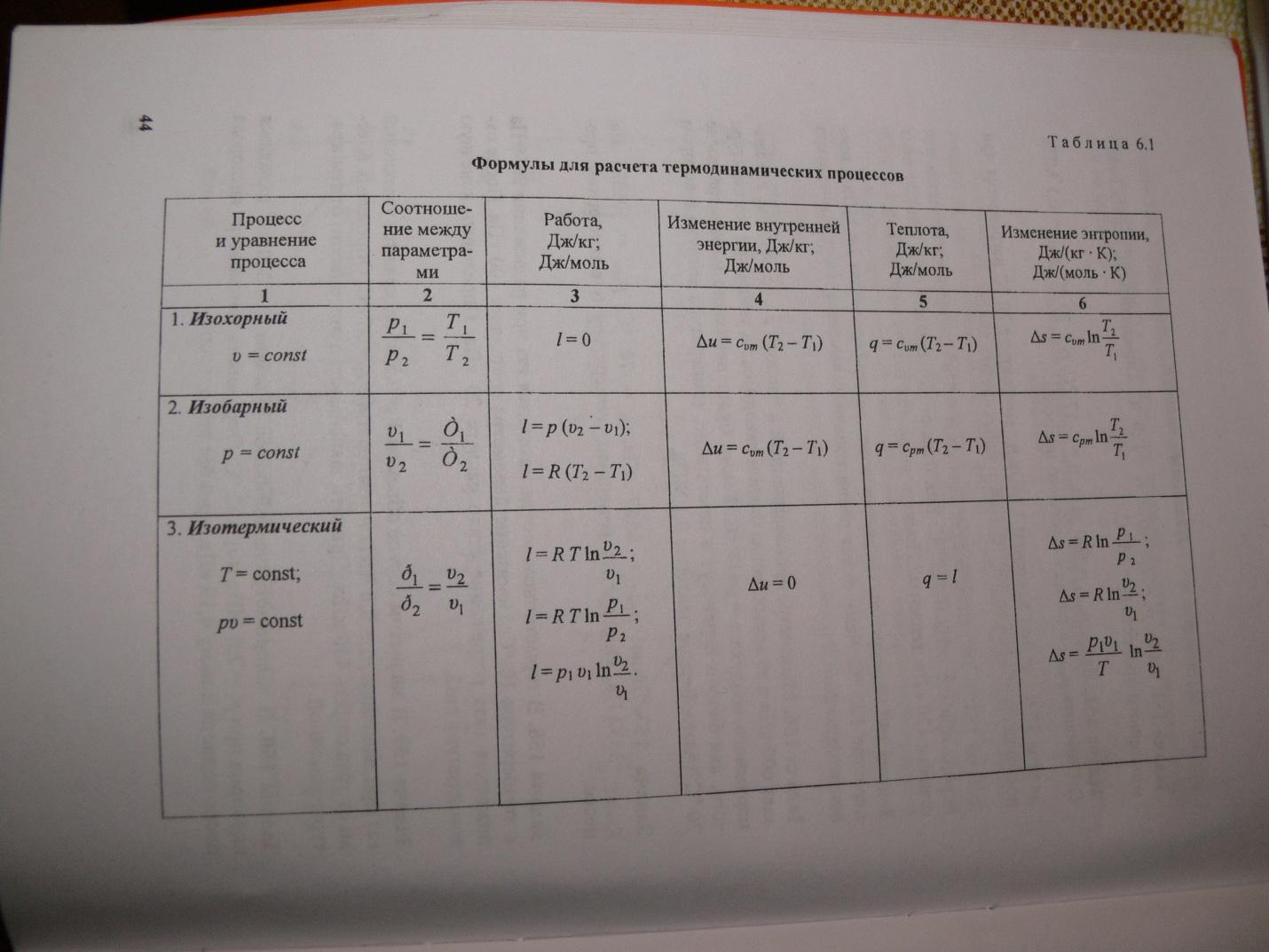
熱容量は、体の温度が変化する条件によって異なります。 体の寸法が変わらない場合、すべての熱が内部エネルギーを変化させます。 ここでは、一定の体積での熱容量について話しています。 外圧が一定の場合、熱膨張により、外力に対して機械的作業が行われ、特定の温度に加熱するにはより多くの熱が必要になります。 したがって、一定圧力での熱容量は常に よりも大きくなります。 為に 理想気体(図を参照)、ここで R はガス定数で、8.32 J / mol K に相当します。
通常は測定します。 古典的な方法熱容量の測定は次のとおりです。熱容量を測定する物体を特定の温度に加熱し、初期温度が の熱量計に入れ、水または既知の熱容量を持つ別の液体で満たします。熱量計と液体)。
熱平衡が確立された後に熱量計で温度を測定することにより、次の式を使用して体の熱容量を計算できます。
![]()
ここで、 と は物体、液体、熱量計の質量です。
最も発達した理論は、ガスの熱容量です。 常温では、加熱は主に気体分子の並進および回転運動のエネルギーの変化につながります。 単原子気体のモル熱容量の場合、理論では 、二原子および多原子 - および が得られます。 非常に低い温度では、量子効果により熱容量がいくらか小さくなります (図を参照)。 量子力学)。 で 高温振動エネルギーが追加され、多原子ガスの熱容量は温度の上昇とともに増加します。
古典理論によると、結晶の原子熱容量は に等しく、これは Dulong と Petit の経験則 (1819 年にフランスの科学者 P. Dulong と A. Petit によって確立された) と一致しています。 量子論熱容量は、高温で同じ結論につながりますが、温度の低下に伴う熱容量の減少を予測します。 絶対零度に近づくと、すべての物体の熱容量はゼロになる傾向があります (熱力学の第 3 法則)。
体の熱容量- これは 物理量、加熱されたときに体が吸収する熱量とその温度の変化の比率によって決定されます。
物体の熱容量の物理的な意味: 物体の熱容量は、加熱されたときに物体が吸収する熱量、または 1K 冷却されたときに放出される熱量に等しい。
熱容量は可変であるため、平均熱容量と真の熱容量を区別します。 平均熱容量の下で、熱量の比率を理解する q 、物質(ガス)の量の単位に合計され、からの温度の変化に t 1 前 t 2 温度差があれば t 2 – トン 1 有限値です。 平均質量、体積、およびモル熱容量は、それぞれ次のように表されます。 c メートル 、c メートル ' と メートル . 平均熱容量の定義から、ガス温度が t 1 前 t 2 その平均熱容量 [kJ / (kg * K)]
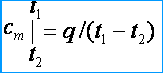
真の熱容量の下で、温度の微小変化に対応する、ガス温度の微小変化に対応するガスの熱容量を理解します dt 、つまり
c = dq/dt、
どこ dq=cdt.
比熱さまざまな物質が加熱されたときに熱を吸収する能力です。 物質の比熱容量は、物質の質量に対する加熱時に物質が受け取る熱量の比率と、次の場合の温度変化によって決まります。 ![]()
モル熱容量 Cp と CV の間の関係を表す関係は、次の形式 (マイヤーの式) を持ちます: Cp = CV + R. OR MORE EXPANDED 熱容量 理想気体熱伝達の結果、一定量の熱が体に伝達されると、体の内部エネルギーとその温度が変化します。 1kgの物質を1K熱するのに必要な熱量Qを物質の比熱cといいます。 c = Q / (mΔT)。 多くの場合、モル熱容量 C: C = M c を使用すると便利です。ここで、M は物質のモル質量です。 このようにして決定された熱容量は、物質の明確な特性ではありません。 熱力学の第一法則によると、体の内部エネルギーの変化は、受け取った熱量だけでなく、体が行う仕事にも依存します。 熱伝達プロセスが実行される条件に応じて、体はさまざまな作業を実行できます。 したがって、身体に伝達される同じ量の熱が、その内部エネルギーに異なる変化を引き起こし、その結果、温度が変化する可能性があります。 熱容量を決定する際のこのようなあいまいさは、ガス状物質の場合にのみ典型的です。 液体と固体が加熱されると、それらの体積は実質的に変化せず、膨張仕事はゼロに等しいことがわかります。 したがって、体が受け取った熱の全量がその内部エネルギーを変化させます。 液体とは異なり、 固体、熱伝達の過程にあるガスは、その体積を大きく変化させて仕事をすることができます。 したがって、気体物質の熱容量は、熱力学的プロセスの性質に依存します。 通常、ガスの熱容量の2つの値が考慮されます。CVは等容プロセス(V = const)のモル熱容量であり、Cpは等圧プロセス(p = const)のモル熱容量です。 一定体積でのプロセスでは、ガスは仕事をしません: A = 0. 1 モルのガスの熱力学の第一法則から、QV = CVΔT = ΔU に従います。 気体の内部エネルギーの変化 ΔU は、その温度の変化 ΔT に正比例します。 圧力が一定の場合、熱力学の第一法則は次のようになります。Qp = ΔU + p(V2 - V1) = CVΔT + pΔV、ここで、ΔV は理想気体の温度が ΔT 変化したときの 1 モルの体積変化です。 これは次のとおりです: 比 ΔV / ΔT は、1 モルについて書かれた理想気体の状態方程式から求めることができます: pV = RT、ここで、R は普遍気体定数です。 で p = const したがって、モル熱容量 Cp と CV の間の関係を表す関係は、次の形式 (マイヤーの式) を持ちます: Cp = CV + R.
気体定数は、1 K 加熱されたときの、一定圧力下での理想気体 1 モルの膨張仕事に数値的に等しくなります。 R = pV/T = 1.01 10 5 22.4 10-3/273[Pa m 3 /mol]/ K =8.31(44) Dzh/ (mol K)
普遍気体定数は、ボルツマン定数 k とアボガドロ定数の積に等しい、普遍的で基本的な物理定数 R です。
物理的な意味: ガス定数 i は、温度が 1 K 上昇した場合の等圧過程における理想気体 1 モルの膨張仕事に数値的に等しい
CGS システムでは、ガス定数は次のとおりです。
特定のガス定数は次のとおりです。
断熱指数(と呼ばれることもあります。 係数ポアソン) - 一定圧力での熱容量 () と一定体積での熱容量 () の比率。 と呼ばれることもあります 要素 等エントロピー 拡張子. ギリシャ文字 (ガンマ) または (カッパ) で表されます。 文字記号は、主に化学工学分野で使用されます。 熱工学では、ラテン文字が使用されます。
混合ガス 検討中の条件下では、互いに化学反応を起こさないいくつかの異なるガスの集まりです。
ガスの混合物は、均一な熱力学システムです(システムの巨視的な部分を互いに分離し、それらの特性と組成が異なるインターフェースはありません)。
分圧 混合物中の i 番目のガスの P i は、混合物から他のすべてのガスが除去され、V と T が同じままである場合に、このガスの圧力になります。
ダルトンの法則 - 互いに化学的に相互作用しないガスの混合物の圧力は、これらのガスの分圧の合計に等しくなります。
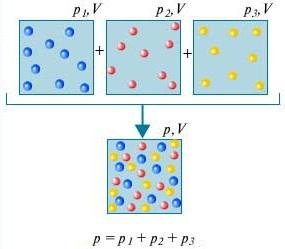
とは何かを理解するために ダルトンの法則、これは部屋の空気を考慮してください。 それはいくつかのガスの混合物です: 窒素 (80%)、酸素 (20%)。 これらの各ガスの分圧は、ガスが単独で全体の体積を占める場合の圧力です。 たとえば、部屋から窒素以外のすべてのガスが除去された場合、残ったものの圧力は窒素の分圧になります。 ダルトンの法則一緒に取られたすべてのガスの全圧は、別々に取られた各ガスの分圧の合計に等しいと述べています。 (厳密に言えば、この法則は理想気体にのみ適用されますが、十分に近似的には実在気体についても説明できます。)
熱力学第一法則 は、熱力学系のエネルギーの保存と変換の法則の一般化です。 次のように定式化されます。
変化Δう 分離されていない熱力学系の内部エネルギーは、熱量の差に等しいQ システムに転送され、動作しますあ 、外部の物体に対する完全なシステム。
|
熱力学の第 1 法則を表す関係は、多くの場合、別の形式で記述されます。
|
システムが受け取った熱量は、内部エネルギーを変更し、外部物体で作業を実行するために使用されます。
熱力学の第一法則は、実験事実の一般化です。 この法則によれば、エネルギーは生成も破壊もできません。 あるシステムから別のシステムに転送され、ある形式から別の形式に変換されます。 熱力学の第一法則の重要な帰結は、外部からエネルギーを消費せず、また機械自体の内部を変更せずに有用な仕事を行うことができる機械を作成することは不可能であるという主張です. そのような仮想マシンは呼ばれます 第一種永久機関(永久機関) . そのようなマシンを作成するための多くの試みは、常に失敗に終わりました。 どんな機械でもポジティブな仕事ができる あ一定量の熱を得ることによってのみ外部物体を覆う Q周囲の物体から、またはΔの減少 うその内部エネルギー。
熱力学の第一法則を気体中の等過程に適用してみましょう。
等圧展開あり Q> 0 - ガスが熱を吸収し、ガスは正の仕事をします。 等圧圧縮あり Q < 0 – тепло отдается внешним телам. В этом случае あ < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T 1 ; 内部エネルギーが減少、Δ う < 0.
で 等温プロセスガス温度は変化しないため、ガスの内部エネルギー Δ う = 0.
で アイソコリックプロセス (Ⅴ= const) ガスは機能しません。 あ= 0. したがって、
等圧プロセスの熱力学の第 1 法則は、次のようになります。
|
等温過程の熱力学の第一法則は、次の関係で表されます。
|
熱量 Q、等温膨張の過程でガスによって得られ、外部物体の仕事に変わります。 等温圧縮下では、ガスに発生する外力の仕事が熱に変換され、周囲の物体に伝達されます。
熱力学では、等容性、等圧性、等温性のプロセスに加えて、周囲の物体との熱交換がない場合に発生するプロセスを考慮することがよくあります。 断熱壁を備えた容器は呼ばれます 断熱シェル、およびそのような容器内のガス膨張または圧縮のプロセスは呼ばれます 断熱的な.
で 断熱過程Q= 0; したがって、熱力学の第一法則は
|
|
|
物理的な意味では、熱力学の第 1 法則は、熱力学におけるエネルギーの保存 (変化) の法則です。 力学におけるエネルギー変化の法則によれば、非保存力の仕事がシステムの力学的エネルギーの増分に等しい場合 (特に、負の符号を持つ摩擦力の仕事は、システムの機械的エネルギー)、熱力学の第一法則によれば、熱力学システムの内部エネルギーの増分は、システム全体で完全な外力の仕事の合計に等しくなり、エネルギーはシステムに伝達されます熱伝達によるシステム。 エンタルピー(ギリシャ語から。 エンタルポ- ヒートアップ)は 物質の性質、熱に変換できるエネルギーの量を示します。 エンタルピー分子構造に蓄えられたエネルギーのレベルを示す、物質の熱力学的特性です。 つまり、物質は温度と圧力に基づいてエネルギーを持つことができますが、そのすべてが熱に変換できるわけではありません。 内部エネルギーの一部は常に物質内に留まり、分子構造を維持しています。 物質の運動エネルギーの一部は、その温度が周囲温度に近づくと利用できなくなります。 その結果、 エンタルピー特定の温度と圧力で熱に変換できるエネルギー量です。 エンタルピーの単位は、エネルギーを表す BTU またはジュールと、比エネルギーを表す Btu/lbm または J/kg です。 11の質問 |

目的:材料の熱容量の実験的決定。
装置:はかり、分銅、熱量計、熱容量がわかっている金属製のシリンダー、ビーカー、ヒーター、フック。
簡単な理論:
すべての巨視的な物体と物体のシステムは、それらの動きと相互作用による機械的エネルギーに加えて、それらの内部状態に依存するエネルギーを持っています。 体を構成するすべての粒子間の運動と相互作用のエネルギーであるこのエネルギーは、内部と呼ばれます。
内部エネルギーには、特定の物体を構成する分子や原子の熱運動の運動エネルギー、原子核の周りの原子内を移動する電子の運動エネルギー、分子、原子、電子、原子核間の相互作用のポテンシャル エネルギー、原子核内の核子が含まれます。など 内部エネルギーの概念には、特定の物体全体の運動エネルギーと位置エネルギーは含まれません。
内部エネルギーは、特定のシステムの状態を特徴付ける一連のパラメーターによって一意に決定されます。 このシステムの状態の単一値関数です。
内部エネルギーは通常、文字 U で表されます。
相転移の温度から離れた温度で発生する熱現象では、内部エネルギー DU の変化は分子の運動エネルギーとポテンシャル エネルギーの変化に関連付けられますが、内部エネルギーの残りの成分は変化しません。 したがって、そのようなプロセスでは、物体の内部エネルギーは、この物体の重心に対するすべての分子のカオス熱運動の運動エネルギーと、すべての相互作用のポテンシャルエネルギーの合計に等しいと仮定できます。分子同士。
体の状態が変化すると、その内部エネルギーが変化します。 たとえば、体の温度が上昇すると、この体の分子の動きの平均運動エネルギーが増加するため、その内部エネルギーが増加します。 体温が下がると、体の内部エネルギーが減少します。
体の内部エネルギーは変化する可能性があります 違う方法. たとえば、内部エネルギーは、変形中に特定の物体に外力によって機械的仕事が行われた場合、および物体がそれよりも高いまたは低い温度を持つ別の物体 (または媒体) と接触している場合に、仕事が行われていなくても変化します。与えられた体。
機械的な仕事をせずに物体の内部エネルギーを変化させるプロセスは、熱伝達または熱伝達と呼ばれます。 熱伝達には、対流、伝導、放射の 3 種類があります。
熱交換中、あるタイプから別のタイプへのエネルギーの変換はありません。 熱伝達のプロセスは、より高温の物体からの内部エネルギーの一部が、より高温でない物体 (または媒体) に伝達されるという事実にあります。
熱伝達のプロセスを特徴付けるために、熱量の概念が導入されます。これは、熱伝達のプロセスにおける身体の内部エネルギーの変化の定量的尺度である量と呼ばれます。
体はエネルギーを与えたり受け取ったりすることしかできず、熱量 Q は、熱伝達の過程で体が与えたり受け取ったりするエネルギーの数値にすぎないことを覚えておく必要があります。
熱量はプロセスのタイプに依存し、システムの状態の関数ではありません。
相転移を伴わずに(物質の凝集状態を変化させずに)物体を加熱するのに必要な熱量:
ここで、c は体の比熱容量であり、体の質量 m に伝達される熱量の比率によって決定され、結果として生じる温度 DT の変化、m は体の質量、DT は最終的な温度差です。および与えられた物体の初期温度。
温度を 1 ケルビン上げるために体に与える必要のある熱量は、この物質の熱容量と呼ばれます。 1 ケルビン冷やすと、体は同じ量の熱を放出します。 物体の熱容量は物体の質量に比例し、それを構成する物質に依存します。 SI 単位系では、熱容量は J/K で測定されます。
物質の熱特性を特徴付けるために、この物質の単位質量の熱容量が取得されます。 この特性は比熱容量と呼ばれます。 これは、特定の物体の質量に対する熱容量の比率に等しくなります。 SI システムでの比熱容量は、J / (kg × K) で測定されます。
実験的に、金属体の比熱は、熱量計と温度計を使用して決定されます。 最も単純な熱量計は、ストッパー (断熱の目的で) 上の別のガラスの内側に配置された研磨された金属ガラスで構成されます。 内側のガラスは、既知の比熱容量を持つ水または別の液体で満たされています。 特定の温度 t に加熱された物体を熱量計に降ろします。 物体が下降する前の熱量計内の液体の温度をt 1とし、液体とその中に下降した物体の熱平衡が確立された後、それらの合計温度はqに等しくなります。
エネルギー保存則から、次のことが成り立ちます。
Q \u003d Q 1 + Q 2、(2)
熱量はどこですか Q、加熱された物体によって与えられ、熱量の合計に等しい Q1、水によって得られ、 Q2、熱量計によって受信されます。
(1) を考慮して、(2) を次のように書き換えます。
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1)、(3)
どこ c 1と メートル 1- 熱量計内の水の比熱容量と質量、 c 2と m2- 熱量計の比熱容量と質量。 この式を熱収支式といいます。 それから、体の比熱容量を見つけます。
ある実験の枠組みでのエネルギー損失が同じであると仮定すると、この問題の解決策に別の方法でアプローチすることができます。 体 と特定の温度に加熱された既知の比熱容量 t、温度が変化する熱量計に下げられます。 次に、熱収支方程式は次の形式になります。
cm(t-q) = c 1 m 1 (q-t 1) + Q損失、(5)
どこ Qロスは熱量計が受け取る熱量であり、 環境、 その結果:
Q 損失 = cm(t-q) - c 1 m 1 (q-t 1)。 (6)
同じ温度に加熱された未知の比熱容量を持つ物体を熱量計に降ろすと、熱収支方程式は次の形式になります。
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q 損失、(7)
どこ m¢ 1は熱量計内の水の質量であり、 t¢ 1- この実験の水温。 それで:
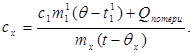 (8)
(8)
値 (6) を (8) に代入すると、次のようになります。
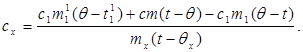 (9)
(9)
熱の基本量はどこにありますか。 - 温度の基本的な変化。
熱容量は、特定の条件下でシステムの温度を 1 度上昇させるためにシステムに供給しなければならない熱量に数値的に等しくなります。 SI の熱の単位はジュールで、温度は度 K であるため、熱容量の単位は J/K です。
熱力学で熱が供給される体の量的単位に応じて、質量、体積、およびモル熱容量が区別されます。
質量熱容量作動流体の単位質量あたりの熱容量、
ここで、 と は、通常の物理的条件下での体の体積と密度です。
体積熱容量は、J/(m3 K) で測定されます。
モル熱容量- 作動流体(ガス)の量をモルで表した熱容量
| , |
ここで、m3/mol は通常の状態でのガスのモル体積です。
熱容量は一定ではなく、温度やその他の熱パラメーターに依存することを考慮して、真の熱容量と平均熱容量を区別します。 通常、真の熱容量は、任意のプロセスで熱力学的システムに報告される基本的な熱量と、与えられた熱によって引き起こされるこのシステムの温度のごくわずかな上昇との比率として理解されます。 に等しいシステム温度での熱力学システムの真の熱容量を考慮し、 - true 比熱容量に等しい温度の作動流体。 次に、温度が から に変化したときの作動流体の平均比熱容量は、次のように決定できます。
体の内部エネルギーの決定。
内部エネルギー体(と呼ばれる えまた う) は、分子の相互作用と分子の熱運動のエネルギーの合計です。 特に、理想気体の内部エネルギーは、連続的かつランダムな熱運動におけるすべての気体粒子の運動エネルギーの合計に等しくなります。 これからジュールの法則に従い、多数の実験によって確認されました。
分子動力学理論は、分子が並進運動のみを実行する理想的な単原子ガス (ヘリウム、ネオンなど) の 1 モルの内部エネルギーの次の式につながります。
この上、 内部エネルギー う体は、体の状態を特徴付ける巨視的なパラメーターによって一意に決定されます. 与えられた状態がどのように実現されたかには依存しません。 内部エネルギーは状態関数であると言うのが通例です。
TD では、絶対値ではなく、内部エネルギーの変化が使用されます。
拡張工事とは。 TDの第一法則。
拡張作業 - 拡張の過程で外圧の力に対して車両によって実行される機械的作業。 体積が変化すると、気体は仕事をし、V の変化の符号は仕事の符号と一致します。
TD の第一法則: システムに与えられた熱は、内部エネルギーを変換して仕事をするために使用されます。
熱の形でエネルギーを受け取る(または与える)能力の観点から、熱容量によって熱力学的システムを特徴付けるのが通例です。
物体 (システム) の熱容量は、温度を 1 ケルビン変化させるために物体 (システム) に与えなければならない熱量に数値的に等しい物理量です。
体に極微量の熱を与えると Q、温度の極小の上昇を引き起こした dT、次に、その熱容量 から定義上、等しい
熱容量の SI 単位は、ジュールをケルビンで割った値です ( J/に).
実験と理論計算は、 物体の熱容量は、その化学組成、質量、および熱力学的状態に依存します(たとえば、温度について)、および熱が加えられたときに体の状態を変化させるプロセスの種類について。
比熱容量は、物質の単位質量あたりの熱容量です。つまり、均質な物質の場合
![]() , (25.2)
, (25.2)
どこ と- 比熱容量、 M物質の質量です。
比熱の SI 単位は、ジュールをケルビン キログラムで割った値です [( J/(に . kg)].
モル熱容量は、物質 1 モルの熱容量です。あれは
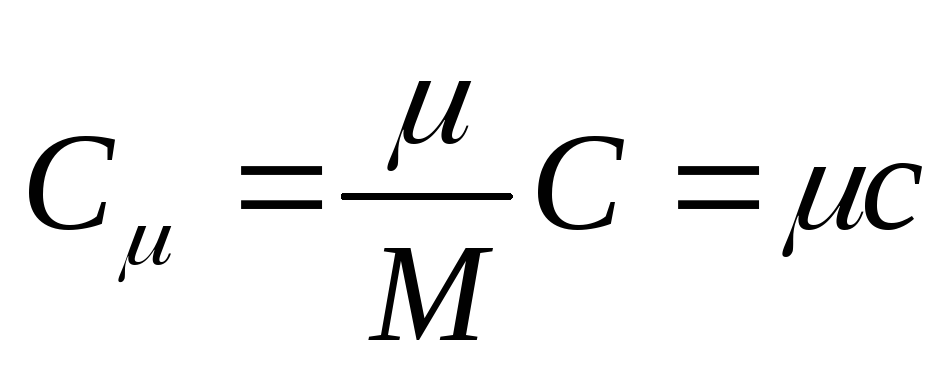 , (25.3)
, (25.3)
どこ から - モル熱容量; 物質のモル質量です。
SI におけるモル熱容量の単位は、ジュールをケルビン モル [ J/(に . モル)].
素熱量 Q, 体温を変えるのに必要 dT、 と定義されている
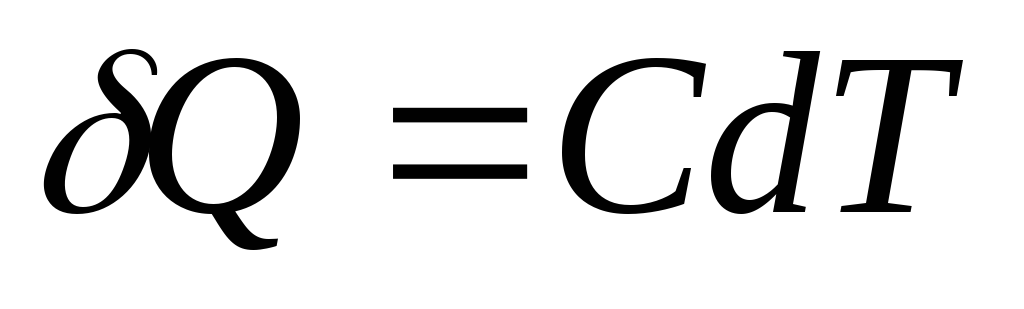 ,
,
そして均質な体のために
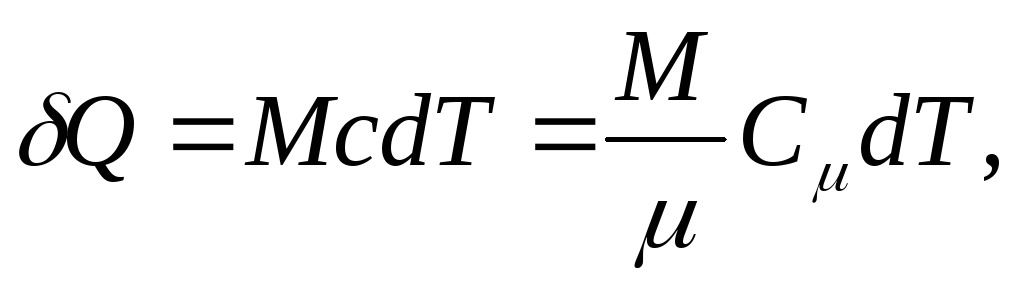 (25.4)
(25.4)
どこ M/ - 物質の量 (モル数)。
§26。 熱力学第一法則
熱力学の第一法則 (第一法則) は、熱力学系に適用されるエネルギーの保存と変換の法則の数学的表現です。 物理学と化学の分野における実験的および理論的研究の結果として確立され、その最終段階は熱と仕事の等価性の発見、つまり熱の仕事への変換と仕事への変換の発見でした。加熱は常に同じ厳密に一定の量比で行われます。
§24 では、システムの内部エネルギーは 2 つの方法で変更できることに注意してください: 仕事を行うことと、熱を伝達することです。 したがって、次のように書くことができます。
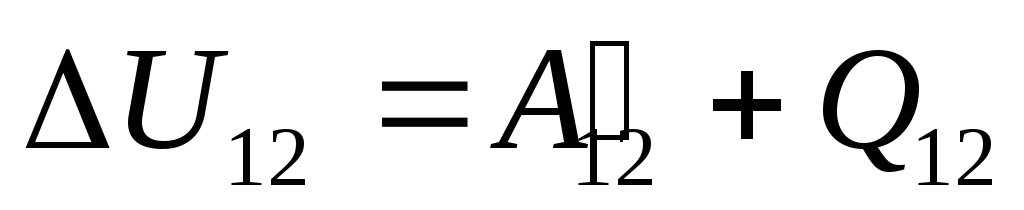 ,
(26.1)
,
(26.1)
どこ
う 12
-
状態からの遷移中のシステムの内部エネルギーの変化 1
状態に 2
それに取り組んだ結果として 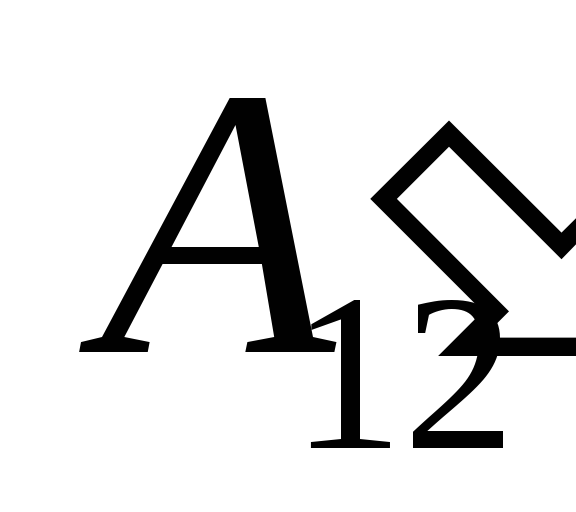 外部の物体から、外部からそれに一定量の熱を伝達する
外部の物体から、外部からそれに一定量の熱を伝達する  .
.
私たちはその仕事を知っています 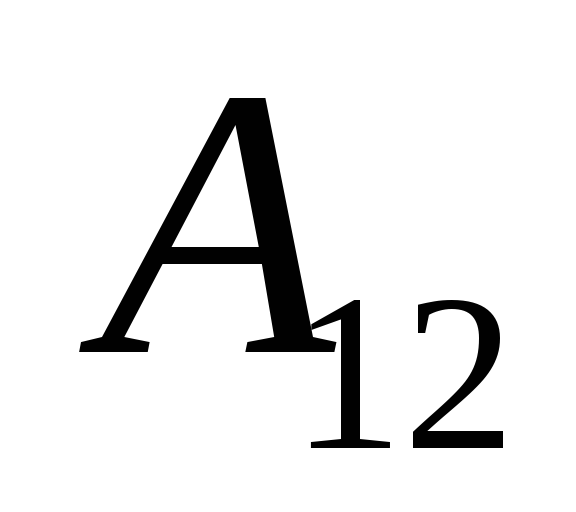 システム自体によって外部の物体に対して実行されたものは、数値的に等しく、符号が逆です。
システム自体によって外部の物体に対して実行されたものは、数値的に等しく、符号が逆です。  システムの上の外部の物体、つまり
システムの上の外部の物体、つまり
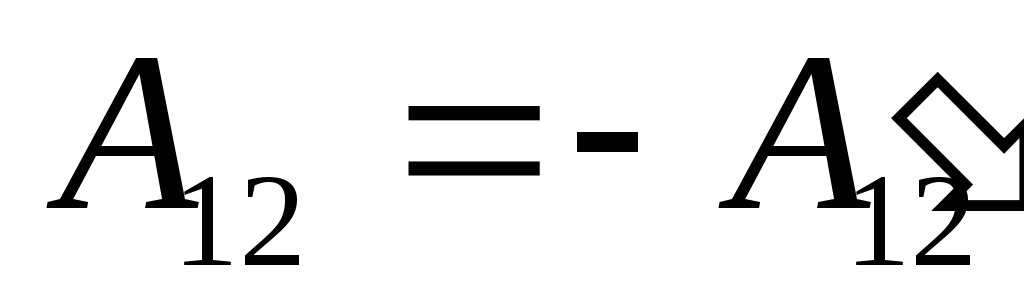 ,
(26.2)
,
(26.2)
したがって、式 (26.1) は次のように書き換えることができます。
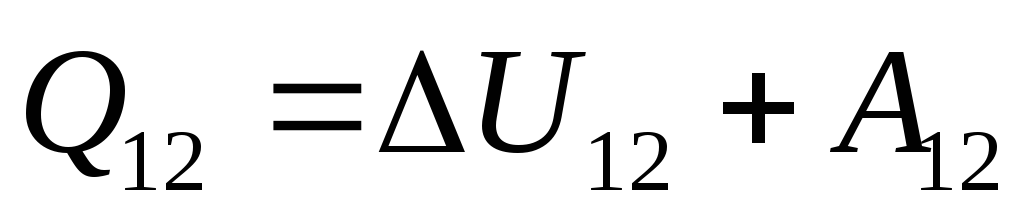 . (26.3)
. (26.3)
この方程式は、熱力学の第 1 法則の数学的記録です。システムに伝えられる熱の量は、システムの内部エネルギーの変化と、システムによる外部物体に対する作業の実行に費やされます。
システムの状態が微小に変化すると、式 (26.3) は次の形式になります。
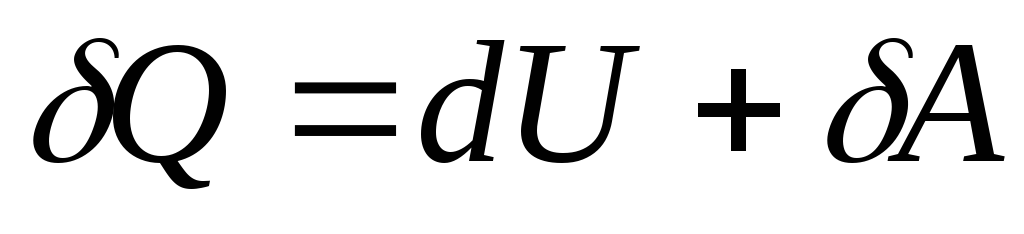 , (26.4)
, (26.4)
どこ 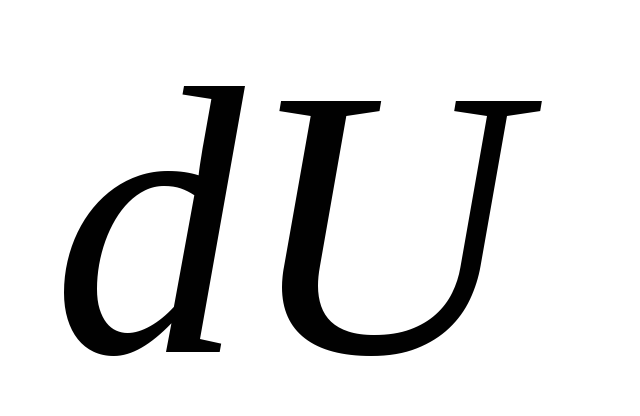 - 基本量の熱がシステムに与えられたときのシステムの内部エネルギーの極小の変化
Qシステムによる基本的な作業の実行
しかし外部体の上。
- 基本量の熱がシステムに与えられたときのシステムの内部エネルギーの極小の変化
Qシステムによる基本的な作業の実行
しかし外部体の上。
