Ի՞նչ միավորներով է չափվում ջերմային հզորությունը: Գազերի ջերմային հզորությունը. Ջերմային հզորությունների տեսակները
Մարմնի ջերմունակությունը ջերմության այն քանակությունն է, որը պետք է փոխանցվի տվյալ մարմնին, որպեսզի նրա ջերմաստիճանը մեկ աստիճանով բարձրանա։ Մեկ աստիճանով սառչելիս մարմինը նույնքան ջերմություն է արձակում։ Ջերմային հզորությունը համաչափ է մարմնի զանգվածին։ Մարմնի միավորի զանգվածի ջերմունակությունը կոչվում է հատուկ, իսկ հատուկ ջերմության արտադրյալը ատոմային կամ մոլեկուլային զանգվածով` համապատասխանաբար ատոմային կամ մոլային:
Ջերմային հզորություններ տարբեր նյութերմեծապես տարբերվում են միմյանցից. Այսպիսով, հատուկ ջերմությունջուրը 20°C-ում 4200 Ջ/կգ Կ է, սոճու փայտը՝ 1700, օդը՝ 1010։ Մետաղների համար այն քիչ է՝ ալյումին՝ 880 Ջ/կգ Կ, երկաթ՝ 460, պղինձ՝ 385, կապար՝ 130։ Տեսակարար ջերմություն։ ջերմաստիճանի հետ փոքր-ինչ ավելանում է (90°C-ում, ջրի ջերմունակությունը 4220 Ջ/կգ Կ է) և մեծապես տատանվում է փուլային փոխակերպումների ժամանակ. 0°C սառույցի ջերմունակությունը 2 անգամ պակաս է, քան ջրինը. ջրի գոլորշիների ջերմային հզորությունը 100°C-ում կազմում է մոտ 1500 Ջ/կգ Կ։
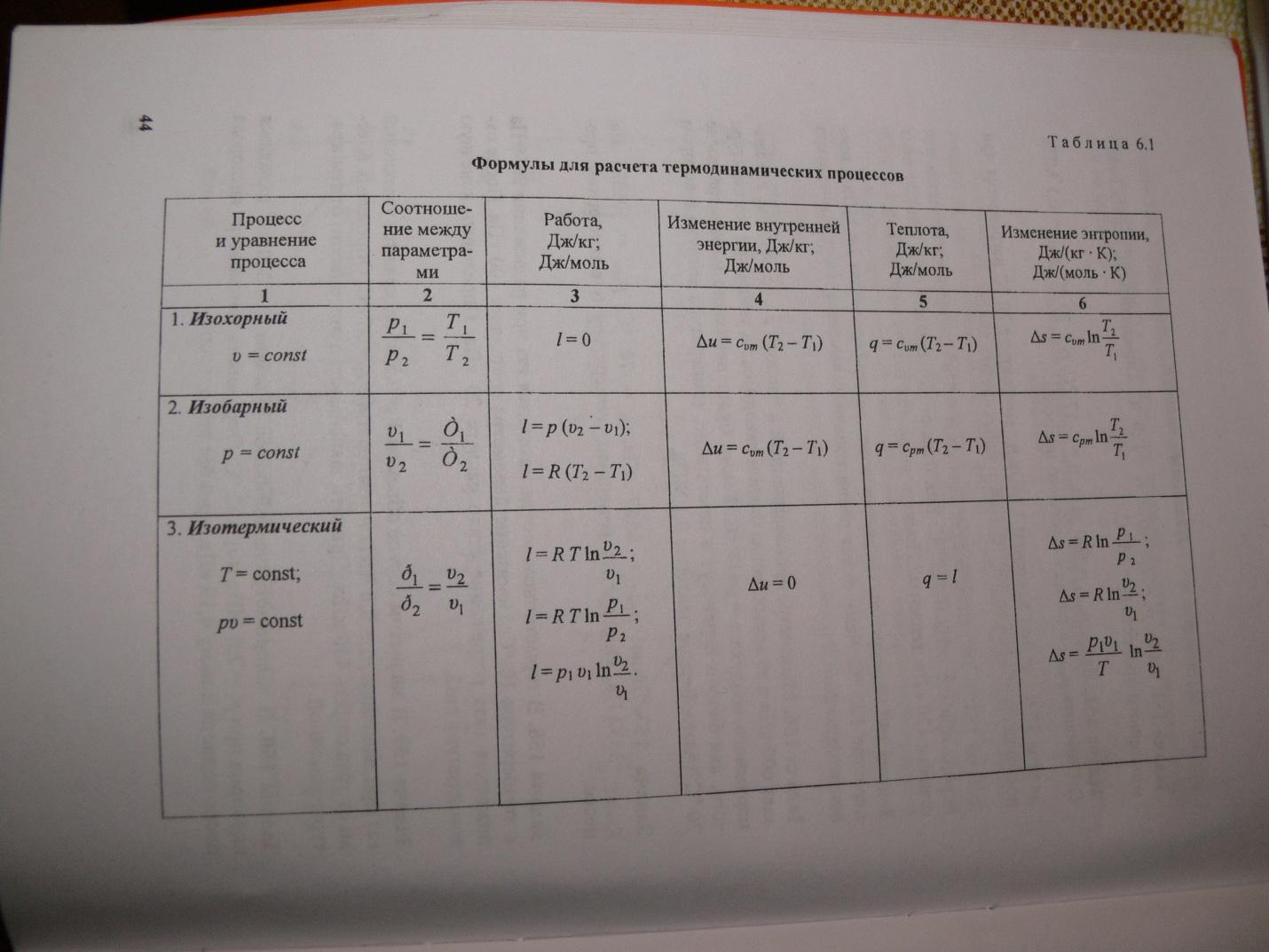
Ջերմային հզորությունը կախված է այն պայմաններից, որոնցում փոխվում է մարմնի ջերմաստիճանը։ Եթե մարմնի չափերը չեն փոխվում, ապա ամբողջ ջերմությունը գնում է ներքին էներգիան փոխելու համար: Այստեղ մենք խոսում ենք մշտական ծավալով ջերմային հզորության մասին: Մշտական արտաքին ճնշման դեպքում, ջերմային ընդարձակման պատճառով, մեխանիկական աշխատանք է կատարվում արտաքին ուժերի դեմ, իսկ որոշակի ջերմաստիճանի ջեռուցումն ավելի շատ ջերմություն է պահանջում։ Հետևաբար, ջերմային հզորությունը մշտական ճնշման դեպքում միշտ ավելի մեծ է, քան . Համար իդեալական գազեր(տես նկարը), որտեղ R-ը գազի հաստատունն է, որը հավասար է 8,32 Ջ/մոլ Կ-ի:
Սովորաբար չափվում է: Դասական եղանակջերմային հզորության չափումները հետևյալն են. մարմինը, որի ջերմունակությունը պետք է չափվի, տաքացվում է մինչև որոշակի ջերմաստիճան և տեղադրվում է նախնական ջերմաստիճանով կալորիմետրի մեջ, լցված ջրով կամ այլ հեղուկով, որն ունի հայտնի ջերմային հզորություն և - ջերմային հզորությամբ: կալորիմետր և հեղուկ):
Ջերմային հավասարակշռության հաստատումից հետո կալորիմետրում ջերմաստիճանը չափելով՝ մարմնի ջերմային հզորությունը կարելի է հաշվարկել՝ օգտագործելով բանաձևը.
![]()
որտեղ և են մարմնի զանգվածները, հեղուկը և կալորիմետրը:
Առավել զարգացած տեսությունը գազերի ջերմունակությունն է։ Սովորական ջերմաստիճաններում ջեռուցումը հիմնականում հանգեցնում է գազի մոլեկուլների փոխադրական և պտտվող շարժման էներգիայի փոփոխության։ Միատոմ գազերի մոլային ջերմունակության համար տեսությունը տալիս է երկատոմային և բազմատոմային - և . Շատ ցածր ջերմաստիճանների դեպքում ջերմային հզորությունը որոշ չափով ավելի քիչ է քվանտային էֆեկտների պատճառով (տես Նկար 1): Քվանտային մեխանիկա) ժամը բարձր ջերմաստիճաններավելանում է թրթռային էներգիա, և պոլիատոմային գազերի ջերմային հզորությունը մեծանում է ջերմաստիճանի բարձրացման հետ։
Բյուրեղների ատոմային ջերմային հզորությունը, ըստ դասական տեսության, հավասար է , որը համապատասխանում է Դուլոնի և Պետի էմպիրիկ օրենքին (ստեղծվել է 1819 թվականին ֆրանսիացի գիտնականներ Պ. Դուլոնգի և Ա. Պետտի կողմից)։ Քվանտային տեսությունջերմային հզորությունը հանգեցնում է նույն եզրակացության բարձր ջերմաստիճանների դեպքում, բայց կանխատեսում է ջերմային հզորության նվազում ջերմաստիճանի նվազմամբ: Բացարձակ զրոյի մոտ բոլոր մարմինների ջերմունակությունը ձգտում է զրոյի (թերմոդինամիկայի երրորդ օրենք)։
Մարմնի ջերմային հզորությունը- սա ֆիզիկական քանակություն, որը որոշվում է տաքացման ժամանակ մարմնի կողմից կլանված ջերմության քանակի և նրա ջերմաստիճանի փոփոխության հարաբերակցությամբ.
Մարմնի ջերմունակության ֆիզիկական նշանակությունը. մարմնի ջերմունակությունը հավասար է մարմնի կողմից տաքացման ժամանակ կլանված կամ 1K-ով սառչելիս արտազատվող ջերմության քանակին:
Քանի որ ջերմային հզորությունները փոփոխական են, նրանք տարբերում են միջին և իրական ջերմային հզորությունները: Միջին ջերմային հզորության տակ հասկանալ ջերմության քանակի հարաբերակցությունը ք , ամփոփված է նյութի (գազի) քանակի միավորի, մինչև դրա ջերմաստիճանի փոփոխությունը տ 1 նախքան տ 2 պայմանով, որ ջերմաստիճանի տարբերությունը տ 2 - տ 1 վերջավոր արժեք է: Միջին զանգվածը, ծավալը և մոլային ջերմային հզորությունները համապատասխանաբար նշանակվում են գ մ , ք մ ' և մ . Միջին ջերմային հզորության սահմանումից հետևում է, որ եթե գազի ջերմաստիճանը բարձրանում է տ 1 նախքան տ 2 ապա դրա միջին ջերմային հզորությունը [կՋ / (կգ * Կ)]
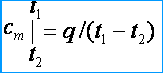
Իրական ջերմային հզորության ներքո հասկանալ գազի ջերմային հզորությունը, որը համապատասխանում է գազի ջերմաստիճանի անվերջ փոքր փոփոխությանը, որը համապատասխանում է ջերմաստիճանի անսահման փոքր փոփոխությանը dt , այսինքն.
c = dq/dt,
որտեղ dq = cdt.
Հատուկ ջերմությունտարբեր նյութերի տաքացման ժամանակ ջերմություն կլանելու ունակությունն է։ Նյութի տեսակարար ջերմունակությունը որոշվում է տաքացնելիս ստացած ջերմության քանակի հարաբերակցությամբ նյութի զանգվածին և նրա ջերմաստիճանի փոփոխությանը, եթե. ![]()
Cp-ի և CV-ի մոլային ջերմային հզորությունների միջև կապն արտահայտող հարաբերությունն ունի ձև (Մայերի բանաձև). իդեալական գազԵթե ջերմության փոխանցման արդյունքում որոշակի քանակությամբ ջերմություն է փոխանցվում մարմնին, ապա փոխվում է մարմնի ներքին էներգիան եւ նրա ջերմաստիճանը։ 1 կգ նյութը 1 Կ-ով տաքացնելու համար Q ջերմության քանակը կոչվում է c նյութի տեսակարար ջերմություն։ c = Q / (mΔT): Շատ դեպքերում հարմար է օգտագործել C մոլային ջերմային հզորությունը՝ C = M c, որտեղ M-ը նյութի մոլային զանգվածն է։ Այս կերպ որոշված ջերմային հզորությունը նյութի միանշանակ բնութագիր չէ: Թերմոդինամիկայի առաջին օրենքի համաձայն՝ մարմնի ներքին էներգիայի փոփոխությունը կախված է ոչ միայն ստացվող ջերմության քանակից, այլև մարմնի կատարած աշխատանքից։ Կախված նրանից, թե ինչ պայմաններում է իրականացվել ջերմափոխանակման գործընթացը, մարմինը կարող է կատարել տարբեր աշխատանքներ։ Հետևաբար, մարմնին փոխանցվող ջերմության նույն քանակությունը կարող է առաջացնել նրա ներքին էներգիայի և, հետևաբար, ջերմաստիճանի տարբեր փոփոխություններ։ Ջերմային հզորության որոշման նման երկիմաստությունը բնորոշ է միայն գազային նյութին։ Երբ հեղուկ և պինդ մարմինները տաքացվում են, դրանց ծավալը գործնականում չի փոխվում, և ընդլայնման աշխատանքը հավասար է զրոյի։ Հետեւաբար, մարմնի ստացած ջերմության ողջ քանակությունը գնում է նրա ներքին էներգիան փոխելու համար: Ի տարբերություն հեղուկների և պինդ նյութեր, ջերմության փոխանցման գործընթացում գազը կարող է մեծապես փոխել իր ծավալը և կատարել աշխատանք։ Հետեւաբար, գազային նյութի ջերմունակությունը կախված է թերմոդինամիկական գործընթացի բնույթից։ Սովորաբար, հաշվի են առնվում գազերի ջերմային հզորության երկու արժեք. Հաստատուն ծավալով պրոցեսում գազը չի աշխատում. A = 0: Թերմոդինամիկայի առաջին օրենքից 1 մոլ գազի համար հետևում է QV = CVΔT = ΔU: Գազի ներքին էներգիայի ΔU փոփոխությունն ուղիղ համեմատական է նրա ջերմաստիճանի ΔT փոփոխությանը։ Մշտական ճնշման տակ գտնվող պրոցեսի համար թերմոդինամիկայի առաջին օրենքը տալիս է. Այստեղից հետևում է. ΔV / ΔT հարաբերակցությունը կարելի է գտնել 1 մոլի համար գրված իդեալական գազի վիճակի հավասարումից՝ pV = RT, որտեղ R-ը գազի համընդհանուր հաստատունն է: P = const-ում Այսպիսով, Cp-ի և CV-ի մոլային ջերմային հզորությունների միջև կապն արտահայտող հարաբերությունն ունի ձև (Մայերի բանաձև)՝ Cp = CV + R:
Գազի հաստատունը թվայինորեն հավասար է մշտական ճնշման տակ 1 մոլ իդեալական գազի ընդլայնման աշխատանքին, երբ տաքացվում է 1 Կ: R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8.31(44) Dzh/ (մոլ Կ)
Գազի համընդհանուր հաստատունը ունիվերսալ, հիմնարար ֆիզիկական հաստատուն R է, որը հավասար է Բոլցմանի k հաստատունի և Ավոգադրոյի հաստատունի արտադրյալին։
Ֆիզիկական իմաստ. Գազի մշտական i-ը թվայինորեն հավասար է իզոբարային պրոցեսում իդեալական գազի մեկ մոլի ընդլայնման աշխատանքին 1 Կ-ով ջերմաստիճանի բարձրացմամբ։
CGS համակարգում գազի հաստատունը հետևյալն է.
Հատուկ գազի հաստատունը հետևյալն է.
Ադիաբատիկ ցուցիչ(երբեմն կոչվում է գործակիցըՊուասոն) - մշտական ճնշման () ջերմային հզորության հարաբերակցությունը մշտական ծավալով ջերմային հզորությանը (): Երբեմն այն նաև կոչվում է գործոն իզենտրոպիկ ընդարձակումներ. Նշվում է հունարեն (գամմա) կամ (կապպա) տառով։ Տառի նշանը հիմնականում օգտագործվում է քիմիական ճարտարագիտության առարկաներում։ Ջերմային ճարտարագիտության մեջ օգտագործվում է լատինական տառը։
Գազերի խառնուրդ մի քանի տարբեր գազերի հավաքածու է, որոնք դիտարկվող պայմաններում քիմիական ռեակցիաների մեջ չեն մտնում միմյանց հետ։
Գազերի խառնուրդը համասեռ թերմոդինամիկ համակարգ է (որի ներսում չկան միջերեսներ, որոնք բաժանում են համակարգի մակրոսկոպիկ մասերը միմյանցից՝ տարբերվելով դրանց հատկություններով և կազմով)։
Մասնակի ճնշում Խառնուրդի i-րդ գազի P i-ն այն ճնշումն է, որի տակ կհայտնվի այս գազը, եթե մնացած բոլոր գազերը հանվեն խառնուրդից, իսկ V և T մնան նույնը:
Դալթոնի օրենք - Գազերի խառնուրդի ճնշումը, որոնք քիմիապես չեն փոխազդում միմյանց հետ, հավասար է այդ գազերի մասնակի ճնշումների գումարին:
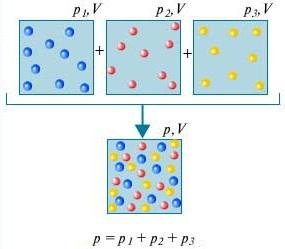
Որպեսզի հասկանանք, թե ինչ է Դալթոնի օրենքը, դրա համար հաշվի առեք սենյակի օդը։ Մի քանի գազերի խառնուրդ է՝ ազոտ (80%), թթվածին (20%)։ Այս գազերից յուրաքանչյուրի մասնակի ճնշումը այն ճնշումն է, որը կունենար գազը, եթե այն միայնակ զբաղեցներ ամբողջ ծավալը: Օրինակ, եթե բոլոր գազերը, բացի ազոտից, հեռացվեն սենյակից, ապա մնացածի ճնշումը կլինի ազոտի մասնակի ճնշումը: Դալթոնի օրենքընշում է, որ բոլոր գազերի ընդհանուր ճնշումը միասին վերցրած հավասար է յուրաքանչյուր գազի առանձին վերցրած մասնակի ճնշման գումարին։ (Խստորեն ասած՝ օրենքը վերաբերում է միայն իդեալական գազերին, բայց բավական լավ մոտարկման դեպքում այն նաև նկարագրում է իրական գազերը):
Թերմոդինամիկայի առաջին օրենքը թերմոդինամիկական համակարգի համար էներգիայի պահպանման և փոխակերպման օրենքի ընդհանրացումն է։ Այն ձևակերպված է հետևյալ կերպ.
Փոխել ΔU Ոչ մեկուսացված թերմոդինամիկական համակարգի ներքին էներգիան հավասար է ջերմության քանակի տարբերությանըՔ փոխանցվել է համակարգին, և աշխատելԱ , կատարյալ համակարգ արտաքին մարմինների վրա։
|
Ջերմոդինամիկայի առաջին օրենքը արտահայտող հարաբերությունը հաճախ գրվում է այլ ձևով.
|
Համակարգի ստացած ջերմության քանակն օգտագործվում է նրա ներքին էներգիան փոխելու և արտաքին մարմինների վրա աշխատանք կատարելու համար։
Թերմոդինամիկայի առաջին օրենքը փորձարարական փաստերի ընդհանրացում է։ Համաձայն այս օրենքի՝ էներգիան չի կարող ստեղծվել կամ ոչնչացվել. այն տեղափոխվում է մի համակարգից մյուսը և մի ձևից վերածվում մյուսի։ Թերմոդինամիկայի առաջին օրենքի կարևոր հետևանքն այն պնդումն է, որ անհնար է ստեղծել մի մեքենա, որը կարող է օգտակար աշխատանք կատարել առանց դրսից էներգիա սպառելու և առանց մեքենայի ներսում որևէ փոփոխության: Նման հիպոթետիկ մեքենան կոչվում է առաջին տեսակի հավերժ շարժման մեքենա (perpetuum mobile): . Նման մեքենա ստեղծելու բազմաթիվ փորձեր անփոփոխ ավարտվում էին անհաջողությամբ: Ցանկացած մեքենա կարող է դրական աշխատանք կատարել Աարտաքին մարմինների վրա միայն որոշակի քանակությամբ ջերմություն ստանալով Քշրջակա մարմիններից կամ Δ-ի նվազում Uնրա ներքին էներգիան:
Եկեք կիրառենք թերմոդինամիկայի առաջին օրենքը գազերի իզոպրոցեսների նկատմամբ։
Իզոբարային ընդարձակմամբ Ք> 0 - ջերմությունը կլանում է գազը, և գազը դրական աշխատանք է կատարում: Իզոբարային սեղմումով Ք < 0 – тепло отдается внешним телам. В этом случае Ա < 0. Температура газа при изобарном сжатии уменьшается, Տ 2 < Տմեկ; ներքին էներգիան նվազում է, Δ U < 0.
AT իզոթերմային գործընթացգազի ջերմաստիճանը չի փոխվում, հետևաբար, գազի ներքին էներգիան, Δ U = 0.
AT isochoric գործընթաց (Վ= const) գազը չի աշխատում, Ա= 0. Հետևաբար,
Թերմոդինամիկայի առաջին օրենքը իզոբար գործընթացի համար տալիս է.
|
Թերմոդինամիկայի առաջին օրենքը իզոթերմային գործընթացի համար արտահայտվում է կապով
|
Ջերմության քանակություն Ք, իզոթերմային ընդարձակման գործընթացում ստացված գազը վերածվում է արտաքին մարմինների վրա աշխատանքի։ Իզոթերմային սեղմման պայմաններում գազի վրա արտադրվող արտաքին ուժերի աշխատանքը վերածվում է ջերմության, որը փոխանցվում է շրջակա մարմիններին։
Իզոխորիկ, իզոբարային և իզոթերմային պրոցեսների հետ մեկտեղ թերմոդինամիկան հաճախ դիտարկում է գործընթացներ, որոնք տեղի են ունենում շրջակա մարմինների հետ ջերմափոխանակության բացակայության դեպքում։ Մեկուսիչ պատերով անոթները կոչվում են ադիաբատիկ պատյաններ, և այդպիսի անոթներում գազի ընդլայնման կամ սեղմման գործընթացները կոչվում են ադիաբատիկ.
AT ադիաբատիկ գործընթացՔ= 0; Այսպիսով, թերմոդինամիկայի առաջին օրենքը ձև է ստանում
|
|
|
Իր ֆիզիկական իմաստով թերմոդինամիկայի առաջին օրենքը թերմոդինամիկայի մեջ էներգիայի պահպանման (փոփոխության) օրենքն է։ Եթե մեխանիկայի էներգիայի փոփոխության օրենքի համաձայն, ոչ պահպանողական ուժերի աշխատանքը հավասար է համակարգի մեխանիկական էներգիայի ավելացմանը (մասնավորապես, բացասական նշան ունեցող շփման ուժերի աշխատանքը հավասար է նվազմանը. համակարգի մեխանիկական էներգիան), այնուհետև, ըստ թերմոդինամիկայի առաջին օրենքի, թերմոդինամիկական համակարգի ներքին էներգիայի աճը հավասար է արտաքին ուժերի աշխատանքի գումարին, որը կատարյալ է համակարգի վրա, և էներգիան փոխանցվում է համակարգին. համակարգ ջերմության փոխանցման միջոցով: Էնթալպիա(հունարենից. էնթալպո- տաքացնել) է նյութի հատկությունը, ցույց տալով էներգիայի քանակությունը, որը կարող է վերածվել ջերմության։ Էնթալպիանյութի թերմոդինամիկական հատկությունն է, որը ցույց է տալիս նրա մոլեկուլային կառուցվածքում պահվող էներգիայի մակարդակը։ Սա նշանակում է, որ թեև նյութը կարող է էներգիա ունենալ՝ հիմնված ջերմաստիճանի և ճնշման վրա, այն ոչ բոլորը կարող են վերածվել ջերմության: Ներքին էներգիայի մի մասը միշտ մնում է նյութի մեջ և պահպանում է իր մոլեկուլային կառուցվածքը։ Նյութի կինետիկ էներգիայի մի մասը հասանելի չէ, երբ նրա ջերմաստիճանը մոտենում է շրջակա միջավայրի ջերմաստիճանին: հետևաբար, էնթալպիաէներգիայի քանակն է, որը հասանելի է տվյալ ջերմաստիճանի և ճնշման դեպքում ջերմության վերածելու համար: Էնթալպիայի միավորներն են՝ BTU կամ Joule էներգիայի համար, Btu/lbm կամ J/kg՝ հատուկ էներգիայի համար։ 11 հարց |

Նպատակը:Նյութերի ջերմունակության փորձարարական որոշում.
Սարքավորումներ:Կշեռք, քաշ, կալորիմետր, հայտնի ջերմունակությամբ մետաղյա բալոն, բաժակ, տաքացուցիչ, կեռիկ:
Համառոտ տեսություն.
Բոլոր մակրոսկոպիկ մարմինները և մարմինների համակարգերը, բացի մեխանիկական էներգիայից, իրենց շարժման և փոխազդեցության շնորհիվ, ունեն էներգիա, որը կախված է նրանց ներքին վիճակից: Այս էներգիան, որը շարժման և մարմինը կազմող բոլոր մասնիկների փոխազդեցության էներգիան է, կոչվում է ներքին։
Ներքին էներգիան ներառում է տվյալ մարմինը կազմող մոլեկուլների և ատոմների ջերմային շարժման կինետիկ էներգիան, միջուկների շուրջ ատոմներում շարժվող էլեկտրոնների կինետիկ էներգիան, մոլեկուլների, ատոմների, էլեկտրոնների և միջուկների փոխազդեցության պոտենցիալ էներգիան, միջուկի նուկլոնները։ և այլն։ Ներքին էներգիա հասկացությունը չի ներառում տվյալ մարմնի կինետիկ և պոտենցիալ էներգիան որպես ամբողջություն։
Ներքին էներգիան եզակիորեն որոշվում է տվյալ համակարգի վիճակը բնութագրող պարամետրերի բազմությամբ, այսինքն. այս համակարգի վիճակի միարժեք ֆունկցիան է։
Ներքին էներգիան սովորաբար նշվում է U տառով։
Ջերմային երևույթներում, որոնք տեղի են ունենում փուլային անցումների ջերմաստիճանից հեռու ջերմաստիճաններում, DU-ի ներքին էներգիայի փոփոխությունը կապված է մոլեկուլների կինետիկ և պոտենցիալ էներգիայի փոփոխության հետ, մինչդեռ ներքին էներգիայի մնացած բաղադրիչները չեն փոխվում: Հետևաբար, նման գործընթացներում մենք կարող ենք ենթադրել, որ մարմնի ներքին էներգիան հավասար է բոլոր մոլեկուլների քաոսային ջերմային շարժման կինետիկ էներգիաների գումարին այս մարմնի զանգվածի կենտրոնի և բոլորի փոխազդեցության պոտենցիալ էներգիաների հետ։ մոլեկուլները միմյանց հետ:
Երբ մարմնի վիճակը փոխվում է, նրա ներքին էներգիան փոխվում է։ Օրինակ, երբ մարմնի ջերմաստիճանը բարձրանում է, նրա ներքին էներգիան մեծանում է, քանի որ այս մարմնի մոլեկուլների շարժման միջին կինետիկ էներգիան մեծանում է։ Ջերմաստիճանի նվազման հետ մարմնի ներքին էներգիան նվազում է։
Մարմինների ներքին էներգիան կարող է փոխվել տարբեր ճանապարհներ. Օրինակ, ներքին էներգիան փոխվում է, երբ մեխանիկական աշխատանք է կատարվում տվյալ մարմնի վրա արտաքին ուժերի կողմից դրա դեֆորմացման ժամանակ, ինչպես նաև առանց աշխատանքի, երբ մարմինը շփվում է մեկ այլ մարմնի (կամ միջավայրի) հետ, որն ունի ավելի բարձր կամ ցածր ջերմաստիճան, քան տվյալ մարմինը։
Առանց մեխանիկական աշխատանք կատարելու մարմնի ներքին էներգիան փոխելու գործընթացը կոչվում է ջերմափոխանակում կամ ջերմափոխանակում։ Գոյություն ունեն ջերմության փոխանցման երեք տեսակ՝ կոնվեկցիա, հաղորդում և ճառագայթում:
Ջերմափոխանակության ժամանակ էներգիայի փոխակերպում չի կատարվում մի տեսակից մյուսը։ Ջերմության փոխանցման գործընթացը բաղկացած է նրանից, որ ավելի տաք մարմնի ներքին էներգիայի մի մասը փոխանցվում է ավելի քիչ տաք մարմնի (կամ միջինի):
Ջերմափոխանակման գործընթացները բնութագրելու համար ներկայացվում է ջերմության քանակի հասկացությունը, որը կոչվում է մեծություն, որը ջերմության փոխանցման գործընթացում մարմնի ներքին էներգիայի փոփոխության քանակական միջոց է։
Պետք է հիշել, որ մարմինը կարող է տալ կամ ստանալ միայն էներգիա, իսկ ջերմության Q քանակը միայն ջերմության փոխանցման գործընթացում մարմնի կողմից տրված կամ ստացած էներգիայի թվային համարժեքն է:
Ջերմության քանակությունը կախված է գործընթացի տեսակից և համակարգի վիճակի ֆունկցիա չէ:
Մարմինը տաքացնելու համար պահանջվող ջերմության քանակությունը, որը տեղի է ունենում առանց փուլային փոխակերպումների (առանց նյութի ագրեգացման վիճակը փոխելու).
որտեղ c-ն մարմնի հատուկ ջերմային հզորությունն է, որը որոշվում է մարմնի m զանգվածին փոխանցվող ջերմության քանակի հարաբերակցությամբ և DT-ի ջերմաստիճանի փոփոխության արդյունքում, m-ը մարմնի զանգվածն է, DT-ն՝ վերջնական տարբերությունը: և տվյալ մարմնի սկզբնական ջերմաստիճանը։
Ջերմության այն քանակությունը, որը պետք է փոխանցվի մարմնին, որպեսզի բարձրացվի նրա ջերմաստիճանը մեկ Կելվինով, կոչվում է այս նյութի ջերմունակություն։ Երբ սառչում է մեկ Կելվինով, մարմինը նույն քանակությամբ ջերմություն է տալիս: Մարմնի ջերմունակությունը համաչափ է մարմնի զանգվածին և կախված է այն նյութից, որից այն կազմված է։ SI միավորների համակարգում ջերմային հզորությունը չափվում է J/K-ով:
Նյութի ջերմային հատկությունները բնութագրելու համար վերցվում է այս նյութի միավոր զանգվածի ջերմունակությունը։ Այս հատկանիշը կոչվում է հատուկ ջերմային հզորություն: Այն հավասար է տվյալ մարմնի ջերմային հզորության և զանգվածի հարաբերությանը։ Հատուկ ջերմային հզորությունը SI համակարգով չափվում է J / (kg × K):
Փորձնականորեն մետաղական մարմնի հատուկ ջերմությունը որոշվում է կալորիմետրի և ջերմաչափի միջոցով: Ամենապարզ կալորիմետրը բաղկացած է փայլեցված մետաղյա ապակուց, որը տեղադրված է մեկ այլ ապակու ներսում խցանների վրա (ջերմամեկուսացման նպատակով): Ներքին ապակին լցված է ջրով կամ հայտնի հատուկ ջերմային հզորությամբ այլ հեղուկով: Որոշակի ջերմաստիճանի t տաքացված մարմինը իջեցվում է կալորիմետրի մեջ: Հեղուկի ջերմաստիճանը կալորիմետրում թող լինի t 1 մինչև մարմնի իջեցումը, իսկ հեղուկի և դրա մեջ իջեցված մարմնի ջերմային հավասարակշռությունը հաստատելուց հետո դրանց ընդհանուր ջերմաստիճանը հավասար կլինի q-ի:
Էներգիայի պահպանման օրենքից հետևում է, որ.
Q \u003d Q 1 + Q 2,(2)
որտեղ է ջերմության քանակը Ք, որը տրվում է տաքացած մարմնի կողմից, հավասար է ջերմության քանակի գումարին Q1,ստացված ջրով և Q2,ստացված կալորիմետրով:
Հաշվի առնելով (1)՝ (2) մենք վերագրում ենք հետևյալ կերպ.
սմ (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
որտեղ գ 1և մ 1- հատուկ ջերմային հզորությունը և ջրի զանգվածը կալորիմետրում, գ 2և մ2- տեսակարար ջերմային հզորություն և կալորիմետրի զանգված: Այս հավասարումը կոչվում է ջերմային հաշվեկշռի հավասարում։ Դրանից մենք գտնում ենք մարմնի հատուկ ջերմային հզորությունը.
Այս խնդրի լուծմանը կարելի է այլ կերպ մոտենալ, ենթադրենք, որ մեկ փորձի շրջանակներում էներգիայի կորուստները նույնն են լինելու։ Մարմին Հետհայտնի հատուկ ջերմային հզորություն, ջեռուցվում է որոշակի ջերմաստիճանի տ, իջեցված կալորիմետրի մեջ, որի ջերմաստիճանը փոխվում է։ Այնուհետև ջերմային հաշվեկշռի հավասարումը կունենա հետևյալ ձևը.
սմ (t-q) = c 1 m 1 (q-t 1) + Q կորուստ,(5)
որտեղ Q կորուստկալորիմետրի ստացած ջերմության քանակն է և միջավայրը, հետևաբար.
Q կորուստ, = cm(t-q) - c 1 m 1 (q-t 1): (6)
Եթե անհայտ հատուկ ջերմային հզորությամբ մարմինը, որը ջեռուցվում է նույն ջերմաստիճանում, իջեցվում է կալորիմետրի մեջ, ապա ջերմային հաշվեկշռի հավասարումը կստանա հետևյալ ձևը.
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q կորուստներ,(7)
որտեղ մ¢ 1ջրի զանգվածն է կալորիմետրում, և t¢ 1- ջրի ջերմաստիճանը այս փորձի մեջ: Ապա.
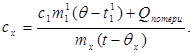 (8)
(8)
Փոխարինելով (6) արժեքը (8)-ով՝ մենք ստանում ենք.
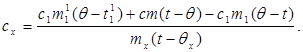 (9)
(9)
որտեղ է ջերմության տարրական քանակությունը; - ջերմաստիճանի տարրական փոփոխություն.
Ջերմային հզորությունը թվայինորեն հավասար է ջերմության քանակին, որը պետք է մատակարարվի համակարգին՝ տվյալ պայմաններում ջերմաստիճանը 1 աստիճանով բարձրացնելու համար։ Քանի որ SI-ում ջերմության միավորը ջոուլն է, իսկ ջերմաստիճանը՝ K աստիճանը, ջերմային հզորության միավորը J/K է:
Կախված մարմնի քանակական միավորից, որին ջերմություն է մատակարարվում թերմոդինամիկայում, առանձնանում են զանգվածային, ծավալային և մոլային ջերմային հզորությունները։
Զանգվածային ջերմային հզորությունաշխատանքային հեղուկի մեկ միավոր զանգվածի ջերմունակությունն է,
որտեղ և են մարմնի ծավալն ու խտությունը նորմալ ֆիզիկական պայմաններում:
Ծավալային ջերմային հզորությունը չափվում է J/(m3 K):
Մոլային ջերմային հզորություն- ջերմային հզորությունը, որը վերաբերում է աշխատանքային հեղուկի (գազի) քանակին մոլերում,
| , |
որտեղ մ3/մոլը նորմալ պայմաններում գազի մոլային ծավալն է:
Հաշվի առնելով, որ ջերմային հզորությունը հաստատուն չէ, այլ կախված է ջերմաստիճանից և այլ ջերմային պարամետրերից, տարբերակում են իրական և միջին ջերմային հզորությունները: Սովորաբար, իրական ջերմային հզորությունը հասկացվում է որպես ջերմության տարրական քանակի հարաբերակցությունը, որը հաղորդում է ջերմադինամիկական համակարգին ցանկացած գործընթացում, այս համակարգի ջերմաստիճանի անսահման փոքր աճին, որն առաջանում է փոխանցվող ջերմությունից: Մենք կդիտարկենք թերմոդինամիկական համակարգի իրական ջերմային հզորությունը համակարգի ջերմաստիճանում, որը հավասար է , և - ճշմարիտ հատուկ ջերմային հզորությունաշխատանքային հեղուկը իր ջերմաստիճանում հավասար է. Այնուհետև կարող է որոշվել աշխատանքային հեղուկի միջին տեսակարար ջերմային հզորությունը, երբ նրա ջերմաստիճանը փոխվում է մինչև
Մարմնի ներքին էներգիայի որոշում.
Ներքին էներգիամարմին (նշվում է որպես Եկամ U) մոլեկուլի մոլեկուլային փոխազդեցությունների և ջերմային շարժումների էներգիաների գումարն է։ Մասնավորապես, իդեալական գազի ներքին էներգիան հավասար է անընդհատ և պատահական ջերմային շարժման մեջ գտնվող բոլոր գազի մասնիկների կինետիկ էներգիաների գումարին։ Դրանից բխում է Ջուլի օրենքը, որը հաստատվել է բազմաթիվ փորձերով։
Մոլեկուլային կինետիկ տեսությունը հանգեցնում է իդեալական մոնատոմային գազի մեկ մոլի ներքին էներգիայի հետևյալ արտահայտությանը (հելիում, նեոն և այլն), որի մոլեկուլները կատարում են միայն թարգմանական շարժում.
Այս կերպ, ներքին էներգիա Uմարմինը եզակիորեն որոշվում է մարմնի վիճակը բնութագրող մակրոսկոպիկ պարամետրերով. Դա կախված չէ նրանից, թե ինչպես է իրականացվել տվյալ պետությունը։ Ընդունված է ասել, որ ներքին էներգիան պետական ֆունկցիա է։
TD-ում օգտագործվում է ներքին էներգիայի փոփոխությունը, և ոչ թե դրա բացարձակ արժեքը։
Ինչ է ընդլայնման աշխատանքը: ՏԴ-ի առաջին օրենքը.
Ընդարձակման աշխատանք - մեխանիկական աշխատանք, որն իրականացվում է մեքենայի կողմից արտաքին ճնշման ուժերի դեմ դրա ընդլայնման գործընթացում: Երբ ծավալը փոխվում է, գազն աշխատում է, V-ի փոփոխության նշանը համընկնում է աշխատանքի նշանի հետ
TD-ի առաջին օրենքը. համակարգին հաղորդվող ջերմությունն օգտագործվում է ներքին էներգիան փոխարկելու և աշխատանք կատարելու համար:
Ջերմության տեսքով էներգիա ստանալու (կամ տալու) ունակության տեսանկյունից ընդունված է թերմոդինամիկական համակարգը բնութագրել իր ջերմունակությամբ։
Մարմնի (համակարգի) ջերմունակությունը ֆիզիկական մեծություն է, որը թվայինորեն հավասար է այն ջերմության քանակին, որը պետք է փոխանցվի մարմնին (համակարգին), որպեսզի նրա ջերմաստիճանը փոխվի մեկ Կելվինով։
Եթե մարմնին տրվում է անսահման փոքր քանակությամբ ջերմություն Ք, որն առաջացրել է ջերմաստիճանի անսահման փոքր աճ դՏ,ապա դրա ջերմային հզորությունը ԻՑըստ սահմանման հավասար է
SI ջերմային հզորության միավորը ջոուլն է, որը բաժանվում է կելվինի վրա ( Ջ/Դեպի).
Փորձերն ու տեսական հաշվարկները ցույց են տալիս, որ Մարմնի ջերմունակությունը կախված է նրա քիմիական բաղադրությունից, զանգվածից և թերմոդինամիկ վիճակից(օրինակ՝ ջերմաստիճանի վրա), ինչպես նաև մարմնի վիճակի փոփոխման գործընթացի տեսակի վրա, երբ ջերմություն է փոխանցվում նրան։
Հատուկ ջերմային հզորությունը նյութի մեկ միավոր զանգվածի ջերմունակությունն է,այսինքն միատարր նյութի համար
![]() , (25.2)
, (25.2)
որտեղ Հետ- հատուկ ջերմային հզորություն, Մնյութի զանգվածն է։
Հատուկ ջերմության SI միավորը ջոուլն է, որը բաժանվում է կելվին-կիլոգրամով [( Ջ/(Դեպի . կգ)].
Մոլային ջերմունակությունը նյութի մեկ մոլի ջերմունակությունն է,այն է
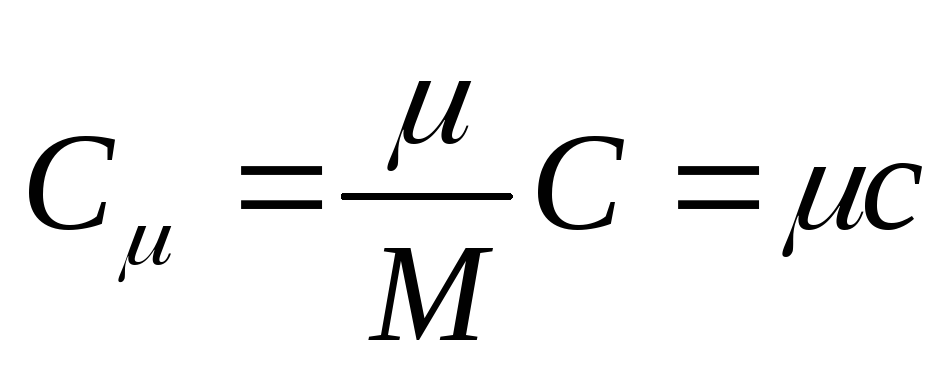 , (25.3)
, (25.3)
որտեղ ԻՑ - մոլային ջերմային հզորություն; նյութի մոլային զանգվածն է։
SI-ում մոլային ջերմային հզորության միավորը կելվին-մոլի վրա բաժանված ջոուլն է [ Ջ/(Դեպի . խալ)].
Ջերմության տարրական քանակություն Ք, անհրաժեշտ է մարմնի ջերմաստիճանը փոխելու համար դՏ, սահմանվում է որպես
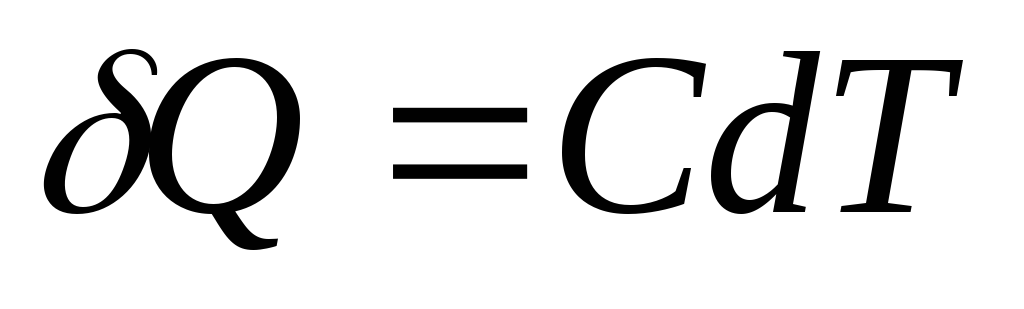 ,
,
և միատարր մարմնի համար
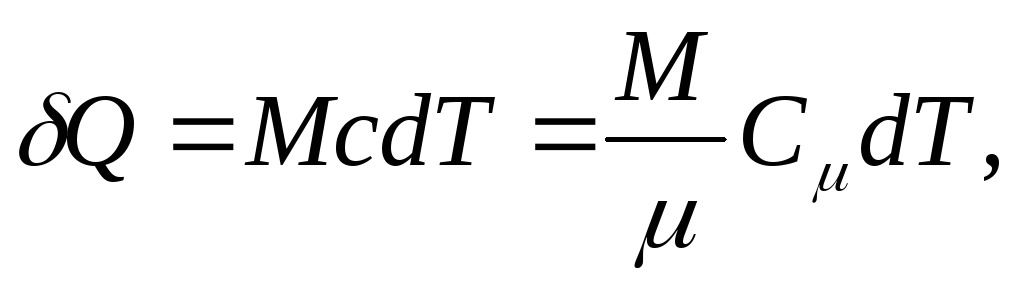 (25.4)
(25.4)
որտեղ Մ/ - նյութի քանակը (խալերի քանակը).
§26. Թերմոդինամիկայի առաջին օրենքը
Թերմոդինամիկայի առաջին օրենքը (առաջին օրենքը) էներգիայի պահպանման և փոխակերպման օրենքի մաթեմատիկական արտահայտությունն է, որը կիրառվում է թերմոդինամիկական համակարգերում։ Այն ստեղծվել է ֆիզիկայի և քիմիայի բնագավառում փորձարարական և տեսական հետազոտությունների արդյունքում, որի վերջնական փուլը եղել է ջերմության և աշխատանքի համարժեքության հայտնաբերումը, այսինքն՝ այն բացահայտումը, որ ջերմությունը վերածվում է աշխատանքի և աշխատանքի։ ջերմությունը միշտ իրականացվում է նույն խիստ հաստատուն քանակական հարաբերակցությամբ:
§24-ում նշվեց, որ համակարգի ներքին էներգիան կարող է փոխվել երկու եղանակով՝ աշխատանք կատարելով և ջերմություն փոխանցելով։ Այսպիսով, մենք կարող ենք գրել.
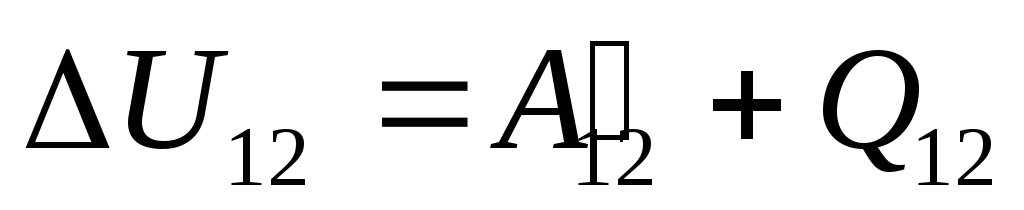 ,
(26.1)
,
(26.1)
որտեղ
U 12
-
համակարգի ներքին էներգիայի փոփոխություն՝ վիճակից անցնելու ընթացքում 1
պետության մեջ 2
դրա վրա կատարված աշխատանքի արդյունքում 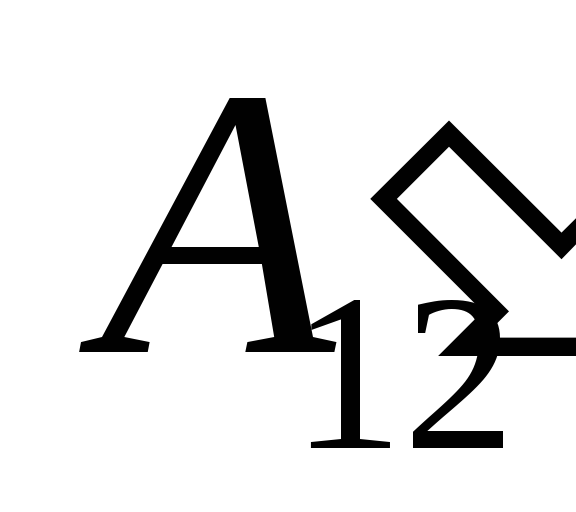 արտաքին մարմիններից և դրսից դրան փոխանցելով որոշակի քանակությամբ ջերմություն
արտաքին մարմիններից և դրսից դրան փոխանցելով որոշակի քանակությամբ ջերմություն  .
.
Մենք գիտենք այդ աշխատանքը 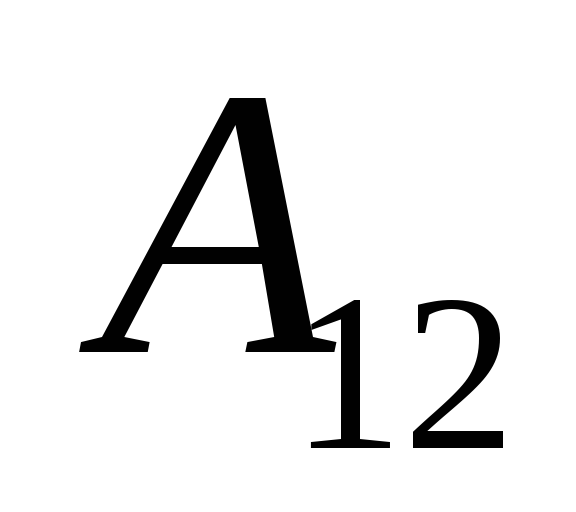 Համակարգի կողմից իրականացվող արտաքին մարմինների վրա թվայինորեն հավասար է և աշխատանքին հակառակ նշանով
Համակարգի կողմից իրականացվող արտաքին մարմինների վրա թվայինորեն հավասար է և աշխատանքին հակառակ նշանով  արտաքին մարմինները համակարգից վեր, այսինքն
արտաքին մարմինները համակարգից վեր, այսինքն
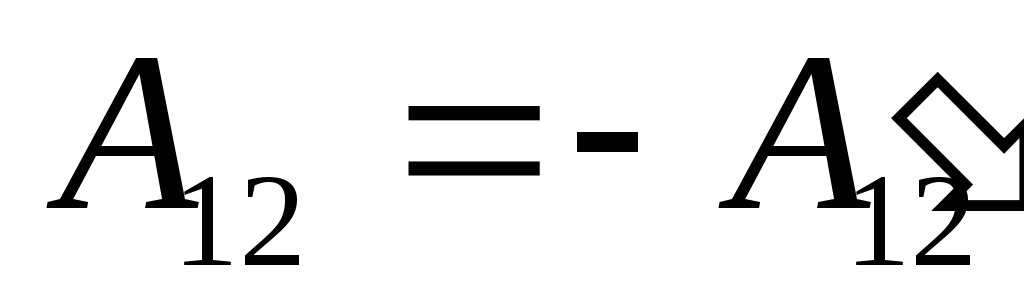 ,
(26.2)
,
(26.2)
հետևաբար (26.1) արտահայտությունը կարող է վերագրվել որպես
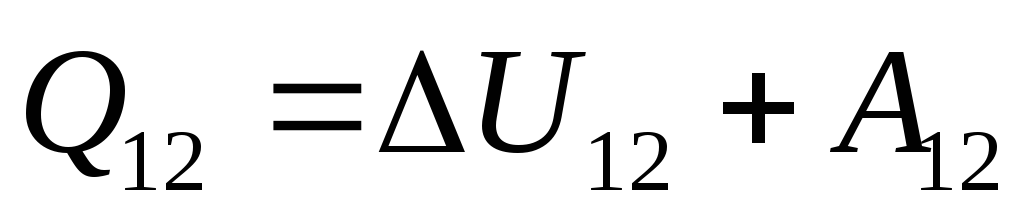 . (26.3)
. (26.3)
Այս հավասարումը թերմոդինամիկայի առաջին օրենքի մաթեմատիկական գրառումն է. համակարգին փոխանցվող ջերմության քանակությունը ծախսվում է նրա ներքին էներգիան փոխելու և համակարգի կողմից արտաքին մարմինների վրա աշխատանք կատարելու վրա:
Համակարգի վիճակի անվերջ փոքր փոփոխության դեպքում (26.3) հավասարումը ձև է ստանում
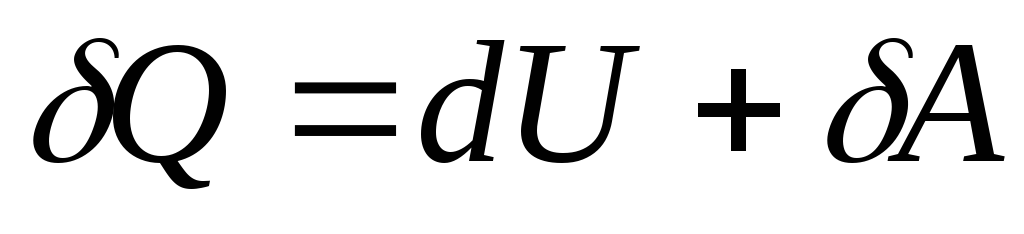 , (26.4)
, (26.4)
որտեղ  - համակարգի ներքին էներգիայի անսահման փոքր փոփոխություն, երբ տարրական քանակությամբ ջերմություն է փոխանցվում նրան.
Քև համակարգի կողմից տարրական աշխատանք կատարելը
ԲԱՅՑարտաքին մարմինների վրայով.
- համակարգի ներքին էներգիայի անսահման փոքր փոփոխություն, երբ տարրական քանակությամբ ջերմություն է փոխանցվում նրան.
Քև համակարգի կողմից տարրական աշխատանք կատարելը
ԲԱՅՑարտաքին մարմինների վրայով.
