Metoda određivanja toplinskog kapaciteta čvrstog tijela
Što je TOPLINSKI KAPACITET
Kada se dovodi toplina, temperatura sustava raste. U slučaju beskonačno male promjene temperature vrijedi proporcionalnost
dT=δQ , ili dT=constδQ
Pogodnije je ovu relaciju napisati u obliku: δQ=SdT odn
Vrijednost C naziva se stvarni toplinski kapacitet sustava.
Toplinski kapacitet je omjer količine topline dovedene u sustav i promjene temperature do koje dolazi.
Uz pravi, postoji i prosječni toplinski kapacitet:
Toplinski kapacitet
Ako se toplinski kapacitet pripiše jedinici mase (molu) tvari, tada on postaje neovisan o masi cijelog sustava i dobiva svojstva intenzivnog parametra. Ako se toplinski kapacitet odnosi na jedinicu mase tvari, naziva se specifičnim, a na 1 mol - toplinski kapacitet s dimenzijom J / (mol * k).
Razmotrit ćemo samo molarne toplinske kapacitete, jer za njih su sve zakonitosti puno jednostavnije nego za specifični toplinski kapacitet.
Toplinski kapacitet ovisi o uvjetima pod kojima se odvija prijenos topline u sustav. Ako je sustav zatvoren u konstantnom volumenu, tada će doći do porasta temperature za dT pod djelovanjem topline jednake CvdT, gdje je Cv toplinski kapacitet pri konstantnom volumenu. U slučajevima konstantnog tlaka tijekom širenja sustava, za povećanje temperature za dT bit će potrebna toplina CpdT, gdje je Cp toplinski kapacitet pri konstantnom tlaku.
S obzirom na uvjete prijenosa topline, kada se jedna ili više varijabli održava konstantnom, dok se druge mijenjaju, toplinski kapacitet može se izraziti pomoću parcijalnih izvedenica: ![]() . Kako je δQ v = dU,
. Kako je δQ v = dU,
δQ p =dH, možemo napisati:
![]() (1)
(1)
Cv je izohorni toplinski kapacitet plinova, Cp je izobarni toplinski kapacitet plinova.
Razlike između izohornog i izobarnog toplinskog kapaciteta nastaju zbog razlike unutarnje energije i entalpije. Promjene entalpije i unutarnje energije razlikuju se prema količini rada koji sustav obavi.
δW=∆nRT, ∆H-∆U=∆nRT
Stoga se toplinski kapaciteti pri konstantnom volumenu Cv i konstantnom tlaku Cp razlikuju i po količini rada: Cp - Cv = δW
Na temelju izraza (1) možemo napisati:
Zamjenom ovih jednakosti u jednadžbu ∆H- ∆U=∆nRT
a uzimajući u obzir da je ∆n= 1, naći ćemo odnos između molarnih toplinskih kapaciteta plinova:
Cp– Cv= R ili Cp= Cv+ R
Kao što se vidi, razlikuju se po vrijednosti plinske konstante.
Iz uvjeta Cp= Cv+ R slijedi da je Cp˃Cv, tj. u izobarnom procesu, kada je P=const, za povećanje temperature sustava potrebno je velika količina topline nego u izohornom procesu.
Molarni toplinski kapacitet plinova ima vrijednosti reda R, pa je razlika između Cp i Cv vrlo značajna. Dakle, za ugljikov dioksid CO 2 na 25 0 C Cp = 37, 14; i Cv = 28,83 J / (mol * K)
Razlika Cp - Cv je rad izobarne ekspanzije jednog mola idealni plin kada temperatura poraste za jedan stupanj. Tekućine i čvrste tvari u tijelu karakterizira lagano povećanje volumena pri zagrijavanju. Stoga za kondenzirana tijela možemo pretpostaviti da je Sr ≈ Sv.
KIRCHHOFFOVA JEDNADŽBA. OVISNOST TOPLINSKIH UČINAKA O TEMPERATURI.
Prethodno razmatrani proračuni toplinskih učinaka temeljeni na Hessovom zakonu za toplinu nastanka i izgaranja ograničeni su standardnim uvjetima. Iz praktičnih razloga potrebno je izračunati toplinske učinke za specifične uvjete koji nisu standardni.
Krenite od poznatih toplinskih učinaka pod standardnim uvjetima, tj. pri temperaturi od 25 0 C (298,15 K) i tlaku od 1 atm. (1,013 * 10 5 Pa), moguće je izračunati toplinske učinke na bilo kojoj temperaturi koja nas zanima koristeći Kirchhoffov zakon. Procese u industrijskim uvjetima karakteriziraju značajne temperaturne varijacije, čiji raspon je određen ne samo uvjetima tehnologije, već i godišnjim dobom. Taj raspon može doseći stotine stupnjeva - prirodno je da će toplinski učinci biti bitno razlikuju i ovise o temperaturi.
Razmotrite Kirchhoffov zakon u diferencijalnom obliku. Da bismo to učinili, zapisujemo promjene entalpije u izobarnim i unutarnje energije u izohornim procesima.
∆H \u003d H2-H1; ∆U \u003d U 2 -U 1.
Diferencirajte ove jednadžbe s obzirom na temperaturu i dobijte:
Kirchhoffove jednadžbe:

I - temperaturni koeficijenti toplinskog učinka izobarnih i izohornih procesa, respektivno; i - promjena toplinskog kapaciteta sustava kao rezultat izobarnih odnosno izohornih procesa.
Na temelju Kirchhoffove jednadžbe, Kirchhoffov zakon je formuliran u diferencijalnom obliku: temperaturni koeficijent toplinskog učinka procesa jednak je promjeni toplinskog kapaciteta sustava koja se javlja kao rezultat tog procesa.
Dakle, Kirchhoffov zakon u diferencijalnom obliku omogućuje određivanje samo promjene toplinskog učinka s temperaturom, a ne i veličinu samog toplinskog učinka.
Analizirajmo Kirchhoffovu jednadžbu
Za reakciju: aA + bB = dD + rR u izobarnom procesu (r=const), prema Kirchhoffovom zakonu, promjena toplinskog kapaciteta u sustavu imat će oblik:
Sličan izraz može se dobiti za izohorni proces:
Budući da Kirchhoffov zakon omogućuje određivanje promjena toplinskog učinka procesa s promjenom temperature, gradimo grafikon:
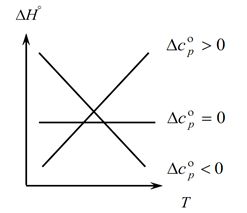
1. Razmotrimo prvi slučaj, kada je ∆Sr(∆Sv)˃0, jer ∆Sr=∑S kon. -∑S početni, stoga slijedi da je zbroj toplinskih kapaciteta produkata reakcije veći od zbroja toplinskih kapaciteta polaznih tvari: ∑S kon. ˃∑Od početka U ovom slučaju na grafu dobivamo krivulju 1, što znači da s porastom temperature raste i promjena toplinskog učinka procesa (T i ∆H);
2. Drugi slučaj, kada je ∆Sr(∆Sv)˂0. Slično prvom zakonu, imamo ∑S con. ˂∑Od ranog (zbroj toplinskih kapaciteta konačnih proizvoda manji je od zbroja toplinskih kapaciteta početnih tvari). Tada na grafu dobivamo krivulju koja znači da s porastom temperature opada promjena toplinskog učinka procesa (T→∆H↓)
3. I treći slučaj, kada je promjena toplinskih kapaciteta sustava jednaka nuli ∆Sr(∆Sv)=0. Tada je zbroj toplinskih kapaciteta konačnih produkata reakcija jednak zbroju toplinskih kapaciteta polaznih tvari ∑S con. \u003d ∑ Od početka. U ovom slučaju toplinski učinak reakcije nije funkcija temperature (∆H ≠ f(T)) i dobivamo ravnu liniju na grafu.
PRORAČUN TOPLINSKIH UČINAKA ZA DAT
TEMPERATURA. INTEGRACIJA KIRCHHOFFOVE JEDNADŽBE
Za pronalaženje vrijednosti toplinskog učinka kao funkcije temperature potrebno je integrirati jednadžbe

Od T do T 0 (gdje je T tražena temperatura, T 0 je standardna temperatura), od ∆H do ∆H 0 ili od ∆U do ∆U 0 (gdje su ∆H i ∆U entalpija i unutarnja energija pod uvjeti koji se razlikuju od standardnih). Integracija se provodi za dva slučaja:
Za ne organska tvar: Za organske tvari:
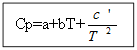
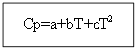
Primjer: za H 2 (g) - anorganska tvar
| Sr=f(T) | T | |||
| a | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H2 (g)) \u003d 27,28 + 3,26 * 10 -3 T+.
a) Približna integracija:
za izobarni proces
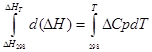
∆H T - ∆H 298 = ∆Cp*(T-298)
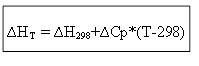
za izohorni proces:
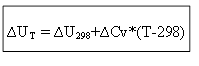
Dakle, za određivanje toplinskog učinka ∆H ili unutarnje energije ∆U pri bilo kojoj temperaturi T, potrebno je znati toplinu procesa u standardnim uvjetima ∆H 0 (∆U 0) i promjenu toplinskih kapaciteta ∆Sr, ∆ Cv.
Primjer. Izračunajte toplinski učinak ∆H procesa dobivanja benzena iz acetilena:
3C 2 H 2 (g) → C 6 H 6 (g) na 75 0 C (348 K).
1. Iz tablica nalazimo prosječne molarne izobarne toplinske kapacitete benzena i acetilena:
Sr S6N6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J/(mol * K).
2. Pronalazimo promjenu toplinskog kapaciteta procesa:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) početno \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) = 81,67 - 3 * 43,93 \u003d - 50,12 J / (mol * K) .
3. Prema tabličnim podacima nalazimo toplinski učinak u standardnim uvjetima:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Nađite toplinski učinak pri zadanoj temperaturi:
∆H = ∆H 0 + ∆Sr (T-T 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
b) Točna integracija:
Razmotrimo drugi, složeniji slučaj, kada promjena toplinskog kapaciteta ovisi o temperaturi, tj. Sr=f(T), Cv=f(T).
Pogledajmo jednadžbu reakcije u općem obliku
dD + rR = qQ + pP
| a | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
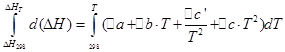
Provest ćemo iste operacije za izohorni proces:
TOPLINA OTAPANJA
Promjena entalpije pri prijelazu čvrste, tekuće ili plinovite tvari u otopinu naziva se toplinska ili entalpija otapanja.
Toplina otapanja općenito uključuje toplinu razaranja kristalne rešetke (npr čvrste tvari), ionizacija i otapanje.
Za prekid veze između iona kristalne soli potrebna je energija, tj. dok se toplina apsorbira. U isto vrijeme dolazi do hidratacije iona u vodenoj otopini; nastaje veza između iona i molekula H 2 O. Predznak topline otapanja određen je procesom koji je energetski jače izražen.
LiBr: ∆H dist = - 49,02 kJ / mol - toplina se oslobađa
KCl: ∆H dist = 7,23 kJ/mol - toplina se apsorbira
Razlikovati: integralna toplina otapanja je toplina koja se oslobađa ili apsorbira kada se 1 mol dane tvari otopi da nastane otopina dane koncentracije. Integralna toplina otapanja varira ovisno o količini otopljene tvari.
Razlikujemo: diferencijalnu toplinu otapanja - to je toplina koja prati otapanje 1 mola određene tvari u beskonačnom vremenu. veliki volumen otopina ove tvari. Integralne topline naširoko se koriste u proračunu toplina stvaranja i toplina drugih reakcija prema Hessovom zakonu. Diferencijalne topline otapanja karakteriziraju termodinamička svojstva otopina i proces njihovog nastanka.
LABORATORIJ #8
ODREĐIVANJE TOPLINSKOG KAPACITETA ČVRSTIH TIJELA
Instrumenti i pribor: eksperimentalna postavka FPT1-8.
Cilj: određivanje toplinskog kapaciteta metalnih uzoraka kalorimetrijskom metodom pomoću električnog grijanja.
Kratka teorija
Specifični toplinski kapacitet tvari - vrijednost jednaka količini topline potrebnoj za zagrijavanje 1 kg tvari za 1 K:
Molarni toplinski kapacitet - vrijednost jednaka količini topline potrebnoj za zagrijavanje 1 mola tvari po 1 K:
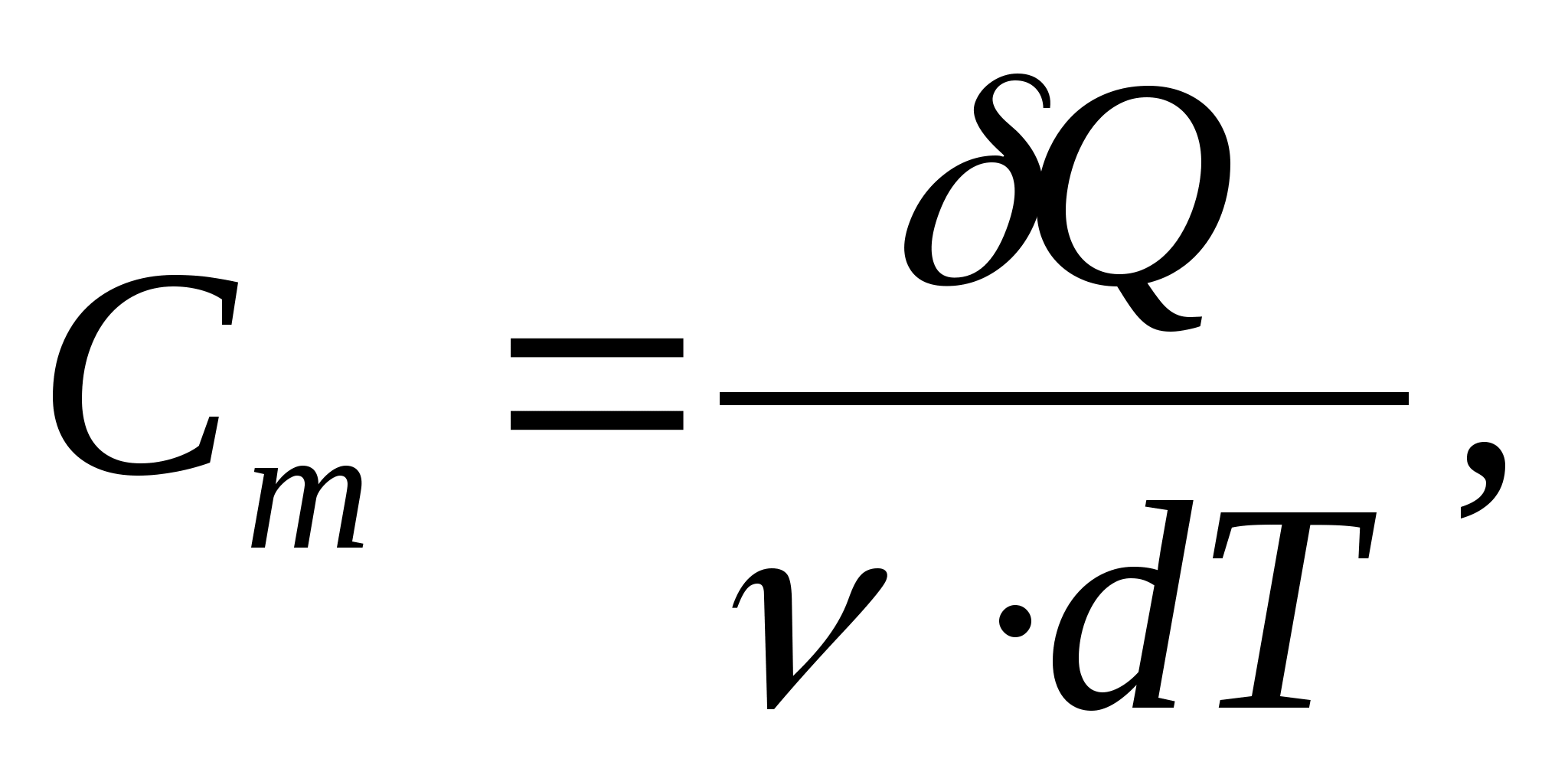
gdje 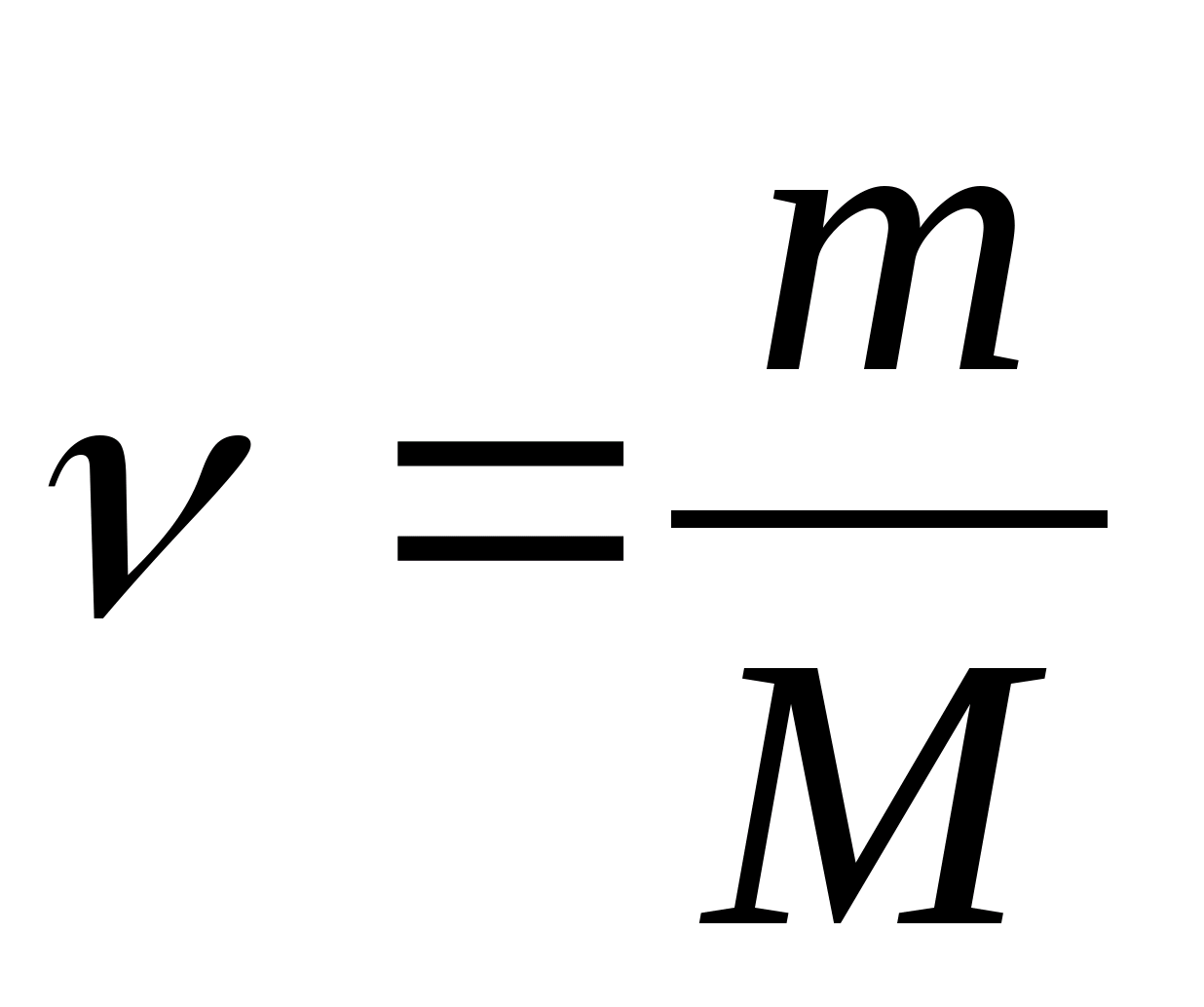 − količina tvari.
− količina tvari.
Određena toplina c povezan s kutnjakom C m omjer

gdje M je molarna masa tvari.
razlikovati toplinski kapacitet pri konstantnom volumenu i stalni pritisak, ako se u procesu zagrijavanja tvari njen volumen ili tlak održava konstantnim.
Najmanji broj neovisnih varijabli (koordinata) koje u potpunosti određuju položaj sustava u prostoru naziva se broj stupnjeva slobode .
Prema Boltzmannovom zakonu o ravnomjernoj raspodjeli energije po stupnjevima slobode molekula, svaki translacijski i rotacijski stupanj slobode ima prosječnu kinetičku energiju jednaku
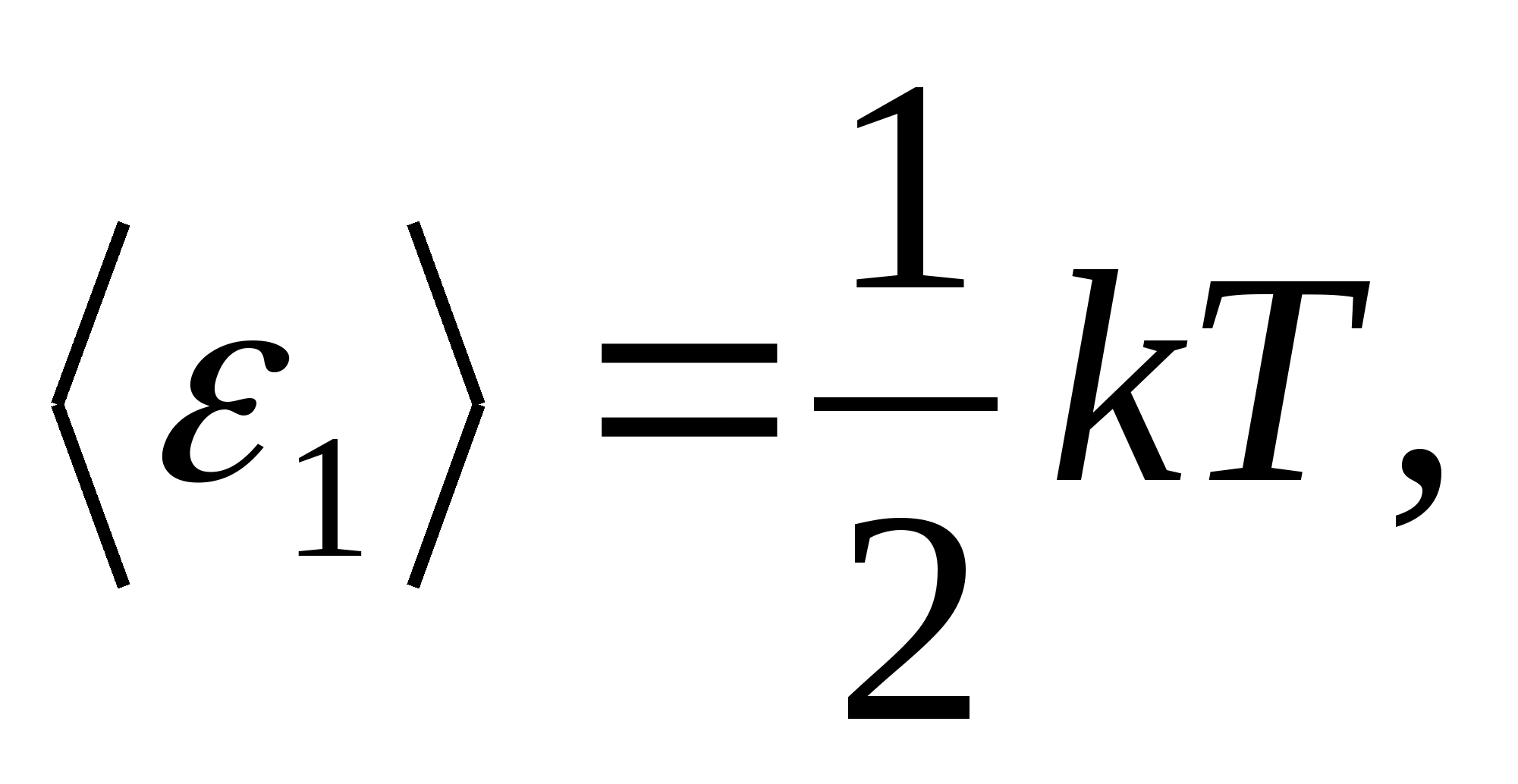
(gdje k je Boltzmannova konstanta), a za svaki vibracijski stupanj slobode, u prosjeku, energija jednaka
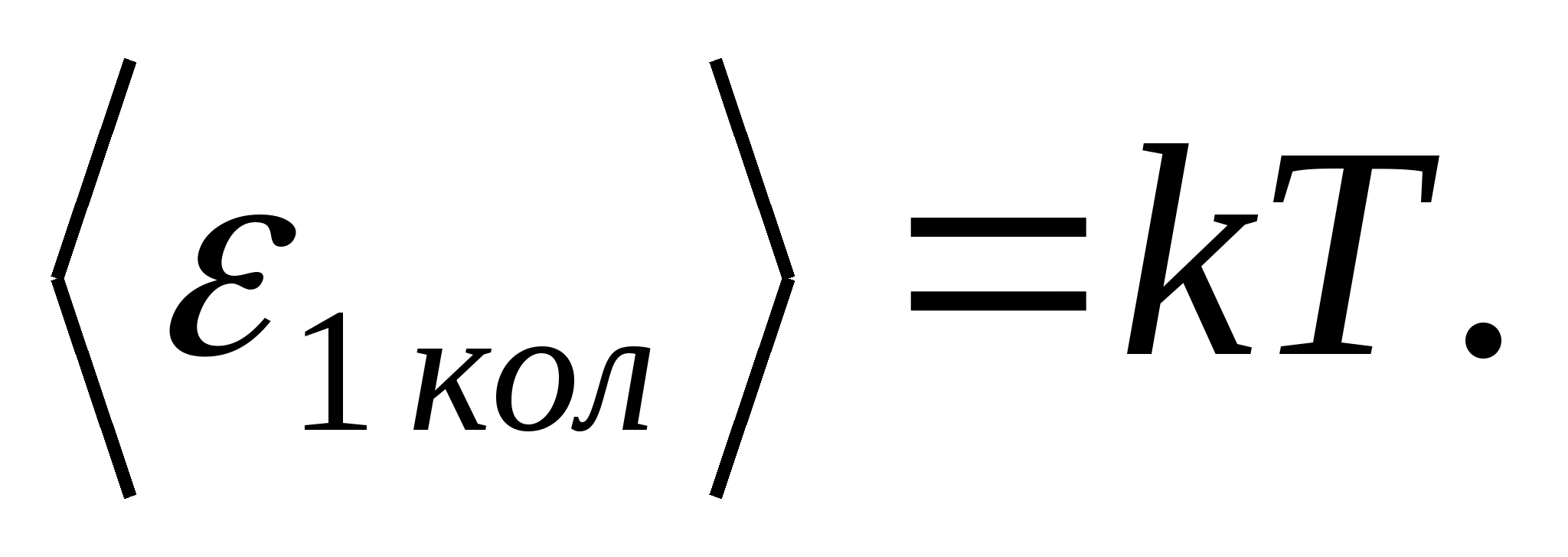
Dakle, prosječna energija molekule
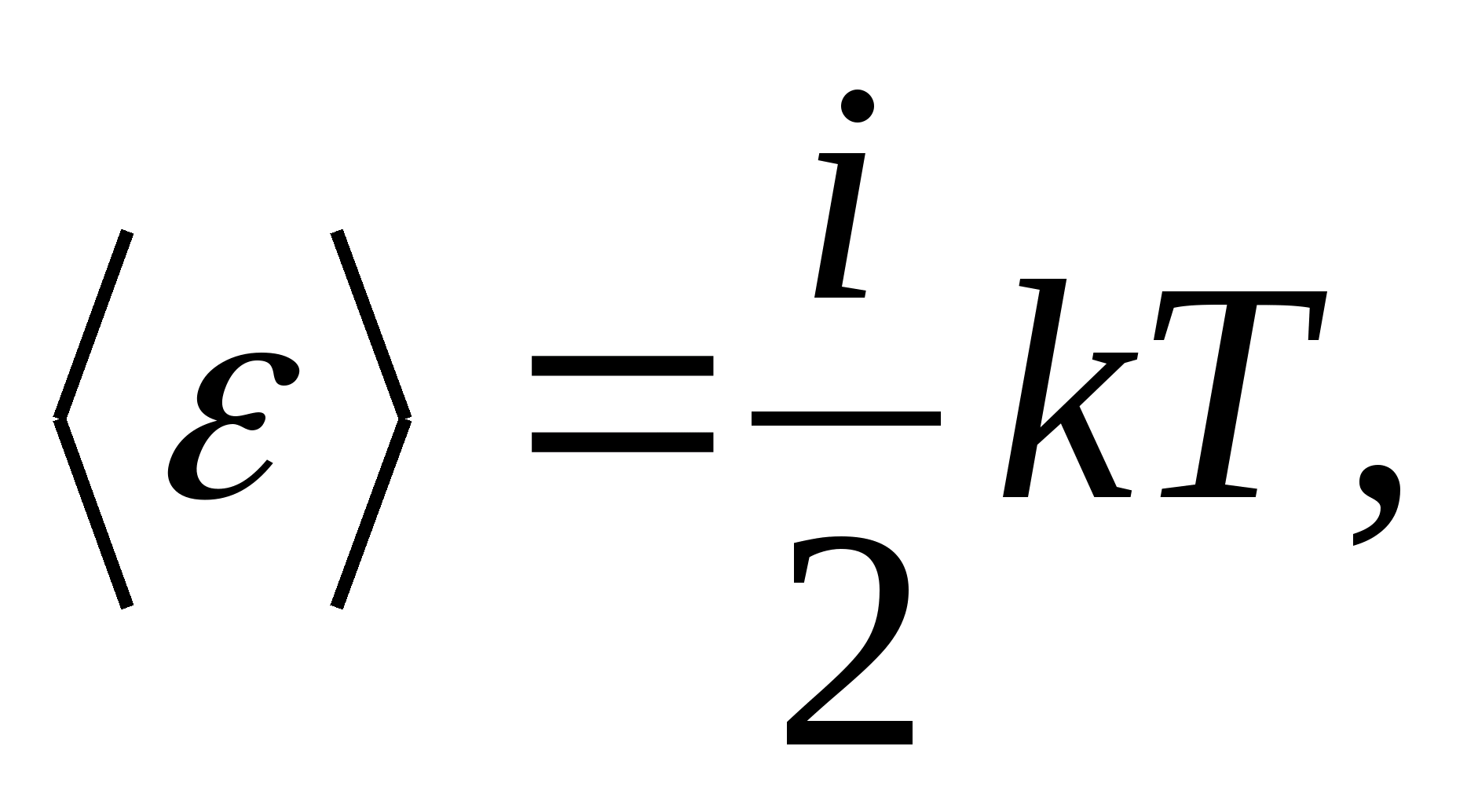
gdje ja je zbroj broja translacijskih, broja rotacijskih i dvostrukog broja vibracijskih stupnjeva slobode molekule:
![]()
Na primjer, prosječna kinetička energija monoatomskih molekula idealnog plina ( 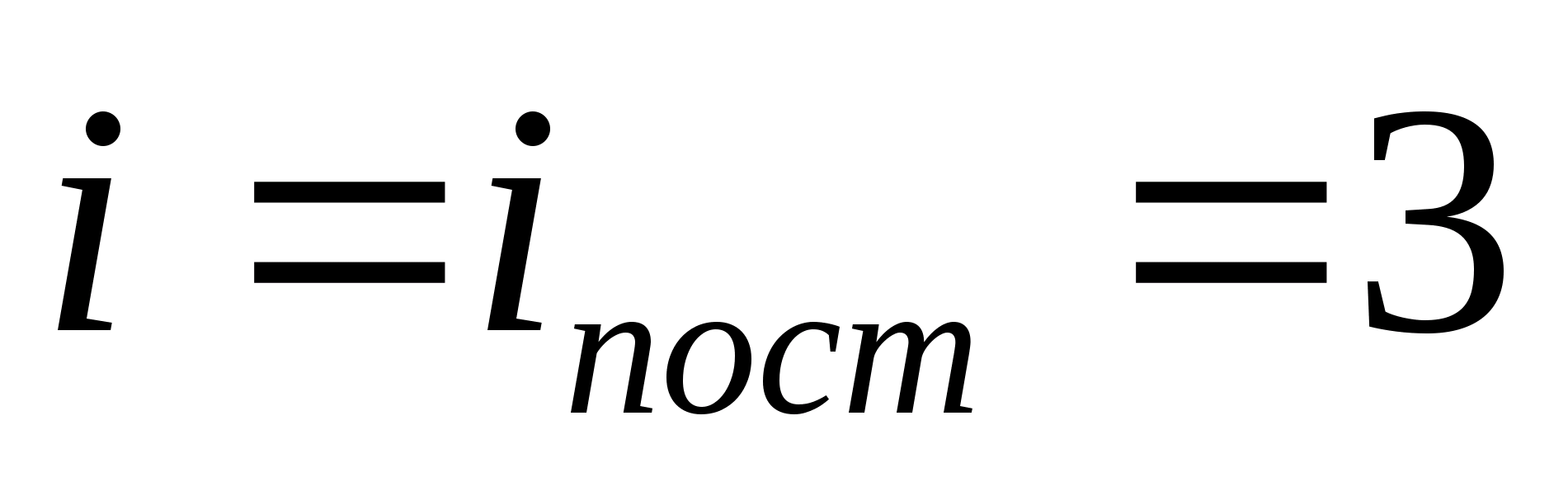 ) jednako je
) jednako je
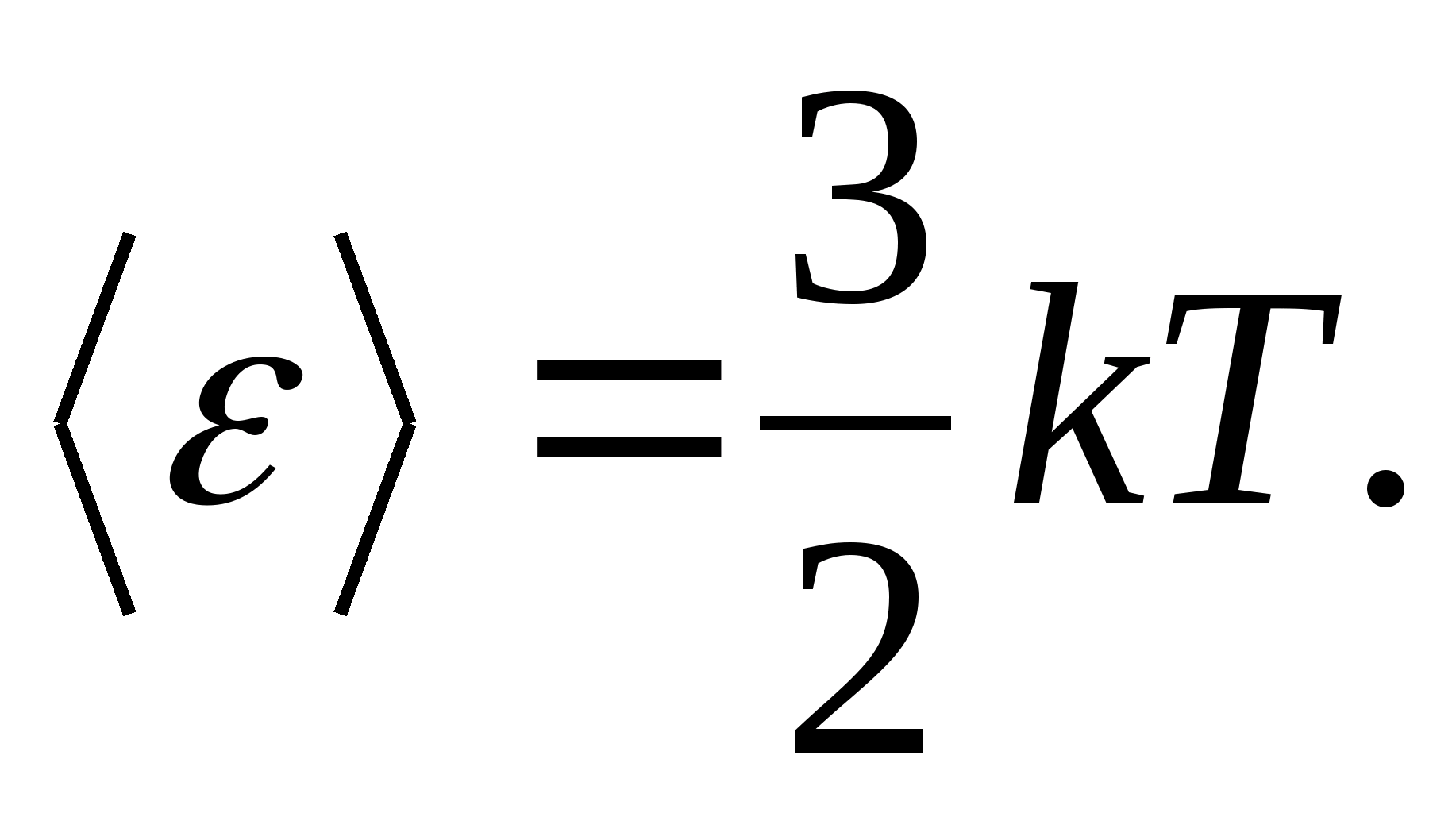
Kao modeličvrstog tijela, razmotrite ispravno izgrađenu kristalnu rešetku, u čijim čvorovima se čestice (atomi, ioni, molekule) uzimaju kao materijalne bodove, osciliraju oko svojih ravnotežnih položaja - čvorovi rešetke - u tri međusobno okomita pravca. Dakle, svakoj čestici koja čini kristalnu rešetku dodijeljena su tri vibracijska stupnja slobode, od kojih svaki, prema zakonu jednolike raspodjele energije po stupnjevima slobode, ima energiju kT.
Zatim prosječna vrijednost ukupne energije čestice tijekom oscilatornog gibanja u kristalnoj rešetki
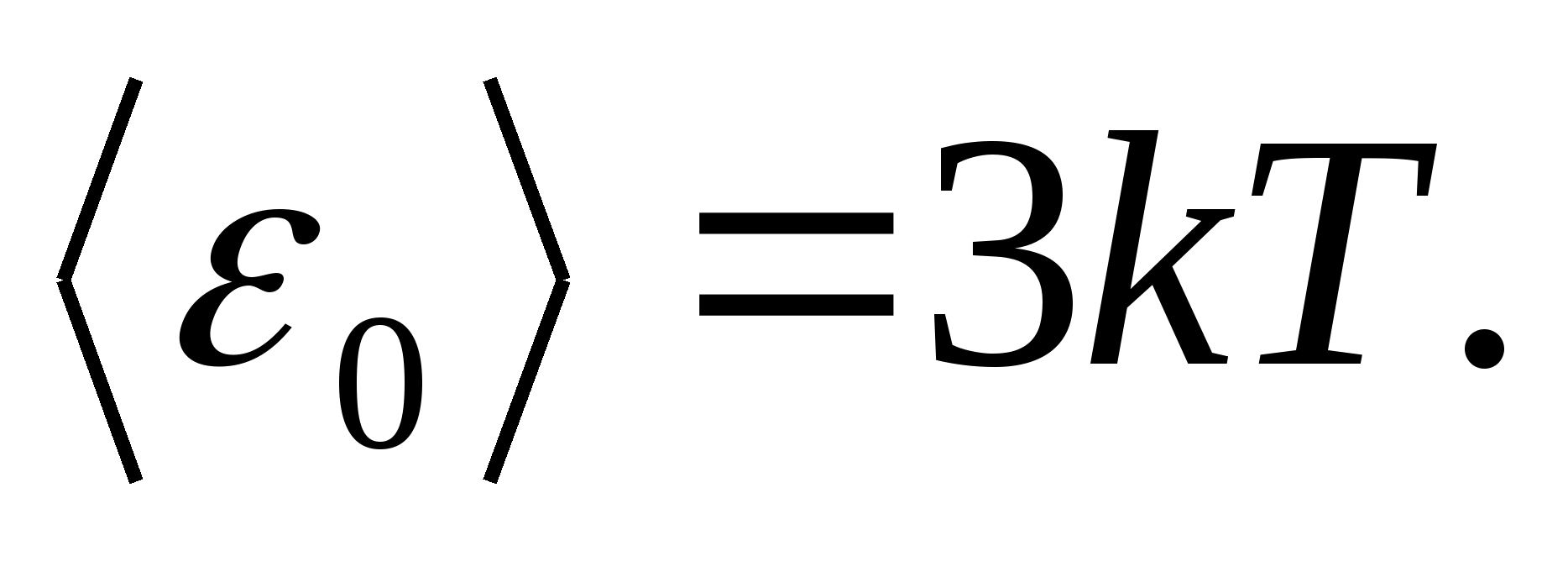
Ukupna unutarnja energija jednog mola krutog tijela dobiva se množenjem prosječne energije jedne čestice s brojem neovisno titrajućih čestica sadržanih u jednom molu, tj. prema Avogadrovoj konstanti N A :
gdje R=N A k je univerzalna (molarna) plinska konstanta, R= 8,31 J/(molK).
Za čvrste tvari, zbog malog koeficijenta toplinskog rastezanja, toplinski kapaciteti pri stalnom tlaku i stalnom volumenu praktički se ne razlikuju. Stoga, uzimajući u obzir (8.1), molarni toplinski kapacitet krutine
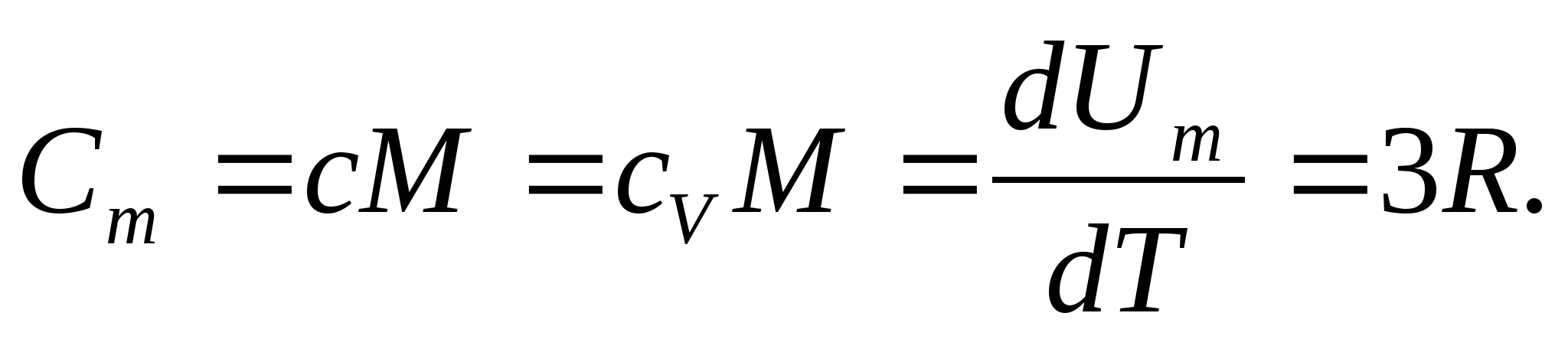 (8.2)
(8.2)
Zamjenom numeričke vrijednosti molarne plinske konstante dobivamo:
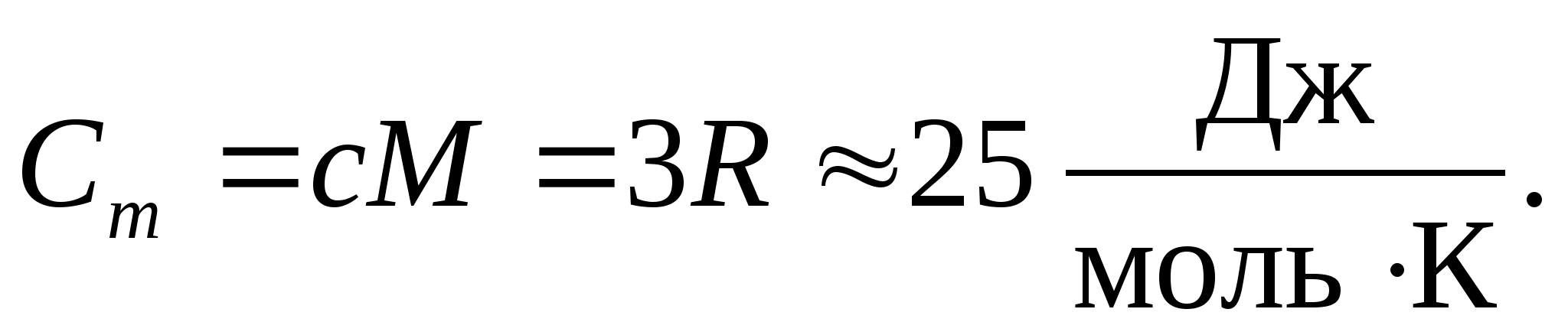
Ova jednakost vrijedi kao prilično dobra aproksimacija za mnoge tvari na sobnoj temperaturi i naziva se Dulong i Petit zakon : molarni toplinski kapacitet svih kemijski jednostavnih kristalnih čvrste tvari približno jednako 25 J/(mol DO). Kako se temperatura smanjuje, toplinski kapaciteti svih krutih tijela opadaju, približavajući se nuli na T0. U blizini apsolutne nule molarni toplinski kapacitet svih tijela proporcionalan je T 3 i tek pri dovoljno visokoj temperaturi karakterističnoj za svaku tvar počinje vrijediti jednakost (8.2). Ove značajke toplinskih kapaciteta krutih tijela pri niskim temperaturama mogu se objasniti korištenjem kvantne teorije toplinskog kapaciteta koju su stvorili Einstein i Debye.
Da bi se eksperimentalno odredio toplinski kapacitet, tijelo koje se proučava stavlja se u kalorimetar, koji se zagrijava električnom strujom. Ako se temperatura kalorimetra s ispitnim uzorkom vrlo sporo povećava od početne T 0 do T, tada će se energija električne struje koristiti za zagrijavanje uzorka i kalorimetra:
gdje ja i U− struja i napon grijača; − vrijeme zagrijavanja; m 0 i m su mase kalorimetra i ispitnog uzorka, S 0 i S− specifični toplinski kapaciteti kalorimetra i ispitnog uzorka, Q− gubitak topline u toplinskoj izolaciji kalorimetra iu okolnom prostoru.
Da bi se iz jednadžbe (8.3) isključila količina topline utrošena na zagrijavanje kalorimetra i gubitak topline u okolni prostor, potrebno je, pri istoj snazi grijača, zagrijati prazan kalorimetar (bez uzorka) od početne temperature T 0 za istu temperaturnu razliku T. Gubitak topline u oba slučaja bit će gotovo isti i vrlo mali, ako je temperatura zaštitnog omotača kalorimetra u oba slučaja konstantna i jednaka sobnoj temperaturi:
Jednadžbe (8.3) i (8.4) impliciraju
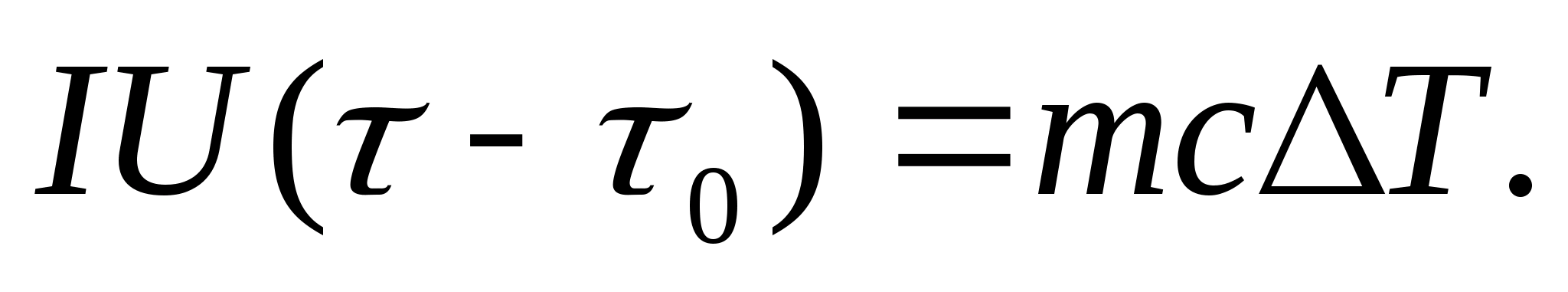 (8.5)
(8.5)
Jednadžba (8.5) može se koristiti za eksperimentalno određivanje specifičnog toplinskog kapaciteta materijala ispitnog uzorka. Promjenom temperature kalorimetra potrebno je nacrtati ovisnost razlike vremena zagrijavanja o promjeni temperature ispitnog uzorka: (
−
0)=f(T), prema kutnom koeficijentu od kojih 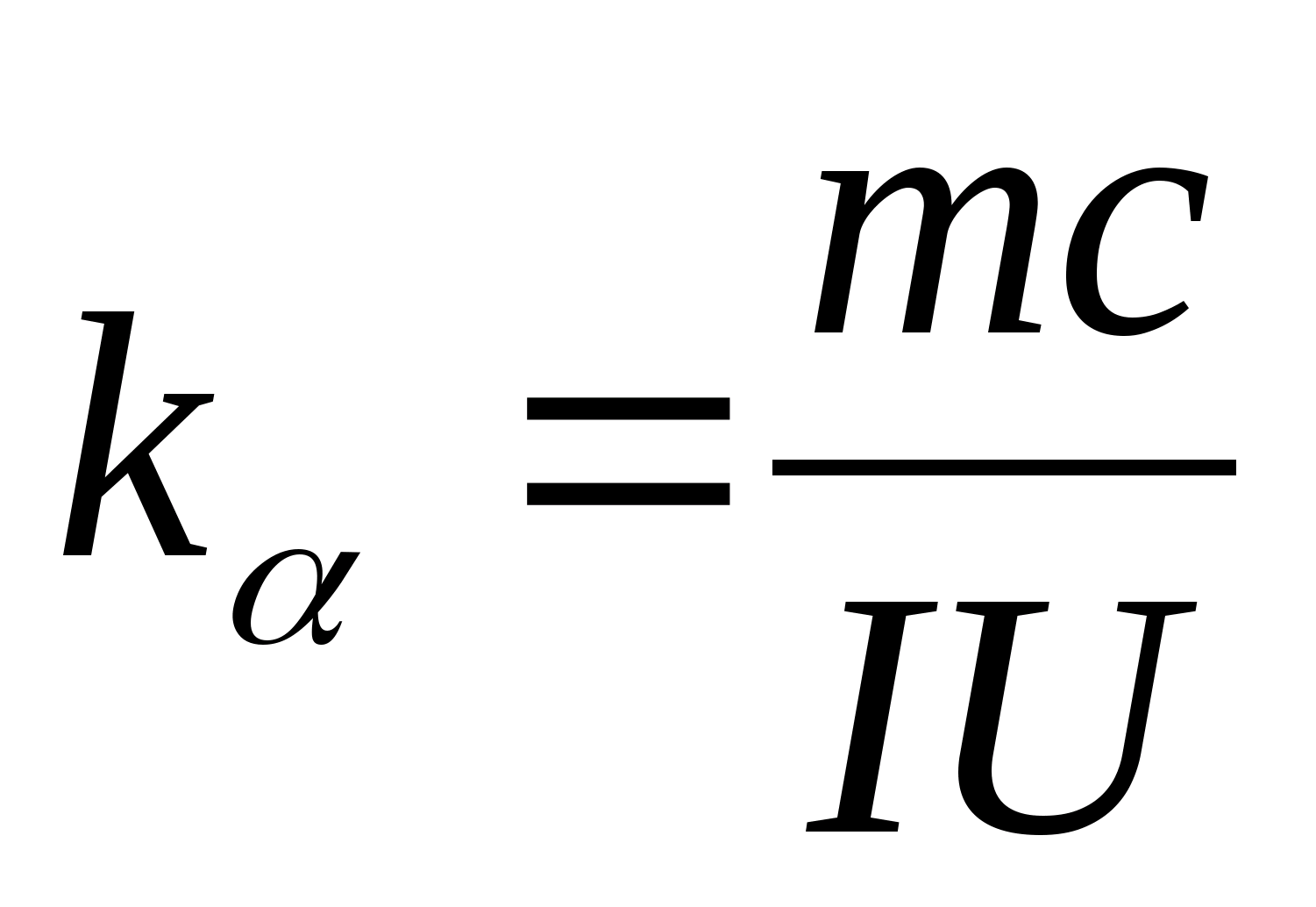 može se odrediti specifični toplinski kapacitet uzorka.
može se odrediti specifični toplinski kapacitet uzorka.
Opis laboratorijskog postava
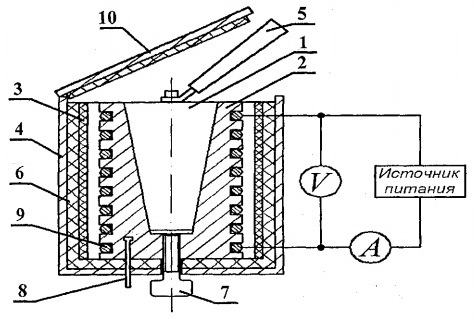
Za određivanje toplinskog kapaciteta krutih tvari dizajnirana je eksperimentalna postavka FPT1-8, čiji je opći prikaz prikazan na Sl. 8.1. Instalacija se sastoji od tri glavna dijela: instrumentalna jedinica 1, radna jedinica 2 i stalak 3.
Na prednjoj ploči upravljačke jedinice 1 nalaze se: prekidač "MREŽA", koji povezuje jedinicu s mrežom opskrbnog napona; preklopni prekidač "GRIJANJE", koji uključuje grijač; regulator “GRIJANJE” pomoću kojeg se regulira snaga grijača; voltmetar i ampermetar, koji mjere napon i struju u krugu grijača; štoperica, koja mjeri vrijeme zagrijavanja kalorimetra. Štoperica se aktivira kada je jedinica instrumenta uključena.
Blok radnog elementa 2 zatvoren je ispred s uklonjivim zaslonom iz org. stakla. Prilikom izvođenja radova, zaslon je obješen na stražnju stijenku bloka radnog elementa. Na bloku ploče radnog elementa nalazi se digitalni termometar 6 za mjerenje temperature. Na dnu, u gnijezdima, nalazi se 5 ispitnih uzoraka od raznih materijala i ručka za stavljanje uzoraka u grijač.
Grijač 4 sastoji se od metalnog kućišta, toplinsko izolacijskog materijala i kalorimetra.

Uzorci se zagrijavaju u kalorimetru čija je shema prikazana na sl. 8.2.
Kalorimetar je mjedeno kućište 2 sa koničnom rupom, u koju se umeće ispitni uzorak 1. Na vanjskoj površini kućišta u posebne utore postavljena je grijaća zavojnica 9. Izvana je kućište kalorimetra toplinski izolirano slojevima azbesta. 3 i staklenim vlaknima 6 i zatvoren aluminijskim kućištem 4. Kalorimetar je zatvoren toplinsko-izolacijskim poklopcem 10. Nakon završetka pokusa uzorak se može izgurati iz konusnog otvora tijela kalorimetra uz pomoć vijak 7. Za uklanjanje zagrijanog uzorka iz kalorimetra i ugradnju uzorka u grijač koristi se ručka 5 koja se nalazi u posebnom ležištu pored uzoraka koji se proučavaju.
Temperatura kalorimetra mjeri se digitalnim termometrom čiji je temperaturni senzor 8 smješten u kućištu 2 kalorimetra.
Sigurnost
Pri izvođenju radova poštuju se opći zahtjevi sigurnosti u mehaničkom laboratoriju.
Radni nalog
PAŽNJA! Kalorimetru treba dugo da se ohladi pa nakon mjerenja svih vremenskih vrijednosti 0 zagrijavanja praznog kalorimetra, odmah isključite grijanje (vidi točku 4 dolje). Maksimalna temperatura grijanja za ovu jedinicu je +44S.
1. Uklonite prozirni poklopac jedinice radnog elementa instalacije i objesite ga na vijke stražnje ploče. Postavite regulator GRIJANJA na minimum. Uključite instalaciju pomoću prekidača "MREŽA".
2. Čvrsto zatvorite poklopac praznog kalorimetra. Uključite prekidač "HEAT". Pomoću regulatora HEAT namjestite napon na 10-20 V (što je napon veći, to je brže zagrijavanje). Upiši u tablicu. 8.1 odabrane vrijednosti napona U i trenutni ja.
3. Polazeći od temperature kalorimetra t 0 koju odredi nastavnik, nakon intervala od 1S upisati u tablicu. 8.1 vremenske vrijednosti 0 koja odgovara svakoj dosegnutoj temperaturi t.
4. Isključite prekidač "HEAT", otvorite poklopac i ohladite kalorimetar na početnu temperaturu t 0 . Za brzo hlađenje kalorimetra, možete spustiti jedan od uzoraka u kalorimetar, osim onog koji je učitelj označio (prilikom postavljanja uzorka u kalorimetar, okrenite vijak na dnu kalorimetra ulijevo). Temperatura će početi padati. Kada se brzina hlađenja smanji, izvadite zagrijani uzorak i ubacite sljedeći (hladni), osim onog koji je označio učitelj. Za uklanjanje uzorka, okrenite vijak na dnu kalorimetra udesno (u smjeru kazaljke na satu), a zatim izvucite uzorak ručkom.
Tablica 8.1
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =SM, J/(molK) |
||||||||
5. Okrećući vijak ulijevo, stavite jedan od ispitnih uzoraka uzet prema uputama nastavnika u kalorimetar. Čvrsto zatvorite poklopac kalorimetra i pričekajte 2-3 minute da se temperature kalorimetra i uzorka izjednače.
6. Uključite preklopnu sklopku "HEAT" i postavite isti napon u krugu kao kod zagrijavanja praznog kalorimetra.
7. Polazeći od iste početne temperature kalorimetra t 0, nakon intervala od 1S unijeti u tablicu. 8.1 vremenske vrijednosti koja odgovara svakoj postignutoj temperaturi t.
8. Regulator “GRIJANJE” postaviti u krajnji lijevi položaj (na minimum), isključiti preklopni prekidač “GRIJANJE”, otvoriti poklopac kalorimetra. Za uklanjanje uzorka iz kalorimetra, okrenite vijak udesno, zatim uklonite zagrijani uzorak pomoću ručke.
9. Isključite jedinicu pomoću preklopnog prekidača "MREŽA".
10. Prevedite sve vrijednosti količina 0 i u vrijednosti u sekundama (bez minuta) i unesite ih u tablicu. 8.1. Za svaki red tablice. 8.1 izračunajte vrijednosti = − 0 i T= t− t 0 .
11. Napravite procijenjeni izračun specifičnog toplinskog kapaciteta uzorka pomoću formule 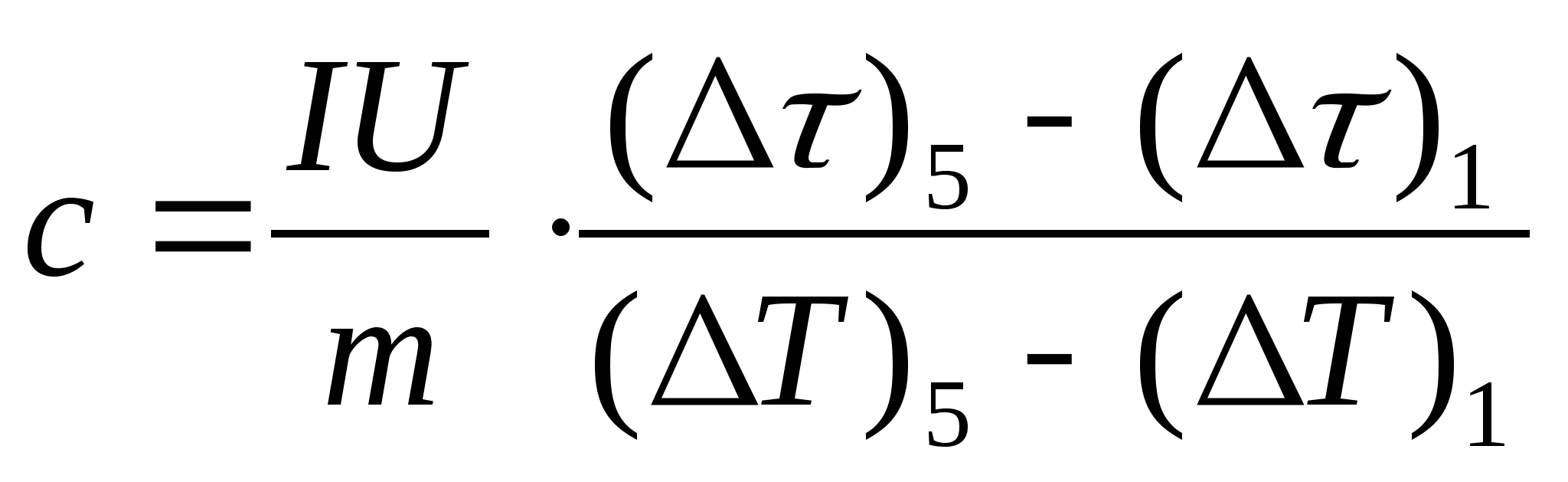 , gdje je masa uzorka m=139,5 g (mjed) odn m= 129,7 g (čelik) ili
m= 46,05 g (duraluminij). Dođite kod nastavnika na provjeru.
, gdje je masa uzorka m=139,5 g (mjed) odn m= 129,7 g (čelik) ili
m= 46,05 g (duraluminij). Dođite kod nastavnika na provjeru.
Obrada rezultata mjerenja
1. Parcela
=f(T) ovisnost razlike u vremenu zagrijavanja kalorimetra s uzorkom i praznog kalorimetra o promjeni temperature kalorimetra, odaberite bilo koje dvije točke na grafikonu i odredite nagib ravne crte pomoću formule 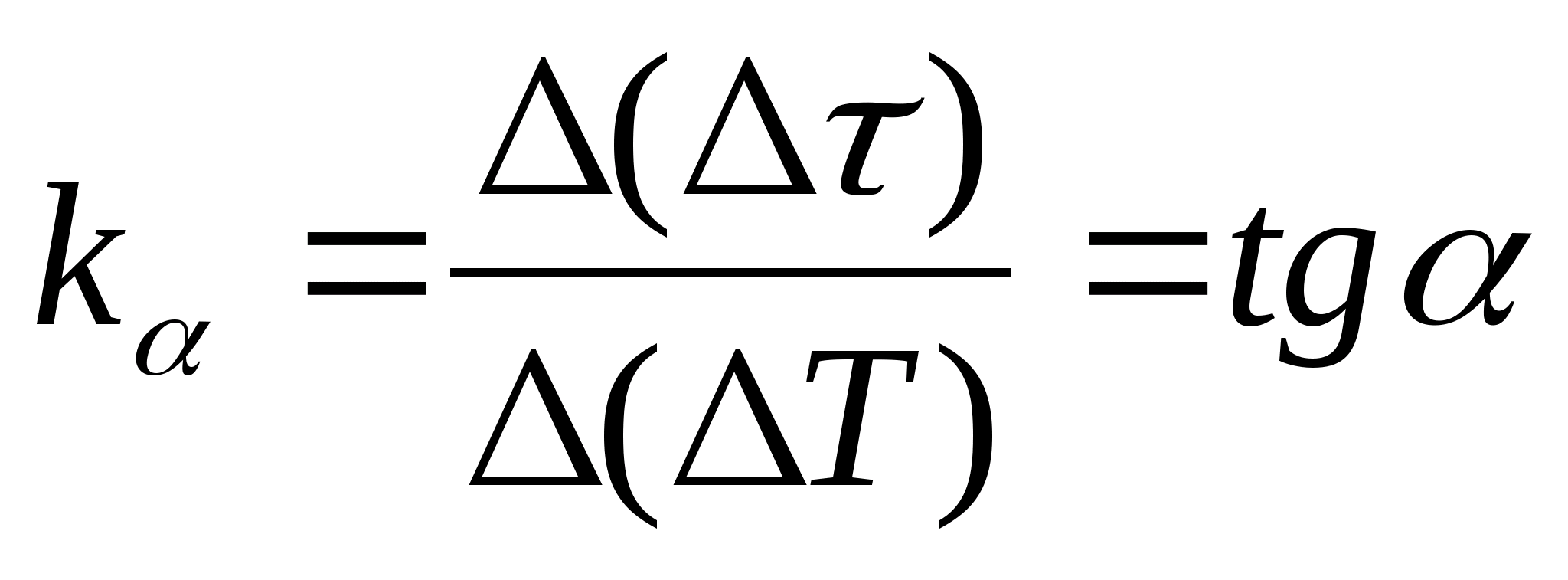 , gdje
− kut nagiba grafa prema osi T
(ako jedinice od
i T prikazani su na obje osi kao segmenti iste duljine).
, gdje
− kut nagiba grafa prema osi T
(ako jedinice od
i T prikazani su na obje osi kao segmenti iste duljine).
2. Korištenje vrijednosti nagiba k
, odrediti specifični toplinski kapacitet uzorka pomoću formule 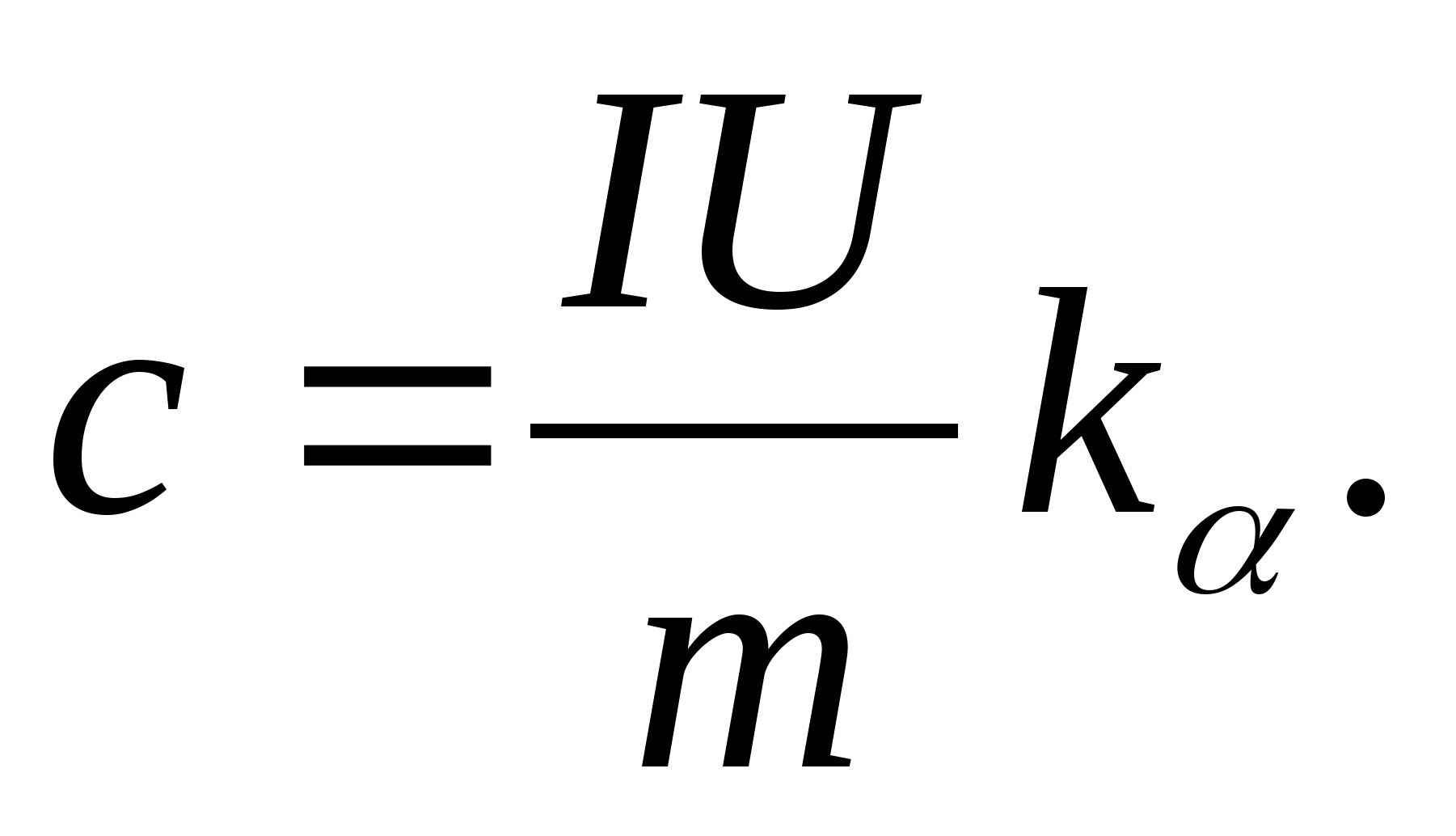
3. Pomoću podataka u tablici 8.2 (ili periodnog sustava) odredite molarni toplinski kapacitet uzorka pomoću formule C m =SM.
Tablica 8.2
|
Uzorak materijala |
Atomska masa, kg/mol |
|
Kao model čvrstog tijela uzmimo ispravno izgrađenu kristalnu rešetku u čijim čvorovima čestice (atomi, ioni, molekule), uzete kao materijalne točke, osciliraju oko svojih ravnotežnih položaja – čvorova rešetke – u tri međusobno okomita smjera. . Dakle, svakoj čestici koja čini kristalnu rešetku dodijeljena su tri vibracijska stupnja slobode, od kojih svaki, prema zakonu ravnomjerne raspodjele energije prema stupnjevima slobode (vidi § 50), ima energiju kT.
Unutarnja energija mole čvrstog tijela
U m \u003d 3N A kT \u003d 3RT,
gdje je N A Avogadrova konstanta; N A k= R (R je molarna plinska konstanta).
Molarni toplinski kapacitet čvrste tvari
tj. molarni (atomski) toplinski kapacitet kemijski jednostavna tijela u kristalnom stanju je isti (jednak 3 R) i ne ovisi o temperaturi. Ovaj zakon su empirijski dobili francuski znanstvenici P. Dulong (1785-1838) i L. Petit (1791-1820) i titulaDulong i Petit zakon.
Ako je krutina kemijski spoj (na primjer, NaCl), tada broj čestica u molu nije jednak Avogadrovoj konstanti, nego je jednak nN A , gdje n - broj atoma u molekuli (za NaCl, broj čestica u molu je 2 N i, dakle, jedan mol NaCl sadrži N A Na atoma i N A Cl atoma). Dakle, molarni toplinski kapacitet čvrsti kemijski spojevi
C V \u003d 3R25n J / (mol K),
tj. jednak zbroju atomskih toplinskih kapaciteta elemenata koji čine ovaj spoj.
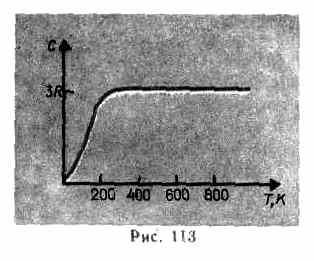
Kao što eksperimentalni podaci pokazuju (tablica 4), za mnoge tvari Dulongov i Petitov zakon je zadovoljen s prilično dobrom aproksimacijom, iako neke tvari (C, Be, B) imaju značajna odstupanja od izračunatih toplinskih kapaciteta. Osim toga, kao i kod plinova (vidi § 53), pokusi mjerenja toplinskog kapaciteta krutina pri niskim temperaturama pokazali su da on ovisi o temperaturi (si. 113). U blizini nule Kelvina toplinski kapacitet tijela proporcionalan je T 3 , a samo pri dovoljno visokim temperaturama, karakterističnim za svaku tvar, zadovoljen je uvjet (73.1). Dijamant, na primjer, ima toplinski kapacitet 3 R na 1800K! Međutim, za većinu krutih tvari sobna temperatura je već dovoljno visoka.
Razlika između eksperimentalnih i teoretskih vrijednosti toplinskih kapaciteta izračunatih na
osnovu klasične teorije, objasnio, na temelju kvantne teorije toplinskih kapaciteta, A. Einstein i P. Debye (1884-1966).
§ 74. Isparavanje, sublimacija, taljenje i kristalizacija. Amorfna tijela
I u tekućinama i u čvrstim tijelima uvijek postoji određeni broj molekula čija je energija dovoljna da nadvlada privlačnost drugih molekula i koje se mogu otrgnuti od površine tekućine ili krutine i prijeći u prostor koji ih okružuje. Ovaj proces za tekućinu se zove isparavanje(ili isparavanje), za čvrste tvari - sublimacija(ili sublimacija).
Isparavanje tekućina događa se na bilo kojoj temperaturi, ali njegov intenzitet raste s porastom temperature. Uz proces isparavanja odvija se i kompenzacijski proces kondenzacija para u tekućinu. Ako je broj molekula koje napuštaju tekućinu po jedinici vremena kroz jedinicu površine jednak broju molekula koje prelaze iz pare u tekućinu, tada dinamička ravnoteža između procesa isparavanja i kondenzacije. Para u ravnoteži sa svojom tekućinom naziva se bogati(vidi također § 62).
Za većinu krutina, proces sublimacije na uobičajenim temperaturama je zanemariv, a tlak pare na površini krutine je nizak; povećava se s porastom temperature. Intenzivno sublimirati tvari poput naftalina, kamfora, što se otkriva po oštrom, karakterističnom mirisu. Sublimacija se posebno intenzivno događa u vakuumu - to se koristi za izradu ogledala. Poznati primjer sublimacije je pretvaranje leda u paru – mokro rublje se suši na hladnoći.
Ako se čvrsto tijelo zagrijava, tada ono unutarnja energija(zbroj energije titraja čestica na mjestima rešetke i energije međudjelovanja tih čestica) raste. Kako temperatura raste, amplituda oscilacija čestica
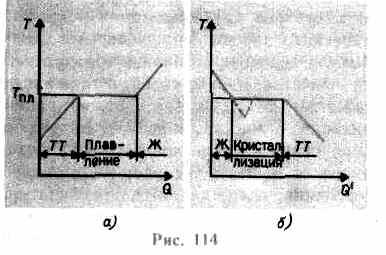
povećava sve dok se kristalna rešetka ne uruši – krutina se otopi. Na sl. 114 a prikazana je približna ovisnost T(Q), gdje Q- količina topline koju tijelo primi tijekom taljenja. Kao poruka solidu toplina tijela njegova temperatura raste, a na talištu T pl počinje prijelaz tijela iz krutog u tekuće stanje. Temperatura T pl ostaje konstantna dok se cijeli kristal ne otopi, a tek tada temperatura tekućine ponovno počinje rasti.
Zagrijavanje krutine do T pl još ga ne pretvara u tekuće stanje, budući da energija čestica tvari mora biti dovoljna da uništi kristalnu rešetku. U procesu taljenja toplina predana tvari koristi se za obavljanje rada na razaranju kristalne rešetke, pa je stoga T pl =const dok se cijeli kristal ne rastali. Tada će dovedena toplina ponovno ići na povećanje energije čestica tekućine i njezina temperatura će početi rasti. Količina topline potrebna za taljenje 1 kg tvari naziva se specifična toplina taljenja.
Ako se tekućina ohladi, tada se proces odvija u suprotnom smjeru (Sl. 114, b; Q" - količina topline koju tijelo predaje tijekom kristalizacije): prvo se temperatura tekućine smanjuje, a zatim počinje pri konstantnoj temperaturi jednakoj T pl kristalizacija, nakon njegovog završetka, temperatura kristala se počinje smanjivati. Za kristalizaciju tvari važna je prisutnost tzv centri kristalizacije - kristalne jezgre, koje mogu biti ne samo kristali nastale tvari, već i nečistoće, kao i prašina, čađa itd. Odsutnost centara kristalizacije u čistoj tekućini otežava stvaranje mikroskopskih kristala, a tvar, ostajući u tekućem stanju, hladi se na temperaturu nižu od temperature kristalizacije i tako nastaje prehlađena tekućina(na 114, b odgovara crtkanoj krivulji). S jakim superhlađenjem počinje spontano stvaranje centara kristalizacije i tvar kristalizira prilično brzo.
Obično se superhlađenje taline događa od frakcija do desetaka stupnjeva, ali za niz tvari može doseći stotine stupnjeva. Zbog visoke viskoznosti, jako prehlađene tekućine gube svoju fluidnost, zadržavajući svoj oblik, poput krutih tvari. Ta se tijela nazivaju amorfne čvrste tvari; to uključuje smole, vosak, pečatni vosak, staklo. Amorfna tijela, koja su stoga prehlađene tekućine, izotropno, tj. njihova svojstva su ista u svim smjerovima; za njih je, kao i za tekućine, karakteristična poredak kratkog dometa u rasporedu čestica; u njima je, za razliku od tekućina, pokretljivost čestica relativno mala. Značajka amorfnih tijela je da nemaju određeno talište, odnosno nemoguće je naznačiti određenu temperaturu iznad koje bi se moglo utvrditi tekuće stanje, a ispod čvrsto stanje. Iz iskustva je poznato da se u amorfnim tijelima tijekom vremena može promatrati proces kristalizacije, npr. kristali se pojavljuju u staklu; ona, gubeći prozirnost, počinje se mutiti i pretvarati u polikristalno tijelo.
Nedavno je široka uporaba u nacionalno gospodarstvo dobio polimeri- organska amorfna tijela, čije se molekule sastoje od velikog broja identičnih dugih molekulskih lanaca povezanih kemijskim (valentnim) vezama. Polimeri uključuju prirodne (škrob, proteine, gumu, vlakna itd.) i umjetne (plastika, guma, polistiren, lavsan, najlon itd.) organske tvari. Polimerima je svojstvena čvrstoća i elastičnost; neki polimeri podnose istezanje 5-10 puta veće od svoje izvorne duljine. To se objašnjava činjenicom da se dugi molekularni lanci mogu, pod deformacijom, saviti u guste kuglice ili istegnuti u ravne linije. Elastičnost polimera očituje se samo u određenom temperaturnom rasponu, ispod kojeg postaju tvrdi i krhki, a iznad - plastični. Iako je stvoreno mnogo sintetskih polimernih materijala (umjetna vlakna, nadomjesci za kožu, građevinski materijali, nadomjesci za metale itd.), teorija polimera još nije u potpunosti razvijena. Njegov razvoj određen je zahtjevima suvremene tehnologije koja zahtijeva sintezu polimera s unaprijed određenim svojstvima.
Specifični toplinski kapacitet tvari shvaća se kao vrijednost
, (1)
gdje je količina topline predana tijelu.
je promjena temperature koja se događa u
kao rezultat prijenosa topline na tijelo,
m je masa zagrijanog tijela.
Iskustvo obično određuje prosjek određena toplina tvar c, brojčano jednaka količini topline koja se mora predati jedinici mase ove tvari da bi se njezina temperatura povisila za:
(2),
gdje je razlika između konačne i početne temperature promatranog tijela.
Za eksperimentalno određivanje toplinskog kapaciteta koriste se različite kalorimetrijske metode. Raznolikost ovih metoda je zbog činjenice da točno mjerenje količine topline koja se prenosi tijelu zahtijeva eliminaciju gubitaka topline koji se ne uzimaju u obzir pri zagrijavanju tijela koje se proučava.
Obično se u takozvane kalorimetre s izotermnim omotačem uvodi izračunata ili eksperimentalno određena korekcija za zračenje, odnosno količinu topline koju kalorimetar zračenjem prima ili preda vanjskoj okolini tijekom eksperimenta.
Međutim, moguće je značajno smanjiti toplinske gubitke uvođenjem dobre toplinske izolacije ili skraćenjem trajanja pokusa, što se postiže velikom brzinom zagrijavanja uzorka ~ (pulsna metoda za mjerenje toplinskog kapaciteta), pri kojoj će toplinski gubici biti mali u usporedbi s ukupnom količinom dovedene topline.
Jedna od najtočnijih metoda za određivanje toplinskog kapaciteta je metoda adijabatskog kalorimetra. Poteškoće povezane s potrebom uzimanja u obzir gubitaka topline u kalorimetrima ove vrste uklanjaju se činjenicom da se mjerenja provode u uvjetima toplinske ravnoteže, odnosno u uvjetima jednakih temperatura uzorka koji se proučava i bloka koji okružuje uzorak . Prednosti ove metode, uz visoku točnost, uključuju i mogućnost određivanja toplinskog kapaciteta krutih tvari u širokom temperaturnom području, što je osobito važno ako tvari prolaze kroz fazne transformacije.
Uređaj jedne od vrsta adijabatskog kalorimetra shematski je prikazan na slici. Uzorak za ispitivanje 1 stavlja se u bakreni blok 3 i zajedno s njim zagrijava u peći 4. Unutar uzorka uvodi se grijač 2 koji omogućuje dodatno zagrijavanje uzorka.
Nakon uključivanja peći 4, u koju se nalazi blok s uzorkom, temperatura uzorka počinje rasti i ostaje ispod temperature bloka. Da bi se uspostavila jednakost između temperatura uzorka i bloka, uključite grijač smješten unutar uzorka. Kada je temperatura uzorka malo iznad temperature bloka, unutarnji grijač se isključuje.
Nakon toga se taj grijač povremeno uključuje i isključuje, tako da temperaturna razlika između uzorka i bloka cijelo vrijeme mijenja predznak.
U trenutku kada je jednak nuli (kada je uključen unutarnji grijač) nema izmjene topline između uzorka i bloka, a cjelokupna količina topline koju oslobodi unutarnji grijač troši se samo na zagrijavanje uzorka; specifična toplina u ovom slučaju može se odrediti formulom (2).
Količina topline koju oslobađa unutarnji grijač određena je formulom:
gdje je I struja unutarnjeg grijača;
V je pad napona na njemu;
- vremenski interval tijekom kojeg je temperatura porasla za .
Zatim
(4)
gdje je vrijeme tijekom kojeg se temperatura uzorka promijenila za .
U diferencijalnom obliku formula (4) ima oblik
(5)
Temperatura uzorka mjeri se termoelementom T. Temperaturna razlika između bloka i uzorka mjeri se diferencijalnim termoelementom. Za određivanje temperature uzorka koristi se kalibracijska krivulja termopara T. Temperaturna razlika između bloka i uzorka određuje se u podjelama galvanometarske ljestvice (budući da je potrebno samo fiksirati trenutak kada je razlika temperature između bloka i uzorka). uzorak mijenja predznak).
Završetak rada.
Uzorak se stavlja na grijač smješten unutar bakrenog bloka. Spojevi termoparova T i spojeni su na uzorak i blok. Pećnica je zatvorena poklopcem. Uključuje se električni namot peći, u kojem se nalazi blok. Grijač smješten unutar uzorka povremeno se uključuje i isključuje, a vrijednosti I i V bilježe se u krugu unutarnjeg grijača.
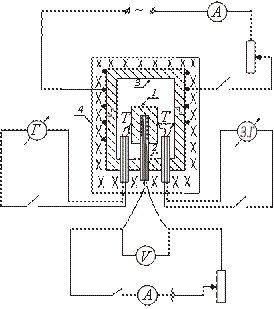
Prije početka mjerenja potrebno je provjeriti nulti položaj zrcalnog galvanometra. Da bi to učinili, odspajanjem termoelementa od galvanometra očekuju da zečić prestane fluktuirati duž ljestvice. Ako se nakon toga slika niti ne podudara s nulom, tada se pomicanjem ljestvice postiže ta podudarnost.
Nacrtane su krivulje ovisnosti T i o vremenu.
Iz nagiba krivulje T(t) na mjestu gdje ona mijenja predznak (odnosno kada je uspostavljena toplinska ravnoteža), izračunava se specifična toplina pomoću formule (5). Ovaj toplinski kapacitet odnosi se na temperaturu koju treba očitati s krivulje T(t) u trenutku kada temperaturna razlika između bloka i uzorka promijeni predznak.
