plinske smjese. Toplinski kapacitet plinova. Gorivo, plinske smjese i toplinski kapacitet
1.3. Jednadžba stanja idealnog plina
Oblik jednadžbi stanja (1.1) za stvarne tvari prilično je kompliciran.
S tim u vezi, u termodinamici se koriste pojednostavljeni fizikalni modeli radnih tijela.
Za radne fluide u plinovitom stanju najjednostavniji i povijesno prvi model je idealni plin. Idealni plin je plin u kojem nema sila međumolekularnog međudjelovanja (privlačenja i odbijanja), a same molekule se smatraju kao materijalne bodove. Idealni plin se pokorava Claiperonova jednadžba– Mendeljejev
gdje m je masa plina u sustavu; μ je molarna masa plina; Rμ = 8314 J/(kmol K) je univerzalna plinska konstanta, koja ne ovisi o vrsti plina niti o uvjetima njegova postojanja. Jednadžba stanja (1.2) dobiva se kombiniranjem Boyle-Mariotteovi zakoni i Gay Lussac uzeti u obzir Avogadrov zakon.
Molekulska masa μ = m/n, kg/mol, je masa tvari uzeta u količini od jednog mola. 1 mol je jedinica količine tvari koja sadrži onoliko čestica koliko i 12 grama ugljika. Količina tvari– n = N/N A, krtica, gdje N je broj čestica (atoma, molekula), N A ≈ 6,02 10 23 - broj atoma u 12 grama ugljika ( Avogadrov broj). Brojčano μ = Mr 10 -3, gdje je Mr relativna molekulska težina tvari ( tab. Mendeljejev) (na primjer: =2 kg/kmol).
Konkretno (tj. za 1 kg plina), jednadžba (1.2) će imati oblik
gdje R– specifična plinska konstanta, J/(kg K).
Objasnimo fizičko značenje specifične plinske konstante R. Za prvo stanje jednadžba (1.2) bit će zapisana kao , za drugo stanje pri istom tlaku - . Oduzmite prvu jednadžbu od druge jednadžbe i pronađite da je , tj. Specifična plinska konstanta je rad koji izvrši 1 kg plina kada se zagrije za 1 stupanj pri konstantnom tlaku.
Eksperimentalni podaci pokazuju da je realni plin to bliži idealnom što mu je manja gustoća. Drugim riječima, sa smanjenjem volumena dane količine plina, uzrokovano povećanjem tlaka ili smanjenjem temperature, svaki će plin sve više odstupati od svojstava idealnog plina. Dakle, pod pojmom "idealnog plina" odgovaraju svi stvarni plinovi pri visokim temperaturama i niskim tlakovima.
1.4. Mješavine idealni plinovi
U praksi je radni fluid često mješavina homogenih plinova (na primjer, zraka), od kojih se svaki može smatrati idealnim i koji ne ulaze u kemijske reakcije.
Takva smjesa također je idealan plin i pokorava se jednadžbi stanja (1.2) za smjesu
gdje R=R μ / μ je plinska konstanta smjese; μ je prosječna (prividna) molarna masa smjese(uvjetna vrijednost koja se odnosi na homogeni reprezentativni plin, u kojem su broj molekula i ukupna masa jednaki broju molekula i masi smjese).
Masa smjese jednaka je masi svih sastavnih dijelova
Glavni zakon koji određuje ponašanje plinske smjese je daltonov zakon:
svaki pojedini plin ponaša se u plinskoj smjesi kao da sam, na temperaturi smjese, zauzima cijeli volumen smjese,
svaki pojedini plin koji ulazi u plinsku smjesu ima isti tlak kakav bi imao da sam zauzima cijeli volumen plinske smjese.
Otuda vrijednost R(apsolutni tlak smjese) definiran je kao
gdje R ja – parcijalni tlak ja komponenta, tj. pritisak koji bi ja komponente, ako je sama zauzimala cijeli volumen smjese pri istoj temperaturi ().
Sastav smjese dat je masenim ili molnim udjelima sastavnih sastojaka smjese, kao i volumnim udjelima (koncentracijama).
Maseni udio je omjer mase svakog plina prema ukupnoj masi smjese: .
Jednadžba (1.3) implicira da .
Volumni udio naziva se omjer djelomični volumen(volumen koji bi plin zauzimao da su mu tlak i temperatura jednaki tlaku i temperaturi plinske smjese, tj.) na ukupni volumen plinske smjese: . Iz definicija parcijalnog tlaka i volumena te konstantnosti temperature slijedi:
![]() (1.5)
(1.5)
Zbrajajući posljednju jednakost po svim komponentama smjese, dobivamo , tj. zbroj parcijalnih volumena plinova koji čine smjesu jednak je volumenu smjese plinova.
Zbroj volumnih udjela jednak je jedan: .
molni udio komponenta naziva se omjer količine tvari svakog plina n ja na količinu tvari smjese plinova n. Iz odnosa i i Avogadrov zakon(u jednakim volumenima različitih idealnih plinova pri istim temperaturama i istim tlakovima zatvoren je jednak broj molekula, tj.) slijedi:
oni. određivanje smjese molnim udjelima jednako je određivanja njezinih volumnih udjela.
Maseni i volumni udjeli povezani su omjerom:
![]() .
.
Ako je smjesa dana masenim udjelima g ja, tada se plinska konstanta smjese i molarna masa smjese izračunavaju na sljedeći način:
![]()
![]()
Ako je smjesa dana volumnim udjelima r ja, tada su formule za izračunavanje molarne mase smjese i plinske konstante smjese sljedeće:
![]() (1.6)
(1.6)
Parcijalni tlakovi i volumeni plinova određuju se prema boyleov zakon–marriotte(pri konstantnoj temperaturi plina, umnožak tlaka plina i njegovog volumena je konstantna vrijednost, tj.):
![]() .
.
ispitna pitanja
Međunarodni sustav jedinica (SI) i njegove osnovne jedinice.
Osnovni termodinamički parametri i njihove dimenzije.
Što se podrazumijeva pod stanjem ravnoteže termodinamičkog sustava?
Pojam ravnotežnih i neravnotežnih stanja.
Što je jednadžba stanja sustava?
Geometrijska interpretacija stanja sustava, termodinamički proces.
Što je idealan plin? Koja je razlika između idealnog plina i stvarnog?
Kolika je plinska konstanta? Njegovo fizičko značenje, dimenzija i metode definiranja.
2. Toplinski kapacitet
Poruka topline radnom tijelu u bilo kojem procesu uzrokuje promjenu njegovog stanja i, u općem slučaju, praćena je promjenom temperature. Promjena temperature, kao i bilo koji drugi parametar stanja radnog fluida, ne ovisi o vrsti procesa, već o njegovom početnom ( 1 ) i konačni ( 2 ) navodi, tj. (za elementarni proces, promjena parametra zamjenjuje se njegovim diferencijalom).
Omjer količine topline δ Q prenosi tijelu na promjenu tjelesne temperature dT u elementarnom termodinamičkom procesu naziva se pravi toplinski kapacitet tijela u ovom procesu:
Indeks ovdje ukazuje na činjenicu da toplinski kapacitet, kao i toplina, ovisi o prirodi procesa. Osim toga, toplinski kapacitet ovisi o količini tijela i njegovom termodinamičkom stanju. Također treba napomenuti da se u ovom procesu ne mijenja kemijski sastav tijela, nema prijelaza tvari iz jednog agregatnog stanja u drugo, nema otapanja komponenti itd.
Ovisno o odabranoj jedinici količine tvari, razlikuju se maseni, volumenski i molarni specifični toplinski kapaciteti:
U praksi se najčešće koristi pojam masenog toplinskog kapaciteta.
2.1. Pravi i prosječni toplinski kapacitet
Toplinski kapacitet stvarne tvari nije konstantna vrijednost. Mijenja se s temperaturom, a ova ovisnost može biti vrlo značajna (slika 2.1).
Specifična količina procesne topline izračunava se formulom
Za određivanje ove vrijednosti koriste se sljedeće metode:
prema rezultatima pokusa, ovisnost toplinskog kapaciteta o temperaturi prikazana je kao aproksimacijski polinom
gdje su koeficijenti aproksimacije. Ovi koeficijenti navedeni su u referentnoj literaturi. Zatim
u praktičnim proračunima u temperaturnom području t 1 , t 2 toplinski kapacitet smatra se konstantnom vrijednošću jednakom
nazvao prosječni toplinski kapacitet u tom intervalu, za razliku od pravog toplinskog kapaciteta uvedenog u (2.1). Referentni podaci daju prosječne toplinske kapacitete od 0 do fiksne temperature t dobiven empirijskim putem, tj.
Prosječni toplinski kapacitet u temperaturnom području t 1 , t 2 prema ovim referentnim podacima može se izračunati formulom
Zatim određena količina procesna toplina se definira kao
2.2. Izohorni i izobarni toplinski kapaciteti
imaju veliki značaj u termodinamici.
izohornitoplinski kapacitet
jednaka omjeru količine topline u procesu pri konstantnom volumenu i promjene tjelesne temperature,
izobarnitoplinski kapacitet
jednak omjeru količine topline u procesu pri stalnom tlaku i promjeni temperature tijela.
U termotehničkim proračunima koriste se tablice koje prikazuju numeričke vrijednosti dobivene eksperimentalno za specifične izobarne i izohorne toplinske kapacitete za različite tvari ovisno o temperaturi.
2.3. Toplinski kapacitet plinskih smjesa
U proračunima je često potrebno raditi i na mješavinama plinova, a toplinski kapaciteti dani su u tablicama samo za pojedine plinove.
Ako je smjesa plinova dana masenim udjelima g ja, tada se specifični maseni toplinski kapaciteti smjese određuju formulama
![]()
Ako je smjesa plinova dana volumnim udjelima r ja, tada se specifični volumetrijski toplinski kapaciteti smjese određuju formulama
![]()
ispitna pitanja
Napiši jedinice specifičnog toplinskog kapaciteta.
Kako se uvodi pojam prosječnog toplinskog kapaciteta?
3. Zakon o održanju i transformaciji energije
Pojam energije povezan je s kretanjem materije.
Energija može imati mnogo oblika - mehanički rad, toplina, kemijska energija, energija električnog i magnetskog polja.
U termodinamičkom procesu međudjelovanje okoline i zatvorenog termodinamičkog sustava odvija se izmjenom energije u obliku topline i mehaničkog rada.
3.1. Unutarnja energija
Svaka sredina ima neku marginu unutarnja energijaU(J), koja se u tehničkoj termodinamici predstavlja kao zbroj kinetičke i potencijalne energije molekula i atoma medija. Kinetička energija ovih čestica određena je njihovom brzinom i masom, dok je potencijalna energija određena silama međudjelovanja među njima, koje ovise o njihovom međusobnom položaju. Unutarnja energija sustava je energija sadržana u samom sustavu. To znači da unutarnja energija može karakterizirati stanje tijela zajedno s količinama R, V, T.
Unutarnja energija ima svojstvo aditivnosti, tj. unutarnja energija složenog sustava jednaka je zbroju unutarnjih energija njegovih sastavnih dijelova:
Unutarnja energija 1 kg tvari naziva se specifična unutarnja energija u= U/ m (J/kg).
Za većinu tehničkih primjena termodinamike nije bitna apsolutna vrijednost U, i promjena ove vrijednosti. Stoga se kvantitativna definicija unutarnje energije homogenog sustava često određuje s obzirom na neko konvencionalno odabrano standardno stanje.
3.2. Zakon održanja energije u termodinamici
Obavljajući termodinamički proces, zatvoreni sustav stupa u interakciju s vanjskom okolinom (vanjskim tijelima i poljima), tj. razmjenjuje energiju. U tehničkoj termodinamici razmatraju se dvije vrste prijenosa energije - prijenosom topline i mehaničkim radom.
Prijenos topline događa se između tijela različitih temperatura koja dolaze u kontakt ili između tijela različitih temperatura koja se nalaze na udaljenosti pomoću elektromagnetskih valova ( toplinsko zračenje). Emitiranje toplina događa se na molekularnoj (mikrofizičkoj) razini bez vidljivog kretanja tijela.
Prijenos energije u obliku rada događa se kretanjem cijelog tijela ili njegovog dijela u prostoru. Ovom metodom tijelo se ili kreće u polju sile ili mijenja svoj volumen pod utjecajem vanjskog pritiska. Raditi je makrofizički oblik prijenosa energije.
Treba napomenuti da toplina i rad, za razliku od energije tijela, nisu funkcije njegovog stanja, već ovise o vrsti procesa, određuju taj proces, tj. funkcije su samog procesa.
Brojni eksperimenti i promatranja doveli su do otkrića temeljnog zakona prirode - zakona održanja energije: energija u prirodi ne nastaje ni iz čega i ne nestaje, ili količina energije je nepromijenjena, samo prelazi iz jednog oblika u drugi, ili
gdje Q je toplina uključena u proces; L- posao koji se obavlja; Δ E je promjena energije sustava. Ovdje i dolje, slažemo se razmotriti:
raditi pozitivan ako taj posao obavlja radno tijelo, i negativan, ako se rad obavlja na radnom tijelu sustava;
toplina dovedena u tijelo pozitivan, i dodijeljeni - negativan
osim toga, promjena bilo kojeg parametra stanja u konačnom procesu bit će označena simbolom Δ (delta), au elementarnom procesu - d(diferencijal odgovarajućeg parametra). Kod bilo kojeg konačnog termodinamičkog procesa promjena parametra stanja (tlak, temperatura, unutarnja energija, entalpija, entropija itd.) ne ovisi o vrsti procesa, već je određena početnim i završnim stanjem.
Općenito, termodinamički sustav ima unutarnju energiju U, kinetička energija (u termodinamici se sustav promatra kao cjelina koja se kreće brzinom w) – mw 2/2, potencijal - mgz (z je visina na kojoj se sustav nalazi). Promjena ukupne energije u procesu 1 –2 može se zamisliti kao:
Rad obavljen u ovom procesu je zbroj rada L o, povezan s promjenom volumena radne tekućine sustava (deformacijski rad), rad L dv o kretanju sustava u prostoru, tehnički rad L oni (prilikom kretanja sustava u raznim tehničkim uređajima, na primjer, u motoru, parnom kotlu, kompresoru itd.), rade protiv sila trenja L tr:
L \u003d L oko + L dv + L oni + L tr.
Toplina uključena u proces je zbroj topline Q vanjska, uključena u izmjenu s vanjskom okolinom i toplina trenja Q tr:
Q = Q vanjski + Q tr.
S obzirom na to Q tr = L tr (brojni pokusi su pokazali da se rad strujanja utrošen na svladavanje trenja potpuno pretvara u toplinu koju strujanje percipira), zakon održanja energije u termodinamici za 1 kg radne homogene tvari (tj. u specifičnim vrijednostima mase) ) u elementarnom procesu može se napisati:
![]() , (3.1)
, (3.1)
(vanjski indeks izostavljen kao nepotreban).
Treba naglasiti da su na desnoj strani (3.1) pod predznakom diferencijala funkcije stanja, a ostalo su veličine koje ovise o prirodi termodinamičkog procesa. Budući da su rad i toplina procesne funkcije, a ne funkcije stanja, znak δ označava samo činjenicu da su u elementarnom procesu količine koje slijede proizvoljno infinitezimalne, a ne prirast bilo koje specifične funkcije. Dakle, δ q i δ l-elementarne (tj. koje odgovaraju infinitezimalnim promjenama stanja sustava) količine topline i rada.
Ako termodinamički sustav ne mijenja svoj položaj u prostoru i jedina vrsta rada je rad povezan s promjenom volumena sustava, tada jednadžba (3.1) ima jednostavniji oblik:
Posao δ l oko vrši se ili protiv sila vanjskog tlaka i tada se volumen radne tekućine širi ili, obrnuto, vanjski okoliš vrši rad na tijelu, sabijajući ga. Za ravnotežne procese, kada je tlak medija jednak tlaku u radnom fluidu, ovaj rad se izračunava kao Rdv, gdje v je specifični volumen radne tvari.
Jednadžba
nazvao prvi zakon termodinamike: toplina dovedena zatvorenom termodinamičkom sustavu u mirovanju troši se na promjenu unutarnje energije sustava i na obavljanje rada za promjenu volumena sustava. Relacija ravnoteže (3.2) naziva se i predavanja na teorijska literatura. 1. Barok: ...
L. A. Eliseeva © Savezna državna proračunska ustanova za znanost Državna javna znanstvena i tehnička knjižnica Sibirskog ogranka Ruske akademije znanosti, 2013.
PokazivačSlučajne šetnje / A.N. Borodin, I. A. Ibragimov; pod... 241. Dorogokupets P.I. Termodinamika minerali i mineralne ravnoteže ... katalozi: kompendij predavanja na kolegij „Referentni ... drž tehničkog sveučilište. Niz, tehnički znanost. - ...
N. V. Basova [i drugi]; ur. N. V. Basova. Rostov n/a: Phoenix, 2008
UdžbenikTečaj) Napisani D. T. Sinopsis predavanja na viša matematika [Tekst]: ... tehnički termodinamika Rudobashta, S.P. Toplinska tehnika [Tekst]: udžbenik za studente. sveučilišta koja studiraju na... 2008. - 204 str. deset Borodin, I. F. Automatizacija tehnoloških procesa...
Popis znanstvenih radova Riznice za razdoblje 2008. - 1. lipnja 2013. (1)
Dokument... "X-zrake metode istraživanja" Predavanja na klinička onkologija. Almaty... drugog zakona termodinamika» 2-Međunarodni... i stručni pregled tehničkog opremanje zdravstvenih organizacija ... Akademik Ruske akademije medicinskih znanosti Yu.I. Borodin, Biškek, 2009., str. ...
U inženjerskoj praksi često se ne radi o homogenim plinovima, već o mješavinama kemijski nepovezanih plinova. Primjeri plinskih smjesa su: atmosferski zrak, prirodni plin, plinoviti produkti izgaranja goriva itd.
Za plinske smjese vrijede sljedeće odredbe.
1. Svaki plin koji ulazi u smjesu ima temperaturu, jednaka temperaturi smjese.
2. Svaki od plinova uključenih u smjesu raspoređen je po cijelom volumenu smjese i stoga je volumen svakog plina jednak volumenu cijele smjese.
3. Svaki od plinova uključenih u smjesu pokorava se vlastitoj jednadžbi stanja.
4. Smjesa kao cjelina je poput novog plina i pokorava se vlastitoj jednadžbi stanja.
Proučavanje plinskih smjesa temelji se na Daltonovom zakonu, prema kojem je pri konstantnoj temperaturi tlak smjese jednak zbroju parcijalnih tlakova plinova uključenih u smjesu:
gdje je p cm tlak smjese;
p i - parcijalni tlak i-tog plina uključenog u smjesu;
n je broj plinova uključenih u smjesu.
Parcijalni tlak je tlak koji će plin koji ulazi u smjesu stvarati ako sam zauzme cijeli volumen smjese pri istoj temperaturi.
Metode stvrdnjavanja plinskih smjesa
Sastav plinske smjese može se odrediti masenim, volumenskim i molnim udjelima.
Maseni udjeli. Maseni udio bilo kojeg plina uključenog u smjesu je omjer mase tog plina i mase smjese.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ..........; m n \u003d M n / M cm,
gdje su m 1 , m 2 , ..., m n - maseni udjeli plinova;
M 1 , M 2 , ..., M n - mase pojedinih plinova;
M cm je masa smjese.
To je lako vidjeti  i
i  (100%).
(100%).
Količinske dionice. Volumni udio bilo kojeg plina uključenog u smjesu je omjer reduciranog (djelomičnog) volumena tog plina prema volumenu smjese.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
gdje su V 1 , V 2 , ..., V n - reducirani volumeni plinova;
V cm je volumen smjese;
r 1 , r 2 , ..., r n - volumni udjeli plinova.
Reducirani volumen je volumen plina pod uvjetima smjese (pri temperaturi i tlaku smjese).
Smanjeni volumen može se prikazati na sljedeći način: ako se svi plinovi osim jednog uklone iz posude koja sadrži smjesu, a preostali plin se komprimira na tlak smjese uz održavanje temperature, tada će se njegov volumen smanjiti ili djelomično smanjiti.
Može se dokazati da će volumen smjese biti jednak zbroju reduciranih volumena plinova.
 (100%).
(100%).
Molni udjeli. Molni udio bilo kojeg plina uključenog u smjesu je omjer broja kilomola tog plina prema broju kilomola smjese.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
gdje r 1 , r 2 , ..., r n - molni udjeli plinova;
n cm je broj kilomola smjese;
n 1 , n 2 , ..., n n je broj kilomola plinova.
Određivanje smjese prema molnim udjelima identično je određivanja smjese prema volumnim udjelima, tj. molarni i volumni udjeli imaju iste numeričke vrijednosti za svaki plin uključen u smjesu.
Plinska konstanta i prividna (prosječna) molekularna težina smjese. Da bismo izračunali konstantu mješavine plinova danu masenim udjelima, napišemo jednadžbe stanja:
za smjesu
p cm × V cm = M cm R cm T; (1.9)
za plinove
 .
(1.10)
.
(1.10)
Zbrajamo lijevi i desni dio jednadžbi (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Jer  ,
,
tada je p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
Jednadžbe (1.9) i (1.11) impliciraju da
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
ili  ,
(1.12)
,
(1.12)
gdje je R cm plinska konstanta smjese.
Budući da plinska konstanta i-tog plina
R i = 8314 / m i,
tada se jednadžba (1.12) prepisuje na sljedeći način:
 .
(1.13)
.
(1.13)
Pri određivanju parametara plinske smjese prikladno je koristiti određenu uvjetnu vrijednost koja se naziva prividna (prosječna) molekularna težina plinske smjese. Koncept prividne molekularne težine smjese omogućuje nam da smjesu konvencionalno smatramo homogenim plinom, što uvelike pojednostavljuje izračune.
Za odvojeni plin, izraz
Analogno tome, za smjesu možemo napisati
m cm R cm = 8314, (1,14)
gdje je m cm prividna molekularna težina smjese.
Iz jednadžbe (1.14), korištenjem izraza (1.12) i (1.13), dobivamo
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Raspravljajući na ovaj način, mogu se dobiti formule za izračunavanje R cm i m cm kroz volumne udjele, formule za pretvorbu masenih udjela u volumne udjele i, obrnuto, volumnih udjela u masene udjele, formule za izračunavanje specifičnog volumena smjese u cm i gustoća smjese r cm kroz masene i volumne udjele i, na kraju, formule za izračunavanje parcijalnih tlakova plinova uključenih u smjesu, kroz volumne i masene udjele. Ove formule bez izvođenja prikazujemo u tablici.
Formule za izračunavanje plinskih smjesa
|
Postavljanje sastava smjese |
Prijenos iz jedne kompozicije u drugu |
Gustoća i specifični volumen smjese |
Prividna molekularna težina smjese |
Konstanta mješavine plinova |
Parcijalni tlak |
|
Maseni udjeli |
|
|
|
|
|
|
Volumni udjeli |
|
|
|
|
|
Toplinski kapacitet plinova
Toplinski kapacitet tijela je količina topline potrebna da se tijelo zagrije ili ohladi za 1 K. Toplinski kapacitet jedinice količine tvari naziva se specifični toplinski kapacitet.
Dakle, specifični toplinski kapacitet tvari je količina topline koja se mora prenijeti ili oduzeti od jedinice tvari kako bi se promijenila njezina temperatura za 1 K u ovom procesu.
Budući da će se u nastavku razmatrati samo specifični toplinski kapaciteti, specifični toplinski kapacitet jednostavno ćemo nazivati toplinski kapacitet.
Količina plina može se izraziti masom, volumenom i brojem kilomola. Treba napomenuti da se pri postavljanju volumena plina taj volumen dovodi u normalne uvjete i mjeri u normalnim kubičnim metrima (nm 3).
Ovisno o načinu podešavanja količine plina, razlikuju se sljedeći toplinski kapaciteti:
c - maseni toplinski kapacitet, J / (kg × K);
c¢ - volumetrijski toplinski kapacitet, J / (nm 3 × K);
c m - molarni toplinski kapacitet, J / (kmol × K).
Između ovih toplinskih kapaciteta postoje sljedeći odnosi:
c = c m / m; s m = s × m;
s¢ = s m / 22,4; uz m = s¢ × 22,4,
odavde  ; s¢ = s × r n,
; s¢ = s × r n,
gdje u n i r n - specifični volumen i gustoća u normalnim uvjetima.
Izohorni i izobarni toplinski kapaciteti
Količina topline predana radnom fluidu ovisi o značajkama termodinamičkog procesa. Dvije vrste toplinskog kapaciteta su od praktične važnosti ovisno o termodinamičkom procesu: izohorni i izobarni.
Toplinski kapacitet pri u = const je izohoran.
c u - maseni izohorni toplinski kapacitet,
c¢ u je volumetrijski izohorni toplinski kapacitet,
c m u je molarni izohorni toplinski kapacitet.
Toplinski kapacitet pri p = const je izobarni.
c p - maseni izobarni toplinski kapacitet,
c¢ r - volumetrijski izobarni toplinski kapacitet,
c m p - molarni izobarni toplinski kapacitet.
Uz istu promjenu temperature u procesu koji se odvija pri p = const troši se više topline nego u procesu pri u = const. To se objašnjava činjenicom da se pri u = const toplina predana tijelu troši samo na promjenu njegove unutarnje energije, dok se pri p = const toplina troši i na povećanje unutarnje energije i na obavljanje rada širenja. Razlika između masenog izobarnog i masenog izohornog toplinskog kapaciteta prema Mayerovoj jednadžbi
c p - c u=R. (1.17)
Ako se lijeva i desna strana jednadžbe (1.17) pomnože s masom kilomola m, tada se dobiva
c m p - c m u= 8314 J/(kmol×K) (1,18)
U termodinamici i njezinim primjenama, omjer izobarnog i izohornog toplinskog kapaciteta je od velike važnosti:
 ,
(1.19)
,
(1.19)
gdje je k adijabatski eksponent.
Proračuni pokazuju da je za jednoatomne plinove k » 1,67, za dvoatomne plinove k » 1,4, a za troatomne plinove k » 1,29.
Lako je vidjeti da vrijednost do ovisno o temperaturi. Doista, iz jednadžbi (1.17) i (1.19) slijedi da
 ,
(1.20)
,
(1.20)
i iz jednadžbi (1.18) i (1.19)
 .
(1.21)
.
(1.21)
Budući da toplinski kapaciteti rastu s porastom temperature plina, vrijednost k opada, približavajući se jedinici, ali uvijek ostaje veća od nje.
Znajući vrijednost k, može se odrediti vrijednost odgovarajućeg toplinskog kapaciteta. Tako, na primjer, iz jednadžbe (1.20) imamo
 ,
(1.22)
,
(1.22)
i od s p = k × s u, onda dobivamo
 .
(1.23)
.
(1.23)
Slično, za molarne toplinske kapacitete, iz jednadžbe (1.21) dobivamo
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Prosječni i pravi toplinski kapacitet
Toplinski kapacitet plinova ovisi o temperaturi i, donekle, o tlaku. Ovisnost toplinskog kapaciteta o tlaku je mala i zanemaruje se u većini proračuna. Ovisnost toplinskog kapaciteta o temperaturi je značajna i mora se uzeti u obzir. Ova se ovisnost prilično točno izražava jednadžbom
c = a + u t + et 2, (1.26)
gdje, u i e su vrijednosti koje su konstantne za dati plin.
Često se u izračunima toplinske tehnike nelinearna ovisnost (1.26) zamjenjuje linearnom:
c = a + u t. (1,27)
|
Ako grafički konstruiramo ovisnost toplinskog kapaciteta o temperaturi prema jednadžbi (1.26), tada će to biti krivocrtna ovisnost (slika 1.4). Kao što je prikazano na slici, svaka vrijednost temperature ima svoju vrijednost toplinskog kapaciteta, koja se obično naziva pravi toplinski kapacitet. Matematički, izraz za pravi toplinski kapacitet zapisan je na sljedeći način:
|
|
|
|
Stoga je pravi toplinski kapacitet omjer beskonačno male količine topline dq i infinitezimalne promjene temperature dt. Drugim riječima, pravi toplinski kapacitet je toplinski kapacitet plina pri određenoj temperaturi. Na sl. 1.4, pravi toplinski kapacitet na temperaturi t 1 označen je s t1 i prikazan je kao segment 1-4, na temperaturi t 2 - s t2 i prikazan je kao segment 2-3. Iz jednadžbe (1.28) dobivamo dq=cdt. (1,29) U praktičnim proračunima uvijek određujemo količina topline pri konačnoj promjeni |
temperatura. Očito je da se količina topline q, koja se javlja jedinici količine tvari kada se zagrijava od t 1 do t 2, može pronaći integracijom (1.29) od t 1 do t 2.
 .
(1.30)
.
(1.30)
Grafički se integral (1.30) izražava površinom 4-1-2-3. Ako u izrazu (1.30) zamijenimo vrijednost pravog toplinskog kapaciteta prema linearnoj ovisnosti (1.27), tada dobivamo
 (1.31)
(1.31)
gdje  - prosječni toplinski kapacitet u temperaturnom području od t 1 do t 2.
- prosječni toplinski kapacitet u temperaturnom području od t 1 do t 2.
 ,
(1.32)
,
(1.32)
Prema tome, prosječni toplinski kapacitet je omjer konačne količine topline q i konačne promjene temperature t 2 - t 1:
 .
(1.33)
.
(1.33)
Ako se na temelju 4-3 (sl. 1.4) konstruira pravokutnik 4-1¢-2¢-3 koji je veličine jednak slici 4-1-2-3, tada će visina tog pravokutnika biti jednak prosječnom toplinskom kapacitetu, gdje  nalazi se u temperaturnom području t 1 - t 2 .
nalazi se u temperaturnom području t 1 - t 2 .
Obično se vrijednosti prosječnih toplinskih kapaciteta daju u tablicama termodinamičkih svojstava tvari. Međutim, kako bi se smanjio volumen ovih tablica, one daju vrijednosti prosječnih toplinskih kapaciteta određenih u temperaturnom rasponu od 0 °C do t °C.
Ako je potrebno izračunati vrijednost prosječnog toplinskog kapaciteta u određenom temperaturnom rasponu t 1 - t 2, tada se to može učiniti na sljedeći način.
Područje 0a14 ispod krivulje c \u003d f (t) (slika 1.4) odgovara količini topline q 1 potrebnoj za povećanje temperature plina od 0 ° C do t 1 ° C.

Slično, područje 0a23 odgovara q 2 kada temperatura poraste od 0 o C do t 2 o C:

Dakle, q \u003d q 2 - q 1 (područje 4123) može se predstaviti kao
![]() (1.34)
(1.34)
Zamjenom vrijednosti q prema (1.34) u izraz (1.33), dobivamo formulu za prosječni toplinski kapacitet u bilo kojem temperaturnom rasponu:
 .
(1.35)
.
(1.35)
Stoga se prosječni toplinski kapacitet može izračunati iz tabličnih prosječnih toplinskih kapaciteta pomoću jednadžbe (1.35). Štoviše, dobivamo nelinearnu ovisnost c = f(t). Također možete pronaći prosječni toplinski kapacitet koristeći jednadžbu (1.32) koristeći linearni odnos. Vrijednosti a i u u jednadžbi (1.32) za razne plinove dani su u literaturi.
Količina topline dovedena ili odvedena iz radnog fluida može se izračunati pomoću bilo koje jednadžbe:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
gdje 

 - prosječnu masu, volumen i molarni toplinski kapacitet; M je masa plina; n je broj kilomola plina; V n - volumen plina u normalnim uvjetima.
- prosječnu masu, volumen i molarni toplinski kapacitet; M je masa plina; n je broj kilomola plina; V n - volumen plina u normalnim uvjetima.
Volumen plina V n može se pronaći na sljedeći način. Nakon što smo napisali jednadžbu stanja za zadane uvjete: pV = MRT i za normalne uvjete: p n V n = MRT n, drugu jednadžbu pripisujemo prvoj:
 ,
,
odavde  .
(1.39)
.
(1.39)
Toplinski kapacitet plinskih smjesa
Toplinski kapacitet plinske smjese može se izračunati ako je zadan sastav smjese i poznati toplinski kapaciteti komponenti koje ulaze u smjesu.
Da bi se smjesa mase M cm zagrijala za 1 K, potrebno je također povećati temperaturu svake komponente za 1 K. Pritom se količina topline jednaka c i M i troši na zagrijavanje i-te komponente smjese mase M i . Za cjelokupnu smjesu količina topline  ,
,
gdje su c i i c cm maseni toplinski kapaciteti i-te komponente i smjese.
Podijelivši zadnji izraz s M cm, dobivamo formulu za izračun masenog toplinskog kapaciteta smjese:
 ,
(1.40)
,
(1.40)
gdje je m i maseni udio i-te komponente.
Raspravljajući na sličan način, nalazimo volumetrijski toplinski kapacitet c¢ cm i molarni toplinski kapacitet c m cm smjese:
 (1.41)
(1.41)
gdje je c¢ i - volumenski toplinski kapacitet i-te komponente, r i - volumni udio i-te komponente,
 ,
(1.42)
,
(1.42)
gdje je c m i molarni toplinski kapacitet i-te komponente,
r i - molni (volumenski) udio i-te komponente.
Kod toplinskih motora (strojeva) radna tekućina je smjesa raznih plinova. Ako komponente smjese ne stupaju u međusobne kemijske reakcije, a svaka se komponenta pokorava Claiperonovoj jednadžbi stanja, tada se takva smjesa smatra idealnim plinom.
Za izračunavanje smjese potrebno je odrediti μ cm - prosječnu molarnu masu i R c m - specifičnu plinsku konstantu smjese. Da bi ih odredili, potrebno je znati sastav smjese, odnosno koje komponente i u kojim količinama čine ovu smjesu, koje parametre ima svaka komponenta uključena u smjesu.
Svaka komponenta smjese ponaša se kao da nema drugih plinova u smjesi, zauzima cijeli raspoloživi volumen u kojem se smjesa nalazi, prati svoju jednadžbu stanja i vrši svoj tzv. parcijalni tlak na stijenke, dok temperatura svih komponenti smjese je ista i jednaka temperaturi smjese.
Prema Daltonovom zakonu, tlak smjese P jednak je zbroju parcijalnih tlakova pojedinačnih komponenti uključenih u smjesu:
gdje je n broj komponenti smjese.
Prema Amagovom zakonu, volumen smjese V jednak je zbroju parcijalnih volumena pojedinačnih komponenti uključenih u smjesu pri temperaturi i tlaku smjese:
 , (1.21)
, (1.21)
gdje - djelomični volumen, m 3; V- volumen smjese, m3
Sastav smjese zadan je volumnim (molarnim) ili masenim udjelima.
Volumni udio i-te komponente je omjer parcijalnog volumena komponente prema volumenu smjese, tj. tada je zbroj volumnih udjela komponenata smjese 1, tj. Ako je vrijednost dana u %, tada je njihov zbroj = 100%.
Molarni udio i-te komponente n i je omjer broja kilomola komponente N i prema broju kilomola smjese N, tj. ![]() , , tj. broj kilomola svake komponente i smjese kao cjeline jednak je omjeru odgovarajuće komponente i smjese kao cjeline prema volumenu koji zauzima jedan kilomol.
, , tj. broj kilomola svake komponente i smjese kao cjeline jednak je omjeru odgovarajuće komponente i smjese kao cjeline prema volumenu koji zauzima jedan kilomol.
S obzirom da idealni plin pod istim uvjetima ima isti volumen kilomola, tada nakon supstitucije dobivamo:, tj. za idealne plinove molarni i volumni udjeli su brojčano jednaki.
Maseni udio i-te komponente je omjer mase komponente prema masi smjese: , slijedi da je masa smjese jednaka zbroju masa komponenti, a također je jednak i zbroj masenih udjela komponenti na 1 (ili 100%).
Pretvorba volumnih udjela u masene udjele i obrnuto temelji se na sljedećim omjerima:
![]() ,
,
gdje je ρ = μ / 22,4, kg / m 3.
Odatle slijedi da ćemo maseni udio i-te komponente odrediti iz relacije:
 ,
,
gdje je gustoća smjese, kg / m 3, volumni udio i-te komponente.
U budućnosti se može odrediti kroz volumne udjele.
 .
.
Gustoća smjese za volumne udjele određuje se iz omjera
 , gdje
, gdje  , (1.22)
, (1.22)
 .
.
Parcijalni tlak određuje se formulama:
![]() ili
ili  (1.23)
(1.23)
Jednadžbe stanja komponenata i smjese u cjelini imaju oblik:
![]() ;
;
![]() ,
,
odakle nakon transformacija dobivamo for masivan dionice
 ,
,  . (1.24)
. (1.24)
Gustoća i specifični volumen smjese za masivan udio:
;  . (1.25)
. (1.25)
Za izračunavanje parcijalnih tlakova koristi se formula:
 . (1.26)
. (1.26)
Pretvorba masenih udjela u volumne udjele provodi se prema formuli:
 .
.
Pri određivanju toplinskog kapaciteta mješavine plinova pretpostavlja se da je za zagrijavanje (hlađenje) plinske smjese potrebno zagrijati (ohladiti) svaku od komponenti smjese.
gdje je Q i =M i c i ∆t toplina utrošena na promjenu temperature i-te komponente smjese, c i maseni toplinski kapacitet i-te komponente smjese.
Toplinski kapacitet smjese određuje se iz omjera (ako je smjesa dana masenim udjelima)
 , slično
, slično  . (1.28)
. (1.28)
Molarni i volumetrijski toplinski kapaciteti za smjesu dati volumnim udjelima određuju se prema
 ;
;  ;
;
 ;
; 
Primjer 1.5 Maseni suhi zrak sastoji se od g O2 \u003d 23,3% kisika i g N2 \u003d 76,6% dušika. Odredite volumenski sastav zraka (r O2 i r N 2) i plinsku konstantu smjese.
Riješenje.
1. Iz tablice 1 nalazimo kg/kmol i kg/kmol
2. Odredite volumne udjele kisika i dušika:
1. Plinska konstanta zraka (smjese) određena je formulom:
 , J/kg K
, J/kg K
Primjer 1.6. Odredite količinu topline potrebnu za zagrijavanje plinske smjese mase M = 2 kg pri P = const, koja se sastoji od masenih postotaka: , , , , kada se temperatura promijeni od t 1 =900 ° C do t 2 = 1200 °C.
Riješenje:
1. Odredite prosječni maseni toplinski kapacitet komponenata koji čine plinsku smjesu pri P=const i t 1 =900 o C (iz P2):
1,0258 kJ/kg K; =1,1045 kJ/kg K;
1,1078 kJ/kg K; =2,1097 kJ/kg K;
2. Određujemo prosječni maseni toplinski kapacitet komponenti koje čine plinsku smjesu pri P=const i t 1 =1200 o C (iz P2):
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Određujemo prosječni maseni toplinski kapacitet smjese za temperaturni raspon: t 2 \u003d 1200 ° C i t 1 \u003d 900 ° C:
4. Količina topline za zagrijavanje 2 kg smjese pri P=const:
Prvi zakon termodinamike uspostavlja kvantitativni odnos između promjene unutarnje energije sustava i mehaničkog rada koji se vrši protiv sila vanjskog tlaka okoline kao rezultat dovođenja topline u radni fluid.
Za zatvoreni termodinamički sustav jednadžba prvog zakona ima oblik
Toplina predana radnom fluidu (ili sustavu) koristi se za povećanje njegove unutarnje energije (dU) zbog povećanja tjelesne temperature i za obavljanje vanjskog rada (dL) zbog širenja radnog fluida i povećanja njegove volumen.
Prvi zakon se može napisati kao dH=dq+VdP=dq-dL 0 ,
gdje je dL 0 \u003d VdP - elementarni rad promjene tlaka naziva se korisnim vanjskim (tehničkim) radom.
dU je promjena unutarnje energije radnog fluida (sustava), koja uključuje energiju toplinskog gibanja molekula (translacijsku, rotacijsku i vibracijsku) i potencijalnu energiju međudjelovanja molekula.
Budući da se prijelaz sustava iz jednog stanja u drugo događa kao rezultat opskrbe toplinom, stoga se radni fluid zagrijava i njegova temperatura raste za dT, a volumen se povećava za dV.
Povećanje temperature tijela uzrokuje povećanje kinetičke energije njegovih čestica, a povećanje volumena tijela dovodi do promjene potencijalne energije čestica. Time se unutarnja energija tijela povećava za dU, pa je unutarnja energija U funkcija stanja tijela i može se prikazati kao funkcija dva neovisna parametra U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). Promjena unutarnje energije u termodinamičkom procesu određena je samo početnim (U 1) i završnim (U 2) stanjem, tj.
U diferencijalnom obliku zapisana je promjena unutarnje energije
a) kao funkcija specifičnog volumena i temperature

b) u ovisnosti o temperaturi, jer , onda
Za praktične proračune, u kojima je potrebno uzeti u obzir promjenu C v s temperaturom, postoje empirijske formule i tablice specifične unutarnje energije (često molarne). Za idealne plinove molarna unutarnja energija smjese U m određena je formulom
 , J/kmol
, J/kmol
Za smjesu danu masenim udjelima . Na ovaj način unutarnja energija tamo je svojstvo sustava i karakterizira stanje sustava.
Entalpija je funkcija toplinskog stanja koju je uveo Kamerling-Onnes (pobjednik Nobelova nagrada, 1913), koji je zbroj unutarnje energije sustava U i umnoška tlaka sustava P i njegovog volumena V.
Budući da su veličine uključene u njega funkcije stanja, stoga je H također funkcija stanja, tj. H \u003d f 1 (P, V); H=f2 (V,T); H=f3 (P, T).
Promjena entalpije dH u bilo kojem termodinamičkom procesu određena je početnim H 1 i konačnim H 2 stanjem i ne ovisi o prirodi procesa. Ako sustav sadrži 1 kg tvari, tada se primjenjuje specifična entalpija, J/kg.
Za idealan plin diferencijalna jednadžba ima oblik
prema tome, specifična entalpija određena je formulom
Jednadžba prvog zakona termodinamike je dq=dU+Pdυ, kada je jedini tip rada ekspanzijski rad Pdυ=d(Pυ)-υdP, tada je dq=d(U+Pυ)-υdP, odakle
Praktični rad№ 2
Tema: Toplinski kapacitet, entalpija, smjese idealnih plinova, unutarnja energija, rad, termodinamički procesi.
Svrha rada: Konsolidacija znanja stečenog tijekom teorijske obuke, stjecanje vještina u provedbi proračuna toplinske tehnike.
ja Osnovne definicije, formule i jednadžbe
1. Smjese idealnih plinova
Plinska smjesa je mehanička smjesa nekoliko plinova koji međusobno ne kemijski djeluju. Svaki od plinova u smjesi naziva se plinskom komponentom; ponaša se kao da u smjesi nema drugih plinova, tj. ravnomjerno rasporediti po smjesi. Tlak kojim svaki plin iz smjese djeluje na stijenke posude naziva se parcijalni tlak. Osnovni zakon za smjese idealnih plinova je Daltonov zakon prema kojem je tlak smjese jednak zbroju parcijalnih tlakova plinova koji tvore smjesu:
2. Unutarnja energija
Unutarnja energija tijela kombinacija je kinetičke energije gibanja mikročestica koje čine tijelo i njihove potencijalne energije. definirana interakcija. sile međusobnog privlačenja ili odbijanja. Apsolutnu vrijednost unutarnje energije nemoguće je odrediti, stoga se u termodinamičkim proračunima ne računa apsolutna vrijednost unutarnje energije, već njezina promjena, tj.
![]() ili
ili ![]()
gdje su U 1 i U 2 - unutarnja energija početnog i konačnog stanja radnog fluida (plina);
u 1 i i 2 - otkucaji. unutarnja energija početnog i konačnog stanja radnog fluida.
Iz ovoga slijedi da promjena unutarnje energije ne ovisi o prirodi i putu procesa, već je određena stanjem radnog fluida na početku i na kraju procesa promjene.
Značajka idealnog plina je odsutnost sila molekularnih interakcija u njemu, a time i odsutnost unutarnje potencijalne energije, tj. U n \u003d 0 i U „ \u003d 0. Prema tome, unutarnja energija idealnog plina:
U=U k =f(T) unu u=uk =f(T).
H. Plinski rad.
U termodinamici svaka promjena stanja radnog fluida kao rezultat izmjene energije s okoliš zove proces. U ovom slučaju se mijenjaju glavni parametri radnog tijela:
Transformacija topline u mehanički rad povezana je s procesom promjene stanja radnog fluida. Procesi promjene stanja plina mogu biti procesi širenja i skupljanja. Za proizvoljnu masu plina M (kg), rad je jednak:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
gdje je l \u003d p (v 2 -v 1) J / kg rad 1 kg plina ili specifični rad.
4. Plinska entalpija,
Entalpija je parametar koji karakterizira potencijalnu energiju veze radnog fluida (plina) s okolinom. Entalpija i specifična entalpija:
I \u003d U + pV, J i i i \u003d i + pv, J / kg.
5. Toplinski kapacitet.
Specifični toplinski kapacitet je količina topline koja se mora dovesti do 1 kg plina da bi se zagrijao za 1 °C u određenom temperaturnom području.
Specifični toplinski kapacitet je maseni, volumetrijski i kilomolski. Postoji veza između mase C, volumena C i kilomol C toplinskih kapaciteta:
 ;
; 
gdje je Vo 22,4 m 3 / kmol - otkucaja. volumen plina u normalnim uvjetima.
Misa ud. toplinski kapacitet plinske smjese:

Volumetrijski određena toplina plinska smjesa:

Kilomolarna specifična toplina plinske smjese:

6. Jednadžba za određivanje količine topline
Količina topline koju radni fluid (plin) preda ili primi može se odrediti jednadžbom:
Q \u003d M C m (t 2 -t 1), J ili Q \u003d VC (t-t), J, gdje su M i V težina ili volumen količina plina, kg ili m 3;
t u t - temperatura plina na kraju i na početku procesa ° S;
C i C - prosječni otkucaji mase i volumena. toplinski kapacitet plina
Pri t cp \u003d J / kgK ili J / m 3 K
7. Prvi zakon termodinamike
Ovaj zakon razmatra međupretvorbe topline i mehaničkog rada. Prema tom zakonu toplina se pretvara u mehanički rad i obrnuto, mehanički rad u toplinu u strogo ekvivalentnim količinama. Jednadžba ekvivalencije za toplinu i rad ima oblik:
Uzimajući u obzir načelo ekvivalencije topline i rada, jednadžba toplinske bilance za proizvoljnu masu plina:
Q \u003d U + L i q \u003d u + l \u003d u -u + l
Rješavanje problemaII
Zadatak #1 (#1)
Atmosferski suhi zrak ima sljedeći približni maseni sastav: g 02 =23,2%, g N 2 =76,8%.
Barometrom odredite volumenski sastav zraka, njegovu plinsku konstantu, prividnu molekulsku masu, parcijalni tlak kisika i dušika, ako je zrak P = 101325 Pa.
Određujem volumenski sastav zraka:
 ;
; ;
;
gdje je r maseni udio;
m je relativna molekulska težina;
g je volumni udio.
m zrak. =m O2 r O2 +m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
gdje je R 0 plinska konstanta.
Određujem parcijalne tlakove raznih plinova:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
gdje P O 2, P N 2 - parcijalni tlak;
P cm je tlak smjese.
Zadatak #2 (#2)
Posuda je pregradom podijeljena na 2 dijela čiji su volumeni V 1 =1,5 m 3 i V 2 =1,0 m 3 . Prvi dio volumena V 1 sadrži CO 2 pri P 1 =0,5 MPa i t 1 =30°C; drugi dio volumena V 2 sadrži O 2 pri P 2 =0,2 MPa i t 2 =57°C. Odredite maseni i volumni udio CO 2 i O 2, prividnu molekulsku masu smjese i njezinu plinsku konstantu nakon uklanjanja pregrade i završetka procesa miješanja.
Određujem pojedinačne plinske konstante:
Da bih to učinio, određujem relativnu molekularnu težinu: m (CO 2) \u003d 32 + 12 \u003d 44; m(02)=32;

 ;
;
![]()
 ;
;
Prema Klaiperonovoj karakterističnoj jednadžbi određujem mase plinova:
 (kg);
(kg);
 (kg);
(kg);
Određujem masene udjele:


Određujem volumne udjele:


Odredite prividnu molekulsku masu zraka:
m zrak. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 = 41,48;
Određujem pojedinačnu plinsku konstantu za zrak (R):

 ;
;
Zadatak #3 (#6)
U posudi s volumenom od 300 l nalazi se kisik pri tlaku P 1 = 0,2 MPa i t 1 = 20 0 C. Koliko topline mora biti dovedeno tako da temperatura kisika poraste na t 2 = 300 0 C ? Koliki će se tlak uspostaviti u posudi? Za izračun uzmite prosječnu volumetrijsku specifičnu toplinu kisika na n.o. C 02 \u003d 0,935 
Prema Charlesovom zakonu, određujem konačni pritisak procesa:
;  (Godišnje);
(Godišnje);
gdje su P, T parametri plina.
Određujem pojedinačnu plinsku konstantu za kisik (R):

 ;
;
Budući da je proces izohoričan, određujem količinu topline koju treba dostaviti prema odgovarajućoj formuli: Q v \u003d M C cv (T 2 -T 1) za to, prema Claiperonovoj karakterističnoj jednadžbi, određujem masu plina
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
Zadatak #4 (#7)
Koliko topline treba utrošiti da se zagrije 2m 3 zraka pri stalnom pretlaku P ex. \u003d 0,2 MPa od temperature od 100 0 C do temperature od 500 0 C. Kakav će rad u tom slučaju obaviti zrak? Za izračun uzmite: atmosferski tlak P at. \u003d 0,1 MPa, prosječni maseni izobarni toplinski kapacitet zraka C pm \u003d 1,022  ; izračunajte plinsku konstantu imajući u vidu da je prividna molekularna težina zraka M zrak. =29.
; izračunajte plinsku konstantu imajući u vidu da je prividna molekularna težina zraka M zrak. =29.
Određujem pojedinačnu plinsku konstantu za zrak:

 ;
;
Apsolutni tlak jednak je zbroju viška i atmosferskog P=P est. + P na. =0,1+0,2=0,3 MPa
 (kg);
(kg);
Budući da je proces izobarni, Q i L određujem prema odgovarajućim formulama:
prema Gay-Lussacovom zakonu određujem konačni volumen:
 m 3;
m 3;
Q \u003d M C pm (T 2 -T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Zadatak #5 (#8)
U cilindru se nalazi zrak tlaka P=0,5 MPa i temperature t 1 =400 0 C. Zraku se odvodi toplina pri P=const tako da je na kraju procesa temperatura t 2 =0 0 C volumen cilindra u kojem je zrak V 1 \u003d 400l.
Odredite količinu odvedene topline, konačni volumen, promjenu unutarnje energije i savršeni rad kompresije C pm =1,028  .
.
Budući da je proces izobarni, tada prema Gay-Lussacovom zakonu određujem konačni volumen:
 m 3;
m 3;
Prema Klaiperonovoj karakterističnoj jednadžbi određujem masu plina:
Iz prethodnog zadatka R=286.7 
 (kg);
(kg);
Određujem količinu topline koja se oslobađa:
Q = M C pm (T2-Tl) = 1,03 1028 (273-673) = -423536 (J);
Određujem količinu utrošenog rada:
L=P (V 2 -V 1) = 500 000 (0,16-0,4) = -120 000 (J);
Iz jednadžbe kojom se određuje ukupni iznos određujem promjenu iznosa unutarnje energije:
![]() ; (J)
; (J)
Problem #6 (#9)
Zrak volumena V 1 =0,02 m3 pri tlaku P 1 =1,1 MPa i t 1 =25 s ekspandira u cilindru s pomičnim klipom do tlaka P 2 =0,11 MPa. Nađite konačni volumen V 2 , konačnu temperaturu t 2 , rad zraka i dovedenu toplinu ako dođe do širenja u cilindru:
a) izotermno
b) adijabatski s eksponentom adijabate k=1,4
c) politropni s indeksom politropnosti n=1,3
Izotermni proces:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000J
adijabatski proces:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036 M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32 k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1,4-1) (1,1 10 6 0,02 -0,11 10 6 0, 1) = 2,0275 10 6 J
Politropni proces:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118 M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1,3-1)) (1,1 10 6 0,02 -0,11 10 6 0,118) = 30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Književnost:
1. Energija, Moskva, 1975.
2. Litvin A.M. "Teorijske osnove toplinske tehnike", izdavačka kuća "Energija", Moskva, 1969.
3. Tugunov P.I., Samsonov A.A., “Osnove toplinske tehnike, toplinski strojevi i parna energija”, izdavačka kuća Nedra, Moskva, 1970.
4. Krutov V.I., "Toplotna tehnika", izdavačka kuća "Engineering", Moskva, 1986.
Plinske smjese. Toplinski kapacitet plinova
Pod plinskim smjesama podrazumijeva se mehanička smjesa nekoliko plinova koji međusobno ne kemijski djeluju. Mješavina idealnih plinova poštuje sve zakone koji se odnose na idealni plinovi. Sastav plinske smjese određen je količinom svakog od plinova uključenih u smjesu, a može se odrediti masenim ili volumnim udjelima:
gdje je masa -te komponente, volumen -te komponente, i i su masa i volumen cijele smjese.
Očito je da
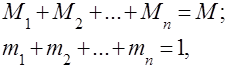
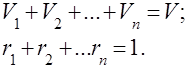
Radi lakšeg rješavanja praktičnih problema s plinskim smjesama, uvodi se pojam prividne molekulske mase plinske smjese, koja je prosječna masa stvarnih molekulskih težina pojedinačnih komponenata smjese.
Jednadžba stanja za smjesu plinova ima oblik:
Plinske smjese podliježu konceptu univerzalne plinske konstante
Odnos između tlaka plinske smjese i parcijalnog tlaka pojedinačnih komponenata uključenih u smjesu utvrđen je Daltonovim zakonom:
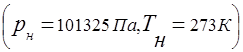
1 plin ima različitu masu ovisno o tlaku i temperaturi. U tom smislu, volumetrijski toplinski kapacitet uvijek se odnosi na masu plina zatvorenu u 1 pod normalnim uvjetima. U ovom slučaju, volumen 1 kmol raznih plinova je 22,4 / kmol, a univerzalna plinska konstanta je . Ovisno o načinu dovođenja topline plinu razlikuju se izobarni i izohorni toplinski kapaciteti. Omjer tih veličina naziva se eksponent adijabate
Toplinski kapaciteti i također su povezani Mayerovom relacijom
Količina topline koja se mora potrošiti u procesu zagrijavanja 1 kg plina u rasponu temperatura od do određena je formulom:
gdje su i prosječni toplinski kapaciteti unutar 0°- i 0°-.
Ako je (kg) ili () plin uključen u proces, tada
Toplinski kapacitet plinske smjese treba odrediti formulama:
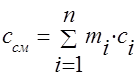
masa - ;
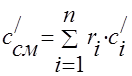
volumetrijski -;
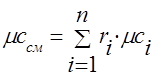
kutnjak - .
Za korištenje topline plinova koji su proizvodi izgaranja goriva u kotlovskoj jedinici, grijači zraka potrebnog za izgaranje goriva ugrađeni su u plinske kanale potonjeg (slika 1). Plinovi koji izlaze iz kotla ulaze u grijač zraka s temperaturom i hlade se, dajući toplinu zraku, do. U plinskom kanalu kotlovske jedinice, pod utjecajem rada dimnjaka, tlak se postavlja malo ispod atmosferskog. Zrak u grijaču zraka se zagrijava od temperature do temperature.
dimni plinovi
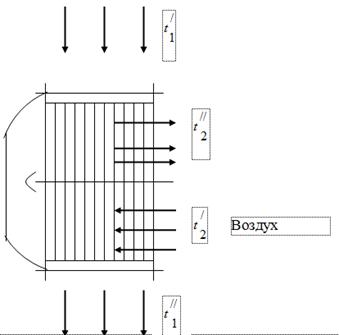
Prilikom ispitivanja kotlovske jedinice dobiveni su sljedeći podaci:
Temperatura plinova na ulazu u grijač zraka, = 450 °C.
Temperatura plinova na izlazu iz grijača zraka = 150 °C.
Temperatura zraka na ulazu u grijač zraka = 26°C.
Temperatura zraka na izlazu iz grijača zraka = 260 °C.
Volumetrijski sastav dimnih plinova - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Satna potrošnja plinova pri je 50 ·/h.
Vakuum u plinskom kanalu - 15 mm vode. Umjetnost.
Barometarski tlak 760 mm Hg. Umjetnost.
Definirati:
prividna molekularna težina dimnih plinova;
dimni plin plinska konstanta;
težinski (maseni) udjeli pojedinih komponenti koje čine dimne plinove;
parcijalni tlakovi komponenti:
satni protok zraka.
Pretpostavimo da svu toplinu koju oslobađa plin preuzima zrak.
Smatra se da je ovisnost toplinskog kapaciteta o temperaturi krivocrtna.
1. Prividna molekularna masa dimnih plinova
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Plinska konstanta dimnog plina
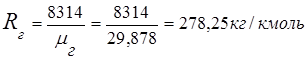
3. Maseni udjeli komponente plina
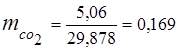
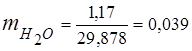
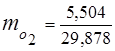
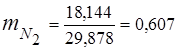
4. Parcijalni tlakovi komponenti
Rezultati izračuna bit će uneseni u tablicu
|
Mogućnosti |
plinska smjesa |
|||
|
|
||||
|
|
||||
|
|
5. Potrošnja zraka po satu
Potrošnja zraka određuje se iz jednadžbe toplinske bilance grijača zraka
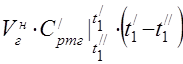
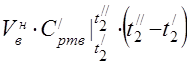
prosječni molarni toplinski kapacitet na 450 °C
Prosječni specifični toplinski kapacitet komponenti u temperaturnom rasponu 0 ... 450 ° C.













 .
(1.28)
.
(1.28)