Comment déterminer la capacité thermique spécifique de l'eau. Grande encyclopédie du pétrole et du gaz
INSTRUMENTS ET ACCESSOIRES : calorimètre, thermomètre, balances, corps d'épreuve, bécher (calibré en grammes), résistance électrique.
– confirmer expérimentalement la validité de l'équation du bilan thermique ;
– calculer les capacités calorifiques spécifiques des solides ;
– organiser les résultats des mesures et des calculs sous forme de tableau ;
– notez vos suggestions pour améliorer la technique des mesures et des calculs dans cet ouvrage.
BRÈVE THÉORIE DE L'EXPÉRIENCE
L'un des concepts physiques de base de la thermodynamique est la capacité thermique.
Capacité calorifique du corps appelé quantité physique, numériquement égal à la chaleur, qui doit être communiqué au corps afin de modifier sa température de 1 K dans le processus thermodynamique considéré. D'autre part, la capacité calorifique d'un corps est égale au rapport entre la chaleur dQ transmise au corps et la variation dT de la température corporelle dans le processus thermodynamique considéré :
La capacité calorifique d'un corps dépend de sa composition chimique, la masse du corps et son état thermodynamique, ainsi que, comme le montre la définition, sur le type de processus de modification de l'état du corps, dans lequel la chaleur dQ entre.
Propriétés thermiques les corps homogènes sont caractérisés par les valeurs de capacité thermique spécifique et molaire (molaire). La capacité calorifique spécifique d'une substance appelée grandeur physique Avec, numériquement égal à la chaleur qui doit être conférée à un kilogramme d'une substance pour modifier sa température de 1 K dans le processus thermodynamique considéré. La capacité calorifique d'un corps homogène peut être définie comme le produit de la masse du corps m pour la capacité thermique spécifique Avec ses substances :
![]() ou (2.2).
ou (2.2).
Ainsi, la relation entre dQ et dT pour un corps homogène a la forme :
capacité calorifique molaire la grandeur physique C est appelée, numériquement égale à la chaleur qui doit être conférée à une mole d'une substance pour changer sa température de 1 K dans le processus thermodynamique considéré :
DE = MME = (2.4),
où M est la masse molaire de la substance; DE est sa capacité thermique spécifique dans le même processus.
L'expression (2.4) peut maintenant s'écrire sous la forme :
où = n est la quantité de substance.
L'unité de mesure de la capacité calorifique d'un corps est 1 J/K, chaleur spécifique– 1J/kg. K, molaire - 1 J / mol. À.
Si le chauffage se produit dans des conditions où le volume reste constant, la capacité thermique molaire correspondante est appelée capacité calorifique à volume constant, ou capacité calorifique isochore, et est noté C v :
Si la pression reste constante pendant le chauffage, la capacité calorifique est appelée capacité calorifique à pression constante C p (on peut aussi l'appeler capacité calorifique isobare) :
Notez que pour les solides, seule la capacité calorifique à pression constante, et non à volume constant, est disponible pour la mesure directe, car en raison de la dilatation thermique, il est impossible d'assurer la constance du volume du corps. Cependant, en raison de la faible variation de volume pendant le chauffage, la différence entre les capacités calorifiques C p et C v est faible.
Expérimentalement, la capacité calorifique d'un corps est déterminée en appliquant l'équation du bilan thermique. Laissez le corps être chauffé à une température supérieure à la température environnement. Puis, en se refroidissant, le corps dégage une certaine quantité de chaleur. Selon la loi de conservation de l'énergie dans un système fermé, la quantité de chaleur reçue par le milieu doit être exactement égale à la quantité de chaleur dégagée par le corps. Dans ce travail, en se refroidissant, le corps d'épreuve cède de la chaleur à l'eau du calorimètre et au calorimètre lui-même.
Laissez le corps de test donné avec la masse m, porté à une température t0, est descendu dans le calorimètre avec de l'eau dont la température t1. Suite au transfert de chaleur la température de l'eau et le calorimètre monte à t2, un Température corporelle tombe à t2. La quantité de chaleur dégagée par le corps est de :
Q dép = cm(t0 - t2) (2.6),
où c est la capacité calorifique spécifique du corps d'épreuve,
t0– la température corporelle initiale,
t2– la température corporelle finale,
m- masse corporelle.
La quantité de chaleur reçue par le calorimètre et l'eau est égale à :
où et sont la masse et la chaleur spécifique du calorimètre,
I - masse et spécifique capacité calorifique de l'eau,
t1– la température initiale de l'eau,
t2 est la température finale de l'eau.
D'après la loi de conservation de l'énergie dans un système fermé :
Q otd \u003d Q étage (2,8).
Ensuite, en remplaçant les formules 2.6 et 2.7 dans l'équation 2.8 et en exprimant la valeur souhaitée DE , on a:
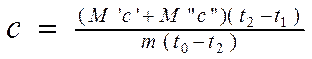 (2.9).
(2.9).
DÉTERMINER LES CAPACITÉS THERMIQUES SPÉCIFIQUES DE TROIS CORPS CYLINDRIQUES À PARTIR DE DIFFÉRENTS MÉTAUX
1. Déterminer les valeurs des masses des corps - moi je, masse du calorimètre – , chaleur spécifique de l'eau – , chaleur spécifique du calorimètre – .
2. Versez dans le calorimètre une quantité mesurée d'eau froide à température ambiante (environ 150 g).
3. Mesurer la température initiale de l'eau froide t 1 .
4. Faites bouillir l'eau dans le récipient.
5. Placer un des corps d'essai dans de l'eau bouillante pendant un certain temps. Prendre la température du corps chauffé t 0 égale à la température eau bouillante dans des conditions normales - 100 ° C.
6. Placer le corps chauffé dans le calorimètre avec de l'eau. Attendre la fin du transfert de chaleur et mesurer la température finale dans le calorimètre - t 2 .
8. Déterminez de même les capacités calorifiques spécifiques des deux autres corps.
9. Enregistrez les résultats des mesures et des calculs dans le tableau 3.
10. Sur la base des valeurs des capacités thermiques spécifiques, déterminez les substances à partir desquelles les corps sont fabriqués.
12. Après avoir mesuré les dimensions linéaires des corps, déterminez leur densité.
13. Calculez les erreurs et enregistrez le résultat conformément à GOST.
14. Notez les conclusions sur le travail de laboratoire.
Tableau 3
| Nbre p/p | M", kg | M", kg | m, kg | C", J / kg. K | C", J / kg. K | t 0 , 0 C | t 1 , 0 C | t 2 , 0 C | C, J/kg. À |
Page 2
La précision de la détermination de la chaleur spécifique selon Sykes est très élevée. Cependant, cette méthode est associée à des difficultés expérimentales plus importantes que la méthode de Smith et ne donne également des résultats précis que pour les courbes de chauffage, bien qu'elle puisse également être utilisée pour obtenir des courbes de refroidissement. La méthode de Smith facilite l'étude de plages de température étroites, mais est probablement moins précise.
Par conséquent, afin de déterminer la capacité thermique spécifique sg d'une substance, il est nécessaire de mesurer le travail A effectué par des forces externes agissant sur le corps et de mesurer le changement de température corporelle observé à la suite du travail en l'absence d'échange de chaleur avec d'autres corps.
La méthode la plus couramment utilisée pour déterminer la capacité thermique spécifique ; appelé mélange. Le calorimètre (Regno) est constitué d'un récipient en cuivre rouge, placé sur des pieds en bois au fond d'un autre récipient en cuivre, dont il est séparé par une couche d'air dont la conductivité thermique et la capacité calorifique, par unité de volume, sont négligeable. Le premier récipient est rempli d'eau.
Considérons maintenant les méthodes de détermination de la capacité calorifique spécifique d'un mélange gazeux.
La détermination directe (directe) de la capacité calorifique spécifique Su et l'étude de l'évolution de son évolution en fonction de la température et du volume spécifique est l'une des des moyens efficacesétude de l'état critique des substances. Par conséquent, les déterminations expérimentales de la capacité calorifique présentent un grand intérêt théorique et pratique dans l'étude des phénomènes critiques.
Quelle est la formule pour déterminer la capacité thermique spécifique des solutions.
Lors de la réalisation d'expériences pour déterminer la chaleur spécifique par mélange, il est nécessaire de chauffer l'échantillon d'essai - - à une température précisément fixée. Pour cela, des appareils de chauffage portables sont utilisés, qui sont installés au-dessus du calorimètre pendant une courte période, nécessaires au transfert rapide de l'échantillon chauffé vers le calorimètre.
| Schéma de l'appareil. |
L'essence de la méthode stationnaire absolue la plus simple pour déterminer la chaleur spécifique est la suivante: un échantillon du matériau d'essai d'épaisseur h et de section transversale 5 est placé entre le réchauffeur et le refroidisseur. Le réchauffeur peut être un récipient avec eau chaude ou un élément chauffant électrique dont la puissance peut être ajustée à volonté en modifiant la tension. Le refroidisseur est un corps métallique creux à travers lequel passe de l'eau froide. Les températures sur les surfaces chauffées et refroidies de l'échantillon (tj et, respectivement, / 2) sont mesurées par des thermocouples.
Vous trouverez ci-dessous un exemple de traitement de données expérimentales lors de la détermination de la capacité thermique spécifique d'un échantillon de grès. Un cylindre creux rempli de poudre de l'échantillon de roche étudié a été chauffé à 40 C et refroidi dans une chambre à air calme à une température de 18 à 20 C.
Sur la fig. 3 à 6 montrent des nomogrammes pour déterminer la capacité calorifique spécifique d'hydrocarbures individuels liquides et de mélanges d'huiles, ainsi que de solutions aqueuses de méthanol et d'éthanol.
Par exemple, faisons une équation de bilan thermique, qui est utilisée pour déterminer la capacité thermique spécifique d'une substance à l'aide d'un calorimètre. Approximativement, on peut considérer que dans ce cas trois corps participent à l'échange de chaleur: un calorimètre, un liquide et un corps dont la chaleur spécifique de la substance est déterminée.
6.4. Transfert de chaleur entre les corps
6.4.1. Capacité calorifique du corps, spécifique capacité thermique d'une substance, capacité thermique molaire d'une substance
Pour élever la température du corps, celui-ci a besoin de communiquer une certaine quantité de chaleur.
1 kg d'une substance donnée pour 1 K s'appelle chaleur spécifique substances et est calculé par la formule
c bat = Q m Δ T ,
où Q est la quantité de chaleur nécessaire pour chauffer une certaine masse de matière ; m est la masse de la substance ; ΔT est le changement de température de la substance lorsqu'elle est chauffée.
Dans le Système international d'unités, la capacité thermique spécifique d'une substance est mesurée en joules divisé par kilogramme-kelvin (1 J/(kg ⋅ K)).
La quantité de chaleur nécessaire pour chauffer une masse de matière, est déterminé par le produit
Q = c bat m ∆T .
La quantité de chaleur nécessaire pour élever un corps donné de 1 K est appelée capacité calorifique du corps et est calculé par la formule
C = QΔT,
où Q est la quantité de chaleur nécessaire pour chauffer un corps donné ; ΔT - changement de température corporelle lorsqu'il est chauffé.
Dans le système international d'unités, la capacité calorifique d'un corps est mesurée en joules divisés par kelvin (1 J/K).
La quantité de chaleur nécessaire pour chauffer un certain corps est déterminée par le produit
Q=CΔT,
où C est la capacité calorifique du corps.
La capacité calorifique d'un corps et la capacité calorifique de la substance dont le corps est composé, interconnecté expression
C \u003d mc bat,
où C est la capacité calorifique du corps; m - poids corporel; c battement est la capacité calorifique spécifique de la substance à partir de laquelle ce corps est fait.
La quantité de chaleur nécessaire pour élever la température de 1 mole d'une substance donnée de 1 K est appelée capacité calorifique molaire d'une substance et est calculé par la formule
c μ = Q ν Δ T ,
où Q est la quantité de chaleur nécessaire pour chauffer une certaine quantité d'une substance ; ν est la quantité de matière ; ΔT est le changement de température de la quantité spécifiée de substance lorsqu'elle est chauffée.
Dans le Système international d'unités, la capacité calorifique molaire d'une substance est mesurée en joules par mol-kelvin (1 J/(mol ⋅ K)).
La quantité de chaleur nécessaire pour chauffer une certaine quantité de substance, est déterminé par le produit
Q = c µ νΔT .
Capacités thermiques molaire et spécifique d'une substance interconnecté expression
c µ = Ms bat,
où c µ est la capacité calorifique molaire de la substance; M est la masse molaire de la substance ; c sp - capacité thermique spécifique de la substance.
Exemple 14 Des billes de fer et de plomb ont le même diamètre. Combien de fois la capacité calorifique d'une boule de fer est-elle supérieure à celle d'une boule de plomb ? Les capacités thermiques spécifiques du fer et du plomb sont de 0,46 et 0,13 kJ / (kg ⋅ K) et les densités sont respectivement de 7,80 et 11,5 g / cm 3.
La solution . Les capacités calorifiques des billes sont déterminées par les formules suivantes :
- boule de fer -
C 1 \u003d m 1 c ud1,
où m 1 est la masse de la boule de fer ; c ud1 - capacité thermique spécifique du fer;
- balle de plomb -
C 2 \u003d m 2 c battement2,
où m 2 est la masse de la bille de plomb ; c sp2 - capacité thermique spécifique du plomb.
Le rapport souhaité est les capacités calorifiques :
C 1 C 2 \u003d m 1 c battre 1 m 2 c battre 2,
qui est déterminé par le rapport des masses des billes de fer et de plomb et le rapport des capacités calorifiques spécifiques du fer et du plomb.
Les masses des balles sont déterminées par leur taille et leur densité :
- boule de fer -
m 1 \u003d ρ 1 V 1,
où ρ 1 est la masse volumique du fer ; V 1 - le volume de la boule de fer;
- balle de plomb -
m 2 \u003d ρ 2 V 2,
où ρ 2 - la densité de plomb; V 2 - le volume de la balle en plomb.
Les boules ont le même diamètre, donc leurs volumes sont les mêmes :
V 1 \u003d V 2 \u003d V \u003d π d 2 6,
où d sont les diamètres des billes de fer et de plomb.
Compte tenu de cette dernière circonstance, le rapport de masse est égal à :
m 1 m 2 = ρ 1 V 1 ρ 2 V 2 = ρ 1 ρ 2 .
Remplaçons m 1 /m 2 dans la formule du rapport des capacités calorifiques des billes de fer et de plomb :
C 1 C 2 \u003d ρ 1 c sp 1 ρ 2 c sp 2.
Faisons le calcul :
C 1 C 2 = 7,80 ⋅ 10 3 ⋅ 0,46 ⋅ 10 3 11,5 ⋅ 10 3 ⋅ 0,13 ⋅ 10 3 = 2,4.
La capacité calorifique d'une boule de fer est 2,4 fois supérieure à celle d'une boule de plomb.
Exemple 15. Lors de la préparation d'un mélange, une certaine masse de sable et quatre fois la masse de ciment ont été versées dans le bunker. Les capacités thermiques spécifiques du ciment et du sable sont respectivement de 810 et 960 J/(kg ⋅ K). Déterminer la capacité calorifique spécifique du mélange.
La solution . La capacité thermique spécifique du mélange est déterminée par la formule
c bat = Q m Δ T ,
où Q est la quantité de chaleur nécessaire pour élever la température du mélange de ΔT ; m est la masse du mélange.
La quantité de chaleur nécessaire pour chauffer le mélange, -
Q \u003d Q 1 + Q 2,
où Q 1 - la quantité de chaleur nécessaire pour chauffer le sable, qui fait partie du mélange, de ΔT; Q 2 - la quantité de chaleur nécessaire pour chauffer le ciment, qui fait partie du mélange, de ΔT.
La quantité de chaleur nécessaire pour le chauffage :
- le sable -
Q 1 \u003d c ud1 m 1 ∆T,
où c ud1 - capacité thermique spécifique du sable; m 1 - masse de sable;
- ciment -
Q 2 \u003d c ud2 m 2 ∆T,
où c ud2 - capacité thermique spécifique du ciment; m 2 est la masse de ciment.
La quantité de chaleur nécessaire pour chauffer un mélange de sable et de ciment est déterminée par l'expression
Q \u003d c battre 1 m 1 Δ T + c battre 2 m 2 Δ T \u003d (c battre 1 m 1 + c battre 2 m 2) Δ T.
La masse du mélange est la somme des masses de sable et de ciment :
m \u003d m 1 + m 2.
Remplaçons les expressions obtenues pour la quantité de chaleur et la masse du mélange dans la formule de la capacité calorifique spécifique du mélange :
c bat \u003d (c bat 1 m 1 + c bat 2 m 2) Δ T (m 1 + m 2) Δ T \u003d c bat 1 m 1 + c bat 2 m 2 m 1 + m 2.
Nous allons transformer l'expression résultante en tenant compte du rapport de masse :
m 2 = 4m 1 , c'est-à-dire c bat \u003d c bat 1 m 1 + 4 c bat 2 m 1 m 1 + 4 m 1 \u003d c bat 1 + 4 c bat 2 5.
Le calcul donne la valeur :
c bat = 960 + 4 ⋅ 810 5 = 840 J/(kg ⋅ K).
Par conséquent, la capacité calorifique spécifique du mélange est de 840 J/(kg ⋅ K).
