¿En qué unidades se mide la capacidad calorífica? Capacidad calorífica de los gases. Tipos de capacidades caloríficas.
La capacidad calorífica de un cuerpo es la cantidad de calor que debe impartirse a un cuerpo dado para elevar su temperatura en un grado. Cuando se enfría un grado, el cuerpo emite la misma cantidad de calor. La capacidad calorífica es proporcional a la masa del cuerpo. La capacidad calorífica de una unidad de masa de un cuerpo se denomina específica, y el producto del calor específico por la masa atómica o molecular se denomina atómica o molar, respectivamente.
Capacidades de calor varias sustancias difieren mucho entre sí. Asi que, calor especifico el agua a 20 ° C es 4200 J / kg K, madera de pino - 1700, aire - 1010. Para metales, es menor: aluminio - 880 J / kg K, hierro - 460, cobre - 385, plomo - 130. Calor específico aumenta ligeramente con la temperatura (a 90°C, la capacidad calorífica del agua es 4220 J/kg K) y varía mucho durante las transformaciones de fase: la capacidad calorífica del hielo a 0°C es 2 veces menor que la del agua; La capacidad calorífica del vapor de agua a 100°C es de aproximadamente 1500 J/kg K.
La capacidad calorífica depende de las condiciones en las que cambia la temperatura del cuerpo. Si las dimensiones del cuerpo no cambian, entonces todo el calor se destina a cambiar la energía interna. Aquí estamos hablando de capacidad calorífica a volumen constante. A presión externa constante, debido a la expansión térmica, el trabajo mecánico se realiza contra fuerzas externas y calentar a una temperatura particular requiere más calor. Por lo tanto, la capacidad calorífica a presión constante siempre es mayor que . Para gases ideales(ver figura), donde R es la constante de los gases, igual a 8,32 J/mol K.
Generalmente medido. Manera clasica Las medidas de capacidad calorífica son las siguientes: un cuerpo cuya capacidad calorífica se va a medir se calienta a una temperatura determinada y se coloca en un calorímetro con una temperatura inicial de , lleno de agua u otro líquido con una capacidad calorífica conocida y - la capacidad calorífica de el calorímetro y el líquido).
Al medir la temperatura en el calorímetro después de que se haya establecido el equilibrio térmico, la capacidad calorífica del cuerpo se puede calcular utilizando la fórmula:
![]()
donde y son las masas del cuerpo, líquido y calorímetro.
La teoría más desarrollada es la capacidad calorífica de los gases. A temperaturas ordinarias, el calentamiento conduce principalmente a un cambio en la energía del movimiento de traslación y rotación de las moléculas de gas. Para la capacidad calorífica molar de los gases monoatómicos, la teoría da , diatómico y poliatómico - y . A temperaturas muy bajas, la capacidad calorífica es algo menor debido a los efectos cuánticos (ver Fig. Mecánica cuántica). A altas temperaturas se agrega energía vibracional y la capacidad calorífica de los gases poliatómicos aumenta con el aumento de la temperatura.
La capacidad de calor atómico de los cristales, según la teoría clásica, es igual a , lo que es consistente con la ley empírica de Dulong y Petit (establecida en 1819 por los científicos franceses P. Dulong y A. Petit). Teoría cuántica La capacidad calorífica conduce a la misma conclusión a altas temperaturas, pero predice una disminución de la capacidad calorífica con la disminución de la temperatura. Cerca del cero absoluto, la capacidad calorífica de todos los cuerpos tiende a cero (la tercera ley de la termodinámica).
Capacidad calorífica del cuerpo.- esto es cantidad física, determinado por la relación entre la cantidad de calor absorbido por el cuerpo cuando se calienta y el cambio en su temperatura:
El significado físico de la capacidad calorífica de un cuerpo: la capacidad calorífica de un cuerpo es igual a la cantidad de calor absorbido por el cuerpo cuando se calienta o liberado cuando se enfría por 1K.
Dado que las capacidades caloríficas son variables, distinguen entre las capacidades caloríficas medias y verdaderas. Debajo de la capacidad de calor promedio, comprenda la proporción de la cantidad de calor. q , sumado a una unidad de la cantidad de una sustancia (gas), a un cambio en su temperatura de t 1 antes de t 2 siempre que la diferencia de temperatura t 2 – t 1 es un valor finito. Las capacidades medias de calor de masa, volumen y molar, respectivamente, se denotan por C metro , C metro ' y metro . De la definición de la capacidad calorífica promedio se deduce que si la temperatura del gas aumenta de t 1 antes de t 2 entonces su capacidad calorífica promedio [kJ / (kg * K)]
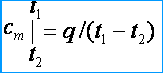
Bajo la verdadera capacidad calorífica, entienda la capacidad calorífica del gas, correspondiente a un cambio infinitesimal en la temperatura del gas, correspondiente a un cambio infinitesimal en la temperatura dt , es decir.
c = dq/dt,
dónde dq=cdt.
Calor especifico es la capacidad de diferentes sustancias para absorber calor cuando se calientan. La capacidad calorífica específica de una sustancia está determinada por la relación entre la cantidad de calor que recibe cuando se calienta y la masa de la sustancia y el cambio en su temperatura, si: ![]()
la relación que expresa la relación entre las capacidades caloríficas molares Cp y CV tiene la forma (fórmula de Mayer): Cp = CV + R. O MÁS EXPANDIDA Capacidad calorífica gas ideal Si, como resultado de la transferencia de calor, se transfiere una cierta cantidad de calor al cuerpo, entonces la energía interna del cuerpo y su temperatura cambian. La cantidad de calor Q requerida para calentar 1 kg de una sustancia en 1 K se llama calor específico de la sustancia c. c = Q / (mΔT). En muchos casos, es conveniente utilizar la capacidad calorífica molar C: C = M c, donde M es la masa molar de la sustancia. La capacidad calorífica determinada de esta manera no es una característica inequívoca de una sustancia. De acuerdo con la primera ley de la termodinámica, el cambio en la energía interna de un cuerpo depende no solo de la cantidad de calor recibido, sino también del trabajo realizado por el cuerpo. Dependiendo de las condiciones en las que se llevó a cabo el proceso de transferencia de calor, el cuerpo podría realizar varios trabajos. Por lo tanto, la misma cantidad de calor transferido al cuerpo podría provocar diferentes cambios en su energía interna y, en consecuencia, en la temperatura. Tal ambigüedad en la determinación de la capacidad calorífica es típica solo para una sustancia gaseosa. Cuando se calientan cuerpos líquidos y sólidos, su volumen prácticamente no cambia, y el trabajo de expansión resulta ser igual a cero. Por lo tanto, toda la cantidad de calor que recibe el cuerpo se destina a cambiar su energía interna. A diferencia de los líquidos y sólidos, el gas en el proceso de transferencia de calor puede cambiar mucho su volumen y realizar trabajo. Por lo tanto, la capacidad calorífica de una sustancia gaseosa depende de la naturaleza del proceso termodinámico. Por lo general, se consideran dos valores de la capacidad calorífica de los gases: CV es la capacidad calorífica molar en un proceso isocórico (V = const) y Cp es la capacidad calorífica molar en un proceso isobárico (p = const). En el proceso a volumen constante, el gas no realiza trabajo: A = 0. De la primera ley de la termodinámica para 1 mol de gas se sigue QV = CVΔT = ΔU. El cambio ΔU de la energía interna de un gas es directamente proporcional al cambio ΔT de su temperatura. Para un proceso a presión constante, la primera ley de la termodinámica da: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, donde ΔV es el cambio de volumen de 1 mol de un gas ideal cuando su temperatura cambia en ΔT. De aquí se sigue: La relación ΔV / ΔT se puede encontrar a partir de la ecuación de estado de un gas ideal escrita para 1 mol: pV = RT, donde R es la constante universal de los gases. En p = constante Por lo tanto, la relación que expresa la relación entre las capacidades caloríficas molares Cp y CV tiene la forma (fórmula de Mayer): Cp = CV + R.
La constante de gas es numéricamente igual al trabajo de expansión de 1 mol de un gas ideal bajo presión constante cuando se calienta 1 K. R = pV/T = 1.01 10 5 22.4 10-3/273[Pa m 3 /mol]/ K = 8,31 (44) Dzh/ (mol K)
La constante universal de los gases es una constante física fundamental universal R, igual al producto de la constante k de Boltzmann y la constante de Avogadro
Significado físico: Constante de gas i es numéricamente igual al trabajo de expansión de un mol de un gas ideal en un proceso isobárico con un aumento de temperatura de 1 K
En el sistema CGS, la constante de los gases es:
La constante específica de los gases es:
Exponente adiabático(aveces llamado coeficienteveneno) - la relación entre la capacidad calorífica a presión constante () y la capacidad calorífica a volumen constante (). A veces también se le llama factor isentrópico extensiones. Denotado por la letra griega (gamma) o (kappa). El símbolo de la letra se utiliza principalmente en disciplinas de ingeniería química. En ingeniería térmica, se utiliza la letra latina.
Una mezcla de gases es una colección de varios gases diferentes que, bajo las condiciones consideradas, no entran en reacciones químicas entre sí.
Una mezcla de gases es un sistema termodinámico homogéneo (dentro del cual no existen interfases que separen entre sí las partes macroscópicas del sistema, que difieren en sus propiedades y composición).
Presión parcial Pi del i-ésimo gas en la mezcla es la presión a la que estaría este gas si todos los demás gases se eliminaran de la mezcla, y V y T permanecieran iguales.
Ley de Dalton - La presión de una mezcla de gases que no interactúan químicamente entre sí es igual a la suma de las presiones parciales de estos gases.
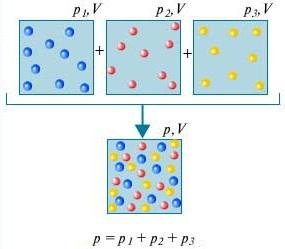
Para entender lo que es ley de dalton, considere para esto el aire en la habitación. Es una mezcla de varios gases: nitrógeno (80%), oxígeno (20%). La presión parcial de cada uno de estos gases es la presión que tendría el gas si ocupase solo todo el volumen. Por ejemplo, si todos los gases excepto el nitrógeno se eliminaran de la habitación, entonces la presión de lo que queda sería la presión parcial de nitrógeno. ley de dalton establece que la presión total de todos los gases tomados juntos es igual a la suma de las presiones parciales de cada gas tomado por separado. (Estrictamente hablando, la ley se aplica solo a los gases ideales, pero en una buena aproximación también describe los gases reales).
Primera ley de la termodinámica es una generalización de la ley de conservación y transformación de la energía para un sistema termodinámico. Está formulado de la siguiente manera:
Cambiar Δtu La energía interna de un sistema termodinámico no aislado es igual a la diferencia entre la cantidad de calorq transferido al sistema, y trabajarA , un sistema perfecto sobre cuerpos externos.
|
La relación que expresa la primera ley de la termodinámica a menudo se escribe en una forma diferente:
|
La cantidad de calor que recibe el sistema se utiliza para cambiar su energía interna y realizar trabajo en los cuerpos externos.
La primera ley de la termodinámica es una generalización de hechos experimentales. Según esta ley, la energía no se crea ni se destruye; se transfiere de un sistema a otro y se transforma de una forma a otra. Una consecuencia importante de la primera ley de la termodinámica es la afirmación de que es imposible crear una máquina capaz de realizar un trabajo útil sin consumir energía del exterior y sin cambios en el interior de la propia máquina. Tal máquina hipotética se llama máquina de movimiento perpetuo (perpetuum mobile) del primer tipo . Numerosos intentos de crear una máquina de este tipo terminaron invariablemente en fracaso. Cualquier máquina puede hacer un trabajo positivo. A sobre cuerpos externos sólo obteniendo una cierta cantidad de calor q de los cuerpos circundantes o una disminución en Δ tu su energía interna.
Apliquemos la primera ley de la termodinámica a los isoprocesos en gases.
Con expansión isobárica q> 0 - el gas absorbe calor y el gas realiza un trabajo positivo. Con compresión isobárica q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T una ; la energía interna disminuye, Δ tu < 0.
A proceso isotérmico la temperatura del gas no cambia, por lo tanto, la energía interna del gas, Δ tu = 0.
A proceso isocórico (V= const) el gas no realiza trabajo, A= 0. Por lo tanto,
La primera ley de la termodinámica para un proceso isobárico da:
|
La primera ley de la termodinámica para un proceso isotérmico se expresa mediante la relación
|
cantidad de calor q, obtenido por el gas en el proceso de expansión isotérmica, se convierte en trabajo sobre cuerpos externos. Bajo compresión isotérmica, el trabajo de las fuerzas externas producidas sobre el gas se convierte en calor, que se transfiere a los cuerpos circundantes.
Junto con los procesos isocóricos, isobáricos e isotérmicos, la termodinámica a menudo considera procesos que ocurren en ausencia de intercambio de calor con los cuerpos circundantes. Los recipientes con paredes aislantes se llaman conchas adiabáticas, y los procesos de expansión o compresión de gas en tales recipientes se denominan adiabático.
A proceso adiabáticoq= 0; por lo que la primera ley de la termodinámica toma la forma
|
|
|
En su significado físico, la primera ley de la termodinámica es la ley de conservación (cambio) de energía en termodinámica. Si, de acuerdo con la ley del cambio de energía en mecánica, el trabajo de las fuerzas no conservativas es igual al incremento de la energía mecánica del sistema (en particular, el trabajo de las fuerzas de fricción con signo negativo es igual a la disminución de la energía mecánica del sistema), entonces según la primera ley de la termodinámica, el incremento de la energía interna del sistema termodinámico es igual a la suma del trabajo de las fuerzas externas, perfectas sobre el sistema, y la energía transferida al sistema por transferencia de calor. entalpía(del griego. entalpo- calentar) es propiedad de la materia, que indica la cantidad de energía que se puede convertir en calor. entalpía es una propiedad termodinámica de una sustancia que indica el nivel de energía almacenada en su estructura molecular. Esto significa que, si bien la materia puede tener energía en función de la temperatura y la presión, no toda puede convertirse en calor. Parte de la energía interna permanece siempre en la sustancia y mantiene su estructura molecular. Parte de la energía cinética de una sustancia no está disponible cuando su temperatura se acerca a la temperatura ambiente. Como consecuencia, entalpía es la cantidad de energía que está disponible para convertirla en calor a una temperatura y presión dadas. Las unidades de entalpía son BTU o Joule para energía y Btu/lbm o J/kg para energía específica. 11 pregunta |

Objetivo: Determinación experimental de la capacidad calorífica de los materiales.
Equipo: Balanza, peso, calorímetro, cilindro de metal con capacidad calorífica conocida, vaso de precipitados, calentador, gancho.
Breve teoría:
Todos los cuerpos macroscópicos y sistemas de cuerpos, además de la energía mecánica debida a su movimiento e interacción, tienen energía que depende de su estado interno. Esta energía, que es la energía de movimiento e interacción entre todas las partículas que componen el cuerpo, se llama interna.
La energía interna incluye la energía cinética del movimiento térmico de las moléculas y los átomos que forman un cuerpo determinado, la energía cinética de los electrones que se mueven en los átomos alrededor de los núcleos, la energía potencial de las interacciones entre las moléculas, los átomos, los electrones y los núcleos, los nucleones en el núcleo , etc. El concepto de energía interna no incluye la energía cinética y potencial de un cuerpo dado como un todo.
La energía interna está determinada únicamente por el conjunto de parámetros que caracterizan el estado del sistema dado, es decir es una función de un solo valor del estado de este sistema.
La energía interna generalmente se denota con la letra U.
En fenómenos térmicos que ocurren a temperaturas alejadas de las temperaturas de transición de fase, un cambio en la energía interna DU está asociado con un cambio en la energía cinética y potencial de las moléculas, mientras que los restantes componentes de la energía interna no cambian. Por lo tanto, en tales procesos, podemos suponer que la energía interna de un cuerpo es igual a la suma de las energías cinéticas del movimiento térmico caótico de todas las moléculas relativas al centro de masa de este cuerpo y las energías potenciales de interacción de todas moléculas entre sí.
Cuando el estado del cuerpo cambia, su energía interna cambia. Por ejemplo, cuando la temperatura de un cuerpo aumenta, su energía interna aumenta, ya que aumenta la energía cinética promedio del movimiento de las moléculas de este cuerpo. A medida que la temperatura disminuye, la energía interna del cuerpo disminuye.
La energía interna de los cuerpos puede cambiar diferentes caminos. Por ejemplo, la energía interna cambia cuando se realiza trabajo mecánico por fuerzas externas sobre un cuerpo dado durante su deformación, y también sin realizar trabajo, cuando el cuerpo está en contacto con otro cuerpo (o medio) que tiene una temperatura mayor o menor que el cuerpo dado.
El proceso de cambiar la energía interna de un cuerpo sin realizar un trabajo mecánico se llama transferencia de calor o transferencia de calor. Hay tres tipos de transferencia de calor: convección, conducción y radiación.
Durante el intercambio de calor, no hay conversión de energía de un tipo a otro. El proceso de transferencia de calor consiste en que parte de la energía interna de un cuerpo más caliente se transfiere a un cuerpo (o medio) menos caliente.
Para caracterizar los procesos de transferencia de calor, se introduce el concepto de cantidad de calor, que se denomina cantidad que es una medida cuantitativa del cambio en la energía interna del cuerpo en el proceso de transferencia de calor.
Debe recordarse que el cuerpo solo puede dar o recibir energía, y la cantidad de calor Q es solo un equivalente numérico de la energía dada o recibida por el cuerpo en el proceso de transferencia de calor.
La cantidad de calor depende del tipo de proceso y no es una función del estado del sistema.
La cantidad de calor requerida para calentar el cuerpo que ocurre sin transformaciones de fase (sin cambiar el estado de agregación de la sustancia):
donde c es la capacidad calorífica específica del cuerpo, determinada por la relación entre la cantidad de calor transferido a la masa m del cuerpo y el cambio de temperatura resultante DT, m es la masa corporal, DT es la diferencia entre la temperatura final y temperaturas iniciales del cuerpo dado.
La cantidad de calor que debe impartirse al cuerpo para elevar su temperatura en un Kelvin se denomina capacidad calorífica de esta sustancia. Cuando se enfría un Kelvin, el cuerpo emite la misma cantidad de calor. La capacidad calorífica de un cuerpo es proporcional a la masa del cuerpo y depende de la sustancia de la que está compuesto. En el sistema SI de unidades, la capacidad calorífica se mide en J/K.
Para caracterizar las propiedades térmicas de una sustancia, se toma la capacidad calorífica de una unidad de masa de esta sustancia. Esta característica se llama capacidad calorífica específica. Es igual a la relación entre la capacidad calorífica de un cuerpo dado y su masa. La capacidad calorífica específica con el sistema SI se mide en J / (kg × K).
Experimentalmente, el calor específico de un cuerpo metálico se determina utilizando un calorímetro y un termómetro. El calorímetro más simple consiste en un vaso de metal pulido colocado dentro de otro vaso sobre tapones (a efectos de aislamiento térmico). El vaso interior está lleno de agua u otro líquido con una capacidad calorífica específica conocida. Un cuerpo calentado a cierta temperatura t se baja a un calorímetro. Supongamos que la temperatura del líquido en el calorímetro sea t 1 antes de que se baje el cuerpo, y después de que se establezca el equilibrio térmico entre el líquido y el cuerpo, su temperatura total será igual a q.
De la ley de conservación de la energía se sigue que:
Q \u003d Q 1 + Q 2,(2)
donde esta la cantidad de calor q, dada por un cuerpo calentado, es igual a la suma de la cantidad de calor Q1, obtenidos por agua, y Q2, recibida por el calorímetro.
Considerando (1), reescribimos (2) como:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
dónde do 1 y metro 1- capacidad calorífica específica y masa de agua en el calorímetro, c 2 y m2- capacidad calorífica específica y masa del calorímetro. Esta ecuación se llama ecuación de balance de calor. De ella encontramos la capacidad calorífica específica del cuerpo:
Es posible abordar la solución de este problema de una manera diferente, suponga que las pérdidas de energía en el marco de un experimento serán las mismas. Cuerpo Con capacidad calorífica específica conocida, calentada a una cierta temperatura t, bajado a un calorímetro, cuya temperatura cambia. Entonces la ecuación de balance de calor tomará la forma:
cm(t-q) = c 1 m 1 (q-t 1) + pérdida Q,(5)
dónde Q pérdida es la cantidad de calor recibido por el calorímetro y ambiente, Como consecuencia:
Pérdida Q, = cm(t-q) - c 1 m 1 (q-t 1). (6)
Si un cuerpo con una capacidad calorífica específica desconocida, calentado a la misma temperatura, se baja a un calorímetro, entonces la ecuación de balance de calor tomará la forma:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q pérdidas,(7)
dónde m¢ 1 es la masa de agua en el calorímetro, y t¢ 1- temperatura del agua en este experimento. Después:
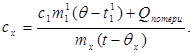 (8)
(8)
Sustituyendo el valor (6) en (8) obtenemos:
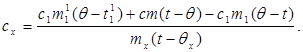 (9)
(9)
donde está la cantidad elemental de calor; - un cambio elemental de temperatura.
La capacidad calorífica es numéricamente igual a la cantidad de calor que debe suministrarse al sistema para aumentar su temperatura en 1 grado en determinadas condiciones. Dado que la unidad de calor en el SI es el joule y la temperatura es el grado K, la unidad de capacidad calorífica es J/K.
Dependiendo de la unidad cuantitativa del cuerpo al que se suministra calor en termodinámica, se distinguen las capacidades de calor de masa, volumen y molar.
Capacidad de calor de masa es la capacidad calorífica por unidad de masa del fluido de trabajo,
donde y son el volumen y la densidad del cuerpo en condiciones físicas normales.
La capacidad calorífica volumétrica se mide en J/(m3 K).
Capacidad calorífica molar- capacidad calorífica, referida a la cantidad de fluido de trabajo (gas) en moles,
| , |
donde m3/mol es el volumen molar del gas en condiciones normales.
Teniendo en cuenta que la capacidad calorífica no es constante, sino que depende de la temperatura y otros parámetros térmicos, se hace una distinción entre la capacidad calorífica real y la media. Por lo general, la capacidad calorífica verdadera se entiende como la relación entre la cantidad elemental de calor que se transmite a un sistema termodinámico en cualquier proceso y un aumento infinitesimal en la temperatura de este sistema causado por el calor impartido. Consideraremos la verdadera capacidad calorífica del sistema termodinámico a una temperatura del sistema igual a , y - verdadera capacidad calorífica específica fluido de trabajo a su temperatura igual a . Entonces, la capacidad calorífica específica promedio del fluido de trabajo cuando su temperatura cambia de a se puede determinar como
Determinación de la energía interna del cuerpo.
Energía interna cuerpo (denominado mi o tu) es la suma de las energías de las interacciones moleculares y los movimientos térmicos de una molécula. En particular, la energía interna de un gas ideal es igual a la suma de las energías cinéticas de todas las partículas de gas en movimiento térmico continuo y aleatorio. De aquí se sigue la ley de Joule, confirmada por numerosos experimentos.
La teoría cinética molecular conduce a la siguiente expresión para la energía interna de un mol de un gas monoatómico ideal (helio, neón, etc.), cuyas moléculas solo realizan un movimiento de traslación:
De este modo, energía interna tu el cuerpo está determinado únicamente por parámetros macroscópicos que caracterizan el estado del cuerpo. No depende de cómo se realizó el estado dado. Es costumbre decir que la energía interna es una función de estado.
En TD, se utiliza el cambio en la energía interna y no su valor absoluto.
¿Qué es una obra de ampliación? La primera ley de TD.
Trabajo de expansión: el trabajo mecánico realizado por el vehículo contra las fuerzas de presión externa en el proceso de su expansión. Cuando cambia el volumen, el gas realiza trabajo, el signo del cambio en V coincide con el signo del trabajo
La primera ley de TD: el calor impartido al sistema se utiliza para convertir la energía interna y realizar trabajo.
Desde el punto de vista de su capacidad para recibir (o dar) energía en forma de calor, se acostumbra caracterizar un sistema termodinámico por su capacidad calorífica.
La capacidad calorífica de un cuerpo (sistema) es una cantidad física que es numéricamente igual a la cantidad de calor que debe impartirse al cuerpo (sistema) para cambiar su temperatura en un Kelvin.
Si al cuerpo se le da una cantidad infinitesimal de calor q, lo que provocó un aumento infinitesimal de la temperatura dT, entonces su capacidad calorífica DE es por definición igual a
La unidad SI de capacidad calorífica es el joule dividido por el kelvin ( j/A).
Experimentos y cálculos teóricos muestran que la capacidad calorífica de un cuerpo depende de su composición química, masa y estado termodinámico(por ejemplo, sobre la temperatura), así como sobre el tipo de proceso de cambio del estado del cuerpo cuando se le imparte calor.
La capacidad calorífica específica es la capacidad calorífica por unidad de masa de una sustancia, es decir, para una sustancia homogénea
![]() , (25.2)
, (25.2)
dónde Con- capacidad calorífica específica, METRO es la masa de la sustancia.
La unidad SI de calor específico es el joule dividido por un kelvin-kilogramo [( j/(A . kg)].
La capacidad calorífica molar es la capacidad calorífica de un mol de una sustancia, eso es
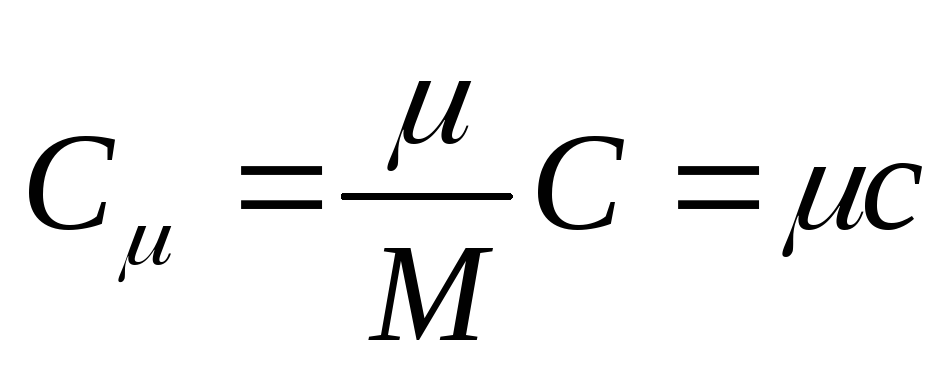 , (25.3)
, (25.3)
dónde DE - capacidad calorífica molar; es la masa molar de la sustancia.
La unidad de capacidad calorífica molar en SI es el joule dividido por el kelvin-mol [ j/(A . Topo)].
Cantidad elemental de calor q, necesario para cambiar la temperatura corporal dT, Se define como
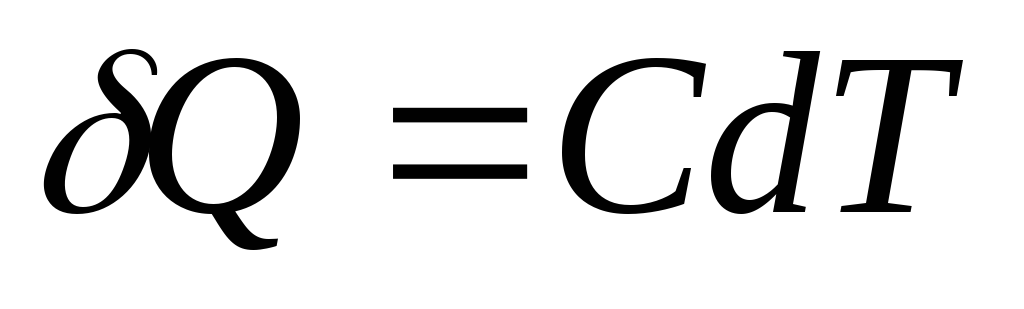 ,
,
y para un cuerpo homogéneo
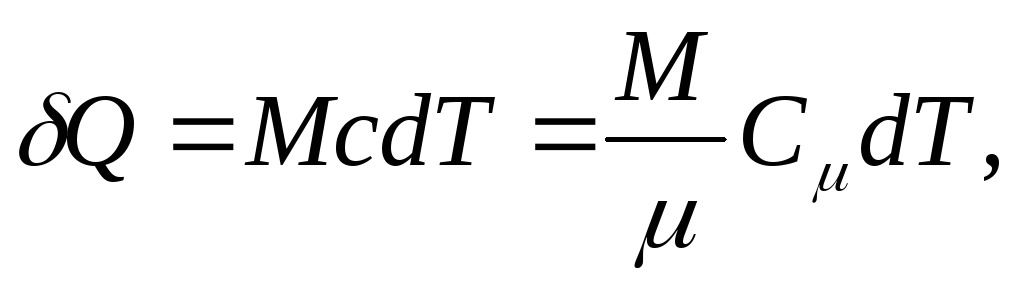 (25.4)
(25.4)
dónde METRO/ - cantidad de sustancia (número de moles).
§26. Primera ley de la termodinámica
La primera ley (primera ley) de la termodinámica es una expresión matemática de la ley de conservación y transformación de la energía aplicada a los sistemas termodinámicos. Se estableció como resultado de investigaciones experimentales y teóricas en el campo de la física y la química, cuya etapa final fue el descubrimiento de la equivalencia de calor y trabajo, es decir, el descubrimiento de que la conversión de calor en trabajo y trabajo en el calor siempre se lleva a cabo en la misma proporción cuantitativa estrictamente constante.
En §24 se señaló que la energía interna de un sistema se puede cambiar de dos formas: realizando trabajo y mediante transferencia de calor. Por lo tanto, podemos escribir:
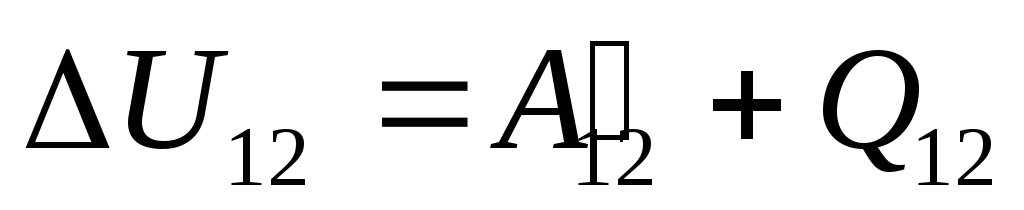 ,
(26.1)
,
(26.1)
dónde
tu 12
-
cambio en la energía interna del sistema durante su transición del estado 1
en un estado 2
como resultado del trabajo en él 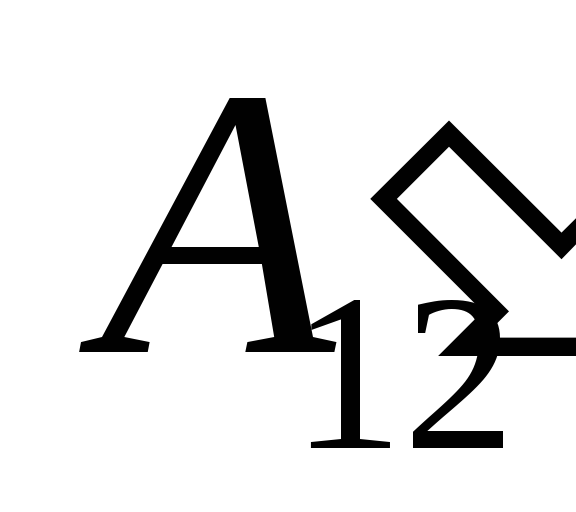 de cuerpos externos y transfiriéndole desde el exterior una cierta cantidad de calor
de cuerpos externos y transfiriéndole desde el exterior una cierta cantidad de calor  .
.
Sabemos que el trabajo 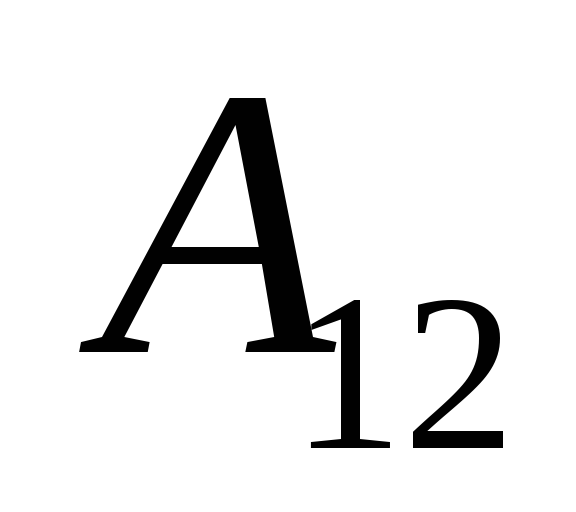 realizado por el propio sistema sobre cuerpos externos es numéricamente igual y de signo opuesto al trabajo
realizado por el propio sistema sobre cuerpos externos es numéricamente igual y de signo opuesto al trabajo  cuerpos externos por encima del sistema, es decir
cuerpos externos por encima del sistema, es decir
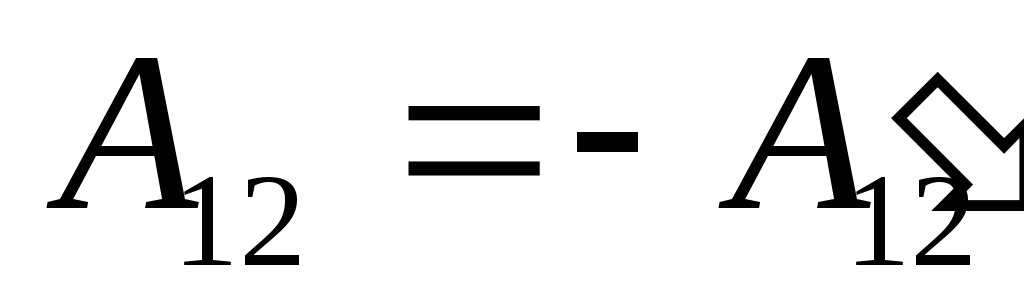 ,
(26.2)
,
(26.2)
por lo tanto, la expresión (26.1) se puede reescribir como
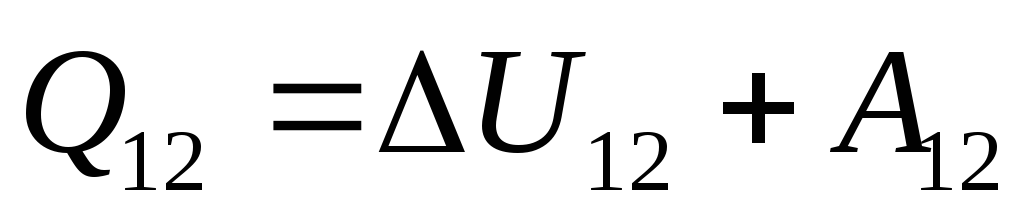 . (26.3)
. (26.3)
Esta ecuación es un registro matemático de la primera ley de la termodinámica: la cantidad de calor comunicada al sistema se gasta en cambiar su energía interna y en realizar trabajo en cuerpos externos por parte del sistema.
Con un cambio infinitesimal en el estado del sistema, la ecuación (26.3) toma la forma
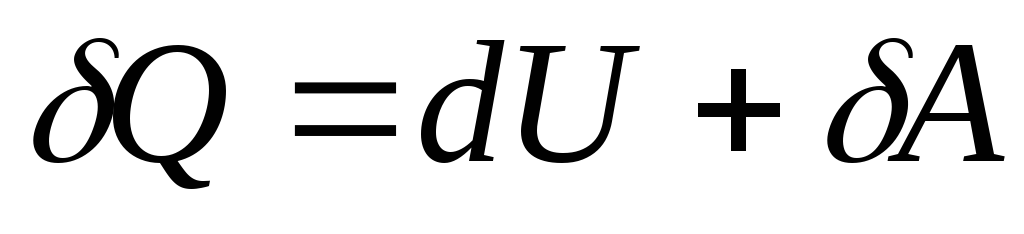 , (26.4)
, (26.4)
dónde 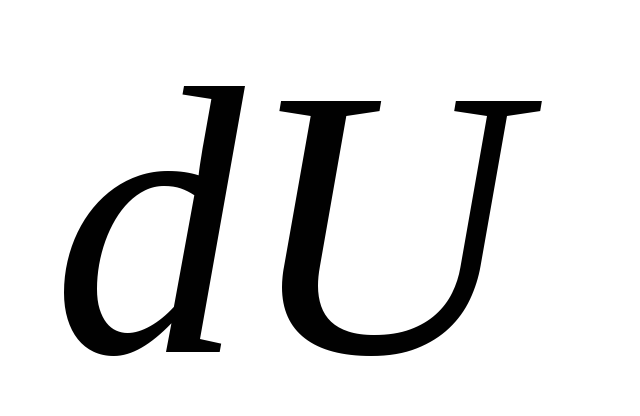 - un cambio infinitesimal en la energía interna del sistema cuando se le imparte una cantidad elemental de calor
q y realizar trabajo elemental por el sistema
PERO sobre cuerpos externos.
- un cambio infinitesimal en la energía interna del sistema cuando se le imparte una cantidad elemental de calor
q y realizar trabajo elemental por el sistema
PERO sobre cuerpos externos.
