วิธีการหาความจุความร้อนของวัตถุแข็ง
ความจุความร้อนคืออะไร
เมื่อให้ความร้อน อุณหภูมิของระบบจะเพิ่มขึ้น ในกรณีที่อุณหภูมิเปลี่ยนแปลงเล็กน้อยอย่างอนันต์ สัดส่วนจะถูกต้อง
dT=δQ หรือ dT=constδQ
การเขียนความสัมพันธ์ในรูปแบบนี้สะดวกกว่า: δQ=СdT หรือ
ค่า C เรียกว่าความจุความร้อนที่แท้จริงของระบบ
ความจุความร้อนคืออัตราส่วนของปริมาณความร้อนที่จ่ายให้กับระบบต่อการเปลี่ยนแปลงของอุณหภูมิที่เกิดขึ้น
นอกจากของจริงแล้ว ยังมีความจุความร้อนเฉลี่ย:
ความจุความร้อน
หากความจุความร้อนเกิดจากมวลหน่วย (โมล) ของสสาร มันก็จะเป็นอิสระจากมวลของระบบทั้งหมดและได้รับคุณสมบัติของพารามิเตอร์แบบเข้มข้น ถ้าความจุความร้อนหมายถึงมวลหน่วยของสารจะเรียกว่าจำเพาะและ 1 โมล - ความจุความร้อนที่มีขนาด J / (mol * k)
เราจะพิจารณาเฉพาะความจุความร้อนกรามเนื่องจาก สำหรับพวกเขา ความสม่ำเสมอทั้งหมดนั้นง่ายกว่าความจุความร้อนจำเพาะมาก
ความจุความร้อนขึ้นอยู่กับสภาวะที่มีการถ่ายเทความร้อนไปยังระบบ หากระบบปิดด้วยปริมาตรคงที่ อุณหภูมิจะเพิ่มขึ้นโดย dT ภายใต้การกระทำของความร้อนเท่ากับ CvdT โดยที่ Cv คือความจุความร้อนที่ปริมาตรคงที่ ในกรณีของแรงดันคงที่ระหว่างการขยายตัวของระบบ เพื่อเพิ่มอุณหภูมิโดย dT จะต้องให้ความร้อน CpdT โดยที่ Cp คือความจุความร้อนที่แรงดันคงที่
เมื่อพิจารณาจากเงื่อนไขการถ่ายเทความร้อน เมื่อตัวแปรตั้งแต่หนึ่งตัวขึ้นไปมีค่าคงที่ ในขณะที่ตัวแปรอื่นๆ เปลี่ยนแปลง ความจุความร้อนสามารถแสดงได้โดยใช้อนุพันธ์ย่อยบางส่วน: ![]() . เนื่องจาก δQ v = dU
. เนื่องจาก δQ v = dU
δQ p =dH เราสามารถเขียนได้ดังนี้
![]() (1)
(1)
Cv คือความจุความร้อนไอโซโคริกของก๊าซ Cp คือความจุความร้อนไอโซบาริกของก๊าซ
ความแตกต่างระหว่างความจุความร้อนแบบไอโซโคริกและไอโซบาริกเกิดจากความแตกต่างของพลังงานภายในและเอนทาลปี การเปลี่ยนแปลงของเอนทาลปีและพลังงานภายในแตกต่างกันไปตามปริมาณงานที่ระบบทำ
δW=∆nRT, ∆H-∆U=∆nRT
ดังนั้นความจุความร้อนที่ปริมาตรคงที่ Cv และความดันคงที่ Cp ก็แตกต่างกันไปตามปริมาณงาน: Cp - Cv = δW
จากนิพจน์ (1) เราสามารถเขียน:
แทนค่าความเท่าเทียมกันเหล่านี้ลงในสมการ ∆H- ∆U=∆nRT
และเมื่อพิจารณาว่า ∆n= 1 เราจะพบความสัมพันธ์ระหว่างความจุความร้อนกรามของก๊าซ:
Cp– Cv= R หรือ Cp= Cv+ R
อย่างที่เห็น ค่าของค่าคงที่ของแก๊สต่างกัน
จากเงื่อนไข Cp= Cv+ R จะเป็นไปตาม Cp˃Cv เช่น ในกระบวนการ isobaric เมื่อ P=const จะเพิ่มอุณหภูมิของระบบ ปริมาณมากความร้อนมากกว่าในกระบวนการไอโซโคริก
ความจุความร้อนโมลาร์ของก๊าซมีค่าตามลำดับของ R ดังนั้นความแตกต่างระหว่าง Cp และ Cv จึงมีความสำคัญมาก ดังนั้น สำหรับคาร์บอนไดออกไซด์ CO 2 ที่ 25 0 C Cp = 37, 14 และ Cv = 28.83 J / (mol * K)
ความแตกต่าง Cp - Cv คือการทำงานของการขยายตัวแบบไอโซบาริกของหนึ่งโมล ก๊าซในอุดมคติเมื่ออุณหภูมิสูงขึ้นหนึ่งองศา ของเหลวและของแข็งของร่างกายมีปริมาตรเพิ่มขึ้นเล็กน้อยเมื่อถูกความร้อน ดังนั้นสำหรับวัตถุที่ควบแน่น เราสามารถสันนิษฐานได้ว่า Ср ≈ Сv.
KIRCHHOFF สมการ การพึ่งพาผลกระทบทางความร้อนต่ออุณหภูมิ
การคำนวณผลกระทบทางความร้อนที่พิจารณาก่อนหน้านี้ตามกฎของเฮสส์สำหรับความร้อนของการก่อตัวและการเผาไหม้ถูกจำกัดโดยเงื่อนไขมาตรฐาน เพื่อวัตถุประสงค์ในทางปฏิบัติ จำเป็นต้องคำนวณผลกระทบทางความร้อนสำหรับสภาวะเฉพาะนอกเหนือจากสภาวะมาตรฐาน
หลีกเลี่ยงผลกระทบจากความร้อนที่เป็นที่รู้จักภายใต้สภาวะมาตรฐาน กล่าวคือ ที่อุณหภูมิ 25 0 C (298.15 K) และความดัน 1 atm (1.013 * 10 5 Pa) เป็นไปได้ที่จะคำนวณผลกระทบทางความร้อนที่อุณหภูมิใด ๆ ที่เราสนใจโดยใช้ กฎของเคอร์ชอฟฟ์. กระบวนการในสภาพอุตสาหกรรมมีลักษณะแปรผันของอุณหภูมิอย่างมีนัยสำคัญซึ่งช่วงนั้นไม่ได้กำหนดโดยเงื่อนไขของเทคโนโลยีเท่านั้น แต่ยังขึ้นอยู่กับฤดูกาล ช่วงนี้สามารถเข้าถึงได้หลายร้อยองศา - เป็นเรื่องปกติที่ผลกระทบจากความร้อนจะเป็น แตกต่างกันอย่างมีนัยสำคัญและขึ้นอยู่กับอุณหภูมิ
พิจารณากฎของ Kirchhoff ในรูปแบบดิฟเฟอเรนเชียล ในการทำเช่นนี้ เราเขียนการเปลี่ยนแปลงของเอนทาลปีในพลังงานไอโซบาริกและพลังงานภายในในกระบวนการไอโซโคริก
∆H \u003d H 2 -H 1; ∆U \u003d คุณ 2 -U 1
แยกความแตกต่างของสมการเหล่านี้เทียบกับอุณหภูมิและรับ:
สมการ Kirchhoff:

และ - ค่าสัมประสิทธิ์อุณหภูมิของผลกระทบทางความร้อนของกระบวนการ isobaric และ isochoric ตามลำดับ และ - การเปลี่ยนแปลงความจุความร้อนของระบบอันเป็นผลมาจากกระบวนการ isobaric และ isochoric ตามลำดับ
บนพื้นฐานของสมการ Kirchhoff กฎ Kirchhoff ถูกสร้างในรูปแบบดิฟเฟอเรนเชียล: ค่าสัมประสิทธิ์อุณหภูมิของผลกระทบทางความร้อนของกระบวนการเท่ากับการเปลี่ยนแปลงในความจุความร้อนของระบบที่เกิดขึ้นจากกระบวนการนี้
ดังนั้น กฎของเคอร์ชอฟฟ์ในรูปแบบดิฟเฟอเรนเชียลทำให้สามารถกำหนดได้เฉพาะการเปลี่ยนแปลงของผลกระทบทางความร้อนกับอุณหภูมิเท่านั้น และไม่ระบุขนาดของผลกระทบทางความร้อนด้วย
ให้เราวิเคราะห์สมการ Kirchhoff
สำหรับปฏิกิริยา: aA + bB = dD + rR ในกระบวนการไอโซบาริก (р=const) ตามกฎหมาย Kirchhoff การเปลี่ยนแปลงความจุความร้อนในระบบจะมีรูปแบบดังนี้
สามารถหานิพจน์ที่คล้ายกันได้สำหรับกระบวนการ isochoric:
เนื่องจากกฎของ Kirchhoff อนุญาตให้คุณกำหนดการเปลี่ยนแปลงของเอฟเฟกต์ความร้อนของกระบวนการด้วยการเปลี่ยนแปลงของอุณหภูมิ เราจึงสร้างกราฟ:
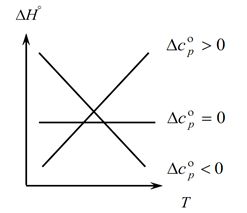
1. พิจารณากรณีแรกเมื่อ ∆Ср(∆Сv)˃0 เพราะ ∆Ср=∑С con. -∑Сเริ่มต้นดังนั้นจึงเป็นไปตามที่ผลรวมของความจุความร้อนของผลิตภัณฑ์ปฏิกิริยามากกว่าผลรวมของความจุความร้อนของสารตั้งต้น: ∑С con. ˃∑จากจุดเริ่มต้น ในกรณีนี้ เราได้รับเส้นโค้ง 1 บนกราฟ ซึ่งหมายความว่าเมื่ออุณหภูมิเพิ่มขึ้น การเปลี่ยนแปลงของผลกระทบทางความร้อนของกระบวนการก็จะเพิ่มขึ้นเช่นกัน (T และ ∆H)
2. กรณีที่สอง เมื่อ ∆Ср(∆Сv)˂0. ในทำนองเดียวกันกับกฎข้อแรก เรามี ∑С con ˂∑ตั้งแต่เช้า (ผลรวมของความจุความร้อนของผลิตภัณฑ์ขั้นสุดท้ายน้อยกว่าผลรวมของความจุความร้อนของสารตั้งต้น) จากนั้นเราจะได้เส้นโค้งบนกราฟ ซึ่งหมายความว่าเมื่ออุณหภูมิเพิ่มขึ้น การเปลี่ยนแปลงของผลกระทบทางความร้อนของกระบวนการจะลดลง (Т→∆H↓)
3. และกรณีที่สาม เมื่อการเปลี่ยนแปลงความจุความร้อนของระบบเท่ากับศูนย์ ∆Ср(∆Сv)=0 จากนั้นผลรวมของความจุความร้อนของผลิตภัณฑ์ขั้นสุดท้ายของปฏิกิริยาจะเท่ากับผลรวมของความจุความร้อนของวัสดุเริ่มต้น ∑С con \u003d ∑ จากจุดเริ่มต้น ในกรณีนี้ ผลกระทบทางความร้อนของปฏิกิริยาไม่ใช่ฟังก์ชันของอุณหภูมิ (∆H ≠ f(T)) และเราจะได้เส้นตรงบนกราฟ
การคำนวณผลทางความร้อนสำหรับสิ่งตอบแทน
อุณหภูมิ. การบูรณาการของสมการเคิร์ชโฮฟ
ในการหาค่าเอฟเฟกต์ความร้อนเป็นฟังก์ชันของอุณหภูมิ จำเป็นต้องรวมสมการเข้าด้วยกัน

จาก T ถึง T 0 (โดยที่ T คืออุณหภูมิที่ต้องการ T 0 คืออุณหภูมิมาตรฐาน) จาก ∆H ถึง ∆H 0 หรือจาก ∆U ถึง ∆U 0 (โดยที่ ∆H และ ∆U เป็นเอนทาลปีและพลังงานภายในภายใต้ เงื่อนไขที่แตกต่างจากมาตรฐาน) บูรณาการดำเนินการในสองกรณี:
เพื่อไม่ อินทรียฺวัตถุ: สำหรับสารอินทรีย์:
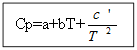
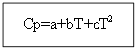
ตัวอย่าง: สำหรับ H 2 (g) - สารอนินทรีย์
| Ср=f(T) | ตู่ | |||
| เอ | ข*10 3 | c'*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27.28 + 3.26 * 10 -3 T +
ก) บูรณาการโดยประมาณ:
สำหรับกระบวนการไอโซบาริก
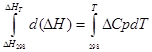
∆H T - ∆H 298 =∆Cp*(T-298)
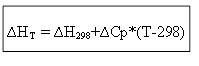
สำหรับกระบวนการ isochoric:
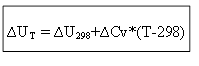
ดังนั้น เพื่อตรวจสอบผลกระทบทางความร้อน ∆H หรือพลังงานภายใน ∆U ที่อุณหภูมิ T ใดๆ จำเป็นต้องทราบความร้อนของกระบวนการภายใต้สภาวะมาตรฐาน ∆H 0 (∆U 0) และการเปลี่ยนแปลงของความจุความร้อน ∆Ср, ∆ ประวัติย่อ.
ตัวอย่าง. คำนวณผลความร้อน ∆H ของกระบวนการรับเบนซินจากอะเซทิลีน:
3C 2 H 2 (g) → C 6 H 6 (g) ที่ 75 0 C (348K)
1. เราพบจากตารางความจุความร้อนไอโซบาริกเฉลี่ยของน้ำมันเบนซินและอะเซทิลีน:
СрС6Н6 (g) \u003d 81.67 J / (mol * K);
Cp C2H2 (g) \u003d 43.93 J / (mol * K)
2. เราพบการเปลี่ยนแปลงความจุความร้อนของกระบวนการ:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) เริ่มต้น \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 J / (mol * K) .
3. จากข้อมูลแบบตาราง เราพบผลทางความร้อนภายใต้สภาวะมาตรฐาน:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82.93 - 3 * 226.73 \u003d - 597.26 kJ / mol
4. ค้นหาผลกระทบทางความร้อนที่อุณหภูมิที่กำหนด:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597.26 * 10 3 + (-50.12) * (348- 298) = -599766 J / mol
ข) บูรณาการที่แน่นอน:
ให้เราพิจารณากรณีที่สองที่ซับซ้อนกว่านั้น เมื่อการเปลี่ยนแปลงความจุความร้อนขึ้นอยู่กับอุณหภูมิ กล่าวคือ Ср=f(T), Cv=f(T).
ให้เราหันไปหาสมการปฏิกิริยาในรูปแบบทั่วไป
dd + rR = qQ + pP
| เอ | ข*10 3 | c'*10 -5 | C*10 6 | |
| ดี | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| พี | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
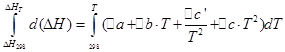
เราจะดำเนินการแบบเดียวกันสำหรับกระบวนการ isochoric:
ความร้อนของการละลาย
การเปลี่ยนแปลงของเอนทาลปีระหว่างการเปลี่ยนสถานะของแข็ง ของเหลว หรือก๊าซไปเป็นสารละลายเรียกว่า ความร้อนหรือเอนทาลปีของการละลาย.
ความร้อนของการละลายโดยทั่วไปรวมถึงความร้อนจากการทำลายโครงผลึก (for ของแข็ง) การแตกตัวเป็นไอออนและการละลาย
ในการทำลายพันธะระหว่างไอออนของเกลือผลึกนั้น จำเป็นต้องมีพลังงาน กล่าวคือ ในขณะที่ความร้อนถูกดูดซับ ในเวลาเดียวกัน ไอออนไฮเดรชั่นเกิดขึ้นในสารละลายที่เป็นน้ำ พันธะเกิดขึ้นระหว่างไอออนและโมเลกุลของ H 2 O สัญญาณของความร้อนของการละลายจะถูกกำหนดโดยกระบวนการที่เด่นชัดกว่าอย่างกระฉับกระเฉง
LiBr: ∆H dist = - 49.02 kJ / mol - ปล่อยความร้อน
KCl: ∆H dist = 7.23 kJ/mol - ความร้อนถูกดูดซับ
แยกแยะ: ความร้อนรวมของการละลายคือความร้อนที่ปล่อยออกมาหรือดูดซับเมื่อ 1 โมลของสารที่กำหนดถูกละลายเพื่อสร้างสารละลายที่มีความเข้มข้นที่กำหนด ความร้อนรวมของการละลายจะแตกต่างกันไปตามปริมาณของสารที่ละลาย
แยกแยะ: ความร้อนจากการละลาย - นี่คือความร้อนที่มาพร้อมกับการสลายตัวของสารที่กำหนด 1 โมลอย่างไม่สิ้นสุด ปริมาณมากสารละลายของสารนี้ ฮีตอินทิกรัลใช้กันอย่างแพร่หลายในการคำนวณความร้อนของการก่อตัวและความร้อนของปฏิกิริยาอื่นๆ ตามกฎของเฮสส์ ความร้อนที่แตกต่างกันของการละลายเป็นตัวกำหนดคุณสมบัติทางอุณหพลศาสตร์ของสารละลายและกระบวนการของการก่อตัว
LAB #8
การกำหนดความจุความร้อนของของแข็ง
เครื่องมือและอุปกรณ์เสริม:การตั้งค่าทดลอง FPT1-8
วัตถุประสงค์:การหาความจุความร้อนของตัวอย่างโลหะโดยวิธีแคลอรีเมตริกโดยใช้ความร้อนไฟฟ้า
ทฤษฎีสั้น
ความจุความร้อนจำเพาะของสาร - ค่าเท่ากับปริมาณความร้อนที่ต้องการให้ความร้อนแก่สาร 1 กิโลกรัมโดย 1 K:
ความจุความร้อนกราม - ค่าเท่ากับปริมาณความร้อนที่ต้องการให้ความร้อนแก่สาร 1 โมลต่อ 1 K:
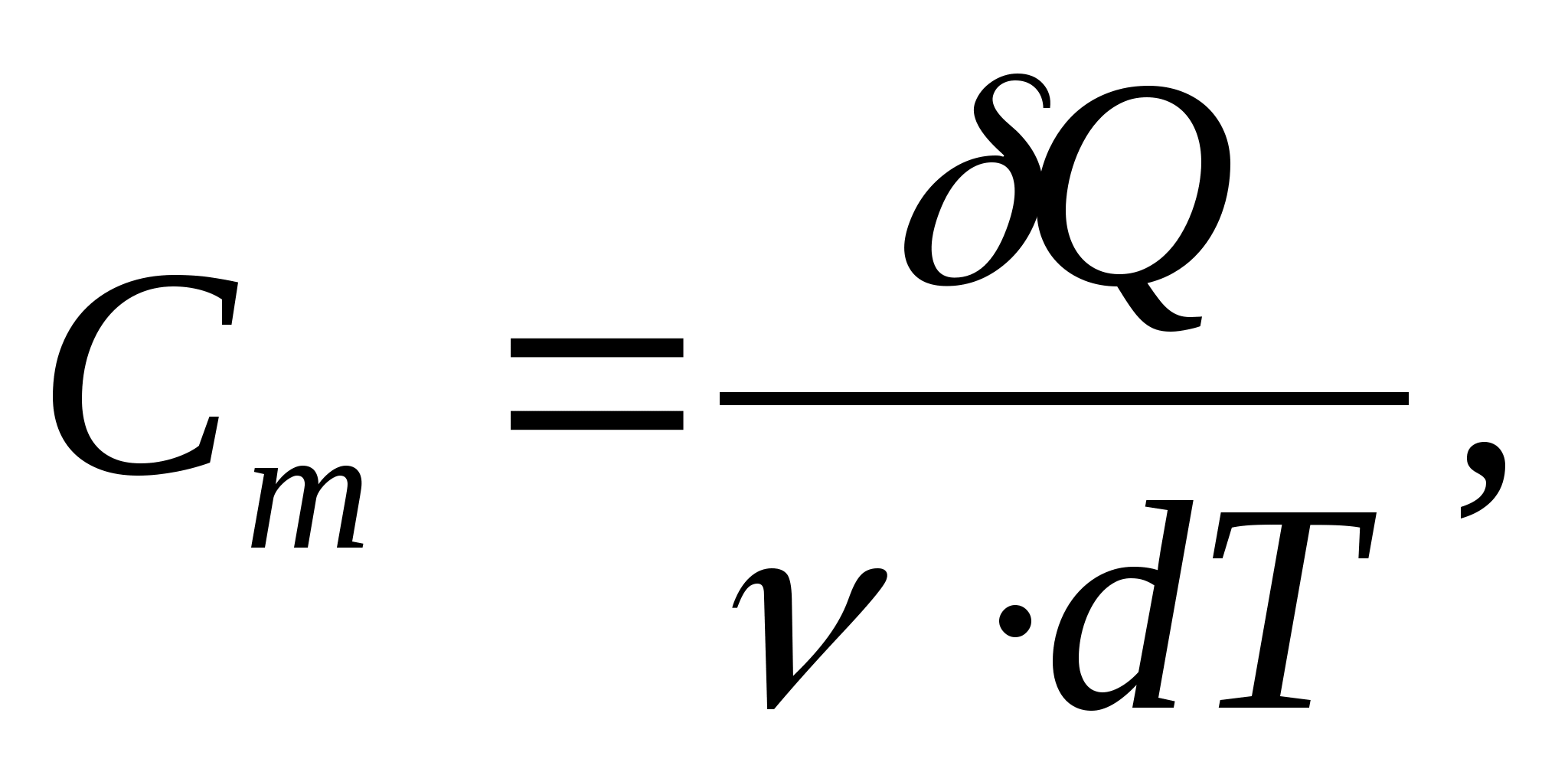
ที่ไหน 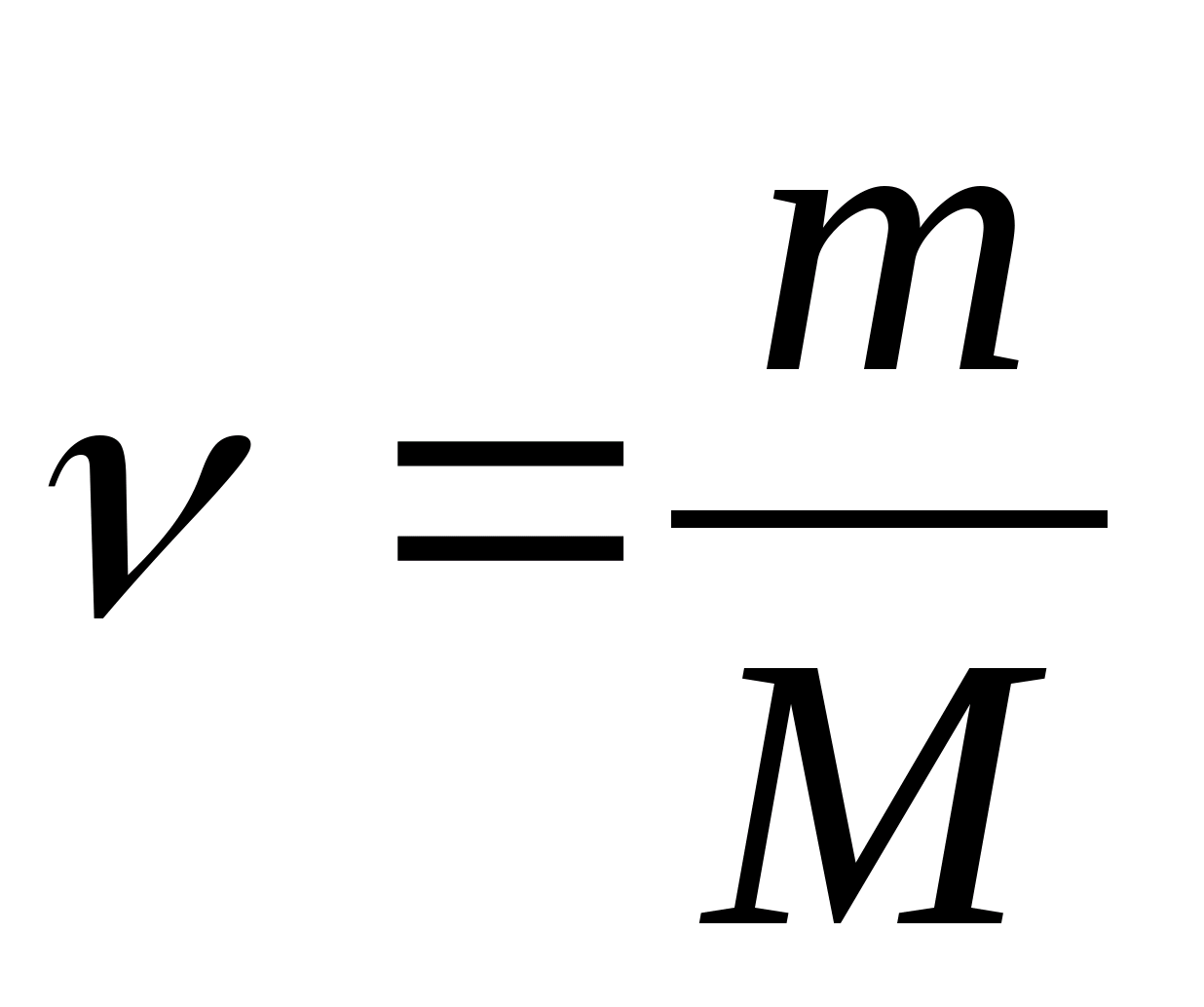 - ปริมาณของสาร
- ปริมาณของสาร
ความร้อนจำเพาะ คเกี่ยวข้องกับฟันกราม ค มอัตราส่วน

ที่ไหน เอ็มคือมวลโมลาร์ของสาร
แยกแยะ ความจุความร้อนที่ปริมาตรคงที่และ ความดันคงที่ถ้าอยู่ในกระบวนการให้ความร้อนแก่สาร ปริมาตรหรือความดันของสารจะคงค่าคงที่
ตัวแปรอิสระจำนวนน้อยที่สุด (พิกัด) ที่กำหนดตำแหน่งของระบบในอวกาศอย่างสมบูรณ์เรียกว่า จำนวนองศาอิสระ .
ตามกฎของ Boltzmann ว่าด้วยการกระจายพลังงานที่สม่ำเสมอเหนือระดับความอิสระของโมเลกุล องศาอิสระของการแปลและการหมุนของอิสระแต่ละระดับมีพลังงานจลน์เฉลี่ยเท่ากับ
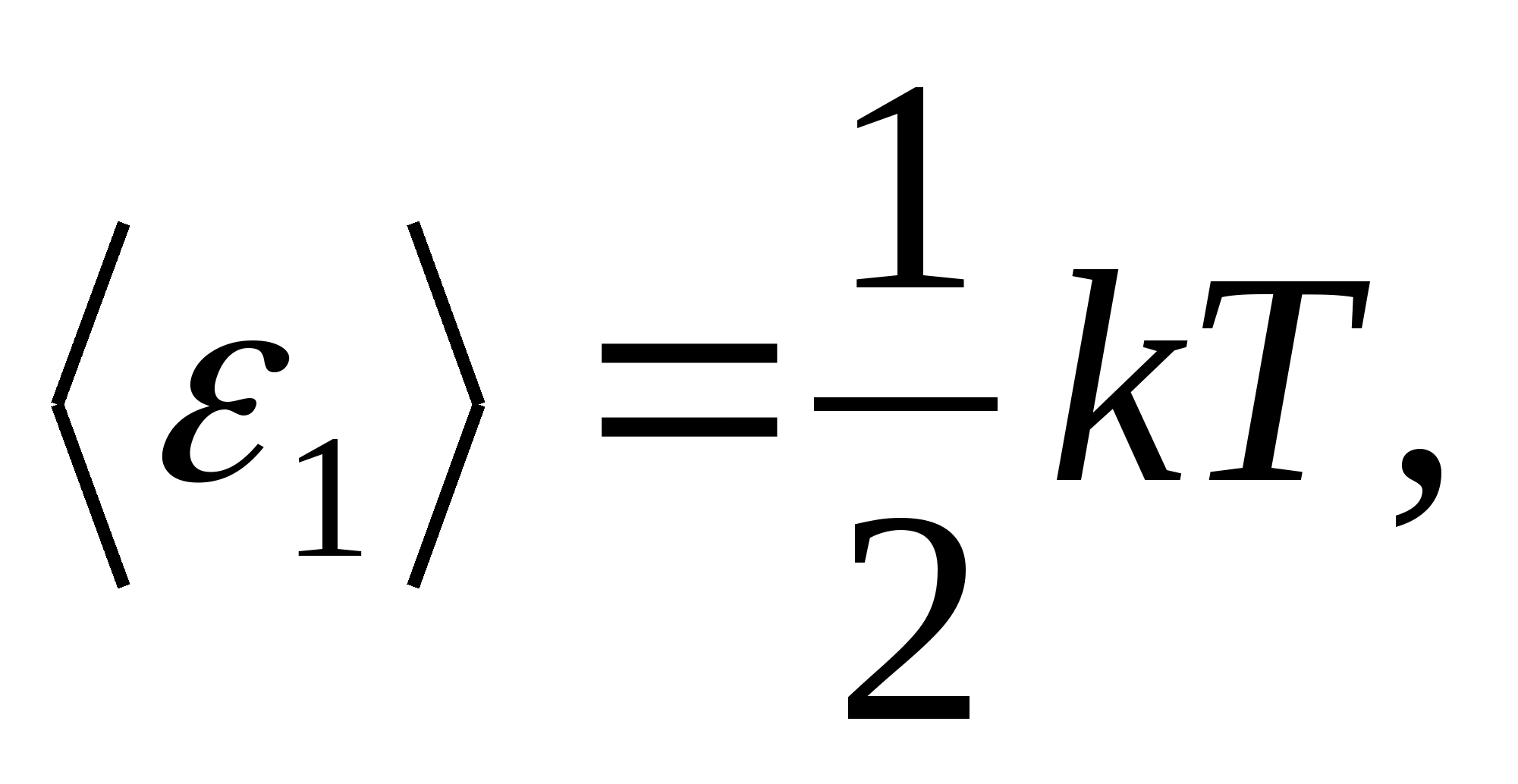
(ที่ไหน kคือค่าคงที่โบลต์ซมันน์) และสำหรับระดับอิสระของการสั่นแต่ละครั้ง โดยเฉลี่ย พลังงานจะเท่ากับ
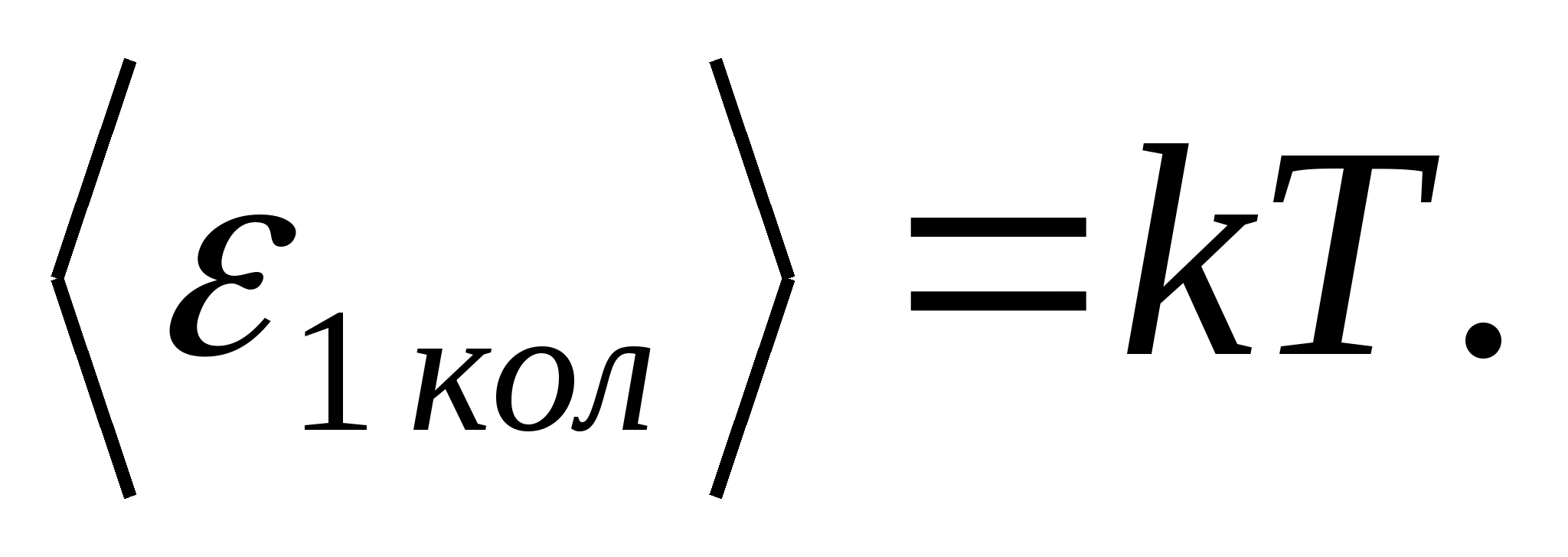
ดังนั้น พลังงานเฉลี่ยของโมเลกุล
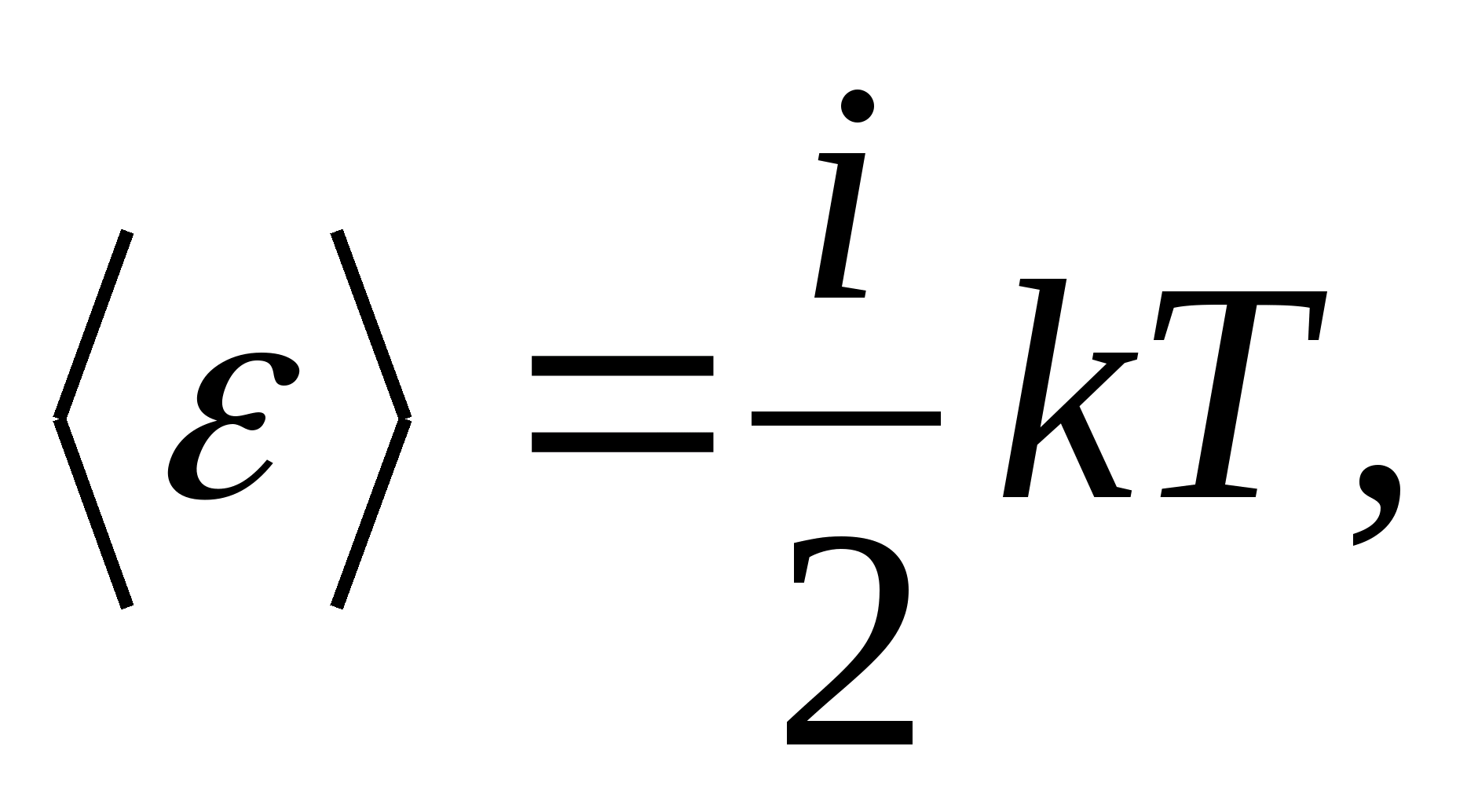
ที่ไหน ผมคือผลรวมของจำนวนการแปล จำนวนการหมุน และสองเท่าของจำนวนองศาการสั่นของอิสระของโมเลกุล:
![]()
ตัวอย่างเช่น พลังงานจลน์เฉลี่ยของโมเลกุลก๊าซอุดมคติเชิงเดี่ยว ( 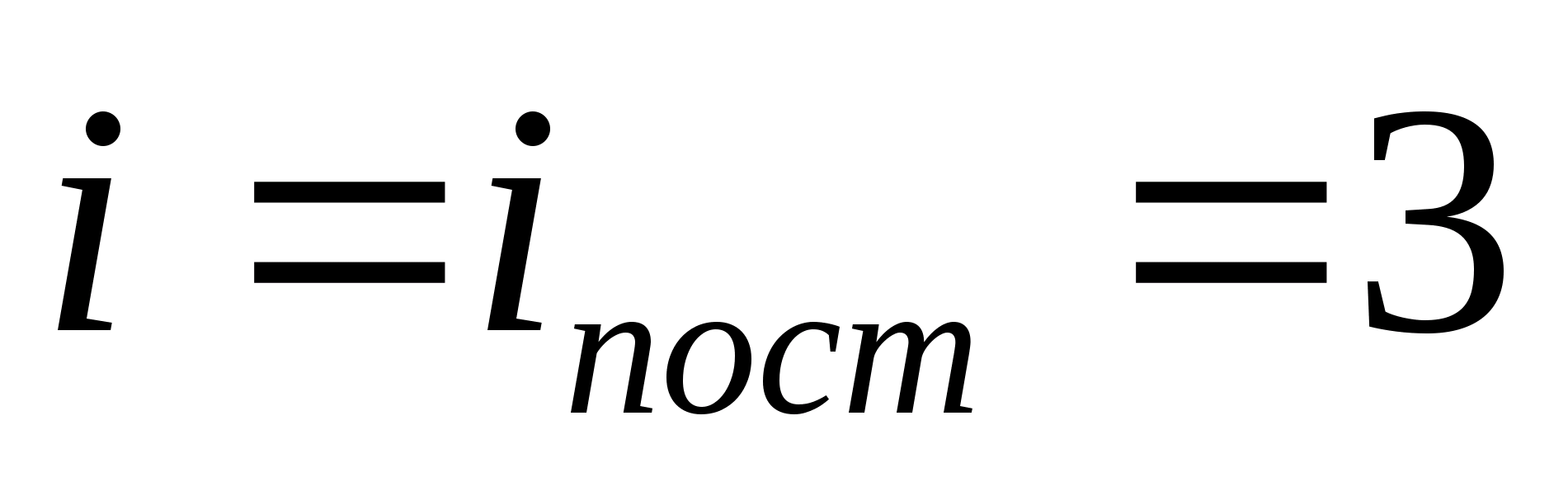 ) เท่ากับ
) เท่ากับ
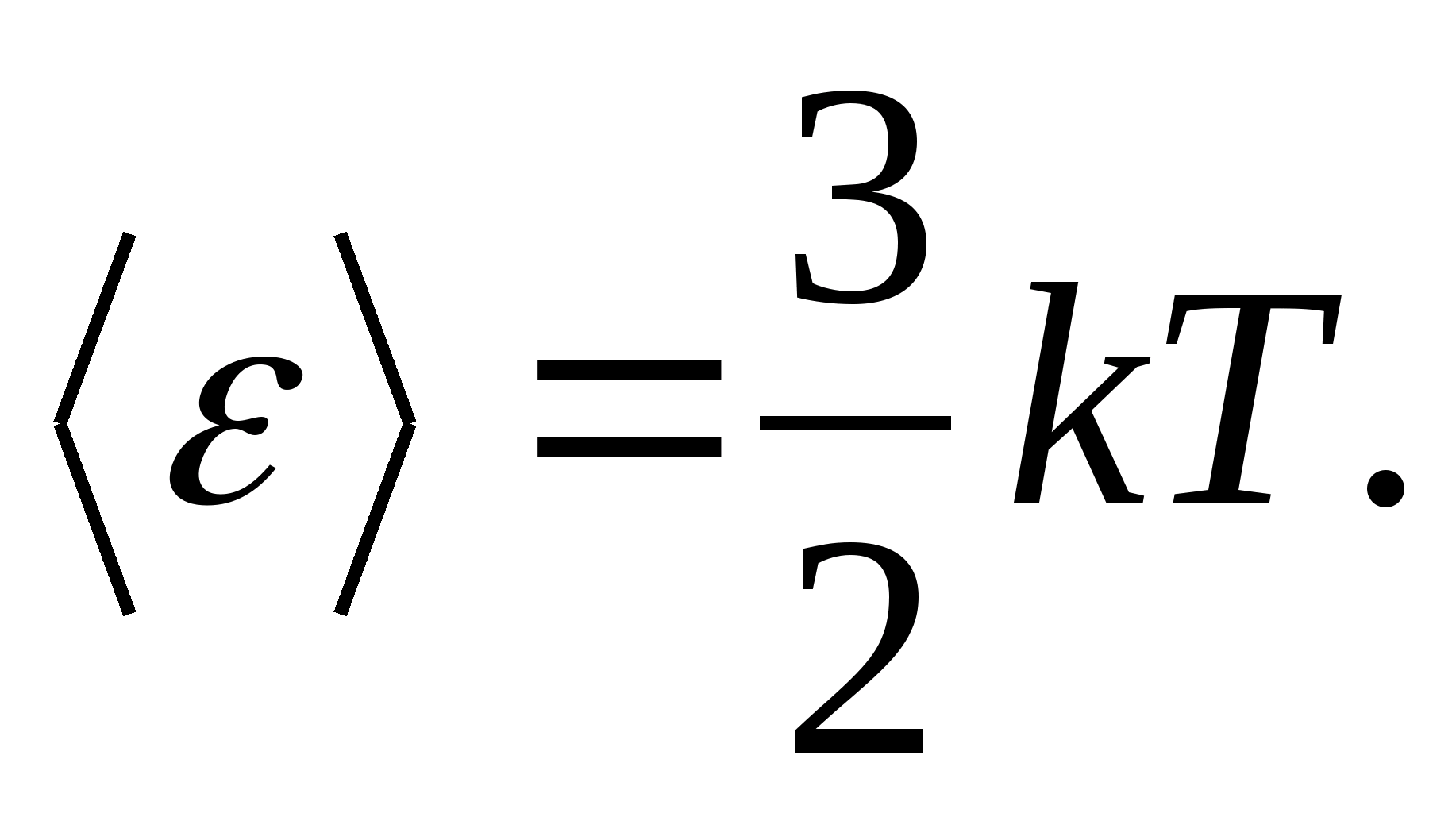
เนื่องจาก รุ่นของวัตถุที่เป็นของแข็ง ให้พิจารณาโครงผลึกที่สร้างขึ้นอย่างถูกต้อง ในโหนดที่อนุภาค (อะตอม ไอออน โมเลกุล) ถูกนำมาเป็น จุดวัสดุ, แกว่งไปรอบๆ ตำแหน่งสมดุล - โหนดขัดแตะ -ในสามทิศทางตั้งฉากกัน ดังนั้นอนุภาคแต่ละอนุภาคที่ประกอบเป็นโครงผลึกจึงถูกกำหนดระดับอิสระการสั่นสามระดับ ซึ่งตามกฎหมายว่าด้วยการกระจายพลังงานที่สม่ำเสมอเหนือองศาอิสระจะมีพลังงาน kT.
จากนั้นค่าเฉลี่ยของพลังงานทั้งหมดของอนุภาคระหว่างการเคลื่อนที่แบบสั่นในโครงผลึก
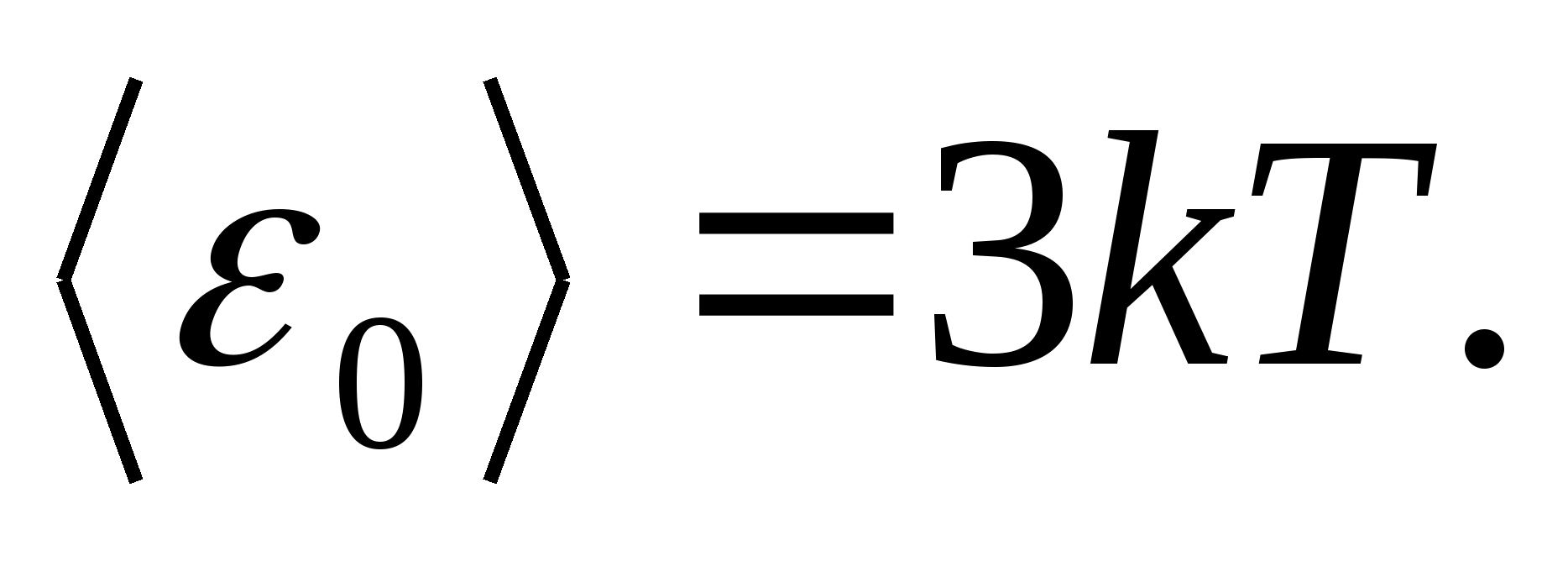
พลังงานภายในทั้งหมดของวัตถุแข็งหนึ่งโมลนั้นได้มาจากการคูณพลังงานเฉลี่ยของอนุภาคหนึ่งด้วยจำนวนอนุภาคที่สั่นสะเทือนอย่างอิสระที่มีอยู่ในหนึ่งโมล กล่าวคือ สู่ค่าคงที่อโวกาโดร นู๋ อา :
ที่ไหน R=N อา kคือค่าคงที่แก๊สสากล (โมลาร์) R= 8.31 J/(โมลK).
สำหรับของแข็ง เนื่องจากมีค่าสัมประสิทธิ์การขยายตัวทางความร้อนเพียงเล็กน้อย ความจุความร้อนที่ความดันคงที่และปริมาตรคงที่แทบไม่ต่างกัน ดังนั้น เมื่อพิจารณา (8.1) ความจุความร้อนกรามของของแข็ง
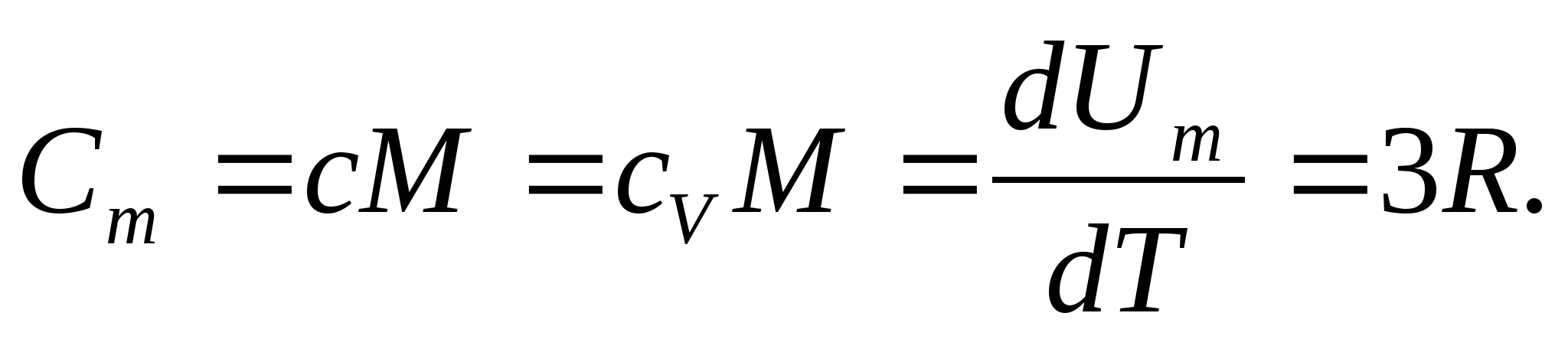 (8.2)
(8.2)
แทนค่าตัวเลขของค่าคงที่โมลาร์ เราได้รับ:
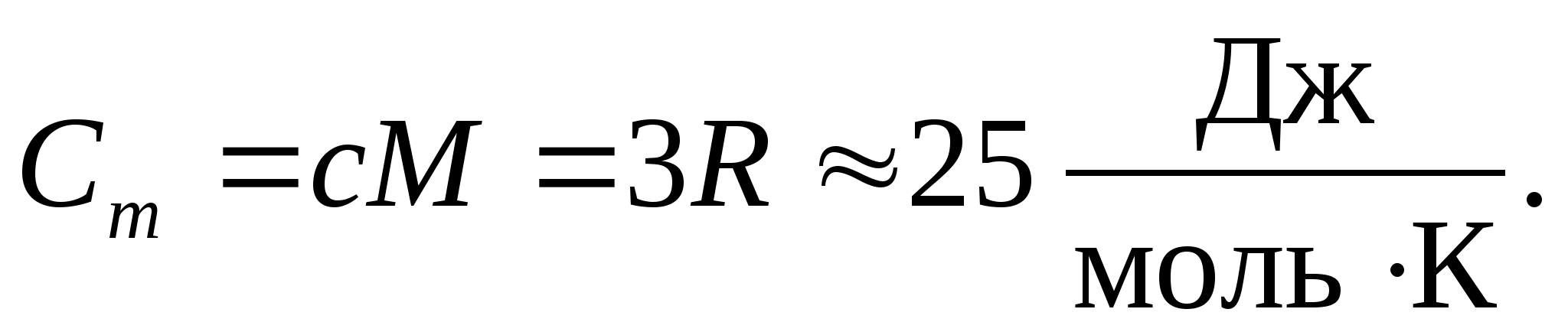
ความเท่าเทียมกันนี้ถือเป็นค่าประมาณที่ค่อนข้างดีสำหรับสารหลายชนิดที่อุณหภูมิห้องและเรียกว่า กฎหมาย Dulong และ Petit : ความจุความร้อนกรามของผลึกง่าย ๆ ทางเคมีทั้งหมด ของแข็งประมาณเท่ากับ 25 J/(โมล ถึง). เมื่ออุณหภูมิลดลง ความจุความร้อนของของแข็งทั้งหมดจะลดลงจนเข้าใกล้ศูนย์ที่ ตู่0. ใกล้ศูนย์สัมบูรณ์ ความจุความร้อนของโมลาร์ของวัตถุทั้งหมดเป็นสัดส่วนกับ T 3 และความเท่าเทียมกัน (8.2) ที่คุณสมบัติอุณหภูมิสูงเพียงพอของสารแต่ละชนิดเท่านั้นจึงจะเริ่มคงอยู่ คุณลักษณะเหล่านี้ของความจุความร้อนของของแข็งที่อุณหภูมิต่ำสามารถอธิบายได้โดยใช้ทฤษฎีควอนตัมของความจุความร้อนที่สร้างขึ้นโดย Einstein และ Debye
ในการทดลองกำหนดความจุความร้อน ร่างกายภายใต้การศึกษาจะถูกวางในเครื่องวัดความร้อนซึ่งถูกทำให้ร้อนด้วยกระแสไฟฟ้า หากอุณหภูมิของแคลอรีมิเตอร์กับตัวอย่างทดสอบเพิ่มขึ้นช้ามากจากจุดเริ่มต้น ตู่ 0 ถึง ตู่จากนั้นพลังงานของกระแสไฟฟ้าจะถูกนำมาใช้เพื่อให้ความร้อนแก่ตัวอย่างและเครื่องวัดความร้อน:
ที่ไหน ฉันและ ยู− กระแสฮีตเตอร์และแรงดันไฟ − เวลาทำความร้อน ม 0 และ มคือมวลของแคลอรีมิเตอร์และตัวอย่างทดสอบ กับ 0 และ กับ− ความจุความร้อนจำเพาะของแคลอรีมิเตอร์และตัวอย่างทดสอบ Q− การสูญเสียความร้อนต่อฉนวนความร้อนของแคลอรีมิเตอร์และพื้นที่โดยรอบ
เพื่อแยกจากสมการ (8.3) ปริมาณความร้อนที่ใช้ไปในการให้ความร้อนแก่แคลอริมิเตอร์และการสูญเสียความร้อนไปยังพื้นที่โดยรอบ จำเป็นต้องให้ความร้อนแคลอรีมิเตอร์เปล่า (ไม่มีตัวอย่าง) ออกจากอุณหภูมิเริ่มต้นด้วยกำลังฮีตเตอร์เดียวกัน ตู่ 0 สำหรับความแตกต่างของอุณหภูมิเท่ากัน ตู่. การสูญเสียความร้อนในทั้งสองกรณีจะใกล้เคียงกันและน้อยมาก หากอุณหภูมิของปลอกป้องกันของแคลอริมิเตอร์ในทั้งสองกรณีคงที่และเท่ากับอุณหภูมิห้อง:
สมการ (8.3) และ (8.4) หมายถึง
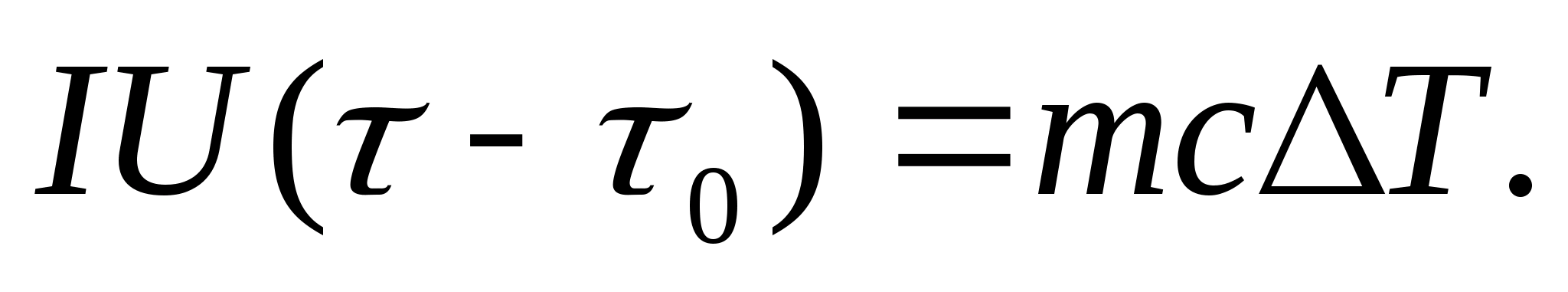 (8.5)
(8.5)
สมการ (8.5) สามารถใช้ในการทดลองหาความจุความร้อนจำเพาะของวัสดุของตัวอย่างทดสอบได้ โดยการเปลี่ยนอุณหภูมิของแคลอรีมิเตอร์ จำเป็นต้องพล็อตการพึ่งพาความแตกต่างของเวลาทำความร้อนจากการเปลี่ยนแปลงของอุณหภูมิของตัวอย่างทดสอบ: (
−
0)=ฉ(ตู่) ตามค่าสัมประสิทธิ์เชิงมุมซึ่ง 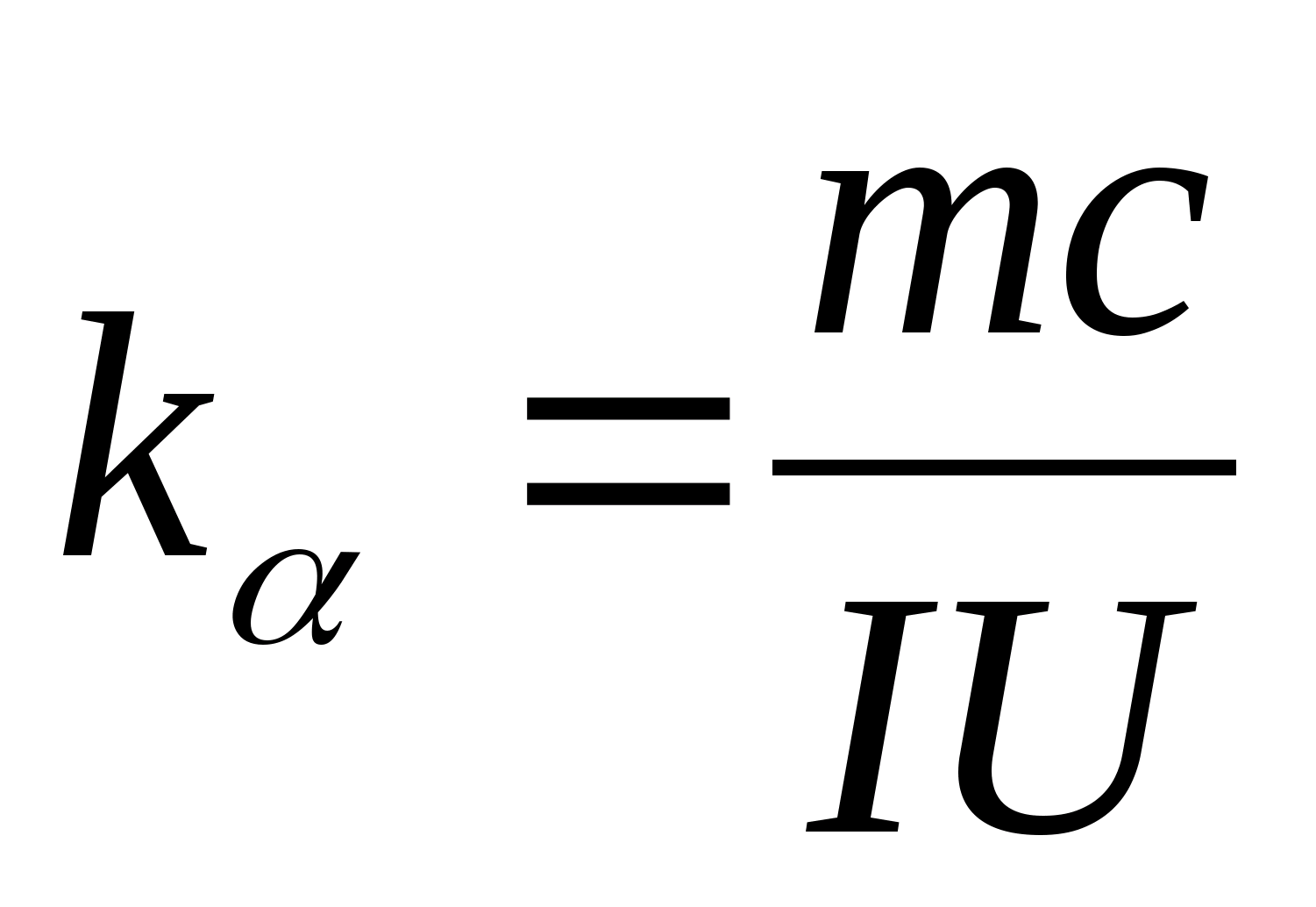 สามารถกำหนดความจุความร้อนจำเพาะของตัวอย่างได้
สามารถกำหนดความจุความร้อนจำเพาะของตัวอย่างได้
คำอธิบายของการตั้งค่าห้องปฏิบัติการ
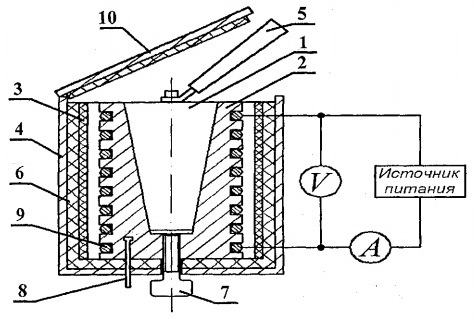
ในการกำหนดความจุความร้อนของของแข็ง การออกแบบการตั้งค่าทดลอง FPT1-8 ได้รับการออกแบบ มุมมองทั่วไปซึ่งแสดงในรูปที่ 8.1. การติดตั้งประกอบด้วยสามส่วนหลัก: หน่วยเครื่องมือ 1, หน่วยองค์ประกอบการทำงาน 2 และชั้นวาง 3
ที่แผงด้านหน้าของชุดควบคุม 1 มีสวิตช์สลับ "เครือข่าย" ซึ่งเชื่อมต่อเครื่องกับเครือข่ายแรงดันไฟฟ้า สวิตช์สลับ "HEATING" ซึ่งเปิดเครื่องทำความร้อน ตัวควบคุม "HEATING" ซึ่งควบคุมกำลังของฮีตเตอร์ โวลต์มิเตอร์และแอมมิเตอร์ซึ่งวัดแรงดันและกระแสในวงจรฮีตเตอร์ นาฬิกาจับเวลาซึ่งวัดเวลาความร้อนของเครื่องวัดความร้อน นาฬิกาจับเวลาจะเปิดใช้งานเมื่อเปิดเครื่อง
บล็อกขององค์ประกอบการทำงาน 2 ถูกปิดด้านหน้าด้วยหน้าจอที่ถอดออกได้จากองค์กร กระจก. เมื่อปฏิบัติงาน หน้าจอจะถูกแขวนไว้ที่ผนังด้านหลังของบล็อกของชิ้นงาน บนแผงหน้าปัดขององค์ประกอบการทำงานคือเทอร์โมมิเตอร์แบบดิจิตอล 6 สำหรับวัดอุณหภูมิ ที่ด้านล่างในรังมีตัวอย่างทดสอบ 5 ตัวอย่างที่ทำจากวัสดุต่างๆ และที่จับสำหรับวางตัวอย่างในเครื่องทำความร้อน
เครื่องทำความร้อน 4 ประกอบด้วยปลอกโลหะ วัสดุฉนวนความร้อน และเครื่องวัดความร้อน

ตัวอย่างจะถูกให้ความร้อนในเครื่องวัดความร้อน ซึ่งแสดงไว้ในรูปที่ 8.2.
แคลอรีมิเตอร์เป็นตัวเรือนทองเหลือง 2 ที่มีรูรูปกรวย โดยใส่ตัวอย่างทดสอบ 1 ไว้ บนพื้นผิวด้านนอกของเคส คอยล์ร้อน 9 วางอยู่ในร่องพิเศษ ด้านนอกเคสแคลอริมิเตอร์มีฉนวนป้องกันความร้อนด้วยชั้นของแร่ใยหิน 3 และใยแก้ว 6 และปิดด้วยปลอกอลูมิเนียม 4. แคลอรีมิเตอร์ปิดด้วยฝาปิดที่เป็นฉนวนความร้อน 10. หลังจากสิ้นสุดการทดลอง สามารถผลักตัวอย่างออกจากรูรูปกรวยของตัวแคลอรีมิเตอร์ได้โดยใช้ สกรู 7 ในการถอดตัวอย่างที่ร้อนออกจากเครื่องวัดความร้อนและติดตั้งตัวอย่างลงในเครื่องทำความร้อน ให้ใช้ที่จับ 5 ซึ่งอยู่ในช่องเสียบพิเศษถัดจากตัวอย่างที่ศึกษา
อุณหภูมิของแคลอรีมิเตอร์วัดโดยเทอร์โมมิเตอร์แบบดิจิตอลซึ่งมีเซ็นเซอร์อุณหภูมิ 8 ตัวอยู่ในตัวเรือน 2 ของแคลอรีมิเตอร์
ความปลอดภัย
เมื่อปฏิบัติงานจะต้องปฏิบัติตามข้อกำหนดด้านความปลอดภัยทั่วไปในห้องปฏิบัติการกลศาสตร์
สั่งงาน
ความสนใจ!แคลอรีมิเตอร์ใช้เวลานานกว่าจะเย็นตัวลง ดังนั้นหลังจากวัดค่าตลอดเวลา 0 ความร้อนจากแคลอรีมิเตอร์ที่ว่างเปล่า ให้ปิดการทำความร้อนทันที (ดูจุดที่ 4 ด้านล่าง) อุณหภูมิความร้อนสูงสุดสำหรับหน่วยนี้คือ +44С
1. ถอดฝาครอบโปร่งใสของยูนิตองค์ประกอบการทำงานของการติดตั้งออก แล้วแขวนไว้บนสกรูที่แผงด้านหลัง ตั้งปุ่มควบคุม HEAT เป็นค่าต่ำสุด เปิดการติดตั้งด้วยสวิตช์สลับ "เครือข่าย"
2. ปิดฝาให้สนิทบนเครื่องวัดความร้อนที่ว่างเปล่า เปิดสวิตช์สลับ "HEAT" ใช้ตัวควบคุม HEAT ตั้งแรงดันไฟฟ้าไว้ที่ 10-20 V (ยิ่งแรงดันไฟฟ้าสูงเท่าใดความร้อนก็จะยิ่งเร็วขึ้น) เขียนในตาราง 8.1 ค่าแรงดันไฟฟ้าที่เลือก ยูและปัจจุบัน ฉัน.
3. เริ่มจากอุณหภูมิของแคลอรีมิเตอร์ t 0 ระบุโดยครูหลังจากช่วงเวลา 1С เข้าสู่ตาราง ค่าเวลา 8.1 0 ที่สอดคล้องกับแต่ละอุณหภูมิถึง t.
4. ปิดสวิตช์สลับ "HEAT" เปิดฝาและทำให้แคลอรีมิเตอร์เย็นลงจนถึงอุณหภูมิเริ่มต้น t 0 . ในการทำให้แคลอรีมิเตอร์เย็นลงอย่างรวดเร็ว คุณสามารถลดตัวอย่างหนึ่งตัวอย่างลงในแคลอรีมิเตอร์ ยกเว้นตัวอย่างที่อาจารย์ระบุ (เมื่อติดตั้งตัวอย่างลงในแคลอรีมิเตอร์ ให้หมุนสกรูที่ด้านล่างของแคลอรีมิเตอร์ไปทางซ้าย) อุณหภูมิจะเริ่มลดลง เมื่ออัตราการทำความเย็นลดลง ให้นำตัวอย่างที่ร้อนออกแล้วใส่ตัวอย่างถัดไป (เย็น) ยกเว้นตัวอย่างที่อาจารย์ระบุไว้ ในการนำตัวอย่างออก ให้หมุนสกรูที่ด้านล่างของเครื่องวัดปริมาณความร้อนไปทางขวา (ตามเข็มนาฬิกา) แล้วดึงตัวอย่างออกด้วยที่จับ
ตาราง8.1
|
ตู่= t− t 0 , |
= − 0 , |
เจ/(กก.K) |
ค ม =กับเอ็ม, เจ/(molK) |
||||||||
5. หมุนสกรูไปทางซ้าย ใส่ตัวอย่างทดสอบตัวใดตัวหนึ่งตามคำแนะนำของครู ลงในเครื่องวัดปริมาณความร้อน ปิดฝาแคลอรีมิเตอร์ให้แน่น แล้วรอ 2-3 นาทีเพื่อให้แคลอรีมิเตอร์และอุณหภูมิของตัวอย่างเท่ากัน
6. เปิดสวิตช์สลับ "HEAT" และตั้งค่าแรงดันไฟฟ้าเดียวกันในวงจรเหมือนกับเมื่อให้ความร้อนกับเครื่องวัดความร้อนที่ว่างเปล่า
7. เริ่มจากอุณหภูมิแคลอรีมิเตอร์เริ่มต้นเท่าเดิม t 0 หลังจากช่วงเวลา 1С เข้าสู่ตาราง ค่าเวลา 8.1 สอดคล้องกับแต่ละอุณหภูมิถึง t.
8. ตั้งตัวควบคุม "HEATING" ไปที่ตำแหน่งซ้ายสุด (ต่ำสุด) ปิดสวิตช์สลับ "HEATING" เปิดฝาของเครื่องวัดความร้อน ในการนำตัวอย่างออกจากแคลอรีมิเตอร์ ให้หมุนสกรูไปทางขวา จากนั้นเอาตัวอย่างที่อุ่นโดยใช้ที่จับ
9. ปิดเครื่องด้วยสวิตช์สลับ "เครือข่าย"
10. แปลค่าทั้งหมดของปริมาณ 0 และ เป็นค่าเป็นวินาที (ไม่มีนาที) แล้วป้อนลงในตาราง 8.1. สำหรับแต่ละบรรทัดของตาราง 8.1 คำนวณค่าของ = − 0 และ ตู่= t− t 0 .
11. คำนวณความจุความร้อนจำเพาะของตัวอย่างโดยประมาณโดยใช้สูตร 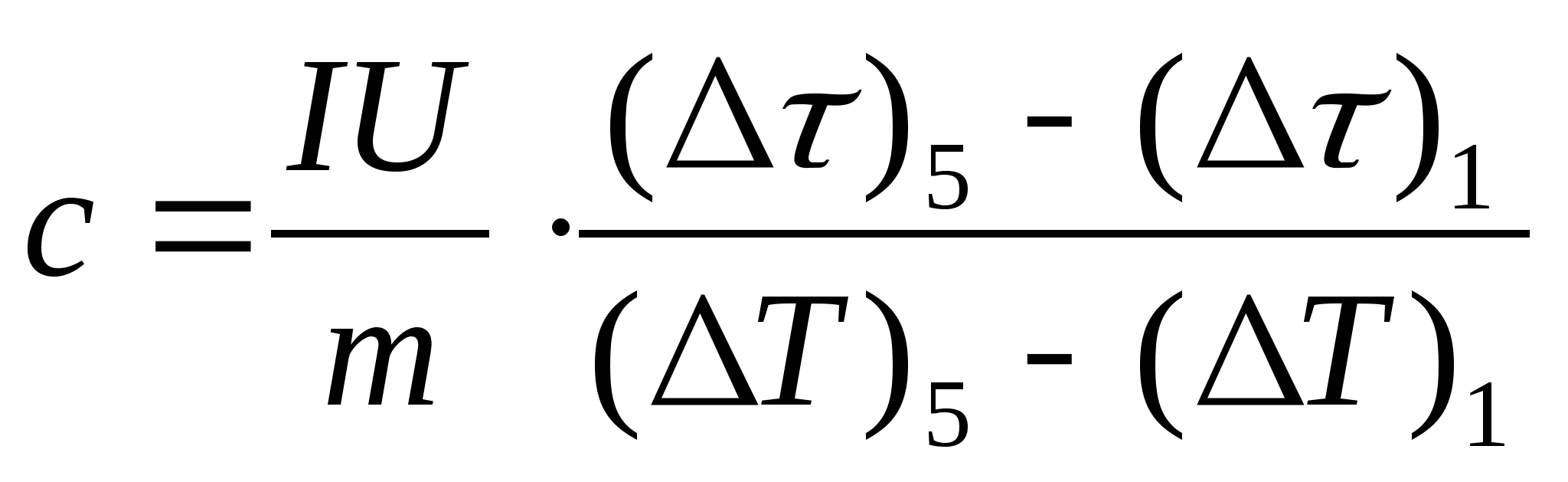 ที่มวลของตัวอย่าง ม=139.5 กรัม (ทองเหลือง) หรือ ม=129.7 กรัม (เหล็ก) หรือ
ม=46.05 ก. (ดูราลูมิน) มาหาอาจารย์เพื่อตรวจสอบ
ที่มวลของตัวอย่าง ม=139.5 กรัม (ทองเหลือง) หรือ ม=129.7 กรัม (เหล็ก) หรือ
ม=46.05 ก. (ดูราลูมิน) มาหาอาจารย์เพื่อตรวจสอบ
กำลังประมวลผลผลการวัด
1. พล็อต
=f(ตู่) การพึ่งพาความแตกต่างของเวลาความร้อนของเครื่องวัดความร้อนกับตัวอย่างและเครื่องวัดความร้อนที่ว่างเปล่าในการเปลี่ยนแปลงอุณหภูมิของเครื่องวัดความร้อน เลือกจุดสองจุดบนกราฟและกำหนดความชันของเส้นตรงโดยใช้สูตร 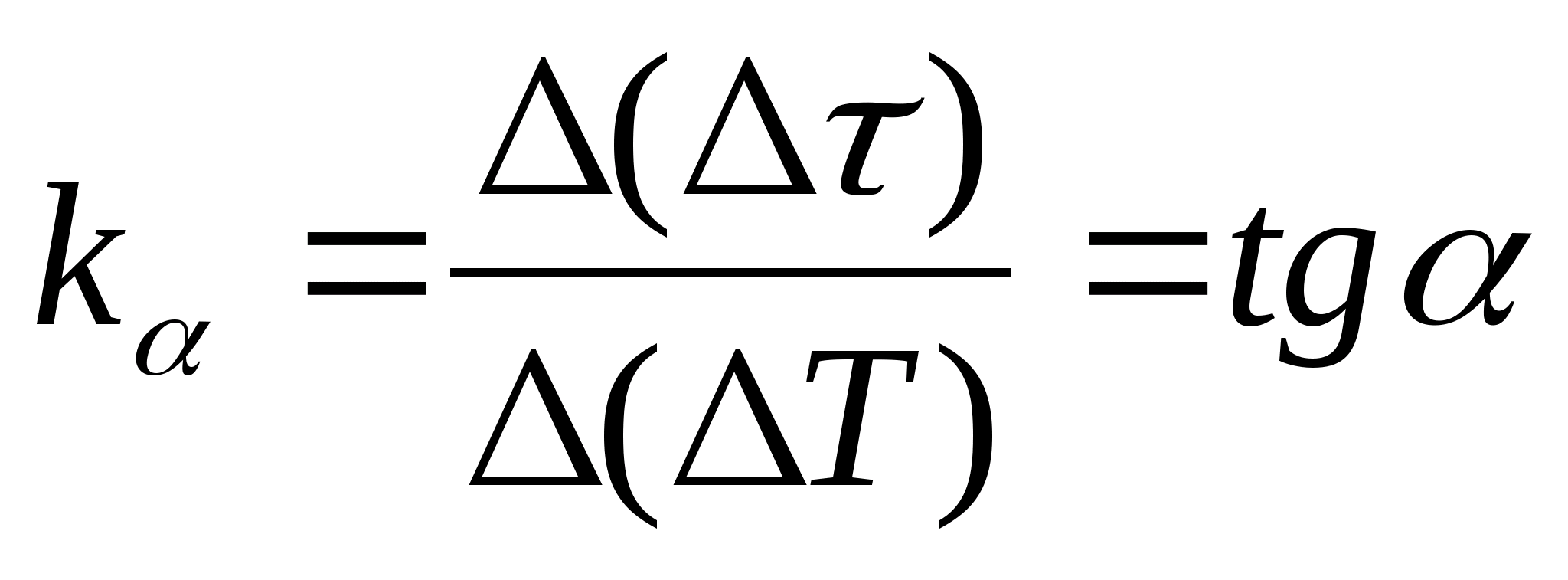 , ที่ไหน
− มุมเอียงของกราฟกับแกน ตู่
(ถ้าหน่วยของ
และ ตู่แสดงบนแกนทั้งสองเป็นส่วนที่มีความยาวเท่ากัน)
, ที่ไหน
− มุมเอียงของกราฟกับแกน ตู่
(ถ้าหน่วยของ
และ ตู่แสดงบนแกนทั้งสองเป็นส่วนที่มีความยาวเท่ากัน)
2. การใช้ค่าความชัน k
กำหนดความจุความร้อนจำเพาะของตัวอย่างโดยใช้สูตร 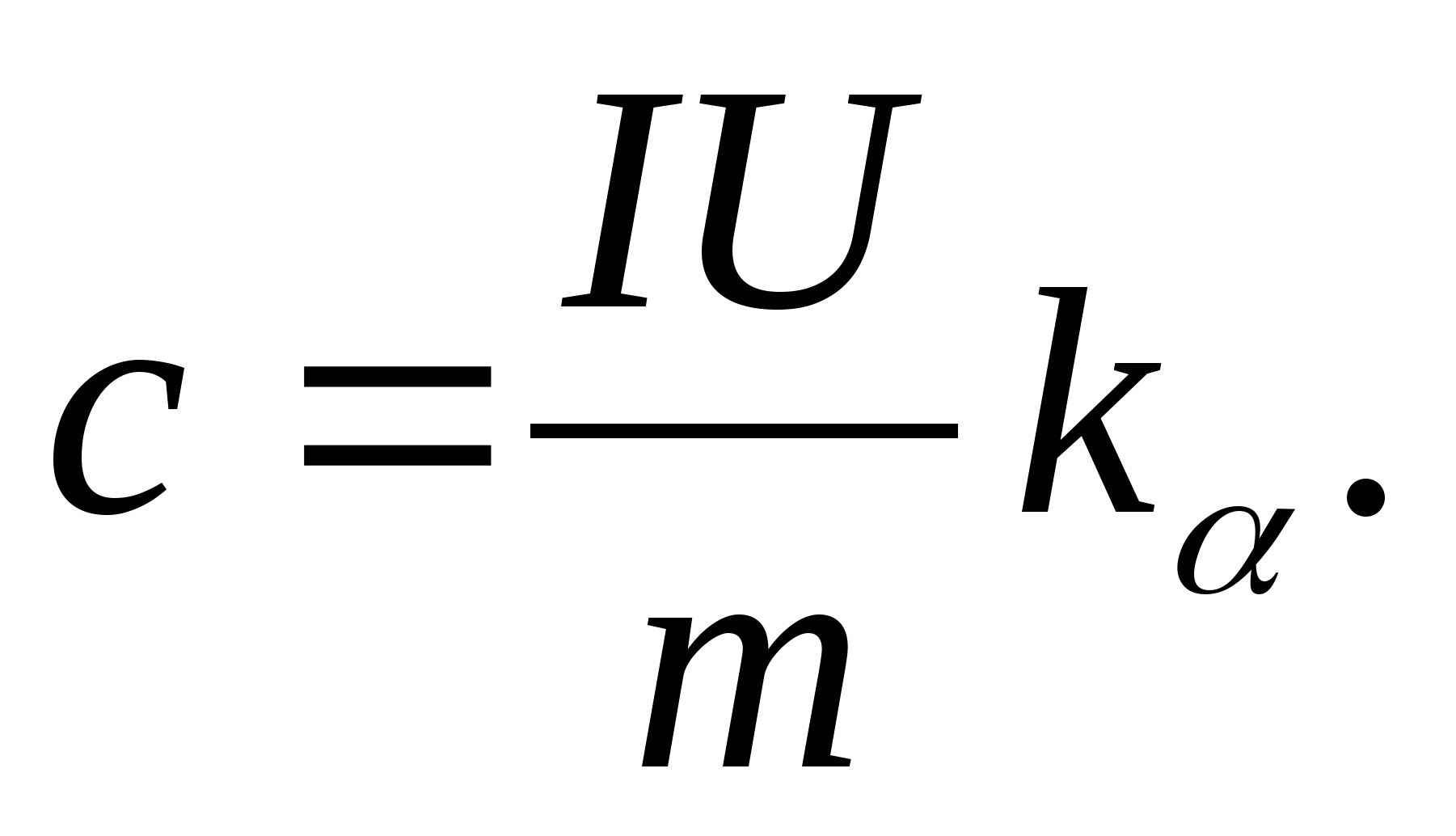
3. ใช้ข้อมูลในตารางที่ 8.2 (หรือตารางธาตุ) กำหนดความจุความร้อนโมลาร์ของตัวอย่างโดยใช้สูตร ค ม =กับเอ็ม.
ตาราง 8.2
|
วัสดุตัวอย่าง |
มวลอะตอม kg/mol |
|
ในฐานะที่เป็นแบบจำลองของวัตถุแข็ง ให้เราพิจารณาโครงผลึกที่สร้างขึ้นอย่างถูกต้อง ในโหนดที่อนุภาค (อะตอม ไอออน โมเลกุล) ถูกนำมาเป็นจุดวัสดุ แกว่งไปรอบๆ ตำแหน่งสมดุล - โหนดขัดแตะ - ในสามทิศทางตั้งฉากกัน . ดังนั้น อนุภาคแต่ละตัวที่ประกอบเป็นโครงผลึกจึงถูกกำหนดระดับความอิสระของการสั่นสามระดับ ซึ่งแต่ละอนุภาคนั้น ตามกฎว่าด้วยการให้พลังงานเท่ากันเหนือระดับความเป็นอิสระ (ดู § 50) มีพลังงาน kT.
พลังงานภายในของโมลของร่างกายที่เป็นของแข็ง
U m \u003d 3N A kT \u003d 3RT
โดยที่ N A คือค่าคงที่ของ Avogadro นู๋อา k= R (R คือค่าคงที่ของก๊าซโมลาร์)
ความจุความร้อนกรามของของแข็ง
คือความจุความร้อนกราม (อะตอม) ร่างกายที่เรียบง่ายทางเคมีในสถานะผลึกจะเหมือนกัน (เท่ากับ 3 R) และไม่ขึ้นกับอุณหภูมิ กฎข้อนี้ได้รับจากการทดลองโดยนักวิทยาศาสตร์ชาวฝรั่งเศส P. Dulong (1785-1838) และ L. Petit (1791-1820) และเป็น ชื่อกฎหมาย Dulong และ Petit
หากของแข็งเป็นสารประกอบทางเคมี (เช่น NaCl) จำนวนอนุภาคในโมลจะไม่เท่ากับค่าคงที่อโวกาโดร แต่จะเท่ากับ nNอา , ที่ไหน น - จำนวนอะตอมในโมเลกุล (สำหรับ NaCl จำนวนอนุภาคในโมลเท่ากับ 2 นู๋และด้วยเหตุนี้ NaCl หนึ่งโมลจึงมีอะตอม N A Na และอะตอม N A Cl) ดังนั้นความจุความร้อนของฟันกราม สารประกอบเคมีที่เป็นของแข็ง
C V \u003d 3R25n J / (mol K),
กล่าวคือ เท่ากับผลรวมของความจุความร้อนปรมาณูของธาตุที่ประกอบเป็นสารประกอบนี้
จากข้อมูลการทดลองแสดง (ตารางที่ 4) สำหรับสารหลายชนิด กฎ Dulong และ Petit พอใจกับการประมาณที่ค่อนข้างดี แม้ว่าสารบางชนิด (C, Be, B) จะมีความเบี่ยงเบนอย่างมีนัยสำคัญจากความจุความร้อนที่คำนวณได้ นอกจากนี้ เช่นเดียวกับในกรณีของก๊าซ (ดู § 53) การทดลองเกี่ยวกับการวัดความจุความร้อนของของแข็งที่อุณหภูมิต่ำได้แสดงให้เห็นว่าขึ้นอยู่กับอุณหภูมิ (รูปที่ 113) ใกล้ศูนย์เคลวิน ความจุความร้อนของวัตถุเป็นสัดส่วนกับ T 3 และเฉพาะที่อุณหภูมิที่สูงเพียงพอเท่านั้น ลักษณะเฉพาะของสารแต่ละชนิด สภาวะ (73.1) เป็นที่พอใจ ตัวอย่างเช่น เพชรมีความจุความร้อน 3 R ที่ 1800 K! อย่างไรก็ตาม สำหรับของแข็งส่วนใหญ่ อุณหภูมิห้องสูงพออยู่แล้ว
ความคลาดเคลื่อนระหว่างค่าการทดลองและค่าทางทฤษฎีของความจุความร้อนที่คำนวณได้
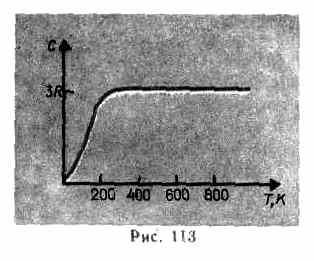
พื้นฐานของทฤษฎีคลาสสิกอธิบายโดยอิงตามทฤษฎีควอนตัมของความจุความร้อน A. Einstein และ P. Debye (1884-1966)
§ 74. การระเหย การระเหิด การหลอมเหลวและการตกผลึก ร่างกายอสัณฐาน
ทั้งในของเหลวและของแข็ง มีโมเลกุลจำนวนหนึ่งเสมอที่มีพลังงานเพียงพอที่จะเอาชนะแรงดึงดูดของโมเลกุลอื่น ๆ และสามารถแยกตัวออกจากพื้นผิวของของเหลวหรือของแข็งและผ่านเข้าไปในพื้นที่รอบ ๆ พวกมันได้ กระบวนการสำหรับของเหลวนี้เรียกว่า การระเหย(หรือ การกลายเป็นไอ),สำหรับของแข็ง - การระเหิด(หรือ ระเหิด)
การระเหยของของเหลวเกิดขึ้นที่อุณหภูมิใดก็ได้ แต่ความเข้มข้นจะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น ควบคู่ไปกับกระบวนการระเหยกลายเป็นกระบวนการชดเชย การควบแน่นไอเป็นของเหลว ถ้าจำนวนโมเลกุลที่ปล่อยของเหลวต่อหน่วยเวลาผ่านพื้นผิวหนึ่งหน่วยเท่ากับจำนวนโมเลกุลที่ผ่านจากไอเป็นของเหลวแล้ว สมดุลไดนามิกระหว่างกระบวนการระเหยและการควบแน่น ไอในสภาวะสมดุลกับของเหลวเรียกว่า รวย(ดู § 62 ด้วย)
สำหรับของแข็งส่วนใหญ่ กระบวนการระเหิดที่อุณหภูมิปกตินั้นน้อยมาก และความดันไอเหนือพื้นผิวของของแข็งนั้นต่ำ มันเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น สารระเหยอย่างเข้มข้น เช่น แนฟทาลีน การบูร ซึ่งตรวจพบโดยกลิ่นที่มีลักษณะเฉพาะที่แหลมคม การระเหิดเกิดขึ้นโดยเฉพาะอย่างยิ่งในสุญญากาศ - ใช้ทำกระจก ตัวอย่างที่รู้จักกันดีของการระเหิดคือการเปลี่ยนน้ำแข็งเป็นไอน้ำ - ผ้าเปียกจะแห้งในที่เย็น
หากร่างกายแข็งได้รับความร้อนก็แสดงว่า กำลังภายใน(ผลรวมของพลังงานของการสั่นของอนุภาคที่ไซต์ขัดแตะและพลังงานของปฏิกิริยาของอนุภาคเหล่านี้) เพิ่มขึ้น เมื่ออุณหภูมิสูงขึ้น แอมพลิจูดของการสั่นของอนุภาค
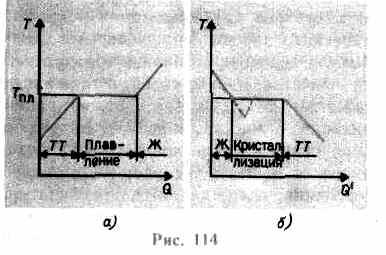
เพิ่มขึ้นจนตะแกรงคริสตัลยุบ - ของแข็งละลาย ในรูป 114 เอมีการพึ่งพาอาศัยกันโดยประมาณ ตู่(Q), ที่ไหน Q- ปริมาณความร้อนที่ร่างกายได้รับระหว่างการหลอม เป็นข้อความถึงของแข็ง ร่างกายอบอุ่นอุณหภูมิของมันสูงขึ้นและที่จุดหลอมเหลว ตู่ pl เริ่มการเปลี่ยนแปลงของร่างกายจากสถานะของแข็งเป็นสถานะของเหลว อุณหภูมิ ตู่กรุณา ยังคงคงที่จนกว่าคริสตัลทั้งหมดจะละลาย จากนั้นอุณหภูมิของของเหลวจะเริ่มสูงขึ้นอีกครั้งเท่านั้น
ทำความร้อนของแข็งได้ถึง ตู่กรุณา ยังไม่ได้แปลงเป็นสถานะของเหลว เนื่องจากพลังงานของอนุภาคของสารต้องเพียงพอที่จะทำลายโครงผลึก ในกระบวนการหลอมเหลว ความร้อนที่ส่งไปยังสารจะใช้เพื่อดำเนินการกับการทำลายโครงผลึก ดังนั้น T pl =const จนกว่าคริสตัลทั้งหมดจะละลาย จากนั้นความร้อนที่จ่ายไปจะไปเพิ่มพลังงานของอนุภาคของของเหลวอีกครั้งและอุณหภูมิของของเหลวก็จะเริ่มสูงขึ้น ปริมาณความร้อนที่ต้องใช้ในการหลอมสาร 1 กิโลกรัม เรียกว่า ความร้อนจำเพาะของการหลอมเหลว
หากของเหลวเย็นลง กระบวนการจะดำเนินการไปในทิศทางตรงกันข้าม (รูปที่ 114, b; Q" - ปริมาณความร้อนที่ร่างกายปล่อยออกมาในระหว่างการตกผลึก): ขั้นแรก อุณหภูมิของของเหลวจะลดลง จากนั้นที่อุณหภูมิคงที่เท่ากับ T pl เริ่มต้น การตกผลึกหลังจากเสร็จสิ้น อุณหภูมิของคริสตัลจะเริ่มลดลง สำหรับการตกผลึกของสาร การมีอยู่ของสิ่งที่เรียกว่า ศูนย์ตกผลึก -นิวเคลียสของผลึกซึ่งไม่เพียง แต่เป็นผลึกของสารที่ก่อตัวขึ้นเท่านั้น แต่ยังรวมถึงสิ่งเจือปนเช่นเดียวกับฝุ่นเขม่า ฯลฯ การไม่มีศูนย์ตกผลึกในของเหลวบริสุทธิ์ทำให้ยากต่อการก่อตัวของผลึกด้วยกล้องจุลทรรศน์และสาร ยังคงอยู่ในสถานะของเหลว เย็นตัวลงที่อุณหภูมิต่ำกว่าอุณหภูมิการตกผลึกจึงก่อตัวขึ้น น้ำยา supercooled(ในวันที่ 114 b สอดคล้องกับเส้นโค้งเส้นประ) ด้วย supercooling ที่แข็งแกร่ง การก่อตัวของศูนย์กลางการตกผลึกที่เกิดขึ้นเองตามธรรมชาติจะเริ่มต้นขึ้น และสารจะตกผลึกค่อนข้างเร็ว
โดยปกติ supercooling ของการหลอมละลายเกิดขึ้นจากเศษส่วนถึงหลายสิบองศา แต่สำหรับสารจำนวนหนึ่ง มันสามารถไปถึงหลายร้อยองศา เนื่องจากความหนืดสูง ของเหลวที่มีความเย็นสูงยิ่งสูญเสียความลื่นไหล โดยคงรูปร่างไว้เหมือนของแข็ง ร่างกายเหล่านี้เรียกว่า ของแข็งอสัณฐาน;เหล่านี้รวมถึงเรซิน ขี้ผึ้ง ขี้ผึ้งปิดผนึก แก้ว วัตถุอสัณฐานจึงเป็นของเหลวที่เย็นมาก ไอโซโทรปิก,กล่าวคือคุณสมบัติของมันเหมือนกันในทุกทิศทาง สำหรับพวกเขาเช่นเดียวกับของเหลวมันเป็นลักษณะ คำสั่งระยะสั้นในการจัดเรียงอนุภาค ในทางตรงกันข้ามกับของเหลวการเคลื่อนที่ของอนุภาคค่อนข้างเล็ก คุณลักษณะของวัตถุอสัณฐานคือพวกมันไม่มีจุดหลอมเหลวจำเพาะ กล่าวคือ มันเป็นไปไม่ได้ที่จะระบุอุณหภูมิจำเพาะที่สูงกว่าซึ่งสามารถระบุสถานะของเหลวได้ และต่ำกว่าสถานะของแข็ง จากประสบการณ์ เป็นที่ทราบกันดีอยู่แล้วว่าในวัตถุอสัณฐาน กระบวนการตกผลึกสามารถสังเกตได้เมื่อเวลาผ่านไป ตัวอย่างเช่น ผลึกปรากฏในแก้ว มันสูญเสียความโปร่งใสเริ่มมีเมฆมากและกลายเป็นตัวโพลีคริสตัลลีน
ล่าสุดมีการใช้อย่างแพร่หลายใน เศรษฐกิจของประเทศได้ โพลีเมอร์- วัตถุอสัณฐานอินทรีย์ โมเลกุลซึ่งประกอบด้วยสายโมเลกุลยาวเหมือนกันจำนวนมากเชื่อมต่อกันด้วยพันธะเคมี (วาเลนซ์) โพลีเมอร์ประกอบด้วยสารอินทรีย์ทั้งจากธรรมชาติ (แป้ง โปรตีน ยาง เส้นใย ฯลฯ) และสารอินทรีย์ประดิษฐ์ (พลาสติก ยาง โพลีสไตรีน ลาฟซาน ไนลอน ฯลฯ) โพลีเมอร์มีความแข็งแรงและยืดหยุ่นโดยธรรมชาติ โพลีเมอร์บางชนิดทนต่อการยืดตัวได้ 5-10 เท่าของความยาวเดิม สิ่งนี้อธิบายได้ด้วยความจริงที่ว่าโซ่โมเลกุลยาวสามารถพับเป็นลูกบอลหนาแน่นหรือยืดเป็นเส้นตรงได้ภายใต้การเสียรูป ความยืดหยุ่นของโพลีเมอร์จะปรากฏเฉพาะในช่วงอุณหภูมิที่กำหนด ซึ่งด้านล่างจะแข็งและเปราะ และเหนือกว่าพลาสติก แม้ว่าจะมีการสร้างวัสดุโพลีเมอร์สังเคราะห์จำนวนมาก (เส้นใยประดิษฐ์ วัสดุทดแทนหนัง วัสดุก่อสร้าง วัสดุทดแทนโลหะ ฯลฯ) ทฤษฎีของโพลีเมอร์ยังไม่ได้รับการพัฒนาอย่างเต็มที่ การพัฒนาถูกกำหนดโดยความต้องการของเทคโนโลยีสมัยใหม่ ซึ่งต้องมีการสังเคราะห์พอลิเมอร์ที่มีคุณสมบัติที่กำหนดไว้ล่วงหน้า
ความจุความร้อนจำเพาะของสารเป็นที่เข้าใจกันว่าเป็นค่า
, (1)
ปริมาณความร้อนที่ส่งไปยังร่างกายอยู่ที่ไหน
คือการเปลี่ยนแปลงของอุณหภูมิที่เกิดขึ้นใน
อันเป็นผลมาจากการถ่ายเทความร้อนสู่ร่างกาย
m คือมวลของวัตถุร้อน
ประสบการณ์มักจะกำหนดค่าเฉลี่ย ความร้อนจำเพาะสาร c เป็นตัวเลขเท่ากับปริมาณความร้อนที่ต้องให้กับมวลหน่วยของสารนี้เพื่อเพิ่มอุณหภูมิโดย:
(2),
ความแตกต่างระหว่างอุณหภูมิขั้นสุดท้ายและอุณหภูมิเริ่มต้นของร่างกายภายใต้การศึกษาอยู่ที่ไหน
ใช้วิธีการคำนวณความร้อนแบบต่างๆ เพื่อทดสอบความจุความร้อน ความหลากหลายของวิธีการเหล่านี้เกิดจากการที่การวัดปริมาณความร้อนที่ร่างกายได้รับอย่างแม่นยำนั้นจำเป็นต้องกำจัดการสูญเสียความร้อนที่ไม่ได้นำมาพิจารณาเมื่อให้ความร้อนแก่ร่างกายภายใต้การศึกษา
โดยปกติในแคลอรีมิเตอร์ที่เรียกว่าเปลือกไอโซเทอร์มอล จะมีการแนะนำการแก้ไขการแผ่รังสีที่คำนวณหรือกำหนดโดยการทดลอง นั่นคือปริมาณความร้อนที่แคลอรีมิเตอร์ได้รับหรือปล่อยออกสู่สภาพแวดล้อมภายนอกโดยการแผ่รังสีระหว่างการทดลอง
อย่างไรก็ตาม สามารถลดการสูญเสียความร้อนได้อย่างมากโดยการแนะนำฉนวนกันความร้อนที่ดี หรือโดยการลดระยะเวลาของการทดลอง ซึ่งทำได้โดยอัตราการให้ความร้อนสูงของตัวอย่าง ~ (วิธีพัลส์สำหรับการวัดความจุความร้อน) ซึ่งการสูญเสียความร้อนจะ น้อยเมื่อเทียบกับปริมาณความร้อนที่จ่ายไปทั้งหมด
หนึ่งในวิธีการที่แม่นยำที่สุดในการกำหนดความจุความร้อนคือวิธีอะเดียแบติกแคลอริมิเตอร์ ความยากลำบากที่เกี่ยวข้องกับความจำเป็นในการคำนึงถึงการสูญเสียความร้อนในแคลอรีมิเตอร์ประเภทนี้จะหมดไปโดยข้อเท็จจริงที่ว่าการวัดทำภายใต้สภาวะสมดุลทางความร้อน กล่าวคือ ภายใต้สภาวะอุณหภูมิที่เท่ากันของตัวอย่างที่ศึกษาและบล็อกรอบๆ ตัวอย่าง . ข้อดีของวิธีนี้พร้อมกับความแม่นยำสูง ยังรวมถึงความเป็นไปได้ในการพิจารณาความจุความร้อนของของแข็งในช่วงอุณหภูมิที่กว้าง ซึ่งมีความสำคัญอย่างยิ่งหากสารได้รับการแปลงเฟส
อุปกรณ์ของเครื่องวัดความร้อนแบบอะเดียแบติกประเภทใดประเภทหนึ่งแสดงเป็นแผนผังในรูป ตัวอย่างทดสอบ 1 ถูกวางไว้ในบล็อกทองแดง 3 และนำไปให้ความร้อนในเตาเผา 4 ร่วมกับตัวอย่างในเตาเผา 4 มีการแนะนำฮีตเตอร์ 2 ภายในตัวอย่าง ซึ่งช่วยให้ความร้อนเพิ่มเติมของตัวอย่าง
หลังจากเปิดเตาเผา 4 ซึ่งวางบล็อกที่มีตัวอย่างไว้ อุณหภูมิของตัวอย่างจะเริ่มสูงขึ้น โดยคงอยู่ต่ำกว่าอุณหภูมิของบล็อก ในการสร้างความเท่าเทียมกันระหว่างอุณหภูมิของตัวอย่างกับบล็อก ให้เปิดฮีตเตอร์ที่วางอยู่ภายในตัวอย่าง เมื่ออุณหภูมิของตัวอย่างสูงกว่าอุณหภูมิบล็อกเล็กน้อย เครื่องทำความร้อนภายในจะปิด
ต่อจากนั้น เครื่องทำความร้อนนี้จะเปิดและปิดเป็นระยะ เพื่อให้ความแตกต่างของอุณหภูมิระหว่างตัวอย่างและบล็อกมีการเปลี่ยนแปลงตลอดเวลา
ในขณะที่มีค่าเท่ากับศูนย์ (เมื่อฮีตเตอร์ภายในเปิดอยู่) จะไม่มีการแลกเปลี่ยนความร้อนระหว่างตัวอย่างกับบล็อก และปริมาณความร้อนทั้งหมดที่ปล่อยออกมาจากฮีตเตอร์ภายในจะใช้ไปกับการให้ความร้อนกับตัวอย่างเท่านั้น ความร้อนจำเพาะในกรณีนี้สามารถหาได้จากสูตร (2)
ปริมาณความร้อนที่ปล่อยออกมาจากฮีตเตอร์ภายในถูกกำหนดโดยสูตร:
โดยที่ I คือกระแสของเครื่องทำความร้อนภายใน
V คือแรงดันตกคร่อมมัน
- ช่วงเวลาที่อุณหภูมิเพิ่มขึ้น .
แล้ว
(4)
โดยที่ช่วงเวลาที่อุณหภูมิของตัวอย่างเปลี่ยนไปคือ .
ในรูปแบบดิฟเฟอเรนเชียล สูตร (4) มีรูปแบบ
(5)
อุณหภูมิของตัวอย่างวัดด้วยเทอร์โมคัปเปิล T ความแตกต่างของอุณหภูมิระหว่างบล็อกและตัวอย่างวัดด้วยเทอร์โมคัปเปิลแบบดิฟเฟอเรนเชียล ในการกำหนดอุณหภูมิตัวอย่าง จะใช้เส้นโค้งสอบเทียบเทอร์โมคัปเปิล T ความแตกต่างของอุณหภูมิระหว่างบล็อกและตัวอย่างจะถูกกำหนดโดยการแบ่งส่วนของสเกลกัลวาโนมิเตอร์ เครื่องหมายการเปลี่ยนแปลงตัวอย่าง)
เสร็จสิ้นการทำงาน
ตัวอย่างถูกวางบนฮีตเตอร์ที่วางอยู่ภายในบล็อกทองแดง ชุมทางเทอร์โมคัปเปิล T และเชื่อมต่อกับตัวอย่างและบล็อก เตาอบปิดด้วยฝา เปิดขดลวดไฟฟ้าของเตาเผาที่วางบล็อกไว้ เครื่องทำความร้อนที่วางอยู่ภายในตัวอย่างจะถูกเปิดและปิดเป็นระยะ และค่าของ I และ V จะถูกบันทึกในวงจรของเครื่องทำความร้อนภายใน
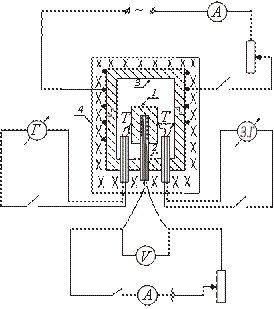
ก่อนเริ่มการวัด จำเป็นต้องตรวจสอบตำแหน่งศูนย์ของกัลวาโนมิเตอร์กระจก เมื่อต้องการทำเช่นนี้ โดยการถอดเทอร์โมคัปเปิลออกจากเครื่องวัดกระแสไฟฟ้า พวกเขาคาดหวังว่ากระต่ายจะหยุดผันผวนตามมาตราส่วน หากหลังจากนี้ภาพของเธรดไม่ตรงกับศูนย์ การย้ายมาตราส่วนจะทำให้เกิดความบังเอิญนี้
กราฟการพึ่งพาของ T และตรงเวลาถูกพล็อต
จากความชันของเส้นโค้ง T(t) ณ จุดที่เปลี่ยนเครื่องหมาย (นั่นคือ เมื่อสร้างสมดุลทางความร้อน) ความร้อนจำเพาะจะคำนวณโดยใช้สูตร (5) ความจุความร้อนนี้หมายถึงอุณหภูมิที่จะอ่านจากเส้นโค้ง T(t) ในขณะที่ความแตกต่างของอุณหภูมิระหว่างบล็อกและตัวอย่างมีการเปลี่ยนแปลง
