Como determinar a capacidade calorífica específica da água. Grande enciclopédia de petróleo e gás
INSTRUMENTOS E ACESSÓRIOS: calorímetro, termômetro, balança, corpos de prova, béquer (calibrado em gramas), aquecedor elétrico.
– confirmar experimentalmente a validade da equação do balanço de calor;
– calcular as capacidades caloríficas específicas dos sólidos;
– organizar os resultados das medições e cálculos na forma de uma tabela;
– anote suas sugestões para melhorar a técnica de medições e cálculos neste trabalho.
BREVE TEORIA DA EXPERIÊNCIA
Um dos conceitos físicos básicos da termodinâmica é a capacidade calorífica.
Capacidade térmica do corpo chamado quantidade física, numericamente igual ao calor, que deve ser comunicado ao corpo para alterar sua temperatura em 1 K no processo termodinâmico considerado. Por outro lado, a capacidade calorífica de um corpo é igual à razão entre o calor dQ transmitido ao corpo e a mudança dT na temperatura do corpo no processo termodinâmico considerado:
A capacidade calorífica de um corpo depende de sua composição química, massa do corpo e seu estado termodinâmico, e também, como pode ser visto a partir da definição, sobre o tipo de processo de mudança de estado do corpo, no qual o calor dQ entra.
Propriedades térmicas corpos homogêneos são caracterizados pelos valores de capacidade térmica específica e molar (molar). A capacidade calorífica específica de uma substância chamada de grandeza física Com, numericamente igual ao calor que deve ser transmitido a um quilograma de uma substância para alterar sua temperatura em 1 K no processo termodinâmico em consideração. A capacidade calorífica de um corpo homogêneo pode ser definida como o produto da massa do corpo m para capacidade calorífica específica Com suas substâncias:
![]() ou (2.2).
ou (2.2).
Assim, a relação entre dQ e dT para um corpo homogêneo tem a forma:
capacidade de calor molar a quantidade física C é chamada, numericamente igual ao calor que deve ser transmitido a um mol de uma substância para alterar sua temperatura de 1 K no processo termodinâmico em consideração:
A PARTIR DE = EM = (2.4),
onde M é a massa molar da substância; A PARTIR DEé sua capacidade calorífica específica no mesmo processo.
A expressão (2.4) pode agora ser escrita na forma:
onde = n é a quantidade de substância.
A unidade de medida da capacidade calorífica de um corpo é 1 J/K, calor específico– 1J/kg. K, molar - 1 J/mol. PARA.
Se o aquecimento ocorrer sob condições em que o volume permanece constante, a capacidade calorífica molar correspondente é chamada capacidade calorífica a volume constante, ou capacidade de calor isocórica, e é denotado C v:
Se a pressão permanece constante durante o aquecimento, então a capacidade calorífica é chamada capacidade calorífica a pressão constante C p (também pode ser chamado de capacidade térmica isobárica):
Observe que para sólidos, apenas a capacidade calorífica a pressão constante, e não a volume constante, está disponível para medição direta, pois devido à expansão térmica é impossível garantir a constância do volume do corpo. No entanto, devido à pequena variação de volume durante o aquecimento, a diferença entre as capacidades de calor Cp e Cv é pequena.
Experimentalmente, a capacidade calorífica de um corpo é determinada pela aplicação da equação de balanço de calor. Deixe o corpo ser aquecido a uma temperatura maior que a temperatura meio Ambiente. Então, esfriando, o corpo libera uma certa quantidade de calor. De acordo com a lei de conservação de energia em um sistema fechado, a quantidade de calor recebida pelo meio deve ser exatamente igual à quantidade de calor liberada pelo corpo. Neste trabalho, esfriando, o corpo de prova emite calor para a água no calorímetro e para o próprio calorímetro.
Deixe o corpo de teste dado com massa m, aquecido a uma temperatura t0, é abaixado no calorímetro com água, cuja temperatura t1. Como resultado da transferência de calor temperatura da água e o calorímetro sobe para t2, uma Temperatura corporal cai para t2. A quantidade de calor liberada pelo corpo é:
Q dep = cm(t0 - t2) (2.6),
onde c é a capacidade calorífica específica do corpo de prova,
t0– temperatura corporal inicial,
t2– temperatura corporal final,
m- massa corporal.
A quantidade de calor recebida pelo calorímetro e água é igual a:
onde e são a massa e o calor específico do calorímetro,
I - massa e específico capacidade calorífica da água,
t1– temperatura inicial da água,
t2é a temperatura final da água.
De acordo com a lei da conservação da energia em um sistema fechado:
Q otd \u003d Q andar (2.8).
Então, substituindo as fórmulas 2.6 e 2.7 na equação 2.8 e expressando o valor desejado A PARTIR DE , Nós temos:
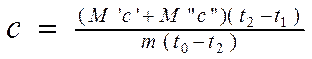 (2.9).
(2.9).
DETERMINAR AS CAPACIDADES DE CALOR ESPECÍFICAS DE TRÊS CORPOS CILÍNDRICOS DE VÁRIOS METAIS
1. Determine os valores das massas dos corpos - eu, massa do calorímetro – , calor específico da água – , calor específico do calorímetro – .
2. Despeje no calorímetro uma quantidade medida de água fria à temperatura ambiente (aproximadamente 150 g).
3. Meça a temperatura inicial da água fria t 1 .
4. Aqueça a água no recipiente até ferver.
5. Coloque um dos corpos de prova em água fervente por um tempo. Tome a temperatura do corpo aquecido t 0 igual a temperaturaágua fervente em condições normais - 100 ° C.
6. Coloque o corpo aquecido no calorímetro com água. Aguarde o final da transferência de calor e meça a temperatura final no calorímetro - t 2 .
8. Determine igualmente as capacidades caloríficas específicas dos outros dois corpos.
9. Registre os resultados das medições e cálculos na tabela 3.
10. Com base nos valores das capacidades específicas de calor, determine as substâncias das quais os corpos são feitos.
12. Tendo medido as dimensões lineares dos corpos, determine sua densidade.
13. Calcule os erros e registre o resultado de acordo com GOST.
14. Anote as conclusões sobre o trabalho de laboratório.
Tabela 3
| Nº p/p | M", kg | M", kg | m, kg | C", J / kg. K | C", J / kg. K | t0,0C | t1, 0C | t2, 0C | C, J/kg. Para |
Página 2
A precisão da determinação do calor específico de acordo com Sykes é muito alta. No entanto, este método está associado a maiores dificuldades experimentais do que o método de Smith, e também fornece resultados precisos apenas para curvas de aquecimento, embora também possa ser usado para obter curvas de resfriamento. O método de Smith facilita o estudo de faixas estreitas de temperatura, mas provavelmente é menos preciso.
Portanto, para determinar a capacidade calorífica específica sg de uma substância, é necessário medir o trabalho A realizado pelas forças externas que atuam sobre o corpo e medir a mudança na temperatura corporal observada como resultado do trabalho na ausência de troca de calor com outros corpos.
O método mais comumente usado para determinar a capacidade calorífica específica; chamado de mixagem. O calorímetro (Regno) consiste em um recipiente de cobre vermelho, colocado sobre pernas de madeira no fundo de outro recipiente de cobre, do qual é separado por uma camada de ar, cuja condutividade térmica e capacidade calorífica, por unidade de volume, são insignificante. O primeiro recipiente está cheio de água.
Vamos agora considerar métodos para determinar a capacidade calorífica específica de uma mistura de gases.
A determinação direta (direta) da capacidade calorífica específica Su e o estudo do curso de sua mudança dependendo da temperatura e do volume específico é um dos Meios eficazes estudo do estado crítico das substâncias. Portanto, determinações experimentais de capacidade calorífica são de grande interesse teórico e prático no estudo de fenômenos críticos.
Qual é a fórmula para determinar a capacidade calorífica específica das soluções.
Ao realizar experimentos para determinar o calor específico por mistura, é necessário aquecer a amostra de teste - - a uma temperatura precisamente fixada. Para isso, são utilizados aquecedores portáteis, que são instalados acima do calorímetro por um curto período de tempo, necessário para a rápida transferência da amostra aquecida para o calorímetro.
| Diagrama do dispositivo. |
A essência do método estacionário absoluto mais simples para determinar o calor específico é a seguinte: uma amostra do material de teste com espessura h e área de seção transversal 5 é colocada entre o aquecedor e o resfriador. O aquecedor pode ser um recipiente com água quente ou um elemento de aquecimento elétrico para que sua potência possa ser ajustada conforme desejado alterando a tensão. O refrigerador é um corpo de metal oco através do qual a água fria passa. As temperaturas nas superfícies aquecidas e resfriadas da amostra (tj e, respectivamente, /2) são medidas por termopares.
Abaixo está um exemplo de processamento de dados experimentais ao determinar a capacidade térmica específica de uma amostra de arenito. Um cilindro oco preenchido com pó da amostra de rocha estudada foi aquecido a 40 C e resfriado em uma câmara de ar parado a uma temperatura de 18 a 20 C.
Na fig. 3 - 6 mostra nomogramas para determinar a capacidade calorífica específica de hidrocarbonetos individuais líquidos e misturas de óleo, bem como soluções aquosas de metanol e etanol.
Por exemplo, vamos fazer uma equação de balanço de calor, que é usada para determinar a capacidade calorífica específica de uma substância usando um calorímetro. Aproximadamente, pode-se considerar que, neste caso, três corpos participam da troca de calor: um calorímetro, um líquido e um corpo, cujo calor específico da substância é determinado.
6.4. Transferência de calor entre corpos
6.4.1. Capacidade calorífica do corpo, específica capacidade calorífica de uma substância, capacidade calorífica molar de uma substância
Para aumentar a temperatura do corpo, ele precisa comunicar uma certa quantidade de calor.
1 kg de uma dada substância por 1 K é chamado calor específico substâncias e é calculado pela fórmula
c batidas = Q m Δ T ,
onde Q é a quantidade de calor necessária para aquecer uma certa massa de matéria; m é a massa da substância; ΔT é a mudança na temperatura da substância quando aquecida.
No Sistema Internacional de Unidades, a capacidade calorífica específica de uma substância é medida em joules dividido por quilograma-kelvin (1 J/(kg ⋅ K)).
A quantidade de calor necessária para aquecer alguma massa de matéria, é determinado pelo produto
Q = c batida m ∆T .
A quantidade de calor necessária para elevar um determinado corpo em 1 K é chamada de capacidade de calor do corpo e é calculado pela fórmula
C = QΔT,
onde Q é a quantidade de calor necessária para aquecer um determinado corpo; ΔT - mudança na temperatura do corpo quando aquecido.
No Sistema Internacional de Unidades, a capacidade calorífica de um corpo é medida em joules dividido por kelvin (1 J/K).
A quantidade de calor necessária para aquecer um determinado corpo é determinada pelo produto
Q=CΔT,
onde C é a capacidade calorífica do corpo.
A capacidade calorífica de um corpo e a capacidade calorífica da substância da qual o corpo é composto, interligado expressão
C \u003d mc batidas,
onde C é a capacidade calorífica do corpo; m - peso corporal; c beat é a capacidade calorífica específica da substância da qual esse corpo é feito.
A quantidade de calor necessária para aumentar a temperatura de 1 mol de uma dada substância em 1 K é chamada capacidade calorífica molar de uma substância e é calculado pela fórmula
c μ = Q ν Δ T ,
onde Q é a quantidade de calor necessária para aquecer uma certa quantidade de uma substância; ν é a quantidade de substância; ΔT é a mudança na temperatura da quantidade especificada de substância quando aquecida.
No Sistema Internacional de Unidades, a capacidade calorífica molar de uma substância é medida em joules por mol-kelvin (1 J/(mol ⋅ K)).
A quantidade de calor necessária para aquecer alguma quantidade de substância, é determinado pelo produto
Q = cµ νΔT .
Capacidades de calor específico e molar de uma substância interligado expressão
c µ = Ms batimentos,
onde c µ é a capacidade calorífica molar da substância; M é a massa molar da substância; c sp - capacidade calorífica específica da substância.
Exemplo 14 As bolas de ferro e chumbo têm o mesmo diâmetro. Quantas vezes maior é a capacidade calorífica de uma bola de ferro do que a de uma bola de chumbo? As capacidades caloríficas específicas do ferro e do chumbo são 0,46 e 0,13 kJ/(kg ⋅ K), e as densidades são 7,80 e 11,5 g/cm3, respectivamente.
Solução. As capacidades caloríficas das bolas são determinadas pelas seguintes fórmulas:
- bola de ferro -
C 1 \u003d m 1 c ud1,
onde m 1 é a massa da bola de ferro; c ud1 - capacidade calorífica específica do ferro;
- bola de chumbo -
C 2 \u003d m 2 c beat2,
onde m 2 é a massa da bola de chumbo; c sp2 - capacidade calorífica específica do chumbo.
A proporção desejada é a capacidade de calor:
C 1 C 2 \u003d m 1 c batida 1 m 2 c batida 2,
que é determinado pela razão entre as massas das esferas de ferro e chumbo e a razão das capacidades caloríficas específicas de ferro e chumbo.
As massas das bolas são determinadas pelo seu tamanho e densidade:
- bola de ferro -
m 1 \u003d ρ 1 V 1,
onde ρ 1 é a densidade do ferro; V 1 - o volume da bola de ferro;
- bola de chumbo -
m 2 \u003d ρ 2 V 2,
onde ρ 2 - a densidade do chumbo; V 2 - o volume da bola de chumbo.
As bolas têm o mesmo diâmetro, então seus volumes são os mesmos:
V 1 \u003d V 2 \u003d V \u003d π d 2 6,
onde d são os diâmetros das esferas de ferro e chumbo.
Levando em conta esta última circunstância, a razão de massa é igual a:
m 1 m 2 = ρ 1 V 1 ρ 2 V 2 = ρ 1 ρ 2 .
Vamos substituir m 1 /m 2 na fórmula para a razão das capacidades caloríficas das bolas de ferro e chumbo:
C 1 C 2 \u003d ρ 1 c sp 1 ρ 2 c sp 2.
Vamos fazer o cálculo:
C 1 C 2 = 7,80 ⋅ 10 3 ⋅ 0,46 ⋅ 10 3 11,5 ⋅ 10 3 ⋅ 0,13 ⋅ 10 3 = 2,4.
A capacidade calorífica de uma bola de ferro é 2,4 vezes a de uma bola de chumbo.
Exemplo 15. Ao preparar uma mistura, uma certa massa de areia e quatro vezes a massa de cimento foram despejadas no bunker. As capacidades caloríficas específicas do cimento e da areia são 810 e 960 J/(kg ⋅ K), respectivamente. Determine a capacidade calorífica específica da mistura.
Solução. A capacidade calorífica específica da mistura é determinada pela fórmula
c batidas = Q m Δ T ,
onde Q é a quantidade de calor necessária para aumentar a temperatura da mistura em ΔT; m é a massa da mistura.
A quantidade de calor necessária para aquecer a mistura, -
Q \u003d Q 1 + Q 2,
onde Q 1 - a quantidade de calor necessária para aquecer a areia, que faz parte da mistura, por ΔT; Q 2 - a quantidade de calor necessária para aquecer o cimento, que faz parte da mistura, por ΔT.
A quantidade de calor necessária para o aquecimento:
- areia -
Q 1 \u003d c ud1 m 1 ∆T,
onde c ud1 - capacidade calorífica específica da areia; m 1 - massa de areia;
- cimento -
Q 2 \u003d c ud2 m 2 ∆T,
onde c ud2 - capacidade calorífica específica do cimento; m 2 é a massa de cimento.
A quantidade de calor necessária para aquecer uma mistura de areia e cimento é determinada pela expressão
Q \u003d c bateu 1 m 1 Δ T + c bateu 2 m 2 Δ T \u003d (c bateu 1 m 1 + c bateu 2 m 2) Δ T.
A massa da mistura é a soma das massas de areia e cimento:
m \u003d m 1 + m 2.
Vamos substituir as expressões obtidas para a quantidade de calor e massa da mistura na fórmula para a capacidade calorífica específica da mistura:
c bate \u003d (c bate 1 m 1 + c bate 2 m 2) Δ T (m 1 + m 2) Δ T \u003d c bate 1 m 1 + c bate 2 m 2 m 1 + m 2.
Vamos transformar a expressão resultante, levando em consideração a razão de massa:
m2 = 4m1, ou seja. c bate \u003d c bate 1 m 1 + 4 c bate 2 m 1 m 1 + 4 m 1 \u003d c bate 1 + 4 c bate 2 5.
O cálculo dá o valor:
c batimentos = 960 + 4 ⋅ 810 5 = 840 J/(kg ⋅ K).
Portanto, a capacidade calorífica específica da mistura é 840 J/(kg ⋅ K).
