طريقة لتحديد السعة الحرارية لجسم صلب
ما هي السعة الحرارية
عندما يتم توفير الحرارة ، ترتفع درجة حرارة النظام. في حالة حدوث تغير طفيف للغاية في درجة الحرارة ، فإن التناسب صالح
dT = δQ ، أو dT = constδQ
من الأنسب كتابة هذه العلاقة بالصيغة: δQ = СdT أو
تسمى القيمة C السعة الحرارية الحقيقية للنظام.
السعة الحرارية هي نسبة كمية الحرارة المقدمة للنظام إلى تغير درجة الحرارة الذي يحدث.
بالإضافة إلى الحقيقة ، هناك أيضًا متوسط سعة حرارية:
السعة الحرارية
إذا كانت السعة الحرارية تُعزى إلى كتلة وحدة (مول) من مادة ، فإنها تصبح مستقلة عن كتلة النظام بأكمله وتكتسب خصائص معلمة مكثفة. إذا كانت السعة الحرارية تشير إلى كتلة وحدة من مادة ما ، فإنها تسمى محددة ، وإلى 1 مول - سعة حرارية بأبعاد J / (mol * k)
سننظر فقط في السعات الحرارية المولية ، منذ ذلك الحين بالنسبة لهم ، جميع الانتظامات أبسط بكثير من السعة الحرارية المحددة.
تعتمد السعة الحرارية على الظروف التي يتم في ظلها نقل الحرارة إلى النظام. إذا كان النظام محاطًا بحجم ثابت ، فستحدث زيادة في درجة الحرارة بمقدار dT تحت تأثير الحرارة المساوية لـ CvdT ، حيث Cv هي السعة الحرارية عند الحجم الثابت. في حالات الضغط المستمر أثناء تمدد النظام ، لزيادة درجة الحرارة بمقدار dT ، ستكون الحرارة CpdT مطلوبة ، حيث Cp هي السعة الحرارية عند ضغط ثابت.
نظرًا لظروف نقل الحرارة ، عندما يظل متغير واحد أو أكثر ثابتًا ، بينما يتغير الآخرون ، يمكن التعبير عن السعة الحرارية باستخدام المشتقات الجزئية: ![]() . منذ δQ v = dU ،
. منذ δQ v = dU ،
δQ p = dH ، يمكننا أن نكتب:
![]() (1)
(1)
Cv هي السعة الحرارية المتساوية للغازات ، Cp هي السعة الحرارية متساوية الضغط للغازات.
ترجع الاختلافات بين السعات الحرارية متساوية الضغط والمتساوية إلى الاختلاف في الطاقة الداخلية والمحتوى الحراري. تختلف التغييرات في المحتوى الحراري والطاقة الداخلية حسب مقدار العمل الذي يقوم به النظام.
δW = ∆nRT ، ∆H-∆U = nRT
لذلك ، تختلف السعات الحرارية عند الحجم الثابت Cv والضغط الثابت Cp أيضًا بمقدار الشغل: Cp - Cv = δW
بناءً على التعبيرات (1) ، يمكننا كتابة:
استبدال هذه المساواة في المعادلة ∆H- ∆U = nRT
ومع الأخذ في الاعتبار أن ∆n = 1 ، سنجد العلاقة بين السعات الحرارية المولية للغازات:
Cp– Cv = R أو Cp = Cv + R
كما يتضح ، فهي تختلف حسب قيمة ثابت الغاز.
من الحالة Cp = Cv + R يتبع ذلك Cp˃Cv ، أي في عملية متساوية الضغط ، عندما يكون P = const ، لزيادة درجة حرارة النظام ، يكون مطلوبًا كمية كبيرةالحرارة مما كانت عليه في عملية متساوية الصدور.
السعة الحرارية المولية للغازات لها قيم من رتبة R ، لذا فإن الفرق بين Cp و Cv مهم جدًا. لذلك ، بالنسبة لثاني أكسيد الكربون CO 2 عند 25 0 Cp = 37 ، 14 ؛ و Cv = 28.83 J / (mol * K)
الفرق Cp - Cv هو عمل التمدد متساوي الضغط لمول واحد غاز مثاليعندما ترتفع درجة الحرارة بدرجة واحدة. تتميز السوائل والمواد الصلبة في الجسم بزيادة طفيفة في الحجم عند تسخينها. لذلك ، بالنسبة للأجسام المكثفة ، يمكننا افتراض أن Ср ≈ Сv.
معادلة KIRCHHOFF. الاعتماد على التأثيرات الحرارية على درجة الحرارة.
إن الحسابات المدروسة سابقًا للتأثيرات الحرارية بناءً على قانون Hess لحرارة التكوين والاحتراق مقيدة بشروط قياسية. لأغراض عملية ، من الضروري حساب التأثيرات الحرارية لظروف معينة غير الظروف القياسية.
انتقل من التأثيرات الحرارية المعروفة في ظل الظروف القياسية ، أي عند درجة حرارة 25 درجة مئوية (298.15 كلفن) وضغط 1 ضغط جوي. (1.013 * 10 5 Pa) ، من الممكن حساب التأثيرات الحرارية عند أي درجة حرارة تهمنا باستخدامها قانون كيرشوف. تتميز العمليات في الظروف الصناعية بتغير كبير في درجات الحرارة ، والذي يتحدد نطاقه ليس فقط بظروف التكنولوجيا ، ولكن أيضًا حسب الموسم.يمكن أن يصل هذا النطاق إلى مئات الدرجات - من الطبيعي أن تكون التأثيرات الحرارية تختلف اختلافًا كبيرًا وتعتمد على درجة الحرارة.
ضع في اعتبارك قانون كيرشوف بصيغة تفاضلية. للقيام بذلك ، نقوم بتدوين التغييرات في المحتوى الحراري في الطاقة الداخلية متساوية الضغط في العمليات متساوي الصدور.
∆H = H 2 -H 1 ؛ ∆U \ u003d U 2 -U 1.
ميّز هذه المعادلات فيما يتعلق بدرجة الحرارة واحصل على:
معادلات كيرشوف:

و - معاملات درجة الحرارة للتأثير الحراري للعمليات متساوية الضغط والعمليات متساوي الضغط ، على التوالي ؛ و - التغيير في السعة الحرارية للنظام نتيجة لعمليات متساوية الضغط ومتساوي الضغط ، على التوالي.
على أساس معادلة كيرشوف ، تمت صياغة قانون كيرشوف في شكل تفاضلي: معامل درجة الحرارة للتأثير الحراري للعملية يساوي التغير في السعة الحرارية للنظام الذي يحدث نتيجة لهذه العملية.
وهكذا ، فإن قانون كيرشوف في شكل تفاضلي يجعل من الممكن تحديد التغير في التأثير الحراري فقط مع درجة الحرارة ، وليس حجم التأثير الحراري نفسه.
دعونا نحلل معادلة كيرشوف
للتفاعل: aA + bB = dD + rR في عملية متساوية الضغط (р = const) ، وفقًا لقانون Kirchhoff ، سيكون للتغيير في السعة الحرارية في النظام الشكل:
يمكن الحصول على تعبير مماثل لعملية isochoric:
نظرًا لأن قانون Kirchhoff يسمح لك بتحديد التغييرات في التأثير الحراري للعملية مع تغيير درجة الحرارة ، فإننا نبني رسمًا بيانيًا:
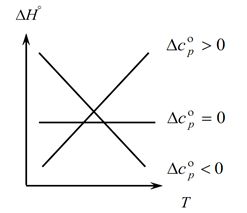
1. النظر في الحالة الأولى ، عندما ∆Ср (∆Сv) ˃0 ، لأن ∆Ср = ∑С con. -С الأولية ، ومن ثم فإن مجموع السعات الحرارية لنواتج التفاعل أكبر من مجموع السعات الحرارية للمواد الأولية: ∑С con. ˃∑ من البداية في هذه الحالة ، نحصل على المنحنى 1 على الرسم البياني ، مما يعني أنه مع زيادة درجة الحرارة ، يزداد أيضًا التغيير في التأثير الحراري للعملية (T و ∆H) ؛
2. الحالة الثانية ، عندما ∆Ср (∆Сv) ˂0. على غرار القانون الأول ، لدينا خدعة ∑С. ˂∑ من وقت مبكر (مجموع السعات الحرارية للمنتجات النهائية أقل من مجموع السعات الحرارية للمواد الأولية). ثم نحصل على منحنى على الرسم البياني ، مما يعني أنه مع زيادة درجة الحرارة ، ينخفض التغيير في التأثير الحراري للعملية (Т → ∆H ↓)
3. والحالة الثالثة ، عندما يكون التغيير في السعات الحرارية للنظام يساوي صفر ∆Ср (∆Сv) = 0. ثم يكون مجموع السعات الحرارية للمنتجات النهائية للتفاعلات مساويًا لمجموع السعات الحرارية لمواد البداية ∑С con. \ u003d ∑ من البداية. في هذه الحالة ، لا يكون التأثير الحراري للتفاعل دالة لدرجة الحرارة (∆H ≠ f (T)) ونحصل على خط مستقيم على الرسم البياني.
حساب التأثيرات الحرارية لمعطى
درجة حرارة. تكامل معادلة KIRCHHOFF
لإيجاد قيمة التأثير الحراري كدالة لدرجة الحرارة ، من الضروري تكامل المعادلات

من T إلى T 0 (حيث T هي درجة الحرارة المطلوبة ، T 0 هي درجة الحرارة القياسية) ، من ∆H إلى ∆H 0 أو من ∆U إلى ∆U 0 (حيث ∆H و U هما المحتوى الحراري والطاقة الداخلية تحت الشروط التي تختلف عن المعيار). يتم الاندماج في حالتين:
لا المواد العضوية: للمواد العضوية:
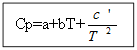
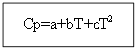
مثال: لـ H 2 (g) - مادة غير عضوية
| Ср = f (T) | تي | |||
| أ | ب * 10 3 | ج "* 10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) = 27.28 + 3.26 * 10 -3 T +.
أ) تكامل تقريبي:
لعملية متساوية الضغط
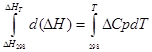
∆H T - ∆H 298 = Cp * (T-298)
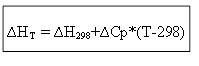
لعملية isochoric:
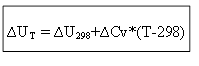
وبالتالي ، لتحديد التأثير الحراري ∆H أو الطاقة الداخلية ∆U عند أي درجة حرارة T ، من الضروري معرفة حرارة العملية في ظل الظروف القياسية ∆H 0 (∆U 0) والتغير في السعات الحرارية ∆Ср ، ∆ السيرة الذاتية.
مثال. احسب التأثير الحراري ∆H لعملية الحصول على البنزين من الأسيتيلين:
3C 2 H 2 (g) → C 6 H 6 (g) عند 75 0 درجة مئوية (348 كلفن).
1. نجد من الجداول متوسط السعات الحرارية متساوية الضغط المولية للبنزين والأسيتيلين:
Ср С6Н6 (g) = 81.67 J / (mol * K) ؛
Cp C2H2 (g) = 43.93 J / (مول * ك).
2. نجد التغيير في السعة الحرارية للعملية:
∆Cp \ u003d ∑ (nCp) con - (nCp) الأولي \ u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \ u003d 81.67 - 3 * 43.93 \ u003d - 50.12 J / (mol * K).
3. وفقًا للبيانات المجدولة ، نجد التأثير الحراري في ظل الظروف القياسية:
∆H 0 \ u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \ u003d 82.93 - 3 * 226.73 \ u003d - 597.26 kJ / mol
4. أوجد التأثير الحراري عند درجة حرارة معينة:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597.26 * 10 3 + (-50.12) * (348-298) = -599766 J / مول
ب) التكامل الدقيق:
دعونا نفكر في الحالة الثانية الأكثر تعقيدًا ، عندما يعتمد التغيير في السعة الحرارية على درجة الحرارة ، أي Ср = f (T) ، Cv = f (T).
دعونا ننتقل إلى معادلة التفاعل بشكل عام
dD + rR = qQ + pP
| أ | ب * 10 3 | ج "* 10 -5 | ج * 10 6 | |
| د | + | + | - | + |
| ص | + | + | + | - |
| س | + | + | + | - |
| ص | + | + | + | - |
∆a = q * a (Q) + p * a (P) - ؛
∆b = q * b (Q) + p * b (P) - ؛
∆c '= q * c' (Q) + p * c '(P) - ؛
![]()
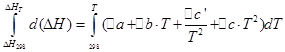
سنقوم بتنفيذ نفس العمليات لعملية isochoric:
حرارة الانحلال
يسمى التغيير في المحتوى الحراري أثناء انتقال مادة صلبة أو سائلة أو غازية إلى محلول حراري أو محتوى حراري للذوبان.
تتضمن حرارة الذوبان عمومًا حرارة تدمير الشبكة البلورية (لـ المواد الصلبة) والتأين والذوبان.
لكسر الرابطة بين أيونات الملح البلوري ، نحتاج إلى طاقة ، أي بينما يتم امتصاص الحرارة. في الوقت نفسه ، يحدث الترطيب الأيوني في المحلول المائي ؛ تتشكل رابطة بين أيونات وجزيئات H 2 O. يتم تحديد علامة حرارة الذوبان من خلال العملية الأكثر وضوحًا من الناحية النشطة.
LiBr: ∆H dist = - 49.02 kJ / mol - تنبعث الحرارة
KCl: ∆H dist = 7.23 kJ / mol - يمتص الحرارة
التمييز: الحرارة المتكاملة للذوبان هي الحرارة التي يتم إطلاقها أو امتصاصها عند إذابة 1 مول من مادة معينة لتشكيل محلول بتركيز معين. تختلف الحرارة المتكاملة للذوبان تبعًا لكمية المادة المذابة.
التمييز: الحرارة التفاضلية للذوبان - هذه هي الحرارة المصاحبة لانحلال 1 مول من مادة معينة بشكل لانهائي صوت عاليمحلول هذه المادة. تُستخدم درجات الحرارة التكاملية على نطاق واسع في حساب درجات حرارة التكوين والحرارة للتفاعلات الأخرى وفقًا لقانون هيس. تميز درجات الحرارة التفاضلية للذوبان الخصائص الديناميكية الحرارية للحلول وعملية تكوينها.
مختبر # 8
تحديد السعة الحرارية للأجسام الصلبة
الآلات والاكسسوارات:الإعداد التجريبي FPT1-8.
الهدف من العمل:تحديد السعة الحرارية لعينات المعادن بالطريقة المسعرية باستخدام التسخين الكهربائي.
نظرية موجزة
السعة الحرارية النوعية للمادة - قيمة تساوي كمية الحرارة المطلوبة لتسخين 1 كغم من المادة بمقدار 1 كلفن:
السعة الحرارية المولية - قيمة مساوية لكمية الحرارة المطلوبة لتسخين 1 مول من مادة لكل 1 كلفن:
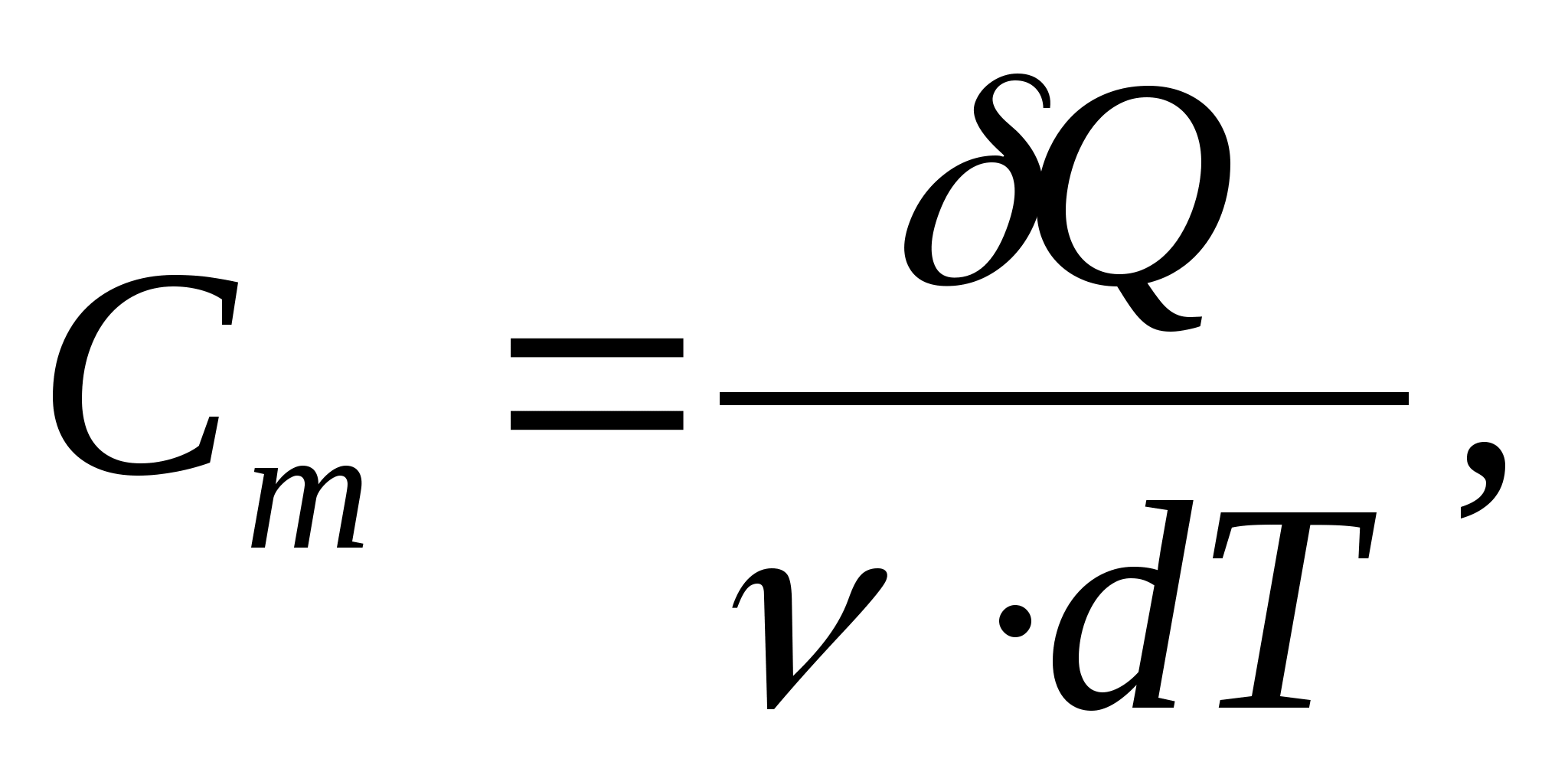
أين 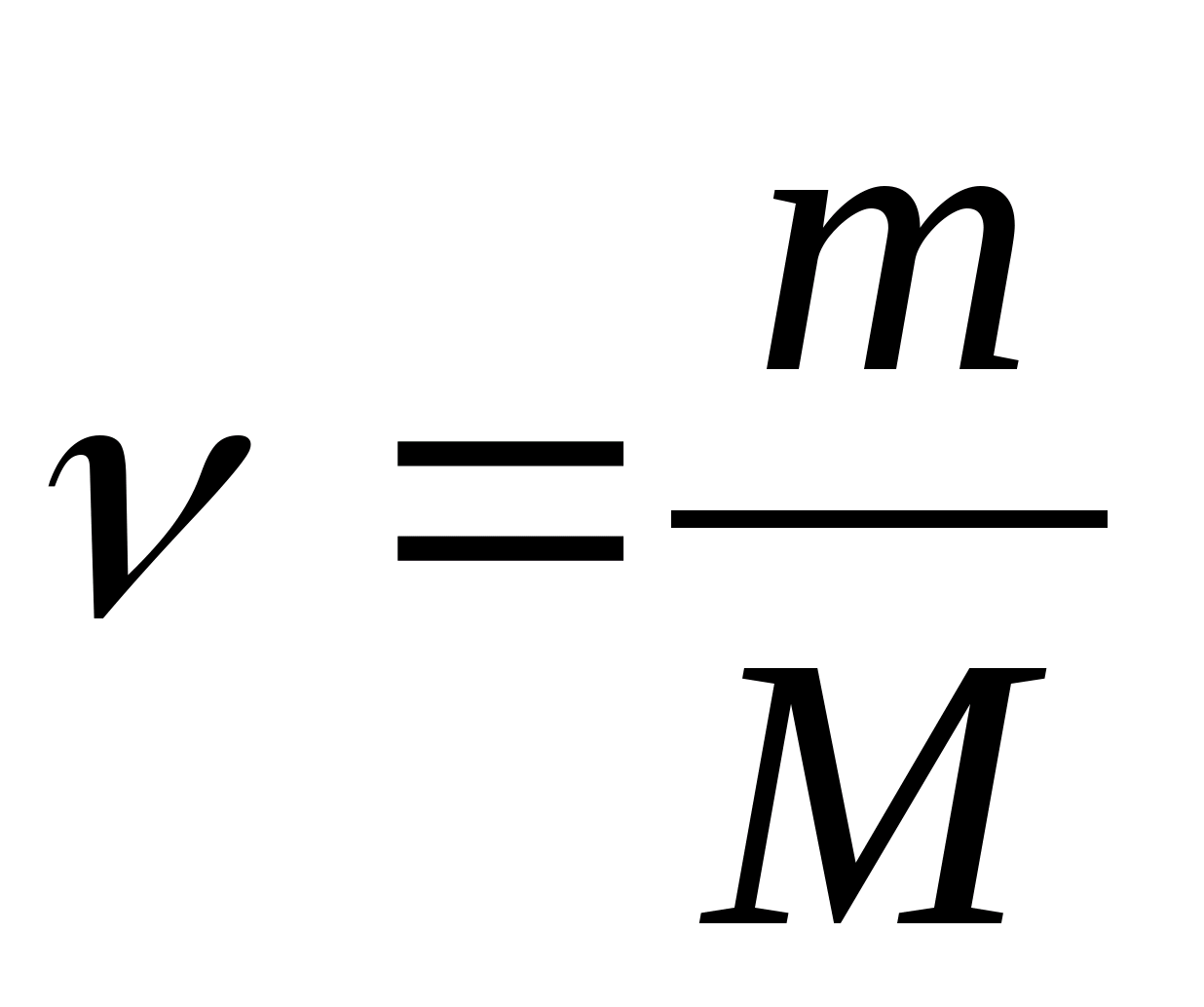 - كمية المادة.
- كمية المادة.
حرارة نوعية جالمرتبطة بالضرس ج منسبة

أين مهي الكتلة المولية للمادة.
يميز السعة الحرارية في حجم ثابتو ضغط متواصل، إذا كان حجمها أو ضغطها ثابتًا أثناء عملية تسخين مادة ما.
يسمى أصغر عدد من المتغيرات المستقلة (الإحداثيات) التي تحدد تمامًا موضع النظام في الفضاء عدد درجات الحرية .
وفقًا لقانون بولتزمان بشأن التوزيع المنتظم للطاقة على درجات حرية الجزيئات ، فإن كل درجة انتقالية ودورانية من الحرية لها متوسط طاقة حركية يساوي
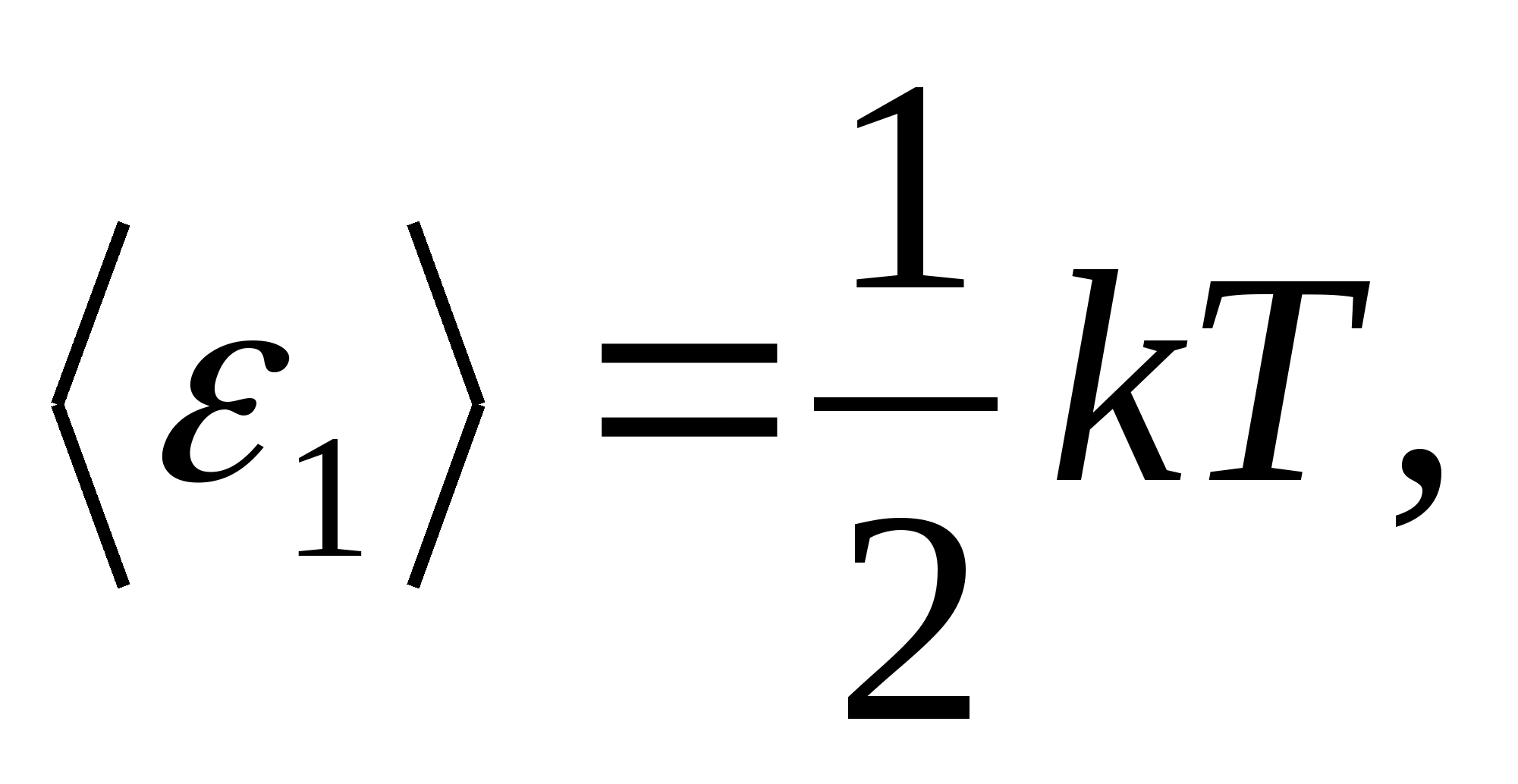
(أين كهو ثابت بولتزمان) ، ولكل درجة اهتزازية من الحرية ، في المتوسط ، الطاقة تساوي
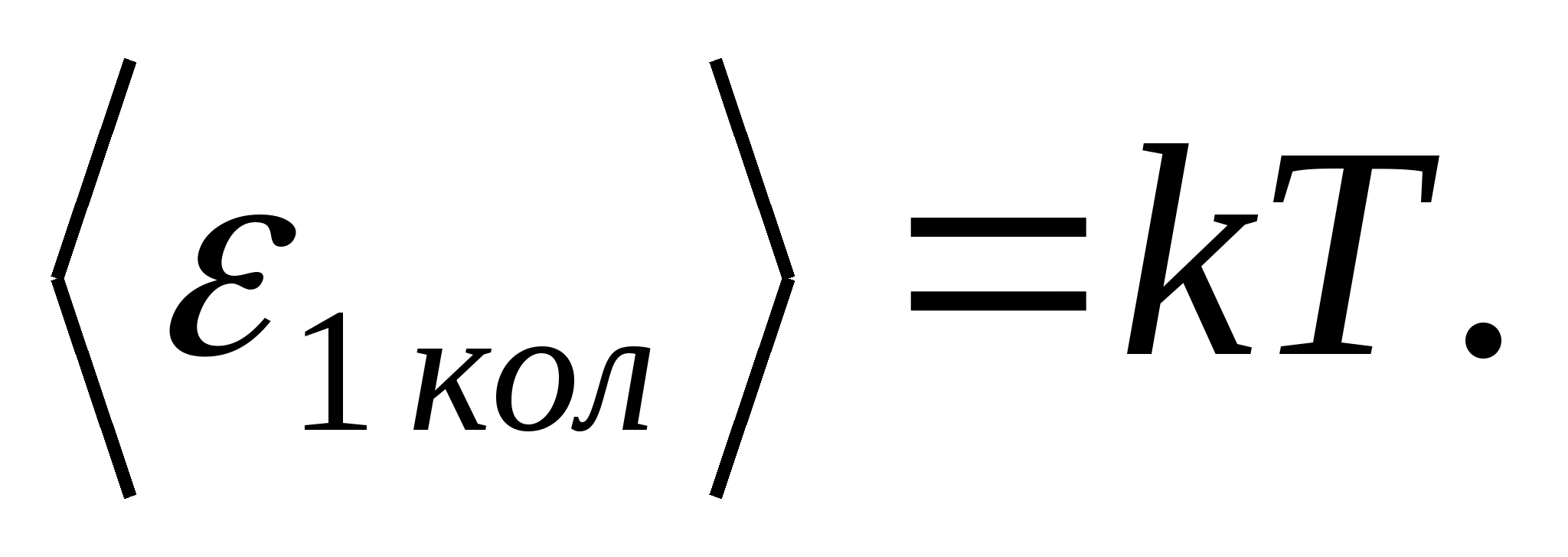
وبالتالي ، متوسط طاقة الجزيء
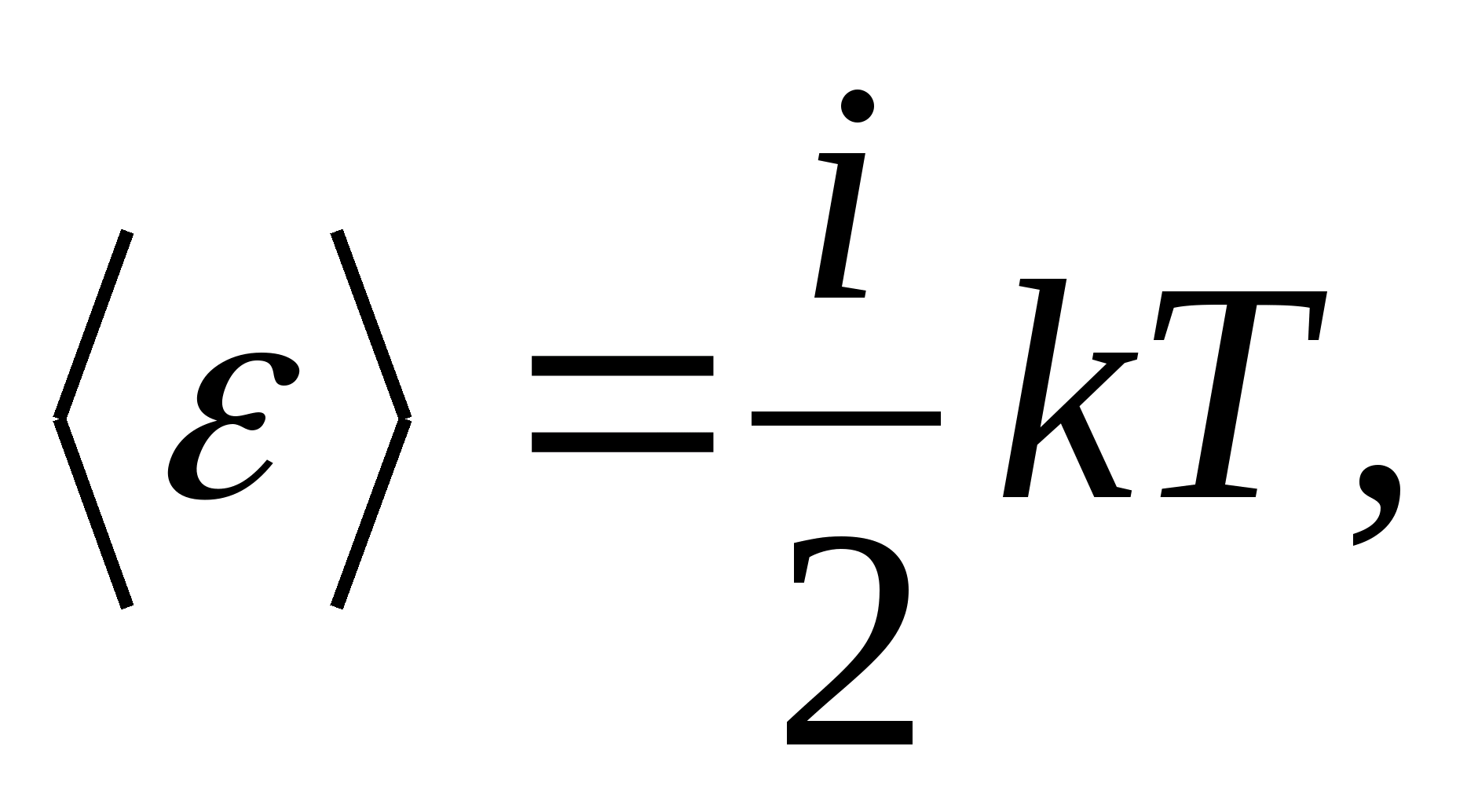
أين أناهو مجموع عدد متعدية ، عدد الدوران ومضاعفة عدد درجات الحرية الاهتزازية للجزيء:
![]()
على سبيل المثال ، متوسط الطاقة الحركية لجزيئات الغاز المثالية أحادية الذرة ( 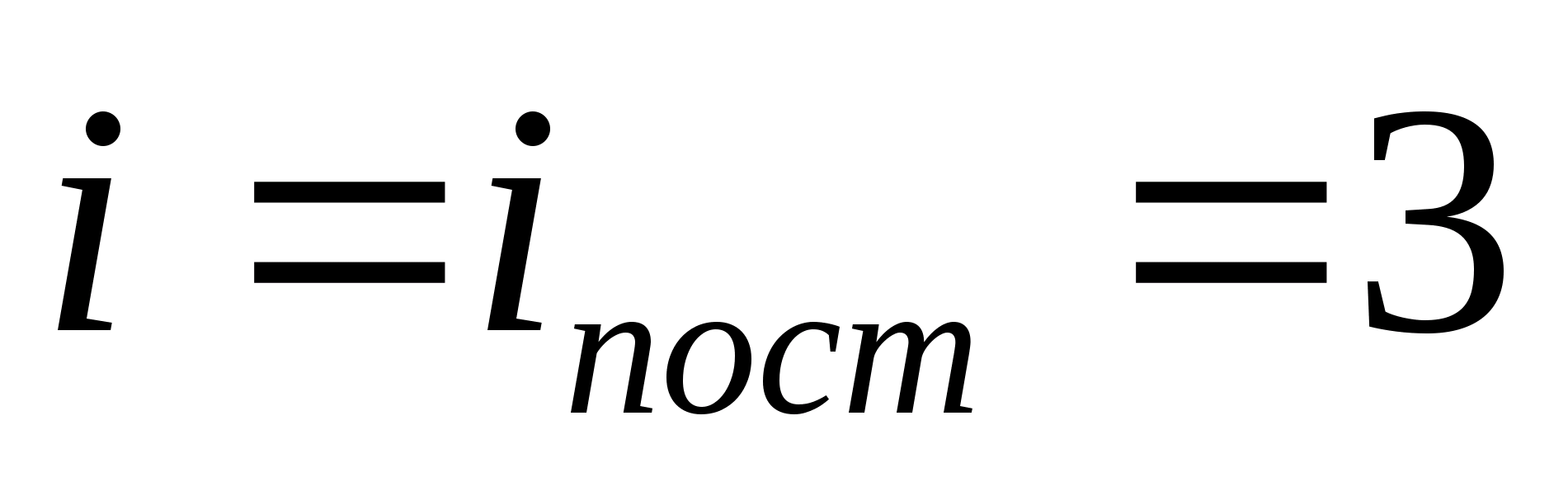 ) مساوي ل
) مساوي ل
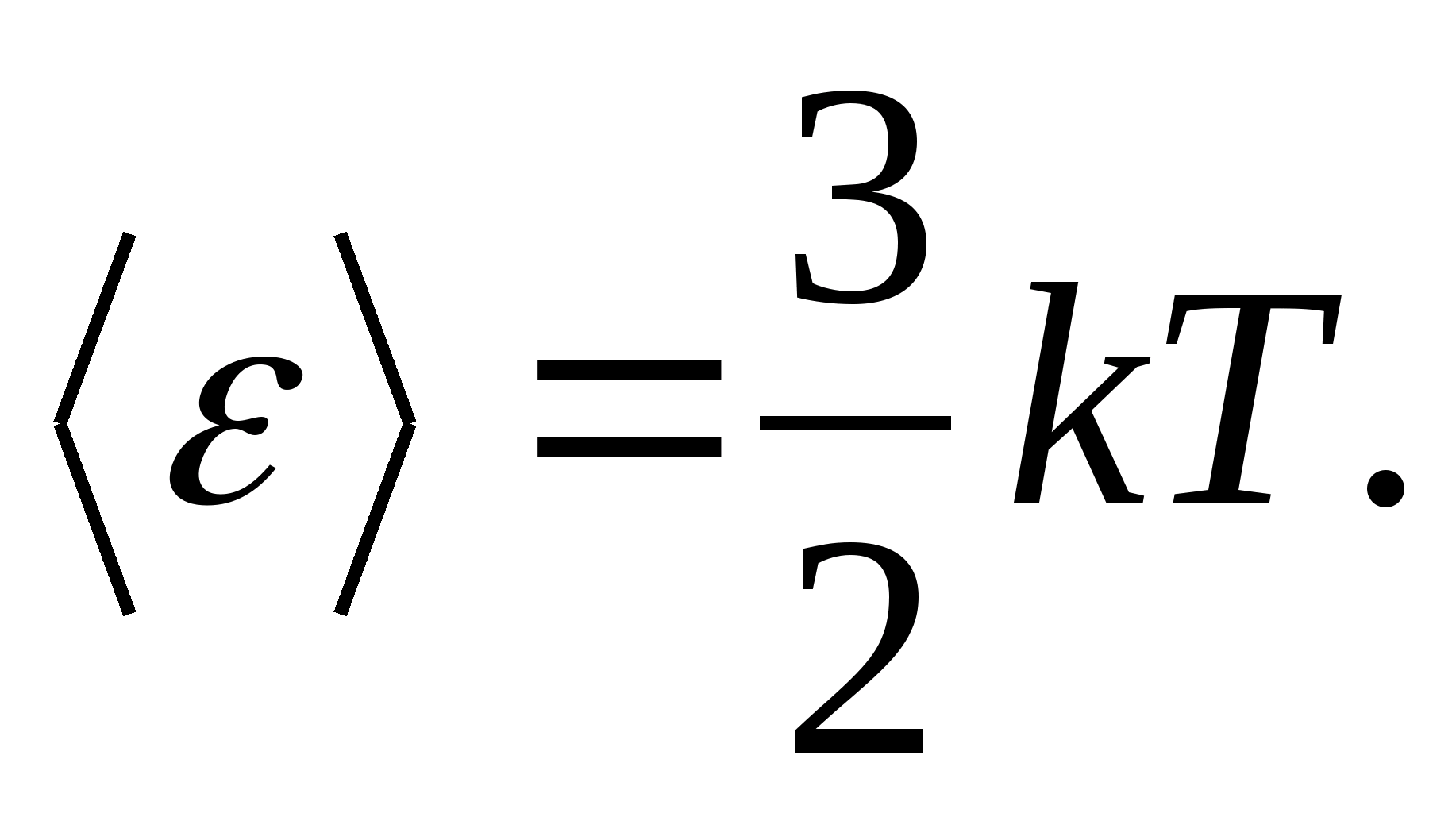
مثل عارضات ازياءلجسم صلب ، ضع في اعتبارك شبكة بلورية تم إنشاؤها بشكل صحيح ، حيث يتم أخذ الجسيمات (الذرات والأيونات والجزيئات) على أنها نقاط مادية، تتأرجح حول مواضع توازنها - عقد شعرية -في ثلاثة اتجاهات متعامدة بشكل متبادل. وبالتالي ، يتم تخصيص ثلاث درجات اهتزازية من الحرية لكل جسيم يشكل الشبكة البلورية ، ولكل منها ، وفقًا لقانون التوزيع المنتظم للطاقة على درجات الحرية ، الطاقة كيلو ت.
ثم متوسط قيمة الطاقة الإجمالية للجسيم أثناء الحركة التذبذبية في الشبكة البلورية
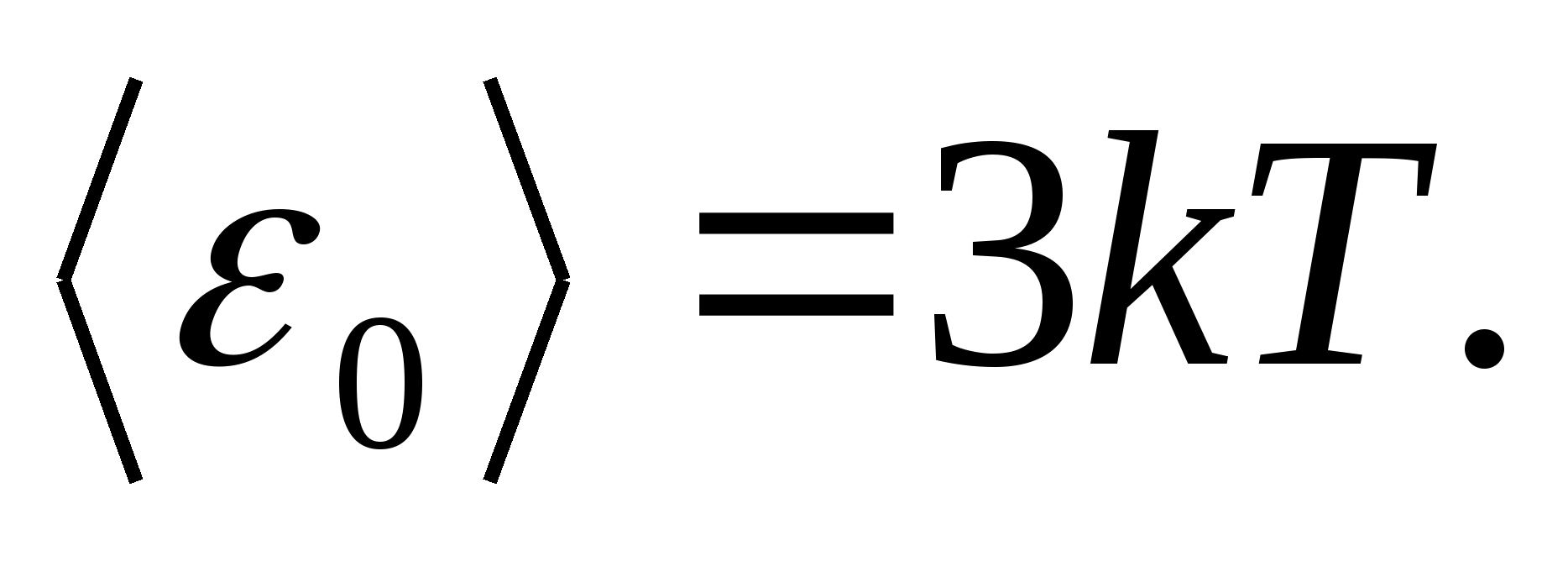
يتم الحصول على إجمالي الطاقة الداخلية لمول واحد من الجسم الصلب بضرب متوسط الطاقة لجسيم واحد في عدد الجسيمات المهتزة بشكل مستقل الموجودة في مول واحد ، أي إلى ثابت أفوجادرو ن أ :
أين ص = ن أ كهو ثابت الغاز العالمي (المولي) ، ص = 8.31 جول / (مول كلفن).
بالنسبة للمواد الصلبة ، نظرًا لصغر معامل التمدد الحراري ، فإن السعات الحرارية عند الضغط الثابت والحجم الثابت لا تختلف عمليًا. لذلك ، مع الأخذ في الاعتبار (8.1) ، السعة الحرارية المولية لمادة صلبة
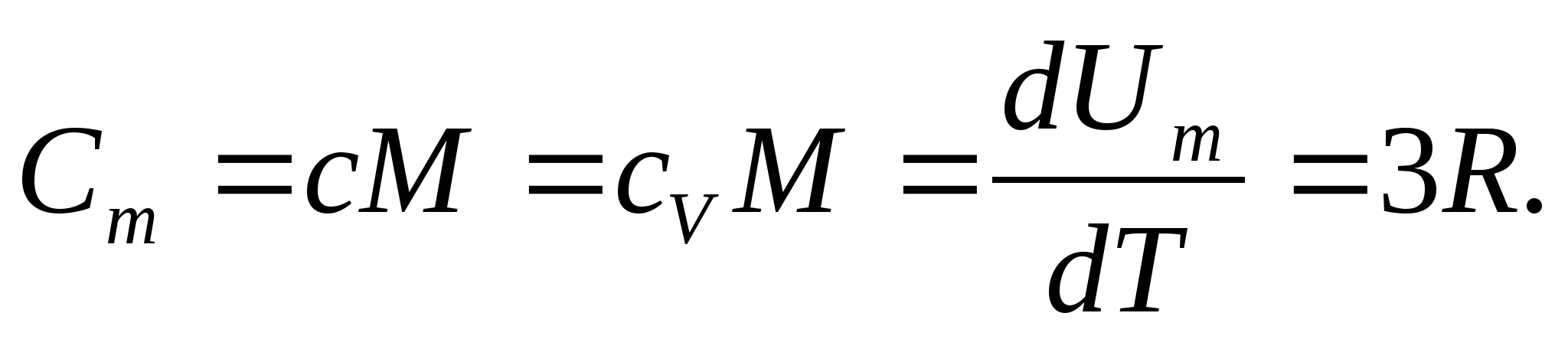 (8.2)
(8.2)
باستبدال القيمة العددية لثابت الغاز المولي ، نحصل على:
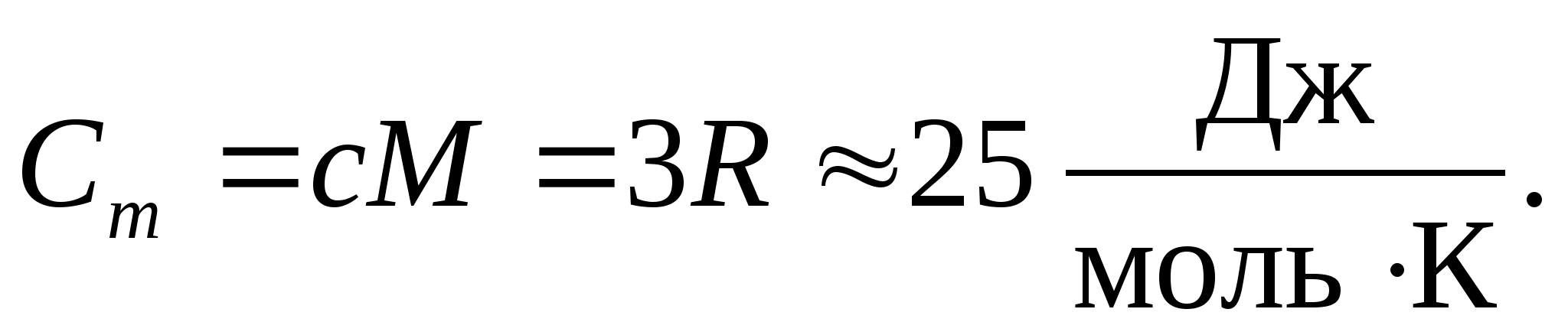
تحمل هذه المساواة تقريبًا جيدًا إلى حد ما للعديد من المواد في درجة حرارة الغرفة ويسمى قانون Dulong و Petit : السعة الحرارية المولية لجميع البلورات البسيطة كيميائيا المواد الصلبةيساوي تقريبًا 25 جول / (مول ل). مع انخفاض درجة الحرارة ، تنخفض السعات الحرارية لجميع المواد الصلبة ، وتقترب من الصفر في تي0. بالقرب من الصفر المطلق ، تتناسب السعة الحرارية المولية لجميع الأجسام مع T 3 ، وفقط عند درجة حرارة عالية بما فيه الكفاية مميزة لكل مادة تبدأ المساواة (8.2) في الصمود. يمكن تفسير هذه الميزات للقدرات الحرارية للمواد الصلبة في درجات حرارة منخفضة باستخدام نظرية الكم للسعة الحرارية التي أنشأها أينشتاين وديباي.
لتحديد السعة الحرارية بشكل تجريبي ، يتم وضع الجسم قيد الدراسة في جهاز قياس السعرات الحرارية ، والذي يتم تسخينه بواسطة تيار كهربائي. إذا كانت درجة حرارة المسعر بعينة الاختبار تزداد ببطء شديد من البداية تي 0 إلى تي، ثم يتم استخدام طاقة التيار الكهربائي لتسخين العينة والمسعر:
أين أناو يو- تيار السخان والجهد ؛ - وقت التسخين م 0 و مهي كتل المسعر وعينة الاختبار ، مع 0 و مع- السعات الحرارية النوعية للمسعر وعينة الاختبار ، س- فقدان الحرارة للعزل الحراري للمسعر وللفضاء المحيط.
لاستبعاد كمية الحرارة المنفقة على تسخين المسعر وفقدان الحرارة إلى المساحة المحيطة من المعادلة (8.3) ، من الضروري ، بنفس قوة السخان ، تسخين المسعر الفارغ (بدون عينة) من درجة الحرارة الأولية تي 0 لنفس فرق درجة الحرارة تي. سيكون فقدان الحرارة في كلتا الحالتين متماثلًا تقريبًا وصغير جدًا ، إذا كانت درجة حرارة الغلاف الواقي للمسعر في كلتا الحالتين ثابتة وتساوي درجة حرارة الغرفة:
المعادلتان (8.3) و (8.4) تدلان على ذلك
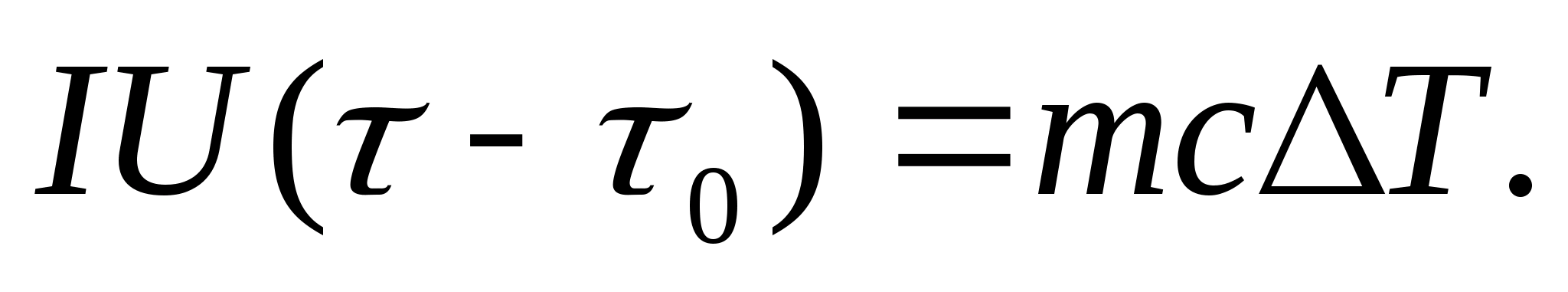 (8.5)
(8.5)
يمكن استخدام المعادلة (8.5) لتحديد السعة الحرارية النوعية لمادة عينة الاختبار بشكل تجريبي. من خلال تغيير درجة حرارة المسعر ، من الضروري تحديد اعتماد الاختلاف في وقت التسخين على التغير في درجة حرارة عينة الاختبار: (
−
0)=F(تي) حسب المعامل الزاوي الذي 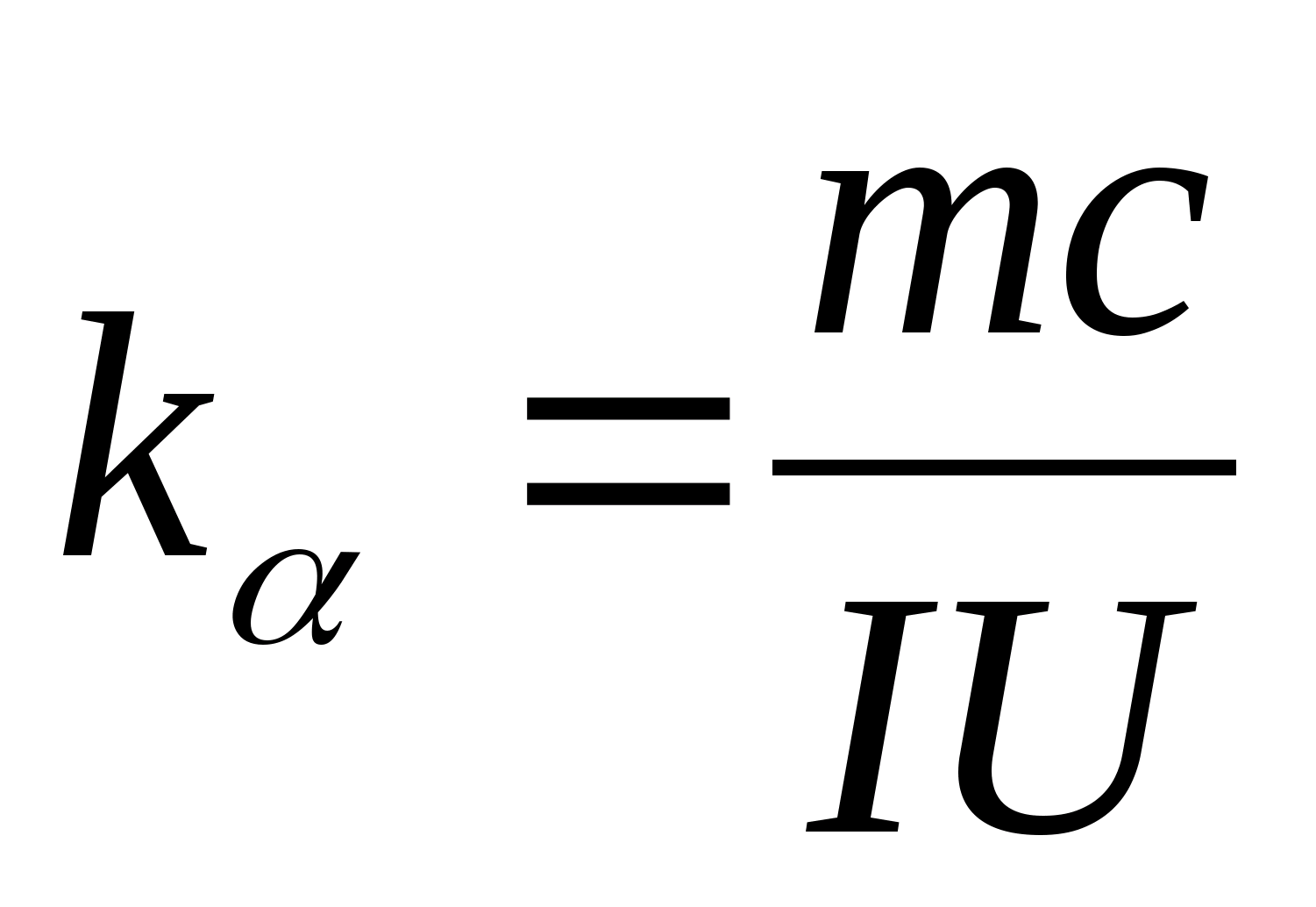 يمكن تحديد السعة الحرارية المحددة للعينة.
يمكن تحديد السعة الحرارية المحددة للعينة.
وصف تجهيزات المختبر
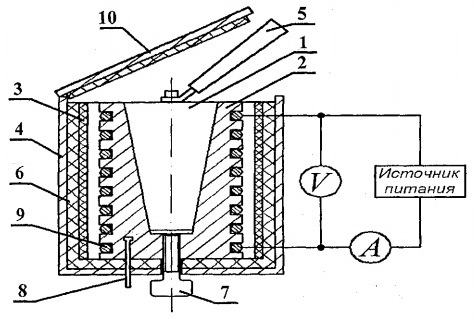
لتحديد السعة الحرارية للمواد الصلبة ، تم تصميم الإعداد التجريبي FPT1-8 ، ويظهر الشكل العام في الشكل. 8.1 يتكون التركيب من ثلاثة أجزاء رئيسية: وحدة الأدوات 1 ووحدة عنصر التشغيل 2 والرف 3.
يوجد على اللوحة الأمامية لوحدة التحكم 1: مفتاح تبديل "NETWORK" ، الذي يربط الوحدة بشبكة جهد الإمداد ؛ تبديل مفتاح "التسخين" ، الذي يشغل السخان ؛ منظم "التسخين" ، الذي يتم بموجبه تنظيم طاقة السخان ؛ الفولتميتر ومقياس التيار الكهربائي ، اللذان يقيسان الجهد والتيار في دائرة السخان ؛ ساعة توقيت ، والتي تقيس وقت تسخين المسعر. يتم تنشيط ساعة الإيقاف عند تشغيل وحدة العدادات.
يتم إغلاق كتلة عنصر العمل 2 أمام شاشة قابلة للإزالة من المؤسسة. زجاج. عند القيام بالعمل ، يتم تعليق الشاشة على الجدار الخلفي لكتلة عنصر العمل. على كتلة لوحة عنصر العمل يوجد مقياس حرارة رقمي 6 لقياس درجة الحرارة. في الأسفل ، في الأعشاش ، توجد 5 عينات اختبار مصنوعة من مواد مختلفة ومقبض لوضع العينات في المدفأة.
يتكون السخان 4 من غلاف معدني ومادة عازلة للحرارة ومسعر.

يتم تسخين العينات في المسعر ، ويظهر مخططها في الشكل. 8.2
المسعر عبارة عن علبة نحاسية 2 بفتحة مخروطية ، حيث يتم إدخال عينة الاختبار 1. على السطح الخارجي للعلبة ، يتم وضع ملف تسخين 9 في أخاديد خاصة. في الخارج ، يتم عزل علبة المسعر حراريًا بطبقات من الأسبستوس 3 والألياف الزجاجية 6 ومغلقة بغلاف من الألومنيوم 4. يتم إغلاق المسعر بغطاء عازل للحرارة 10. بعد انتهاء التجربة ، يمكن إخراج العينة من الفتحة المخروطية في جسم المسعر بمساعدة المسمار 7. لإزالة العينة المسخنة من المسعر وتركيب العينة في السخان ، يتم استخدام المقبض 5 ، الموجود في مقبس خاص بجوار العينات قيد الدراسة.
يتم قياس درجة حرارة المسعر بواسطة مقياس حرارة رقمي ، يوجد مستشعر درجة الحرارة 8 منه في السكن 2 من المسعر.
أمان
عند أداء العمل ، يتم مراعاة متطلبات السلامة العامة في مختبر الميكانيكا.
أمر العمل
انتباه!يستغرق المسعر وقتًا طويلاً حتى يبرد ، لذلك بعد قياس كل قيم الوقت 0 تسخين مسعر فارغ ، قم بإيقاف التسخين على الفور (انظر النقطة 4 أدناه). أقصى درجة حرارة للتدفئة لهذه الوحدة هي + 44 درجة مئوية.
1. قم بإزالة الغطاء الشفاف لوحدة عنصر العمل للتركيب وقم بتعليقه على مسامير اللوحة الخلفية. اضبط مقبض التحكم في الحرارة على الحد الأدنى. قم بتشغيل التثبيت باستخدام مفتاح تبديل "NETWORK".
2. أغلق الغطاء بإحكام على المسعر الفارغ. قم بتشغيل مفتاح التبديل "HEAT". باستخدام منظم الحرارة ، اضبط الجهد على 10-20 فولت (كلما زاد الجهد ، زادت سرعة التسخين). اكتب في الجدول. 8.1 قيم الجهد المحددة يووالحالية أنا.
3. ابتداء من درجة حرارة المسعر ر 0 محدد من قبل المعلم ، بعد فاصل 1С أدخل في الجدول. 8.1 قيم الوقت 0 مطابق لكل درجة حرارة تم الوصول إليها ر.
4. قم بإيقاف تشغيل مفتاح التبديل "HEAT" ، وافتح الغطاء وقم بتبريد المسعر لدرجة الحرارة الأولية ر 0. لتبريد المسعر بسرعة ، يمكنك خفض إحدى العينات في المسعر ، باستثناء النموذج الذي أشار إليه المعلم (عند تثبيت العينة في المسعر ، قم بتدوير المسمار الموجود أسفل المسعر إلى اليسار). ستبدأ درجة الحرارة في الانخفاض. عندما ينخفض معدل التبريد ، أخرج العينة المسخنة وأدخل العينة التالية (الباردة) ، باستثناء العينة التي أشار إليها المعلم. لإزالة العينة ، قم بتدوير البرغي الموجود في الجزء السفلي من المسعر إلى اليمين (في اتجاه عقارب الساعة) ، ثم اسحب العينة للخارج بالمقبض.
الجدول 8.1
|
تي= ر− ر 0 , |
= − 0 , |
J / (kgK) |
ج م =معم, J / (مول كلفن) |
||||||||
5. أدر المسمار إلى اليسار ، ضع إحدى عينات الاختبار المأخوذة وفقًا لتعليمات المعلم في جهاز قياس السعرات الحرارية. أغلق غطاء المسعر بإحكام وانتظر 2-3 دقائق حتى يتساوى المسعر وعينة الحرارة.
6. قم بتشغيل مفتاح التبديل "HEAT" واضبط نفس الجهد في الدائرة كما هو الحال عند تسخين المسعر الفارغ.
7. البدء من نفس درجة حرارة المسعر الأولي ر 0 ، بعد فترة 1С أدخل في الجدول. 8.1 قيم الوقت المقابلة لكل درجة حرارة تم الوصول إليها ر.
8. اضبط منظم "HEATING" على أقصى الموضع الأيسر (إلى الحد الأدنى) ، وأوقف تشغيل مفتاح التبديل "HEATING" ، وافتح غطاء جهاز قياس السعرات الحرارية. لإزالة العينة من المسعر ، قم بتدوير البرغي إلى اليمين ، ثم قم بإزالة العينة الساخنة باستخدام المقبض.
9. قم بإيقاف تشغيل الوحدة باستخدام مفتاح تبديل "NETWORK".
10. ترجمة جميع قيم الكميات 0 و إلى قيم بالثواني (بدون دقائق) وأدخلها في الجدول. 8.1 لكل سطر من الجدول. 8.1 احسب قيم = − 0 و تي= ر− ر 0 .
11. قم بعمل حساب تقديري للسعة الحرارية النوعية للعينة باستخدام الصيغة 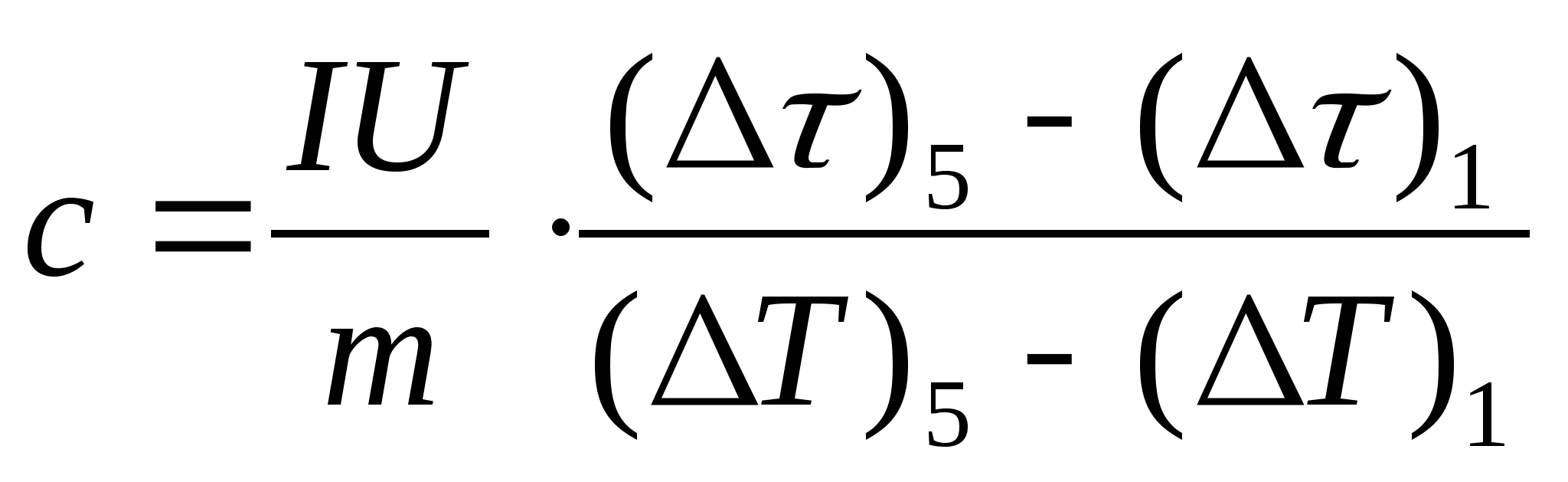 ، حيث كتلة العينة م= 139.5 جم (نحاس) أو م= 129.7 جم (فولاذ) أو
م= 46.05 جرام (دورالومين). تعال إلى المعلم للتحقق.
، حيث كتلة العينة م= 139.5 جم (نحاس) أو م= 129.7 جم (فولاذ) أو
م= 46.05 جرام (دورالومين). تعال إلى المعلم للتحقق.
نتائج القياس المعالجة
1. مؤامرة
= و(تي) اعتماد الاختلاف في زمن تسخين المسعر مع العينة والمسعر الفارغ على تغير درجة حرارة المسعر ، حدد أي نقطتين على الرسم البياني وحدد ميل الخط المستقيم باستخدام الصيغة 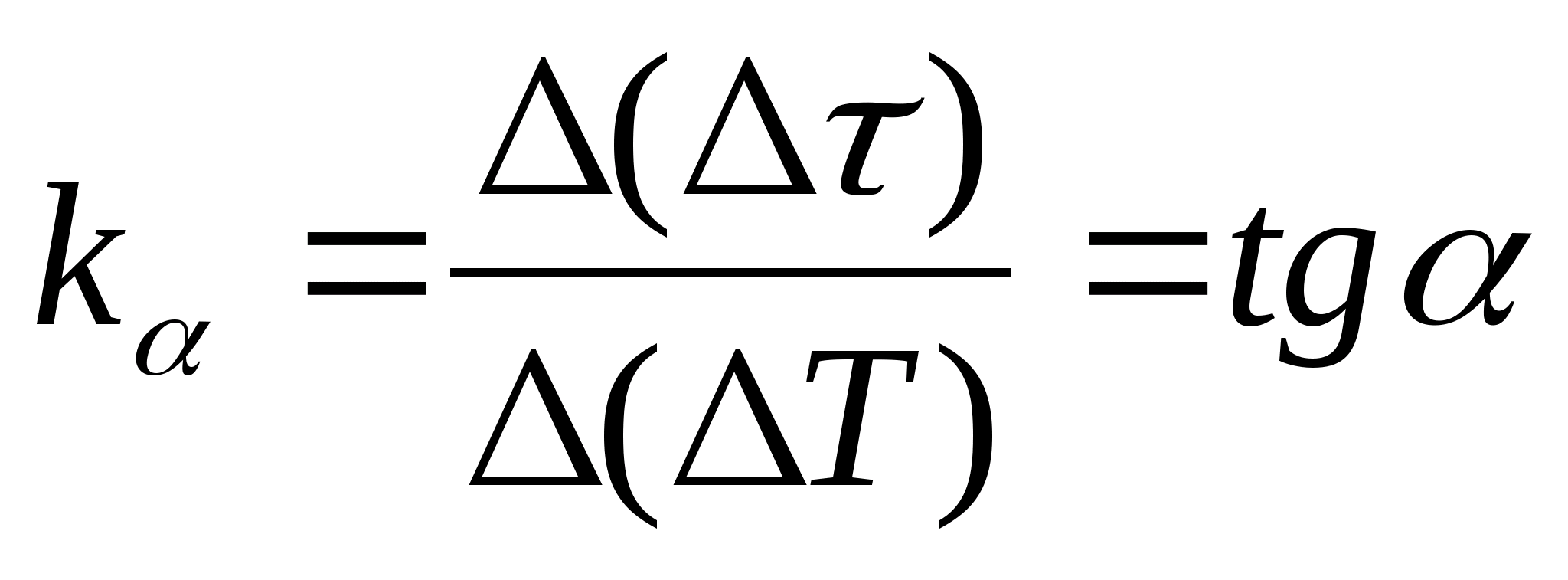 ، أين
- زاوية ميل الرسم البياني للمحور تي
(إذا كانت وحدات
و تيتظهر على كلا المحورين كأجزاء من نفس الطول).
، أين
- زاوية ميل الرسم البياني للمحور تي
(إذا كانت وحدات
و تيتظهر على كلا المحورين كأجزاء من نفس الطول).
2. باستخدام قيمة المنحدر ك
، تحديد السعة الحرارية المحددة للعينة باستخدام الصيغة 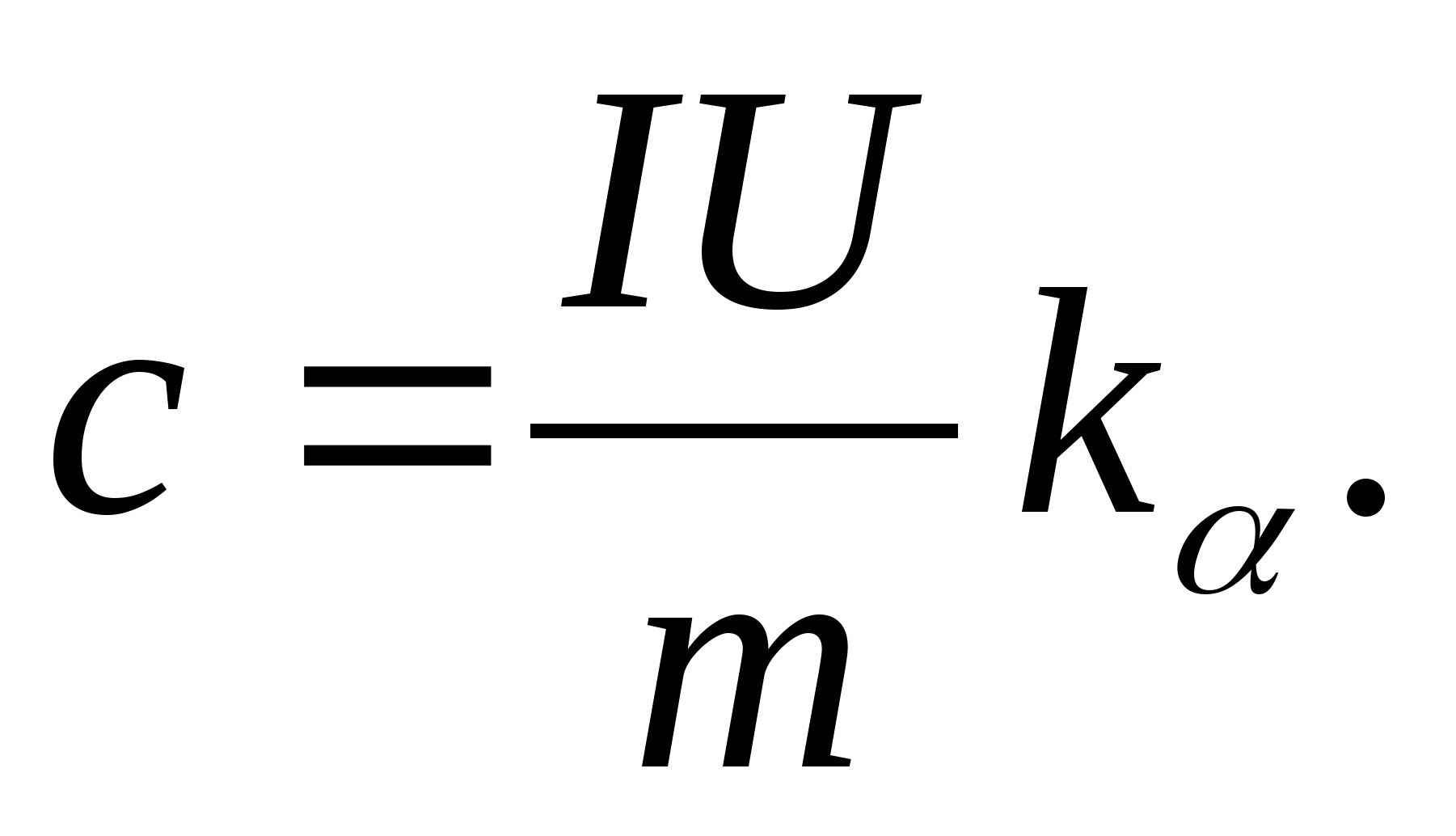
3. باستخدام البيانات الواردة في الجدول 8.2 (أو الجدول الدوري) ، حدد السعة الحرارية المولارية للعينة باستخدام الصيغة ج م =معم.
الجدول 8.2
|
مواد العينة |
الكتلة الذرية ، كجم / مول |
|
كنموذج لجسم صلب ، دعونا نفكر في شبكة بلورية مبنية بشكل صحيح ، حيث تتأرجح الجسيمات (الذرات والأيونات والجزيئات) ، التي تؤخذ كنقاط مادية ، حول مواضع توازنها - العقد الشبكية - في ثلاثة اتجاهات متعامدة بشكل متبادل . وبالتالي ، يتم تخصيص ثلاث درجات اهتزازية من الحرية لكل جسيم يشكل الشبكة البلورية ، ولكل منها ، وفقًا لقانون تقسيم الطاقة على درجات الحرية (انظر الفقرة 50) ، الطاقة كيلو ت.
الطاقة الداخلية لجسم صلب
U م \ u003d 3N ألف كيلو طن \ u003d 3RT ،
حيث N A هو ثابت أفوجادرو ؛ نأ ك= ص (ص هو ثابت الغاز المولي).
السعة الحرارية المولية لمادة صلبة
أي السعة الحرارية المولية (الذرية) أجسام بسيطة كيميائيافي الحالة البلورية هو نفسه (يساوي 3 ص) ولا تعتمد على درجة الحرارة. تم الحصول على هذا القانون تجريبيًا من قبل العالمين الفرنسيين P. Dulong (1785-1838) و L. Petit (1791-1820) وهو اسمقانون Dulong و Petit.
إذا كانت المادة الصلبة مركبًا كيميائيًا (على سبيل المثال ، NaCl) ، فإن عدد الجسيمات في الخلد لا يساوي ثابت Avogadro ، ولكنه يساوي nNأ , أين ن - عدد الذرات في الجزيء (بالنسبة لكلوريد الصوديوم ، يكون عدد الجسيمات في الخلد 2 نوهكذا ، يحتوي مول واحد من كلوريد الصوديوم على ذرات NA Na و N A Cl الذرات). لذا فإن السعة الحرارية المولية مركبات كيميائية صلبة
C V = 3R25n J / (مول K) ،
أي يساوي مجموع السعات الحرارية الذرية للعناصر التي يتكون منها هذا المركب.
كما تظهر البيانات التجريبية (الجدول 4) ، بالنسبة للعديد من المواد ، يرضى قانون Dulong و Petit بتقريب جيد إلى حد ما ، على الرغم من أن بعض المواد (C ، Be ، B) لها انحرافات كبيرة عن السعات الحرارية المحسوبة. بالإضافة إلى ذلك ، كما في حالة الغازات (انظر الفقرة 53) ، أظهرت التجارب على قياس السعة الحرارية للمواد الصلبة في درجات حرارة منخفضة أنها تعتمد على درجة الحرارة (الشكل 113). بالقرب من الصفر كلفن ، تتناسب السعة الحرارية للأجسام مع T 3 ، وفقط عند درجات حرارة عالية بما فيه الكفاية ، مميزة لكل مادة ، يتم استيفاء الحالة (73.1). الماس ، على سبيل المثال ، لديه سعة حرارية 3 ص عند 1800 كلفن! ومع ذلك ، بالنسبة لمعظم المواد الصلبة ، تكون درجة حرارة الغرفة مرتفعة بالفعل بدرجة كافية.
تم حساب التناقض بين القيم التجريبية والنظرية للقدرات الحرارية المحسوبة على
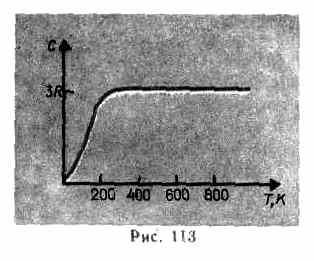
أسس النظرية الكلاسيكية ، كما أوضح ، بناءً على نظرية الكم للسعات الحرارية ، أ. أينشتاين وبي. ديباي (1884-1966).
§ 74. التبخر والتسامي والذوبان والتبلور. أجسام غير متبلورة
في كل من السوائل والمواد الصلبة ، يوجد دائمًا عدد معين من الجزيئات التي تكفي طاقتها للتغلب على الانجذاب إلى الجزيئات الأخرى والتي تكون قادرة على الانفصال عن سطح سائل أو صلب وتنتقل إلى الفضاء المحيط بها. تسمى هذه العملية للسائل تبخر(أو تبخير)،للمواد الصلبة - تسامي(أو تسامي).
يحدث تبخر السوائل في أي درجة حرارة ، ولكن تزداد شدته مع زيادة درجة الحرارة. جنبا إلى جنب مع عملية التبخر ، يتم إجراء عملية تعويض تركيزبخار إلى سائل. إذا كان عدد الجزيئات التي تترك السائل لكل وحدة زمنية عبر سطح الوحدة يساوي عدد الجزيئات التي تمر من بخار إلى سائل ، إذن توازن ديناميكيبين عمليات التبخر والتكثيف. يسمى بخار في حالة توازن مع سائلها ثري(انظر أيضا § 62).
بالنسبة لمعظم المواد الصلبة ، تكون عملية التسامي في درجات الحرارة العادية ضئيلة وضغط البخار على سطح المادة الصلبة منخفض ؛ يزداد مع زيادة درجة الحرارة. يتم تسامي المواد بشكل مكثف مثل النفثالين والكافور ، والتي يتم الكشف عنها برائحة حادة مميزة. يحدث التسامي بشكل مكثف بشكل خاص في الفراغ - ويستخدم هذا في صنع المرايا. أحد الأمثلة المعروفة على التسامي هو تحويل الجليد إلى بخار - يجف الغسيل الرطب في البرد.
إذا تم تسخين جسم صلب ، فعندئذٍ الطاقة الداخلية(مجموع طاقة اهتزازات الجسيمات في مواقع الشبكة وطاقة تفاعل هذه الجسيمات) يزداد. مع ارتفاع درجة الحرارة ، اتساع اهتزازات الجسيمات
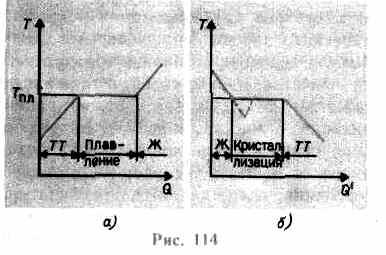
يزداد حتى تنهار الشبكة البلورية - تذوب المادة الصلبة. على التين. 114 أيظهر تبعية تقريبية تي(س), أين س- كمية الحرارة التي يتلقاها الجسم أثناء الذوبان. كرسالة صلبة دفء الجسمترتفع درجة حرارتها وعند نقطة الانصهار تييبدأ رر انتقال الجسم من الحالة الصلبة إلى الحالة السائلة. درجة حرارة تيرر تظل ثابتة حتى تذوب البلورة بأكملها ، وعندها فقط تبدأ درجة حرارة السائل في الارتفاع مرة أخرى.
تسخين مادة صلبة تصل إلى تيرر لا تحوله بعد إلى حالة سائلة ، لأن طاقة جسيمات المادة يجب أن تكون كافية لتدمير الشبكة البلورية. في عملية الذوبان ، تُستخدم الحرارة المنقولة إلى المادة لأداء عمل على تدمير الشبكة البلورية ، وبالتالي T pl = const حتى تذوب البلورة بأكملها. ثم ستعود الحرارة الموردة مرة أخرى لزيادة طاقة جزيئات السائل وستبدأ درجة حرارته في الارتفاع. كمية الحرارة المطلوبة لإذابة 1 كجم من المادة تسمى حرارة محددة للانصهار.
إذا تم تبريد السائل ، فإن العملية تستمر في الاتجاه المعاكس (الشكل 114 ، ب ؛ س" - مقدار الحرارة المنبعثة من الجسم أثناء التبلور): أولاً ، تنخفض درجة حرارة السائل ، ثم عند درجة حرارة ثابتة تساوي T pl ، تبدأ بلورة،بعد اكتمالها ، تبدأ درجة حرارة البلورة في الانخفاض. لتبلور مادة ما يسمى وجود مراكز التبلور -النوى البلورية ، والتي لا يمكن أن تكون فقط بلورات من المادة المشكلة ، ولكن أيضًا شوائب ، بالإضافة إلى الغبار والسخام ، وما إلى ذلك. يؤدي عدم وجود مراكز التبلور في سائل نقي إلى صعوبة تكوين البلورات المجهرية والمادة ، يبقى في حالة سائلة ، يبرد إلى درجة حرارة أقل من درجة حرارة التبلور ، وبالتالي يتشكل سائل فائق التبريد(في 114 ، b يتوافق مع المنحنى المتقطع). مع التبريد الفائق القوي ، يبدأ التكوين التلقائي لمراكز التبلور وتتبلور المادة بسرعة إلى حد ما.
عادةً ما يحدث التبريد الفائق للذوبان من الكسور إلى عشرات الدرجات ، ولكن بالنسبة لعدد من المواد يمكن أن يصل إلى مئات الدرجات. بسبب اللزوجة العالية ، تفقد السوائل شديدة البرودة سيولتها ، وتحتفظ بشكلها مثل المواد الصلبة. هذه الهيئات تسمى مواد صلبة غير متبلورةوتشمل هذه الراتنجات والشمع وشمع الختم والزجاج. أجسام غير متبلورة ، كونها سوائل فائقة التبريد ، متماثل،أي خصائصهم هي نفسها في جميع الاتجاهات ؛ بالنسبة لهم ، وكذلك بالنسبة للسوائل ، فهي مميزة ترتيب قصير المدىفي ترتيب الجسيمات. فيها ، على عكس السوائل ، تكون حركة الجسيمات صغيرة نوعًا ما. من سمات الأجسام غير المتبلورة أنها لا تحتوي على نقطة انصهار محددة ، أي أنه من المستحيل الإشارة إلى درجة حرارة معينة يمكن فوقها التأكد من الحالة السائلة ، وتحت الحالة الصلبة. من المعروف من التجربة أنه في الأجسام غير المتبلورة يمكن ملاحظة عملية التبلور بمرور الوقت ، على سبيل المثال ، تظهر البلورات في الزجاج ؛ يبدأ ، بفقدان الشفافية ، في أن يصبح غائما ويتحول إلى جسم متعدد الكريستالات.
في الآونة الأخيرة ، استخدم على نطاق واسع في اقتصاد وطنييملك البوليمرات- أجسام عضوية غير متبلورة ، تتكون جزيئاتها من عدد كبير من السلاسل الجزيئية الطويلة المتطابقة المتصلة بواسطة روابط كيميائية (تكافؤ). تشمل البوليمرات كلاً من المواد العضوية الطبيعية (النشا والبروتين والمطاط والألياف وما إلى ذلك) والاصطناعية (البلاستيك والمطاط والبوليسترين واللافسان والنايلون وما إلى ذلك). البوليمرات هي قوة ومرونة متأصلة ؛ بعض البوليمرات تتحمل التمدد 5-10 أضعاف طولها الأصلي. ويفسر ذلك حقيقة أن السلاسل الجزيئية الطويلة يمكن ، تحت التشوه ، إما أن تنثني إلى كرات كثيفة أو تمتد إلى خطوط مستقيمة. تتجلى مرونة البوليمرات فقط في نطاق درجة حرارة معينة ، والتي تحتها تصبح صلبة وهشة ، وفوقها - بلاستيكية. على الرغم من إنشاء الكثير من المواد البوليمرية الاصطناعية (الألياف الاصطناعية وبدائل الجلد ومواد البناء وبدائل المعادن وما إلى ذلك) ، إلا أن نظرية البوليمرات لم يتم تطويرها بالكامل بعد. يتم تحديد تطورها من خلال متطلبات التكنولوجيا الحديثة ، والتي تتطلب تخليق البوليمرات ذات الخصائص المحددة مسبقًا.
تُفهم السعة الحرارية النوعية لمادة ما على أنها القيمة
, (1)
أين كمية الحرارة المنقولة إلى الجسم.
هو التغير في درجة الحرارة الذي يحدث في
نتيجة انتقال الحرارة إلى الجسم ،
م هي كتلة الجسم الساخن.
عادة ما تحدد الخبرة المتوسط حرارة نوعيةمادة ج ، مساوية عدديًا لكمية الحرارة التي يجب نقلها إلى وحدة كتلة من هذه المادة من أجل رفع درجة حرارتها عن طريق:
(2),
أين هو الفرق بين درجات الحرارة النهائية والأولية للجسم قيد الدراسة.
تُستخدم طرق قياس السعرات الحرارية المختلفة لتحديد السعة الحرارية بشكل تجريبي. تنوع هذه الأساليب يرجع إلى حقيقة أن القياس الدقيق لكمية الحرارة المنقولة إلى الجسم يتطلب التخلص من فقدان الحرارة الذي لا يؤخذ في الاعتبار عند تسخين الجسم قيد الدراسة.
عادةً ، في ما يسمى بالمُسعرات ذات الغلاف المتساوي الحرارة ، يتم إدخال تصحيح محسوب أو مُحدد تجريبيًا للإشعاع ، أي كمية الحرارة التي يتلقاها المسعر أو ينبعث منها إلى البيئة الخارجية عن طريق الإشعاع أثناء التجربة.
ومع ذلك ، من الممكن تقليل فقد الحرارة بشكل كبير عن طريق إدخال عزل حراري جيد أو عن طريق تقليل مدة التجربة ، والتي يتم تحقيقها من خلال معدل تسخين مرتفع للعينة ~ (طريقة النبض لقياس السعة الحرارية) ، حيث يتم فقدان الحرارة صغيرة مقارنة بالكمية الإجمالية للحرارة المزودة.
من أكثر الطرق دقة لتحديد السعة الحرارية طريقة المسعر الحراري. يتم التخلص من الصعوبات المرتبطة بالحاجة إلى مراعاة فقد الحرارة في المسعرات من هذا النوع من خلال حقيقة أن القياسات تتم في ظل ظروف التوازن الحراري ، أي في ظل ظروف درجات حرارة متساوية للعينة قيد الدراسة والكتلة المحيطة بالعينة . تشمل مزايا هذه الطريقة ، إلى جانب الدقة العالية ، إمكانية تحديد السعة الحرارية للمواد الصلبة في نطاق درجات حرارة واسع ، وهو أمر مهم بشكل خاص إذا خضعت المواد لتحولات طورية.
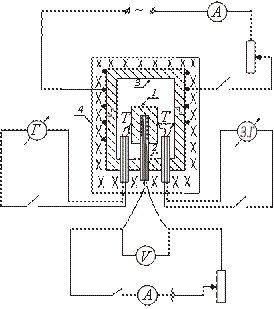
يظهر جهاز أحد أنواع المسعر الحراري بشكل تخطيطي في الشكل. يتم وضع عينة الاختبار 1 في الكتلة النحاسية 3 ويتم تسخينها معها في الفرن 4. يتم إدخال السخان 2 داخل العينة ، مما يسمح بتسخين إضافي للعينة.
بعد تشغيل الفرن 4 ، حيث يتم وضع الكتلة مع العينة ، تبدأ درجة حرارة العينة في الارتفاع ، وتبقى أقل من درجة حرارة الكتلة. لتحقيق المساواة بين درجات حرارة العينة والكتلة ، قم بتشغيل المدفأة الموضوعة داخل العينة. عندما تكون درجة حرارة العينة أعلى قليلاً من درجة حرارة الكتلة ، يتم إيقاف تشغيل السخان الداخلي.
بعد ذلك ، يتم تشغيل وإيقاف هذا السخان بشكل دوري ، بحيث يتم تسجيل اختلاف درجة الحرارة بين العينة والكتلة طوال الوقت.
في الوقت الذي تساوي فيه الصفر (عندما يكون السخان الداخلي قيد التشغيل) ، لا يوجد تبادل حراري بين العينة والكتلة ، ويتم إنفاق كامل كمية الحرارة المنبعثة من السخان الداخلي فقط على تسخين العينة ؛ يمكن تحديد الحرارة النوعية في هذه الحالة بالصيغة (2).
يتم تحديد مقدار الحرارة المنبعثة من السخان الداخلي من خلال الصيغة:
أين أنا تيار السخان الداخلي ؛
V هو انخفاض الجهد عبره ؛
- الفترة الزمنية التي ارتفعت فيها درجة الحرارة بمقدار.
ثم
(4)
أين هو الوقت الذي تغيرت فيه درجة حرارة العينة.
في الشكل التفاضلي ، الصيغة (4) لها الشكل
(5)
يتم قياس درجة حرارة العينة بمزدوجة حرارية T. يتم قياس فرق درجة الحرارة بين الكتلة والعينة بمزدوجة حرارية تفاضلية. لتحديد درجة حرارة العينة ، يتم استخدام منحنى المعايرة الحرارية T. يتم تحديد فرق درجة الحرارة بين الكتلة والعينة في أقسام مقياس الجلفانومتر (لأنه من الضروري فقط تحديد اللحظة التي يكون فيها فرق درجة الحرارة بين الكتلة و علامة تغييرات العينة).
استكمال العمل.
توضع العينة على سخان يوضع داخل كتلة نحاسية. ترتبط الوصلات الحرارية T بالعينة والكتلة. الفرن مغلق بغطاء. يتم تشغيل الملف الكهربائي للفرن ، حيث يتم وضع الكتلة. يتم تشغيل وإيقاف السخان الموجود داخل العينة بشكل دوري ، ويتم تسجيل قيم I و V في دائرة السخان الداخلي.
قبل بدء القياسات ، من الضروري التحقق من الموضع الصفري لجلفانومتر المرآة. للقيام بذلك ، من خلال فصل المزدوج الحراري عن الجلفانومتر ، فإنهم يتوقعون أن يتوقف الأرنب عن التذبذب على طول المقياس. إذا لم تتطابق صورة الخيط بعد ذلك مع الصفر ، فعندئذٍ تتحقق هذه المصادفة بتحريك المقياس.
يتم رسم منحنيات التبعية لـ T وفي الوقت المحدد.
من منحدر المنحنى T (t) عند النقطة التي يتغير فيها الإشارة (أي عند إنشاء التوازن الحراري) ، يتم حساب الحرارة النوعية باستخدام الصيغة (5). تشير هذه السعة الحرارية إلى درجة الحرارة التي يجب قراءتها من المنحنى T (t) في اللحظة التي يوقع فيها اختلاف درجة الحرارة بين الكتلة وتغيير العينة.
