Cómo determinar la capacidad calorífica específica del agua. Gran enciclopedia de petróleo y gas.
INSTRUMENTOS Y ACCESORIOS: calorímetro, termómetro, balanza, cuerpos de prueba, vaso de precipitados (calibrado en gramos), calentador eléctrico.
– confirmar experimentalmente la validez de la ecuación del balance de calor;
– calcular las capacidades caloríficas específicas de los sólidos;
– organizar los resultados de las mediciones y los cálculos en forma de tabla;
– escriba sus sugerencias para mejorar la técnica de medidas y cálculos en este trabajo.
BREVE TEORÍA DE LA EXPERIENCIA
Uno de los conceptos físicos básicos de la termodinámica es la capacidad calorífica.
Capacidad calorífica del cuerpo. llamó cantidad física, numéricamente igual al calor, que debe comunicarse al cuerpo para cambiar su temperatura en 1 K en el proceso termodinámico considerado. Por otro lado, la capacidad calorífica de un cuerpo es igual a la relación entre el calor dQ impartido al cuerpo y el cambio dT en la temperatura del cuerpo en el proceso termodinámico bajo consideración:
La capacidad calorífica de un cuerpo depende de su composición química, la masa del cuerpo y su estado termodinámico, y también, como se puede ver en la definición, sobre el tipo de proceso de cambio del estado del cuerpo, en el que entra el calor dQ.
Propiedades termales Los cuerpos homogéneos se caracterizan por los valores de capacidad calorífica específica y molar (molar). La capacidad calorífica específica de una sustancia. llamada cantidad física Con, numéricamente igual al calor que debe impartirse a un kilogramo de una sustancia para cambiar su temperatura en 1 K en el proceso termodinámico en consideración. La capacidad calorífica de un cuerpo homogéneo se puede definir como el producto de la masa del cuerpo metro para la capacidad calorífica específica Con sus sustancias:
![]() o (2.2).
o (2.2).
Así, la relación entre dQ y dT para un cuerpo homogéneo tiene la forma:
capacidad calorífica molar la cantidad física C se llama, numéricamente igual al calor que se debe impartir a un mol de una sustancia para cambiar su temperatura en 1 K en el proceso termodinámico en consideración:
DE = EM = (2.4),
donde M es la masa molar de la sustancia; DE es su capacidad calorífica específica en el mismo proceso.
La expresión (2.4) ahora se puede escribir en la forma:
donde = n es la cantidad de sustancia.
La unidad de medida de la capacidad calorífica de un cuerpo es 1 J/K, calor especifico– 1 J/kg. K, molar - 1 J / mol. A.
Si el calentamiento ocurre bajo condiciones donde el volumen permanece constante, entonces la capacidad calorífica molar correspondiente se llama capacidad calorífica a volumen constante, o capacidad calorífica isocórica, y se denota C v:
Si la presión permanece constante durante el calentamiento, entonces la capacidad calorífica se llama capacidad calorífica a presión constante C p (también se le puede llamar capacidad calorífica isobárica):
Tenga en cuenta que para los sólidos, solo la capacidad calorífica a presión constante, y no a volumen constante, está disponible para la medición directa, ya que debido a la expansión térmica es imposible asegurar la constancia del volumen del cuerpo. Sin embargo, debido a la pequeñez del cambio de volumen durante el calentamiento, la diferencia entre las capacidades caloríficas Cp y Cv es pequeña.
Experimentalmente, la capacidad calorífica de un cuerpo se determina aplicando la ecuación de balance de calor. Deje que el cuerpo se caliente a una temperatura superior a la temperatura ambiente. Luego, al enfriarse, el cuerpo emite una cierta cantidad de calor. Según la ley de conservación de la energía en un sistema cerrado, la cantidad de calor que recibe el medio debe ser exactamente igual a la cantidad de calor que desprende el cuerpo. En este trabajo, al enfriarse, el cuerpo de ensayo cede calor al agua del calorímetro y al propio calorímetro.
Sea el cuerpo de prueba dado con masa metro, calentado a una temperatura t0, se introduce en el calorímetro con agua, cuya temperatura t1. Como resultado de la transferencia de calor temperatura de agua y el calorímetro sube a t2, a Temperatura corporal cae a t2. La cantidad de calor que desprende el cuerpo es:
Q dep = cm(t0 - t2) (2.6),
donde c es la capacidad calorífica específica del cuerpo de prueba,
t0– temperatura corporal inicial,
t2– temperatura corporal final,
metro- masa corporal.
La cantidad de calor recibida por el calorímetro y el agua es igual a:
donde y son la masa y el calor específico del calorímetro,
I - masivo y específico capacidad calorifica del agua,
t1– temperatura inicial del agua,
t2 es la temperatura final del agua.
Según la ley de conservación de la energía en un sistema cerrado:
Q otd \u003d Q piso (2.8).
Luego, sustituyendo las fórmulas 2.6 y 2.7 en la ecuación 2.8 y expresando el valor deseado DE , obtenemos:
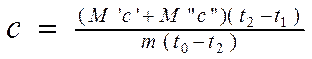 (2.9).
(2.9).
DETERMINAR LAS CAPACIDADES TÉRMICAS ESPECÍFICAS DE TRES CUERPOS CILÍNDRICOS DE VARIOS METALES
1. Determinar los valores de las masas de los cuerpos - yo, masa del calorímetro – , calor específico del agua – , calor específico del calorímetro – .
2. Vierta en el calorímetro una cantidad medida de agua fría a temperatura ambiente (aproximadamente 150 g).
3. Mida la temperatura inicial del agua fría t 1 .
4. Caliente el agua en el recipiente hasta que hierva.
5. Coloque uno de los cuerpos de prueba en agua hirviendo por un tiempo. Tome la temperatura del cuerpo calentado t 0 igual a la temperatura agua hirviendo en condiciones normales - 100 ° C.
6. Coloque el cuerpo calentado en el calorímetro con agua. Espere el final de la transferencia de calor y mida la temperatura final en el calorímetro - t 2 .
8. Determine de manera similar las capacidades caloríficas específicas de los otros dos cuerpos.
9. Registre los resultados de las mediciones y cálculos en la tabla 3.
10. Con base en los valores de las capacidades caloríficas específicas, determine las sustancias de las que están hechos los cuerpos.
12. Habiendo medido las dimensiones lineales de los cuerpos, determine su densidad.
13. Calcule los errores y registre el resultado de acuerdo con GOST.
14. Escribir las conclusiones del trabajo de laboratorio.
Tabla 3
| Nº p/p | M", kg | M", kg | metro, kg | C", J / kg.K | C", J / kg.K | t 0 , 0 C | t 1 , 0 C | t 2 , 0 C | C, J/kg. A |
Página 2
La precisión de determinar el calor específico según Sykes es muy alta. Sin embargo, este método está asociado con mayores dificultades experimentales que el método de Smith, y también da resultados precisos solo para curvas de calentamiento, aunque también puede usarse para obtener curvas de enfriamiento. El método de Smith facilita el estudio de rangos estrechos de temperatura, pero probablemente sea menos preciso.
Por lo tanto, para determinar la capacidad calorífica específica sg de una sustancia, es necesario medir el trabajo A realizado por las fuerzas externas que actúan sobre el cuerpo y medir el cambio en la temperatura corporal observado como resultado del trabajo en ausencia. de intercambio de calor con otros cuerpos.
El método más comúnmente utilizado para determinar la capacidad calorífica específica; llamado mezcla. El calorímetro (Regno) consiste en un recipiente de cobre rojo, colocado sobre patas de madera en el fondo de otro recipiente de cobre, del cual está separado por una capa de aire, cuya conductividad térmica y capacidad calorífica, por unidad de volumen, son insignificante. El primer recipiente está lleno de agua.
Consideremos ahora métodos para determinar la capacidad calorífica específica de una mezcla de gases.
La determinación directa (directa) de la capacidad calorífica específica Su y el estudio del curso de su cambio según la temperatura y el volumen específico es uno de los medios eficaces estudio del estado crítico de las sustancias. Por lo tanto, las determinaciones experimentales de la capacidad calorífica son de gran interés teórico y práctico en el estudio de fenómenos críticos.
¿Cuál es la fórmula para determinar la capacidad calorífica específica de las soluciones?
Al realizar experimentos para determinar el calor específico mediante mezcla, es necesario calentar la muestra de prueba - - a una temperatura fijada con precisión. Para ello se utilizan calentadores portátiles, que se instalan encima del calorímetro por un tiempo breve, necesarios para el rápido traslado de la muestra calentada al calorímetro.
| Diagrama del dispositivo. |
La esencia del método estacionario absoluto más simple para determinar el calor específico es la siguiente: una muestra del material de prueba con espesor h y área de sección transversal 5 se coloca entre el calentador y el enfriador. El calentador puede ser un recipiente con agua caliente o un elemento de calentamiento eléctrico para que su potencia se pueda ajustar como se desee cambiando el voltaje. El enfriador es un cuerpo de metal hueco a través del cual pasa agua fría. Las temperaturas en las superficies calentadas y enfriadas de la muestra (tj y, respectivamente, / 2) se miden mediante termopares.
A continuación se muestra un ejemplo de procesamiento de datos experimentales al determinar la capacidad calorífica específica de una muestra de arenisca. Un cilindro hueco lleno de polvo de la muestra de roca estudiada se calentó a 40 C y se enfrió en una cámara de aire quieto a una temperatura de 18 a 20 C.
En la fig. 3 - 6 muestra nomogramas para determinar la capacidad calorífica específica de hidrocarburos líquidos individuales y mezclas de aceite, así como soluciones acuosas de metanol y etanol.
Por ejemplo, compongamos la ecuación de balance de calor, que se usa para determinar la capacidad calorífica específica de una sustancia usando un calorímetro. Aproximadamente, se puede considerar que en este caso participan tres cuerpos en el intercambio de calor: un calorímetro, un líquido y un cuerpo del que se determina la capacidad calorífica específica.
6.4. Transferencia de calor entre cuerpos
6.4.1. Capacidad calorífica del cuerpo, específica. capacidad calorífica de una sustancia, capacidad calorífica molar de una sustancia
Para elevar la temperatura del cuerpo, éste necesita comunicar cierta cantidad de calor.
1 kg de una sustancia dada por 1 K se llama calor especifico sustancias y se calcula con la formula
c latidos = Q metro Δ T ,
donde Q es la cantidad de calor requerida para calentar cierta masa de materia; m es la masa de la sustancia; ΔT es el cambio en la temperatura de la sustancia cuando se calienta.
En el Sistema Internacional de Unidades, la capacidad calorífica específica de una sustancia se mide en julios divididos por kilogramo-kelvin (1 J/(kg ⋅ K)).
La cantidad de calor necesaria para calentar alguna masa de materia, está determinado por el producto
Q = c vence a metro ∆T .
La cantidad de calor requerida para elevar un cuerpo dado en 1 K se llama capacidad calórica del cuerpo y se calcula con la formula
C = QΔT,
donde Q es la cantidad de calor requerida para calentar un cuerpo dado; ΔT - cambio en la temperatura corporal cuando se calienta.
En el Sistema Internacional de Unidades, la capacidad calorífica de un cuerpo se mide en julios divididos por kelvin (1 J/K).
La cantidad de calor necesaria para calentar un determinado cuerpo está determinada por el producto
Q=C∆T,
donde C es la capacidad calorífica del cuerpo.
La capacidad calorífica de un cuerpo y la capacidad calorífica de la sustancia de la que está compuesto el cuerpo, interconectado expresión
C \u003d mc late,
donde C es la capacidad calorífica del cuerpo; m - peso corporal; c beat es la capacidad calorífica específica de la sustancia de la que está hecho este cuerpo.
La cantidad de calor requerida para elevar la temperatura de 1 mol de una sustancia dada en 1 K se llama capacidad calorífica molar de una sustancia y se calcula con la formula
c μ = Q ν Δ T ,
donde Q es la cantidad de calor requerida para calentar una cierta cantidad de una sustancia; ν es la cantidad de sustancia; ΔT es el cambio de temperatura de la cantidad especificada de sustancia cuando se calienta.
En el Sistema Internacional de Unidades, la capacidad calorífica molar de una sustancia se mide en julios por mol-kelvin (1 J/(mol ⋅ K)).
La cantidad de calor necesaria para calentar cierta cantidad de sustancia, está determinado por el producto
Q = do µ νΔT .
Calor específico y molar de una sustancia interconectado expresión
c µ = Ms latidos,
donde c µ es la capacidad calorífica molar de la sustancia; M es la masa molar de la sustancia; c sp - capacidad calorífica específica de la sustancia.
Ejemplo 14 Bolas de hierro y plomo tienen el mismo diámetro. ¿Cuántas veces mayor es la capacidad calorífica de una bola de hierro que la de una bola de plomo? Las capacidades caloríficas específicas del hierro y el plomo son 0,46 y 0,13 kJ/(kg ⋅ K), y las densidades son 7,80 y 11,5 g/cm 3, respectivamente.
Solución . Las capacidades caloríficas de las bolas están determinadas por las siguientes fórmulas:
- bola de hierro -
C 1 \u003d m 1 c ud1,
donde m 1 es la masa de la bola de hierro; c ud1 - capacidad calorífica específica del hierro;
- bola de plomo -
C 2 \u003d m 2 c tiempo2,
donde m 2 es la masa de la bola de plomo; c sp2 - capacidad calorífica específica del plomo.
La relación deseada son las capacidades caloríficas:
C 1 C 2 \u003d m 1 c tiempo 1 m 2 c tiempo 2,
que está determinada por la relación de las masas de las bolas de hierro y plomo y la relación de los calores específicos del hierro y el plomo.
Las masas de las bolas están determinadas por su tamaño y densidad:
- bola de hierro -
m 1 \u003d ρ 1 V 1,
donde ρ 1 es la densidad del hierro; V 1 - el volumen de la bola de hierro;
- bola de plomo -
m 2 \u003d ρ 2 V 2,
donde ρ 2 - la densidad del plomo; V 2 - el volumen de la bola de plomo.
Las bolas tienen el mismo diámetro, por lo que sus volúmenes son los mismos:
V 1 \u003d V 2 \u003d V \u003d π d 2 6,
donde d son los diámetros de las bolas de hierro y plomo.
Teniendo en cuenta esta última circunstancia, la relación de masas es igual a:
metro 1 metro 2 = ρ 1 V 1 ρ 2 V 2 = ρ 1 ρ 2 .
Sustituyamos m 1 /m 2 en la fórmula de la relación de las capacidades caloríficas de las bolas de hierro y plomo:
C 1 C 2 \u003d ρ 1 c sp 1 ρ 2 c sp 2.
Hagamos el cálculo:
C 1 C 2 = 7,80 ⋅ 10 3 ⋅ 0,46 ⋅ 10 3 11,5 ⋅ 10 3 ⋅ 0,13 ⋅ 10 3 = 2,4.
La capacidad calorífica de una bola de hierro es 2,4 veces mayor que la de una bola de plomo.
Ejemplo 15. Al preparar una mezcla, se vertió en el búnker cierta masa de arena y cuatro veces la masa de cemento. Las capacidades caloríficas específicas del cemento y la arena son 810 y 960 J/(kg ⋅ K), respectivamente. Determine la capacidad calorífica específica de la mezcla.
Solución . La capacidad calorífica específica de la mezcla está determinada por la fórmula
c latidos = Q metro Δ T ,
donde Q es la cantidad de calor necesaria para elevar la temperatura de la mezcla en ΔT; m es la masa de la mezcla.
La cantidad de calor requerida para calentar la mezcla, -
Q \u003d Q 1 + Q 2,
donde Q 1 - la cantidad de calor requerida para calentar la arena, que es parte de la mezcla, por ΔT; Q 2 - la cantidad de calor requerida para calentar el cemento, que es parte de la mezcla, por ΔT.
La cantidad de calor necesaria para calentar:
- arena -
Q 1 \u003d c ud1 m 1 ∆T,
donde c ud1 - capacidad calorífica específica de la arena; m 1 - masa de arena;
- cemento -
Q 2 \u003d c ud2 m 2 ∆T,
donde c ud2 - capacidad calorífica específica del cemento; m 2 es la masa de cemento.
La cantidad de calor requerida para calentar una mezcla de arena y cemento está determinada por la expresión
Q \u003d c latido 1 m 1 Δ T + c latido 2 m 2 Δ T \u003d (c latido 1 m 1 + c latido 2 m 2) Δ T.
La masa de la mezcla es la suma de las masas de arena y cemento:
m \u003d m 1 + m 2.
Sustituyamos las expresiones obtenidas para la cantidad de calor y masa de la mezcla en la fórmula de la capacidad calorífica específica de la mezcla:
c late \u003d (c late 1 m 1 + c late 2 m 2) Δ T (m 1 + m 2) Δ T \u003d c late 1 m 1 + c late 2 m 2 m 1 + m 2.
Transformaremos la expresión resultante, teniendo en cuenta la relación de masas:
m 2 = 4m 1 , es decir c latidos \u003d c latidos 1 m 1 + 4 c latidos 2 m 1 m 1 + 4 m 1 \u003d c latidos 1 + 4 c latidos 2 5.
El cálculo da el valor:
c pulsaciones = 960 + 4 ⋅ 810 5 = 840 J/(kg ⋅ K).
Por lo tanto, la capacidad calorífica específica de la mezcla es 840 J/(kg ⋅ K).
