Как определить удельную теплоемкость воды. Большая энциклопедия нефти и газа
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: калориметр, термометр, весы, испытуемые тела, мензурка (проградуированная в граммах), электронагревательный прибор.
– подтвердить экспериментально справедливость уравнения теплового баланса;
– вычислить удельные теплоемкости твердых тел;
– оформить в виде таблицы результаты измерений и вычислений;
– записать свои предложения по улучшению техники измерений и вычислений в данной работе.
КРАТКАЯ ТЕОРИЯ ОПЫТА
Одним из основных физических понятий термодинамики является теплоемкость.
Теплоемкостью тела называется физическая величина, численно равная теплоте, которую надо сообщить телу для изменения ее температуры на 1 К в рассматриваемом термодинамическом процессе. С другой стороны, теплоемкость тела равна отношению теплоты dQ, сообщаемой телу, к изменению dT температуры тела в рассматриваемом термодинамическом процессе:
Теплоемкость тела зависит от его химического состава, массы тела и его термодинамического состояния, а также, как видно из определения, от вида процесса изменения состояния тела, в котором поступает теплота dQ.
Тепловые свойства однородных тел характеризуются значениями удельной и мольной (молярной) теплоемкости. Удельной теплоемкостью вещества называется физическая величина с , численно равная теплоте, которую надо сообщить одному килограмму вещества для изменения его температуры на 1 К в рассматриваемом термодинамическом процессе. Теплоемкость однородного тела можно определить как произведение массы тела m на удельную теплоемкость с его вещества:
![]() или (2.2).
или (2.2).
Таким образом, связь между dQ и dT для однородного тела имеет вид:
Молярной теплоемкостью называется физическая величина С, численно равная теплоте, которую нужно сообщить одному молю вещества для изменения его температуры на 1 К в рассматриваемом термодинамическом процессе:
С = Мс = (2.4),
где М – молярная масса вещества; С – его удельная теплоемкость в том же процессе.
Выражение (2.4) можно записать теперь в форме:
где = n – количество вещества.
Единицей измерения теплоемкости тела является 1 Дж/К, удельной теплоемкости – 1 Дж/кг. К, молярной – 1 Дж/моль. К.
Если нагревание происходит в условиях, когда объем остается постоянным, то соответствующая молярная теплоемкость называется теплоемкостью при постоянном объеме , или изохорической теплоемкостью, и обозначается С v:
Если при нагревании постоянным остается давление, то теплоемкость называется теплоемкостью при постоянном давлении С р (ее можно также назвать изобарической теплоемкостью):
Отметим, что для твердых тел непосредственному измерению доступна только теплоемкость при постоянном давлении, а не при постоянном объеме, так как из-за теплового расширения нельзя обеспечить постоянство объема тела. Однако вследствие малости изменения объема при нагревании различие между теплоемкостями С р и С v мало.
Экспериментально теплоемкость тела определяют, применяя уравнение теплового баланса. Пусть тело нагрето до температуры, которая выше температуры окружающей среды. Тогда, остывая, тело отдает некоторое количество тепла. По закону сохранения энергии в замкнутой системе количество тепла, полученное средой, должно быть в точности равно количеству тепла, отданного телом. В данной работе, остывая, испытуемое тело отдает тепло воде, находящейся в калориметре, и самому калориметру.
Пусть данное испытуемое тело массой m , нагретое до температуры t 0 , опущено в калориметр с водой, температура которой t 1 . В результате теплообмена температура воды и калориметра повышается до t 2 , а температура тела понижается до t 2 . Количество теплоты, отданное телом, равно:
Q отд = cm (t 0 - t 2 ) (2.6),
где с – удельная теплоемкость испытуемого тела,
t 0 – начальная температура тела,
t 2 – конечная температура тела,
m – масса тела.
Количество теплоты, полученное калориметром и водой равно:
где и – масса и удельная теплоемкость калориметра,
И – масса и удельная теплоемкость воды,
t 1 – начальная температура воды,
t 2 – конечная температура воды.
По закону сохранения энергии в замкнутой системе:
Q отд = Q пол (2.8).
Тогда, подставляя формулы 2.6 и 2.7 в уравнение 2.8 и выражая искомую величину С , получим:
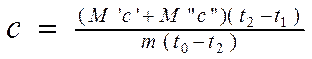 (2.9).
(2.9).
ОПРЕДЕЛИТЬ УДЕЛЬНЫЕ ТЕПЛОЕМКОСТИ ТРЕХ ЦИЛИНДРИЧЕСКИХ ТЕЛ ИЗ РАЗЛИЧНЫХ МЕТАЛЛОВ
1. Определить значения масс тел – m i , массы калориметра – , удельной теплоемкости воды – , удельной теплоемкости калориметра – .
2. Налить в калориметр отвешенное количество холодной воды массой комнатной температуры (примерно 150 г).
3. Измерить начальную температуру холодной воды t 1 .
4. Нагреть воду в сосуде до кипения.
5. Поместить одно из испытуемых тел в кипящую воду на некоторое время. Температуру нагретого тела t 0 принять равной температуре кипения воды при нормальных условиях – 100 °С.
6. Поместить нагретое тело в калориметр с водой. Дождаться окончания теплообмена и измерить конечную температуру в калориметре – t 2 .
8. Определить аналогично удельные теплоемкости двух других тел.
9. Результаты измерений и вычислений занести в таблицу 3.
10. По значениям удельных теплоемкостей определить вещества, из которых изготовлены тела.
12. Измерив линейные размеры тел, определить их плотности.
13. Провести расчет погрешностей и записать результат в соответствии с ГОСТом.
14. Записать выводы по лабораторной работе.
Таблица 3
| № п/п | М", кг | М", кг | m, кг | C", Дж/кг. К | C", Дж/кг. К | t 0 , 0 C | t 1 , 0 C | t 2 , 0 C | C, Дж/кг. К |
Cтраница 2
Точность определения удельной теплоемкости по Сайксу очень высока. Однако этот метод связан с большими экспериментальными трудностями, чем метод Смита, и также дает точные результаты только для кривых нагрева, хотя может быть применен и для получения кривых охлаждения. Метод Смита разрешает легче исследовать узкие температурные интервалы, но, вероятно, менее точен.
Следовательно, для определения удельной теплоемкости сг вещества нужно измерить работу А, совершенную внешними силами, действующими на тело, и измерить наблюдаемое в результате совершения работы изменение температуры тела в условиях отсутствия теплообмена его с другими телами.
Наиболее употребителен способ определения удельной теплоемкости; называемый способом смешения. Калориметр (Реньо) состоит из сосуда красной меди, поставленного на деревянных ножках на дно другого медного сосуда, от которого он отделен слоем воздуха, теплопроводность и теплоемкость которого, отнесенная к единице объема, незначительны. Первый сосуд наполняется водою.
Рассмотрим теперь способы определения удельной теплоемкости газовой смеси.
Непосредственное (прямое) определение удельной теплоемкости Су и изучение хода ее изменения в зависимости от температуры и удельного объема является одним из эффективных средств изучения критического состояния веществ. Поэтому экспериментальные определения теплоемкости представляют большой теоретический и практический интерес при изучении критических явлений.
Какая существует формула для определения удельной теплоемкости растворов.
При проведении опытов по определению удельной теплоемкости методом смешения необходимо исследуемый образец нагре - - вать до точно фиксируемой температуры. Для этого применяют переносные нагреватели, которые устаналивают над калориметром на короткое время, необходимое для быстрого переноса нагретого образца в калориметр.
| Схема устройства. |
Сущность простейшего абсолютного стационарного способа определения удельной теплоемкости сводится к следующему: образец испытуемого материала толщиной h и площадью поперечного сечения 5 помещается между нагревателем и охладителем. Нагревателем может служить сосуд с горячей водой или же электронагревательный элемент так, чтобы его мощность могла по желанию регулироваться изменением напряжения. Охладителем является полое металлическое тело, через которое пропускается холодная вода. Температуры на нагреваемой и охлаждаемой поверхностях образца (tj и, соответственно, / 2) измеряются термопарами.
Ниже приведен пример обработки опытных данных при определении удельной теплоемкости образца песчаника. Полый цилиндр, заполненный порошком исследуемого образца породы, подогревался до 40 С и охлаждался в камере спокойного воздуха до температуры 18 - 20 С.
На рис. 3 - 6 приведены номограммы для определения удельной теплоемкости жидких индивидуальных углеводородов и нефтяных смесей, а также водных растворов метанола и этанола.
Для примера составим уравнение теплового баланса, которое используется при определении удельной теплоемкости вещества с помощью калориметра. Приближенно можно считать, что в этом случае в теплообмене участвуют три тела: калориметр, жидкость и тело, удельную теплоемкость вещества которого определяют.
6.4. Теплообмен между телами
6.4.1. Теплоемкость тела, удельная теплоемкость вещества, молярная теплоемкость вещества
Для того чтобы повысить температуру тела, ему необходимо сообщить некоторое количество теплоты.
1 кг данного вещества на 1 К, называется удельной теплоемкостью вещества и вычисляется по формуле
c уд = Q m Δ T ,
где Q - количество теплоты, необходимое для нагревания некоторой массы вещества; m - масса вещества; ΔT - изменение температуры вещества при нагревании.
В Международной системе единиц удельная теплоемкость вещества измеряется в джоулях, деленных на килограмм-кельвин (1 Дж/(кг ⋅ К)).
Количество теплоты, необходимое для нагревания некоторой массы вещества , определяется произведением
Q = c уд m ∆T .
Количество теплоты, необходимое для нагревания данного тела на 1 К, называется теплоемкостью тела и вычисляется по формуле
C = Q Δ T ,
где Q - количество теплоты, необходимое для нагревания данного тела; ΔT - изменение температуры тела при нагревании.
В Международной системе единиц теплоемкость тела измеряется в джоулях, деленных на кельвин (1 Дж/К).
Количество теплоты, необходимое для нагревания некоторого тела , определяется произведением
Q = C ΔT ,
где C - теплоемкость тела.
Теплоемкость тела и теплоемкость вещества, из которого состоит данное тело, связаны между собой выражением
C = mc уд,
где C - теплоемкость тела; m - масса тела; c уд - удельная теплоемкость вещества, из которого изготовлено это тело.
Количество теплоты, необходимое для нагревания 1 моль данного вещества на 1 К, называется молярной теплоемкостью вещества и вычисляется по формуле
c μ = Q ν Δ T ,
где Q - количество теплоты, необходимое для нагревания некоторого количества вещества; ν - количество вещества; ΔT - изменение температуры указанного количества вещества при нагревании.
В Международной системе единиц молярная теплоемкость вещества измеряется в джоулях на моль-кельвин (1 Дж/(моль ⋅ К)).
Количество теплоты, необходимое для нагревания некоторого количества вещества , определяется произведением
Q = c µ νΔT .
Молярная и удельная теплоемкости вещества связаны между собой выражением
c µ = Mс уд,
где c µ - молярная теплоемкость вещества; M - молярная масса вещества; с уд - удельная теплоемкость вещества.
Пример 14. Железный и свинцовый шарики имеют одинаковые диаметры. Во сколько раз теплоемкость железного шарика больше теплоемкости свинцового? Удельные теплоемкости железа и свинца равны 0,46 и 0,13 кДж/(кг ⋅ К), а плотности - 7,80 и 11,5 г/см 3 соответственно.
Решение . Теплоемкости шариков определяются следующими формулами:
- железного шарика -
C 1 = m 1 c уд1 ,
где m 1 - масса железного шарика; c уд1 - удельная теплоемкость железа;
- свинцового шарика -
C 2 = m 2 c уд2 ,
где m 2 - масса свинцового шарика; c уд2 - удельная теплоемкость свинца.
Искомым является отношение теплоемкостей:
C 1 C 2 = m 1 c уд 1 m 2 c уд 2 ,
которое определяется отношением масс железного и свинцового шариков и отношением удельных теплоемкостей железа и свинца.
Массы шариков определяются их размерами и плотностью:
- железного шарика -
m 1 = ρ 1 V 1 ,
где ρ 1 - плотность железа; V 1 - объем железного шарика;
- свинцового шарика -
m 2 = ρ 2 V 2 ,
где ρ 2 - плотность свинца; V 2 - объем свинцового шарика.
Шарики имеют одинаковые диаметры, поэтому их объемы одинаковы:
V 1 = V 2 = V = π d 2 6 ,
где d - диаметры железного и свинцового шариков.
С учетом последнего обстоятельства отношение масс равно:
m 1 m 2 = ρ 1 V 1 ρ 2 V 2 = ρ 1 ρ 2 .
Подставим m 1 /m 2 в формулу для отношения теплоемкостей железного и свинцового шариков:
C 1 C 2 = ρ 1 c уд 1 ρ 2 c уд 2 .
Произведем вычисление:
C 1 C 2 = 7,80 ⋅ 10 3 ⋅ 0,46 ⋅ 10 3 11,5 ⋅ 10 3 ⋅ 0,13 ⋅ 10 3 = 2,4 .
Теплоемкость железного шарика превышает в 2,4 раза теплоемкость свинцового шарика.
Пример 15. При изготовлении смеси в бункер засыпали некоторую массу песка и вчетверо большую массу цемента. Удельные теплоемкости цемента и песка равны 810 и 960 Дж/(кг ⋅ К) соответственно. Определить удельную теплоемкость смеси.
Решение . Удельная теплоемкость смеси определяется формулой
c уд = Q m Δ T ,
где Q - количество теплоты, необходимое для того, чтобы повысить температуру смеси на ΔT ; m - масса смеси.
Количество теплоты, необходимое для нагревания смеси, -
Q = Q 1 + Q 2 ,
где Q 1 - количество теплоты, необходимое для нагревания песка, входящего в состав смеси, на ΔT ; Q 2 - количество теплоты, необходимое для нагревания цемента, входящего в состав смеси, на ΔT .
Количество теплоты, необходимое для нагревания:
- песка -
Q 1 = c уд1 m 1 ∆T ,
где c уд1 - удельная теплоемкость песка; m 1 - масса песка;
- цемента -
Q 2 = c уд2 m 2 ∆T ,
где c уд2 - удельная теплоемкость цемента; m 2 - масса цемента.
Количество теплоты, необходимое для нагревания смеси песка и цемента, определяется выражением
Q = c уд 1 m 1 Δ T + c уд 2 m 2 Δ T = (c уд 1 m 1 + c уд 2 m 2) Δ T .
Масса смеси есть сумма масс песка и цемента:
m = m 1 + m 2 .
Подставим полученные выражения для количества теплоты и массы смеси в формулу удельной теплоемкости смеси:
c уд = (c уд 1 m 1 + c уд 2 m 2) Δ T (m 1 + m 2) Δ T = c уд 1 m 1 + c уд 2 m 2 m 1 + m 2 .
Произведем преобразование полученного выражения с учетом соотношения масс:
m 2 = 4m 1 , т.е. c уд = c уд 1 m 1 + 4 c уд 2 m 1 m 1 + 4 m 1 = c уд 1 + 4 c уд 2 5 .
Расчет дает значение:
c уд = 960 + 4 ⋅ 810 5 = 840 Дж/(кг ⋅ К).
Следовательно, удельная теплоемкость смеси составляет 840 Дж/(кг ⋅ К).
